UNIDADE
1
QUÍMICA: A CIÊNCIA DOS MATERIAIS E DE SUAS TRANSFORMAÇÕES
De modo geral, as pessoas costumam associar a Química a algo negativo, quê póde causar danos à saúde e ao ambiente.No entanto, essa Ciência permite o desenvolvimento de processos e substâncias quê beneficiam os sêres vivos e o ambiente, como a reciclagem e os remédios, por exemplo. Ela também permite o entendimento de uma série de fenômenos quê ocorrem no cotidiano, como a luz emitida por fogos de artifício. A imagem mostra um registro do Festival Folclórico de Parintins, no Amazonas, em quê se observa o uso de fogos de artifício no carro alegórico.
Página onze
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Como você explicaria a emissão de luz por fogos de artifício?
2. Que outros processos ou fenômenos do cotidiano podem sêr compreendidos mediante o uso de conceitos da Química?

Página doze
TEMA
1
O quê é Ciência?
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O planêta Terra fornece tudo o quê as pessoas precisam para viver, mas é necessário saber enfrentar diferentes adversidades, como frio, calor, enchentes, secas, vulcões, raios e terremotos.
Ao longo do tempo, a humanidade evoluiu à medida quê desenvolvê-u uma melhor compreensão dos fenômenos naturais, adaptando-se, adquirindo novos hábitos e alterando as condições do ambiente para tornar os lugares em quê vivia mais agradáveis e seguros.

Diversos conhecimentos resultaram da habilidade humana para analisar e aprender. Pode-se dizêr quê todas as pessoas são capazes de desenvolver algum tipo de conhecimento e quê cada um dêêsses tipos tem sua importânssia e relevância. As pessoas sabem várias coisas e, muitas vezes, especializam-se em algo por admiração ou necessidade profissional.
Neste Tema, serão apresentados os tipos de conhecimento, caracterizando com mais profundidade o quê se denomina de conhecimento científico.
Página treze
Diferenciando conhecimentos
De modo geral, é possível separar o conhecimento em pelo menos três categorias: o senso comum, o conhecimento filosófico e o conhecimento científico.
O conhecimento adquirido intuitivamente por meio de interações com o ambiente, por tentativa e êrro, por observação e interpretação, é denominado senso comum. Ele costuma sêr passado de geração em geração, recebendo o nome de tradição, e possibilita o desenvolvimento de outros tipos de conhecimento, como o científico. A capacidade de dominar o fogo e de escolher o período adequado do ano para se plantar e côlher cereais e frutas são exemplos de senso comum. Trata-se também de um conhecimento quê póde fundamentar superstições e ditos populares, sêndo, geralmente, superficial, subjetivo, desorganizado e incapaz de análise crítica.
Além díssu, o senso comum conduziu a equívocos em uma Ciência ainda não constituída e formalizada como a do século II. O nascer do sól, sempre de um mesmo lado, e o pôr do sól, de outro, levaram o matemático e astrônomo grego de Alexandria Cláudio Ptolomeu (c. 90 d.C.-168 d.C.) a considerar quê o Sol girava em torno da Terra e a formalizar a teoria do geocentrismo. Essa explicação foi aceita por um longo tempo.

CELLARIUS, Andreas. Ptolemaicvm machina. In: CELLARIUS, Andreas. Harmonia macrocosmica: sev atlas universalis et novus, totius universi creati cosmographiam generalem, et novam exhibens. [S. l.: s. n.], 1708. p. 13.
Já o conhecimento filosófico se fundamenta na razão, pois exige uma relação lógica entre enunciados, e é sistemático, por havêer uma busca por representações coerentes e gerais da realidade abordada. No entanto, não se trata de um conhecimento passível de verificação, ou seja, os conceitos produzidos pela Filosofia não são suscetíveis à confirmação ou à refutação com base em dados produzidos por experimentos. Por esse motivo, não se póde dizêr quê há uma evolução do conhecimento filosófico; um sistema filosófico não se sobrepõe a outro, anulando-o ou confirmando-o.
REFLITA
1 Sobre o quê você sabe muito?
2 Qual é a utilidade dêêsse conhecimento em sua vida?
Página quatorze
Alguns autores indicam quê a Filosofia não é exatamente uma forma de conhecimento da realidade, mas um saber quê avalia e estuda a natureza e os limites do conhecimento humano.
Os filósofos gregos desenvolveram a Lógica e muitos usaram a Matemática para estudar problemas para os quais buscavam respostas, duas ferramentas fundamentais para o conhecimento científico. No entanto, a união entre teoria e experimentação, quê possibilitou o desenvolvimento das Ciências experimentais, só aconteceu muito tempo depois.
Hoje, questiona-se se a Filosofia teria mesmo nascido na Grécia antiga, mas é inegável a importânssia dos filósofos gregos para o conhecimento filosófico.

DAVID, Jáque-luí. A morte de Sócrates. 1787. Óleo sobre tela, 129,5 cm x 196,2 cm.
ESPAÇOS DE APRENDIZAGEM
• O texto a seguir discute a origem da Filosofia e faz um breve debate sobre a importânssia de compreender o princípio da produção filosófica.
NOGUERA, Renato. Os gregos não inventaram a filosofia. Cult, São Paulo, 2 jul. 2016. Disponível em: https://livro.pw/rjpct. Acesso em: 26 ago. 2024.
O conhecimento científico
Não é possível afirmar com precisão onde e quando nasceu o quê atualmente é denominado conhecimento científico, pois essa forma de conhecimento se desenvolvê-u por causa do trabalho de autores de muitas nacionalidades e contextos. Entretanto, diversos historiadores da Ciência costumam atribuir sua germinação ao racionalismo do filósofo e matemático francês Renê Descartes (1596-1650) e ao empirismo do matemático, físico, astrônomo e filósofo italiano Galileu Galilei (1564-1642) e do filósofo, político e escritor inglês Frâncis Bacon (1561-1626).
Página quinze
Na obra Novum organum: ou verdadeiras indicações acerca da interpretação da natureza, publicada em 1620, Bacon afirmou quê o entendimento da natureza resultaria de uma estreita aliança entre a razão e a experimentação. Ou seja, o conhecimento se basearia na análise racional de resultados observáveis e reprodutíveis. Com essa publicação, ele ficou conhecido por introduzir o conceito de empirismo, teoria quê considera quê o conhecimento vêm de experiências e vivências.
Começou assim a sêr constituído o conhecimento científico, sistematizado e racional, quê se fundamenta na observação da realidade e na avaliação de hipóteses, por meio da experimentação e da mensuração precisa, para chegar a definições de leis e regras gerais e abrangentes.
ESPAÇOS DE APRENDIZAGEM
• O texto a seguir traz alguns dados biográficos de Frâncis Bacon e introduz algumas de suas ideias.
FRANCIS Bacon, de aluno rebelde a pai do empirismo filosófico e científico. Né chionál Geográfic Portugal, Lisboa, 5 jun. 2023. Disponível em: https://livro.pw/jpmsq. Acesso em: 26 ago. 2024.
Com o pensamento científico, busca-se explicar e compreender tudo quê existe, desde o muito pequeno, como o átomo, ao infinitamente grande, como o Universo.

Como atividade extraclasse, solicitar aos estudantes quê assistam a um vídeo introdutório à quêstão "o que é Ciência?", disponível em: https://livro.pw/ptdbk (acesso em: 26 ago. 2024).
Por muito tempo foi dito quê esse conhecimento no qual se estrutura a Ciência buscava a verdade absoluta. Hoje, considera-se quê a verdade é temporal e relativa, pois novos modos de acesso ao conhecimento podem mostrar quê uma verdade aceita por muito tempo póde deixar de sêr quando analisada de outra forma ou com base em novas informações.
Página dezesseis
A Ciência é formada por vários campos quê se distinguem pêlos seus objetos de estudo. Em cada campo, a definição de leis e regras abrangentes necessita quê pessoas especializadas as avalie e as teste. Só assim o conhecimento científico se desen vólve. Um novo conhecimento em determinado campo póde sêr propôsto por poucos, mas precisa sêr avaliado e aceito por muitos.
Cada um dos campos tem subdivisões. Por isso, muitas vezes, a Ciência é referida no plural. As Ciências Humanas e Sociais estudam a humanidade em seus diversos aspectos. São exemplos a Sociologia, a Filosofia, a Geografia e a História. Já as Ciências da Natureza são aquelas quê têm por objeto de estudo a natureza, desde os aspectos mais fundamentais, como o átomo, aos aspectos mais gerais, como o Universo. São exemplos a Química, a Física e a Biologia.
A Química, quê é o foco neste livro, é a Ciência da Natureza quê estuda os materiais, as substâncias e suas transformações.


As metodologias científicas
As Ciências se caracterizam pelo uso de atividades e práticas sistemáticas, denominadas métodos científicos. Em outras palavras, não há Ciência quê não empregue métodos científicos. No entanto, esse uso não implica quê a produção de conhecimento ocorrerá por um único caminho.
Fazer Ciência não é seguir protocólos rígidos; trata-se de uma atividade quê envolve processos variados, importantes e apropriados para diferentes situações. Sendo uma atividade humana, a Ciência é influenciada por diferentes aspectos, como política, economia e cultura, e está inserida em contextos temporais e históricos. Conhecer a história é essencial para entender por quê não existe uma fórmula única na Ciência quê possa sêr aplicada universalmente.
Página dezessete
Entre os métodos quê fornecem as estruturas fundamentais para a investigação científica, pode-se distinguir o método indutivo experimental, estabelecido por Galileu e aperfeiçoado por Bacon; o método dedutivo, propôsto por Descartes; e o método hipotético-dedutivo, apresentado pelo filósofo da Ciência austríaco káur Raimund Popper (1902-1994). Cada um deles fornece abordagens distintas para a formulação, o teste e a validação de teorias e hipóteses no processo científico.
O método indutivo experimental envolve a observação e o registro sistemático de dados fornecidos por experimentações realizadas para responder a um problema. Com base na análise dêêsses dados, cientistas formulam hipóteses quê expliquem os fenômenos. Em seguida, repetem os experimentos em contextos distintos para acumular dados e testar essas hipóteses. Por fim, buscam estabelecer leis e generalizações.
Já o método dedutivo parte de evidências reconhecidamente verdadeiras (axiomas ou leis gerais) e, por meio do pensamento racional, deduz o particular, quê póde sêr testado por meio de observações ou experimentos. O raciocínio dedutivo busca estabelecer relações necessárias entre as premissas e as conclusões, seguindo uma estrutura lógica rigorosa.
Por fim, o método hipotético-dedutivo combina elemêntos dos dois métodos anteriores, focando na formulação de uma hipótese quê busca explicar um fenômeno observado ou prever um resultado específico. Essa hipótese é então testada por meio de experimentação, observação ou evidência empírica. O aspecto principal dêêsse método é a falsificabilidade: uma hipótese deve sêr formulada de tal maneira quê possa sêr refutada por meio de evidências. O teste de hipóteses por meio de experimentos quê possam potencialmente contradizê-las é o aspecto principal dessa metodologia, pois contribui para o avanço do conhecimento científico, eliminando teorias quê não resistam a evidências empíricas.

ESPAÇOS DE APRENDIZAGEM
• Em qualquer prática científica, é fundamental quê o pesquisador seja ético. Neste vídeo, cientistas discutem as relações entre Ciência e ética.
ÉTICA na pesquisa. [S. l.: s. n.], 2024. 1 vídeo (18 min). Publicado pelo canal ufis cár: Universidade Federal de São Carlos. Disponível em: https://livro.pw/jdkqy. Acesso em: 26 ago. 2024.
Página dezoito
Como cientistas divulgam seus trabalhos?
REFLITA
3 Como você fica sabendo a respeito de uma descoberta científica?
Cientistas de vários campos se reúnem, com freqüência, em congressos científicos para debater resultados de pesquisas e novas teorias. Esses eventos proporcionam um espaço importante para a troca de conhecimento, o estabelecimento de contatos e a construção de rêdes de colaboração entre pesquisadores de diversas áreas e de diferentes partes do Brasil e do mundo.
Por meio de apresentações orais, pôsteres e workshops, pesquisadores podem compartilhar metodologias, resultados e conclusões com a comunidade científica. Isso não só amplia o alcance de suas pesquisas mas também contribui para a construção coletiva do conhecimento científico. Participações em congressos permitem quê cientistas se mantenham atualizados sobre os últimos avanços em suas áreas de pesquisa e recebam críticas construtivas e sugestões de outros pesquisadores. Esses encontros ajudam na melhoria da qualidade dos trabalhos e na identificação de possíveis falhas metodológicas, abrindo novas perspectivas para pesquisas futuras.
Ao longo da história, alguns congressos foram marcos importantes para o desenvolvimento das Ciências da Natureza e, em particular, da Química. Entre eles, pode-se citar o Congresso de Karlsruhe, o primeiro encontro internacional de químicos, realizado na cidade de Karlsruhe, na Alemanha, de 3 a 5 de setembro de 1860, e a Conferência de Solvay de 1911, realizada em Bruxelas, de 30 de outubro a 3 de novembro de 1911.
Congresso de Karlsruhe
O Congresso de Karlsruhe teve como objetivo a busca e a definição de regras para nomenclatura, notação e massas atômicas. Participaram do congresso 127 químicos, entre os quais o russo Dmitri Ivanovich Mendeleev (1834-1907) e o alemão Julius Lothar Méyer (1830-1895), quê mais tarde proporiam, d fórma independente, tabélas similares para a organização dos elemêntos químicos. Naquela época, ainda não havia uma forma consensual de representar as substâncias nem consenso sobre suas fórmulas.
[KARLSRUHE: visão geral: Baden: Alemanha]. [ca. 1890-1900]. Fotocromo color.
Representação da cidade de Karlsruhe (Alemanha), no final do século XIX (entre 1890 e 1900).

Conferência de Solvay
A Conferência de Solvay de 1911 foi patrocinada pelo químico industrial belga Ernest Solvay (1838-1922) e reuniu importantes cientistas, como o físico alemão álbert Áinstain (1879-1955), a física e química polonesa, naturalizada francesa, Maria Salomea Sklodowska-Curie (1867-1934), o físico alemão Max káur érnst Ludwig Planck (1858-1947) e o físico e matemático neozelandês Ernest Rutherford (1871-1937). A conferência teve como objetivo discutir, principalmente, kestões relacionadas à teoria quântica e à radiação, estabelecendo um espaço para troca de ideias e promovendo colaborações científicas quê seriam essenciais para o desenvolvimento da Mecânica Quântica e da Física Teórica no século XX.
Desde então, outras edições da Conferência de Solvay ocorreram, quase sempre trienalmente, reunindo cientistas para discutir kestões ligadas à Química e à Física.

Página dezenove
Os dois maiores congressos de Química quê acontecem anualmente no Brasil são organizados pela Sociedade Brasileira de Química (SBQ) e pela Associação Brasileira de Química (ABQ).
A SBQ organiza rêuní-ões anuais quê contam com a presença de cerca de 4.000 pessoas, entre estudantes, professores e pesquisadores de Química.
A ABQ também organiza congressos anuais com participação de químicos de todo o Brasil e de representantes de indústrias.
Em 2018, durante a realização do XIX Encontro Nacional de Ensino de Química (Eneq), realizado na Universidade Federal do Ácri (UFAC), foi criada a Sociedade Brasileira de Ensino de Química (SBEnQ), quê congrega a comunidade de pesquisadores em Ensino de Química. Essa ssossiedade é responsável pela Revista da Sociedade Brasileira de Ensino de Química (ReSBEnQ), quê divulga a produção científica de pesquisadores quê atuam no Ensino de Química.

SOCIEDADE BRASILEIRA DE CHIMICA. Revista Brasileira de Chimica, Rio de Janeiro, ano 1, n. 1, ago. 1929.

SOCIEDADE BRASILEIRA DE ENSINO DE QUÍMICA. Revista da Sociedade Brasileira de Ensino de Química, Brasília, DF, v. 1, 2020.
ESPAÇOS DE APRENDIZAGEM
• O vídeo e o sáiti a seguir trazem mais informações sobre a Sociedade Brasileira de Química (SBQ).
DOCUMENTÁRIO:"SBQ: uma visão histórica". [S. l.: s. n.], 2014. 1 vídeo (37 min). Publicado pelo canal SBQ: Sociedade Brasileira de Química. Disponível em: https://livro.pw/cxltb. Acesso em: 26 ago. 2024.
SOCIEDADE BRASILEIRA DE QUÍMICA. São Paulo, [2024]. sáiti. Disponível em: https://livro.pw/fxpms. Acesso em: 26 ago. 2024.
Página vinte
Outra maneira quê cientistas utilizam para apresentar seus trabalhos e pesquisas, garantindo quê suas descobertas sêjam acessíveis à comunidade científica e ao público interessado, é a publicação em revistas científicas especializadas, os chamados periódicos científicos. Os trabalhos publicados nessas revistas passam por rigorosos processos de revisão por pares, nos quais outros especialistas no campo de pesquisa avaliam a qualidade e a validade dos estudos antes da publicação. Além de artigos em periódicos, cientistas podem disseminar suas ideias e produções, escrevendo capítulos para livros acadêmicos, dissertações (mestrado) e teses (doutorado), quê são meios quê permitem a exploração mais aprofundada de temas.
Uma alternativa aos congressos, periódicos, livros acadêmicos, teses e dissertações é o uso das mídias sociais, blogues, revistas e museus de Ciência para apresentar descobertas de maneira mais acessível ao público em geral. Nesses meios, conceitos compléksos e discussões sobre implicações práticas ou sociais da pesquisa científica são, normalmente, apresentados de maneira mais resumida, com uma linguagem menos formal, sistemática e rigorosa. No entanto, essas alternativas nem sempre são validadas pelas comunidades científicas.
Em casos de trabalhos significativos ou de interêsse público, pesquisadores podem colaborar com a imprensa, ajudando a aumentar a visibilidade e o impacto de suas descobertas para além da comunidade científica.
Essas diferentes formas de divulgação permitem quê cientistas compartilhem seus conhecimentos, contribuam para o avanço do campo científico e promovam o diálogo e a colaboração dentro e fora da comunidade acadêmica.
No boxe Espaços de aprendizagem, apresentam-se três indicações de artigo, cada uma representando uma forma de divulgação.

ESPAÇOS DE APRENDIZAGEM
• Artigo publicado em periódico quê aborda a aprendizagem da estrutura atômica.
DIÓGENES, Tasso Edson Freire; FIGUEREDO, Kytéria Sabina lópes de; OLIVEIRA, Glaydson Francisco Barros de. Aprendizagem de estrutura atômica a partir do OA: monte um átomo: uma análise dos aspectos pedagógicos. Revista da Sociedade Brasileira de Ensino de Química, Brasília, DF, v. 4, n. 1, p. 1-20, jan./dez. 2023. Disponível em: https://livro.pw/zbnuo. Acesso em: 26 ago. 2024.
• Artigo publicado em revista para público em geral quê aborda as dificuldades de se combater o doping esportivo.
MARIANO, Guto. A compléksa luta contra o doping. Ciência Hoje, Rio de Janeiro, n. 412, ago. 2024. Disponível em: https://livro.pw/gefwa. Acesso em: 26 ago. 2024.
• Artigo publicado em jornál quê aborda os benefícios do cacau para a saúde e o envelhecimento.
RODRÍGUEZ, Carolina Sánchez. Os benefícios do cacau para a saúde e o envelhecimento, segundo a ciência. BBC nius Brasil, [s. l.], 25 jul. 2024. Disponível em: https://livro.pw/wyrhm. Acesso em: 26 ago. 2024.
Página vinte e um
ATIVIDADES
1. Qual é a diferença entre senso comum e conhecimento científico?
2. A Ciência busca a verdade absoluta? Justifique sua resposta a respeito dessa questão.
3. Após a leitura do Tema, responda: por quê é importante estudar Ciências?
4. Forme um grupo com dois ou três côlégas para debater a seguinte questão: qual é a importânssia dos congressos científicos? Pesquisem se, na cidade ou na capital do estado onde vocês moram, aconteceu algum congresso científico no último ano. Descubram qual era o tema dêêsse evento. Verifiquem também se acontecerá algum congresso em breve e, em caso afirmativo, entrem em contato para saber se podem participar de alguma atividade.
5. Observe a fotografia dos participantes da Conferência de Solvay de 1927 e identifique quantas cientistas mulheres estão presentes. No caderno, escrêeva um texto justificando esse fato com base nas kestões sociais da época. Comente se isso mudou atualmente e como deve sêr a distribuição de gênero nesses eventos.
6. Escolha uma reportagem publicada recentemente em algum jornál sobre um tema científico de seu interêsse e escrêeva, no caderno, um resumo de no mássimo dois parágrafos, destacando os principais pontos abordados.
7. Leia o trecho a seguir quê faz parte de um texto em formato de artigo científico, escrito por uma professora de Química em conjunto com cinco estudantes e publicado na Revista Com Censo Jovem em junho de 2023.
[...] Após o encontro, os discentes saíram fascinados com o tema e decididos a criarem suas próprias representações do modelo padrão de partículas elementares e suas combinações [...]. Como as partículas elementares se combinam formando partículas maiores como os prótons e nêutrons e quê estes, combinados com o elétron, dão origem aos diversos tipos de hátomus, quê por sua vez se combinarão formando substâncias simples e compostas, a proposta dos estudantes foi de formár gerações.
COELHO, Hugo H. éti áu. Baralho dos hátomus: aprendizagem gamificada no estudo de química. Revista Com Censo Jovem, Brasília, DF, v. 2, n. 1, p. 45-53, jun. 2023. p. 47. Disponível em: https://livro.pw/adofa. Acesso em: 19 ago. 2024.
Considere quê você tenha criado ou descoberto algo interessante. No caderno, crie um pequeno texto para divulgar para a comunidade científica essa novidade.

Página vinte e dois
TEMA
2
Química: Ciência da Natureza
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O estudo das Ciências permite quê as pessoas compreendam melhor as finalidades dos trabalhos de cientistas e os impactos dos conhecimentos científicos produzidos, inclusive em kestões cotidianas. Em outras palavras, esse estudo torna as pessoas mais capazes de se situarem no mundo, avaliarem e entenderem as diversas informações quê recebem diariamente de múltiplas fontes e, por fim, fazerem escôlhas mais conscientes.
O estudo da Química, em particular, fornece ferramentas para entender como ocorre a fabricação de uma série de produtos utilizados no dia a dia, desde os plásticos até os alimentos industrializados. Compreender Química também evidên-cía a capacidade do sêr humano de transformar o ambiente ao seu redor, sempre em busca de melhorar sua qualidade de vida.
Neste Tema, serão discutidos a origem, a evolução e o funcionamento dessa Ciência da Natureza. Aprendendo a pensar quimicamente, será possível responder a diversas kestões com quê as pessoas se deparam diariamente.

Caso julgue adequado, comentar com os estudantes quê a higienização recomendada de verduras, legumes e frutas é lavá-los muito bem em á gua corrente própria para o consumo e, em seguida, deixá-los de molho em á gua com solução de hipoclorito de sódio.
por quê estudar Química?
Não é necessário ir a uma indústria ou a um laboratório para observar o uso de conhecimentos da Química. Processos e produtos químicos são utilizados em diferentes situações da vida, muitas vezes tão rotineiras quê as pessoas nem se dão conta de quê esses processos e produtos só são possíveis por causa do conhecimento gerado por essa Ciência.
Assim, estudar Química ajuda a entender a composição e a estrutura das substâncias, bem como suas transformações e as trocas de energia envolvidas nelas, o quê é essencial para a compreensão de fenômenos naturais, processos industriais e eventos do cotidiano.
Trata-se de uma Ciência quê é importante, por exemplo, para o desenvolvimento de medicamentos, a produção de alimentos e a criação de materiais inovadores. Compreender os princípios químicos, portanto, possibilita quê as pessoas tomem decisões informadas sobre saúde, nutrição e ambiente.
REFLITA
1 Pense em atividades quê você faz no seu dia a dia e identifique aquelas em quê ocorrem processos químicos. Quais delas você faria melhor se usasse conhecimentos químicos mais aprofundados?
Página vinte e três
AlGO A+
Um famoso analgésico
Durante séculos, vários povos extraíram da casca da árvore salgueiro uma substância quê aliviava a dor e a febre, mas quê, em contrapartida, causava problemas estomacais. No final do século XIX, o químico alemão Felix Hoffmann (1868-1946) descobriu quê pôdêria utilizar essa substância para produzir uma nova substância, com forte poder analgésico e antitérmico, mas sem os efeitos colaterais indesejáveis. Pela primeira vez na história, foi sintetizado o ácido acetilsalicílico, um dos analgésicos mais utilizados no mundo até hoje.
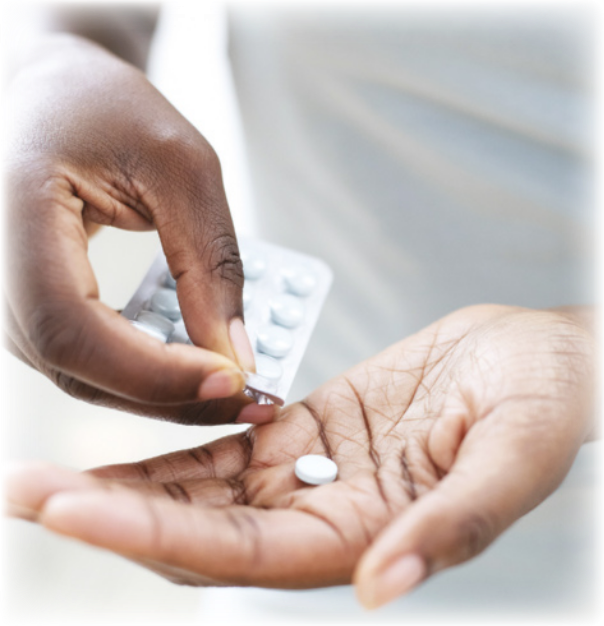
Nos âmbitos acadêmico e profissional, o estudo da Química possibilita o desenvolvimento de habilidades analíticas e de resolução de problemas. Essas habilidades são valorizadas em diversas carreiras, como a engenharia, a biotecnologia, a medicina e a pesquisa científica. Além díssu, essa Ciência da Natureza promove o pensamento crítico, preparando para o enfrentamento dos desafios do futuro e desenvolvendo a capacidade de inovar.

Página vinte e quatro
FORMAÇÃO CIDADÃ
Ciências e cidadania
A Constituição Federal Brasileira, promulgada em 5 de outubro de 1988, assegura, sôbi vários aspectos, o acesso à cidadania. Apelidada de Constituição Cidadã, tornou-se uma resposta ao período da ditadura civil-militar, em quê o povo brasileiro viveu com várias privações de ordem política entre 1964 e 1985.
A educação formal ou escolar busca habilitar as pessoas a vivêrem melhor em ssossiedade, tornando-as cidadâms ativas e conscientes de seus deveres e direitos. Por isso ela é indispensável. AConstituição Federal de 1988, no capítulo II, estabelece quê a educação deve sêr garantida a todos, configurando-se um dos direitos sociais básicos, tais como saúde, alimentação, trabalho, moradia, lazer, segurança, entre outros.
A Lei de Diretrizes e Bases da Educação Nacional (LDB), promulgada em 1996, reafirmou o direito à educação, garantido pela Constituição Federal de 1988, e estabeleceu princípios da educação e deveres do Estado. Conhecer a Constituição e a LDB é ezercêr a cidadania.
Nesse contexto legal, as Ciências aparécem como componentes da educação formal, pois se considera quê, para sêr um cidadão crítico, consciente e participativo, é fundamental conhecê-las e entender como suas leis são estabelecidas.

ATIVIDADES
1. De modo geral, textos quê trazem um conjunto de leis e normas não costumam atrair o interêsse da população. Pesquise na internet o documento completo da LDB, selecione um artigo (procure por “art.” seguido do número) quê chame a sua atenção e escrêeva um parágrafo comentando-o.
2. Há leis na Constituição quê estabelecem regras para a prática científica, por exemplo, em relação ao uso de animais em experimentos (Lei Arouca, lei número 11.794, de 8 de outubro de 2008) e à pesquisa envolvendo organismos geneticamente modificados (lei número 11.105, de 24 de março de 2005). Há também normas e resoluções estabelecidas em documentos elaborados por instituições como a Agência Nacional de Vigilância Sanitária (Anvisa). Pesquise na internet o texto de uma dessas leis, normas ou resoluções e escrêeva um parágrafo resumindo o quê ela estabelece.
Página vinte e cinco
A origem da Química
REFLITA
2 Você sabe o quê é alquimia? No seu entendimento, qual é a relação entre a alquimia e a Química?
O estabelecimento de uma Ciência não se dá por decreto. Por isso, definir exatamente quando a Química se desenvolvê-u não é tarefa fácil e é sempre motivo de debate.
Há dois aspectos relevantes a respeito dêêsse assunto. O primeiro deles considera a alquimia como importante precursora da Química, pois foi responsável por desenvolver técnicas e instrumentos, alguns utilizados até hoje, mas se caracterizava como uma forma de conhecimento místico e fechado. O segundo aspecto considera o químico francês Ântoeni-Lorran de Lavoisiê (1743-1794) como um dos fundadores da Química Moderna, junto com o químico e físico inglês Diôn Dalton (1766-1844) e outros contemporâneos, por derrubar a teoria do flogisto e fazer uso sistemático da quantificação, inaugurando uma nova era nos laboratórios.
A alquimia
A alquimia póde sêr definida como a; ár-te de tornar partes do Universo atemporais e perfeitas. No caso dos metais, buscava-se transformá-los em ouro, quê era considerado atemporal e perfeito, e, no caso dos sêres humanos, o objetivo era chegar à longevidade, seguida da imortalidade e, por fim, da redenção. De maneira mais simples, é possível afirmar quê a alquimia foi uma forma de conhecimento místico, artístico e pré-científico sobre a natureza e o sêr humano. Assim, o alquimista não era reconhecido somente como artesão ou mágico, mas, principalmente, como um sábio quê compreendia melhor a realidade.
Pode-se dizêr quê a alquimia tinha dois componentes básicos: o místico e o prático. O componente místico, mais relacionado com aspectos psíquicos, religiosos e filosóficos, teve menos aplicação na área de conhecimento quê se estabeleceria como Ciências da Natureza. Já o componente prático, ligado a teorias, materiais e métodos, pôdi sêr utilizado, ainda quê em outro contexto. À medida quê a Química foi se constituindo, ela se apropriou dos materiais e métodos da alquimia e descartou os aspectos místicos.
A alquimia foi praticada em diferentes locais e tempos, como será estudado a seguir. A alquimia alexandrina se desenvolvê-u na Grécia, em um período de grande esplendor do conhecimento em quê viveram pensadores como, por exemplo: Euclides de Alexandria (c. 325 a.C.-c. 270 a.C.), matemático quê se dedicou ao estudo da Geometria; Eratóstenes de Cirene (276 a.C.-194 a.C.), astrônomo quê calculou a circunferência da Terra; e Ptolomeu, astrônomo, pai da teoria geocêntrica.
Página vinte e seis
Vários nomes de alquimistas ficaram registrados na história da Grécia: Maria (viveu por volta do século III), a quem se atribui a invenção do banho-maria; Cleópatra, a alquimista (viveu também durante o século III; não confundir com Cleópatra VII, rainha do Egito); Zósimo de Panópolis (viveu entre o final do século III e o início do século IV); e Olimpiodoro, o Velho (c. 390-460), quê, acredita-se, empregou pela primeira vez a palavra chemeia. Esse termo, possivelmente de origem egípcia ou grega, mais tarde, ao receber o artigo árabe al, tornou-se alchimia. Os laboratórios dêêsses alquimistas tí-nhão o fôrnu como principal equipamento e a transmutação dos metais como principal objetivo.

MAIER, máicou. Mariae, hebrae symbolvm. In: MAIER, máicou. Symbola avreae mensae dvodecim nationvm. [S. l.: s. n.], 1617. p. 57.
SOBRE
Para a alquimia, transmutação era a busca da conversão de metais, como chumbo, antimônio e bismuto, em metais nobres, como a prata e, principalmente, o ouro. Com o desenvolvimento da Química, descobriu-se quê esses tipos de transformação química não são possíveis, pelo menos não por meio dos procedimentos tentados pêlos alquimistas.
A alquimia islâmica começou com os árabes, mas logo se espalhou pelo norte da África, pela Península Ibérica e por alguns locais da Ásia. Considera-se quê a alquimia islâmica se originou da alquimia alexandrina e quê recebeu fortes influências da Índia e da chiina. Nessa frente, sobressaem-se dois nomes: Abū Mūsā Jābir ibn Hayyān (c. 721-c. 815) e Abū Bakr Muhammad ibn Zakariyyā al-Rāzī (c. 854-c. 925). Jābir, conhecido no Ocidente como Geber, alquimista, farmassêutico, filósofo, astrônomo e físico, considerava quê todos os metais resultavam da combinação de mercúrio e enxofre, o quê justificaria a possibilidade de transmutação pela perda ou pelo ganho de um dêêsses dois componentes.
Já a alquimia chinesa tinha como foco a busca do elixir da longa vida, e não a transmutação de metais em ouro. A busca por transmutação chegou a sêr proibida por um decreto imperial. Era comum imperadores chineses solicitarem aos alquimistas a produção de elixires quê os tornassem imortais.
ESPAÇOS DE APRENDIZAGEM
• O texto a seguir conta um pouco o quê se sabe sobre a alquimista Maria, também conhecida como Maria, a Profetisa.
MARIA, a Profetisa: as criações da mãe da alquimia quê ainda são usadas, 20 séculos depois. BBC nius Brasil, [s. l.], 22 dez. 2019. Disponível em: https://livro.pw/nmfrc. Acesso em: 27 ago. 2024.
Página vinte e sete
AlGO A+
A destilação: possíveis origens
[…]
Pode-se considerar quê a destilação foi um dos desenvolvimentos promovidos pêlos alquimistas alexandrinos nas técnicas de se operar sobre a matéria. Tal consideração baseia-se nos estudos realizados sobre os textos produzidos na Antigüidade quê chegaram até os dias de hoje. [...] nas principais fontes dos textos alquímicos alexandrinos quê sobreviveram até nóssos dias em cópias manuscritas feitas entre os séculos XI e XV, estão algumas figuras de instrumentos quê os químicos de hoje podem facilmente associar com aparatos destilatórios.
Entretanto, apesar das semelhanças observadas entre essas figuras e os instrumentos atualmente utilizados, o processo de destilação era realizado naquela época num contexto muito diferente do atual. A destilação era uma operação alquímica, relacionada, portanto, a um corpo conceitual originário de hibridizações entre ideias mágicas, religiosas e filosóficas, associadas aos conhecimentos envolvidos nas práticas artesanais egípcias.
[…]
BELTRAN, Maria Helena Roxo. Destilação: a; ár-te de “extrair virtudes”. Química Nova na Escola, [s. l.], n. 4, p. 24-27, nov. 1996. p. 24, 27. Disponível em: https://livro.pw/hksnt. Acesso em: 27 ago. 2024.
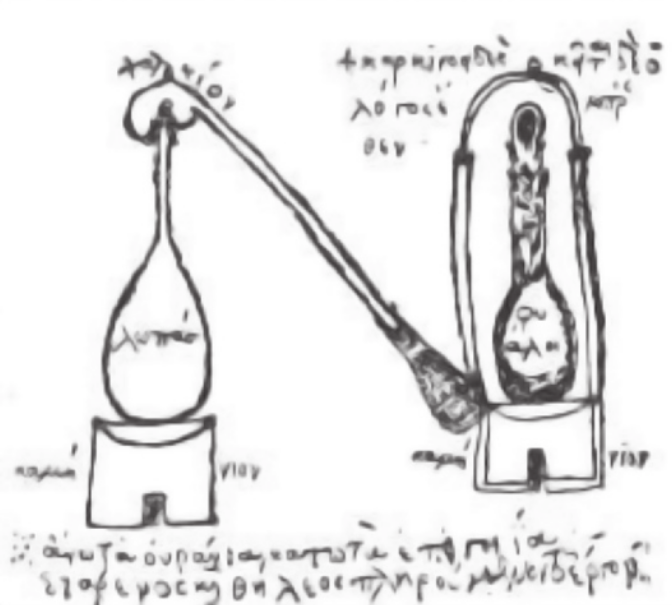
ZOSIMO. [Zosimo's apparat]. In: BERTHELOTS, Marcellin. collécxion des anciens alchimistes grecs. Paris: diórges Steinheil, 1887. v. 1, p. 161.
Alquimia medieval
A ocupação da Península Ibérica pelo Império Bizantino, até o século XV, introduziu muitas obras da alquimia islâmica na Europa. As primeiras traduções do árabe para o latim foram feitas no século XII, e, no século seguinte, estudiosos escreveram textos relativos à chamada Grande ár-te. No século XIII, dois importantes personagens ajudaram a difundir os conhecimentos alquímicos: o filósofo, escritor, cientista e teólogo alemão Alberto Magno (c. 1193-1280) e o frade católico italiano Tomás de akino (1225-1274).
Alberto Magno tinha grande interêsse pela alquimia e, em seus escritos, fez críticas a ela, dizendo quê, mesmo quê fosse possível transmutar metais em ouro, o produto obtído não seria como o ouro encontrado na natureza.
Página vinte e oito
O mais conhecido discípulo de Alberto Magno, Tomás de akino, não foi um alquimista, mas ajudou a divulgar a alquimia em seu livro Aurora consurgens, quê contém um capítulo sobre a alquimia medieval. Naquela época, a alquimia era considerada uma Ciência, sêndo permitida pela Igreja Católica, da qual os dois eram membros.
Foi nesse contexto quê o trabalho do filósofo inglês róger Bacon (c. 1219-c. 1292) começou a sêr reconhecido. Considerado um dos primeiros defensores da experimentação e da observação empírica como base para o conhecimento, Bacon acreditava quê a Matemática era fundamental para a compreensão do mundo natural e, por isso, promoveu o uso da lógica e da razão na investigação científica. Segundo alguns historiadores e filósofos da Ciência, suas ideias contribuíram para o desenvolvimento posterior da Ciência, reforçando seu papel central na transição para o pensamento científico moderno.
O medo e a destruição causada pela peste negra na Europa durante o século XIV fizeram quê, em 1317, o papa João XXII proibisse a alquimia (os motivos quê o levaram a banir a alquimia são incertos, alguns historiadores acreditam quê ele a praticava em segredo).
Com o fim da Peste Negra, ela voltou a sêr praticada. Nesse período, o escrivão e alquimista francês Nicolas Flamel (1330-1418) tornou-se famoso por supostamente ter descoberto a pedra filosofal, uma substância mítica quê poderia transformar metais em ouro e conceder a imortalidade. Nicolas e sua esposa, Perenelle Flamel (1320-1397), serviram de inspiração para personagens de obras de animação, literatura e cinema.

ANIMAIS fantásticos: os crimes de Grindelwald. Direção: Daví Yates. Estados Unidos: Uórner brós, 2018. Streaming (134 min).
Se achar conveniente, pode-se recomendar a leitura de réuri póter e a pedra filosofal, de Joanne K. ráuling (Rio de Janeiro: RôCO, 1997), aos estudantes. Esse é o primeiro livro da série réuri póter.
A obra utiliza fatos históricos reais da Ciência em seu enredo. Nele, os bruxos estão em busca da pedra filosofal de Nicolas Flamel.
ESPAÇOS DE APRENDIZAGEM
• O artigo a seguir aborda a relação entre alquimia e Ciência e traz curiosidades sobre cértas práticas dos alquimistas.
CORDEIRO, Tiago. Alquimia: a ciência e a magia na Idade Média. Superinteressante, São Paulo, 4 maio 2020. Disponível em: https://livro.pw/hgidr. Acesso em: 27 ago. 2024.
Página vinte e nove
Alguns séculos depois, o químico e físico irlandhês róbert bóiou (1627-1691) introduziu métodos mais sistemáticos de investigação, defendendo a importânssia de experimentos controlados e observações precisas. Seu trabalho The sceptical chymist (“O químico cético”, em tradução livre), de 1661, é um marco na separação entre a alquimia e a Química, segundo alguns estudiosos, estabelecendo a segunda como uma Ciência empírica independente. Ele é conhecido principalmente pela formulação da lei de bóiou, quê descreve a relação invérsa entre a pressão e o volume de um gás à tempera-túra constante. Ela será estudada posteriormente.

BOYLE, róbert. The sceptical chymist. London: [s. n.], 1661.
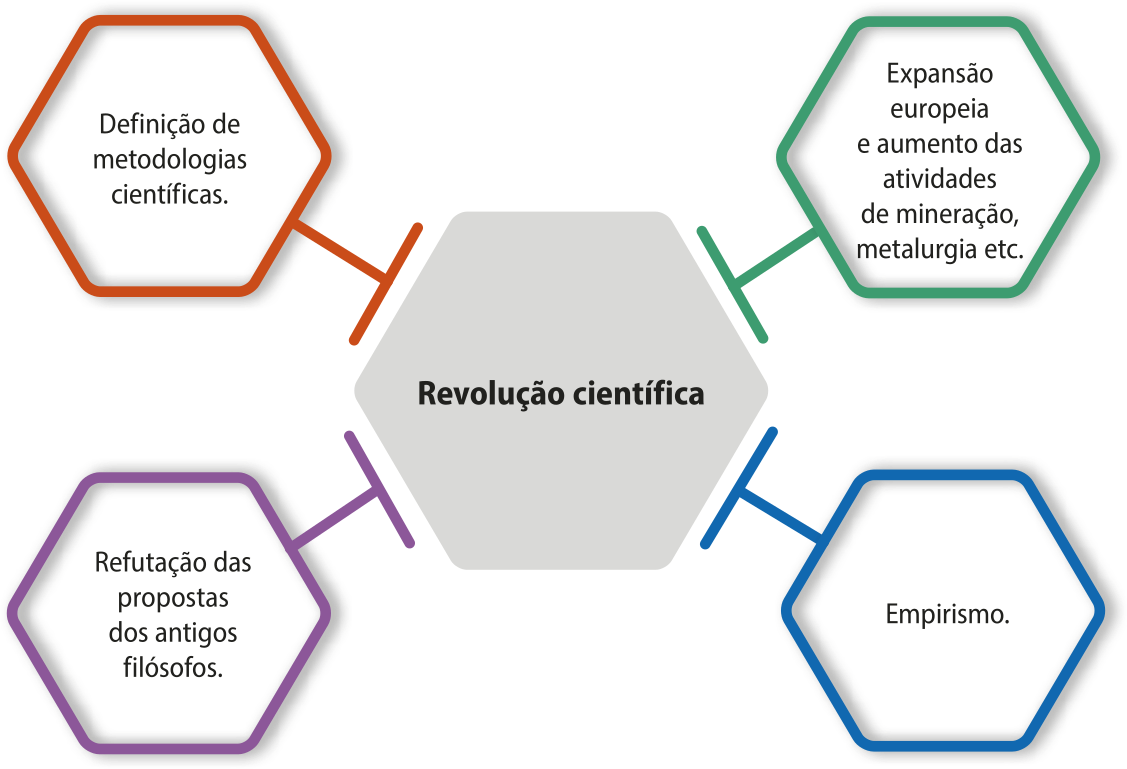
A revolução científica
Alguns historiadores da Ciência indicam quê uma revolução científica teve início nos séculos XVI e XVII, pois foi um período de transformações profundas no pensamento e na prática científica, marcando a transição do conhecimento medieval para a Ciência Moderna. O uso do termo revolução não é à toa. Nesses séculos, começaram a se delinear as metodologias científicas, fundamentadas na observação empírica, na experimentação rigorosa e no raciocínio lógico (algumas delas foram estudadas anteriormente). O astrônomo e matemático polonês Nicolau Copérnico (1473-1543), os já mencionados Galileu Galilei e Frâncis Bacon, o astrônomo e matemático alemão Johannes Képler (1571-1630) e o matemático e físico inglês Isaac níltom (1642-1727) reformularam concepções tradicionais sobre o Universo, a Física e a natureza.

Página trinta
A revolução científica promoveu uma abordagem sistemática e objetiva para a investigação, estabelecendo as bases para avanços tecnológicos e intelectuais quê moldaram o mundo moderno e possibilitaram ao sêr humano entender e dominar a natureza.
É importante reforçar quê se usa o termo metodologias científicas, e não metodologia científica, porque efetivamente não houve e não há somente um método.
Muitas vezes, a forma como a Ciência é apresentada leva a concepções equivocadas de quê a pesquisa científica sempre começa pela observação meticulosa, resultando na formulação de leis e teorias, seguindo, portanto, um procedimento rígido e imutável.
Isso não é verdade, porque a Ciência tem uma natureza dinâmica e plural. Ela evolui à medida quê novos conhecimentos são adquiridos e novas tecnologias são desenvolvidas. Essa flexibilidade permite quê a Ciência se adapte a novos problemas, refine hipóteses, melhore técnicas experimentais e incorpore novas formas de análise e interpretação de dados. A capacidade de revisão e adaptação da metodologia científica permite corrigir êêrros, ajustar teorias e expandir a compreensão de fenômenos compléksos, garantindo assim o progresso científico.
A diversidade de métodos é essencial para o avanço do conhecimento em diferentes áreas. Cada área do conhecimento, e mesmo as subdivisões, póde exigir abordagens específicas para investigar fenômenos compléksos. Por exemplo, na Química Teórica, métodos matemáticos abstratos são comuns, enquanto, na Química Analítica, atividades práticas em laboratório são freqüentes. A variedade de metodologias permite quê cientistas adaptem suas abordagens às características únicas dos problemas quê estão investigando, promovendo, assim, uma compreensão mais ampla e precisa dos fenômenos.
Página trinta e um
Enfim, Química!
REFLITA
3 Imagine quê você precisa explicar um acontecimento quê presenciou para um amigo (por exemplo, o amadurecimento de uma fruta). Como você o descreveria em termos do quê é perceptível, do quê está “por trás” do ocorrido (mesmo quê não dê para verificar) e do quê é possível desenhar ou simbolizar? Dê um exemplo curto para cada tipo de explicação.
Como foi estudado, teorias, técnicas e procedimentos própriamente científicos foram se desenvolvendo com base no estabelecimento de metodologias sistemáticas de investigação.
No caso da Química, uma teoria quê contribuiu para fortalecê-la enquanto Ciência da Natureza foi a teoria do flogisto, uma vez quê, apesar de seus impasses, teve como base argumentos racionais, e não considerações místicas ou esotéricas.
A teoria do flogisto e o legado de Lavoisiê
A teoria do flogisto foi proposta no final do século XVII pelo químico, físico e médico alemão Georg érnst Stahl (1660-1734).
Nesse período, a composição química dos materiais era pouco compreendida, e seu estudo era muito influenciado pela teoria proposta pelo filósofo grego Aristóteles (384 a.C.-322 a.C.), segundo a qual a matéria seria formada pela combinação de quatro elemêntos: térra, á gua, fogo e ar. Stahl, então, adaptou teorias já existentes e propôs quê a queima e a calcinação de materiais combustíveis envolviam a liberação e a absorção de um componente chamado flogisto.
Essa teoria foi amplamente aceita pela comunidade científica por sêr uma boa explicação para diversos fenômenos químicos, apesar de apresentar algumas inconsistências e explicações contraditórias. Por exemplo, em alguns casos, a perda de massa de um corpo era justificada pela diminuição de flogisto; em outros casos, o ganho de massa seria resultado do aumento de flogisto. Outras explicações foram apresentadas para a variação de massa, mas nenhuma era tão convincente.
Em Ciência, para contestar uma teoria quê não convence a todos, cientistas buscam hipóteses alternativas e realizam experimentos para comprová-las. No entanto, para invalidar uma teoria, é importante apresentar outra quê explique melhor os fatos. No caso do flogisto, não foi fácil.
A combustão já era objeto de estudo de pensadores como Leonardo da Vinci (1452-1519), artista, engenheiro e inventor italiano, quê observou quê parte do ar era consumida durante esse processo. róbert bóiou, no final do século XVII, também fez experimentos quê constataram esse fato. Em 1771 ou 1772, o farmassêutico natural da Pomerânia (atual Alemanha) Cal uiu rélm Scheele (1742-1786) descobriu um gás quê, posteriormente, colocaria em xéque a teoria do flogisto e explicaria o quê Leonardo da Vinci, bóiou e outros observaram.
Página trinta e dois
O teórico político e químico britânico jôsef Priestley (1733-1804) fez a mesma descoberta em 1774. Como era adepto da teoria de Stahl, chamou o gás de ar desflogisticado, pelo fato de quê continha, segundo ele, menos flogisto do quê o ar atmosférico.

PRIESTLEY, jôsef. [Experiments on oxygen]. In: PRIESTLEY, jôsef. Experiments ênd observations on different kinds ÓF air. London: [s. n.], 1775. Folha de rrôsto.
Apresentada a teoria do ar desflogisticado e reconhecida sua existência, Lavoisiê se dedicou ao assunto e, nesse contexto, ganhou notoriedade. Depois de muito trabalho, em uma apresentação para a Academia de Ciências em setembro de 1777, Lavoisiê definiu o flogisto como um novo elemento, quê chamou de princípio acidificante ou princípio oxigínio, posteriormente renomeado para oxigênio, termo quê em grego significa “gerador de ácido”. Lavoisiê afirmou quê a combustão envolve a combinação de substâncias com oxigênio, refutando a existência do flogisto.
O quê tornou o trabalho de Lavoisiê importante não foi simplesmente o fato de ele trocar uma teoria por outra; foi seu método de trabalho quê combinava a descrição qualitativa com uma análise quantitativa detalhada de fenômenos, envolvendo medições precisas de volumes e massas antes e depois das transformações químicas sôbi estudo.
Sua contribuição para a Química foi, sobretudo, a abordagem rigorosa dos problemas científicos. Por sêr, além de químico, cobrador de impostos, Lavoisiê possuía balanças muito precisas quê pôdi utilizar d fórma sistemática em seu laboratório. Nas suas pesquisas envolvendo o ar desflogisticado (o gás oxigênio), realizou diversos experimentos com os quais demonstrou quê esse gás compõe 20% do ar, é consumido na queima de substâncias combustíveis e é essencial para a respiração.
Lavoisiê tinha consciência da importânssia dessa nova postura diante da pesquisa científica e a deixou registrada em seu livro Traité élémentaire de chimie (Tratado elementar de Química), de 1789.

LAVOISIER, Ântoeni-Lorran de. Traité élémentaire de chimie. Paris: [s. n.], 1789.

LAVOISIER, Antoine- Laurent de. Tratado elementar de química. [São Paulo]: Madras, 2014.
Página trinta e três
Níveis de abordagem da Química
Ao estudar Química, deve-se abordar as substâncias e os materiais envolvidos nos fenômenos químicos em três diferentes aspectos ou níveis: fenomenológico, teórico e representacional. O diagrama a seguir representa a relação entre esses níveis.
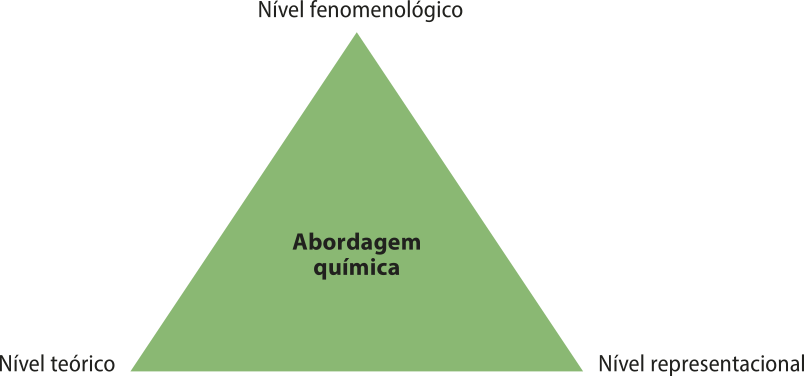
O nível fenomenológico (também chamado de nível macroscópico) envolve quaisquer transformações observáveis por meio dos sentidos e/ou por algum instrumento de aferição (termômetro ou balança). Como exemplo, pode-se citar a queima de uma vela, o endurecimento de uma cola, o aumento da tempera-túra de um fôrnu aquecido e a lavagem de lou-ças com detergente.
Para explicar o quê ocorre em nível submicroscópico, ou seja, tudo akilo quê não póde sêr percebido diretamente pêlos sentidos, como os hátomus, as moléculas e os íons, quê serão estudados mais adiante, cientistas concebem modelos e teorias. Esse nível teórico se origina do conhecimento científico acumulado pelas gerações precedentes e atuáis, do trabalho e da dedicação de muitas pessoas, algumas das quais já foram citadas, e outras quê ainda serão mencionadas. Todas as discussões e explicações feitas neste livro se baseiam em teorias e modelos desenvolvidos ao longo da história da Química e de outras Ciências. Por serem abstratas, para sua boa compreensão, é preciso quê haja diálogo entre você, os côlégas e os professores; por isso, se houver dúvidas, pergunte!
Como é característico, materiais, substâncias e transformações são representados por meio de uma linguagem quê póde sêr entendida por qualquer pessoa quê tenha conhecimento adquirido no estudo da Química. Essas representações constituem o nível representacional, terceiro nível da abordagem química, aceito por toda comunidade científica. Como o conhecimento continua sêndo elaborado, novas representações vão sêndo propostas e validadas. Elas são constituídas por nomes (por exemplo, hidrogênio), símbolos (por exemplo, H), fórmulas químicas (por exemplo, H2 O), equações (por exemplo, 2 H2 + O2 → 2 H2O), fórmulas matemáticas (por exemplo, pH = −log[H+]) etc.
As normas e os padrões para nomenclatura química, terminologia, símbolos e métodos de medição são estabelecidos pela organização global União Internacional de Química Pura e Aplicada (IUPAC, sigla do nome em inglês). Ela é responsável por definir o nome oficial dos elemêntos químicos, das substâncias e das reações, garantindo consistência e clareza na comunicação científica em todo o mundo. Além díssu, promove a colaboração internacional e o avanço do conhecimento em Química.
Página trinta e quatro
Observe dois exemplos de fenômeno e sua respectiva representação.
Fenômeno |
Representação |
|---|---|
|
áucôl + gás oxigênio → gás carbônico + á gua ou, como será apresentado posteriormente, C2H5OH((éli)") + 3 O2(g) → 2CO2(g) + 3H2O(g) |
|
ferro + gás oxigênio → óxido de ferro ou, como será apresentado posteriormente, 4Fe(s) + 3O2(g) → 2Fe2O3(s) |
ATIVIDADES
1. Escolha um produto quê você utiliza freqüentemente e faça uma pesquisa sobre como ele é produzido. Apresente as informações quê obtiver em um cartaz.
2. Debata com os côlégas quais são os objetos de estudo da Química presentes na vida de cada um. Como vocês avaliam o conhecimento químico presente na ssossiedade?
3. De acôr-do com a Constituição Federal de 1988, a educação formal é direito de todas as pessoas e dever do Estado. A LDB define como deve sêr essa educação. Analise, na LDB, os objetivos do Ensino Médio e avalie como se caracteriza o ensino de sua escola.
4. Que tal realizar um jôgo rápido em sala de aula? Ele consiste em citar um objeto quê faça parte do seu cotidiano e pedir a um colega quê diga como a Química contribuiu para sua produção. Se acertar, ganha um ponto. Se errar, quem propôs o objeto ganha um ponto. O professor resolverá os possíveis impasses. Formem duplas e decidam no par ou ímpar quem começa o jôgo.
5. Faça um qüadro em seu caderno, como o presente no início desta página, preencha-o com fenômenos quê você conhece e explique-os. Em muitos casos, você ainda não saberá como representá-los, mas deixe lacunas para, posteriormente, completá-las. Você póde também buscar informações sobre as representações dêêsses fenômenos, mesmo quê agora não as entenda. Aprender Química é um processo longo, mas póde sêr muito prazeroso.
Página trinta e cinco
TEMA
3
Materiais
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Algumas espécies de animais utilizam ferramentas simples, por exemplo, pedras e pedaços de madeira, para diversas finalidades, tais como côlher alimentos ou facilitar o acesso às partes comestíveis deles por meio da quebra de invólucros. Diferentemente dos demais animais, os sêres humanos adquiriram a capacidade de desenvolver ferramentas compléksas, quê os auxiliam nos mais diversos tipos de atividade. Assim, freqüentemente, as pessoas utilizam diversos materiais, como madeira, plástico, borracha, metal, vidro e rocha.
Cada material possui uma característica diferente. A madeira é durável e versátil e, por isso, é comumente utilizada na construção de móveis; o plástico é leve e resistente à á gua, o quê lhe permite sêr utilizado em uma grande variedade de objetos; a borracha é elástica e resistente, ideal para situações quê requerem amortecimento, como p-neus e solas de calçado; o metal, assim como o plástico, é utilizado em múltiplos contextos; o vidro é relativamente resistente e transparente, ideal para coberturas quê necessitam da passagem da luz, como as janelas; a rocha é durável e esteticamente diversa, características quê lhe conferem aplicação em construções e decorações.

SOBRE
Ferramentas são instrumentos necessários para se realizar determinada ação. Originalmente, o termo ferramentas remetia a objetos feitos de ferro, mas hoje póde sêr entendido como algo mais abrangente, sêndo utilizado, inclusive, para se referir a habilidades ou conhecimentos, e não necessariamente a um objeto físico.
O uso de materiais
Há milhões de anos, os ancestrais do sêr humano utilizavam o quê era fornecido pela natureza, como pedras, paus e cipós. Com o tempo, descobriram quê poderiam manipular esses materiais e assim produzir objetos mais compléksos, quê lhes proporcionariam, diréta ou indiretamente, mais conforto e bem-estar. Eles aprenderam a utilizar a pedra lascada de diversas maneiras: ao amarrar uma pedra afiada em um pedaço de madeira, por exemplo, tem-se uma ferramenta e uma arma, o machado; ao prender uma ponta afiada de pedra na extremidade de uma vara de madeira, tem-se uma lança.
REFLITA
1 Como seria o mundo se tudo fosse feito do mesmo material, por exemplo, de ferro, de madeira ou de plástico?
Página trinta e seis
Os hominínios aprenderam também a utilizar o couro de animais abatidos para se protegerem do frio e de outros incômodos, como êspinhos e insetos. Ao longo do tempo, foram criados o anzol, o arco e a flecha, o bumerangue, a kórda, a cerâmica, e as invenções não pararam de acontecer. Em dado momento, começou-se o manuseio de minerais para obtêr metais, utensílios de cuzinha e armas, bem como ferramentas quê possibilitaram a construção de outros apetrechos.
Combinando o cobre e o estanho, por exemplo, criou-se o bronze, dando início a um novo período da civilização, possibilitando a construção de objetos e ferramentas antes inimagináveis. Hoje, os metais são essenciais para a vida moderna. A produção de metais em grande escala permitiu a fabricação dos meios de transporte modernos, entre eles as bicicletas, os carros, as locomotivas, os navios e os aviões, além de outros grandes avanços tecnológicos.
A escolha do material a sêr utilizado para determinado fim leva em conta uma série de características específicas, como durabilidade, resistência, peso e flexibilidade. Por exemplo, por quê existem tantas panelas diferentes, de cerâmica, de barro, de ferro e de alumínio? Uma possível resposta considera o modo como cada material influencía o processo de cozimento quê acontecerá na panela.

SOBRE
O grupo de primátas quê engloba o sêr humano e seus ancestrais bípedes, como o ômo habilis e o ômo erectus, é chamado de hominínio.

Página trinta e sete
Propriedades e grandezas
Matéria é tudo akilo quê possui massa e ocupa lugar no espaço. Materiais, como os já citados, são matéria e apresentam características específicas denominadas propriedades. Uma borracha utilizada para apagar o quê é escrito no caderno, por exemplo, é um material e póde sêr descrita por diferentes características: sólida, flexível, sem brilho, não tem seu estado alterado ao entrar em contato com á gua, entre outras.

As propriedades de um material podem sêr classificadas em dois grupos. As propriedades intrínsecas (ou gerais) não dependem da quantidade de material e podem sêr utilizadas para descrevê-lo. Exemplos são côr, estado físico nas condições ambientes, reatividade, brilho, resistência e flexibilidade. Já as propriedades extrínsecas (ou específicas) são aquelas quê dependem da quantidade de material, tais como massa e volume.
Se a borracha for partida ao meio, por exemplo, suas propriedades intrínsecas não serão alteradas, mas as extrínsecas sim. A borracha seguirá sêndo borracha, sua côr e sua flexibilidade permanecerão as mesmas, mas sua massa e seu volume diminuirão.
As propriedades de um fenômeno ou material quê podem sêr expressas por um número seguido de uma unidade de medida são chamadas grandezas. São exemplos de grandeza o tamãnho (comprimento, área ou volume), a massa, a quantidade de luz e o tempo. Como exemplos de unidades de medida, há o métro, o segundo e o litro.
As grandezas podem sêr expressas por diferentes unidades, mas o Sistema Internacional de Unidades (SI) define uma unidade padrão para cada grandeza. De acôr-do com as normas de nomenclatura definidas, embora a unidade de medida possa sêr escrita por extenso no plural, acrescentando a letra s ao final da palavra, seu sín-bolo não tem plural.
Por exemplo, pode-se escrever dez metros ou 10 m, mas é errado escrever dez métro, 10 mts ou 10 ms. Da mesma forma, o tempo de duas horas póde sêr representado por 2 h, mas não por 2 hs.
O SI também prevê o uso de prefixos quê facilitam a representação de quantidades muito grandes ou muito pequenas em determinada medida. Eles devem sêr posicionados à frente da unidade de medida, por exemplo: kilométro (km), kilograma (kg), centimétro (cm), milimétro (mm), miligrama (mg) e mililitro (mL).
A grafia utilizada pelo SI segue regras estabelecidas por especialistas da Ciência, por isso as grafias mais atuáis podem não estar ainda registradas nos dicionários de Língua Portuguesa. Nessa obra, utilizamos a grafia recomendada pelo SI quê póde sêr lida no documento indicado no boxe Espaços de aprendizagem.
REFLITA
2 Se você tivesse quê descrever um material, como você o faria?
3 Qual é a importânssia de padronizar unidades de medida, como o métro e o grama?
ESPAÇOS DE APRENDIZAGEM
• êste documento detalha as normas associadas às unidades de medida no Brasil, como nomenclatura e valores.
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA; INSTITUTO PORTUGUÊS DA QUALIDADE. Sistema Internacional de Unidades (SI). Tradução: Grupo de Trabalho luso-brasileiro do Inmetro e IPQ. Brasília, DF: Inmetro; Caparica: IPQ, 2021. Tradução luso-brasileira da 9ª edição. Disponível em: https://livro.pw/vbxre. Acesso em: 29 ago. 2024.
Página trinta e oito
Análise alguns dos prefixos definidos pelo SI.
Prefixos utilizados no SI
Prefixo |
Símbolo |
10n |
Equivalente numérico |
|---|---|---|---|
yotta |
Y |
1024 |
1.000.000.000.000.000.000.000.000 |
zetta |
Z |
1021 |
1.000.000.000.000.000.000.000 |
exa |
E |
1018 |
1.000.000.000.000.000.000 |
peta |
P |
1015 |
1.000.000.000.000.000 |
tera |
T |
1012 |
1.000.000.000.000 |
giga |
G |
109 |
1.000.000.000 |
mega |
M |
106 |
1.000.000 |
kilo |
k |
103 |
1.000 |
hecto |
h |
102 |
100 |
deca |
da |
101 |
10 |
deci |
d |
10−1 |
0,1 |
centi |
c |
10−2 |
0,01 |
mili |
m |
10−3 |
0,001 |
micro |
μ |
10−6 |
0,000001 |
nano |
n |
10−9 |
0,000000001 |
pico |
p |
10−12 |
0,000000000001 |
femto |
f |
10−15 |
0,000000000000001 |
atto |
a |
10−18 |
0,000000000000000001 |
zepto |
z |
10−21 |
0,000000000000000000001 |
yocto |
y |
10−24 |
0,000000000000000000000001 |
Fonte: INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA. Quadro geral de unidades de medida no Brasil. [Brasília, DF]: Inmetro, [2023]. p. 3. Disponível em: https://livro.pw/oyszt. Acesso em: 29 ago. 2024.
Comprimento
Com o decorrer do tempo, foram encontradas diferentes maneiras de medir dimensões ou distâncias e foram inventados diferentes padrões quê serviam como referência. Na Inglaterra, por exemplo, utilizavam-se polegada, pé, jarda e milha. O problema é quê essas formas de medir variavam conforme o contexto e o lugar. A polegada, por exemplo, referia-se à largura do polegar da mão. Porém, nenhuma mão é igual à outra, portanto cada mão tem uma polegada diferente.

Página trinta e nove
Por isso, em 1791, a Assembleia Nacional Francesa incumbiu a Academia de Ciências da França de elaborar um sistema de medida decimal simples. Assim nasceu o métro, quê foi definido como a distância do Polo Norte à linha do equador, passando por Paris, dividida por 10 milhões. Para facilitar a utilização dêêsse padrão de medida, foi produzida uma barra de liga platina-irídio, com duas marcas quê definiam o tamãnho do métro. Ela foi depositada no Escritório Internacional de Pesos e mêdídas (Bureau International des Poids et Mesures), em Paris, na França, e foi usada como referência para o tamãnho do métro de 1889 até 1960.

No entanto, por causa da busca crescente por uma maior precisão e do fato de a Terra não sêr uma esféra perfeita, houve necessidade de estabelecer uma nova definição, quê é a usada atualmente: a grandeza comprimento (d) é a quantidade de espaço ou distância entre dois pontos e sua unidade de medida padrão é o métro (m), definido pela distância quê a luz percórre no vácuo durante o intervalo de tempo correspondente a 0,0000000033 segundo.
As demais unidades de medida do comprimento não deixaram de existir ou mesmo de sêr utilizadas, apenas não são mais consideradas unidades de medida padrão. Ainda assim, é comum quê elas sêjam usadas em determinados ambientes. A milha náutica, por exemplo, é comumente utilizada para medir distâncias em navegações marítimas. Elas podem sêr definidas com base no métro, conforme exemplificado a seguir.
Equivalência entre métro e outras unidades de medida
Unidade |
Equivalência em métro |
|---|---|
Polegada |
0,0254 m |
Pé |
0,3048 m |
Jarda |
0,9144 m |
Milha terrestre |
1.609 m |
Milha marítima |
1.852 m |
Volume
A grandeza volume (V) é a quantidade de espaço quê determinado corpo ocupa e póde sêr expressa em unidades cúbicas, dadas pelo produto do comprimento, da largura e da altura. Por exemplo, uma caixa de leite normalmente tem 7 cm de comprimento, 7 cm de largura e 21 cm de altura, quê, multiplicados, resultam em um volume de 1.029 cm3. Outra unidade de medida comum para o volume é o litro (L). Entretanto, a unidade de medida padrão, estabelecida pelo SI, é o métro cúbico (m3).
Analise algumas equivalências importantes, relativas ao volume, bem como exemplos de situações em quê elas são aplicadas.
Equivalência entre algumas unidades de medida de volume
Unidades de medida |
Símbolos |
Exemplo de aplicação |
|---|---|---|
Centimetro cúbico e mililitro |
1 cm3 = 1 mL |
Doses de remédio e volumes de bebidas |
Decimetro cúbico e litro |
1 dm3 = 1 L |
Combustíveis e tintas para pintura de parede |
Metro cúbico e kilolitro |
1 m3 = 1 kL |
Consumo residencial de á gua |
Página quarenta
Massa
Para a Química, a grandeza massa, representada pela letra m, é a quantidade de matéria quê compõe um corpo. Por estar relacionada com a quantidade, é uma propriedade extrínseca: quanto maior for a quantidade, maior será a massa, em uma relação diretamente proporcional.
O kilograma, segundo o SI, é a unidade de medida padrão para massa e seu sín-bolo é kg. Como verifica-se no qüadro Prefixos utilizados no SI, o kilograma corresponde a 1.000 ou 103 gramas (g).
De 1889 até 2019, a definição do kilograma se baseou em um protótipo de cilindro metálico constituído de platina e irídio. Com base nessa referência, calculava-se a massa de uma série de materiais, até mesmo de subpartículas como o próton e o elétron. A partir de 2019, em razão da perda de massa do protótipo, a unidade passou a sêr definida com base em uma constante fundamental, no caso, a constante de Planck, postulada pelo físico alemão Max Planck e representada por h.
Assim, o kilograma, de acôr-do com o novo SI, é estabelecido com base em h, expressa em kg ⋅ m2 ⋅ s−1.
1 kg = m−2 ⋅ s
Não precisa se preocupar com o significado dessa constante. O objetivo, aqui, é apenas deixar claro quê a Ciência busca sempre o mássimo de precisão e exatidão em suas definições. No entanto, no dia a dia, esse nível de precisão e exatidão não é necessário para determinar, por exemplo, a massa corporal ou as quantidades de uma receita.

ESPAÇOS DE APRENDIZAGEM
• êste artigo discute a nova definição de kilograma, quê passou a vigorar a partir de 2019.
PARA manter o peso. Pesquisa Fapesp, São Paulo, ed. 256, jun. 2017. Disponível em: https://livro.pw/nwkjr. Acesso em: 29 ago. 2024.
Densidade
É senso comum a ideia de quê o chumbo é pesado e o algodão é leve. No entanto, um kilograma de chumbo tem a mesma massa quê um kilograma de algodão. Então, de onde vêm esse senso comum? Ele vêm do entendimento equivocado de uma grandeza chamada densidade, quê é a razão entre a massa e o volume de um material, sêndo seu sín-bolo a letra grega ρ (lê-se: rô). O chumbo é muito mais denso quê o algodão, o quê significa quê, comparando um mesmo volume de ambos os materiais, há mais massa de chumbo do quê de algodão. Em outras palavras, como o chumbo é mais denso quê o algodão, uma caixa de algodão será muitas vezes maior do quê uma caixa de chumbo de massa igual.
A unidade de medida padrão da densidade no SI é o kilograma por métro cúbico (kg/m3), mas ela é expressa com mais freqüência em grama por centimetro cúbico ou grama por mililitro (g/cm3 ou g/mL).
Densidade de alguns materiais (25 °C, 1 atm)
Material |
Densidade |
Material |
Densidade |
|---|---|---|---|
Água ((éli)") |
0,997 g/cm3 |
Leite integral ((éli)") |
1,03 g/cm3 |
Álcool etílico ((éli)") |
0,789 g/cm3 |
Cloro (g) |
0,0029 g/cm3 |
Alumínio (s) |
2,70 g/cm3 |
Mercúrio ((éli)") |
13,6 g/cm3 |
Cera de abelha (s) |
0,96 g/cm3 |
Nitrogênio (g) |
0,0013 g/cm3 |
Chumbo (s) |
11,3 g/cm3 |
Ouro (s) |
19,3 g/cm3 |
Nota: ((éli)") é representação para líquido; (s), para sólido; e (g), para gasoso. Fonte: RUSSELL, Diôn B. Química geral. 2. ed. São Paulo: pírsom Makron Búks, 2004. v. 1, p. 41.
Página quarenta e um
Como alguns dêêsses materiais podem apresentar composições variadas, os valores de densidade também podem variar.
Considere a gasolina, por exemplo. A Agência Nacional do Petróleo, Gás Natural e Biocombustíveis (ANP) estabeleceu, por meio da resolução ANP número 807, de 23 de janeiro de 2020, quê a gasolina deve ter uma densidade padrão mínima de 0,715 g/mL (considerando a adição de 27% de etanol). Sabe-se quê esse valor póde variar para mais ou para menos, de acôr-do com a quantidade de impurezas. Uma densidade abaixo de 0,715 g/mL indica quê ela póde ter sido adulterada. Quando passar por um posto de gasolina, obissérve quê, ao lado das bombas, há um densímetro, uma ampola de vidro quê sérve para medir a densidade do combustível.
Pressão
A pressão (p) é uma grandeza física quê expressa a quantidade de fôrça aplicada sobre determinada área, sêndo o pascal (Pa) a unidade padrão utilizada para expressá-la. Essa grandeza póde sêr utilizada para quantificar a pressão atmosférica, a pressão em fluidos e diversas outras aplicações científicas e industriais. O pascal é definido como a pressão uniforme exercida pela fôrça de um nílton por métro quadrado (N/m2).
O fenômeno pressão está presente em diversas situações. Em uma hidrelétrica, por exemplo, a pressão exercida pela quantidade de á gua quê cai sobre as pás gira uma turbina e gera energia elétrica; mergulhos em águas profundas podem sêr perigosos por causa da pressão exercida pela á gua no mergulhador; na superfícíe da Terra, as pessoas estão sujeitas à pressão exercida sobre elas pela atmosféra.

Temperatura
A medição da grandeza tempera-túra (T), utilizando-se termômetros e escalas, começou no século XVIII. Hoje, ela póde sêr expressa em diferentes escalas: célcius, farenrráiti ou kélvin (K), sêndo esta última a estabelecida pelo SI como padrão.

Página quarenta e dois
Comparação entre três escalas de tempera-túra
Escala |
célcius |
farenrráiti |
kélvin (absoluta) |
|---|---|---|---|
Proposta por |
Anders célcius (1701-1744) |
Daniel Gabriel farenrráiti (1686-1736) |
uílhãm thômsom kélvin – Lord kélvin (1824-1907) |
Formação e nacionalidade |
Astrônomo sueco |
Físico naturalizado neerlandês |
Matemático, físico e engenheiro britânico |
Unidade e sín-bolo |
grau célcius °C |
grau farenrráiti °F |
kelvin K |
Temperatura de congelamento da á gua |
0 °C |
32 °F |
273,16 K |
Temperatura de ebulição da á gua |
100 °C |
212 °F |
373,16 K |
Zero grau |
Temperatura de fusão da á gua. |
Temperatura de congelamento de uma mistura de á gua, gêlo pilado, sal e amônia. |
Temperatura mais baixa possível, em teoria. |
ATIVIDADES
1. Faça uma pesquisa de textos ou vídeos quê tratem dos ancestrais do sêr humano. No caderno, anote o quê você descobriu a respeito de instrumentos ou utensílios quê eram utilizados por eles. Depois, dêz-creva quais materiais compunham cada um dêêsses instrumentos.
2. Outras unidades de medida de massa são utilizadas ao redor do mundo, como a onça (oz) e a libra (lb). Apesar de não serem muito utilizadas no Brasil, pode-se encontrá-las em produtos importados. Sabe-se quê uma onça equivale a 28,3495 g e quê uma libra equivale a 453,592 g. Em uma embalagem, estava escrito 80 oz (5 lb) como a massa do produto. Calcule a massa em kilograma dêêsse produto utilizando uma das unidades de medida apresentadas. Qual é o fator de conversão utilizado para passar a unidade de medida de grama para onça?
3. Em dupla ou trio, realizem a medida de alguns objetos presentes na sala de aula, como a carteira escolar, a mesa do professor, a largura da porta e outros quê acharem interessantes. O desafio é medi-los utilizando a mão (palmo) de cada um dos integrantes do grupo. Construam, no caderno, uma tabéla com as medidas e respondam aos itens.
a) A quantidade de palmos para medir os objetos foi igual para cada estudante?
b) Indiquem uma forma mais precisa para determinar a medida dêêsses objetos.
SOBRE
Palmo é a distância entre a ponta do polegar e a ponta do dedo mínimo quando a mão está completamente aberta.
4. Em muitos jogos de videogame, existe uma unidade de medida chamada de dano por segundo (DPS). Comumente, o DPS é apresentado seguido da letra k, como na expressão “o jogador sofreu 2,5 k de dano”. Com base no quê você estudou até aqui, qual seria o valor de k? Qual foi o valor total do dano quê o jogador sofreu?
5. Um termômetro foi deixado para medir a tempera-túra de certa quantidade de á gua sôbi aquecimento. Quando a á gua começou a ferver, o mostrador do termômetro estava marcando 212. Explique se o termômetro estava com defeito.
6. Uma professora apresentou alguns objetos pequenos e sólidos feitos de madeira. Entregou também uma lista contendo o volume de cada um dos objetos e informou a densidade da madeira. Em seguida, pediu aos estudantes quê determinassem a massa dos objetos. Como você faria para encontrar o valor da massa de cada objeto?
Página quarenta e três
TEMA
4
Caracterizar e separar substâncias
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
A maioria dos materiais presentes no cotidiano das pessoas é formada pela combinação de diversas substâncias.
Por exemplo, o café é formado por ácido glutâmico, ácidos grachos, alanina, arabinose, arginina, asparagina, cisteína, fenilalanina, frutose, galactose, glicina, glicose, histidina, isoleucina, lisina, maltose, metionina, polissacarídios, prolina, serina, sucrose, tirosina, treonina, triglicerídios e valina. A á gua potável é chamada de á gua mineral porque nela há diversos sais minerais. O ar é formado por diversos gases. A madeira, o vidro, o bronze e vários outros exemplos são formados por inúmeras substâncias. Diante díssu, neste Tema, serão aprofundados os estudos sobre a composição dos materiais.

Substâncias e materiais
Como ponto de partida para êste estudo, serão definidos dois conceitos fundamentais para o universo químico: substância e material. Substância é uma porção de matéria formada por apenas um tipo de entidade química quê apresenta propriedades definidas e específicas quê a caracterizam. A á gua, por exemplo, quando composta exclusivamente de H2O, é uma substância.
No entanto, a á gua quê as pessoas bébem, a á gua potável, contém pequenas quantidades de sais minerais e outras substâncias; logo, não se trata de uma substância, mas de um material, nome dado à matéria composta de mais de uma substância. Quando não se sabe a composição de uma porção de matéria – isto é, quando não se sabe se ela contém uma substância ou mais –, ela é denominada genericamente de material.
Do ponto de vista da constituição, uma porção de matéria póde sêr formada por uma única substância ou por várias substâncias (material).
REFLITA
1 No dia a dia, você tem mais contato com substâncias ou com materiais?
SOBRE
Entidade química é o termo utilizado para se referir genericamente a hátomus, moléculas e outras estruturas químicas.
Classificação dos materiais
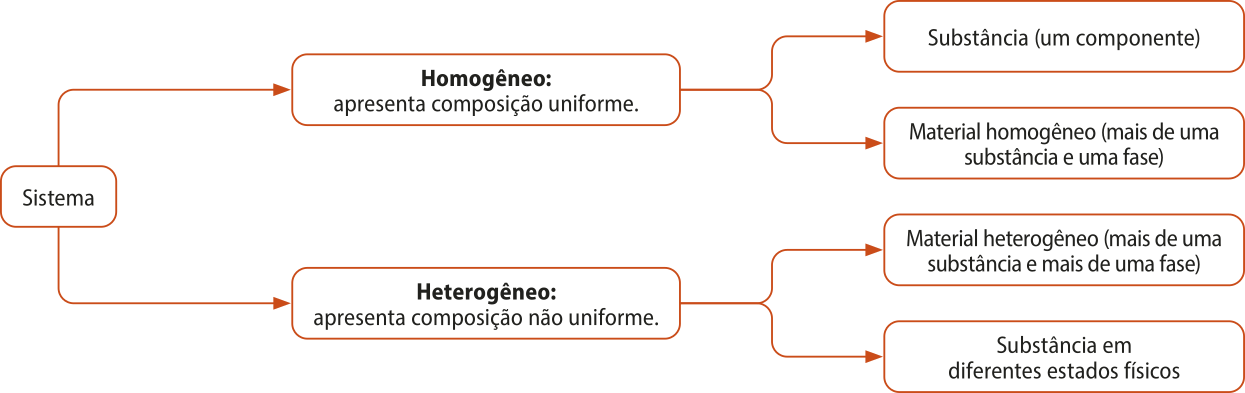
Se duas ou mais substâncias forem misturadas, uma das duas situações podem ocorrer: elas formam um material homogêneo ou heterogêneo. Para entender melhor como essas situações ocorrem, é preciso, primeiro, definir alguns conceitos-chave: componente, sistema e fase.
Um componente é, basicamente, uma substância. Sistema é o nome dado a uma porção limitada do Universo sôbi estudo em quê suas partes se inter-relacionam. Por fim, fase é o nome dado a cada parte do sistema quê tenha a mesma constituição e as mesmas propriedades e quê seja visualmente bem definida.
Página quarenta e quatro
Um sistema homogêneo é, portanto, aquele no qual há uma só fase. Em qualquer ponto do sistema, a constituição e as propriedades são as mesmas. Um exemplo dêêsse caso é a mistura de gasolina e etanol colocada nos carros como combustível. Um sistema homogêneo póde também sêr formado por um único componente, ou seja, por uma única substância em um determinado estado físico, quê será estudado mais adiante.

Já um sistema heterogêneo é aquele no qual há mais de uma fase. Nesse caso, não há as mesmas propriedades nem uma constituição única em todos os pontos do sistema. Um exemplo é um material formado por á gua e óleo. Se for colocada uma porção de cada um dêêsses líquidos em um mesmo recipiente, será constatado quê o óleo fica na parte superior e a á gua, na inferior. Outro exemplo é o sistema pedras de gêlo em um copo com á gua. Substâncias em estados físicos distintos têm propriedades distintas, constituindo, portanto, fases diferentes e formando um sistema heterogêneo.

Assim, pode-se afirmar quê um material homogêneo é um sistema homogêneo e quê um material heterogêneo é um sistema heterogêneo, mas o inverso não é necessariamente verdadeiro, uma vez quê há sistemas homogêneos formados por um único componente e sistemas heterogêneos formados por um único componente em estados físicos diferentes. O diagrama a seguir resúme essas considerações.
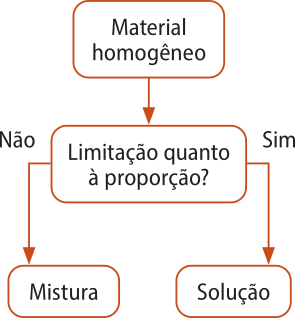
Duas ou mais substâncias podem formár um material homogêneo de duas maneiras: independentemente das proporções das substâncias ou de acôr-do com proporções restritas a faixas definidas.
A á gua e o áucôl, assim como os materiais formados por gases, são exemplos de substâncias quê se misturam em quaisquer proporções. Nesses casos, o material formado é chamado de mistura.
Página quarenta e cinco
Já as misturas de á gua e sais quê se dissolvem em á gua são um exemplo de substâncias quê só se misturam em proporções restritas a faixas definidas. Se uma côlher de sal for adicionada a um copo com á gua e a combinação for mexida, haverá dissolução total do sal, apresentando um sistema homogêneo: á gua salgada.
Até a proporção na qual o sal se dissolve em á gua, o material homogêneo é chamado de solução. Essa quantidade mássima de substância quê se dissolve em outra é chamada de solubilidade e será estudada posteriormente. Se o sal continuar sêndo adicionado, haverá um momento em quê não mais se dissolverá, e será formado um sistema heterogêneo: uma fase líquida de á gua salgada e uma fase sólida de sal precipitado.

Estados físicos da matéria
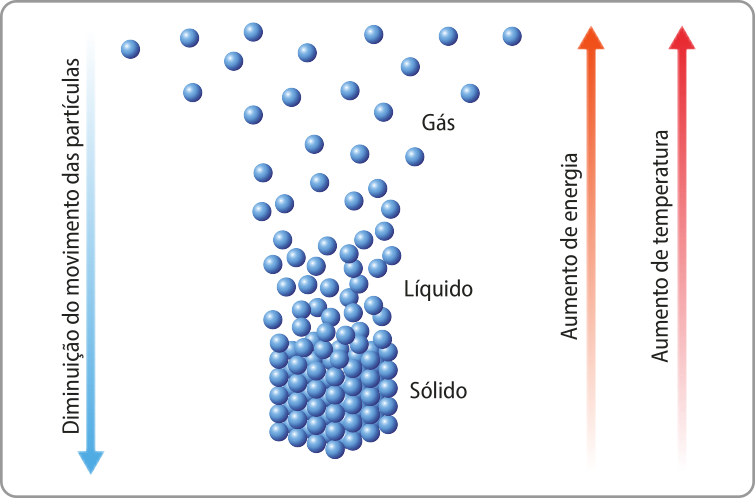
Os estados físicos da matéria são as diferentes formas em quê os materiais são encontrados. Existem quatro estados físicos fundamentais: sólido, líquido, gasoso e plasma. Apesar de o plasma representar aproximadamente 99% da matéria no Universo, para a Química, os estados sólido, líquido e gasoso são os mais importantes, já quê são os mais presentes na superfícíe da Terra.
REFLITA
2 Em quais situações do cotidiano você encontra materiais nos estados sólido, líquido e gasoso?
AlGO A+
O quê é plasma?
Plasma é o estado físico no qual a matéria não apresenta volume nem forma definida, mas não é gás, por possuir apenas partículas carregadas eletricamente, tornando-o bom condutor elétrico. O Sol e as estrelas são formados por matéria no estado plasma. Na Terra, também encontra-se plasma em raios, em alguns tipos de chama e até em alguns objetos, como lâmpadas de neônio ou de mercúrio e telas de Tevê.

Página quarenta e seis
A matéria se organiza em diferentes estados físicos em função das interações quê acontecem entre seus constituintes (átomos, moléculas etc.), da tempera-túra e da pressão.
Os sólidos têm forma bem definida e ocupam volumes fixos. Suas partículas não se móvem livremente (energia cinética baixa). Os líquidos têm volumes fixos, mas suas formas se adaptam para preencher os recipientes quê os contêm, pois suas partículas se movimentam com certa liberdade (energia cinética média). Já os gases não apresentam volume fixo nem forma definida, e suas partículas se movimentam livremente (energia cinética alta), ocupando todos os espaços disponíveis de maneira uniforme.
Mudanças de estado físico
Quando uma substância muda de estado físico (por exemplo, a á gua líquida se torna gelo), a natureza de suas partículas não se altera. O quê muda é a energia dessas partículas, manifesta por meio de seu grau de agitação, quê é menor no sólido, intermediário no líquido e maior no gasoso. Por isso, em situações de pressão constante, como a pressão atmosférica, é preciso fornecer energia às partículas ou removê-la para quê uma mudança de estado físico ocorra, por exemplo, por meio do aumento ou da redução da tempera-túra.
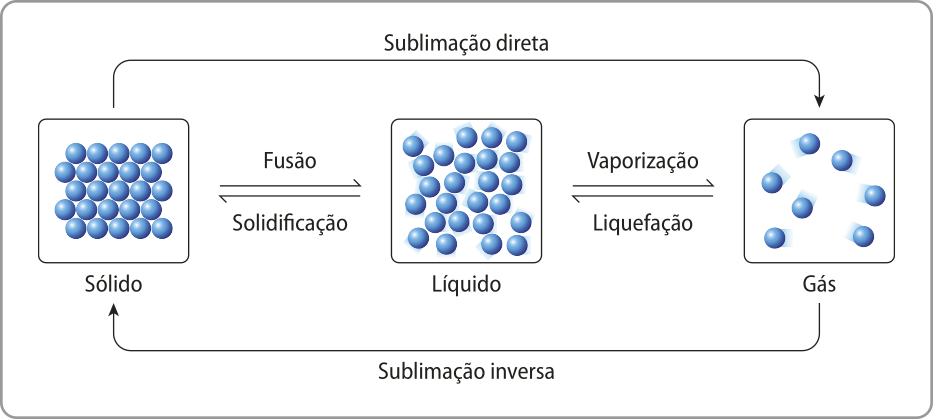
Vale reforçar quê essa é apenas uma representação didática, já quê não é possível visualizar hátomus ou moléculas de uma substância em um recipiente. Além díssu, vale destacar quê as mudanças de fase consistem em uma alteração significativa do nível de organização dos hátomus (inclusive na movimentação das partículas) e não somente no distanciamento entre eles.
Página quarenta e sete
Curva de aquecimento de substâncias
Uma curva de aquecimento indica como os processos de mudança de estado físico à pressão constante ocorrem em relação à variação da tempera-túra. Como as mudanças de estado físico estão relacionadas com as interações quê ocorrem entre as partículas e com as condições a quê estão submetidas, a uma pressão constante, cada substância mudará de estado físico a uma tempera-túra específica. A tempera-túra a qual uma substância passa do estado sólido para o líquido é chamada de tempera-túra de fusão, e a tempera-túra a qual uma substância passa do estado líquido para o gasoso é chamada de tempera-túra de ebulição. Cada substância tem uma tempera-túra de fusão e uma tempera-túra de ebulição, portanto elas podem sêr utilizadas para caracterizá-la.
Considere a á gua pura como exemplo: suas tempera-túras de fusão e de ebulição são constantes e não varíam durante os processos de mudança de estado. À pressão de 1 atm, a tempera-túra de fusão da á gua é 0 °C, e a tempera-túra de ebulição é 100 °C, de modo quê esses valores são características específicas da á gua e podem sêr utilizados para determinar se uma substância é ou não á gua.
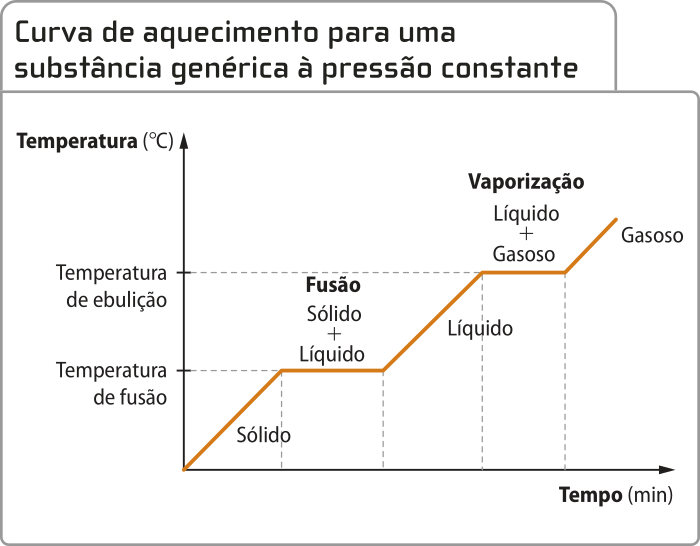
Curva de aquecimento de materiais
No caso de um material, as tempera-túras de fusão e de ebulição não se mantêm constantes durante o processo de mudança de estado físico.
Por causa díssu, a curva de aquecimento de um material será diferente da curva de aquecimento de uma substância, fato quê póde sêr utilizado para diferenciar materiais de substâncias.
Há alguns materiais quê, ao mudar do estado sólido para o líquido, comportam-se como se fossem substâncias, ou seja, fundem-se à tempera-túra constante. Eles são chamados de materiais eutéticos. Um exemplo dêêsse caso é a liga metálica formada por 63% de estanho e 37% de chumbo, quê é utilizada para fazer solda em equipamentos e circuitos elétricos.
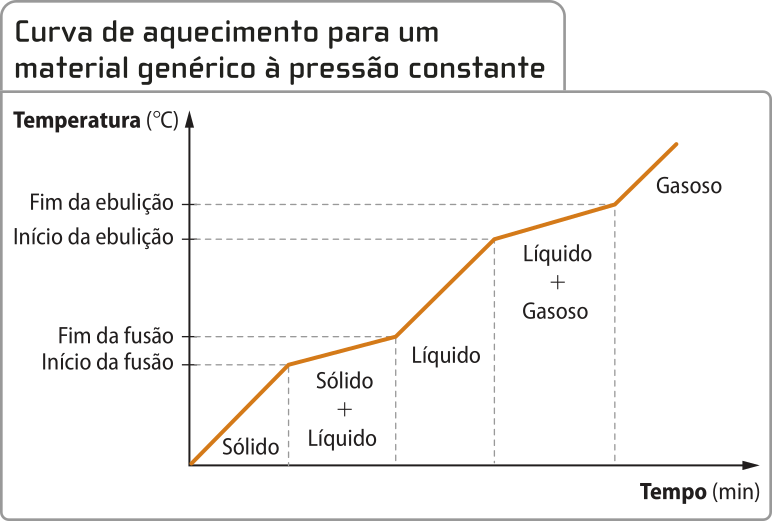

Página quarenta e oito
Há também materiais quê, ao mudar do estado líquido para o gasoso, comportam-se como se fossem substâncias, ou seja, vaporizam-se à tempera-túra constante. Eles são chamados de materiais azeotrópicos (a palavra azeótropo, de origem grega, significa “vaporização sem mudança”). O áucôl 96 °GL, material contendo 96% de áucôl etílico e 4% de á gua, é azeotrópico. Ele era tradicionalmente comercializado em garrafas de plástico para uso doméstico.

FORMAÇÃO CIDADÃ
Cuidados com o áucôl etílico
Leia os textos e responda às atividades.
Texto 1
O áucôl etílico ou etanol foi uma das primeiras substâncias orgânicas produzidas d fórma sistemática pela humanidade e, nos últimos séculos, passou a ter um papel de destaque no contrôle de infekições. As infekições constituem um problema de saúde pública mundial quê póde sêr minimizado pela adoção de medidas básicas de prevenção, como a higienização.

Texto 2
Desde 2002, a Agência Nacional de Vigilância Sanitária (Anvisa) proíbe a comercialização, para a população geral, de áucôl líquido com porcentagem de áucôl igual ou acima de 70% (também identificado como 70 °GL – graus Gay-Lussac, unidade de medida do grau alcoólico de materiais líquidos). O objetivo dessa proibição é impedir acidentes com os materiais, especialmente os de 96 °GL, quê são altamente inflamáveis. Utilizados para acender fogo, freqüentemente ocasionavam sérios acidentes, principalmente entre crianças. Outro problema era a possível ingestão acidental dêêsses materiais.
Hoje, esse tipo de áucôl só póde sêr comercializado em forma de gel, lenço impregnado ou aerossol, pois essas são opções mais seguras. A forma líquida póde se espalhar facilmente antes e durante a combustão, aumentando o risco de acidentes. Além díssu, o áucôl líquido é mais facilmente ingerido, o quê não ocorre com as demais formas.
Por um breve período durante a pandemia de covid-19, as vendas de áucôl 70 °GL foram liberadas em mercados e outros estabelecimentos, por causa da escassez momentânea de matéria-prima para a produção do áucôl em gel.

ATIVIDADES
1. Pesquise o uso do áucôl etílico na higienização e no contrôle de doenças e apresente os resultados para seus côlégas.
2. por quê o áucôl mais indicado para higienização tem graduação 70 °GL? por quê ele é mais indicado quê o áucôl 96 °GL, por exemplo? Realize uma pesquisa para responder.
Página quarenta e nove
Separando substâncias
As substâncias encontradas na natureza estão geralmente associadas umas às outras, na maioria das vezes, na forma de materiais, tanto homogêneos quanto heterogêneos. Assim, freqüentemente, torna-se necessário, nas residências ou nas indústrias, separar diferentes substâncias presentes nos materiais.
O açúcar consumido pelas pessoas, por exemplo, é extraído da cana-de-açúcar por meio de processos químicos e físicos de separação. O ouro é um raro exemplo de substância presente no ambiente natural, pois póde sêr encontrado na forma de pepítas (pedras de ouro puro). No entanto, essas pepítas normalmente estão misturadas a grandes quantidades de outros materiais, como o cascalho, sêndo necessário separá-las para se obtêr o ouro.
É provável quê o método de separação mais antigo seja a catação. Ela é empregada em muitas situações simples do cotidiano e é utilizada também, por exemplo, por outros primátas, para escolher grãos quê sérvem de alimento. A catação consiste em selecionar, utilizando as mãos ou alguma ferramenta como uma pinça, os materiais quê se deseja separar, de acôr-do com diferenças perceptíveis visualmente de tamãnho, formato, textura ou côr. Essa técnica é comumente usada no preparo de refeições, como na separação de feijão para eliminar grãos ruins ou outras partículas estranhas antes de cozinhá-lo.
A separação dos componentes de um material póde sêr realizada por diversas técnicas, considerando diferenças existentes entre uma ou mais propriedades físico-químicas dêêsses componentes.

REFLITA
3 No dia a dia, quê situações exigem quê você separe materiais?
Separação por diferença de tamãnho de partícula
Selecionar os materiais quê se deseja separar, um a um, como na catação, póde não sêr prático. Imagine: quantas pessoas seriam necessárias e quanto tempo se gastaria para remover todas as pedras da areia contida em um caminhão carregado? Em casos como esse, normalmente, a peneiração é utilizada. Também chamada de tamisação, essa técnica separa materiais mediante o uso de peneiras, quê podem sêr fabricadas de tecido, madeira, metal, plástico etc. Peneiras com espaços diferentes entre os fios de suas malhas podem sêr utilizadas em uma separação, obtendo-se frações com materiais formados por grãos ou partículas de diferentes diâmetros.

Página cinquenta
Uma maneira de realizar a separação de materiais quê contêm sólidos e líquidos ou sólidos e gases é a fiutrassão, quê ocorre segundo o mesmo princípio da peneiração, mas por meio do uso de filtros em vez de peneiras. A separação ocorre pela diferença de tamãnho das partículas: as maiores do quê os póros do filtro ficam retidas e as menóres o atravessam.
Os filtros podem sêr de papel, como os utilizados para preparar café, de cerâmica, como os usados nas velas de filtros de á gua, de algum polímero ou de outros materiais porosos.
Às vezes, as partículas sólidas são tão pequenas quê dificultam o processo de separação, tornando-o muito lento. Para aumentar sua rapidez, pode-se realizar uma fiutrassão a vácuo ou fiutrassão à pressão reduzida, fazendo uso de um mecanismo (bomba ou trompa de vácuo) quê suga o ar de dentro do recipiente quê côléta o líquido, denominado kitassato. A baixa pressão criada dentro do kitassato acelera a passagem do líquido pelo filtro, tornando o processo mais veloz.


AlGO A+
Filtros de ar
Os filtros também são utilizados para separar sólidos de gases em diferentes aplicações. Uma delas é a fiutrassão dos gases quê entram nos motores à combustão de automóveis e saem de seus escapamentos. A troca regular dos filtros de ar dos veículos garante a entrada de ar limpo no motor, prolongando sua vida útil, além de favorecer a economia de combustível e a liberação de ar mais limpo pelo escapamento, reduzindo a emissão de poluentes na atmosféra.

Página cinquenta e um
Separação por diferença de densidade
Alguns materiais formados por componentes sólidos podem sêr separados de acôr-do com a densidade dêêsses componentes. Nesse caso, pode-se utilizar o método da ventilação, o qual, por meio de um fluxo de ar aplicado ao material, carrega os componentes de menor densidade, afastando-os dos componentes de maior densidade, quê ficam retidos.
A ventilação é empregada, por exemplo, para separar grãos de arrôz de suas cascas. Outros exemplos envolvem o uso de câmaras de poeira, ou chicanas, quê funcionam como um túnel com vários obstáculos quê dificultam a passagem dos materiais mais densos, retendo-os.
Já a flotação é uma técnica baseada na flutuação, quê tem como princípio a utilização de um líquido ou, em alguns casos, de bolhas de ar para separar componentes de densidades diferentes. Para separar bó-linhas de cortiça de pedras, por exemplo, pode-se adicionar á gua ao material, fazendo com quê apenas a cortiça flutue e possa sêr separada da á gua por outro método, como a catação ou a peneiração.
Essa técnica é muito comum em processos de tratamento de á gua, quê, com o auxílio de microbolhas de ar, utilizam a flotação para mover à superfícíe impurezas presentes na á gua.

Quando o componente desejado é o mais denso e afunda na á gua, é possível utilizar o processo chamado de levigação. Esse método emprega um fluxo de líquido para carregar o componente menos denso, enquanto o mais denso fica retido no recipiente utilizado. É assim quê garimpeiros separam metais preciosos, como ouro, de outras impurezas.

Página cinquenta e dois
Outro processo fundamentado nas diferenças entre as densidades dos componentes de um material heterogêneo é a decantação.
Ela póde sêr observada em águas cristalinas de um rio ou de um lago em quê o fundo póde sêr visualizado. Ao mexer o sedimento depositado no fundo, suspendendo-o, a á gua fica turva. No entanto, com o tempo, as partículas se depositam até quê a á gua fique límpida novamente. É o mesmo quê acontece quando ondas se quebram na praia, e a á gua se mistura com a areia. Quando a onda volta ao mar, á gua e areia separam-se novamente. Esses exemplos demonstram um aspecto importante da decantação: normalmente é preciso esperar cérto tempo até quê as fases dos materiais se separem.

A decantação também póde sêr utilizada para separar líquidos imiscíveis, como óleo de cuzinha e á gua. Nesse caso, pode-se realizar a decantação com o auxílio da técnica da sifonação ou de um instrumento conhecido como funil de separação (ou funil de decantação).
Na sifonação, uma das extremidades de um tubo ou de uma mangueira é mergulhada no líquido quê se deseja remover do material heterogêneo; a outra extremidade é colocada em um recipiente em uma posição mais baixa quê o recipiente contendo o material. Desse modo, o líquido póde sêr sifonado pela criação de um fluxo de líquido. O mesmo processo também póde sêr usado para separar um material heterogêneo constituído de líquidos e sólidos.
Em procedimentos laboratoriais, é muito comum o emprego de funil de separação, um balão de vidro quê possui uma torneira em sua parte inferior. Ao abrir a torneira cuidadosamente, o líquido inferior, de maior densidade, escoa e póde sêr coletado.
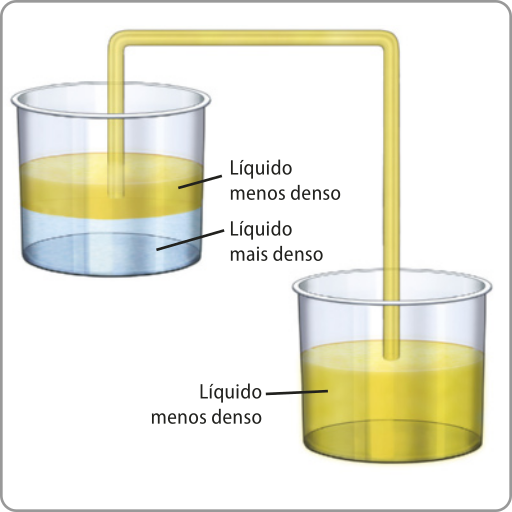

Em muitos casos, a decantação de componentes mais densos dos materiais ocorre muito lentamente. Para acelerar o processo, pode-se utilizar a centrifugação. Na centrífuga, tubos contendo os materiais giram rapidamente em torno de um eixo, e as partículas mais densas se acumulam no fundo.
Página cinquenta e três
Separação por diferença de tempera-túra de mudança de estado físico
Um material formado por á gua e sal é homogêneo e, portanto, não póde sêr separádo por fiutrassão ou decantação, como uma combinação de á gua e areia.
Uma maneira de separar um material homogêneo compôzto de dois componentes, um sólido e outro líquido, é por meio da evaporação do líquido, quê tem menor tempera-túra de ebulição. A evaporação é um processo gradual quê ocorre a pressão e tempera-túra ambientes e se baseia na diferença entre as taxas com quê os componentes do material passam do estado líquido para o gasoso. Essa técnica é a mesma utilizada nas salinas para extrair sal da á gua do mar, em quê a radiação solar e o vento favorécem a evaporação da á gua e a cristalização do sal.

Quando o principal interêsse está no componente líquido e não no sólido ou quando se quer obtêr ambos, pode-se utilizar a destilação simples. Esse método de separação envolve aquecimento do material em um recipiente até quê o componente líquido (que póde sêr á gua ou outro solvente) atinja a tempera-túra de ebulição e passe para o estado gasoso, restando o sólido depositado no fundo do recipiente. O componente no estado gasoso atravessa um aparato chamado de condensador, quê o resfria e o torna novamente líquido. êste é coletado em outro recipiente, geralmente um érlên-máier.
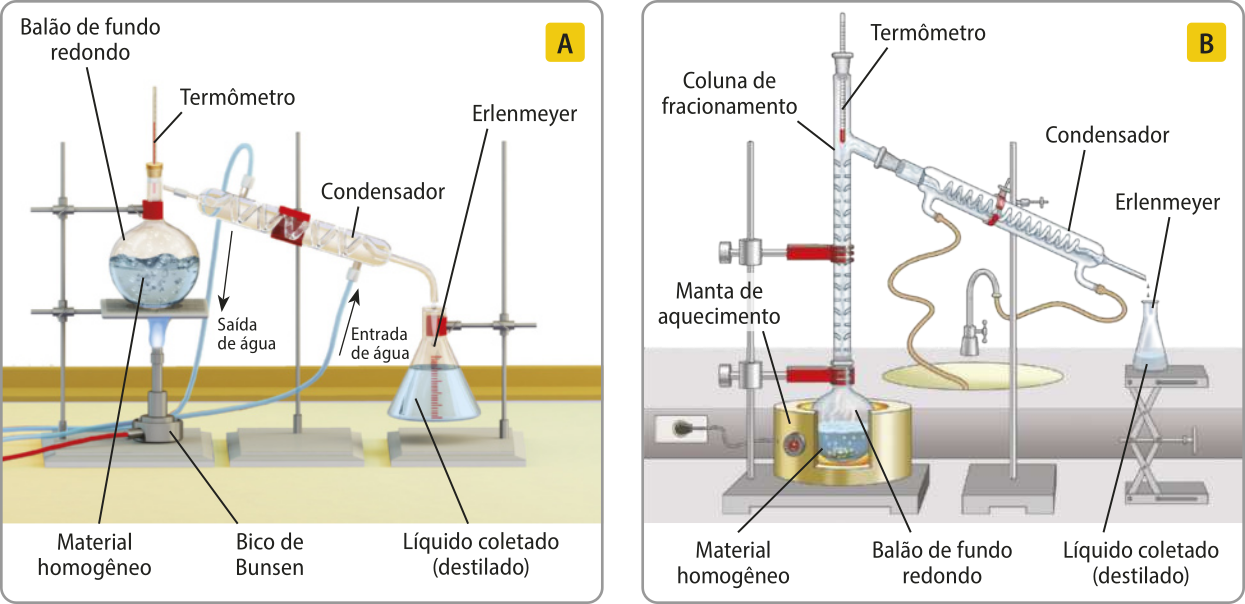
Página cinquenta e quatro
Para separar um material formado por componentes líquidos com tempera-túras de ebulição muito próximas, é possível utilizar a destilação fracionada, na qual é usada uma coluna de fracionamento. Essa coluna é equipada com obstáculos quê criam um gradiente de tempera-túra, ou seja, uma variação de tempera-túra ao longo da altura da coluna (mais kemte na base e mais fria na saída para o condensador). Dessa forma, os componentes com menóres tempera-túras de ebulição chegam à saída para o condensador mais rapidamente, onde se condensam e são coletados em outro recipiente.
A destilação é muito importante nos laboratórios e nas indústrias químicas. No laboratório, uma das aplicações é a purificação da á gua utilizada em experimentos, pois a á gua da torneira possui substâncias dissolvidas quê podem interferir nos resultados. Na indústria, um exemplo do uso da destilação é a separação das diversas frações do petróleo cru. A destilação fracionada do petróleo envolve o aquecimento do material em uma fornalha até quê gases se formem e passem por uma torre de fracionamento. Como no caso da coluna de fracionamento, a torre tem um gradiente de tempera-túra, ou seja, uma variação de tempera-túra ao longo de sua altura: tempera-túras mais altas em sua base e menóres nas partes superiores. Assim, as frações do petróleo, como o dízel e a gasolina, ficam na forma de gás até a altura da torre em quê atingem sua tempera-túra de condensação, retornando à forma líquida e sêndo coletadas separadamente.
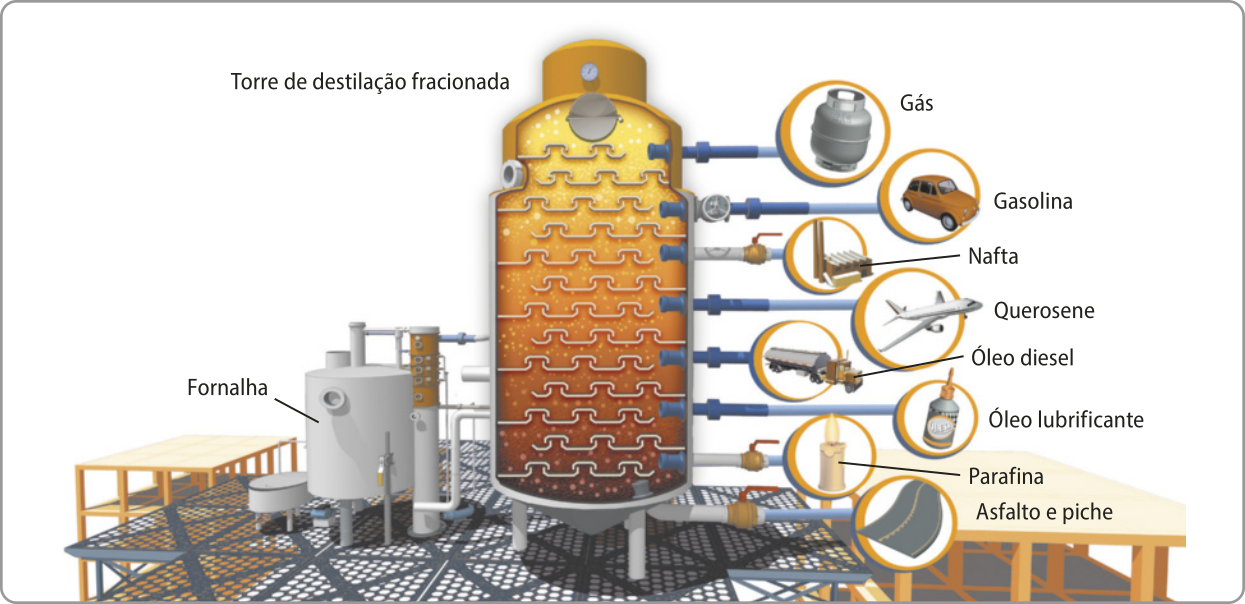
Separação por diferença de solubilidade
Como estudado, um material homogêneo póde sêr denominado solução. Em uma solução, chama-se solvente o líquido em maior quantidade e soluto a substância dissolvida, quê póde sêr um sólido, um líquido ou um gás. Foi citado o termo solução para descrever o material formado por á gua e sal (cloreto de sódio).
A capacidade de um solvente de dissolver um soluto depende das interações entre as substâncias. Por isso, é possível se aproveitar das diferenças de solubilidade entre materiais para separá-los, utilizando a dissolução fracionada. Nesse contexto, pode-se entender o significado de “diferenças de solubilidade”
Página cinquenta e cinco
em termos de homogeneidade e heterogeneidade dos materiais. Por exemplo, ao se adicionar á gua a uma combinação de areia e sal e agitar bem o sistema, o sal formará uma fase homogênea com a á gua, mas a areia continuará separada em outra fase. Na sequência, métodos de separação como a decantação e a destilação podem sêr utilizados para separar completamente cada componente do sistema inicial.
Se os componentes a serem separados formarem um material homogêneo com um determinado líquido, pode-se utilizar um método parecido com a dissolução fracionada denominado extração. Nesse caso, utiliza-se um líquido quê promove a passagem dos materiais a serem obtidos de uma fase para a outra. É o quê ocorre na preparação de café, na qual substâncias solúveis em á gua são extraídas do pó de café, quê continua no coador. O mesmo acontece quando se prepara um chá. A adição de á gua kemte às fô-lhas frescas de alguma planta ou às fô-lhas desidratadas em um saquinho resulta em uma solução chamada de chá.

Técnicas avançadas de separação de substâncias
Nos laboratórios de Química, separar substâncias de materiais póde sêr algo simples ou um grande desafio. Por isso, ao longo do tempo, foram desenvolvidas inúmeras técnicas avançadas de separação, quê normalmente se baseiam em mais de uma propriedade dos materiais. Na diálise, por exemplo, os componentes são separados de acôr-do com a solubilidade e o tamãnho das partículas. Um caso dêêsses é a hemodiálise, um processo artificial de fiutrassão do sangue necessário quando os rins de uma pessoa não funcionam adequadamente. O aparelho sérve como um rim artificial quê, usado periodicamente, melhora a saúde do paciente.
Já na eletroforese, os componentes são separados com base no tamãnho das partículas e em suas propriedades elétricas, utilizando um instrumento quê aplica uma corrente elétrica no sistema. A eletroforese é muito usada na separação de proteínas em análises clínicas.
A cromatografia é o método de separação quê se baseia na diferença de intensidade das interações entre as substâncias de um material e as duas fases do sistema cromatográfico: a fase móvel, constituída por um fluido, quê póde sêr líquido ou gasoso; e a fase estacionária, constituída de outro material líquido ou sólido. A mais simples é a cromatografia em papel, quê póde sêr feita de modo artesanal.



Página cinquenta e seis
A liofilização é um processo utilizado para retirar a á gua de materiais sólidos, a baixas tempera-túras, mantendo sua estrutura. Esse processo é muito empregado como técnica de conservação de alimentos, por exemplo, na preservação da comida quê os astronautas levam em missões espaciais, ou como técnica de preparo de cértas receitas. A retirada da á gua pelo processo de liofilização reduz a proliferação de microrganismos, aumentando o tempo de vida útil do alimento.

ATIVIDADES
1. Analise os gráficos a seguir e indique qual representa o aquecimento de um material comum, o de um material eutético e o de um material azeotrópico.
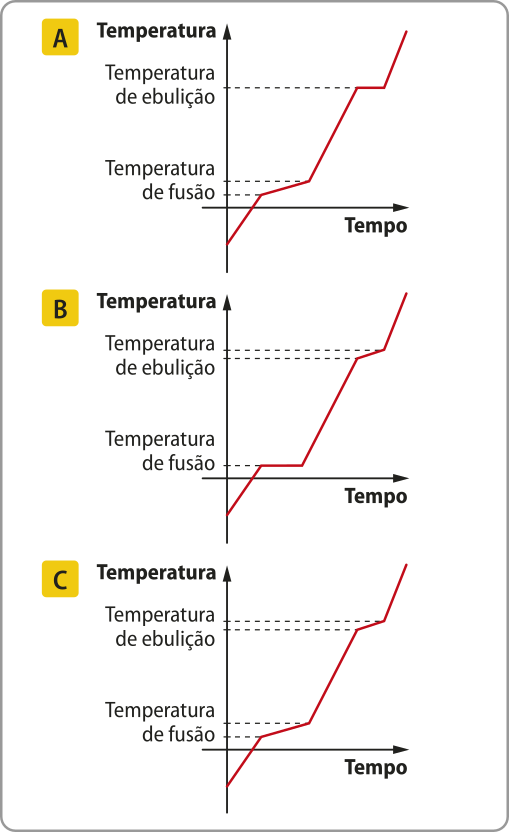
2. Realize uma pesquisa e responda às kestões.
a) por quê não se deve beber á gua destilada?
b) por quê não se utiliza á gua mineral, própria para beber, em laboratórios de Química, e sim á gua destilada?
c) O quê diferencia uma da outra?
3. Descubra onde é captada a á gua quê você recebe para consumo em seu bairro e como ela é tratada. Se possível, em grupo, peçam ao professor quê agende uma visita à estação de captação e tratamento de á gua quê abastece a região onde vocês moram.
4. Considere quê você tem à sua disposição os seguintes materiais: á gua, áucôl etílico, óleo de soja e sal de cuzinha. Você deve combinar dois dêêsses materiais e escrever quais combinações geram materiais homogêneos e quais combinações geram materiais heterogêneos.
5. A á gua póde sêr encontrada em praticamente todos os lugares do planêta, em oceanos, mares, lagos, rios e lençóis fre-átikos. póde sêr encontrada na atmosféra terrestre e nas geleiras e calótas polares. Relacione o estado físico da á gua com o local onde ela póde sêr encontrada.
6. Ao longo do dia, você tem contato com diversas substâncias e materiais. Indique algumas dessas substâncias e o seu respectivo estado físico.
7. Você já deve ter estudado o ciclo da á gua, processo em quê a á gua muda de estado físico gerando alguns fenômenos meteorológicos conhecidos, como a chuva. dêz-creva como ocorre o ciclo da á gua, nomeando as mudanças de estados físicos.
8. Indique qual processo de separação de substâncias você utilizaria para as situações apresentadas a seguir.
I. Remover a gordura presente no leite para obtêr o leite desnatado.
II. Separar sólidos com tamanhos distintos.
III. Separar um sólido insolúvel de um líquido.
IV. Separar um sólido solúvel de um líquido.
Página cinquenta e sete
TEMA
5
Transformações da matéria
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
A natureza é dinâmica e repleta de fenômenos naturais. Em muitos dêêsses fenômenos, é possível observar uma porção de matéria se alterando e se tornando uma matéria distinta, com propriedades diferentes. Já em outros fenômenos, observam-se transformações sem, no entanto, havêer formação de uma matéria distinta.
Como exemplo de fenômenos naturais quê envolvem transformações da natureza da matéria, pode-se citar a fotossíntese, processo químico realizado por plantas, algas e algumas bactérias, em quê a energia luminosa do Sol é utilizada para converter dióxido de carbono e á gua em glicose e gás oxigênio.
Já o ciclo da á gua póde sêr citado como um fenômeno natural em quê a matéria não muda de natureza. Nesse ciclo, a á gua passa por diferentes estados físicos – sólido (gêlo), líquido (á gua) e gasoso (vapor de á gua) – por meio de processos como fusão, evaporação e condensação. A água líquida nos oceanos, rios e lagos ABSÓRVE energia solar e se transforma em vapor de á gua, quê sobe para a atmosféra, onde se resfria e se condensa, formando nuvens (água em estado líquido ou sólido, no caso de cristais de gelo). Quando as gotículas de á gua nas nuvens se juntam e crescem, elas caem de volta à Terra como chuva, néve ou granizo.
Neste Tema, serão apresentadas as transformações físicas e químicas da matéria, com ênfase na segunda.
SOBRE
Um fenômeno é qualquer evento ou ocorrência observável quê se manifesta no mundo natural ou no contexto humano. O termo é derivado da palavra grega phainomenon, quê significa “observável”. Precipitação na Floresta Amazônica e no Rio Juruá. Reserva Extrativista do Médio Juruá, Carauari (AM), 2022.

Página cinquenta e oito
Transformações físicas e químicas
REFLITA
1 Para você, o quê significa a palavra transformar?
2 O quê acontece com os materiais quê se transformam?
Estimular as respostas apresentando alguns questionamentos: um copo inteiro é feito de qual material? Quando um copo se quebra, ele deixa de sêr feito de vidro? Pode-se iniciar aqui o estímulo às evidências de uma transformação química, como a mudança de côr no processo de fritar um ovo.
Nas imagens a seguir, é possível identificar quê algumas transformações ocorreram. Você saberia dizêr quais? Os materiais são os mesmos antes e depois dêêsses processos?

O copo de vidro se transformou em pedaços menóres quando se quebrou, mas o material (vidro) continua o mesmo. Nesse caso, pode-se dizêr quê ocorreu uma transformação física, pois não houve formação de novas substâncias. A composição da matéria é a mesma, antes e depois do fenômeno.
Há muitos outros fenômenos físicos presentes no dia a dia das pessoas. São exemplos a eletricidade quê circula na rê-de elétrica das residências, uma lâmpada acesa emitindo luz, o funcionamento do motor de um liquidificador, o som quê sai do rádio, entre outros.
Já os componentes presentes no ovo são alterados quando ele é frito, em razão do calor da frigideira. Há mudança perceptível na aparência, na textura e no sabor do ovo, antes e depois da fritura, porque são formadas novas substâncias. Dessa forma, pode-se dizêr quê houve uma transformação química.
Há também muitos outros fenômenos químicos presentes no cotidiano das pessoas. Em um café da manhã, saboreiam-se diversos alimentos sem a necessidade de transformá-los quimicamente. No entanto, antes de chegarem à mesa, eles passam por muitas transformações químicas. No preparo do pão, a massa é fermentada e, depois, assada. Para obtêr a manteiga e o queijo, são executados vários processos, tendo o leite como principal ingrediente. O aquecimento da á gua para o preparo do café póde sêr feito sobre a chama resultante da queima do gás de cuzinha, uma transformação química.

Página cinquenta e nove
Como mencionado anteriormente, a Química é a Ciência quê estuda as substâncias, os materiais e suas transformações e, por essa razão, tem proporcionado à humanidade um domínio dos fenômenos químicos.
Esse domínio não começou com o estabelecimento dessa Ciência da Natureza, ele vêm sêndo construído ao longo dos séculos pelo sêr humano, quê, por causa do interêsse em entender a matéria, desenvolvê-u técnicas para transformá-la. No entanto, a Química, desde sua criação, tem acelerado o entendimento sobre a transformação da natureza. Dessa forma, é importante quê sêjam promovidas maneiras mais responsáveis e sustentáveis de lidar com os desafios atuáis, como a produção de energia, de novos materiais e de tecnologias.
AlGO A+
A Ciência para a qualidade do café
O café de origem brasileira é apreciado mundialmente e se destaca por sua boa qualidade. Não à toa, o país é um dos maiores exportadores do setor. Segundo relatório de 2024, indicado na fonte do gráfico sobre a exportação brasileira de café, cerca de 105 países compram o café do Brasil, cuja produção atingiu mais de 43,7 milhões de sacas no ano-cafeeiro de 2023-2024. Dessas, 92,3% correspondem a sacas do grão cru (dos tipos arábica e robusta) e 7,7% correspondem a café industrializado (solúvel, torrado e moído).
Fonte: CONSELHO DOS EXPORTADORES DE CAFÉ DO BRASIL. Relatório mensal: maio 2024. [São Paulo]: Cecafé, 2024. p. 10. Disponível em: https://livro.pw/ukokh. Acesso em: 2 set. 2024.
A qualidade do café está diretamente relacionada às transformações físicas e químicas quê ocorrem nas etapas de cultivo, beneficiamento e industrialização dos grãos. Dependendo das condições em quê ocorrem, essas transformações conferem acidez, coloração e aroma diferentes ao produto, gerando uma variedade de tipos.
A instrução normativa n º 8, de 11 de julho de 2003, legisla sobre a qualidade do café cru (café verde). Já a portaria número 570, de 9 de maio de 2022, é o instrumento legal quê estabelece o padrão oficial de classificação do café torrado.

Página sessenta
Indústria química e sustentabilidade
A indústria química é o setor econômico dedicado à produção e à transformação de substâncias químicas. Ela abrange desde a fabricação de produtos químicos básicos, como ácidos e amônia, até fertilizantes, plásticos e produtos farmacêuticos. Utiliza processos químicos e tecnológicos para converter matérias-primas em produtos acabados ou semiacabados, desempenhando um papel fundamental no cotidiano das pessoas e em diversas áreas da economia.
Pode-se afirmar quê, atualmente, é muito comum usar produtos fabricados pela indústria química ou por indústrias quê utilizam insumos fornecidos pela indústria química.
Em 2022, a indústria química global movimentou aproximadamente 5 trilhões de dólares, valor quê reflete a magnitude e o impacto do setor na economia mundial. No Brasil, uma das maiores economias do mundo, a indústria química tem grande relevância e, em 2022, movimentou 120 bilhões de euros, de acôr-do com The European Chemical Industry Council (“Conselho da Indústria Química Europeia”, em tradução livre).
Por estar tão presente na ssossiedade e não se isentar das discussões a respeito do ambiente e de sua preservação, a indústria química tem buscado mais eficiência, reduzindo o uso de energia e ampliando o tratamento de rejeitos.
No entanto, seu impacto ambiental segue sêndo uma preocupação. Para avançar na sustentabilidade, é fundamental quê continue adotando práticas quê reduzam a emissão de poluentes e o desperdício de recursos. Isso inclui a implementação de tecnologias mais limpas, o desenvolvimento de processos químicos mais eficientes e a utilização de matérias-primas rêno-váveis. Além díssu, precisa investir em reciclagem, promovendo uma economia circular quê minimiza o impacto ambiental. Ao adotar essas práticas, a indústria química póde contribuir significativamente para a preservação ambiental e o desenvolvimento sustentável, equilibrando suas atividades produtivas com a responsabilidade ecológica.
ESPAÇOS DE APRENDIZAGEM
• Texto quê discute kestões sobre a cidade de Cubatão (SP), quê já foi considerada a mais poluída do mundo pela Organização das Nações Unidas (Ônu).
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO. Cubatão comemora quatro dékâdâs de Vale com vida. São Paulo: cetésbi, 2024. Disponível em: https://livro.pw/cnrob. Acesso em: 1 set. 2024.
Página sessenta e um
FORMAÇÃO CIDADÃ
A Química para uma economia global sustentável
O Fórum Econômico Mundial (FEM) é uma organização internacional quê promove um encontro anual em Davos (Suíça), cujo objetivo é facilitar iniciativas de cooperação entre os setores público e privádo. Nesses encontros, pessoas influentes, como empresários, ativistas, figuras políticas e outras personalidades, discutem kestões relevantes para o desenvolvimento socioeconômico mundial.
Em 2020, um dos centros de pesquisa associados ao FEM divulgou um relatório, apresentando alguns dos setores econômicos considerados estratégicos para o desenvolvimento de uma economia global sustentável.
Sobre esse relatório, leia o trecho a seguir.
[...] O estudo dividiu esses setores em conservação do planêta, capacitação e proteção de pessoas e avanço do conhecimento. A expectativa é quê eles possam mudar a forma de consumo e a relação quê temos com o meio ambiente e com os negócios, desde quê sêjam desenvolvidos por meio de uma agenda comprometida com inovação, tecnologia e transformação socioinstitucional.
[…]
Além do apôio governamental […] se faz necessário o envolvimento de todos os agentes e estruturas da ssossiedade – indivíduos, organizações, ciências, tecnologias e regras de mercado e órgãos reguladores.
ANDRADE, Juliana; AGUIAR, Sofia. 20 setores quê transformarão a economia global no pós-pandemia. Forbes, [São Paulo], 23 out. 2020. Disponível em: https://livro.pw/rktvh. Acesso em: 1 set. 2024.

Página sessenta e dois
Dos 20 setores selecionados pelo FEM, 13 estão diretamente ligados a conhecimentos produzidos pelas Ciências da Natureza:
• Veículos elétricos.
• Licença para emissão de gases.
• Hidrogênio combustível.
• Reciclagem de plástico.
• Serviços de reflorestamento.
• Monitoramento e qualidade da á gua.
• Genes e sequências de dê ene há.
• Serviços de satélite.
• Voos espaciais.
• Antivirais de amplo espectro.
• Transporte de alta velocidade quê utiliza cápsulas movendo-se em tubos quase a vácuo.
• Novos antibióticos.
• Medicina de precisão e medicamentos órfãos.
Muitos dêêsses setores se baseiam em conceitos de Química ou têm grande relação com eles. Assim, pode-se dizêr quê os conhecimentos nessa área são fundamentais para um futuro sustentável.
ATIVIDADES
Formem um grupo com dois ou três côlégas e, com base nas informações apresentadas, respondam às kestões.
1. Vocês conhecem algum dos termos da lista de setores apresentada ou já se depararam com algum deles? Qual(is)? Conversem e tentem explicar um para o outro o quê entendem sobre eles.
2. Escolham três setores da lista quê considerem mais interessantes. Façam uma breve pesquisa sobre eles para responder às kestões a seguir.
a) Os setores escolhidos contribuem para a resolução de problemas da ssossiedade atual? Qual(is)?
b) Eles facilitam a vida diária de uma população? De quê maneira?
c) Esses setores afetam o ambiente e/ou a saúde das pessoas? Como?
d) Que tipo de matéria-prima e/ou tecnologias esses setores utilizam?
e) Que tipo de profissionais trabalham nesses setores?
f) No Brasil, existem iniciativas (empresas, institutos, centros de pesquisa, organizações etc.) envolvidas nesses setores? E no mundo?
g) Quais são os desafios mais relevantes enfrentados pêlos setores?
3. Com base nas informações coletadas na pesquisa, decidam se esses setores merécem receber investimentos. Em seguida, produzam um material justificando a escolha do grupo e apresentem-no à turma.

Página sessenta e três
Reação química e reatividade
REFLITA
3 Faça um levantamento de tudo o quê você observou desde quê saiu de sua residência até chegar à escola. Apresente algumas situações nas quais você considera quê ocorreram reações químicas.
Como estudado, transformações químicas são aquelas em quê uma porção de matéria passa por mudanças e se torna uma matéria distinta, com propriedades diferentes. Esse tipo de transformação também recebe o nome de reação química.
Com base nesse conceito, define-se reatividade como a tendência dos materiais de reagirem entre si.
Os objetos de ferro, na presença de á gua e gás oxigênio (umidade e ar), caso não tênham alguma proteção, vão se degradando aos poucos, formando fêrrugem. Já o vidro utilizado para a fabricação de diversos objetos se conserva por muito tempo, se for bem cuidado.
Assim, pode-se dizêr quê há reatividade entre ferro e gás oxigênio, mas quê não há reatividade entre vidro e gás oxigênio. As substâncias ou os materiais quê não reagem entre si são chamados de hí-nértis.

Página sessenta e quatro
Em laboratórios, é importante tomar cuidado ao misturar reagentes químicos, pois o contato entre substâncias reativas, sem os devidos cuidados, póde ocasionar acidentes graves. O potássio metálico, por exemplo, reage intensamente com a á gua, produzindo gás hidrogênio e calor, e póde ocasionar explosões. Para evitar reações indesejadas, essa substância é comumente armazenada imérsa em quêrosene, que não se mistura com a á gua.

A reatividade de substâncias e materiais varia bastante. Enquanto o gás nitrogênio presente no ar é considerado inerte e não reage com os materiais comuns do cotidiano, outros reagem rapidamente, como o gás de cuzinha em contato com o ar: basta uma chama ou uma faísca para iniciar a reação. De modo geral, motoristas sabem quê devem tomar cuidado com o líquido presente nas baterias dos automóveis, pois ele reage com o tecido das roupas e partes do corpo, podendo causar quêimaduras graves. Por conhecerem a reatividade do ferro, ou seja, por saberem que o ferro enferruja, as pessoas costumam pintar objetos feitos dêêsse material com tintas quê o isolam do contato com o ar e a umidade, aumentando sua vida útil.
Assim, conhecer a reatividade de substâncias e materiais é importante não só para cientistas mas também para qualquer pessoa.
É importante frisar quê reatividade é um conceito relativo. Deve-se sempre falar quê uma substância é reativa em relação à outra. Como estudado, o potássio reage rapidamente com a á gua, mas não com o querosene. No entanto, o querosene queima com facilidade, ou seja, reage com gás oxigênio na presença de uma chama ou uma faísca.
Equações químicas
À medida quê a Química foi se formalizando como área de conhecimento, a necessidade de padronização das diversas representações aumentou. A contribuição de cientistas de diferentes nacionalidades, entre eles o já mencionado químico francês Ântoeni-Lorran de Lavoisiê, permitiu o desenvolvimento e o aperfeiçoamento de uma linguagem específica.
As chamadas equações químicas constituem parte fundamental da linguagem química. Por meio delas, pode-se representar o quê acontece em uma transformação química, sem precisar recorrer a palavras de determinado idioma.
Página sessenta e cinco
Por exemplo, é possível descrever o quê acontece em uma fogueira ao dizêr quê a madeira reage com o ar, produzindo cinzas e gases e liberando calor. Uma outra maneira de dizêr isso seria por meio da representação a seguir.
madeira + ar → cinzas + gases (calor)
Nessa representação, pode-se dividir os materiais envolvidos em dois grupos: aqueles à esquerda da seta são chamados de reagentes e aqueles à direita são os produtos. A seta indica o sentido da reação. No entanto, trata-se de uma representação incompleta, pois faltam as fórmulas químicas, outra parte fundamental da linguagem química. Nesse caso, não se póde representar a madeira e as cinzas por fórmulas químicas, pois elas são compostas de diversas substâncias.
Considerando quê grande parte da madeira é formada por celulose e quê o componente do ar quê reage com a celulose é o gás oxigênio, substâncias quê têm fórmulas químicas, pode-se representar essa reação, desconsiderando o produto cinzas, da maneira a seguir.
(C6H10O5)(s) + 6 O2(g) → 6 CO2 (g) + 5 H2O(v)
Ao lado direito da fórmula de cada substância, normalmente, inclui-se entre parênteses seu estado físico: sólido (s), líquido ((éli)") e gasoso (g) ou vapor (v). Quando uma substância está dissolvida em á gua, utiliza-se (aq), abreviação quê indica uma solução aquosa.
Outras informações, como as lêtras e os números quê compõem as fórmulas e os números quê precedem as fórmulas, serão abordadas ao longo dêste livro.
ATIVIDADES
1. Pense no quê ocorre no seu corpo quando você se alimenta, respira, exercita-se, machuca-se, toma sól etc. Pense também nos meios de transporte quê utiliza, nas atividades quê faz durante o lazer e nos fenômenos naturais típicos de cada época do ano.
Reflita sobre as transformações (físicas e/ou químicas) quê acontecem durante esses momentos do dia a dia e escolha três delas para responder aos itens a seguir.
a) No caderno, escrêeva por extenso, o quê acontece com a matéria nessas transformações. Em seguida, faça uma representação quê corresponda a essa descrição, utilizando elemêntos de reações químicas. Caso não saiba a representação correta ou não tenha certeza sobre ela, crie símbolos e/ou siglas quê você julgue adequados.
b) Em um grupo com dois ou mais côlégas, compartilhem as respostas do item anterior, explicando suas escôlhas para as representações das transformações.
c) Ainda em grupo, façam uma análise para decidir se uma pessoa quê não leu a descrição por extenso seria capaz de entender a transformação. Utilizem essa discussão para desenvolver uma linguagem única do grupo, isto é, um conjunto de elemêntos capazes de representar todas as transformações listadas no item a. Em seguida, reescrevam, no caderno, as reações utilizando essa linguagem.
d) Selecionem uma transformação reescrita no item anterior e compartilhem-na com os demais grupos. Tentem identificar as transformações representadas pêlos outros grupos.
2. Quando uma fruta apodrece, trata-se de um fenômeno físico ou químico? Justifique sua resposta.
3. A chuva e a formação de geleiras são fenômenos naturais quê ocorrem com base em fenômenos físicos ou químicos? Justifique sua resposta.
Página sessenta e seis
TEMA
6
Leis ponderais
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Ântoeni-Lorran de Lavoisiê escreveu, em 1789, o seguinte trecho.
Não devemos confiar em nada além de fatos: estes são apresentados a nós pela natureza e não podem enganar. Em todos os casos, devemos submeter nosso raciocínio à próva do experimento e nunca procurar a verdade a não sêr pelo caminho natural do experimento e da observação.
LAVOISIER, Ântoeni-Lorran de. Elements ÓF chemistry, in a new systematic order, containing all the modern discoveries. [S. l.]: The Prôjéct Gutenberg, 2009. p. xviii. E-book. Tradução nossa. Disponível em: https://livro.pw/sbgpa. Acesso em: 2 set. 2024.
A busca por uma compreensão mais sistematizada das transformações químicas, fazendo uso de explicações quê vão além de ideias filosóficas e se baseiam em fenômenos mensuráveis, resultou na formulação das chamadas leis ponderais.
Essas leis fundamentais para o estabelecimento da Química como uma Ciência Moderna são fruto do trabalho de muitos cientistas, mediante uma série de experimentos, observações e estudos, mas acabaram sêndo associadas historicamente a alguns deles e foram “apelidadas” com seus nomes.
Um movimento quê contribuiu para essa busca foi o iluminismo, quê ampliou o saber científico em diversas áreas do conhecimento. O princípio central do iluminismo era a valorização da razão, e sua relevância se manifesta no fato de quê, mesmo séculos depois, suas influências ainda podem sêr observadas em várias instituições. No Brasil, uma dessas influências se apresenta na divisão do pôdêr público em três esferas interdependentes, o Executivo, o Legislativo e o Judiciário – um conceito introduzido pelo político, filósofo e escritor francês Charles-Louis de Secondat (1689-1755), mais conhecido como Montesquieu. No campo das Ciências da Natureza, o pensamento iluminista baseava-se na observação de fenômenos e na prática experimental voltada para a compreensão das leis naturais, o quê contribuiu para afastar cientistas do misticismo comum entre alquimistas.
Neste Tema, serão apresentadas as leis ponderais e o quê cada uma significa, bem como o contexto em quê viviam os cientistas quê tiveram seus nomes associados a elas.

LE CÉNACLE scientifique du chateau de Clairac. In: ALBUM de la science: savants illustres grandes découvertes. Paris: Ancienne Librairie Furne, 1899. p. 81.
Página sessenta e sete
Lei da conservação das massas
Leia o trecho a seguir no qual Lavoisiê faz uma afirmação.
pôdêmos demonstrar como um axioma incontestável quê, em todas as operações da ár-te e da natureza, nada é criado; uma quantidade igual de matéria existe antes e depois do experimento; a qualidade e a quantidade dos elemêntos permanecem precisamente as mesmas; e só ocorrem variações e modificações na combinação dêêsses elemêntos. Deste princípio depende toda a; ár-te da experimentação química: devemos sempre supor quê há uma igualdade exata entre os elemêntos do corpo examinado e aqueles dos produtos de sua análise.
LAVOISIER, Ântoeni-Lorran de. Elements ÓF chemistry, in a new systematic order, containing all the modern discoveries. [S. l.]: The Prôjéct Gutenberg, 2009. p. 130-131. E-book. Tradução nossa. Disponível em: https://livro.pw/kxzjl. Acesso em: 2 set. 2024.
Esse enunciado corresponde ao quê ficou conhecido como lei da conservação das massas e foi mais tarde popularizado na frase: “Na natureza nada se cria, nada se perde, tudo se transforma.”. Ela costuma sêr atribuída ao cientista francês, mas não há evidências de quê seja de sua altoría.
A apresentação dessa lei não foi própriamente uma novidade. O cientista e químico belga Jan batista vã Helmont (1580-1644), mais de um século antes, já havia especulado sobre a conservação de matéria em uma transformação. Além díssu, em 1760, o cientista russo Mi káil Vasilyevich Lomonosov(1711-1765) publicou um ensaio em quê descrevia o mesmo princípio postulado na lei da conservação das massas. Apesar de sêr muito influente na Rússia, sêndo considerado por muitos como o pioneiro do desenvolvimento científico do país, sua obra não teve repercussão na Europa Ocidental.
De qualquer forma, a lei ganhou fôrça e foi amplamente divulgada por causa do trabalho experimental de Lavoisiê, no qual se valeu de balanças bastante precisas. Por esse motivo, ficou conhecida como lei de Lavoisiê.
Para compreendê-la melhor, considere a reação de síntese da á gua a partir do gás hidrogênio e do gás oxigênio, em três experimentos hipotéticos diferentes. Note quê, em todos os casos, as quantidades do produto (á gua), em massa, são equivalentes às somas das massas dos reagentes (gás oxigênio e gás hidrogênio).
Ao realizar experimentos em sistemas fechados, isto é, sistemas em quê não há troca de matéria com o ambiente, Lavoisiê chegou à conclusão de quê, em toda transformação química, a quantidade de matéria antes e depois será sempre a mesma.

ROUTLEDGE, róbert. Composition ÓF water bai synthesis. In: ROUTLEDGE, róbert. A popular rístorí ÓF science. London: Giórgi Routledge ênd Sons, 1881. p. 377.
REFLITA
1 Liste algumas transformações químicas quê você conhece e dêz-creva como a massa varia nelas.
SOBRE
Uma afirmação quê não exige próva para sêr considerada verdadeira é chamada de axioma.
Página sessenta e oito
Marie-Anne Lavoisiê e a campanha pela nova Química
Conhecida como tradutora e ilustradora de textos químicos, a francesa Marie-Anne Pierrette Paulze Lavoisiê (1758-1836) foi uma das maiores responsáveis por difundir a nova Química, movimento quê derrubou a teoria do flogisto e contribuiu para o estabelecimento da Química Moderna. Ela registrava suas observações no laboratório e trocava cartas com pessoas da elite parisiense, entre elas cientistas amadores e personalidades influentes.
Estudos recentes, dedicados a analisar a biografia de Marie-Anne sôbi um ângulo diferente, focam na leitura dêêsses registros. Neles, são encontradas evidências de quê suas habilidades de escrita foram intencionalmente utilizadas para angariar colaboradores e, assim, fortalecer o movimento encabeçado por Lavoisiê, com quem era casada.
Mesmo após a execução de Lavoisiê na guilhotina, durante a Revolução Francesa, a nova Química se estabeleceu, e o legado do cientista se manteve. Marie-Anne, no entanto, quando mencionada, é associada ao papel de admiradora e assistente. Embora essa seja uma maneira de descrevê-la, com base em seus próprios registros, esses rótulos não contemplam a relevância de seu trabalho, quê segue importante até os dias atuáis.
No início do século XIX, o trabalho de Marie-Anne repercutiu mundialmente em países como o Japão, por meio do esfôrço conjunto de estudiosos do rangaku.

DAVID, Jáque-luí. Ântoeni-Lorran Lavoisiê e Marie-Anne Lavoisiê. 1788. Óleo sobre tela, 259,7 cm × 194,6 cm. Museu Metropolitano de ár-te, Nova iórk.
SOBRE
O termo rangaku dêríva da prática de tradução de textos escritos no idioma neerlandês para o idioma japonês. Ao final do século XVIII e início do século XIX, o Japão passou por um isolamento político-econômico, deixando o país inacessível para o Ocidente, com exceção de apenas uma rota comercial com os Países Baixos

(A) PAULZE, Marie-Anne Pierrette. [Detalhe da Planche IV]. In: LAVOISIER, Ântoeni-Lorran de. Traité élémentaire de chimie. Paris: [s. n.], 1789. t. 2, [p. IV]. (B) YŌAN, Udagawa. [Detalhe da Planche IV]. In: YŌAN, Udagawa. Seimi kaisō. [S. l.: s. n.], 1840. p. [78]. (C) YŌAN, Udagawa. 1850. 1 gravura.
Página sessenta e nove
Esse novo olhar sobre o trabalho de Marie-Anne mostra quê a nova Química não dependeu só dos resultados consistentes de Lavoisiê, mas também da habilidade comunicativa dela. Isso foi fundamental para quê o cientista fosse reconhecido ainda em seu tempo.
Os registros de Marie-Anne demonstram, assim como outras evidências, o pôdêr da colaboração e do diálogo entre as pessoas.
Lei das proporções definidas
O químico francês jôsef Louis Proust (1754-1826) desempenhou um papel significativo na compreensão sistemática das reações químicas.
No final do século XVIII, ao estudar certos materiais metálicos, Proust verificou quê as massas das substâncias quê reagiam e as massas das substâncias quê eram produzidas mantinham entre si proporções fixas, enunciando, assim, a lei das proporções definidas, também chamada de lei de Proust. Observou ainda quê essas proporções eram características de cada reação química. Além díssu, ele verificou quê a composição química de uma substância é sempre a mesma, não importa como ela é produzida.
Para entender melhor o enunciado dessa lei, considere três experimentos hipotéticos em quê o gás hidrogênio reage com o gás oxigênio, formando á gua líquida.
Acompanhe as relações de proporcionalidade.
Experimento |
|||
|---|---|---|---|
I |
= 8 |
= 1,125 |
= 9 |
II |
= 8 |
= 1,125 |
= 9 |
III |
= 8 |
= 1,125 |
= 9 |
Ao determinar a proporção entre os reagentes e os produtos, é possível calcular quanto de cada substância reagente, em massa, é necessário para produzir quantidades definidas de produtos. Por exemplo, para obtêr 90 g de á gua por meio da mesma reação, serão necessários 80 g de gás oxigênio e 10 g de gás hidrogênio.
Note quê a lei da conservação das massas também é obedecida nesses casos; em cada experimento, a soma das massas dos reagentes é igual à massa do produto formado.
REFLITA
2 O quê é crescimento proporcional?
Página setenta
Lei das proporções múltiplas
REFLITA
3 A combinação de carbono e gás oxigênio póde formár o monóxido de carbono. O quê precisa acontecer na reação para quê haja a formação de dióxido de carbono?
O químico e físico inglês Diôn Dalton verificou quê, em alguns casos, os mesmos reagentes podiam reagir em proporções diferentes, resultando em outros produtos. Ele também observou quê as diferentes massas de um reagente quê se combinam com uma massa fixa de outro reagente, resultando em produtos distintos, guardam entre si uma razão de números inteiros.
Para entender melhor essa conclusão de Dalton, quê ficou conhecida como lei das proporções múltiplas ou simplesmente lei de Dalton, considere novamente a reação do gás hidrogênio com o gás oxigênio, formando á gua líquida. Como estudado, é preciso 1 g de gás hidrogênio e 8 g de gás oxigênio para obtêr 9 g de á gua. Se a proporção entre esses dois reagentes for alterada de para, haverá a formação de outro produto, a á gua oxigenada. Acompanhe os experimentos hipotéticos a seguir.
Experimento |
Gás hidrogênio |
Gás oxigênio |
Água |
Água oxigenada |
|---|---|---|---|---|
I |
1 g |
8 g |
9 g |
----- |
II |
1 g |
16 g |
----- |
17 g |
III |
4 g |
32 g |
36 g |
|
IV |
4 g |
64 g |
----- |
68 g |
V |
8 g |
64 g |
72 g |
----- |
VI |
8 g |
128 g |
----- |
136 g |
Observe quê, mantendo a massa de gás hidrogênio constante, para produzir á gua oxigenada em vez de á gua, a massa de gás oxigênio tem de dobrar. Em outras palavras, as diferentes massas de gás oxigênio quê se combinam com uma massa fixa de gás hidrogênio, gerando á gua ou á gua oxigenada, guardam entre si uma razão igual a 2. Assim, deduz-se quê a á gua oxigenada possui o dôbro de massa de gás oxigênio em relação à á gua.
Lei das proporções volumétricas
jôsef Louis Gay-Lussac (1778-1850) foi um químico e físico francês quê atuou em diferentes campos. Buscando melhorar a produção de ácido sulfúrico, quê tem grande relevância para a indústria até hoje, estudou diversas reações entre gases.
Em seus trabalhos, verificou quê, nas mesmas condições de tempera-túra e pressão, a proporção entre os volumes dos gases reagentes e os volumes dos produtos em uma reação é sempre dada por pequenos números inteiros, conclusão quê ficou conhecida como lei das proporções volumétricas ou lei de Gay-Lussac.
Considere a reação entre o gás hidrogênio e o gás oxigênio para formár á gua no estado gasoso. Sabe-se quê dois volumes de gás hidrogênio reagem com um volume de gás oxigênio para formár dois volumes de vapor de á gua. Por exemplo, uma reação entre 4 L de gás hidrogênio e 2 L de gás oxigênio produzirá 4 L de vapor de á gua.
REFLITA
4 As leis da Química funcionam para reagentes em todos os estados físicos?
Página setenta e um
Acompanhe os experimentos hipotéticos a seguir.
Experimento |
Gás hidrogênio |
Gás oxigênio |
Vapor de á gua |
|---|---|---|---|
I |
2 L |
1 L |
2 L |
II |
4 L |
2 L |
4 L |
III |
8 L |
4 L |
8 L |
IV |
16 L |
8 L |
16 L |
Note quê a relação volumétrica entre os reagentes e o produto é sempre 2: 1: 2, ou seja, uma proporção simples de números inteiros.
Essas proporções volumétricas dadas por números pequenos inteiros são fundamentais para compreender o conceito de mol e os cálculos estequiométricos, quê serão estudados mais adiante.
As leis ponderais desempenharam um papel fundamental no desenvolvimento da Química Moderna, pois proporcionaram uma base quantitativa sólida para o estudo das reações químicas, permitindo quê cientistas compreendessem como as substâncias se combinam e se transformam. Essas leis constituíram também um fundamento para o desenvolvimento da teoria atômica.
ATIVIDADES
1. escrêeva no caderno um texto dissertativo sobre a importânssia do trabalho de Lavoisiê para o desenvolvimento da Química.
2. O áucôl comum (etanol) reage com o gás oxigênio do ar e produz gás carbônico e á gua. Considerando quê, para 46 g de áucôl, são necessários 96 g de gás oxigênio e são produzidos 88 g de gás carbônico, responda às kestões a seguir.
a) Qual é a massa de á gua produzida nesse caso?
b) Qual é a massa de gás oxigênio necessária para queimar 69 g de áucôl?
c) Qual é a proporção entre a massa de gás oxigênio e a massa de áucôl nessa reação?
3. A reação do etanol com o gás oxigênio produz á gua e gás carbônico, sêndo também possível a formação de monóxido de carbono. Nesse caso, 46 g de áucôl reagem com 64 g de gás oxigênio, formando 56 g de monóxido de carbono. Com essas informações, responda às kestões.
a) Qual é a massa de á gua produzida nessa reação?
b) Qual será a massa de gás oxigênio necessária para queimar 69 g de áucôl, produzindo monóxido de carbono?
c) Qual é a proporção entre a massa de gás oxigênio e a massa de áucôl nessa reação?
d) Qual é a proporção entre a quantidade de gás oxigênio quê reage nas reações em quê ocorre a formação de dióxido de carbono (use dados da questão anterior) e de monóxido de carbono?
4. A produção industrial de amônia é realizada pelo processo de Haber-Bosch, quê consiste na reação entre os gases nitrogênio e hidrogênio. Nessa reação, um volume de gás nitrogênio reage com três volumes de gás hidrogênio, formando dois volumes de gás amônia.
Com base nessas proporções, responda às kestões.
a) Quantos litros dos gases nitrogênio e hidrogênio são necessários para produzir 100 litros de amônia?
b) Se forem utilizados 20 m3 de gás nitrogênio e 60 m3 de gás hidrogênio, quantos metros cúbicos de amônia serão produzidos?
Página setenta e dois
ORGANIZANDO AS IDEIAS
Analise o esquema a seguir, quê apresenta e relaciona os principais conceitos estudados nesta Unidade.
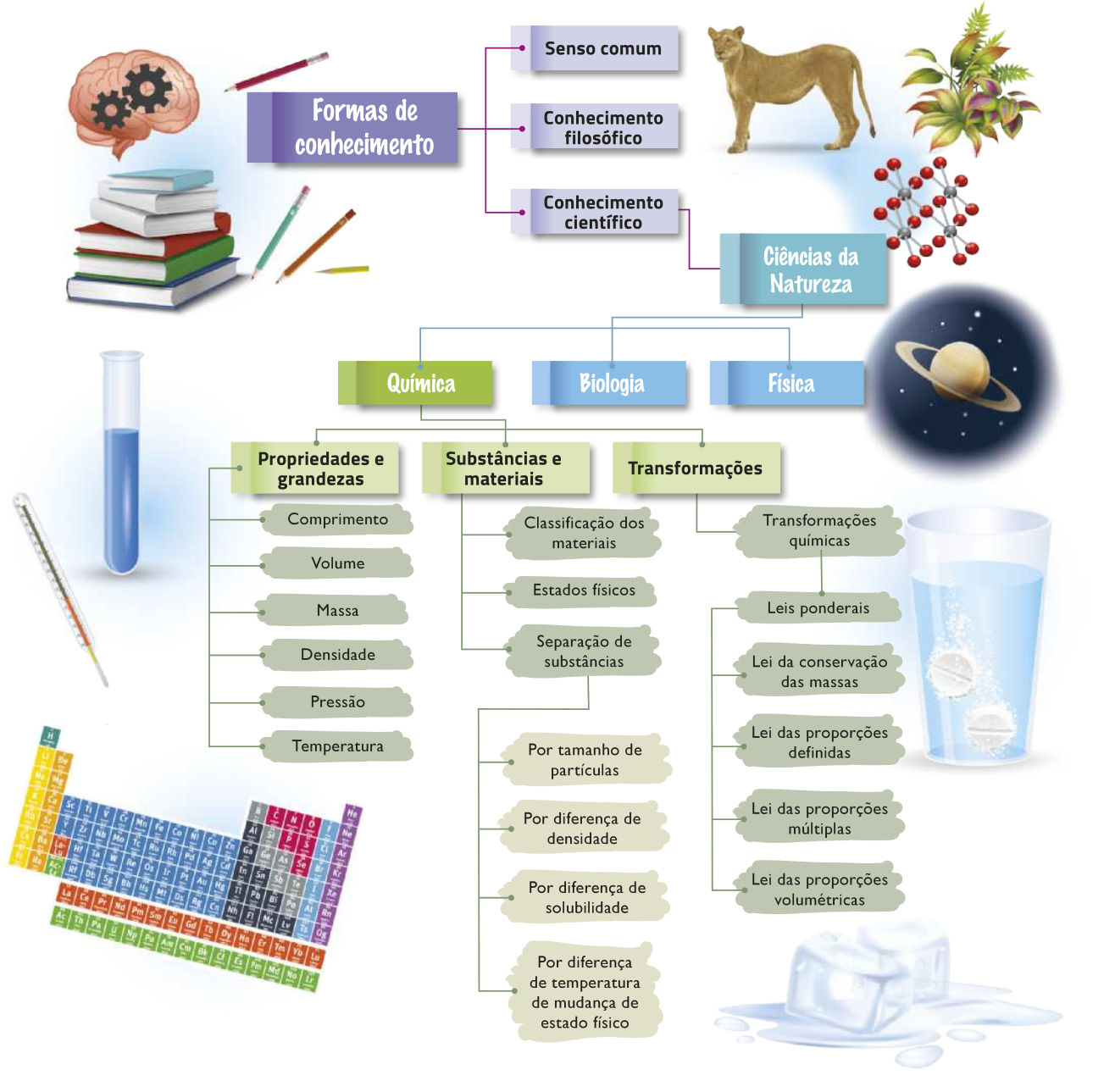
A relação entre os conceitos é uma característica do conhecimento formal, científico e escolar. Aqui, apresenta-se uma síntese esquemática dos principais conceitos trabalhados nesta Unidade. No caderno, elabore seu próprio esquema, organizando os principais conceitos da Unidade, incluindo nele outros termos e outras ideias quê se relacionam ao quê foi estudado e realizando as associações quê considerar importantes. Por fim, elabore um pequeno texto conectando os conceitos e as ideias presentes no esquema. Essa é uma boa forma de estudar e compreender melhor os conceitos.
Página setenta e três
ATIVIDADES COMPLEMENTARES
Respostas e comentários estão disponíveis nas Orientações para o professor.
Tema 1 – O quê é Ciência?
1. (Enem/MEC)
A filosofia encontra-se escrita neste grande livro quê continuamente se ábri perante nóssos olhos (isto é, o Universo), quê não se póde compreender antes de entender a língua e conhecer os caracteres com os quais está escrito. Ele está escrito em língua matemática, os caracteres são triângulos, circunferências e outras figuras geométricas, sem cujos meios é impossível entender humanamente as palavras; sem eles, vagamos perdidos dentro de um obscuro labirinto.
GALILEI, G. O ensaiador. Os pensadores. São Paulo: Abril Cultural, 1978.
No contexto da Revolução Científica do século XVII, assumir a posição de Galileu significava defender a:
a) continuidade do vínculo entre Ciência e fé dominante na Idade Média.
b) necessidade de o estudo linguístico sêr acompanhado do exame matemático.
c) oposição da nova física quantitativa aos pressupostos da filosofia escolástica.
d) importânssia da independência da investigação científica pretendida pela Igreja.
e) inadequação da matemática para elaborar uma explicação racional da natureza.
Resposta: c)
Tema 2 – Química: Ciência da Natureza
2. (Unir-RO) A Química é uma ciência quê trabalha em três níveis: o macroscópico, o submicroscópico e o das representações. Neste último nível, estão as fórmulas, os símbolos e as equações químicas quê facilitam a comunicação e a explicação quê utiliza esta linguagem científica. Sobre o nível das representações, assinale a afirmativa correta.
a) Propõe explicações para as leis criando as teorias e confirmando as hipóteses estudadas pêlos cientistas.
b) Contém dados sobre as propriedades das substâncias, como ponto de fusão e ebulição.
c) É uma linguagem universal construída pela União Internacional de Química Pura e Aplicada (IUPAC).
d) É a parte das informações organolépticas das substâncias, como a côr, o cheiro e a textura.
e) É o nível mais importante, pois é percebido e construído antes dos outros.
Resposta: c)
Tema 3 – Materiais
3. (Enem/MEC) A densidade é uma propriedade quê relaciona massa e volume de um material. Um estudante iniciou um procedimento de determinação da densidade de uma amostra sólida desconhecida. Primeiro ele determinou a massa da amostra, obtendo 27,8 g. Em seguida, utilizou uma proveta, graduada em mililitro, com á gua para determinar o volume da amostra, conforme esquematizado na figura. Considere a densidade da á gua igual a 1 g/mL.
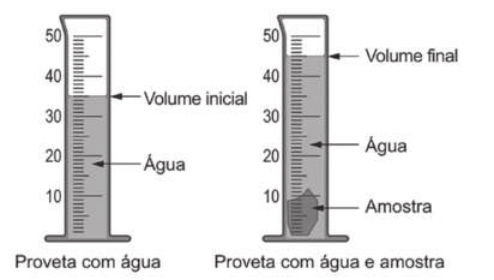
A densidade da amostra ôbitída, em g/mL, é mais próxima de:
a) 0,36.
b) 0,56.
c) 0,62.
d) 0,79.
e) 2,78.
Resposta: e)
Tema 4 – Caracterizar e separar substâncias
4. (PUC-MG) São exemplos de misturas heterogêneas, EXCETO:
a) á gua e óleo
b) gêlo e á gua
c) á gua e areia
d) hexano e á gua
Resposta: b)
5. (UFRGS-RS) Considere dois béqueres, contendo quantidades diferentes de duas amostras líquidas homogêneas A e B, a 25 °C, quê são submetidos a aquecimento por 30 min, sôbi pressão de 1 atm, com fontes de calor equivalentes. A tempera-túra do líquido contido em cada béquer foi medida em função do tempo de aquecimento, e os dados obtidos foram registrados nos gráficos a seguir.
Página setenta e quatro
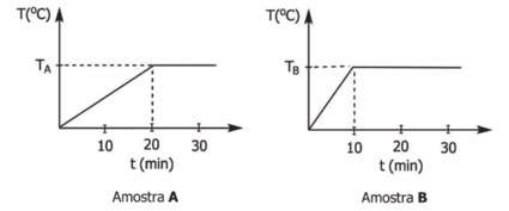
Sobre esses dados, são feitas as afirmações a seguir.
I. Se TA = TB, então a amostra A e a amostra B provavelmente são a mesma substância pura.
II. Se as amostras A e B são constituídas pela mesma substância, então o volume da amostra B é menor quê o volume de amostra A.
III. A amostra A é uma mistura em quê o líquido predominante é aquele quê constitui a amostra B.
Quais estão corretas?
a) Apenas I.
b) Apenas III.
c) Apenas I e II.
d) Apenas II e III.
e) I, II e III.
Resposta: c)
6. (Enem/MEC) Para assegurar a boa qualidade de seu produto, uma indústria de vidro analisou um lote de óxido de silício (SiO2), principal componente do vidro. Para isso, submeteu uma amostra dêêsse óxido ao aquecimento até sua completa fusão e ebulição, obtendo ao final um gráfico de tempera-túra T (°C) vérsus tempo t (min). Após a obtenção do gráfico, o analista concluiu quê a amostra se encontrava pura.
Dados do SiO2: Tfusão = 1.600 °C; Tebulição = 2.230 °C. Qual foi o gráfico obtído pelo analista?
a) 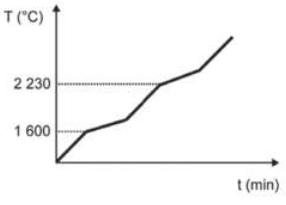
b) 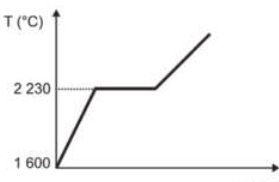
c) 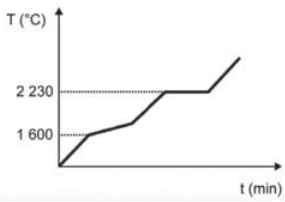
d) 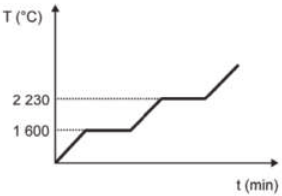
e) 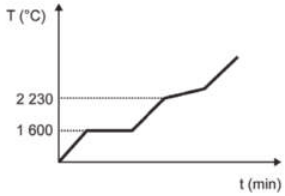
Resposta: d)
7. (Enem/MEC) Para demonstrar os processos físicos de separação de componentes em misturas compléksas, um professor de Química apresentou para seus alunos uma mistura de limalha de ferro, areia, cloreto de sódio, bó-linhas de isopor e grãos de feijão. Os componentes foram separados em etapas, na seguinte ordem:
Etapa |
Material separádo |
Método de separação |
|---|---|---|
1 |
Grãos de feijão |
Catação |
2 |
Limalha de ferro |
Imantação |
3 |
bó linhas de isopor |
Flotação |
4 |
Areia |
Filtração |
5 |
Cloreto de sódio |
Evaporação |
Em qual etapa foi necessário adicionar á gua para dar sequência às separações?
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
Resposta: c)
Tema 5 – Transformações da matéria
8. (UFSM-RS) O conhecimento da Química propicía uma melhor compreensão do mundo e, consequentemente, auxilia na melhoria da qualidade de vida. A Química está presente no dia a dia, como, por exemplo, no processamento e na conservação de alimentos.
Assim, avalie os seguintes processos:
I. o amadurecimento de uma fruta.
II. a fermentação do vinho em vinagre.
III. a transformação do leite em iogurte.
IV. o cozimento do ovo.
Página setenta e cinco
São fenômenos químicos:
a) apenas I e II.
b) apenas I e III.
c) apenas II e IV.
d) apenas III e IV.
e) I, II, III e IV.
Resposta: e)
9. (í éfi cê ê) Entre as transformações a seguir, constitui um fenômeno químico:
a) solidificação da parafina.
b) sublimação da naftalina.
c) obtenção de gêlo a partir da á gua pura.
d) obtenção de oxigênio líquido a partir do ar atmosférico.
e) obtenção da amônia a partir de hidrogênio e nitrogênio.
Resposta: e)
10. (IFSP) Leia as afirmações sobre reciclagem de resíduos.
I. Cortados em lascas, os p-neus velhos são transformados em pó de borracha, sêndo purificado por um sistema de peneiras e moído até atingir a granulação desejada.
II. Na usina de fundição, a sucata de latas de aço é submetida a 1.550 °C em fôrnos elétricos e, após atingir o ponto de fusão e chegar ao estado de líquido fumegante, o material obtído é moldado em tarugos ou placas metálicas.
III. Uma das etapas da reciclagem do papel contendo aparas provenientes de escritórios é o branqueamento com agentes alvejantes para retirar as tintas de impressão.
Das afirmações quê se reférem a exclusivamente fenômenos físicos, está correto apenas o contido em:
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
Resposta: d)
Tema 6 – Leis ponderais
11. (Vunesp-SP) Foram analisadas três amostras (I, II e III) de óxidos de enxofre, procedentes de fontes distintas, obtendo-se os seguintes resultados:
Amostra |
Massa de enxofre (g) |
Massa de oxigênio (g) |
Massa de amostra (g) |
|---|---|---|---|
I |
0,32 |
0,32 |
0,64 |
II |
0,08 |
0,08 |
0,16 |
III |
0,32 |
0,48 |
0,80 |
Estes resultados mostram quê:
a) as amostras I, II e III são do mesmo óxido.
b) apenas as amostras I e II são do mesmo óxido.
c) apenas as amostras II e III são do mesmo óxido.
d) apenas as amostras I e III são do mesmo óxido.
e) as amostras I, II e III são de óxidos diferentes.
Resposta: b)
12. (UFSCar-SP) Durante uma aula de laboratório, um estudante queimou ao ar diferentes massas iniciais (mi) de esponja de ferro. Ao final de cada experimento, determinou também a massa final resultante (mf). Os resultados obtidos estão reunidos na tabéla a seguir.
Experimento número |
Massa inicial m(i) (g) |
Massa final m(f) (g) |
Relação m(f)/m(i) |
|---|---|---|---|
1 |
0,900 |
1,10 |
1,204 |
2 |
0,830 |
1,00 |
1,205 |
3 |
1,05 |
1,26 |
1,200 |
4 |
1,11 |
1,34 |
1,207 |
Admitindo quê em todos os experimentos a queima foi completa, o estudante fez as três afirmações seguintes.
I) A lei da conservação da massa não foi obedecida, pois a massa final encontrada para o sistema em cada experimento é sempre maior quê sua massa inicial.
II) O aumento de massa ocorrido em cada experimento se deve à transformação de energia em massa, tendo se verificado a conservação da soma (massa + energia) do sistema.
III) A relação constante ôbitída entre a massa final e a massa inicial do sistema (mf/mi), em cada experimento realizado, permite afirmar quê, dentro do êrro experimental, os dados obtidos estão de acôr-do com a lei das proporções definidas.
Dentre as afirmações apresentadas, o estudante acertou:
a) I, apenas.
b) II, apenas.
c) III, apenas.
d) I e II, apenas.
e) I, II e III.
Resposta: c)
Página setenta e seis
INTEGRANDO COM...
CIÊNCIAS HUMANAS E SOCIAIS APLICADAS
A guerra dos químicos
A Primeira Guerra Mundial, conhecida como Grande Guerra, durou quatro anos, de 1914 a 1918. Esse conflito teve um impacto significativo na história, pois mais de 16 milhões de pessoas perderam a vida nos campos de batalha e mais de 21 milhões de pessoas ficaram feridas, incluindo civis. Como a Química esteve presente nesse conflito?
Cientistas envolvidos na batalha desenvolveram armas químicas, na forma de gases tóxicos, para serem utilizadas contra seus adversários. Essas armas tiveram tamãnho impacto e influência quê a Primeira Guerra Mundial ficou conhecida como a guerra dos químicos.
Segundo registros históricos, uma das primeiras substâncias tóxicas utilizadas foi o gás lacrimogêneo (brometo de xilila, C8H9Br), na Batalha de Bolimov, Varsóvia (Polônia), em janeiro de 1915. O gás não foi tão eficaz, pois se espalhava lentamente pelo ar e congelava em razão do frio intenso.
Outros gases também foram utilizados: o gás cloro (C(éli)"2), na Segunda Batalha de Ypres, na Bélgica, em abril de 1915, em um evento quê marcou a primeira grande utilização de armas químicas na guerra; e o gás mostarda, em 1917, quê causa efeitos graves no corpo humano, como queimaduras na péle e nos olhos e danos aos pulmões. Outros gases tóxicos, como fosgênio (COC(éli)"2) e difosgênio (C2C(éli)"4O2), também foram utilizados durante a guerra.
A Química não foi usada apenas em medidas ofensivas, uma vez quê cientistas também desenvolveram contramedidas defensivas para neutralizar os efeitos dêêsses gases. No início, os soldados tentavam se proteger apenas com um lenço no rrôsto. Mas, com o desenvolvimento das máscaras antigás, passaram a utilizá-las nos campos de batalha ao longo da guerra. Cientistas desenvolveram os filtros das máscaras quê utilizavam carvão ativado (C), para a absorção de cloro fosgênio, e substâncias como o hipossulfito de sódio (Na2S3O4) para neutralizar gases irritantes.
O uso de armas químicas não foi o quê definiu o lado ganhador nessa guerra, mas causou um alto número de óbitos e influenciou o uso da Ciência nos conflitos políticos mundiais dali em diante. A Primeira Guerra Mundial não só reconfigurou o mapa político da Europa e do ôriênti Médio mas também provocou profundas mudanças sociais e econômicas. As lições aprendidas e as marcas deixadas por ela continuam a influenciar a política e a cultura global até os dias de hoje.

Página setenta e sete
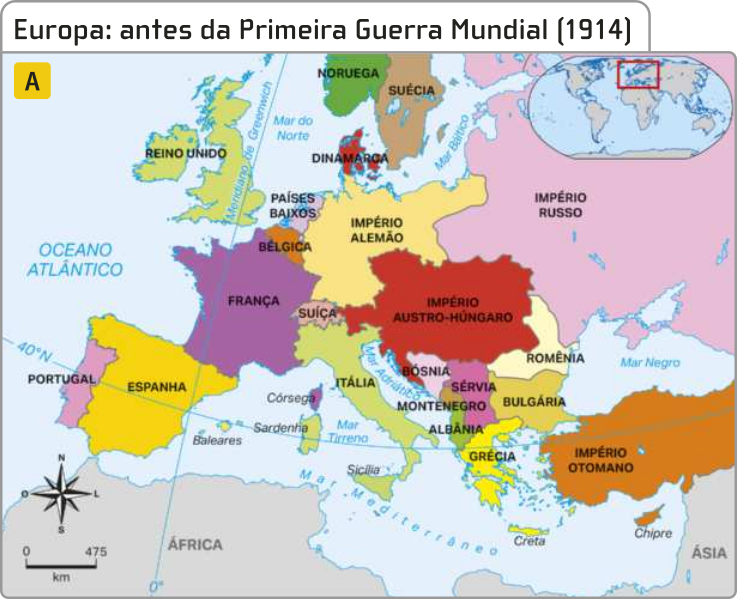
Elaborados com base em: (A) EDEN, Becky L. Europe before uôrd War One (1914) [Europa antes da Primeira Guerra Mundial (1914)]. [Tempe]: Arizona Geográfic alainci, [c2024]. Disponível em: https://livro.pw/qdivt. (B) EDEN, Becky L. Europe after uôrd War One (1918) [Europa depois da Primeira Guerra Mundial (1918)]. [Tempe]: Arizona Geográfic alainci, [c2024]. Disponível em: https://livro.pw/vocix. Acessos em: 2 maio 2025.
Respostas e comentários estão disponíveis nas Orientações para o professor.
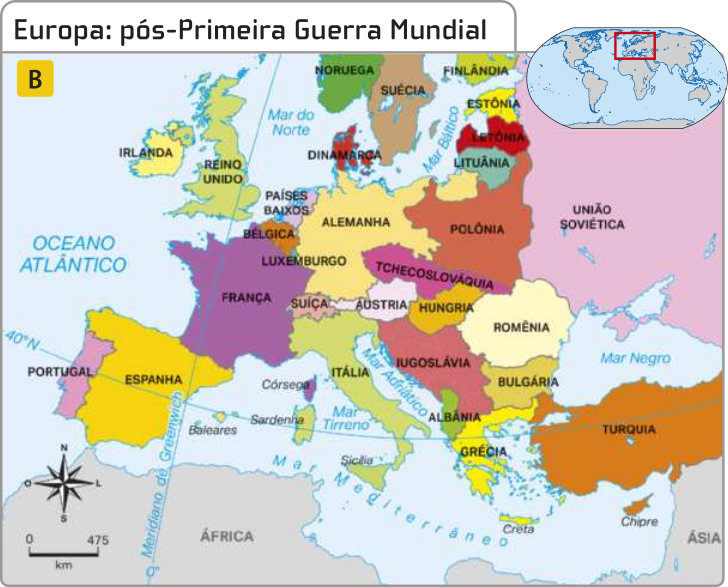
Agora, faça o quê se pede em cada item.
1. O uso de armas químicas é alvo de debates políticos e científicos desde a sua utilização na Grande Guerra. Qual é o seu entendimento a respeito díssu? Reflita sobre o assunto e escrêeva um texto no caderno acerca do uso de armas químicas e da participação de cientistas nesse processo.
2. O carvão ativado foi fundamental para a neutralização dos gases tóxicos durante a Grande Guerra. As moléculas dos gases, como a amônia (NH3), são capturadas e retidas na superfícíe porosa do carvão. Em alguns casos específicos, póde ocorrer a neutralização das substâncias tóxicas por meio da oxidação na presença de permanganato de potássio. Com base no quê foi apresentado, identifique e explique o quê póde sêr classificado como fenômeno químico e como fenômeno físico.
3. Você conhece a expressão ética científica? Faça uma pesquisa e, com suas próprias palavras, escrêeva no caderno uma definição para ela.
4. Você sabe o quê é uma convenção?
a) Pesquise e registre o significado dessa palavra.
b) Pesquise a Convenção sobre a Proibição de Armas Químicas (CPAQ), quê começou a vigorar em 1997, e liste algumas ações quê podem sêr realizadas para quê ela seja cumprida e alguns países quê a apoiam.
5. Releia sua resposta para a atividade 1. Diante das pesquisas realizadas até aqui, você ainda pensa da mesma forma? Refaça o texto no caderno incluindo informações quê você aprendeu durante as pesquisas.
Página setenta e oito





