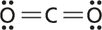UNIDADE
2
CONSTITUIÇÃO QUÍMICA DA MATÉRIA
Página setenta e nove
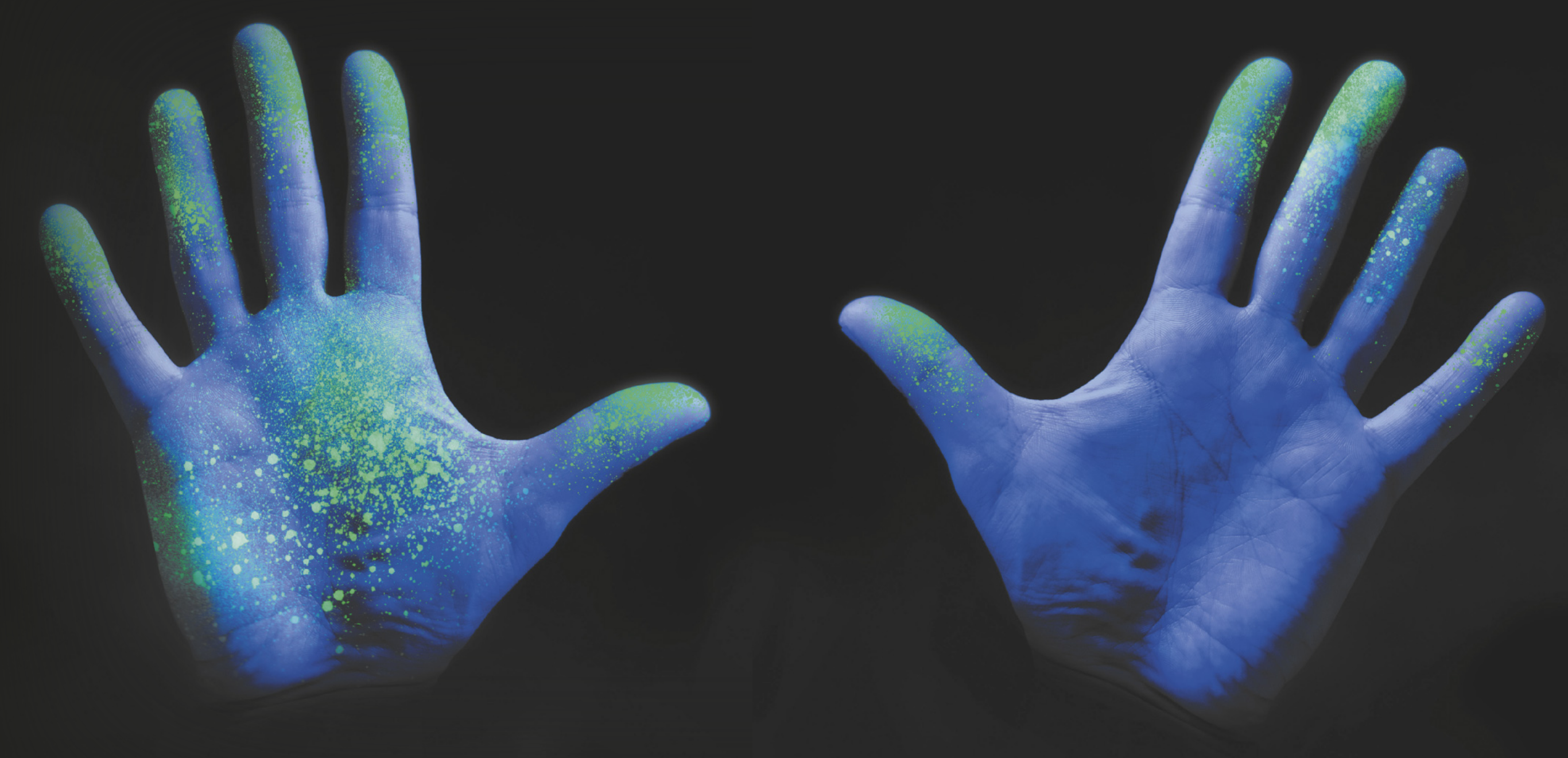
A fluorescência de microrganismos ocorre quando eles absorvem luz ultravioleta (uvê) e reemitem-na em comprimentos de onda visíveis. Esse fenômeno acontece com alguns fungos, algumas algas e cértas bactérias. Assim, a luz uvê é muito utilizada em pesquisas e na detecção de patógenos, pois facilita a visualização dêstes organismos. A imagem mostra o uso de luz uvê para detecção de bactérias na mão de uma pessoa. As mãos foram submetidas à aplicação de um gel e depois lavadas. Quando colocado sôbi luz ultravioleta, o gel fica fluorescente e mostra as áreas quê não foram limpas adequadamente. Isso ilustra a importânssia da lavagem completa das mãos para remover as bactérias e evitar contaminação.
1. Você classificaria a fluorescência como um fenômeno físico ou químico? Apresente um argumento quê justifique sua resposta.
2. Você já observou a emissão de luz por insetos, como os vaga-lumes? Esse fenômeno é conhecido como bioluminescência. Pesquise a respeito dêêsse fenômeno e escrêeva um pequeno parágrafo, explicando-o.
Respostas e comentários estão disponíveis nas Orientações para o professor.
Página oitenta
TEMA
7
Modelando os hátomus
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Há muito tempo, a humanidade busca compreender a estrutura da matéria e os fenômenos naturais. Como esse conhecimento é abstrato e diz respeito a aspectos quê não podem sêr percebidos apenas com os sentidos, foi necessário desenvolver ferramentas para traduzi-lo, como as teorias e os modelos científicos. Entretanto, ao serem criadas, essas ferramentas não estão prontas nem se mantêm constantes, elas são aperfeiçoadas ao longo do tempo, por meio de mais estudos, experimentos, debates e muita reflekção.

O quê são modelos
As Ciências se estabeleceram como uma maneira de compreender a realidade por meio da racionalidade e da lógica. Baseando-se em observações, experimentos, dados fornecidos por esses experimentos e por hipóteses e fazendo uso da abstração, cientistas constroem modelos quê possibilitam às pessoas analisar o quê não póde sêr observado ou tocado e compreender uma enorme variedade de estruturas e fenômenos.
SOBRE
A palavra abstração póde sêr definida como um processo mental de reflekção, quê tem como finalidade analisar algo, geralmente d fórma isolada do seu contexto real.
REFLITA
1 Imagine quê você é cientista e precisa explicar a um amigo como algo funciona, mas sem usar o objeto ou o fenômeno real. Como você faria isso? Já tentou usar essa estratégia para explicar como algo funciona? Dê um exemplo.
Página oitenta e um
Os modelos são uma forma de representar a realidade, uma ferramenta científica, e, portanto, não equivalem à realidade em si. Em outras palavras, são representações simplificadas de objetos, processos, sistemas, estruturas e fenômenos, a análise dêêsses modelos permite a elaboração de previsões, compreensões e/ou explicações.
Os modelos são criados e constantemente aperfeiçoados para responder tanto a kestões profundas sobre a existência humana quanto a kestões relacionadas ao cotidiano, como as apresentadas a seguir.
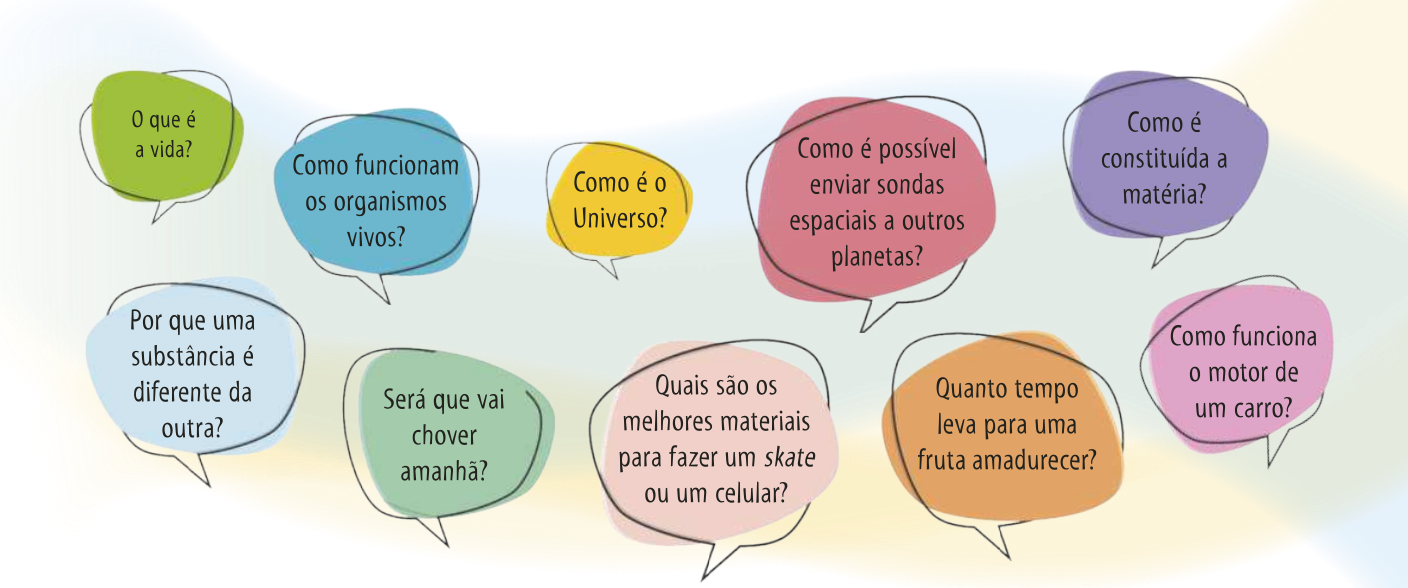
Ao longo da história, diferentes campos da Ciência foram se especializando em busca de respostas a essas e a outras kestões. A Biologia, por exemplo, estuda a vida, investigando aspectos como a estrutura, a evolução, a distribuição geográfica e as relações dos sêres vivos com o ambiente; a Física estuda os fenômenos e as estruturas mais fundamentais da natureza, como o movimento, o calor, a luz, o som e a eletricidade; e a Química, por sua vez, estuda a composição e as transformações da matéria.
É importante frisar, no entanto, quê a Ciência é colaborativa, e, freqüentemente, são necessários conhecimentos de diversos campos específicos para a formulação de um modelo científico. Para chegar a um modelo quê possibilite, por exemplo, entender a dinâmica nos recifes de coral e prever seu estado de conservação, é preciso investigar a composição da á gua (Química), a influência da propagação de calor e luz pela á gua (Física), a ocupação e as interações entre os sêres vivos quê compõem esse ambiente (Biologia), entre vários outros aspectos.

Página oitenta e dois
OFICINA CIENTIFICA
Como é possível descrever o quê não póde sêr observado?
A capacidade de abstrair e de analisar o quê não póde sêr observado foi aprimorada pelo sêr humano ao longo do tempo e é importante para o desenvolvimento de modelos científicos. A atividade a seguir é um exemplo de como essa capacidade póde sêr usada.
Materiais
• Caixas de papelão pequenas, por exemplo, de calçados.
• Objetos não frágeis de formas, tamanhos e materiais diferentes, quê caibam nas caixas (recomenda-se quê haja ao menos dois objetos de ferro no total).
• Fita adesiva.
• Caneta.
Procedimentos
• Faça um grupo com pelo menos três côlégas, selecionem um dos objetos e coloquem-no em uma caixa. Escolham um nome para o grupo e o utilizem para identificar a caixa preparada.
Obs.: deve havêer uma caixa por grupo, e o objeto deve sêr de conhecimento só do grupo quê a preparou.
• Lacrem a caixa com fita adesiva e usem a caneta para identificá-la.
• Troquem de caixa com um grupo. Ao pegar a caixa preparada pelo outro grupo, analisem-na por um tempo, sem abri-la, para tentar estimar as características do objeto.
• Troquem de caixa com outro grupo e repitam o procedimento de análise até quê todas as caixas tênham sido estudadas.
• Anotem no caderno as percepções do grupo sobre os objetos presentes em cada caixa. Vocês podem estimar o formato, o material de quê são compostos, a massa, entre outras características.
ATIVIDADES

1. Quais são as características (peso, forma, dureza, som produzido, tamãnho, material etc.) dos objetos analisados?
2. Tentem representar, por meio de dêzê-nhôs, cada objeto.
Página oitenta e três
Ideias iniciais sobre a constituição da matéria
No século VII a.C., filósofos gregos já indagavam sobre a origem, a natureza e as transformações daquilo quê eles entendiam por matéria. Alguns deles deixaram ideias da constituição da matéria quê perduraram por séculos, entre as quais se destacam duas principais: a teoria dos quatro elemêntos e o atomismo.
REFLITA
2 Algumas reflekções propostas pêlos filósofos gregos são temas recorrentes na cultura popular, como em filmes, seriados ou animações. Você conhece algum exemplo quê mencione a teoria dos quatro elemêntos? Indique como ela é abordada.

SANZIO, Raffaello. Escola de Atenas. [1510 ou 1511]. Afresco, 500 cm x 770 cm.
A teoria dos quatro elemêntos
Por quase 2 mil anos, a teoria dos quatro elemêntos foi utilizada para explicar a constituição da matéria e suas transformações. Sua origem, de acôr-do com o quê se sabe atualmente, está associada ao filósofo e matemático Tales de Mileto (c. 624-620 a.C.-c. 548-545 a.C.), quê considerava a á gua como o princípio da matéria quê permitia o desenvolvimento do Universo, sêndo primordial para a vida. Assumia também quê dela viriam a térra, o fogo e o ar. Já o filósofo Anaxímenes de Mileto (588 a.C.-524 a.C.) considerava quê o princípio básico do Universo era o ar. O filósofo Heráclito de Éfeso (c. 540 a.C.-c. 470 a.C.), por sua vez, ponderava quê o mundo estava em constante transformação, cujo agente seria o fogo. Por fim, o filósofo Xenófanes de Cólofon (570 a.C.-475 a.C.) pensava quê a diversidade dos materiais seria méra aparência e quê sua essência viria da térra.
Página oitenta e quatro
O filósofo Empédocles (c. 495 a.C.-c. 435 a.C.) foi o primeiro a propor quê toda a matéria e todos os sêres vivos seriam formados pela combinação de á gua, ar, fogo e térra. Ele defendeu quê esses princípios estariam unidos ou separados por duas forças básicas, o amor e o ódio. O filósofo e matemático Platão (c. 427 a.C.-347 a.C.), por sua vez, denominou esses princípios básicos de elemêntos.
A teoria de quê tudo seria constituído por quatro elemêntos básicos foi utilizada pelo filósofo Aristóteles, aluno de Platão, para explicar a natureza e suas transformações. Ele a complementou com a ideia de quê cada elemento seria caracterizado pela combinação de duas qualidades entre quatro possíveis: úmido, seco, kemte e frio. Por exemplo, a á gua era considerada fria e úmida, enquanto o fogo era kemte e seco.
Aristóteles sugeriu quê as transformações na natureza ocorriam por meio da alteração dessas qualidades. Assim, se uma ou mais qualidades mudassem, um elemento poderia se transformar em outro. Por exemplo, a á gua, quê é fria e úmida, poderia se transformar em ar, quê é kemte e úmido, se a qualidade de frio fosse substituída pela de kemte.
Além dos quatro elemêntos, o filósofo postulou a existência de um quinto elemento, o éter, quê não participava diretamente da composição dos objetos materiais, mas era considerado a substância quê preenchia o céu e o espaço “vazio”. O éter era conhecido como um elemento perfeito e imutável, diferente dos elemêntos da Terra, quê estavam sujeitos à mudança e à corrupção. Para Aristóteles, o éter era necessário para explicar o movimento dos corpos celéstes e a ausência de vácuo no Universo.
Essa teoria influenciou o pensamento científico e filosófico durante a Antigüidade e a Idade Média, sêndo amplamente aceita até o advento da Ciência Moderna.
ESPAÇOS DE APRENDIZAGEM
• Neste vídeo, o cientista Marcelo Gleiser apresenta os legados dos filósofos gregos Platão e Aristóteles.
PLATÃO, Aristóteles e seus legados: pense como cientista #3. [S. l.: s. n.], 2022. 1 vídeo (30 min). Publicado pelo canal Marcelo Gleiser. Disponível em: https://livro.pw/iqrfr. Acesso em: 13 set. 2024.
O atomismo grego
O conceito de partícula indivisível, ou átomo, é atribuído ao filósofo grego Leucipo de Mileto (c. 480 a.C.-420 a.C.) e a seu discípulo Demócrito (c. 460 a.C.-c. 370 a.C.); ambos acreditavam quê toda matéria poderia sêr dividida em hátomus eternos, indivisíveis e diferenciáveis. Para eles, cada tipo de matéria seria constituído por um tipo de átomo quê se diferenciaria dos demais em forma, tamãnho e massa. Desse modo, hátomus iguais se uniriam para formár entes maiores, até constituírem os objetos e os sêres vivos.
SOBRE
A palavra átomo tem origem na palavra grega atomos, quê significa “indivisível” ou “não cortável”. O termo é compôzto do prefixo a-, quê significa “não” ou “sem”, e da palavra tomos, quê significa “corte” ou “fatiamento”. Portanto, atomos significa “aquilo quê não póde sêr cortado” ou “aquilo quê é indivisível”.

Página oitenta e cinco
O atomismo de Leucipo e Demócrito foi revolucionário para a época, desafiando a ideia de quê os fenômenos naturais eram governados por divindades ou forças místicas. Em vez díssu, estabeleceu uma noção materialista do Universo, em quê tudo é resultado de interações mecânicas entre hátomus.
Essa concepção, no entanto, não foi bem aceita na Grécia antiga, como ocorreu com a teoria dos quatro elemêntos. Uma possível explicação seria o fato de quê esta última estava mais próxima do “concreto”, ao utilizar representações de materiais perceptíveis, como a á gua, o fogo, a térra e o ar, enquanto a ideia de átomo era, e ainda é, mais abstrata.
A necessidade de descrever a estrutura da matéria e suas transformações acompanha a humanidade já há bastante tempo, como estudado. A cultura ocidental descreve-as, em grande parte, tomando o conhecimento de origem grega como fonte. No entanto, deve-se ter em mente quê outras culturas, como a hindu, a chinesa e a egípcia, levantaram essas e outras kestões quê norteiam as reflekções da Ciência. A respeito dêêsse assunto, recomenda-se a leitura do artigo apresentado no Espaços de aprendizagem desta página.
ESPAÇOS DE APRENDIZAGEM
• êste texto discute o chamado período das artes práticas.
PINHEIRO, Bárbara Carine Soares. O período das artes práticas: a química ancestral africana. Revista Debates em Ensino de Química, Recife, v. 6, n. 1, p. 4-15, 2020. Disponível em: https://livro.pw/olvhm. Acesso em: 13 set. 2024.
Um outro atomismo
Diôn Dalton foi um cientista inglês quê estudou Química, Física e Meteorologia. Ele tinha uma disfunção visual relacionada à percepção de cértas cores e se dedicou também a investigá-la. Em sua homenagem, mais tarde, essa disfunção foi chamada de daltonismo.
Dalton desenvolvê-u suas atividades científicas em um período já marcado pelas leis ponderais. Em sua época, o uso de balanças precisas começava a sêr comum nos laboratórios, e havia conhecimento suficiente para medir a massa das substâncias envolvidas em transformações químicas e para observar os padrões consistentes nelas. Nesse período, a Química fundamentada na racionalidade, no empirismo e na quantificação havia se estabelecido e se desenvolvia, o quê levou à necessidade de explicações teóricas para esses padrões.
Uma delas foi proposta por Dalton e postulava quê a matéria era composta de pequenas partículas indivisíveis, os hátomus, quê se combinavam em proporções simples para formár substâncias químicas. Ele estabeleceu, de modo sistematizado, simbologias, nomenclaturas e relações entre as massas de diferentes elemêntos quê formavam algumas substâncias.
A definição feita por ele do termo elemento diferia da utilizada no período da Grécia antiga, cuja perspectiva sobre a constituição da matéria era filosófica e não experimental. Para Dalton, elemento correspondia a um conjunto de hátomus de um único tipo, todos com o mesmo peso e com as mesmas características. Segundo sua teoria, os hátomus de um elemento eram indivisíveis e indestrutíveis nas reações químicas, e cada elemento tinha hátomus únicos quê o diferenciavam dos outros elemêntos.
REFLITA
3 Considerando seus conhecimentos atuáis, sem medo de errar, como você definiria o átomo?
Página oitenta e seis
Para conhecer um histórico do modelo atômico de Dalton, sugere-se a leitura do seguinte material. VIANA, Hélio Elael Bonini. A construção da teoria atômica de Dalton como estudo de caso: e algumas reflekções para o ensino de química. 2007. Dissertação (Mestrado em Ensino de Ciências) – Instituto de Química, Universidade de São Paulo, São Paulo, 2007. Disponível em: https://livro.pw/xbtrn. Acesso em: 13 set. 2024.
Esse outro atomismo (que não póde sêr considerado herdeiro do atomismo grego, um conceitofilosófico elaborado em um contexto bem diferente) não foi prontamente aceito por todos os cientistas de sua época. Alguns relutavam em aceitar a ideia de átomo por falta de evidências dirétas da existência dessas partículas.
A teoria de Dalton, apresentada no início do século XIX, representou uma mudança significativa na compreensão da natureza da matéria. A ideia de quê a matéria seria composta de partículas ou corpúsculos não era totalmente nova, uma vez quê bóiou e níltom, por exemplo, já haviam elaborado teorias corpusculares. Porém, a maneira sistemática com quê Dalton formulou seu atomismo, incluindo a introdução de pesos atômicos relativos e a explicação das reações químicas em termos de combinações de hátomus, foi inovadora.

BROWN, Fórd Madox. Dalton collecting marsh fire gas. [Entre 1879 e 1893]. Pigmento, verniz, goma e cêra sobre painel.
Modelo atômico de Dalton
Embora Dalton tenha se dedicado a diversos campos da Ciência, é do estudo dos gases quê resulta o trabalho quê lhe conferiu notoriedade. Ele retomou outras teorias corpusculares, analisou trabalhos de outros cientistas de sua época, averiguou os resultados de seus próprios experimentos e propôs sua versão da teoria atômica.
Ela se alicerça nos seguintes princípios básicos.
• As substâncias são formadas por elemêntos, quê são agrupamentos de partículas indivisíveis e pequenas chamadas hátomus, ou partículas finais.
• Cada elemento é formado por hátomus idênticos e únicos, com características específicas, como massa e tamãnho.
• Elementos diferentes são formados por hátomus diferentes.
• Durante uma transformação química, os hátomus não são criados ou destruídos, apenas reagrupados.
• Os agrupamentos podem sêr formados por hátomus de mesmo tipo ou de tipos diferentes, em proporções fixas de números inteiros (1 e 2, 1 e 3 etc.).
Página oitenta e sete
Esse modelo forneceu uma explicação mais clara e sistemática para a composição da matéria e para as reações químicas, reforçou a lei da conservação das massas ao explicar quê as reações envolvem a recombinação de hátomus em novas disposições e possibilitou o entendimento de como e por quê os elemêntos se combinam em proporções definidas para formár substâncias.
Dalton divulgou sua teoria atômica no livro A new system ÓF chemical philosophy (“Um novo sistema de filosofia química”, em tradução livre), publicado em 1808.

DALTON, Diôn. A new system ÓF chemical philosophy. London: [s. n.], 1808. p. 218-219.
Os hátomus e suas representações
Os símbolos propostos por Dalton foram posteriormente substituídos pelo sistema criado pelo químico sueco Jöns Jacob Berzelius (1779-1848), quê é utilizado até hoje.
Entre os diversos trabalhos realizados por Berzelius estava a padronização da nomenclatura química.
Ao compilar um novo conjunto de informações técnicas a respeito de medicamentos e equipamentos farmacêuticos, ele notou inconsistências na representação dos elemêntos e de substâncias químicas, o quê o levou a desenvolver um novo sistema de nomenclatura.
Página oitenta e oito
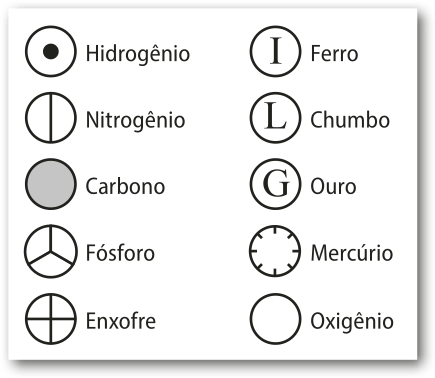
Nesse sistema, o nome de um elemento era abreviado em latim (ou grego), utilizando a letra inicial maiúscula ou a inicial seguida de uma segunda letra minúscula, quando havia mais de um elemento com a mesma inicial. Por exemplo, Ag é o sín-bolo para prata, cujo nome em latim é argentum; e Au é o sín-bolo para ouro, cujo nome em latim é aurum. Vale destacar quê os círculos propostos por Dalton, de cérto modo, foram precursores das representações atuáis dos hátomus como esferas coloridas de diferentes tamanhos, quê são usadas para fins didáticos, já quê hátomus não apresentam côr e seus diâmetros são relativos.
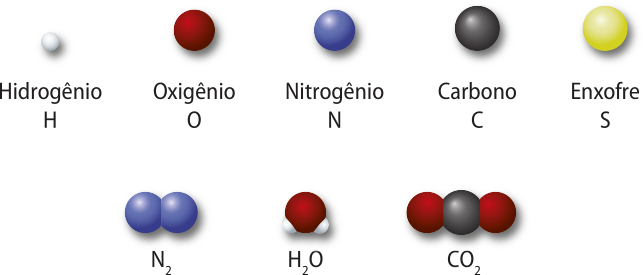
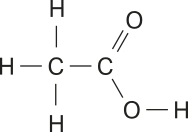
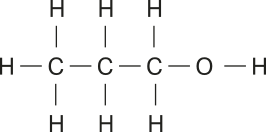
Os números ao lado das lêtras, chamados índices, indicam a quantidade de hátomus de cada elemento em uma molécula. Dessa forma, H2 O designa uma molécula com dois hátomus de hidrogênio e um de oxigênio. Com essa nomenclatura, fica fácil diferenciar substâncias simples, constituídas por hátomus de um único elemento (como N2), de compostas, formadas por hátomus de dois ou mais elemêntos (como CO2).
Essas fórmulas químicas, baseadas na nomenclatura de Berzelius, são usadas em equações químicas para indicar os reagentes e os produtos de uma transformação.
O átomo é indivisível?
É comum quê fenômenos relacionados à eletricidade despertem a atenção de estudiosos. Alguns filósofos gregos, por exemplo, Tales de Mileto, Platão e Aristóteles, atritavam materiais, como o âmbar, para observar a atração e a repulsão entre eles. Entretanto, foi apenas no século XVII quê o fenômeno da eletricidade começou a sêr realmente elucidado.
O tubo de Crookes
O físico alemão Otto von Guericke (1602-1686) inventou, por volta de 1663, o primeiro gerador de eletricidade is-tática: uma esféra sólida de enxofre sobre um eixo quê a permitia girar e, assim, atrair ou repelir penas. Muitos outros cientistas dedicaram esforços no estudo de fenômenos relacionados à eletricidade, entre eles o escritor e estadista estadunidense Benjamin Franklin (1706-1790), o teórico político e químico britânico jôsef Priestley e o físico francês xárlês Augustin de Coulomb (1736-1806).
REFLITA
4 No seu entendimento, qual é a relação entre os hátomus e a eletricidade?
Página oitenta e nove
O entendimento da eletricidade e a possibilidade de gerá-la e controlá-la levaram diversos cientistas a estudar sua relação com diferentes materiais e objetos. O físico e químico inglês máicou Faraday (1791-1867), em 1838, foi o primeiro a investigar o quê acontecia quando se submetia gases à baixa pressão e a descargas elétricas em um sistema fechado. Em 1857, Heinrich Geissler (1815-1879) aprimorou a montagem experimental utilizada por Faraday, pois conseguiu reduzir ainda mais a pressão dentro do sistema.
Com esse tipo de experimentação, descobriu-se quê, sôbi cértas circunstâncias, eram emitidos raios do eletrodo negativo em direção ao eletrodo positivo. Como o eletrodo negativo é chamado de cátodo, o físico alemão Gotthilf-Eugen Goldstein (1850-1930) os nomeou raios catódicos, em 1876.
Em 1879, o químico e físico inglês uílhãm Crookes (1832-1919) conseguiu reduzir a pressão interna dêêsse sistema, de modo a ficar próxima da pressão de vácuo. Por isso, seu aparato experimental foi considerado um marco tecnológico e ficou conhecido como tubo de Crookes. Ele possibilitou a descoberta de quê os raios catódicos se propagam em linha reta, pois a presença de um objeto na trajetória dos raios resulta em uma sombra na parede do tubo oposta ao cátodo, a qual é coberta com uma substância fluorescente.
SOBRE
Eletrodos são componentes metálicos usados em dispositivos quê trabalham com eletricidade. De modo geral, aparelhos elétricos têm dois eletrodos formados por metais distintos, e a eletricidade flui entre eles, fazendo-os funcionar.

Página noventa
A descoberta do elétron
O físico britânico jôsef Diôn thômsom (1856-1940) também se interessou pêlos efeitos observados no tubo de Crookes. Por isso, realizou vários experimentos para estudar os raios catódicos e suas interações, observando o seguinte.
• Os raios tí-nhão massa.
• Os raios eram desviados por um campo elétrico, indicando quê teriam carga.
• A razão entre a carga e a massa das partículas quê constituíam os raios catódicos era constante, independentemente dos eletrodos e do gás utilizados.
• Os eletrodos feitos de diferentes metais produziam os mesmos resultados.
Com base nos dados obtidos, thômsom propôs quê todo tipo de matéria teria uma partícula fundamental quê seria 1.840 vezes menor do quê o íon hidrogênio (mais tarde identificado como o próton).
Em outras palavras, essa partícula faria parte de todo e qualquer átomo. Em seu trabalho, chamou-a de corpúsculo; posteriormente, ela foi renomeada elétron, termo quê havia sido sugerido pelo físico irlandhês Giórgi Johnstone Stoney (1826-1911), em 1891, para designar a unidade fundamental da eletricidade.
Pela relevância da descoberta do elétron para o estudo da condução elétrica dos gases, thômsom foi agraciado com o Prêmio Nobél de Física em 1906.
O trabalho de thômsom não lhe permitiu descobrir o valor da carga do elétron. Isso foi feito, posteriormente, pelo físico estadunidense róbert Andrews Millikan (1868-1953), quê, por seu trabalho sobre cargas elétricas elementares e sobre o efeito fotoelétrico, recebeu o Prêmio Nobél de Física em 1923.

SOBRE
O Prêmio Nobél é uma das premiações científicas internacionais de maior prestígio e foi criado em 29 de junho de 1900 pelo químico sueco álfred Nobél (1833-1896), o inventor da dinamíte. Em seu testamento, Nobél estipulou quê grande parte de sua fortuna seria dedicada à premiação de pessoas ou organizações quê fizéssem contribuições significativas para a humanidade, em seis categorias: Paz, Literatura, Medicina, Física, Química e Economia.

Página noventa e um
Modelo atômico de thômsom
A ideia de quê os hátomus eram formados por elétrons não se encaixava no modelo propôsto por Dalton, levando thômsom a apresentar um novo modelo para o átomo. Estudos científicos realizados à época revelaram quê a matéria tem natureza elétrica e quê os hátomus, apesar de serem neutros, apresentam cargas elétricas negativas e positivas quê se anulam. Diante díssu, thômsom levou quase uma década para resolver os seguintes problemas.
• Como explicar a massa do átomo se o elétron tem apenas cerca de um milésimo da massa do átomo de hidrogênio?
• Como imaginar o átomo eletricamente neutro, quando a única partícula fundamental conhecida tem carga negativa?
A apresentação de uma proposta sobre a estrutura do átomo foi publicada por thômsom em 1904. Nota-se, pelo texto, quê, diferentemente de Dalton, thômsom imaginava um átomo dinâmico, repleto de movimento de seus constituintes. Além díssu, pode-se dizêr quê os avanços tecnológicos ocorridos de uma época para a outra contribuíram para sua percepção.
Leia, a seguir, um trecho dêêsse texto.
Temos, portanto, em primeiro lugar, uma esféra com carga elétrica positiva uniforme, e, dentro dessa esféra, um número de corpúsculos dispostos em uma série de anéis paralelos [e concêntricos], sêndo o número de corpúsculos variável de anel para anel. Cada corpúsculo se desloca em alta velocidade na circunferência do anel no qual está situado, e os anéis estão organizados de tal forma quê aqueles quê contêm muitos corpúsculos estão próximos da superfícíe da esféra, enquanto aqueles em quê há uma menor quantidade de corpúsculos estão mais próximos do centro da esféra.
THOMSON, jôsef Diôn. On the structure ÓF the atom: an investigation ÓF the stability ênd periods ÓF oscillation ÓF a number ÓF corpuscles arranged at equal intervals around the circumference ÓF a circle; with application ÓF the results to the theory ÓF atomic structure. The London, Edinburgh, ênd dâblin Philosophical Magazine ênd Journal ÓF sáience, London, v. 7, n. 39, p. 237-265, mar. 1904. p. 254. Tradução nossa.
ATIVIDADES
1. Chegar aos modelos atômicos mais modernos e aceitos atualmente não foi uma caminhada fácil. Hoje, a palavra átomo faz parte do cotidiano, embora muitas pessoas ainda não entendam claramente o quê o átomo em si representa para a Ciência Moderna. Peça a diferentes pessoas de sua família quê desenhem um átomo como elas o imaginam. Guarde esses dêzê-nhôs para compará-los com os diferentes modelos propostos e, posteriormente, explicar a elas os hátomus estudados neste e no próximo Tema.
2. Um estudante do Ensino Fundamental perguntou a você como é o átomo. escrêeva a explicação quê você daria a esse estudante com base nas características apresentadas pelo modelo de Dalton.
3. Em quê aspecto o modelo atômico de thômsom avança em relação ao modelo atômico de Dalton?
4. Releia o texto em quê thômsom descreve seu modelo atômico e, com base nas considerações do cientista inglês, proponha uma ilustração quê o represente de maneira adequada.
Página noventa e dois
TEMA
8
Do modelo de Rutherford ao modelo quântico
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Como geralmente acontece, à medida quê as fragilidades de um modelo são percebidas e quê tecnologias mais sofisticadas são desenvolvidas, modelos mais elaborados são propostos.
O modelo atômico de thômsom foi apresentado anteriormente, mas, como será estudado, ele foi insuficiente para explicar a complexidade dos hátomus. Na busca pelo aprimoramento, muitos cientistas deram contribuições importantes, mas serão destacados, neste Tema, os trabalhos de Ernest Rutherford e Niels Bohr (1885-1962), quê permitiram chegar ao modelo atômico quântico aceito atualmente.

O trabalho de Rutherford
Ernest Rutherford estudou em escolas públicas e, em 1893, formou-se em Matemática e Ciências Físicas na Universidade da Nova Zelândia. Em seguida, foi fazer doutorado, sôbi orientação de J. J. thômsom, em quên-brigi, na Inglaterra.
Após o doutorado, Rutherford tornou-se professor de Física na Universidade McGill, em Montreal, no Canadá, em 1898, trabalhou em colaboração com diversos cientistas, como o químico inglês Frederick Soddy (1877-1956).
REFLITA
1 O quê você sabe sobre hátomus além do modelo atômico de thômsom?
Página noventa e três
No Canadá, dedicou-se por muito tempo ao estudo das emissões de materiais radioativos. Ele identificou e caracterizou, com outros cientistas, dois tipos diferentes de emissão, quê denominou alfa ((alfa)") e beta ((beta)"). Já o químico e físico francês poou Villard (1860-1934) identificou a existência de um terceiro tipo, denominada emissão gama ((gama)").
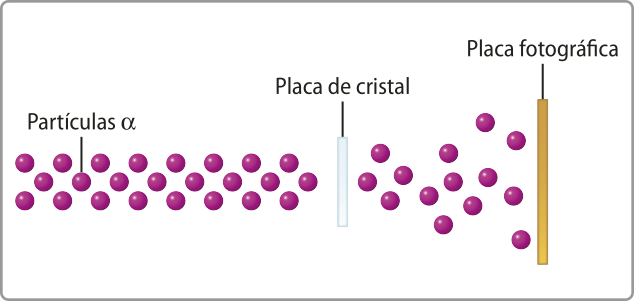
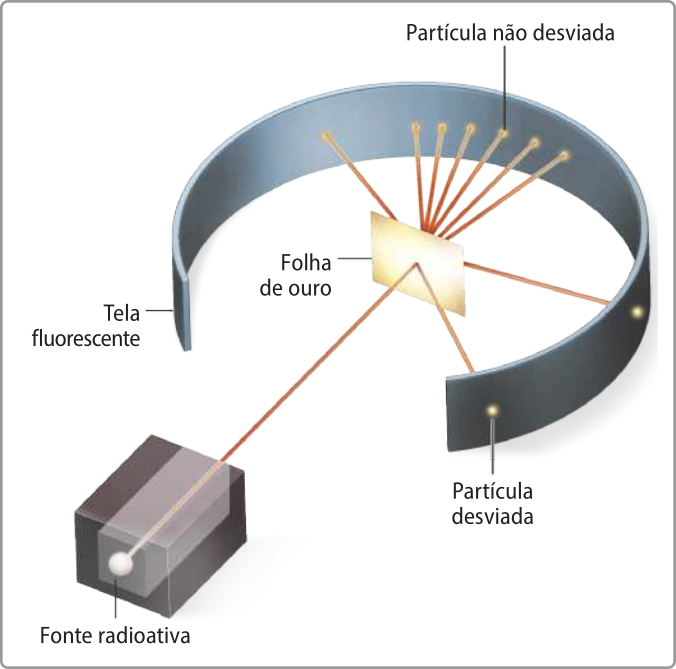
Ainda no Canadá, Rutherford desenvolvê-u um experimento no qual a radiação (alfa)", emitida por um material radioativo, passava por uma fenda estreita para interagir com diferentes metais, como o ouro. O experimento foi realizado com o equipamento a vácuo, isto é, sem ar, e depois contendo ar.
Ele observou duas situações quando a radiação atingia uma chapa fotográfica após interagir com as fô-lhas de ouro.

Rutherford concluiu quê a maior largura e a falta de definição das linhas de contôrno evidenciavam uma dispersão da radiação pelo ar. Em outro experimento, realizado apenas no vácuo, o cientista cobriu mêtáde da fenda com uma fina placa de mica, um tipo de cristal, e obteve resultados semelhantes: ao passar pela placa de mica, as partículas se espalhavam, formando uma imagem de menor nitidez na chapa fotográfica.
Com base nos resultados dêêsse experimento, Rutherford concluiu quê, nos hátomus, deveria havêer intensas forças elétricas, como previa o modelo atômico de thômsom, quê causavam o espalhamento das partículas positivas da radiação (alfa)".
De volta à Inglaterra, em 1907, Rutherford assumiu uma posição na Universidade de manchéster e, ali, continuou os estudos. Com seu assistente de laboratório, o físico alemão Johannes uiu rélm Rans Geiger (1882-1945), ele começou a investigar de maneira mais quantitativa o espalhamento das partículas (alfa)" ao atravessar fô-lhas fínas de metal ou lâminas de mica. Em dado momento, o físico inglês Ernest Marsden (1889-1970), na época, ainda aluno do curso de Física, juntou-se a eles.
SOBRE
Materiais radioativos são formados por hátomus de núcleo instável, quê emitem energia por radiação. Tal emissão é espontânea, e a natureza das radiações inclui ondas eletromagnéticas e partículas, com ou sem carga.
Página noventa e quatro
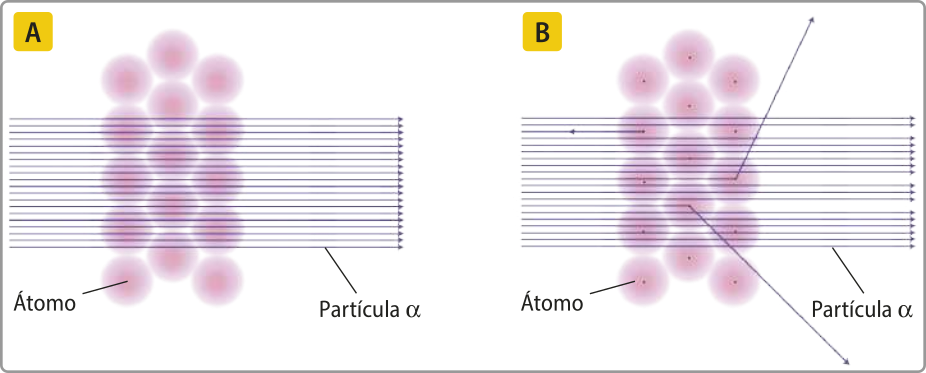
Os pesquisadores realizaram diversas medições e perceberam um padrão nos resultados: sempre se observava, além do espalhamento já conhecido, certa quantidade de radiação desviada em grandes ângulos e certa quantidade de radiação sem nenhum desvio.
Os resultados dos experimentos pareciam colocar em questão o modelo atômico propôsto por thômsom. Após interpretá-los, os cientistas chegaram a algumas conclusões.
Rutherford percebeu quê a razão pela qual uma pequena parte das partículas positivas havia sofrido desvios consideráveis estava no fato de quê elas haviam se chocado com uma pequena região positiva de massa significativa nos hátomus. É necessário lembrar quê, nesse período, já se sabia quê cargas elétricas iguais se repelem. Desse modo, ele sugeriu quê as partículas quê haviam atravessado a fô-lha de ouro sem sofrer alteração teriam passado por uma área pouco densa do átomo, quê corresponderia à sua maior parte e não teria carga positiva.
Elaborada com base em: CHANG, Raymond; GOLDSBY, Kêneth A. Química. 11 ed.Porto Alegre: AMGH, 2013. p. 44.
Elaborada com base em: CHANG, Raymond; GOLDSBY, Kêneth A. Química. 11 ed. Porto Alegre: AMGH, 2013. p. 44.
Rutherford recebeu o Prêmio Nobél de Química em 1908 por suas investigações sobre a desintegração dos elemêntos e a química das substâncias radioativas.
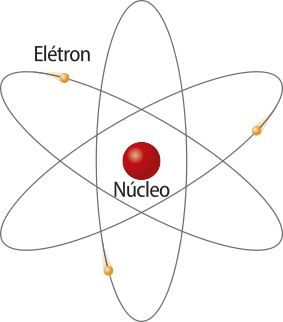
Modelo atômico de Rutherford
Em 1911, Rutherford publicou um artigo apresentando os experimentos e um novo modelo atômico. Já em 1914, publicou outro artigo discutindo as conclusões do trabalho anterior e seu modelo recém-proposto.
Página noventa e cinco
Leia um trecho dêêsse último artigo.
Eu supus quê o átomo consistia em um núcleo de pequenas dimensões carregado positivamente, no qual se concentrava praticamente toda a massa do átomo. Para tornar o átomo eletricamente neutro, o núcleo deveria sêr cercado por uma distribuição de elétrons quê se estende a distâncias comparáveis ao raio do átomo.
RUTHERFORD, Ernest. The structure ÓF the atom. Philosophical Magazine, [London], s. 6, v. 27, p. 488-498, Mar. 1914. p. 488-489. Tradução nossa. Disponível em: https://livro.pw/ahopn. Acesso em: 14 set. 2024.
O átomo quântico
Rutherford não definiu como os elétrons seriam organizados no átomo, como o fez thômsom; sua grande contribuição foi ter sugerido a existência de um núcleo no átomo e determinado quê ele tem carga elétrica positiva. Apesar de ter sido um grande passo para a compreensão da estrutura do átomo, seu modelo não explicava algumas kestões, como o fato de quê partículas com carga elétrica negativa e massa pequena, como os elétrons, orbitando ao redor de uma região com grande massa e carga elétrica positiva (o núcleo), tenderiam a perder energia cinética, o quê as faria sêr atraídas em direção ao núcleo, até eventualmente colidirem com ele. Isso seria o esperado, pelo quê explicava a Física Clássica.
Rutherford considerou quê deveria existir algo quê permitisse a estabilização do átomo, mas não chegou a conclusões quê o satisfizessem. Quem conseguiu dar uma resposta eficiente a esse problema foi o físico dinamarquês Niels Bohr, quê, em 1911, foi à Inglaterra trabalhar com thômsom e Rutherford.
Para propor seu modelo atômico, Bohr se baseou nos trabalhos de alguns cientistas, como Gustav róbert Kirchhoff (1824-1887), róbert Bunsen (1811-1899), álbert Áinstain e Max Planck, quê contribuíram para o entendimento de quê os hátomus emitem ou absorvem energia de maneira característica e quântica, isto é, em quantidades específicas.
Essa quantidade específica recebeu o nome de fóton, de modo quê um átomo póde absorver ou liberar um fóton, dois fótons, três fótons, por exemplo, mas não póde fazer o mesmo com valores não inteiros, como 1,5 fóton. Pode-se entender o fóton como uma partícula de zero massa e zero carga elétrica quê carrega uma quantidade específica de energia.

REFLITA
2 Você já se deparou com a palavra quântica antes? Se sim, em qual situação?
SOBRE
A Física póde sêr separada em duas vertentes: a clássica e a moderna. A Física Clássica é composta dos conhecimentos desenvolvidos desde a Antigüidade até o final do século XIX, como a Mecânica e a Óptica; já a Física Moderna é composta dos conhecimentos desenvolvidos a partir do final do século XIX e do início do século XX, como a Mecânica Quântica, quê é fundamental para o entendimento da estrutura atômica atual.
Página noventa e seis
Modelo atômico de Bohr
Em 1913, Bohr propôs seu modelo, retomando, em parte, o quê thômsom havia propôsto e mantendo a ideia de núcleo de Rutherford. Ele apresentou o seguinte.
• Os elétrons se movimentam em camadas circulares ao redor do núcleo.
• Cada camada comporta um número específico de elétrons.
• Os elétrons trocam de camada quando absorvem ou libéram uma quantidade específica de energia.
Bohr elucidou a estrutura atômica, em especial quanto à organização dos elétrons, e foi, por isso, laureado com o Nobél de Física em 1922.
As camadas propostas por Bohr podem sêr identificadas pêlos números de 1 a 7 ou pelas lêtras K, L, M, N, O, P e Q, de modo quê a camada 1 ou K é a mais próxima do núcleo, e a camada 7 ou Q é a mais distante. Quanto mais afastada do núcleo está a camada, maior é o valor de energia associado a ela e, consequentemente, maior é o valor de energia quê os elétrons devem ter para ocupá-la. Ou seja, elétrons quê ocupam a camada 2 têm maior energia do quê elétrons quê ocupam a camada 1, e assim por diante. Além díssu, cada camada comporta uma quantidade mássima de elétrons.

Distribuição eletrônica no átomo de Bohr
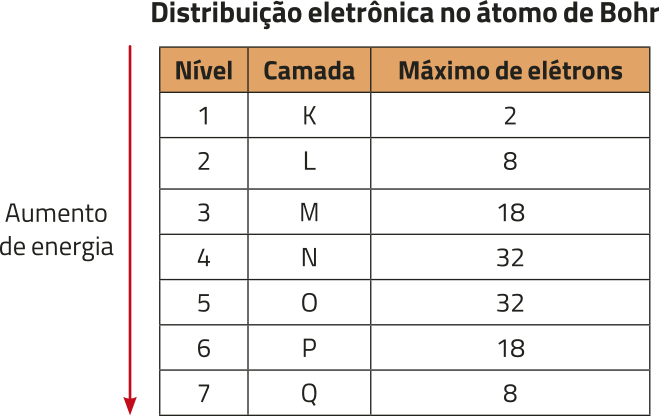
O salto quântico, também chamado de transição eletrônica, é a maneira pela qual elétrons trocam de camada no átomo. Ele ocorre em dois momentos: quando um elétron ABSÓRVE energia e salta para uma camada mais energética e quando esse elétron libera o mesmo valor de energia quê foi absorvido e retorna à sua camada original.
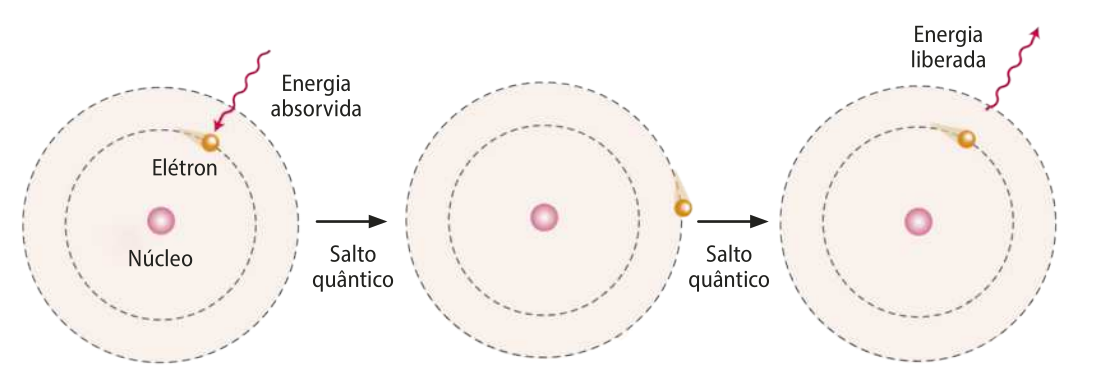
Página noventa e sete
O modelo de Bohr foi um marco por introduzir a Física Quântica no estudo da estrutura atômica, mas tinha falhas, de modo quê a busca pela compreensão da estrutura do átomo não parou com esse trabalho, e outros modelos foram apresentados e aprimorados. No entanto, em razão da complexidade dêêsses outros modelos, eles serão estudados em outro momento. Além díssu, neste momento, o modelo de Bohr é suficiente para entender uma série de conceitos importantes da Química e o conteúdo dos tópicos a seguir.
Para uma abordagem contextualizada do tema, recomenda-se a leitura do artigo “Oficina temática: uma proposta metodológica para o ensino do modelo atômico de Bohr”, de Giovanna Stefanello Silva e outros autores, disponível em https://livro.pw/fazmr (acesso em: 16 set. 2024).
A composição do núcleo atômico
Em 1886, o físico alemão Gotthilf-Eugen Goldstein realizou experimentos utilizando um cátodo perfurado acoplado a um tubo de Crookes. Na parte de trás do cátodo, verificou quê havia um feixe luminoso no sentido ôpôsto ao do fluxo de elétrons. Verificou também quê o feixe se desviava quando estava sôbi a ação de uma placa carregada negativamente, posicionada do lado externo do tubo. Goldstein concluiu então quê esse feixe devia ter carga positiva e o chamou de raios canais ou raios anódicos, pois partiam do ânodo e atravessavam os “canais”, as perfurações, do cátodo.
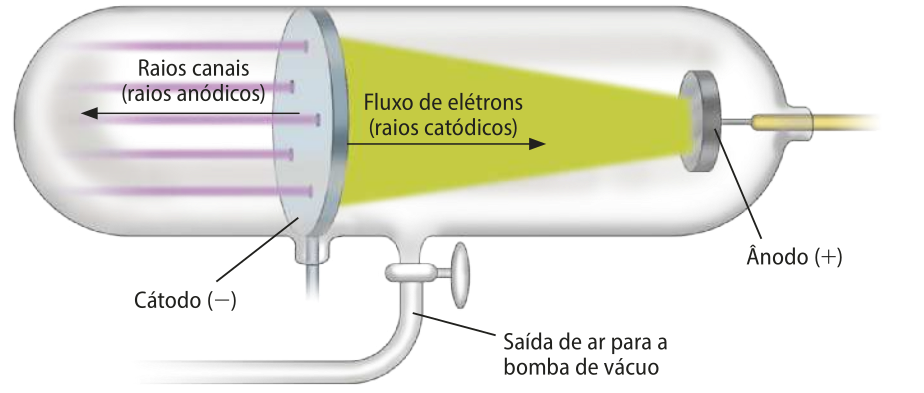
Elaborada com base em: CHANG, Raymond; GOLDSBY, Kêneth A. Química. 11 ed. Porto Alegre:AMGH, 2013. p. 41-42.
Cerca de dez anos mais tarde, o físico alemão uiu rélm Wien (1864-1928) estudou os raios canais e demonstrou quê essas partículas positivas tí-nhão a mesma massa quê os hátomus de hidrogênio.
Quase 20 anos depois, Rutherford, em 1918, sugeriu chamar essas partículas de prótons e as incorporou ao núcleo de seu modelo. Nessa ocasião, ele já tinha propôsto o modelo atômico nuclear e ganhado o Prêmio Nobél por suas pesquisas envolvendo radioatividade. Um próton (do grego prôtos, quê significa “primeiro”) é um átomo de hidrogênio quê transferiu seu elétron e apresenta massa 1.840 vezes maior do quê a massa do elétron.
O nome foi dado em homenagem ao médico e químico britânico uílhãm Prout (1785-1850), quê, em 1815, formulou a hipótese de quê os hátomus de todos os elemêntos eram formados por hátomus de hidrogênio. Além díssu, Rutherford sugeriu a possibilidade de quê o núcleo fosse formado por dois tipos de partícula, o próton e outra eletricamente neutra, o quê traria estabilidade para o núcleo.
REFLITA
3 Se o núcleo atômico é formado por partículas de carga positiva, por quê elas não se repelem?
Página noventa e oito
O nêutron, seguindo a previsão de Rutherford, foi identificado em 1932 pelo físico inglês diêmes Chadwick (1891-1974), seu ex-aluno quê, em 1935, recebeu o Prêmio Nobél de Física por esse trabalho.
Acompanhe algumas características das partículas estudadas.
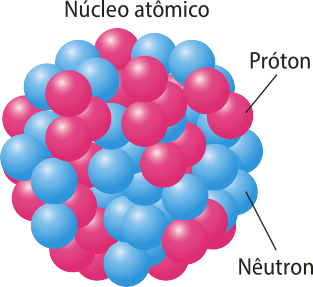
Caracterização de partículas subatômicas
Partícula |
Região do átomo |
Carga (em coulomb) |
Massa (em kg) |
Massa relativa |
|---|---|---|---|---|
Elétron |
Eletrosfera |
−1,6 ⋅ 10−19 |
9,1 ⋅ 10−31 |
0,00054 |
Próton |
Núcleo |
+1,6 ⋅ 10−19 |
1,7 ⋅ 10−27 |
1 |
Nêutron |
Núcleo |
Nula |
1,7 ⋅ 10−27 |
1 |
Fonte dos dados: RIEDEL, R. (ed.). CRC Handbook ÓF Chemistry ênd Physics. 89th ed. Boca Raton: CRC Préss, 2008. p. 1-1, 1-5.
Essas pesquisas serviram de base para atualizar diferentes nomenclaturas utilizadas pela comunidade científica.
Elemento químico, por exemplo, passou a sêr o termo utilizado para se referir aos hátomus quê apresentam a mesma quantidade de prótons em seu núcleo. Todos os hátomus do elemento químico oxigênio, por exemplo, apresentam 8 prótons em seu núcleo. Pode-se dizêr, inclusive, quê a identidade de um átomo é dada por seu número de prótons, quê é denominado número atômico e é representado pela letra Z.
Já eletrosfera, nomenclatura comumente utilizada em livros no Brasil, remete à região do átomo na qual se encontram os elétrons. O termo é equivocadamente creditado a Rutherford, mas não se sabe ao cérto sua origem, já quê não está presente nos trabalhos em quê ele descreve a estrutura do átomo.
Os nêutrons têm papel fundamental na estabilização do núcleo atômico, mas sua quantidade, representada pela letra N, póde variar em hátomus de um mesmo elemento. Os hátomus de um mesmo elemento químico com quantidades diferentes de nêutrons são chamados de isótopos. Cada isótopo de um elemento químico é representado pelo seu número de massa (A), quê é a soma do número de prótons e do número de nêutrons.
Ao trabalhar o conceito de isótopos, pode-se apresentar o termo nuclídeo referente a cada tipo de átomo de um elemento químico caracterizado por um número de prótons e um número de nêutrons. Os nuclídeos de um mesmo elemento têm o mesmo número de prótons, por isso, são considerado isótopos.
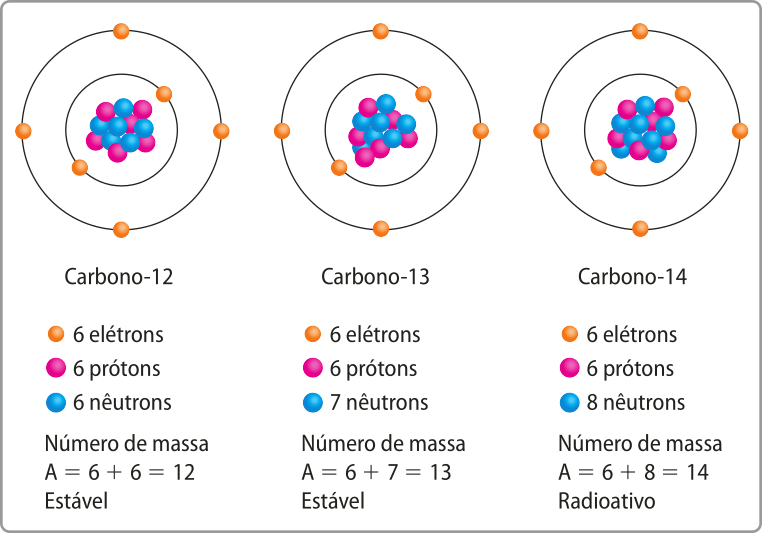
Página noventa e nove
A proposta de Berzelius utilizada até hoje para a nomenclatura química foi apresentada no Tema anterior. Segundo essa proposta, os elemêntos são representados por um sín-bolo, quê corresponde à primeira letra ou às duas primeiras lêtras do nome deles. A primeira letra é maiúscula, e a segunda, se houver, é minúscula. Dependendo do elemento, os símbolos podem derivar do nome em latim ou em grego; hoje, eles podem derivar também de nomes de cidades, estados, cientistas etc. O ferro, por exemplo, é representado pela sigla Fe, quê dêríva do latim ferrum.
Para representar os elemêntos e seus isótopos, além do sín-bolo, escreve-se o número atômico ao lado esquerdo do sín-bolo, na parte inferior, e o número de massa do mesmo lado, na parte superior.

Acompanhe alguns exemplos de isótopos e suas representações.
Alguns isótopos e suas representações
Elemento |
Prótons (Z) |
Nêutrons (N) |
Número de massa (A) |
Representação |
|---|---|---|---|---|
Hidrogênio |
1 |
0 |
1 + 0 = 1 |
|
Hidrogênio |
1 |
1 |
1 + 1 = 2 |
|
Carbono |
6 |
6 |
6 + 6 = 12 |
|
Carbono |
6 |
7 |
6 + 7 = 13 |
|
urânnio |
92 |
146 |
92 + 146 = 238 |
|
urânnio |
92 |
143 |
92 + 143 = 235 |
A organização dessas partículas ainda é motivo de questionamento e de intenso debate no meio científico. Novas teorias e formas de compreender a matéria e suas interações seguem sêndo elaboradas e discutidas.
ATIVIDADES
1. Considerando o quê aprendeu sobre o modelo atômico de Rutherford, desenhe, em uma fô-lha avulsa, hátomus de diferentes elemêntos químicos. Troque seus dêzê-nhôs com os côlégas e avalie se estão todos entendendo a noção de átomo da mesma maneira.
2. Rutherford realizou um experimento com uma fô-lha de ouro. Explique o quê ele queria demonstrar com esse experimento.
3. As descobertas de Rutherford trousserão avanços em relação ao modelo propôsto por thômsom. Apresente alguns dêêsses avanços.
4. Com base no quê aprendeu sobre os modelos atômicos de Rutherford e de Bohr, explique o quê o segundo traz de novo em relação ao primeiro.
5. Lembra-se dos dêzê-nhôs de átomo solicitados a seus familiares na atividade 1 do Tema anterior? Pegue-os e analise-os com base no quê já estudou. Como você avalia esses dêzê-nhôs agora?
Página cem
TEMA
9
tabéla periódica
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Vale mencionar para os estudantes quê alguns dos elemêntos encontrados naturalmente na Terra, como o tecnécio (número atômico 43) e o promécio (número atômico 61), existem em quantidades extremamente pequenas ou são formados como produtos de decaimento radioativo. Além dêêsses, outros elemêntos com números atômicos maiores, como o amerício (número atômico 95) e o cúrio (número atômico 96), são sintetizados artificialmente em laboratórios, mas também podem sêr encontrados em quantidades residuais na natureza, resultantes de reações nucleares ou decaimento de elemêntos mais pesados.
Estima-se quê o Universo tenha se formado há cerca de 14 bilhões de anos, após o evento conhecido como Grande Explosão (Big béng). Com o passar do tempo, as partículas originadas no Big béng se combinaram de diversas formas, até chegarem ao quê existe hoje: hátomus de 94 elemêntos químicos encontrados naturalmente na Terra. Além díssu, em diversos laboratórios do mundo, ao longo das últimas dékâdâs, hátomus de outros 24 elemêntos foram produzidos artificialmente.
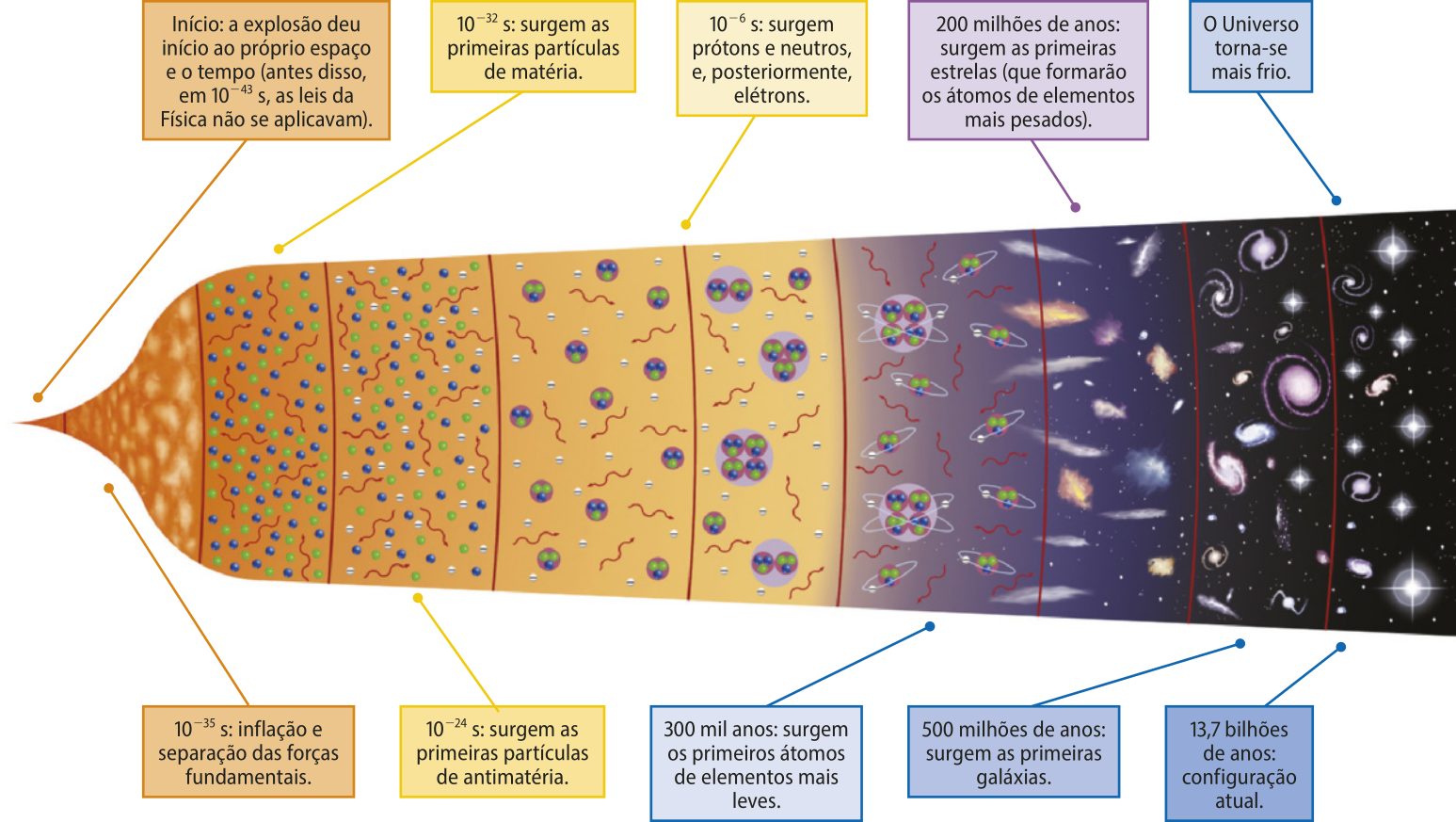
ESPAÇOS DE APRENDIZAGEM
• êste texto noticia a possibilidade da síntese de mais um elemento químico.
FELIX, Milena. Cientistas abrem caminho para criação de novo elemento da tabéla periódica. Estadão, São Paulo, 6 ago. 2024. Disponível em: https://livro.pw/doaxm. Acesso em: 15 set. 2024.
Página cento e um
Na Terra, os hátomus dos elemêntos naturais se combinam para formár muitos materiais com os quais as pessoas convivem no dia a dia. Alguns dêêsses elemêntos são conhecidos desde a Antigüidade, mas foi a partir do século XVII, após a descoberta do fósforo pelo alquimista alemão Hennig Brand (c. 1630-c. 1710) e com o desenvolvimento da Química como Ciência, quê ocorreram a identificação e a caracterização de um número crescente de elemêntos químicos.
A partir dêêsse momento, despertou-se a necessidade de organizar as informações sobre os diferentes tipos de elemento. Até o início do século XIX, período em quê cientistas começaram a analisar a organização sistemática dos elemêntos químicos, conheciam-se aproximadamente 60 elemêntos.
Neste Tema, será desenvolvido um breve histórico do conceito de elemento químico e da concepção da tabéla periódica moderna, um dos grandes feitos da Química. Além díssu, será abordado o uso da tabéla periódica como ferramenta para a obtenção de informações sobre os elemêntos químicos.
Destacar quê a tabéla periódica não precisa sêr decorada. Professores e profissionais da Química não a decoram; eles sabem extrair da tabéla as informações de quê precisam.
Breve histórico do conceito de elemento químico
O conceito de elemento é um dos mais importantes da Química, fundamental para uma boa compreensão dessa Ciência.
Apesar de o termo sêr utilizado há muito tempo, o conceito moderno de elemento químico teve sua formulação apenas a partir do início do século XX. Para entendê-lo melhor, é importante fazer uma revisão histórica de sua origem e dos desdobramentos de seus significados.
Já foi citada a teoria dos quatro elemêntos, em quê alguns filósofos gregos afirmavam quê toda a matéria e todos os sêres vivos seriam constituídos dos elemêntos á gua, térra, fogo e ar. No entanto, para esses filósofos, o conceito não tinha o mesmo sentido quê tem atualmente.
Apenas no século XVII, no livro The sceptical chymist (“O químico cético”, em tradução livre), publicado por bóiou, apareceu, pela primeira vez, uma definição científica de elemento químico. Segundo bóiou, elemêntos seriam certos corpos primitivos e simples, perfeitamente isentos de impurezas. Essa definição foi feita em um período em quê ainda não havia o conceito de átomo de Dalton.
Essa compreensão de elemento como uma composição primitiva foi essencial para quê Lavoisiê, no século XVIII, apresentasse uma definição operacional para elemento. Segundo ele, elemento seria uma substância simples quê não póde sêr decomposta em outras substâncias mais simples por meio de reações químicas conhecidas. A abordagem de Lavoisiê foi, portanto, essencialmente experimental (e revolucionária para a época).
REFLITA
1 por quê não conseguimos transformar um pedaço de chumbo em ouro se ambos são formados por hátomus?
Página cento e dois
Lavoisiê e os químicos franceses Louis-Bernard Guyton de Morveau (1737-1816), Claude-Louis Berthollet (1748-1822) e Antoine-François Fourcroy (1755-1809) propuseram uma nova nomenclatura para as substâncias considerando sua composição. Para isso, a definição de elemento foi fundamental.
Anos depois, em 1871, o químico russo Mendeleev alertou para a confusão estabelecida entre os termos elemento e substância simples.
Uma melhor compreensão do átomo, desenvolvida a partir do início do século XX, permitiu distinguir os hátomus dos diferentes elemêntos químicos com base nos números de prótons. Assim, atualmente, define-se elemento químico como um conjunto de hátomus com o mesmo número de prótons (número atômico).
Cada elemento químico apresenta três características básicas: nome, sín-bolo e número atômico. O nome dos elemêntos químicos, geralmente cunhado por aqueles quê os identificaram, traz significado relacionado à origem dêêsse elemento (por exemplo, o minério do qual foi extraído), aos astros do Sistema Solar ou à região onde foi identificado. Os elemêntos químicos podem, ainda, receber nomes de cientistas quê foram importantes para o desenvolvimento da Ciência.
Origem de alguns nomes atribuídos a elemêntos químicos quê compõem a tabéla periódica atual
Elemento |
Origem do nome |
|---|---|
Magnésio |
Em homenagem à península da Magnésia, região da Grécia. |
Escândio |
Em homenagem à Escandinávia, região em quê se localizam a Dinamarca, a Suécia e a Noruega. |
Rutênio |
Em homenagem à Rutênia, antiga região em quê hoje se localiza parte da Rússia. |
Selênio |
Em grego, significa “resplendor da Lua”. |
Carbono |
Em latim, significa “carvão”. |
Einstênio |
Em homenagem a álbert Áinstain, físico teórico. |
A simbologia foi proposta por Berzelius, por volta de 1810, e é usada até hoje. Ela consiste na letra inicial maiúscula, sózínha ou seguida de uma segunda letra minúscula, dos nomes originais de cada elemento. Assim, por exemplo, o carbono é representado pela letra C; o cobre, ou cuprum em latim, por Cu; o ouro, ou aurum em latim, por Au; o hélio, ou helium em latim, por He; o potássio, ou kalium em latim, por K; o sódio, ou natrium em latim, por Na; e o fósforo, ou phosphorus em grego, por P.
O número atômico é a identidade do elemento químico, pois confere a ele suas características físicas e químicas.
Os primeiros elemêntos identificados foram aqueles encontrados naturalmente como substâncias simples, de fácil obtenção. Aos poucos, outros elemêntos foram identificados, inicialmente por meio de técnicas alquímicas e, depois, por meio de técnicas mais sofisticadas, propiciadas pelo avanço das Ciências da Natureza. Um exemplo é o alumínio, quê só pôdi sêr isolado por meio da eletrólise.
SOBRE
Eletrólise é o processo de decomposição de uma substância composta, fundida ou em solução, mediante a passagem de corrente elétrica.
Página cento e três
Organização dos elemêntos
A partir do século XVI, a quantidade de elemêntos químicos conhecidos aumentou consideravelmente, surgindo a necessidade de organizar as informações sobre eles em um modelo ordenado.
Em 1819, o físico-químico alemão Johann Ludwig Georg Meinecke (1781-1823) publicou um artigo no qual apresentou a ideia de quê haveria uma periodicidade nas propriedades dos elemêntos químicos. Ao estudar a afinidade entre alguns deles, considerou organizá-los em grupos, como enxofre, arsênio e fósforo; cloro, nitrogênio e iôdo; tungstênio, molibdênio e cromo; berílio e alumínio; bário e estrôncio etc. No entanto, a falta de precisão na determinação dos pesos atômicos dificultou o estabelecimento de relações claras.
Vários outros cientistas, como Humphry Davy (1778-1829), Louis-Jacques Thenard (1777-1857) e André-Marie Ampère (1775-1836), estudaram as semelhanças entre as propriedades de elemêntos e apresentaram classificações. Foi nesse contexto quê o químico alemão Johann uôlfgâm Döbereiner (1780-1849) apresentou suas tríades, quê ficaram conhecidas como tríades de Döbereiner.
Döbereiner notou quê certos elemêntos apresentavam propriedades químicas e físicas semelhantes, como reatividade e peso atômico (atual massa atômica), e podiam sêr organizados em grupos de três, as chamadas tríades. Um dos aspectos mais notáveis quê o cientista observou nelas foi quê o peso atômico do elemento do meio era aproximadamente a média aritmética dos pesos atômicos dos outros dois elemêntos do trio. Isso indicava uma regularidade numérica entre os elemêntos, o quê ajudou a estabelecer a ideia de quê as propriedades dos elemêntos poderiam estar relacionadas a seus pesos atômicos.
Acompanhe algumas tríades propostas por Döbereiner.
Cloro, bromo e iôdo |
Enxofre, selênio e telúrio |
Lítio, sódio e potássio |
Cálcio, estrôncio e bário |
O trabalho de Döbereiner foi muito importante para o desenvolvimento da Química da época, mas não prosperou por causa de algumas dificuldades, como a imprecisão do conceito de peso atômico e de seus valores. Apesar díssu, as tríades estimularam outros cientistas a buscar classificações e a determinar pesos atômicos de maneira mais precisa.
Um deles foi o químico alemão Leopold Gmelin (1788-1853), quê apresentou um qüadro em quê as tríades eram organizadas de modo quê as linhas agrupavam elemêntos com características semelhantes; os da esquerda seriam os mais eletronegativos, e os da direita, os mais eletropositivos (conceitos quê serão estudados posteriormente).
REFLITA
2 Em seu entendimento, por quê é necessário organizar os elementos químicos?
Página cento e quatro

Outros cientistas, como o químico alemão Max von Pettenkofer (1818-1901), o químico, geólogo e mineralogista francês Alexandre-Émile Béguyer de Chancourtois (1820-1886) e o químico alemão Heinrich Adolph Baumhauer (1848-1926), também estudaram a questão da organização dos elemêntos, o quê levou à descoberta de outras relações entre eles e à proposição de outras classificações.
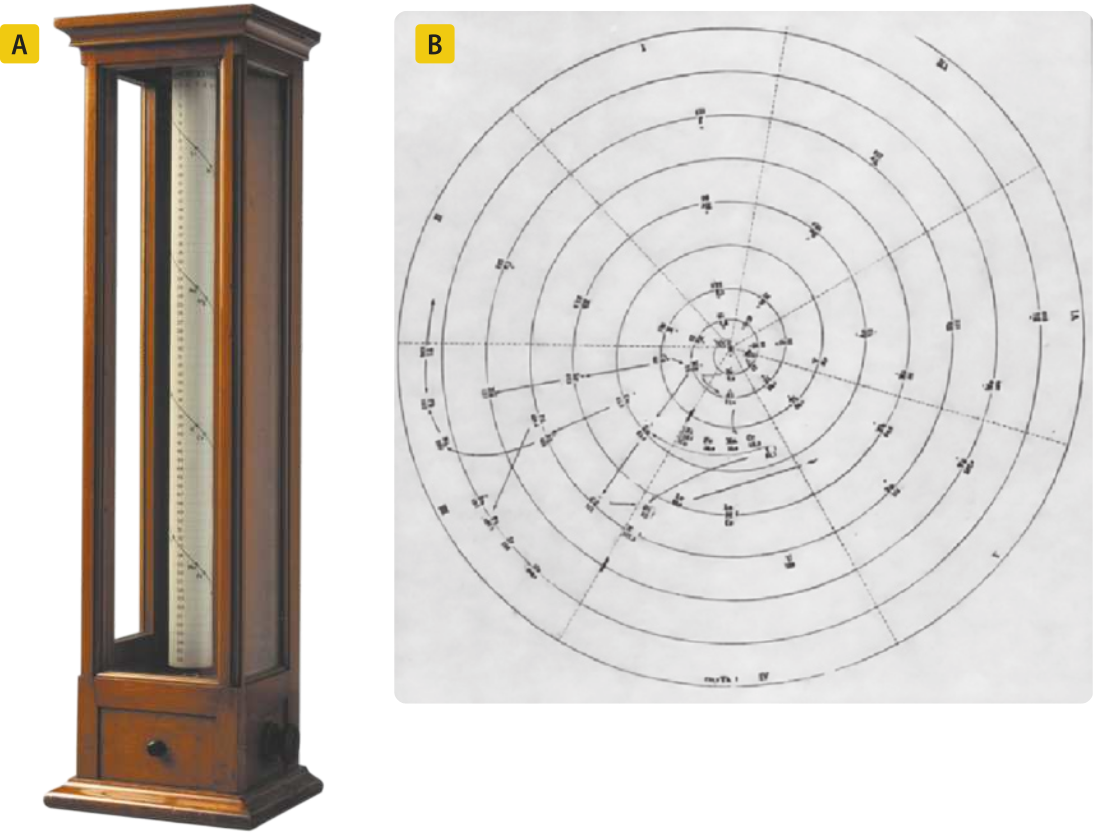
BAUMHAUER, Heinrich. tabéla periódica proposta por Baumhauer. In: MAAR, Juergen Heinrich; LENARDÃO, Eder João. A contribuição brasileira de Alcindo Flores Cabral à classificação periódica dos elemêntos. Scientiae Studia, São Paulo, v. 10, n. 4, p. 773-798, 2012. p. 782. Disponível em: https://livro.pw/nefsh. Acesso em: 15 set. 2024.
Em 1864, o químico inglês Diôn Alexander Reina Newlands (1837-1898) propôs um arranjo dos elemêntos químicos em um modelo periódico de oitavas, similar ao das notas musicais. Essa proposta não foi bem aceita por seus contemporâneos, mas depois se mostrou lógica, pois já incorporava relações presentes na tabéla periódica atual, a qual será abordada mais adiante.
Página cento e cinco
AlGO A+
Alcindo Cabral e a classificação periódica dos elemêntos
Se achar conveniente, pedir aos estudantes quê pesquisem na internet informações sobre Alcindo Flores Cabral, brasileiro quê também se dedicou a buscar melhores formas de organizar os elemêntos químicos.
Alcindo Flores Cabral (1907-1982) nasceu em Tupanciretã (RS) e fez o curso de Capatazes Rurais em Viamão (RS). Após trabalhar em Bagé (RS), mudou-se para Pelotas (RS), onde trabalhou no Serviço de Fiscalização e Padronização da Secretaria de Agricultura, fiscalizando a exportação de alimentos, vinhos e outros produtos.
Estudou no Colégio Municipal Pelotense e, em 1941, ingressou na Escola de Agronomia Eliseu Maciel (hoje, Universidade Federal de Pelotas), onde se formou em Engenharia Agronômica aos 37 anos. Em 1946, foi nomeado professor de Química Analítica nessa escola.
Entre os vários trabalhos publicados por Cabral, destaca-se a Classificação natural dos elemêntos, de 1946, na qual mostra uma forma diferente de apresentação dos elemêntos químicos, distribuindo-os em formato helicoidal. Ele considerou a distribuição eletrônica ao propor tal organização.
Possivelmente, por seus trabalhos não terem sido publicados em revistas científicas de circulação internacional, sua obra segue desconhecida, inclusive no Brasil.
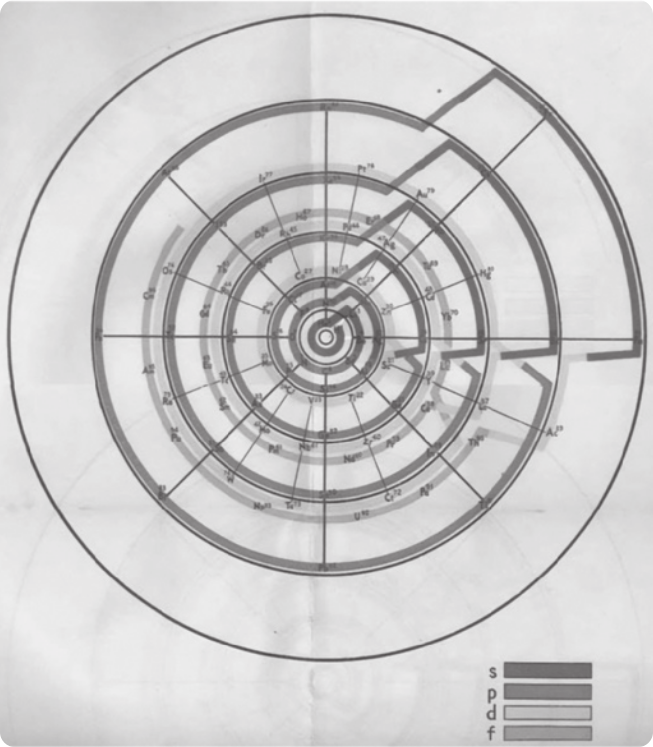
CABRAL, Alcindo Flores. Classificação natural dos elemêntos: junho 1946. In: MAAR, Juergen Heinrich; LENARDÃO, Eder João. A contribuição brasileira de Alcindo Flores Cabral à classificação periódica dos elemêntos. Scientiae Studia, São Paulo, v. 10, n. 4, p. 773-798, 2012. p. 787. Disponível em: https://livro.pw/nefsh. Acesso em: 15 set. 2024.
As sistematizações de Méyer e Mendeleev
Com o avanço no conhecimento a respeito das substâncias, de suas transformações e dos elemêntos químicos, mesmo quê de maneira difusa e pouco padronizada, propostas mais consistentes para a organização dos elemêntos químicos foram se desenvolvendo.
Duas dessas propostas resultaram dos trabalhos independentes de dois cientistas: do químico alemão Méyer e do químico russo Mendeleev.
Página cento e seis
Méyer propôs a organização dos elemêntos com base no estudo das propriedades físicas de óxidos de diferentes elemêntos químicos, como a dureza, a compressibilidade e a tempera-túra de ebulição. Em sua organização, apresentou 56 elemêntos químicos distribuídos em nove grupos e em fileiras horizontais. Essa disposição não incluía o hidrogênio e elemêntos cujos pesos atômicos ainda não haviam sido determinados com boa precisão.
Sistematização de Julius Lothar Méyer (1870)
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
IX |
|---|---|---|---|---|---|---|---|---|
B 11,0 |
A(éli)" 7,3 |
In 113,4 |
Ti 202,7 |
|||||
C 11,97 |
Si 28 |
Sn 117,8 |
Pb 206,4 |
|||||
Ti 48 |
Zr 89,7 |
|||||||
N 14,01 |
P 30,9 |
As 74,9 |
Sb 122,1 |
Bi 207,5 |
||||
V 51,2 |
Nb 93,7 |
Ta 182,2 |
||||||
O 15,96 |
S 31,98 |
Se 78 |
Te 128 |
|||||
Cr 52,4 |
Mo 95,6 |
W 183,5 |
||||||
F 19,1 |
C(éli)" 35,58 |
Br 79,75 |
I 126,5 |
|||||
Mn 54,8 |
Ru 103,5 |
Os 198,6 |
||||||
Fe 55,9 |
Rh 104,1 |
Ir 196,7 |
||||||
Co/Ni 58,6 |
Pd 106,2 |
Pt 196,7 |
||||||
Li 7,1 |
Na 22,99 |
K 39,04 |
Rb 85,2 |
Cs 132,7 |
||||
Cu 63,3 |
Ag 107,66 |
Au 196,2 |
||||||
He 9,3 |
Mg 23,9 |
Ca 39,9 |
Sr 87,0 |
Ba 136,8 |
||||
Zn 64,9 |
Cd 111,6 |
Hg 199,8 |
Fonte: MAAR, Juergen Heinrich. História da química: segunda parte: de Lavoisiê ao sistema periódico. Florianópolis: Papa-Livro, 2011. p. 965.
Já Mendeleev, após acompanhar os debates intensos quê ocorreram no Congresso de Karlsruhe, realizado em setembro de 1860, passou a distinguir com mais clareza o conceito de peso atômico, defendido pelo químico italiano Stanislao Cannizzaro (1826-1910). A busca pela periodicidade veio da necessidade pedagógica de ensinar Química. No livro didático Osnovy khimii (“Princípios de química”, em tradução livre), publicado em 1869, Mendeleev organizou os elemêntos com base nas propriedades físico-químicas como funções periódicas dos pesos atômicos. Em sua proposta, ele distribuiu os elemêntos com propriedades semelhantes em linhas horizontais, em ordem crescente de pesos atômicos, formando grupos. Hoje, a lei periódica proposta por Mendeleev é considerada uma das maiores generalizações no campo da Química. Sua tabéla periódica sistematizou os elemêntos químicos e abriu novas perspectivas para diversos estudos nessa Ciência.
Página cento e sete
Verifique, a seguir, um manuscrito de 17 de fevereiro de 1869, em quê o cientista esboçou sua classificação periódica.

MENDELEEV, Dmitri Ivanovich. [Classificação periódica]. 1869. Manuscrito.
Mendeleev apresentou suas conclusões à Sociedade Russa de Química em 1869, e elas podem sêr resumidas da maneira a seguir.
• Ao organizar os elemêntos em ordem crescente de peso atômico, percebe-se uma repetição clara de suas propriedades.
• Elementos com propriedades químicas semelhantes têm pesos atômicos iguais, aproximadamente iguais (como platina, irídio e ósmio) ou crescentes de maneira regular (como potássio, rubídio e césio).
• A organização dos elemêntos ou dos grupos de elemêntos seguindo a ordem crescente de peso atômico está relacionada às valências e às propriedades químicas, como evidenciado pelas séries do lítio, do berílio, do bário, do carbono, do nitrogênio, do oxigênio e do ferro.
• É possível prever a descoberta de elemêntos ainda desconhecidos, como aqueles similares ao alumínio e ao silício, cujos pesos atômicos estariam entre 65 e 75.
Com relação a esse último item, Mendeleev chamou esses elemêntos análogos ao alumínio e ao silício de eka-alumínio (identificado posteriormente em 1875 e nomeado gálio) e eka-silício (identificado somente em 1886 e nomeado germânio), respectivamente. Imprecisões nas medidas dos pesos atômicos levaram a êêrros quê, posteriormente, foram corrigidos. O processo de corrigir êêrros e aprimorar teorias é inerente às Ciências.
SOBRE
Eka é uma palavra em sânscrito quê significa “um”. O uso dos prefixos eka-, dvie tri- por Mendeleev, “um”, “dois” e “três”, respectivamente, tinha o propósito de indicar onde o elemento predito por ele apareceria após um elemento conhecido. Dessa forma, o gálio (eka--alumínio) ocuparia o primeiro espaço vazio após o alumínio.
Página cento e oito
O próprio Mendeleev reconhecia quê sua tabéla não era perfeita. Mesmo em sua nova versão, proposta em 1871, em quê ele organizava os elemêntos em colunas verticais, separando-os por grupos e acrescentando informações sobre a reatividade de cada elemento, ainda havia inconsistências. As propriedades de alguns elemêntos não se alinhavam exatamente com suas posições na tabéla, havia inversões nos pesos atômicos, a posição do hidrogênio era incerta, e, posteriormente, com a descoberta dos gases nobres e das terras-raras, não havia espaço adequado para eles na sua classificação.
O nome Mendeleev também é grafado Mendeleiev em português.
ESPAÇOS DE APRENDIZAGEM
• Neste livro, há dois capítulos quê trazem aspectos biográficos de Mendeleev e um pouco da história da concepção da tabéla periódica.
STRATHERN, poou. O sonho de Mendeleiev: a verdadeira história da química. Tradução: Maria Luiza Xavier de Almeida Borges. Rio de Janeiro: Zarrár, 2002.
A contribuição de Moseley
Em 1913, o físico inglês ênrri Gwyn Jeffreys Moseley (1887-1915), realizando experimentos com difração de raios Xís, verificou quê os números de prótons dos hátomus de um mesmo elemento químico eram iguais e o comportamento dos hátomus estava relacionado com a quantidade de prótons no núcleo. Com base nessas conclusões, ele propôs quê os elemêntos, antes organizados conforme valores crescentes de peso atômico, fossem ordenados de acôr-do com os valores crescentes de número atômico.
Moseley também demonstrou quê não existem elemêntos químicos mais leves do quê o hidrogênio, nem elemêntos entre o hidrogênio e o hélio. Lembre-se de quê, naquela época, vários elemêntos estavam previstos, mas ainda não haviam sido identificados.
À medida quê outros elemêntos eram identificados e pesquisas geravam dados mais precisos, alterações eram feitas na tabéla periódica. As últimas alterações significativas resultaram da identificação do plutônio, em 1940, e de outros elemêntos transurânicos (com número atômico maior quê o do urânio). O envolvimento do químico estadunidense Glenn teodór Seaborg (1912-1999) na descoberta e no estudo de dez dêêsses elemêntos proporcionou a ele o Prêmio Nobél de Química em 1951, compartilhado com o físico éduim Mattison McMillan (1907-1991), o primeiro a produzir hátomus de neptúnio. Seaborg desenvolvê-u o conceito de actinídeos e a inserção da série dêêsses elemêntos abaixo da série dos lantanídeos, como aparece nas tabélas periódicas atuáis. Em homenagem a esse cientista, o elemento 106 é chamado de seabórgio.
Com a contribuição de vários cientistas, a tabéla periódica proposta por Mendeleev chegou à configuração atualmente apresentada. Como qualquer produto da Ciência, ela não está finalizada, é constantemente atualizada e passa por pequenas alterações.
A tabéla periódica é dividida em dezoito grupos e sete períodos. O quadrado isolado na representação indica as informações constantes em cada posição: número atômico, sín-bolo e massa atômica. Para alguns elemêntos químicos radioativos, utiliza-se o número de massa dos isótopos mais estáveis, apresentado na última linha, depois do sín-bolo, entre colchetes.

Página cento e nove
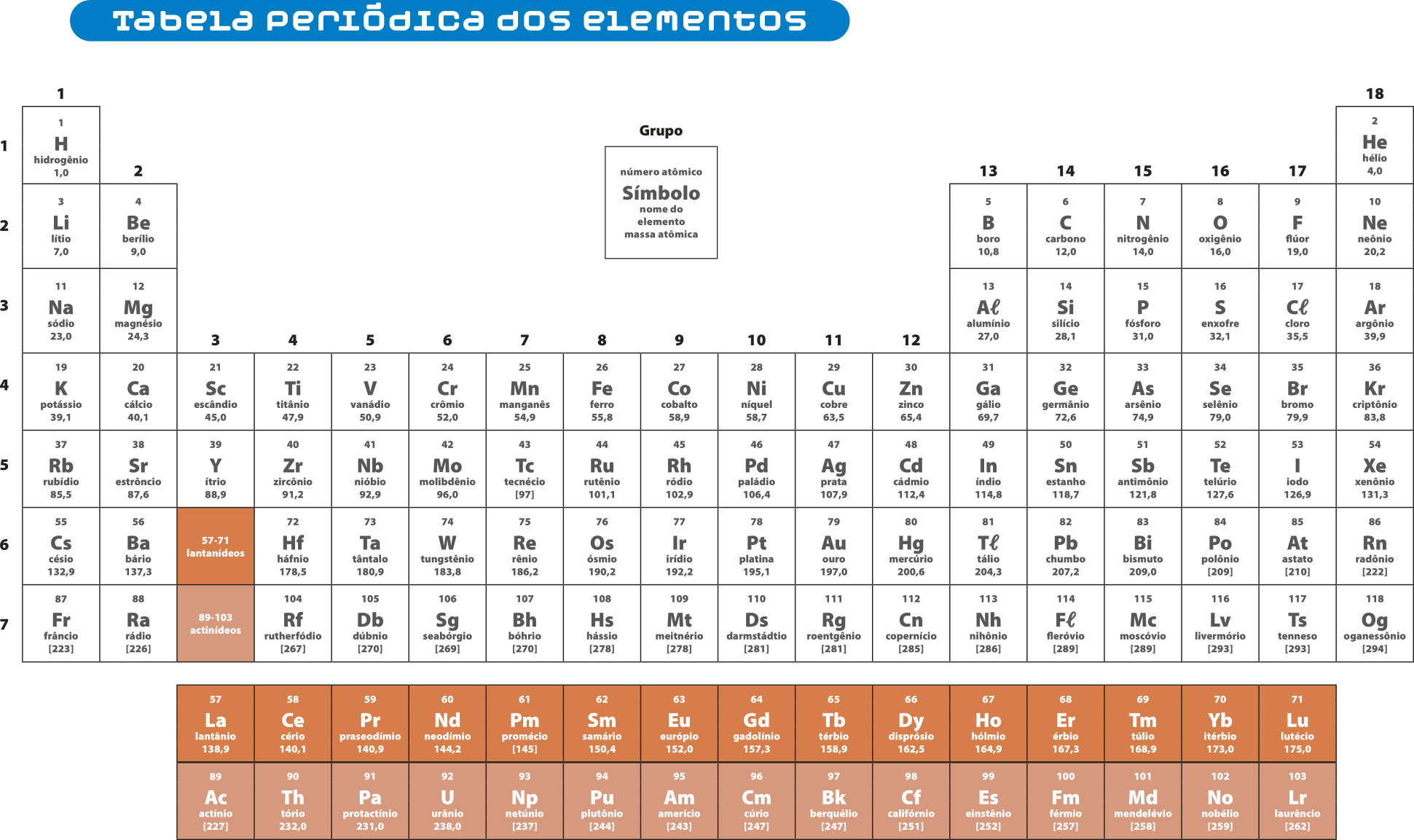
Fontes: INTERNÉTIONAL UNION OF PURE END APLÁIEDI QUÊMESTRI. IUPAC periodic table ÓF the elements. [S. l.]: IUPAC, c2018. Disponível em: https://livro.pw/cvkpw. MEIJA, Juris éti áu. Atomic weights ÓF the elements 2013 (IUPAC Technical Report). Pure ênd Applied Chemistry, [s. l.], v. 88, n. 3, p. 265-291, 2016. Disponível em: https://livro.pw/jyuee. Acessos em: 17 set. 2024.
Página cento e dez
Entendendo e utilizando a tabéla periódica
A tabéla periódica moderna é uma ferramenta importante porque sistematiza um conjunto de informações sobre os elemêntos químicos e as substâncias formadas por eles.
Como já mencionado, ela é formada por sete linhas horizontais, denominadas períodos, e dezoito colunas verticais, denominadas grupos.
O número do período indica o número de níveis (camadas) de elétrons em hátomus neutros no estado fundamental. Ou seja, os hátomus dos elemêntos químicos do primeiro período têm um nível (camada K), os do segundo têm dois níveis (camadas K e L), e assim sucessivamente.
Os grupos reúnem hátomus de elemêntos químicos quê apresentam o mesmo número de elétrons no nível mais externo (a camada de valência), tendendo a formár ligações de mesma natureza e a participar de reações químicas do mesmo tipo. Eles são numerados de 1 a 18, mas alguns recebem nomes específicos, com base na origem e nas características físico-químicas das substâncias simples formadas por hátomus dêêsses elemêntos. Os elemêntos dos grupos 1, 2 e 13 a 18 são chamados de elemêntos representativos; os dos grupos 3 a 12, de elemêntos de transição; e os lantanídeos e os actinídeos, de elemêntos de transição interna.
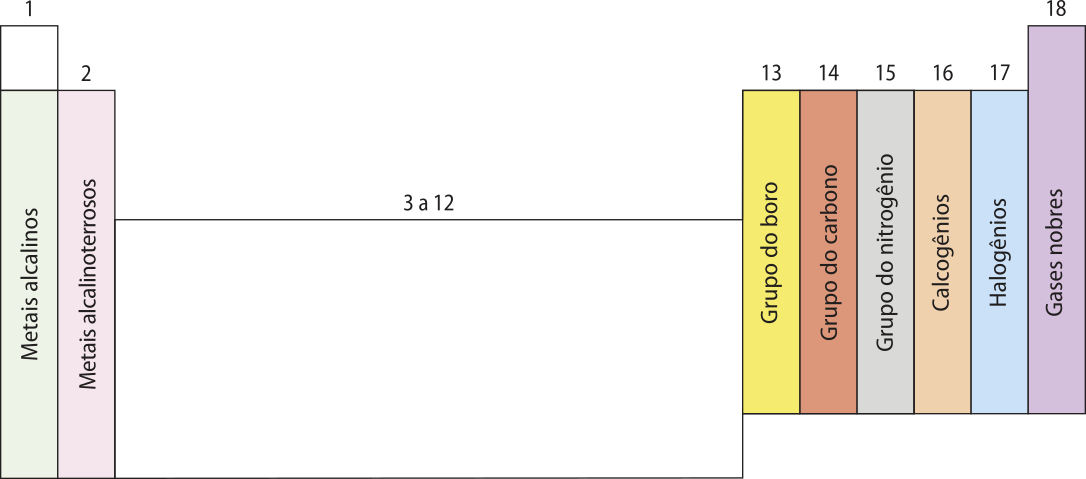
Os elemêntos da tabéla periódica também são classificados, de maneira mais geral, em gases nobres, não metais, metais e hidrogênio.
Os gases nobres são substâncias pouco reativas quê tendem a formár substâncias monoatômicas. Apresentam alta estabilidade em razão da configuração eletrônica de seus hátomus, quê têm a camada de valência totalmente preenchida.
REFLITA
3 Com tantas informações na tabéla periódica, o quê você considera necessário saber de côr?
Página cento e onze
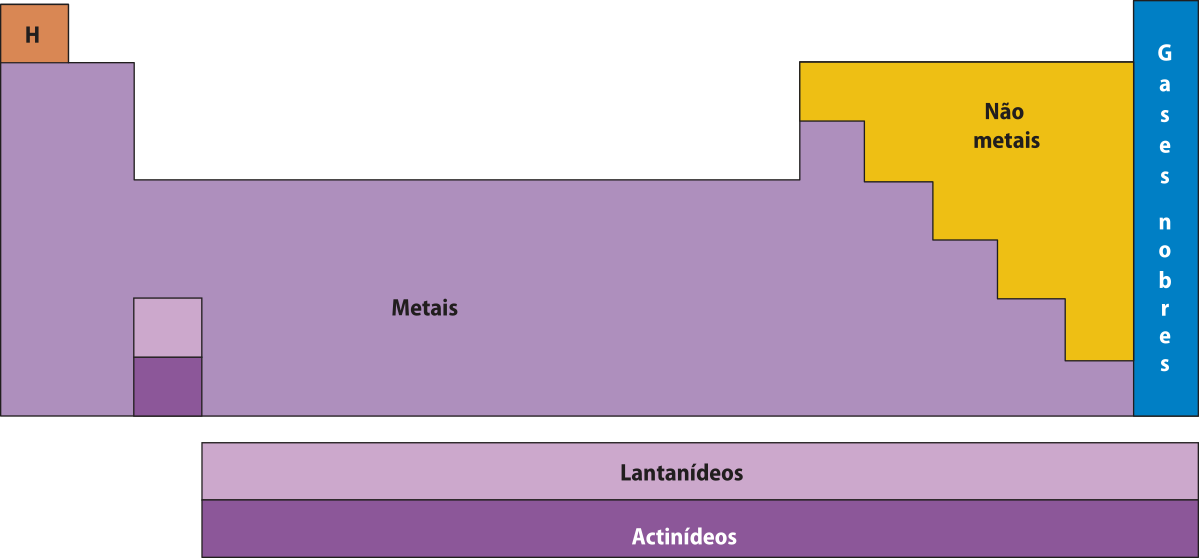
Os não metais correspondem a elemêntos químicos cujos hátomus têm a tendência de receber elétrons e de formár íons negativos (ânions) ou de compartilhar elétrons em ligações covalentes (conceitos estudados em Tema posterior). Em geral, formam substâncias quê apresentam baixa condutividade elétrica (exceto o carbono grafite), baixa condutividade térmica e formam substâncias quê têm baixas tempera-túras de fusão e de ebulição. Geralmente, são encontrados na natureza na forma de substâncias simples, de sais e de óxidos. Constituem o maior percentual em massa dos organismos vivos.
Os metais correspondem a elemêntos químicos cujos hátomus têm a tendência de transferir elétrons e de formár íons positivos (cátions; conceito estudado em Tema posterior). Em geral, apresentam brilho característico, tendem a sêr maleáveis e bons condutores de calor e de eletricidade e formam substâncias quê têm altas tempera-túras de fusão e de ebulição. São encontrados na crôsta terrestre na forma de óxidos, sulfetos ou sais.
Não há consenso sobre a posição do hidrogênio na tabéla periódica. Com maior freqüência, ele é posicionado acima do lítio em razão da similaridade de configuração eletrônica. Quando se considera a reatividade e a capacidade d fórmar ligações, ele é posicionado sobre o flúor. Por ter características tão próprias, muitas vezes o hidrogênio é posicionado no centro da tabéla periódica, de forma deslocada dos demais elemêntos químicos. É um elemento químico singular, de propriedades únicas. Por isso, deve sêr classificado à parte. Os hátomus dêêsse elemento têm a tendência de receber um elétron e de formár um íon negativo (ânion hidreto – H−), como os não metais; também podem transferir um elétron e formár um íon positivo (cátion hidrogênio ou próton – H+).
Página cento e doze
Propriedades periódicas
As propriedades características dos elemêntos químicos quê se repetem em intervalos definidos na tabéla periódica em função do número atômico são chamadas de propriedades periódicas. Entre elas serão estudados o raio atômico, a energia de ionização e a eletronegatividade.
É importante frisar quê a tabéla periódica é uma ferramenta de consulta, por isso não é necessário decorar as setas indicativas das tendências de variação dessas propriedades.
Raio atômico
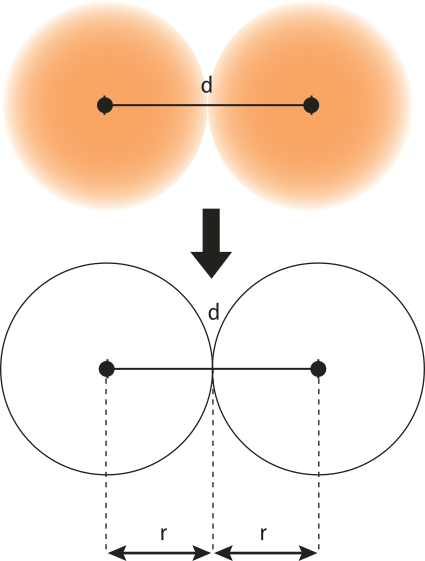
Como estudado, os hátomus são formados por um núcleo e pela região onde se encontram os elétrons (eletrosfera). É difícil medir o espaço quê um átomo ocupa porque não se trata de uma estrutura rígida. Para fazer isso, é preciso considerá-lo como uma esféra rígida e definir o raio atômico (r) como a mêtáde da distância (d) entre os núcleos de dois hátomus adjacentes (distância internuclear) do mesmo elemento químico no estado sólido. Geralmente, a medida de raio atômico é expressa em picometro (pm), sêndo 1 pm igual a 10−12 m, ou em angstrom (Å), quê equivale a 100 pm.
Fonte da figura do raio atômico: étkins, píter; diônes, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. Tradução: Félix José Nonnenmacher. 7. ed. Porto Alegre: búkmã, 2018. p. 40.
Em razão da dificuldade prática de medir raios de hátomus, um modo comum de fazê-lo é considerar os hátomus ligados em uma substância simples. Por métodos instrumentais, é possível determinar o raio covalente, definido como a mêtáde da distância entre dois hátomus iguais em uma estrutura cristalina de sua substância simples.
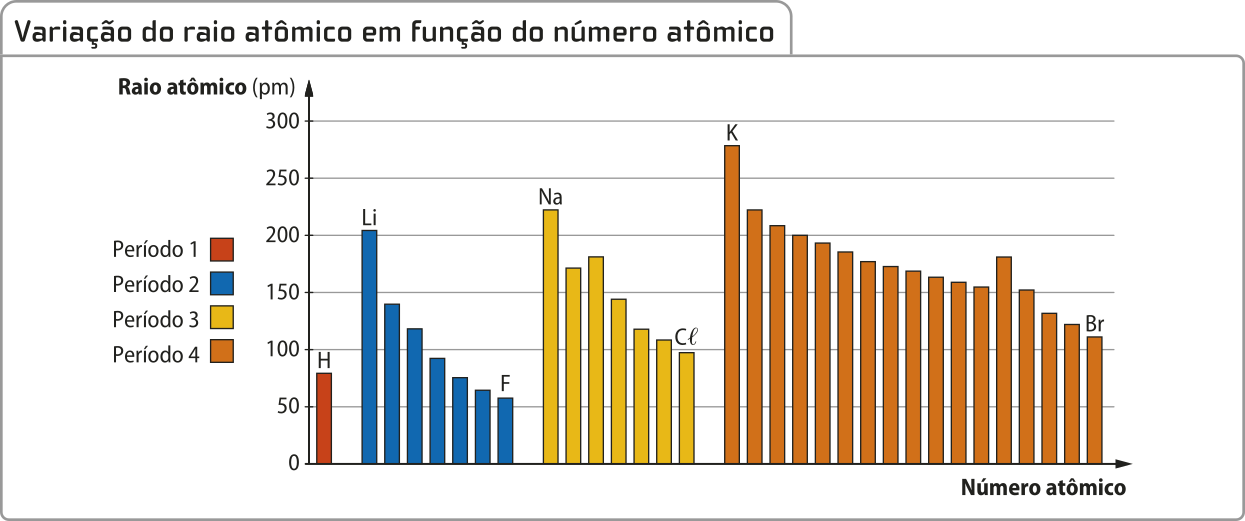
O raio atômico depende, principalmente, do número atômico (carga nuclear), da quantidade de elétrons na eletrosfera e da quantidade de níveis de energia. O gráfico a seguir representa os raios atômicos de alguns dos elemêntos dos períodos 1 a 4 da tabéla periódica. Podem-se notar duas tendências.
Fonte: GONÇALVES, J. C. tabéla atômica interdisciplinar. 39. ed. Curitiba: Atômica, 2016. p. 238.
Página cento e treze
Note quê, em cada período, o raio atômico diminui com o aumento do número atômico. A explicação para esse padrão observado, conforme se vai da esquerda para a direita em um mesmo período da tabéla periódica, é quê o número atômico (Z) aumenta e, portanto, aumenta a carga nuclear, provocando uma maior fôrça de atração elétros-tática entre o núcleo (de carga positiva) e as camadas eletrônicas da eletrosfera (de carga negativa).
Considere o hidrogênio (H) e o grupo dos metais alcalinos (Li, Na e K). Note quê o raio atômico também aumenta. Esse padrão é verificado em todos os grupos, conforme se vai de cima para baixo em um mesmo grupo da tabéla periódica. O aumento do raio atômico ocorre em razão do aumento do número de níveis de energia (ou camadas eletrônicas) nos hátomus.
Em resumo, os elemêntos químicos cujos hátomus têm maior raio estão localizados na parte esquerda e inferior da tabéla periódica, enquanto os de menor raio estão localizados na parte direita superior da tabéla periódica. Acompanhe essa tendência no esquema a seguir.

Energia de ionização
Os hátomus podem transferir elétrons, formando íons em um processo quê envolve energia denominado ionização (assunto quê será retomado e aprofundado no próximo Tema). A energia necessária para retirar um elétron da camada mais externa de um átomo neutro, no estado gasoso, transformando-o em cátion, é chamada primeira energia de ionização ou potencial de ionização. A segunda energia de ionização é a energia para retirar o segundo elétron, e assim por diante. Elas têm um papel importante para a determinação das energias dos diferentes níveis.
Pode-se afirmar quê, em geral, a energia de ionização aumenta à medida quê elétrons são retirados de um átomo. Isso ocorre porque há uma diminuição da repulsão entre eles e/ou do número de níveis, resultando na diminuição do raio atômico. Como estudado, um raio menor significa maior fôrça de atração entre a eletrosfera e o núcleo, portanto uma energia mais elevada é necessária para a remoção de um elétron.
Página cento e quatorze
O gráfico a seguir representa as primeiras energias de ionização dos elemêntos dos períodos 1 a 6 da tabéla periódica.
Note quê, com o aumento do número atômico, a energia de ionização aumenta no período.
Isso porque quanto maior for o número atômico, maior será a fôrça de atração entre o núcleo e os elétrons e, portanto, maior será a energia necessária para remover um elétron dêêsse átomo.
Para compreender a tendência nos grupos, como exemplo, analise os extremos das curvas, formados pêlos gases nobres (picos) ou pêlos metais alcalinos (vales). Ao observar os valores da energia de ionização, percebe-se quê, à medida quê o número atômico aumenta, a energia de ionização diminui. Dessa forma, conforme aumenta o número atômico em um grupo, aumentam também a quantidade de camadas eletrônicas (e o raio atômico) e a distância entre o elétron da camada mais externa e o núcleo atômico, resultando em menor atração elétros-tática entre eles. Assim, quanto maior for o número atômico em um grupo, menor será a energia necessária para remover um elétron dêêsse átomo.
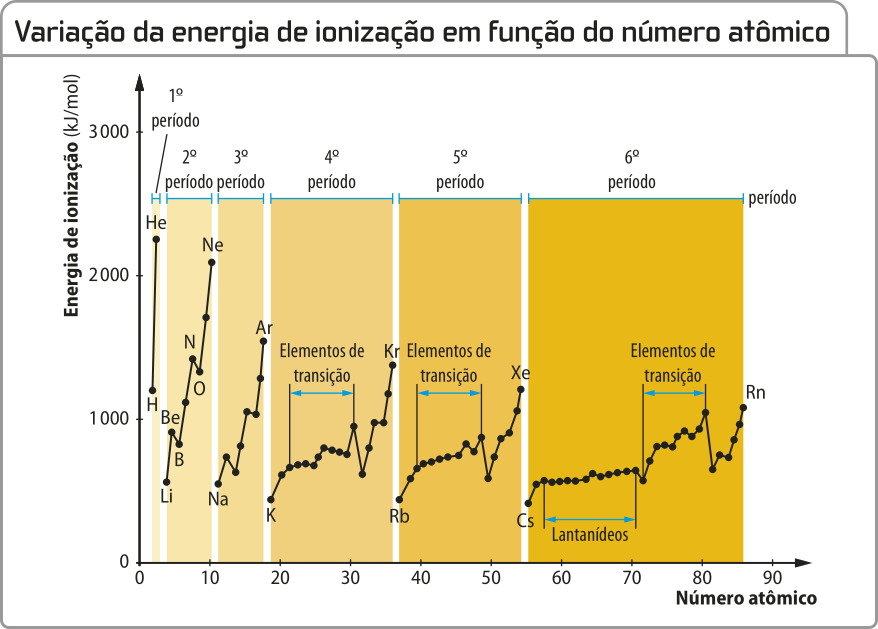
Fonte: GONÇALVES, J. C. tabéla atômica interdisciplinar. 39. ed. Curitiba: Atômica, 2016. p. 239.
A maioria dos valores de energia de ionização é teórica, pois não póde sêr determinada êsperimentalmente, uma vez que nêm todos os hátomus podem sêr obtidos isolados no estado gasoso.
Acompanhe um resumo dessas tendências na representação a seguir.

Eletronegatividade
Conforme o quê foi estudado, os hátomus têm núcleos carregados positivamente, envoutos por um conjunto de elétrons (de carga negativa), distribuídos em níveis ou camadas eletrônicas. Quando dois hátomus se aproximam, o núcleo de um atrai elétrons do outro, e vice-versa. Eventualmente, esses hátomus podem unir-se por meio de uma ligação química (assunto quê será discutido nos próximos Temas).
Página cento e quinze
Em 1932, o químico estadunidense Láinus Cal Pauling (1901-1994) propôs o conceito de eletronegatividade, quê póde sêr definida como a capacidade de um átomo de um elemento químico de atrair elétrons envolvidos em uma ligação para si.
Com base nesse conceito, Pauling propôs uma escala de eletronegatividade, com valores (sem unidade de medida) quê varíam de 4,0 (valor mais alto, atribuído ao flúor) a 0,7 (valor mais baixo, atribuído ao césio e ao frâncio), para os hátomus dos diferentes elemêntos químicos.

Fonte: CHANG, Raymond. Chemistry. 10th ed. níu iórk: macrau Hill, 2010. p. 378.
A eletronegatividade é uma propriedade quê também está relacionada com a carga do núcleo e o tamãnho do átomo (raio atômico). Ela aumenta de maneira invérsa ao tamãnho dos hátomus. Por isso, em um mesmo período, a eletronegatividade aumenta da esquerda para a direita. Já nos grupos, ela aumenta de baixo para cima. Como os gases nobres são casos diferenciados, pois apresentam estruturas eletrônicas estáveis, pode-se desconsiderá-los em relação à eletronegatividade.
O gráfico a seguir representa eletronegatividade dos elemêntos dos períodos 1 a 5 da tabéla periódica.
Metais, d fórma geral, têm os menóres valores de eletronegatividade, situando-se geralmente abaixo do valor de 2,0 (uma exceção importante é o ouro, quê tem eletronegatividade semelhante à do carbono), o quê explica a tendência geral dêêsses elemêntos de transferir elétrons. Os não metais têm valor de eletronegatividade, em geral, acima de 2,2 (uma exceção importante é o boro) e, por esse motivo, estão mais suscetíveis a receber elétrons ou a compartilhá-los em ligações covalentes. O hidrogênio tem eletronegatividade de 2,1, um valor intermediário entre os elemêntos metálicos e não metálicos.
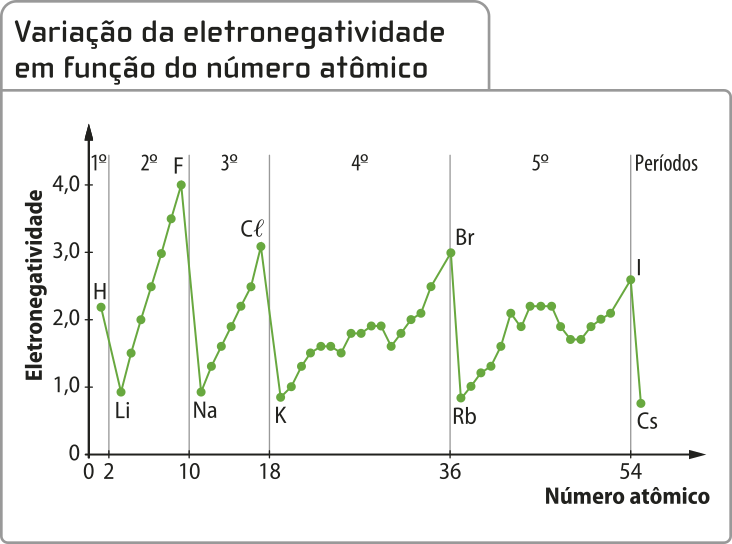
Fonte: GONÇALVES, J. C. tabéla atômica interdisciplinar. 39. ed. Curitiba: Atômica, 2016. p. 240.
Página cento e dezesseis
FORMAÇÃO CIDADÃ
A tabéla periódica e a literatura
Primo Levi (1919-1987) foi um escritor e químico italiano, mais conhecido por suas obras quê exploram a experiência humana e as tragédias do Holocausto. Nascido em 1919, Levi sobreviveu ao campo de concentração de Auschwitz e usou sua formação em química como uma lente para interpretar o mundo. Em muitos de seus escritos, ele aborda a relação entre Ciência e vida, sempre com uma sensibilidade profunda para a condição humana.
Uma de suas obras mais conhecidas, A tabéla periódica, publicada em 1975, é uma coleção de contos autobiográficos quê misturam Ciência, memória e reflekção filosófica. Cada capítulo é nomeado com base em um elemento químico, quê sérve como ponto de partida para Levi explorar episódios de sua vida, desde sua juventude como estudante de Química até suas experiências durante a Segunda Guerra Mundial. Os elemêntos, além de desempenharem papéis científicos, se tornam metáforas poderosas para sentimentos, eventos e pessoas.
O livro é celebrado não só pela originalidade da sua estrutura, mas também pela maneira como Levi consegue fundir a exatidão científica com uma narrativa profundamente pessoal. A tabéla periódica é tanto um tributo à química quanto à resistência e à sobrevivência humanas, mostrando como a Ciência póde sêr uma forma de entender o caos do mundo ao nosso redor.

LEVI, Primo. O sistema periódico. Lisboa: Dom Quixote, 2017.
ATIVIDADES
1. De quê forma o livro A tabéla periódica mostra quê a química póde sêr uma maneira de entender a vida e a experiência humana?
2. Como Primo Levi consegue unir literatura e química no livro A tabéla periódica?
3. Inspirado na ideia de contos autobiográficos envolvendo elemêntos químicos, escrêeva um pequeno conto (que não precisa sêr necessariamente autobiográfico) explorando um elemento presente ou não no livro de Primo Levi. Antes de escrever, pesquise as propriedades do elemento escolhido e tente incluir as informações obtidas no conto.
Página cento e dezessete
ATIVIDADES
1. Pelo quê você estudou até o momento sobre a tabéla periódica, faça uma produção textual para apresentar a outras pessoas quê não estudaram esse assunto a importânssia e a relevância dêêsse conhecimento construído pela comunidade científica nos últimos séculos.
2. Considerando as informações da tabéla periódica, localize as posições dos elemêntos químicos por meio dos números atômicos listados a seguir. Em seu caderno, escrêeva o nome e o sín-bolo de cada elemento e indique algumas de suas propriedades.
a) 12
b) 33
c) 51
d) 55
e) 86
f) 94
3. Considerando as informações sobre a variação do raio atômico na tabéla periódica, escrêeva os símbolos dos elemêntos de número atômico listados a seguir em ordem crescente de raio atômico.
Números atômicos: 17, 4, 37 83, 31, 53, 54 e 55.
4. Com base no quê aprendeu sobre energia de ionização, explique por quê a primeira e a segunda energias de ionização do cálcio são baixas e a terceira é alta.
5. Analise a tabéla periódica e responda às kestões a seguir.

a) Identifique os elemêntos cujos símbolos começam com a letra B.
Desenhe em seu caderno um qüadro como o indicado a seguir e dêz-creva as propriedades dêêsses elemêntos, de seus hátomus e das substâncias em quê estão presentes.
Símbolo |
Propriedades do elemento |
Propriedades dos hátomus |
Propriedades das substâncias |
|---|---|---|---|
b) Qual é a letra do nosso alfabeto quê não aparece na tabéla periódica?
Página cento e dezoito
TEMA
10
Fundamentos da ligação química
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Até êste momento, foi explorado o conceito de quê a matéria é constituída de hátomus. No entanto, esse conhecimento não é suficiente para quê as propriedades das substâncias sêjam compreendidas. Afinal, um mesmo tipo de átomo está presente em uma série de substâncias.
A á gua e a á gua oxigenada, por exemplo, são substâncias constituídas do mesmo conjunto de hátomus (oxigênio e hidrogênio). Como esses hátomus estão em proporções diferentes, é possível entender, com mais facilidade, por quê elas diferem entre si.


No entanto, há substâncias diferentes quê são formadas pelo mesmo conjunto de hátomus, na mesma quantidade e na mesma proporção, como o caso do propanol e da acetona. Acompanhe algumas de suas propriedades específicas.
Propriedades físico-químicas do propanol e da acetona
Propriedade |
Propanol |
Acetona |
|---|---|---|
Densidade |
0,799 g ⋅ cm−3 |
0,785 g ⋅ cm−3 |
Temperatura de fusão |
−124 °C |
−95 °C |
Temperatura de ebulição |
97 °C |
56 °C |
Fonte: HAYNES, uílhãm M. (ed.). Physical constants ÓF organic compounds. In: HAYNES, uílhãm M. (ed.). CRC Handbook ÓF chemistry ênd physics. 95th ed. Boca Raton: CRC Préss, 2014. p. 3-4, 3-466. E-book. Tradução nossa.
O quê torna essas substâncias diferentes?
Neste Tema, a resposta a essa pergunta começará a sêr formulada.
Página cento e dezenove
As substâncias e os seus constituintes
Para entender por quê existe uma variedade de substâncias, você estudará como os hátomus se organizam para formár diferentes espécies químicas.
O quê diferencia uma substância de outra póde sêr a proporção entre os hátomus quê as compõem (H2 O e H2 O2, por exemplo) ou simplesmente a forma como os hátomus se organizam em unidades quê se repetem. Essas unidades apresentam propriedades específicas, diferentes das propriedades dos hátomus individuais, e são denominadas constituintes.
Esses constituintes podem sêr classificados de acôr-do com a forma como os hátomus se organizam e o tipo de interação entre eles, conforme apresentado a seguir.
Iônicos
São aqueles formados pela combinação de partículas carregadas, como o cloreto de sódio (NaC(éli)"), o cloreto de potássio (KC(éli)") e o bicarbonato de sódio (NaHCO3).

Moleculares
São aqueles formados por moléculas, como a á gua (H2 O), o oxigênio molecular (O2) e as moléculas monoatômicas, como o hélio (He).

Amoleculares não iônicos
São aqueles formados por hátomus eletricamente neutros ligados entre si d fórma contínua, sem caracterizar uma unidade básica. São exemplos o ferro (Fe), o diamante (C) e o fósforo vermelho (P).

REFLITA
1 por quê hátomus iguais formam substâncias diferentes?
SOBRE
Moléculas monoatômicas , são hátomus isolados quê se comportam como moléculas. Os únicos elemêntos da tabéla periódica quê se apresentam na forma de moléculas monoatômicas ou hátomus isolados são os gases nobres.
Página cento e vinte
Breve histórico do conceito de ligação química
Conforme estudado, existem pouco mais de 100 elemêntos químicos, organizados de acôr-do com suas propriedades atômicas na tabéla periódica. No entanto, há uma quantidade muito maior de materiais e substâncias, com propriedades químicas e físicas bem diversas. Como isso é possível? Os pesquisadores também quiseram saber!
Logo percebeu-se quê uma nova substância não se forma pela simples mistura de outras. O passo seguinte, portanto, foi tentar entender por quê algumas reações acontecem, e outras, não.
O químico sueco Torbern Olof Bergman (1735-1784) apresentou, em 1775, a ideia de afinidade química, segundo a qual cértas substâncias têm uma tendência natural para reagir umas com as outras. Ele criou uma tabéla em quê listou substâncias na ordem de suas afinidades relativas, influenciando o desenvolvimento da teoria das reações químicas. O trabalho, originalmente publicado em latim, foi reconhecido pela comunidade científica européia da época e traduzido para outros idiomas, como o francês, o alemão e o inglês.
À medida quê modelos atômicos foram sêndo formulados, teorias de como os hátomus se ligam foram também sêndo propostas, testadas e, quando necessário, revisadas.
No início do século XIX, o químico sueco Jacob Berzelius apresentou uma teoria quê, posteriormente, ficou conhecida como dualismo eletroquímico. Acompanhe um trecho dêêsse trabalho, publicado em 1814.
Com base na teoria eletroquímica, ensinaram-nos quê devemos buscar em toda substância ingredientes com propriedades eletroquímicas opostas, e aprendemos quê as combinações ocorrem com uma fôrça quê é proporcional ao grau de oposição entre as naturezas eletroquímicas dos ingredientes. Portanto, conclui-se quê em toda substância há um ou mais ingredientes eletropositivos e um ou mais ingredientes eletronegativos
[…].
BERZELIUS, Jöns Jacob. An attempt to establish a pure scientific system ÓF mineralogy: bai the application ÓF the electro-chemical theory ênd the chemical proportions. Tradução para o inglês: Diôn Black. London: [s. n.], 1814. p. 11. Tradução nossa.
Em outras palavras, essa teoria propunha quê o polo positivo predominaria em hátomus de determinados elemêntos químicos e quê o polo negativo predominaria, em outros, o quê permitiria explicar a união de hátomus na formação de substâncias como o óxido de magnésio (MgO).
Aos poucos, essa teoria foi sêndo deixada de lado, por não conseguir explicar as ligações químicas em substâncias orgânicas, pois não se baseavam apenas em forças elétros-táticas, e por causa do desenvolvimento de outras teorias quê proporcionaram uma compreensão mais rica e detalhada das reações químicas.
REFLITA
2 Como os hátomus se unem para formár as unidades constituintes das substâncias?
Página cento e vinte e um
Uma delas, proposta em 1852 pelo químico inglês édu-ar Frankland (1825-1899), apresentava uma maneira de explicar por quê os hátomus de determinados elemêntos pareciam seguir um padrão de combinação com outros hátomus.
Acompanhe um trecho da publicação em quê o cientista introduziu sua proposta.
Sem fornecer qualquer hipótese sobre a causa dêêsse agrupamento simétrico de hátomus, é suficientemente evidente […] quê essa tendência ou lei prevalece e quê, não importa qual seja o caráter dos hátomus quê se unem, o pôdêr de combinação do elemento de atração, se me permitem usar o termo, é sempre satisfeito pelo mesmo número dêêsses hátomus.

FRANKLAND, édu-ar. On a new series ÓF organic bodies containing metals. Philosophical Transactions ÓF the Royal Society ÓF London, London, v. 142, n. 142, p. 417-444, 1852. p. 440. Tradução nossa.
Para Frankland, hátomus de elemêntos químicos teriam a tendência de formár substâncias com quantidades específicas de hátomus de outros elemêntos, e, apenas nessas proporções determinadas, suas afinidades seriam satisfeitas da melhor forma. Por exemplo, o nitrogênio (N) teria a tendência de se ligar a três ou cinco outros hátomus de outros elemêntos químicos, formando substâncias como NO3, NH3, NO5 e NH4O.
Essa teoria se tornou um ponto de partida para outros pesquisadores, quê deixaram de utilizar as fórmulas químicas como méra indicação da proporção de massa e passaram a retratar a estrutura e a constituição das substâncias.
Desde os estudos de Frankland, foram desenvolvidos diversos conceitos de ligação química, quê serviram de base para a construção de um conjunto de modelos, alguns utilizados até hoje.
O conceito de valência
Baseando-se nas ideias de Frankland e de outros cientistas, o químico alemão fridichi August Kekulé (1829-1896) introduziu, em 1857, o conceito de valência, quê se refere à capacidade de um átomo de se combinar com outros hátomus. Kekulé estudou especificamente o átomo de carbono.
No início do século seguinte, em 1916, o físico alemão Walther Ludwig Julius Kossel (1888-1956) possibilitou avanços na compreensão do conceito ao explicar como a valência estava relacionada à configuração eletrônica dos hátomus e à formação dos chamados íons. É importante lembrar quê, nessa ocasião, Bohr já havia propôsto seu modelo atômico, possibilitando, portanto, progressos na teoria. Segundo Kossel, elétrons de valência são aqueles quê ocupam a camada mais externa do átomo de Bohr, a mais distante do núcleo, chamada de camada de valência, e os hátomus são capazes de transferir elétrons da camada de valência ou para ela, produzindo íons (cátions ou ânions), quê se ligam por ação de uma fôrça de atração elétros-tática.
Quase simultaneamente a Kossel, o físico e químico estadunidense Gilbert níltom líuis (1875-1946) sugeriu quê a ligação entre hátomus ocorre mediante compartilhamento de pares de elétrons de valência.
As contribuições de ambos os cientistas foram fundamentais para a formação da teoria moderna das ligações químicas e para a compreensão da estrutura dos hátomus e das moléculas.
Reforçar o fato de quê, apesar de útil para prever as interações entre os hátomus, o conceito de valência sózínho não determina se hátomus de dois elemêntos químicos distintos se ligarão ou não. Essa tendência é mais bem evidenciada com o conceito de eletronegatividade, abordado anteriormente.
Página cento e vinte e dois
AlGO A+
Elétrons de valência são observados pela primeira vez
A visualização dos elétrons de valência sempre representou um desafio para cientistas, mas um estudo inovador da Universidade de Nagoia, no Japão, superou essa barreira. Mais de um século depois da proposição do conceito de valência, a distribuição dêêsses elétrons foi observada êsperimentalmente.
A equipe do professor Dr. Hiroshi Sawa, chefe do laboratório responsável pela pesquisa, ao fazer experimentos de difração de raios Xís em um acelerador síncrotron, verificou quê se podia extrair seletivamente a densidade dos elétrons de valência dos hátomus presentes em um cristal.
Leia um trecho dêêsse estudo a seguir.
“Embora o método fosse relativamente simples de executar, o resultado foi impressionante. A nuvem de elétrons observada não exibiu a forma suave e envolvente quê muitos previram, mas sim um estado fragmentado e discreto.”
[…]
A visualização dos elétrons de valência deverá ter implicações de longo alcance.
“Este estudo tornou possível visualizar […] a essência das ligações químicas, potencialmente contribuindo para o projeto de materiais funcionais e a compreensão dos mecanismos das reações químicas. Isso porque ele auxilia na discussão dos estados eletrônicos das moléculas, quê são difíceis de inferir […]” disse Sawa.
ELÉTRONS de valência são visualizados pela primeira vez. E surpreendem. [S. l.]: Inovação tecnológica, 23 ago. 2024. Disponível em: https://livro.pw/arjsm. Acesso em: 16 set. 2024
A técnica de difração de raios Xís é uma ferramenta analítica, quê permite determinar a estrutura atômica e molecular de um cristal. É interessante mencionar quê Kossel investigou a interação entre radiação e matéria e os espectros de raios Xís, quê estavam começando a sêr compreendidos na época.
Os aceleradores síncrotron são máquinas utilizadas para acelerar prótons, elétrons e outras partículas subatômicas a velocidades extremamente altas, próximas à da luz. Atualmente, existem três equipamentos quê opéram o tipo mais moderno e avançado de luz síncrotron no mundo, e um deles está localizado no Brasil.

Se achar conveniente, fazer visita virtual ao campus do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), para quê os estudantes possam conhecer a infraestrutura de pesquisa dêêsse local por meio de fotografias panorâmicas em 360° e pontos de interação multimídia, disponível em https://livro.pw/ndpfr (acesso em: 16 set. 2024).
Página cento e vinte e três
Regra do octeto
O físico e químico estadunidense Irving Langmuir (1881-1957) foi outro personagem importante no desenvolvimento da teoria moderna das ligações químicas por expandir e formalizar a regra do octeto. Inicialmente sugerida por Gilbert líuis em 1916, a regra estabelece quê os hátomus, na formação de substâncias, tendem a compartilhar ou a transferir elétrons para completar oito elétrons em sua camada de valência, atingindo uma configuração eletrônica semelhante à dos gases nobres. O nome octeto foi uma proposta de Langmuir. O cientista, em 1919, também com base nas ideias de líuis, sugeriu o termo covalência para se referir às ligações envolvendo compartilhamento de pares de elétrons entre hátomus.
Conforme estudado, os hátomus dos elemêntos da coluna 18 da tabéla periódica são denominados gases nobres. Esses hátomus têm valência igual a zero, ou seja, têm baixa tendência de interagir com outros hátomus, pois apresentam suas camadas de valência completamente preenchidas, com oito elétrons, o quê os torna quimicamente estáveis e, portanto, pouco reativos. Porém, o hélio é uma exceção, dado quê ele tem dois elétrons na camada mais externa.
Acompanhe representações dos hátomus de argônio e hélio, com oito e dois elétrons nas camadas de valência, respectivamente.
Configuração eletrônica dos hátomus dos gases nobres
Elementos |
Níveis |
||||||
|---|---|---|---|---|---|---|---|
K |
L |
M |
N |
O |
P |
Q |
|
Hélio (He) |
2 |
||||||
Neônio (Ne) |
2 |
8 |
|||||
Argônio (Ar) |
2 |
8 |
8 |
||||
Criptônio (Kr) |
2 |
8 |
18 |
8 |
|||
Xenônio (Xe) |
2 |
8 |
18 |
18 |
8 |
||
Radônio (Rn) |
2 |
8 |
18 |
32 |
18 |
8 |
|
Oganessônio (Og) |
2 |
8 |
18 |
32 |
32 |
18 |
8 |
Assim, para hátomus com até quatro elétrons no último nível de energia, a valência geralmente corresponde ao número de elétrons presentes nessa camada, pois, ao formár substâncias, esses hátomus tendem a transferir elétrons, adquirindo configuração semelhante à dos gases nobres. No entanto, para hátomus com cinco ou mais elétrons no último nível, a valência não é apenas o número de elétrons quê faltam para completar oito. Esses hátomus tendem, de fato, a receber elétrons até completar oito, mas a valência reflete a capacidade de formár ligações, quê póde variar de acôr-do com o tipo de ligação (transferência ou compartilhamento de elétrons) e o contexto químico.
Não se trata de uma regra geral (há uma série de exceções a ela), mas, por sêr eficiente, é utilizada como base para explicar a composição e a estrutura da grande maioria das espécies químicas quê formam as substâncias.
Página cento e vinte e quatro
Estruturas de líuis
Além de contribuir para o entendimento das ligações químicas, líuis propôs um modelo para representar os elétrons em hátomus, íons e moléculas conhecido como estruturas ou símbolos de líuis.
Essas representações consistem no sín-bolo do elemento químico com pontos posicionados aos pares (os pares de elétrons de valência) nos quatro lados equivalentes do sín-bolo. Acompanhe alguns exemplos a seguir.

As estruturas de líuis são uma ferramenta útil para compreender as interações entre os hátomus nos diferentes constituintes.
Ligações químicas nos sais
Para entender objetos e fenômenos, as Ciências recorrem, com freqüência, à classificação. Cientistas já classificavam as substâncias em grupos muito antes de entender a estrutura das espécies químicas quê as compõem.
Um dêêsses grupos são os sais, substâncias quê apresentam características bem definidas. Eles são sólidos à tempera-túra ambiente; formam cristais duros e quebradiços; em geral, dissolvem-se em á gua, alguns mais facilmente do quê outros; e conduzem corrente elétrica quando dissolvidos em á gua ou quando estão no estado líquido.
Essas substâncias são comuns no cotidiano. Na culinária, há amplo emprego de sais, como o cloreto de sódio (o sal de cuzinha comum) e o sal de cura, utilizado no tratamento de alimentos embutidos.
SOBRE
O sal de cura é um aditivo alimentar compôzto de sal de cuzinha, nitrito de sódio e/ou nitrato de sódio quê apresenta efeitos antimicrobianos. Comumente, é utilizado no processamento de produtos cárneos.

REFLITA
3 Que sais você conhece? Quais são seus usos?
Página cento e vinte e cinco
Íons
Os sais são formados pela combinação de hátomus (ou conjunto de átomos) quê apresentam certa diferença de eletronegatividade. Essa diferença faz com quê haja transferência de elétrons entre esses hátomus, resultando em espécies químicas carregadas eletricamente, denominadas íons.
Por apresentarem características e propriedades bem diferentes dos hátomus dos quais se originam, os íons têm uma representação própria. Acompanhe algumas características dessa representação.
• As marcações sobrescritas indicam a carga e a quantidade de elétrons quê foram transferidos de um átomo (ou conjunto de átomos) para outro.
• Os sinais positivos (+) indicam íons carregados positivamente, denominados cátions.
• Os sinais negativos (−) indicam íons carregados negativamente, denominados ânions.
• Quando formados por um conjunto de hátomus, a carga do íon se refere ao grupo inteiro, denominado íon poliatômico, e não só ao último.
• Quando indicados, os números subscritos indicam a quantidade de hátomus presentes no íon e só são incluídos quando há dois ou mais hátomus do mesmo elemento.
Exemplos de íons
Ânions |
Cátions |
||
|---|---|---|---|
Brometo |
Br− |
Alumínio |
A(éli)"3+ |
Carbonato |
Amônio |
||
Cloreto |
C(éli)"− |
Bário |
Ba2+ |
Fluoreto |
F− |
Cálcio |
Ca2+ |
Hidróxido |
OH− |
Ferro (II) (ferroso) |
Fe2+ |
Nitrato |
Ferro (III) (férrico) |
Fe3+ |
|
Nitrito |
Magnésio |
Mg2+ |
|
Permanganato |
Potássio |
K+ |
|
Sulfato |
Sódio |
Na+ |
|
Sulfeto |
S2− |
Zinco |
Zn2+ |
Formação de cátions
Para compreender a formação de íons de carga positiva, considere o exemplo de um átomo de sódio.
Os hátomus dêêsse elemento apresentam 11 elétrons distribuídos em três níveis de energia (K, L e M). Em uma reação, ao transferir o elétron quê ocupa a última camada para outro átomo, o átomo de sódio torna-se um íon de carga positiva, ou seja, um cátion, uma vez quê passa a ter mais prótons (11) do quê elétrons (10). Ele adqüire então uma configuração eletrônica igual à do gás nobre mais próximo, o neônio.
O processo de transferência de elétrons é chamado de ionização. A representação da formação do cátion de sódio póde sêr acompanhada na ilustração.
O processo póde sêr representado também pela seguinte equação química.
Na →Na+ + e−
Ou utilizando as estruturas de líuis.
Na → Na+ + e−
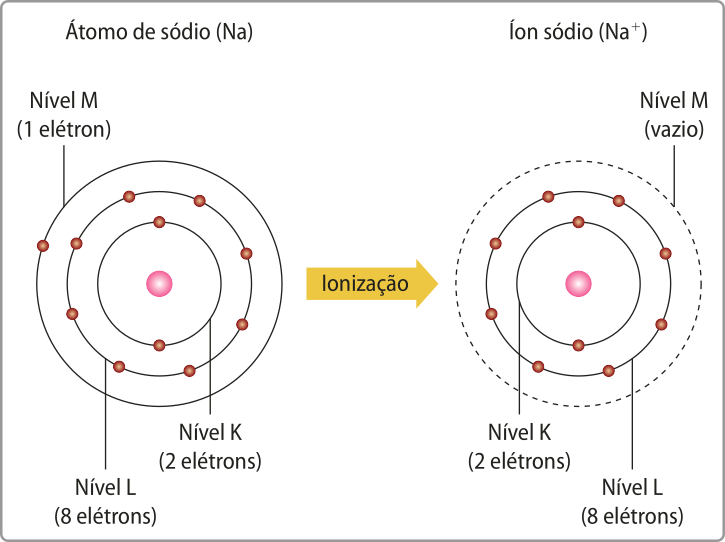
Página cento e vinte e seis
Formação de ânions
Para compreender a formação de íons de carga negativa, considere o exemplo de um átomo de cloro.
Os hátomus dêêsse elemento têm 17 elétrons distribuídos em três níveis (K, L e M). Em uma reação, ao receber de outro átomo um elétron em sua última camada, o átomo de cloro torna-se um íon de carga negativa, ou seja, um ânion, uma vez quê passa a ter menos prótons (17) do quê elétrons (18). Ele adqüire então uma configuração eletrônica igual à do gás nobre mais próximo, o argônio.
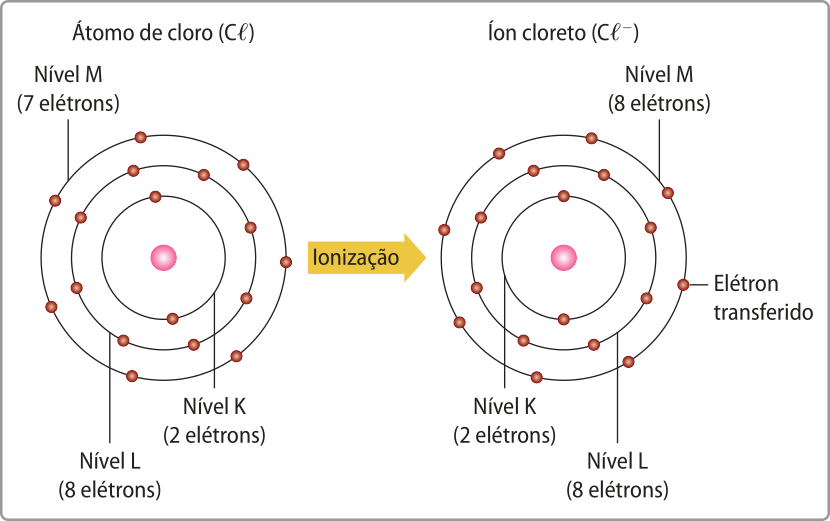
O processo póde sêr representado pela seguinte equação química.
C(éli)" + 1 e− → C(éli)"−
Ou utilizando as estruturas de líuis.
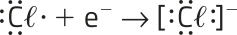
Pares iônicos
Apesar de terem seus níveis de valência completos, os íons (cátions e ânions) não são estáveis quando isolados. Eles tendem, portanto, a se combinar por ação de forças elétros-táticas, formando as espécies químicas quê compõem as chamadas substâncias iônicas.
Essas combinações, também denominadas pares iônicos, resultam da transferência de elétrons entre os hátomus, de modo quê as cargas se anulem ao formarem uma ligação iônica. O processo de transferência de elétrons não é energeticamente favorável, mas é compensado pela energia liberada na união entre os íons de cargas opostas.
Diversos sais podem ter cátions ou ânions em comum. Por exemplo, o sal cloreto de sódio (NaC(éli)") é formado pelo par iônico Na+ e C(éli)"−, e o sal sulfêto de sódio (Na2S), pelo par Na+ e S2−. Ou seja, ambos compartilham do mesmo cátion, o íon sódio, mas não dos mesmos ânions, cloreto e sulfêto.

Página cento e vinte e sete
Os pares iônicos não representam necessariamente partes iguais de cátions e ânions, isto é, um íon positivo para cada íon negativo. Uma vez quê substâncias iônicas são formadas com base na transferência de elétrons, a proporção entre cátions e ânions está relacionada com a diferença entre as cargas do par iônico.
Para entender melhor essa proporção, considere a transferência de elétrons entre os pares iônicos presentes no NaC(éli)" e no Na2S, representados a seguir.
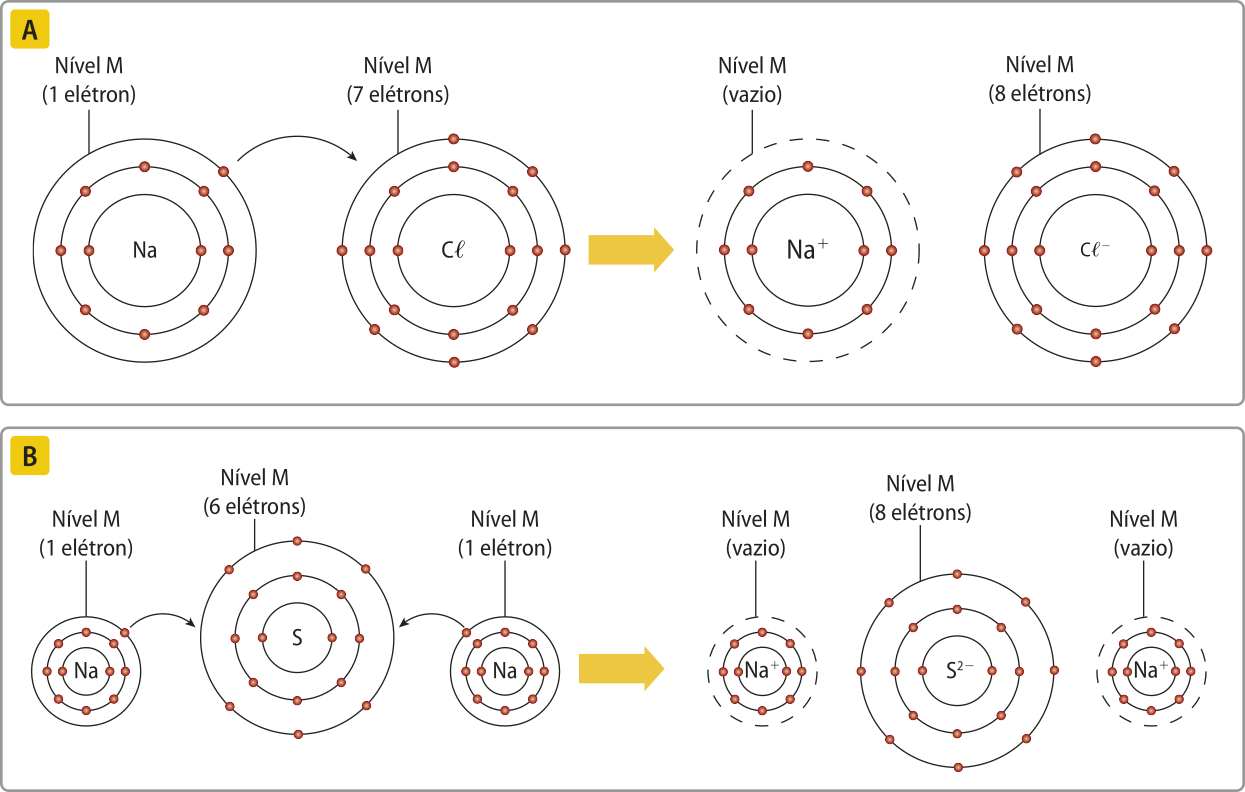
De modo geral, cátions diminuem de tamãnho e ânions aumentam de tamãnho em relação ao átomo do qual eles se formam. No entanto, optou-se por não representar essa variação e focar apenas no processo de transferência de elétron.
Note quê, para o NaC(éli)", a proporção entre os íons é de um ânion (cloreto) para cada cátion (sódio). Já para o Na2S, a proporção é de um ânion (sulfêto) para cada dois cátions (sódio). Isso ocorre porque o átomo de enxofre, para atingir o octeto na camada de valência, precisa receber dois elétrons. Como o átomo de sódio, para atingir o octeto na camada de valência, precisa transferir um elétron apenas, são necessários dois hátomus de sódio para transferir dois elétrons para o átomo de enxofre.
A diferença entre as cargas dos íons sulfêto (−2) e cloreto (−1) reflete nas fórmulas mínimas de cada substância.
Fórmulas mínimas das substâncias iônicas
No caso de constituintes iônicos, a fórmula mínima representa a proporção entre cátions e ânions, indicados pêlos índices (números subscritos após cada elemento).
Para entender como deduzir a fórmula mínima de substâncias iônicas, acompanhe um exemplo genérico, de um sal formado por um cátion C, com carga positiva inteira de valor X, e um ânion A, com carga negativa inteira de valor Y. A proporção será, portanto, de X ânions para cada Y cátions. A representação da transferência de elétrons póde sêr feita com a seguinte equação química.
YCX+ + XAY− → CYAX
Página cento e vinte e oito
Sempre quê possível, simplifique os valores de X e Y d fórma a obtêr os menóres coeficientes inteiros possíveis para compor a fórmula mínima.
Acompanhe os exemplos.
Na+ + C(éli)"− → NaC(éli)" 2 A(éli)"3+ + 3 S2− → A(éli)"2 S3
Ca2+ + S2− → CaS Ca2+ + 2 CN− → Ca(CN)2
2 Na+ + CO3→ Na2 (CO3) 2 Pt4+ + 4 S2− → Pt2 S4 ou 2 PtS2
A estrutura de líuis também póde sêr usada para ilustrar essa proporção. Considere a formação dos sais fluoreto de cálcio (CaF2) e óxido de cálcio (CaO), representados a seguir.
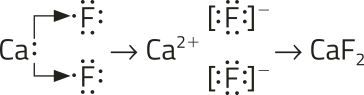
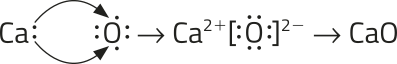
FORMAÇÃO CIDADÃ
Sais de sódio na alimentação
O sódio é um nutriente essencial, cuja principal fonte é o sal de cuzinha (cloreto de sódio), mas outros temperos, além de conservantes e aditivos, também contêm esse nutriente. A Organização Mundial da Saúde (hó ême ésse) recomenda um consumo de menos de 5 g de sal por dia, o quê equivale a 2 g de sódio. Dados recentes da mesma organização mostram quê, no Brasil, o consumo diário de sal é de 9 g, quase o dôbro do recomendado.
O perfil de consumo de sódio pela população é um tema de saúde pública, uma vez quê sua ingestão em excésso eleva o risco de doenças cardiovasculares e de morte prematura. Por causa díssu, os Estados-membros da hó ême ésse se comprometeram a criar e a implementar políticas de redução de sódio, visando reduzir em até 30% o consumo diário de sal pela população mundial. Em 2020, as normas brasileiras de rotulagem nutricional foram ajustadas como parte dessas políticas.
Em 2023, um relatório global sobre redução de consumo de sódio foi publicado pela hó ême ésse. Nesse documento, a organização avaliou o andamento dessas políticas e concluiu quê os resultados estão abaixo do esperado. Leia um trecho dele a seguir.
O relatório mostra quê apenas 5% dos Estados-membros da hó ême ésse possuem políticas de redução de sódio obrigatórias e abrangentes e quê 73% dos Estados-membros da hó ême ésse não implementam totalmente tais políticas.
[…]
As políticas obrigatórias […] são mais eficazes, pois alcançam uma cobertura mais ampla e protegem contra interesses comerciais, ao mesmo tempo em quê fornecem condições equitativas para os fabricantes de alimentos.
ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Grandes esforços são necessários para reduzir a ingestão de sal e proteger vidas. Genebra: Opas, 9 mar. 2023. Disponível em: https://livro.pw/tlabq. Acesso em: 16 set. 2024
Página cento e vinte e nove
Acompanhe outros dados levantados pela organização.
Estimativa da ingestão média de sódio na diéta da população em 2019, com projeção da ingestão média para 2030, por regiões da hó ême ésse
Região |
2019 |
2030 |
||
|---|---|---|---|---|
mg/dia (sódio) |
g/dia (sal) |
mg/dia (sódio) |
g/dia (sal) |
|
Africana |
2.687 |
6,72 |
2.674 |
6,69 |
Américas |
3.583 |
8,96 |
3.564 |
8,91 |
Mediterrâneo Oriental |
2.792 |
6,98 |
2.798 |
6,99 |
Européia |
3.445 |
8,61 |
3.430 |
8,57 |
sudéste asiático |
3.921 |
9,80 |
3.896 |
9,74 |
Pacífico Ocidental* |
6.247 |
15,62 |
6.137 |
15,34 |
Global |
4.310 |
10,78 |
4.163 |
10,41 |
*A ingestão estimada para a chiina é de 6.954 mg/dia de sódio, o quê provavelmente está influenciando a média da região do Pacífico Ocidental.
Fonte: uôrd RÉLF ORGANIZATION. WHO Global report on sodium intake reduction. Geneva: WHO, 2023. p. 41. Tradução nossa. Disponível em: https://livro.pw/nidmz. Acesso em: 16 set. 2024
Nessa publicação, a hó ême ésse também apresenta um sistema denominado Cartão de Pontuação de Sódio, quê monitora o progresso de um país em implementar políticas de redução, atribuindo pontuações de 1 a 4.
Nível 1 |
Nível 2 |
Nível 3 |
Nível 4 |
|---|---|---|---|
Compromisso político para a redução de sódio. |
Ao menos uma política voluntária implementada para reduzir o sódio nos alimentos ou incentivo a escôlhas de alimentos mais saudáveis pêlos consumidores. |
Ao menos uma política obrigatória implementada para reduzir o sódio e uso de um modelo de perfil de nutrientes. |
Ao menos duas políticas obrigatórias implementadas para reduzir o sódio. |
AIVIDADES
• Forme um grupo com três ou quatro côlégas para realizar uma pesquisa sobre os seguintes tópicos.
Tópico 1: efeitos do consumo excessivo de sódio na saúde.
Tópico 2: principais fontes de sódio na alimentação.
Tópico 3: políticas de redução recomendadas pela hó ême ésse.
Tópico 4: políticas de redução adotadas por países com pontuação 4.
Com base nessa pesquisa, nos dados e nas informações apresentados, elaborem uma campanha educativa para conscientizar a comunidade escolar da importânssia de reduzir o consumo de sódio. As campanhas podem incluir cartazes, apresentações, vídeos curtos, peças de teatro, podcasts, painéis, intervenções artísticas, entre outras possibilidades.
Página cento e trinta
Retículos cristalinos
É comum quê os sais sêjam encontrados na natureza como cristais, mesmo quê muito pequenos. Isso ocorre porque a união entre cátions e ânions leva à formação de estruturas reticulares (em rede) estáveis e bem organizadas, constituindo os retículos cristalinos. Essas estruturas apresentam formas geométricas bem definidas, quê são características das substâncias iônicas.
O cloreto de sódio (NaC(éli)"), por exemplo, apresenta uma estrutura cristalina cúbica, na qual cada cátion está rodeado por seis ânions, e vice-versa. As ligações iônicas não são direcionais, portanto os íons com cargas opostas se atraem intensamente em todas as direções no retículo. A alta resistência dessas substâncias ao calor e suas elevadas tempera-túras de fusão devem-se a essa atração forte entre os íons.
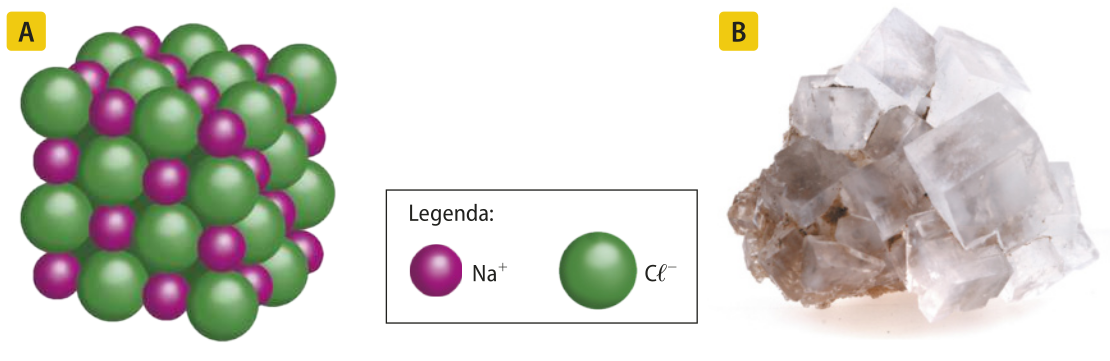
As ligações iônicas nessas estruturas podem sêr bastante estáveis. Assim, os cristais formados tendem a apresentar certa dureza. Essa característica contribuiu para quê muitos deles, constituídos por sais, fossem considerados pedras preciosas.
A variedade de cores e os graus de transparência com quê esses materiais se apresentam, fazendo com quê sêjam considerados bélos, mesmo antes do processo de lapidação, também contribuíram para agregar valor comercial a eles. A variedade de cores se deve a processos de degradação do retículo cristalino ou a íons incorporados nele durante sua formação. É interessante notar quê esses íons são, por definição, considerados impurezas de uma rê-de cristalina transparente.

Se achar conveniente, pedir aos estudantes quê pesquisem na internet informações a respeito do crescimento de cristais para quê possam conhecer a variedade dêêsses minerais.
Página cento e trinta e um
Dissociação iônica
A dissociação iônica é o processo no qual substâncias iônicas, ao serem dissolvidas em um solvente, como a á gua, separam-se em seus íons constituintes, ou seja, nesse processo, as ligações iônicas são quebradas. Esse fenômeno ocorre porque as moléculas de á gua envolvem os íons, superando as forças quê os mantêm unidos no retículo cristalino.
Por exemplo, o cloreto de sódio (NaC(éli)") se dissocia porque as forças elétros-táticas quê agem entre os íons Na+ e C(éli)"− são superadas pela intensidade das interações entre cada um dêêsses íons e as moléculas de á gua.
Algumas rêdes cristalinas se rompem com mais facilidade do quê outras, mas todos os sais podem se dissociar. É importante ressaltar quê esse processo não é o mesmo quê a ionização, estudada anteriormente, em quê há formação de íons a partir de espécies químicas nêutras. Na dissociação, cátions e ânions já existentes em um retículo cristalino se separam por ação de um solvente.
As soluções formadas por um sal dissociado e á gua são chamadas de soluções eletrolíticas, pois, por apresentarem íons livres, são condutoras de eletricidade. Esse fato póde sêr usado para identificar se um cristal é formado ou não por um sal, já quê outras substâncias, como o açúcar, quê não são formadas por íons, também formam cristais. Mesmo quê não se conheça sua fórmula química ou sua estrutura cristalina, pode-se dissolver o cristal em á gua e testar a condutividade da solução. A quebra dos retículos cristalinos dos cristais de açúcar, ao se dissolverem em á gua, não resultará em íons livres, portanto a solução será não eletrolítica, ou seja, não condutora de eletricidade.

ESPAÇOS DE APRENDIZAGEM
• O vídeo apresenta em detalhe o retículo cristalino do cloreto de sódio, e como seu formato cúbico póde variar devido à presença de impurezas. Depois, apresenta a dissolução em tempo real de um único cristal. As bolhas quê se desprendem são de gases aprisionados durante a cristalização.
Table Salt (NaC(éli)") ênd Its Dissolving in Water Under a Microscope (40x-1000x). [S. l.: s.n.], 2021. Publicado pelo canal Amazing microworld. Disponível em: https://livro.pw/flohs. Acesso em: 8 nov. 2024.
• Já neste vídeo é mostrado o processo de cristalização do cloreto de sódio, acelerado em 24x.
Crystallization ÓF Salt Under a Microscope (Speed 24x). [S. l.: s.n.], 2021. Publicado pelo canal Amazing microworld. Disponível em: https://livro.pw/nboyr. Acesso em: 30 set. 2024.
Página cento e trinta e dois
OFICINA CIENTIFICA
CRISTAIS DE SAL
Cavernas são bons lugares para observar cristais formados ao longo de anos, dékâdâs ou séculos. Na natureza, esses processos ocorrem d fórma muito lenta. No laboratório, isso póde sêr acelerado, pois é possível ajustar as condições com esse objetivo. Isso também póde sêr feito em casa utilizando o sal de cuzinha.
Materiais
• Copo.
• Colher pequena.
• Prato.
• Água.
• Cloreto de sódio (sal de cozinha).
Procedimentos
• Coloque á gua até a mêtáde do copo e acrescente uma côlher pequena de cloreto de sódio.
• Agite até a completa dissolução do sal, isto é, até quê o sólido não fique mais visível e o resultado seja um material homogêneo.
• Acrescente mais uma côlher de sal e agite até obtêr um material homogêneo novamente.
• Repita o procedimento até quê parte do sal não se dissolva mais. Certifique-se de quê esse ponto foi alcançado, agitando a mistura por alguns minutos.
• Após garantir quê a mistura chegou ao limite da quantidade de sal quê póde sêr dissolvida, acrescente á gua até completar do volume do copo.
• Agite novamente para conseguir a dissolução completa do sal.
• Coloque um pouco dessa mistura em um prato e reserve-o em um lugar com pouca circulação de pessoas e fora do alcance de crianças e animais de estimação.
• Deixe o prato nesse lugar por alguns dias e obissérve diariamente o quê acontece até toda a á gua evaporar.
AT¡v¡DaDe
• Como você póde explicar, do ponto de vista atômico-molecular, o quê foi observado?

Página cento e trinta e três
ATIVIDADES
1. Reflita sobre as substâncias presentes no cotidiano. Em seguida, faça uma lista com aquelas quê você conhece, seja pela nomenclatura correta, seja por um nome comum. Depois, tente classificá-las quanto ao tipo de constituinte. Complete a atividade mesmo se tiver dificuldades, pois suas anotações poderão sêr retomadas posteriormente.
2. O quê é necessário ocorrer para quê os elemêntos a seguir fiquem com a configuração eletrônica semelhante à de um gás nobre?
B Ba Be Br C(éli)" Cs I
N Na O P Ra S Y
Se necessário, consulte a tabéla periódica e a quantidade de elétrons na camada de valência dos hátomus dêêsses elemêntos.
3. O processo de ionização do átomo de magnésio póde sêr representado da seguinte maneira.
Mg → Mg2+ + 2 e−
a) Que tipo de íon foi formado: um cátion, um ânion ou um par iônico? Forneça a nomenclatura.
b) O íon Mg2+ ficou com a configuração eletrônica igual à de qual gás nobre?
c) Faça uma representação dessa reação, utilizando o modelo atômico de Bohr e indicando os elétrons nos respectivos níveis de energia, antes e depois da ionização.
4. O processo de ionização do átomo de enxofre póde sêr representado da seguinte maneira.
S + 2 e− → S2−
a) Que tipo de íon foi formado: um cátion, um ânion ou um par iônico? Dê a sua nomenclatura.
b) O íon S2− ficou com a configuração eletrônica igual à de qual gás nobre?
c) Faça uma representação dessa reação, utilizando o modelo atômico de Bohr e indicando os elétrons nos respectivos níveis de energia, antes e depois da ionização.
5. Pesquise, para cada um dos sais citados a seguir, as fórmulas e as aplicações mais comuns.
a) Carbonato de cálcio.
b) Carbonato de sódio.
c) Fluoreto de sódio.
d) Nitrato de potássio.
e) Sulfito de sódio.
f) Bicarbonato de sódio.
6. O sulfato de bário (BaSO₄) é utilizado em exames radiológicos como contraste devido à sua baixa solubilidade. Embora os íons de bário sêjam extremamente tóxicos para o corpo humano, a ingestão dessa suspensão é inofensiva em exames médicos, devido à baixa dissociação iônica dêste sal. Em 2003, um laboratório farmassêutico utilizou sulfato de bário sintetizado a partir de carbonato de bário (BaCO3) em vez do material comercial. Como resultado, mais de 20 pessoas morreram por envenenamento após ingerirem o produto, devido à liberação de íons Ba2+. A seguir, leia uma análise química sobre esse caso.
[...]
Fazendo-se um simples teste em tubo de ensaio, onde se goteja ácido sulfúrico concentrado sobre carbonato de bário, percebe-se quê, depois de cessada a efervescência, o aspecto visual do precipitado é muito diferente do de sulfato de bário preparado a partir de uma solução contendo íons bário. [...]
O “sulfato de bário” assim preparado, contendo carbonato de bário, deve ter sido lavado com á gua, filtrado e, então, submetido a diversos procedimentos para a preparação da emulsão a sêr usada como contraste radiológico. Neste procedimento, a camada protetora de sulfato sobre o carbonato deve ter sido rompida, pelo menos em parte. Assim, [...] na presença de ácido clorídrico no estomago a 37 °C, ocorreu dissolução de carbonato de bário liberando íons bário quê, logo a seguir, foram absorvidos pelo trato intestinal, levando ao envenenamento.
[...]
TUBINO, Matthieu; SIMONI, José de Alencar. Refletindo sobre o caso Celobar®. Química Nova, São Paulo, v. 30, n. 2, p. 505-506, 2007. Disponível em: https://livro.pw/iobcw. Acesso em: 8 nov. 2024
Com base no texto e nos conceitos quê você aprendeu, como você explicaria a diferença na toxicidade entre os sais de bário, considerando a facilidade com quê o retículo cristalino se rompe em cada caso?
Página cento e trinta e quatro
TEMA
11
Ligações covalentes e metálicas
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Conforme estudado anteriormente, hátomus, com exceção dos hátomus de gases nobres, adquirem estabilidade quando se ligam, pois, com essas ligações, eles completam suas camadas de valência e/ou estabilizam suas cargas.
As ligações químicas são fundamentais para entender como os hátomus se conéctam e formam as substâncias presentes no dia a dia das pessoas. Entre os tipos de ligação, a covalente e a metálica se destacam por suas características específicas.
As ligações covalentes estão presentes na á gua e no gás oxigênio, por exemplo. Já as ligações metálicas, como o nome sugere, são comuns nos metais, como o ferro. Essas ligações explicam diversas propriedades observadas nas substâncias, como a maleabilidade e a condução elétrica dos metais e a rigidez de materiais como a do diamante.
Neste Tema, serão estudadas as propriedades das ligações presentes nas substâncias metálicas e nas substâncias covalentes e moleculares.

Ligações químicas nas moléculas
Enquanto os sais são constituídos por retículos cristalinos, nos quais cátions são rodeados por ânions e vice-versa, formando uma rê-de contínua, algumas substâncias são formadas por agrupamentos de hátomus neutros, dispostos em arranjos independentes, com massa definida, denominados moléculas.
As substâncias formadas por moléculas, denominadas substâncias moleculares, apresentam propriedades e características variadas. À tempera-túra ambiente, podem se apresentar na forma de gás, líquido ou sólido. Podem formár materiais cristalinos ou amorfos (não cristalinos), duros ou macios e, ainda, maleáveis ou quebradiços. A maioria não dissolve em á gua e não conduz corrente elétrica.
REFLITA
1 Em seu caderno, escrêeva o quê você entende por molécula e desenhe uma de acôr-do com critérios quê considere adequados, apontando as características dela.
Página cento e trinta e cinco
Ligações covalentes
As energias de ionização dos hátomus de elemêntos não metálicos são altas, e a diferença de eletronegatividade entre eles não é grande o suficiente para ocasionar transferência de elétrons com formação de íons e substâncias iônicas. Por essa razão, a existência de substâncias formadas por hátomus de elemêntos não metálicos despertou o interêsse de cientistas e se tornou objeto de pesquisa.
Para explicá-los, os químicos Gilbert líuis e Irving Langmuir desenvolveram uma proposta de ligação química quê envolve o compartilhamento de pares de elétrons. A estabilidade resultante dêêsse compartilhamento diminui a distância entre os hátomus e os mantém unidos. Conforme mencionado anteriormente, Langmuir sugeriu o termo covalência para se referir a essas ligações.
Assim, ligação covalente é aquela quê se estabelece, preferencialmente, entre elemêntos não metálicos. Quando ela ocorre entre dois ou mais hátomus do mesmo elemento químico ou de elemêntos químicos diferentes, são formadas moléculas.
Para compreendê-la, considere a formação de uma molécula de hidrogênio (H2). Os hátomus de hidrogênio têm apenas um elétron e, quando dois deles se aproximam, há forças de repulsão entre os núcleos (positivos) e os elétrons (negativos). No entanto, há também forças de atração entre o núcleo de um átomo e o elétron do outro átomo. Como ambos têm o mesmo valor de eletronegatividade, não há transferência de elétrons. Assim, para alcançarem estabilidade eletrônica de acôr-do com a regra do octeto, ocorre o compartilhamento de elétrons, de modo quê a configuração eletrônica dos hátomus de hidrogênio na molécula passa a sêr igual à de hátomus do gás nobre He (2 elétrons no nível K). Conclui-se, portanto, quê o arranjo se mantém estável por uma ligação covalente.
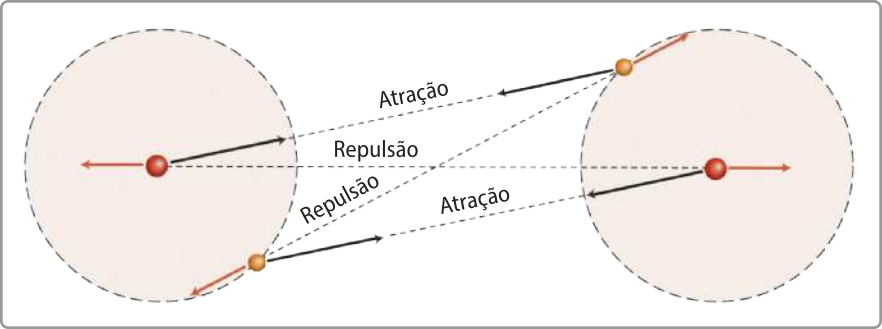
Representação de substâncias moleculares
A formação das ligações covalentes póde sêr representada por meio das estruturas de líuis. Considere, para isso, uma molécula de flúor. Cada átomo de flúor possui sete elétrons na camada de valência. Dessa maneira, a representação dêêsse átomo deve incluir três pares de elétrons e um elétron isolado ao redor do sín-bolo do elemento (F). Ao compartilhar um par de elétrons, esses hátomus alcançam a configuração eletrônica do neônio e estabelecem uma ligação covalente estável, formando uma molécula.
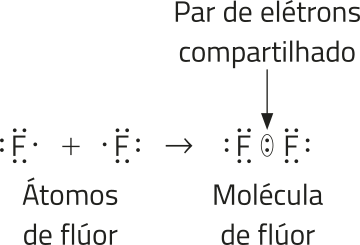
Página cento e trinta e seis
Uma maneira mais simples de representar as ligações covalentes é utilizando os símbolos dos hátomus dos elemêntos químicos separados por um traço. Nessa linguagem, denominada fórmula estrutural, cada traço simboliza o compartilhamento de um par de elétrons.
F – F
As moléculas podem sêr representadas pêlos elemêntos quê as formam com um índice subscrito indicando a quantidade de hátomus de cada elemento. São as fórmulas moleculares, e algumas dessas representações já aparecêram anteriormente. Como exemplo, pode-se citar a molécula de flúor, F2, formada por dois hátomus de flúor; a molécula de ozônio, O3, formada por três hátomus de oxigênio; e a molécula de á gua, H2O, formada por dois hátomus de hidrogênio e um átomo de oxigênio.

É importante frisar quê a fórmula molecular não evidên-cía a maneira quê os hátomus estão ligados, apenas representa o tipo e a quantidade de hátomus de cada elemento em uma molécula.
As fórmulas mínimas das substâncias iônicas, já apresentadas, correspondem à proporção entre cátions e ânions do par iônico. Nas substâncias moleculares, cada conjunto de hátomus ligados constitui uma entidade química independente, portanto as fórmulas moleculares não podem sêr simplificadas.
A fórmula da á gua oxigenada, por exemplo, é H2O2. Os coeficientes indicam quê cada molécula tem dois hátomus de hidrogênio e dois hátomus de oxigênio. Se essa molécula fosse representada utilizando o critério da fórmula mínima simplificada, a representação seria HO, quê não constitui uma espécie química estável (não confundir com o íon hidróxido, OH−, cujas propriedades são totalmente diferentes das da á gua oxigenada).
Fórmula estrutural condensada
Conforme estudado, uma maneira de representar as ligações covalentes é por meio da fórmula estrutural. Essa representação fornece, como o nome sugere, indicações sobre a estrutura da molécula, isto é, sobre como os hátomus se organizam e quais são os tipos de ligação envolvidos.
Acompanhe a fórmula estrutural da vitamina C.
Para simplificar essa representação, pode-se utilizar a condensação, em quê são indicados conjuntos de hátomus com base na sua organização ao longo da molécula.

Página cento e trinta e sete
Acompanhe alguns exemplos.
Algumas substâncias e suas fórmulas
Substância |
Fórmula molecular |
Fórmula estrutural |
Fórmula condensada |
|---|---|---|---|
Ácido acético |
C2H4O2 |
|
CH3COOH |
Propanol |
C3H6O |
|
CH3CH2CH2OH ou CH3(CH2)2OH |
Acetona |
C3H6O |
|
(CH3)2CO |
A fórmula condensada é um recurso bastante útil, em especial para representar substâncias orgânicas, quê serão estudadas posteriormente.
Representações tridimensionais
A fórmula estrutural póde representar a estrutura da molécula, mas não descreve, de maneira fiel, seu arranjo tridimensional. Para isso, existem as representações tridimensionais. Sua elaboração é normalmente feita em softwares especializados.
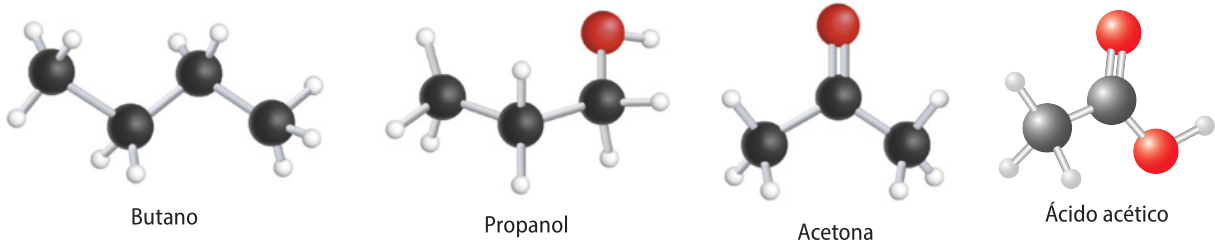
Tipos de ligação covalente
Quando as ligações covalentes são formadas pelo compartilhamento de apenas um par de elétrons, elas são denominadas ligações simples.
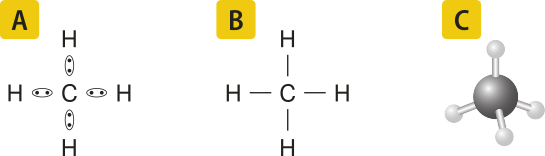
Em algumas moléculas há ligações nas quais ocorre o compartilhamento de dois pares de elétrons, denominadas ligações duplas. Acompanhe a seguir como representá-las.
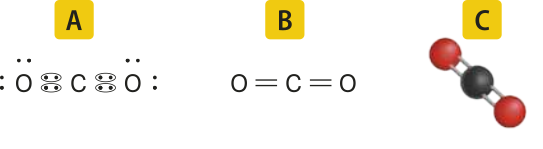
Página cento e trinta e oito
Quando as ligações covalentes são formadas pelo compartilhamento de três pares de elétrons entre dois hátomus, elas são chamadas de ligações triplas.

Em alguns casos, uma ligação covalente é estabelecida quando um átomo fornece ambos os elétrons do arranjo (denominados pares de elétrons não ligantes). Esse tipo de ligação costumava sêr chamado de ligação covalente coordenada ou dativa. No entanto, essa terminologia, assim como sua representação por meio de uma seta, sugerindo d fórma incorréta quê um átomo “doava” um par de elétrons, não é mais recomendada. Atualmente, sabe-se quê essas ligações são iguais às covalentes mencionadas anteriormente e são representadas por um traço, como o das ligações simples.
Para compreender como a ligação covalente ocorre, considere o exemplo do íon amônio ( ), formado por meio da reação entre a amônia (NH3) e o íon hidrogênio (H+;também denominado próton).
Explicar quê o termo próton é utilizado para se referir ao íon de hidrogênio porque ele é, basicamente, um próton. O átomo de hidrogênio é formado por um próton no núcleo e um elétron na eletrosfera. Quando há transferência dêêsse único elétron, o quê resta é apenas o próton, já quê o núcleo do átomo de hidrogênio não contém nêutrons.
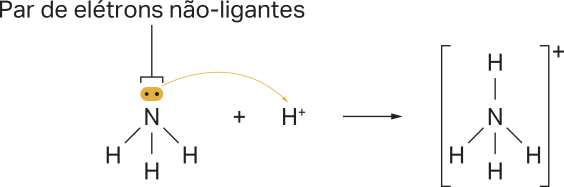
Com o par de elétrons do nitrogênio compartilhado com o H+, a camada mais externa dêêsse íon hidrogênio também é preenchida completamente com dois elétrons. O resultado é uma espécie química de carga positiva, ou seja, um cátion poliatômico.
Alotropia
As substâncias não são caracterizadas apenas pelo tipo de ligação. A forma como os hátomus se organizam no espaço também póde variar, atribuindo propriedades diferentes às substâncias.
A capacidade quê os hátomus de alguns elemêntos químicos têm de formár diferentes tipos de substância simples é chamada de alotropia. As diferentes substâncias são chamadas de formas alotrópicas (ou alótropos), quê podem diferir quanto à organização cristalina, às propriedades físicas e químicas e à quantidade de hátomus (atomicidade).
Um exemplo de elemento químico quê forma alótropos é o carbono, quê póde se apresentar na forma de grafite (macio e cinza) e diamante (duro e translúcido). Outras formas alotrópicas do carbono foram sintetizadas mais recentemente: fulerenos (1985), nanotubos de carbono (1991), grafeno (1994) e Q-carbono (2015).
Página cento e trinta e nove
Outro exemplo é o enxofre, quê tem vários alótropos, sêndo os dois mais importantes o enxofre rômbico e o enxofre monoclínico, ambos constituídos de moléculas com oito hátomus em forma de anel quê diferem em termos de arranjo espacial.

Geometria molecular
As representações tridimensionais foram mencionadas como uma das maneiras de descrever arranjos tridimensionais de moléculas.
E como essas representações podem sêr determinadas?
A forma mais adequada é por meio de estudos da disposição espacial dos hátomus em uma molécula e da maneira quê essa disposição afeta as propriedades físicas e químicas da substância, o quê envolve dados experimentais e cálculos teóricos. O arranjo espacial de uma molécula, ou sua geometria molecular, é determinada principalmente pêlos pares de elétrons ao redor do átomo central.
Prevendo a geometria molecular
O físico-químico japonês Ryutaro Tsuchida (1903-1962), em 1939, e, de maneira independente, os químicos ingleses Nevil víncent Sidgwick (1873-1952) e Herbert Marcus Powell (1906-1991), em 1940, apresentaram um modelo quê relacionava os elétrons da camada de valência dos hátomus com a geometria das moléculas. Posteriormente aprimorado, esse modelo ficou conhecido como modelo da repulsão dos pares de elétrons da camada de valência (RPECV). Nas universidades brasileiras, é comum o uso da sigla VSEPR, quê remete ao nome do modelo em inglês, valence-shell electron-pair repulsion.
Em outras palavras, de acôr-do com esse modelo, primeiro, é preciso identificar a disposição dos elétrons na camada de valência, ou seja, verificar se são ou não compartilhados em ligações, para determinar a geometria de uma molécula.
Foi estudado quê, em ligações covalentes entre hátomus, ocorre o compartilhamento de pares de elétrons. Isso significa quê, em uma região específica entre os hátomus ligados, existe uma maior probabilidade de encontrar esses pares de elétrons, chamados de ligantes. Além díssu, em algumas moléculas, certos hátomus podem ter pares de elétrons quê não são compartilhados, ou seja, quê não participam da ligação química. Esses pares são conhecidos como não ligantes. Os dois tipos de pares são denominados domínios de elétrons.
Página cento e quarenta
A previsão do arranjo espacial das moléculas considera a repulsão elétros-tática entre os pares de elétrons, quê tendem a se distribuírem o mais afastado possível uns dos outros para minimizar essa repulsão.
É possível seguir alguns passos para determinar a geometria de uma molécula com base nesse modelo. Acompanhe.
I) Identificar os hátomus presentes na molécula.
II) Verificar se existe um átomo central.
III) Determinar quantas ligações esse átomo central faz.
IV) Determinar a quantidade de pares de elétrons não ligantes ao redor do átomo central. Essa determinação póde sêr feita mediante desenho da estrutura de líuis da molécula (ou do íon poliatômico), o quê ajuda a identificar os domínios de elétrons e como eles se organizam para minimizar a repulsão.
Alguns exemplos dessas estruturas estão reunidos a seguir.
Exemplos de arranjo espacial de moléculas segundo o modelo RPECV
Domínios de elétrons |
Disposição dos domínios |
Domínios ligantes |
Domínios não ligantes |
Geometria da molécula |
Exemplos |
|---|---|---|---|---|---|
2 |
|
2 |
0 |
|
|
3 |
|
3 |
0 |
|
|
2 |
1 |
|
|
||
4 |
|
4 |
0 |
|
|
3 |
1 |
|
|
||
2 |
2 |
|
|
Imagens sem escala; cores fantasía.
Página cento e quarenta e um
Note quê, na coluna de exemplos, foram usadas duas representações para a ligação simples (–) ainda não apresentadas. São as notações em cunha, quê sérvem para indicar ligações quê estão fora do plano da fô-lha de papel. As cunhas cheias (![]() ) significam um átomo ou grupo de hátomus fora do plano da fô-lha de papel e mais próximo do observador. As cunhas tracejadas (
) significam um átomo ou grupo de hátomus fora do plano da fô-lha de papel e mais próximo do observador. As cunhas tracejadas (![]() ) significam um átomo ou grupo de hátomus atrás do plano e mais distante do observador.
) significam um átomo ou grupo de hátomus atrás do plano e mais distante do observador.
A geometria molecular é essencial para entender muitas propriedades de uma molécula, como polaridade, reatividade e interações intermoleculares.Por exemplo, a geometria da molécula de á gua (angular) contribui para sua polaridade, quê, em contrapartida, influencía sua tempera-túra de ebulição e sua capacidade de dissolver outras substâncias. Assim, estudar a geometria molecular é fundamental para compreender a relação entre a estrutura e o comportamento das moléculas.
ESPAÇOS DE APRENDIZAGEM
• êste simulador explora a geometria das moléculas e a repulsão entre os domínios.
PHYSICS EDUCATION TECHNOLOGY INTERACTIVE SIMULATIONS. Geometria molecular. Boulder: iUnivêrsity ÓF Colorado, c2024. Disponível em: https://livro.pw/zdoyv. Acesso em: 17 set. 2024.
OFICINA CIENTIFICA
Geometria molecular utilizando balões
por quê a molécula de á gua é angular, e não linear? Para responder a essa pergunta, siga as orientações e obtenha um modelo simples capaz de ilustrar como os hátomus e elétrons de valência estão organizados nas substâncias covalentes.
Materiais
• 4 balões de festa de mesmo tamãnho.
Procedimentos
• Primeiro, encha todas as bê-chi-gâs (que devem ficar do mesmo tamanho) e amarre-as, fechando a saída de ar.
• Utilizando as próprias pontas das bê-chi-gâs, amarre duas delas.
• Agora, amarre uma terceira a essas duas.
• Por último, amarre a quarta bexiga ao grupo. póde sêr mais fácil soltar a terceira e pren-dêla à quarta, fazendo dois grupos com duas bê-chi-gâs e, depois, unindo os pares.
ATIVIDADES
1. Como se posicionam as duas bê-chi-gâs amarradas?
2. Como se posicionam as três bê-chi-gâs amarradas?
3. Que forma toma o conjunto de quatro bê-chi-gâs?
4. Como você explicaria as diferentes formas observadas nos conjuntos de dois, três e quatro bê-chi-gâs utilizando o modelo RPECV?
Página cento e quarenta e dois
Ligações químicas nos metais
Não se póde discutir a ssossiedade moderna e sua história sem destacar as estruturas quê o sêr humano construiu ao longo dos séculos utilizando metais e suas ligas. Desde pontes e arranha-céus até veículos e eletroeletrônicos, os metais são fundamentais para o desenvolvimento tecnológico e industrial. O quê torna esses materiais tão valiosos são suas propriedades singulares, como a alta resistência mecânica, quê garante durabilidade, além da boa condutividade térmica e elétrica, essenciais em diversas aplicações.
O uso de metais pela humanidade remonta a milhares de anos, desde a Idade do Bronze. A partir da Revolução Industrial, a capacidade de manipular e produzir esses materiais em grande escala impulsionou o avanço das sociedades.
Por mais quê os metais estejam entre os materiais mais utilizados na indústria, a maioria deles não é encontrada em sua forma pura na natureza (ouro e prata são exceções). Geralmente, são extraídos de minerais, nos quais estão combinados com outros elemêntos químicos.

A mineração e o processamento dêêsses minerais são etapas importantes para a obtenção de metais utilizáveis, como o alumínio, o ferro, o chumbo e o cobre, os quais, posteriormente, podem sêr fundidos e transformados em ligas metálicas. As ligas, como o aço, são ainda mais versáteis, pois combinam características de diferentes metais.
REFLITA
2 Quais são as propriedades dos metais?
Página cento e quarenta e três
AlGO A+
Formação de pepítas de ouro
Um estudo recente, feito por pesquisadores na Austrália, propõe uma nova teoria para a formação de grandes pepítas de ouro na natureza, um fenômeno geológico quê, até então, não era bem explicado.
[…]
Pela nova teoria, os terremotos geram um campo elétrico quê atrai ouro dissolvido em fluidos, quê são forçados a subir do subsolo.
[...]
O acúmulo de ouro [...] ocorre porque o ouro é um bom condutor elétrico, enquanto o quartzo [onde são formadas as pepitas] é isolante. Uma vez quê algum ouro é depositado, ele se torna um ponto focal para crescimento posterior dos cristais, efetivamente “revestindo” os grãos de ouro com mais ouro.
[...]
Esta nova compreensão da formação de pepítas de ouro não apenas lança luz sobre um antigo mistério geológico, como também destaca a inter-relação entre os processos químicos e físicos da Terra.
PEPITAS de ouro podem se formár pela eletricidade gerada por terremotos. [S. l.]: Inovação Tecnológica, 3 set. 2024. Disponível em: https://livro.pw/ivutl. Acesso em: 17 set. 2024.

Os minerais são materiais sólidos, geralmente inorgânicos, com uma composição química definida e uma estrutura cristalina ordenada. Eles podem sêr formados por ligações iônicas, covalentes, metálicas ou uma combinação dessas.
Por meio de um tratamento metalúrgico, ou seja, de um conjunto de processos industriais quê envolvem transformações físicas e químicas, substâncias metálicas podem sêr obtidas dêêsses minérios.
Os metais são substâncias sólidas a pressão e tempera-túra ambientes (com exceção do mercúrio) e apresentam alta densidade; formam materiais cristalinos, ou seja, os hátomus se organizam em arranjos estruturais regulares; apresentam condutividade elétrica alta, o quê possibilita sua utilização em fios e em outros componentes eletroeletrônicos; apresentam, em geral, altas tempera-túras de fusão e condutividade térmica elevada, permitindo o uso em panelas e em diferentes tipos de aquecedores; têm maleabilidade e ductibilidade altas, o quê possibilita sua utilização na confekissão de chapas fínas e de fios resistentes; e, por fim, têm resistência elevada à tração e à compressão, proporcionando aplicações em próteses médicas e vigas de construção.

Página cento e quarenta e quatro
Ligações metálicas
Em uma substância metálica, todos os hátomus são iguais; logo, não há um átomo quê tenda a transferir elétrons em relação a outro ou quê atraia elétrons mais do quê outro. Além díssu, nesses hátomus, costuma-se havêer uma fraca interação elétros-tática entre os elétrons da camada de valência e o núcleo. Como consequência, esses elétrons têm mais facilidade de se deslocar ao longo do retículo cristalino metálico, interagindo com mais de um núcleo. Os elétrons das camadas internas, ao contrário, interagem mais fortemente com seus respectivos núcleos atômicos, portanto não transitam livremente pelo retículo cristalino metálico.
A movimentação de elétrons de valência, chamados deslocalizados, entre hátomus de metais quando há certa proximidade entre eles constitui as ligações metálicas.
Acompanhe uma representação dêêsse tipo de ligação a seguir.

A alta mobilidade dessas partículas explica, por exemplo, a alta condutividade elétrica e térmica dos metais.
Frequentemente, essa movimentação dos elétrons nas ligações metálicas é descrita como “mar de elétrons” ou “nuvem de elétrons”, mas essas são analogias imprecisas e seu uso deve sêr desencorajado. É importante frisar quê os elétrons, embora apresentem cérto grau de liberdade por não estarem associados a nenhum átomo específico, fazem parte do material.
Representação de substâncias metálicas
As substâncias metálicas são formadas por hátomus do mesmo elemento químico quê ocupam todo o retículo. Portanto, não há necessidade de calcular proporções entre eles.
As substâncias metálicas são representadas com o sín-bolo do elemento e seu estado físico. Pode-se também utilizar o termo metálico para indicar quê se trata de uma substância simples, e não de um elemento. Por exemplo, a substância simples formada pelo elemento químico sódio é chamada de sódio metálico e representada como Na(s).
Página cento e quarenta e cinco
Ligas metálicas
Ao apresentar as ligas metálicas, reforçar quê não se tratam de substâncias únicas, mas sim materiais formados por duas substâncias metálicas diferentes.
Uma liga metálica é um material caracterizado por uma combinação de substâncias em quê o metal é o elemento predominante. As propriedades de uma liga metálica diferem das características de seus constituintes e são influenciadas por vários aspectos, como as substâncias quê a compõem, as proporções em quê estão presentes, o tipo de estrutura cristalina formada e o tamãnho e a organização dos cristais quê se dêsênvólvem.
O objetivo principal da criação de uma liga metálica é obtêr propriedades distintas em comparação com os metais puros, como maior resistência mecânica, durabilidade e resistência à corrosão.
As ligas metálicas podem sêr classificadas de várias maneiras. A mais comum é baseada na composição do metal principal. Quando o metal predominante é ferro, como no aço e no ferro fundido, a liga é chamada de ferrosa. Se o metal principal é outro, como alumínio, cobre ou titânio, a liga é denominada não ferrosa. Outra forma de classificação é pelo comportamento mecânico, quê póde variar de ligas duras e resistentes, como o aço, a ligas maleáveis e dúcteis, como as de alumínio.
A obtenção das ligas metálicas geralmente envolve o derretimento do metal principal e a adição controlada de outras substâncias em fôrnos específicos. Após a fusão e a mistura dos componentes, o material é resfriado para formár a liga com a estrutura cristalina desejada. O contrôle da composição, da tempera-túra e da velocidade de resfriamento permite ajustar as propriedades da liga, garantindo o dêsempênho adequado para cada tipo de aplicação.

[MÁSCARA trágica]. [ca. 400 a.C.-301 a.C.]. 1 máscara, bronze.
ATIVIDADES
1. Represente, por meio das estruturas de líuis e da fórmula estrutural plana, as ligações quê formam as moléculas a seguir.
a) NH3
b) H2S
c) BC(éli)"3
d) C2H2
e) CH2F2
2. Com base na atividade anterior, identifique as geometrias moleculares para cada substância, segundo o modelo de repulsão dos pares de elétrons da camada de valência.
3. Considere a molécula de á gua (H2 O) e a molécula de gás carbônico (CO2). Identifique as geometrias moleculares delas e indique se são iguais. Justifique a sua resposta.
4. Considere as moléculas de hidrogênio (H2), de oxigênio (O2) e de nitrogênio (N3) e represente o tipo de ligação covalente de cada uma delas.
5. Como os elétrons livres afetam as propriedades mecânicas dos metais?
Página cento e quarenta e seis
TEMA
12
Polaridade e interações
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
A densidade é a propriedade quê explica por quê determinado objeto flutua em um líquido ou afunda. Por exemplo, uma esféra de plástico, quê tem densidade menor do quê a da á gua, flutua nela, enquanto uma moeda, fabricada de metal, um material mais denso do quê a á gua, afunda completamente.
No entanto, por vezes, há situações quê parecem fugir a essa regra. Você já reparou como vários insetos conseguem andar sobre a á gua, mesmo tendo densidades maiores do quê a dela? Esse fato também póde sêr observado com objetos comuns do dia a dia. Se um clipe ou um grampo de metal, de densidade maior do quê a da á gua, for posicionado cuidadosamente na superfícíe dela, ele não afundará.
Isso ocorre por causa da tensão superficial da á gua, fenômeno quê resulta das interações moleculares nessa substância.

Distribuição de cargas nas moléculas
Antes de apresentar o conceito de interações entre as moléculas, é necessário entender o fenômeno quê as causa, a polaridade. Esse fenômeno está relacionado com a diferença de eletronegatividade entre os hátomus quê participam de uma ligação química e com a geometria molecular.
Uma molécula é chamada de polar quando ela apresenta um dipolo elétrico, ou seja, uma região eletricamente negativa e outra região eletricamente positiva. Quando essas regiões não existem na molécula, ela é chamada de apolar, ou seja, sem polaridade.
Note quê o nome polo é dado a uma região quê centraliza algo. Em Manaus, capital do estado do Amazonas, por exemplo, há um polo industrial, quê é uma região onde se concentram diversas indústrias. No contexto da Química, um polo elétrico é a região de uma molécula na qual se concentram cargas elétricas, e um dipolo são duas regiões.
REFLITA
1 O quê é polaridade? Em quê contexto você já notou essa palavra sêr utilizada?
Página cento e quarenta e sete
O fator eletronegatividade
Como estudado, a eletronegatividade é a tendência quê um átomo tem de atrair elétrons. Essa tendência póde sêr avaliada por meio da escala de Pauling, apresentada nos estudos a respeito da tabéla periódica.
Relembre os valores de eletronegatividade de alguns elemêntos químicos.
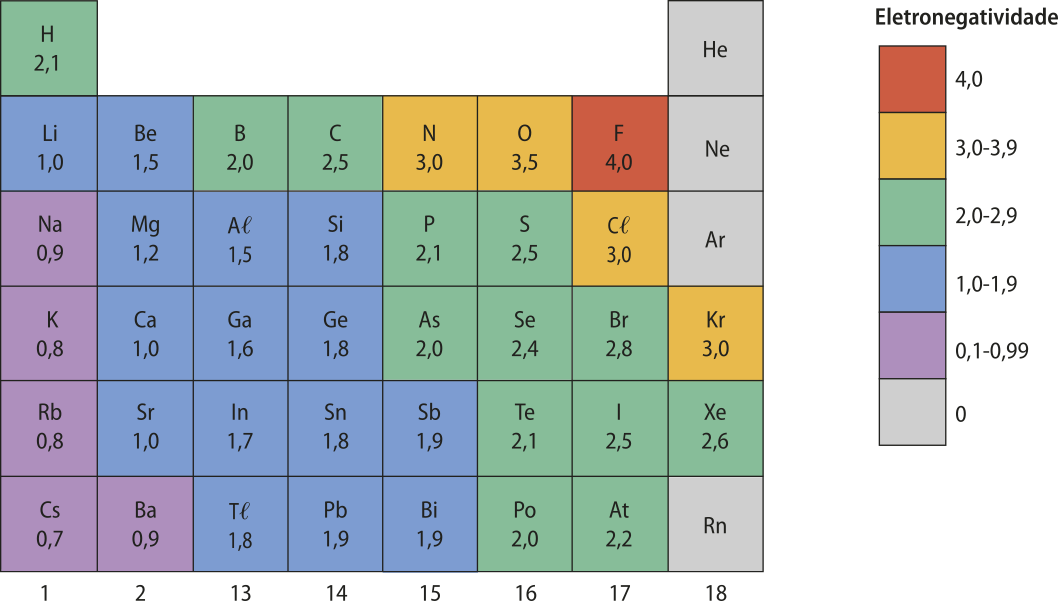
Fonte: CHANG, Raymond. Chemistry. 10th ed. níu iórk: macrau Hill, 2010. p. 378.
Quando dois hátomus iguais se ligam para formár uma molécula diatômica, a distribuição de cargas nessa molécula é uniforme, e não há polaridade. Quando dois hátomus com eletronegatividade diferente se ligam, o átomo mais eletronegativo tende a atrair com mais intensidade os elétrons da ligação, criando uma distribuição desigual de carga, ou seja, um dipolo elétrico.
É importante notar quê não se trata de uma carga formal, como há nos íons, mas de uma carga parcial, ou seja, uma região negativa da molécula, na qual os elétrons estão mais concentrados, representada por (delta)"− (lê-se: delta negativo), e outra região positiva, de menor concentração eletrônica, representada por (delta)"+ (lê-se: delta positivo). A região negativa é originada da atração dos elétrons, enquanto a região positiva resulta do deslocamento deles, e não necessariamente da presença de cargas positivas.
Na ligação entre dois hátomus de hidrogênio, por exemplo, não há formação de dipolos. Já na ligação entre um átomo de hidrogênio, quê, segundo a escala de Pauling, apresenta eletronegatividade de 2,1, e um átomo de oxigênio, quê apresenta eletronegatividade de 3,5, há formação de dipolo, conforme as representações a seguir.
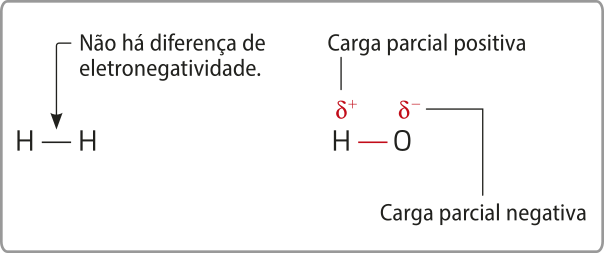
Neste momento dos estudos, cabe fazer uma observação importante. A distinção entre ligações iônicas e covalentes não é rígida. As ligações varíam em caráter, podendo sêr mais ou menos iônicas ou mais ou menos covalentes. Esse caráter póde sêr estimado por meio da diferença de eletronegatividade entre os hátomus quê participam da ligação. Quando essa diferença é pequena, a ligação tende a sêr covalente apolar. À medida quê a diferença aumenta, a ligação se torna mais polar, e um aumento ainda maior resulta em um caráter mais iônico, até quê a ligação seja predominantemente iônica.
Página cento e quarenta e oito
O fator geometria molecular
A disposição espacial dos hátomus na molécula também influencía a polaridade. Se as ligações polares de uma molécula estiverem dispostas de maneira simétrica, as cargas podem se cancelar, resultando em uma molécula apolar. Em contrapartida, se a distribuição de ligações polares for assimétrica, não haverá cancelamento total de cargas, e a molécula será polar.
Isso póde sêr avaliado por meio do momento dipolar, representado pela letra grega μ (lê-se: mi), uma grandeza vetorial quê méde a concentração de cargas elétricas em uma molécula.
O gás carbônico (CO2), por exemplo, tem duas ligações polares (C = O), mas, por causa de sua geometria linear, essas polaridades se cancelam, resultando em uma molécula apolar. O gás metano (CH4) apresenta quatro ligações polares (C (triângulo)" H), mas, por causa de sua geometria tetraédrica, essas polaridades também se cancelam, resultando em uma molécula apolar. Já a á gua tem duas ligações polares (H (triângulo)" O) e uma geometria angular. Nesse caso, não há cancelamento dos vetores, e a molécula é polar.
Note, nas representações a seguir, como o sentido de cada vetor está orientado para o átomo mais eletronegativo, indicando a atração dos elétrons. Quando o momento dipolar é igual a zero, a molécula é apolar, e, quando é diferente de zero, ela é polar.
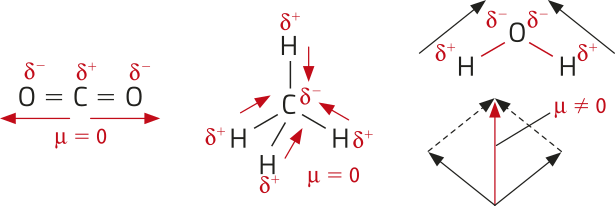
ESPAÇOS DE APRENDIZAGEM
• êste simulador explora a polaridade das moléculas.
PHYSICS EDUCATION TECHNOLOGY INTERACTIVE SIMULATIONS. Polaridade da molécula. Boulder: iUnivêrsity ÓF Colorado, c2024. Disponível em: https://livro.pw/rnpvk. Acesso em: 2 maio 2025.
As interações moleculares
As moléculas de uma substância não existem d fórma isolada, elas interagem entre si.
As interações intermoleculares são forças de atração elétros-tática quê se estabelecem entre moléculas eletricamente nêutras. Embora sêjam mais fracas quê as intramoleculares (como as ligações covalentes e iônicas), as interações intermoleculares explicam muitas das propriedades físicas e químicas das substâncias, como a tempera-túra de ebulição, a solubilidade e o estado físico à tempera-túra ambiente.
Em 2002, cientistas estadunidenses demonstraram quê as lagartixas conseguem andar por diferentes superfícies, independentemente de sua inclinação. Esse fato ocorre por causa das interações intermoleculares quê se estabelecem entre as estruturas presentes em suas patas e as moléculas quê compõem a superfícíe, e não por causa de algum tipo de cola secretada por elas.
Existem diferentes tipos de interação intermolecular, quê dependem da polaridade (permanente, instantânea ou induzida) e da natureza das moléculas envolvidas. Eles serão estudados mais adiante.
REFLITA
2 Considerando quê as moléculas podem sêr mais ou menos polares, como você imagina quê isso influencía na solubilidade das substâncias em um solvente polar, como a á gua?
SOBRE
O termo intermolecular indica interação entre moléculas diferentes. Já o termo intramolecular indica interação em uma mesma molécula.
Página cento e quarenta e nove

Todas as forças atrativas e repulsivas envolvidas nas interações moleculares – quê não sêjam aquelas em consequência da formação de ligações ou da interação elétros-tática entre íons, entre grupos iônicos ou entre grupos iônicos e moléculas nêutras – são também chamadas de interações de vã der Waals. O nome é uma homenagem ao físico neerlandês Johannes Diderik vã der Waals (1837-1923), primeiro cientista a tentar explicar essas forças, em 1873.
Se achar conveniente, mencionar quê as interações de vã der Waals podem ocorrer entre grupos de uma mesma molécula. Nesse caso, são comuns em macromoléculas.
Interações entre moléculas polares
As moléculas polares apresentam uma distribuição de carga desigual, quê gera dipolos elétricos permanentes, em quê uma região da molécula é permanentemente positiva e outra, permanentemente negativa. Quando ocorre interação entre moléculas polares, suas regiões positivas e negativas tendem a se aprossimár em razão de forças elétros-táticas de atração.
Esse tipo de interação póde sêr chamado de interação dipolo-dipolo, ou, ainda, de dipolo permanente-dipolo permanente.
Ligações de hidrogênio
As ligações de hidrogênio são interações mais intensas entre dipolos permanentes e ocorrem por meio da atração entre os hátomus de hidrogênio ligados d fórma covalente a um átomo muito eletronegativo, como o flúor, o oxigênio ou o nitrogênio, e o par de elétrons livres de outro átomo muito eletronegativo, como o flúor, o oxigênio ou o nitrogênio.
Apesar de não se formarem íons nessa interação, ela é tão intensa quê póde sêr considerada elétros-tática. Isso ocorre porque o hidrogênio é um átomo muito pequeno, quê contém apenas um próton no núcleo e um elétron na eletrosfera, e pouco eletronegativo (2,1 na escala de Pauling). Uma ligação química envolvendo o hidrogênio e outro átomo muito eletronegativo faz com quê seu elétron seja fortemente atraído, isolando seu próton e gerando um dipolo intenso.
A ligação de hidrogênio se estabelece, então, quando esse próton isolado interage com outra região negativa de outra molécula ou até mesmo da mesma molécula, a depender de seu tamãnho. Na molécula de á gua, por exemplo, cada átomo de hidrogênio póde interagir com um par de elétrons não compartilhados de um átomo de oxigênio de uma molécula vizinha.
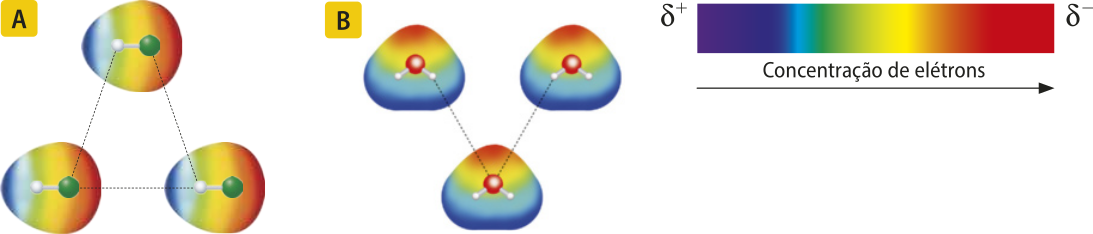
Página cento e cinquenta
FORMAÇÃO CIDADÃ
A tensão superficial da á gua
Em um corpo de á gua, como um rio, um lago ou mesmo um copo com á gua, há uma quantidade enorme de moléculas de H2 O. Mesmo em movimento, elas fazem ligações de hidrogênio entre si, quê podem ocorrer em todas as direções. As moléculas de á gua localizadas na superfícíe, no entanto, não estão completamente rodeadas por outras e interagem com as moléculas quê estão ao lado e abaixo e com as moléculas de gases presentes no ar, como N2 e O2.
Como as interações entre o líquido e os gases, nesse caso, são bastante fracas, a interação das moléculas de á gua da superfícíe com as moléculas ao seu lado e abaixo faz com quê elas sêjam atraídas para o centro do líquido, criando uma tensão na superfícíe, pois a tendência quê as moléculas de superfícíe têm de penetrar no líquido é impedida pela resistência das quê estão no interior. É por causa díssu quê alguns insetos conseguem pousar sobre a superfícíe da á gua sem afundar.

A tensão superficial também explica outros fenômenos, como a formação de gotas quando a á gua está sobre uma superfícíe feita de algum material com o qual as moléculas de á gua não interagem fortemente. Esse fenômeno não se restringe à á gua. O mercúrio metálico, à tempera-túra ambiente, é um dos líquidos conhecidos com maior tensão superficial. Por isso, normalmente, ele tende a não se espalhar nas superfícies, formando pequenas gotas.

ATIVIDADES
Há rios tão poluídos atualmente quê se tornaram notícia em jornais do Brasil e do mundo. Pesquise reportagens publicadas em jornais locais (ou vídeos na internet) sobre rios poluídos. Caso a região onde mora tenha rios próximos, procure saber sobre a qualidade de suas águas. Em seguida, responda às kestões.
1. Quais são as consequências da poluição dos rios sobre a ssossiedade? Caso haja um rio poluído em sua cidade, escrêeva um pequeno texto relatando os possíveis problemas enfrentados pelas pessoas quê moram perto dêêsse rio.
2. O quê acontece com a tensão superficial da á gua quando ela está poluída?
3. Quais são as consequências da alteração da tensão superficial sobre o ambiente?
4. Que ações podem sêr realizadas para evitar a poluição dos rios?
Página cento e cinquenta e um
Interações entre moléculas apolares
Moléculas apolares podem apresentar dipolos elétricos instantâneos, isto é, não permanentes e de breve duração. Eles se formam porque os elétrons estão em constante movimento e podem se concentrar momentaneamente em uma parte da molécula, criando regiões temporárias de carga parcial negativa e carga parcial positiva.
Esse dipolo instantâneo póde induzir um dipolo instantâneo em outra molécula próxima, e essa em outra, sucessivamente. Apesar de os dipolos instantâneos estarem constantemente se formando e se dissipando, a fôrça resultante dessas interações é suficiente para manter moléculas ou hátomus próximos uns dos outros.
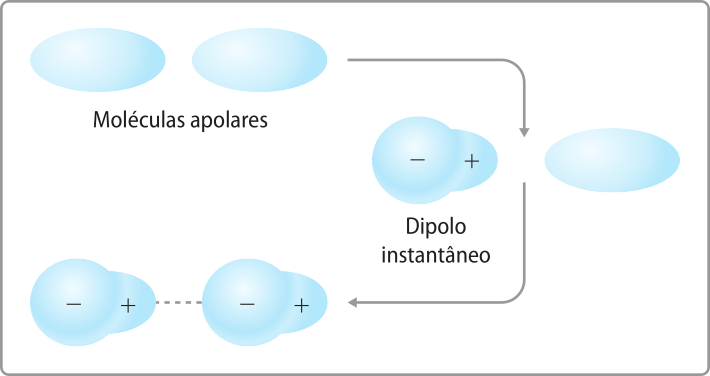
Considere a molécula diatômica de iôdo (I2). Os hátomus de iôdo são relativamente grandes. Conforme estudado, isso significa quê os elétrons do nível eletrônico mais externo são fracamente atraídos pelo núcleo e têm mais mobilidade, formando uma espécie de nuvem eletrônica. Quando uma molécula se aproxima de outra, essa nuvem póde se deslocar em razão da repulsão entre os elétrons e se aprossimár mais de um dos núcleos, gerando dipolos, quê também induzirão dipolos em outras moléculas próximas, e assim sucessivamente.
Esse tipo de interação póde sêr chamado de interação dipolo instantâneo-dipolo induzido, de forças de dispersão ou, ainda, de forças de London, em homenagem ao físico germano-estadunidense Fritz uôlfgâm London (1900-1954), quê as estudou.
Se achar conveniente, mencionar quê, normalmente, o termo nuvem eletrônica é usado para se referir às regiões em quê há maior probabilidade de se encontrar elétrons.
Interações entre moléculas polares e apolares
As interações dipolo permanente-dipolo induzido ocorrem entre uma molécula polar, quê tem um dipolo permanente, e uma molécula apolar. Quando uma molécula polar se aproxima de uma apolar, o dipolo permanente interage com os elétrons da molécula apolar, fazendo com quê ela desenvolva um dipolo induzido temporário, com uma pequena separação de cargas, d fórma semelhante à quê ocorre quando há forças de London atuando.
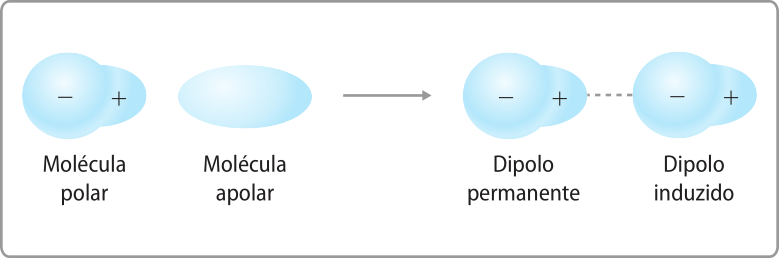
Página cento e cinquenta e dois
Influência das interações nas mudanças de estado físico
Foi estudado quê as partículas dos sólidos não se móvem livremente, pois apresentam energia cinética baixa; as dos líquidos se movimentam com certa liberdade, já quê têm energia cinética média; e as dos gases se movimentam livremente, porque apresentam energia cinética alta. Assim, o pouco movimento e a proximidade entre as moléculas de uma substância no estado sólido tornam a interação entre elas mais intensa do quê a interação entre as moléculas de uma substância no estado líquido, quê, por sua vez, interagem mais intensamente entre si do quê as moléculas de uma substância no estado gasoso.
Vale lembrar também quê mudanças de estado físico ocorrem quando há liberação ou absorção de energia. Uma substância passa do estado sólido para o líquido e dêste para o gasoso quando recebe energia, geralmente na forma de calor. Nesse processo, interações intermoleculares são rompidas. Assim, para compreender como as interações influenciam as tempera-túras de fusão e de ebulição, é preciso analisar a intensidade delas, quê varia de substância para substância.
De modo geral, quanto mais forte for a interação, maior será a energia necessária para rompê-la e, consequentemente, mais altas serão as tempera-túras de mudança de estado físico.
A fôrça das interações está associada à presença de cargas elétricas opostas quê se atraem, de modo quê, quanto mais intensa for essa atração, maior será a fôrça. Portanto, a interação mais forte é a íon-íon, porque há cargas negativas interagindo diretamente com cargas positivas; a interação dipolo permanente-dipolo permanente tem fôrça intermediária, já quê ocorre entre cargas parciais; e as forças de London são as mais fracas, pois se originam de dipolos instantâneos em moléculas apolares.
Acompanhe uma representação da escala de fôrça dessas interações.
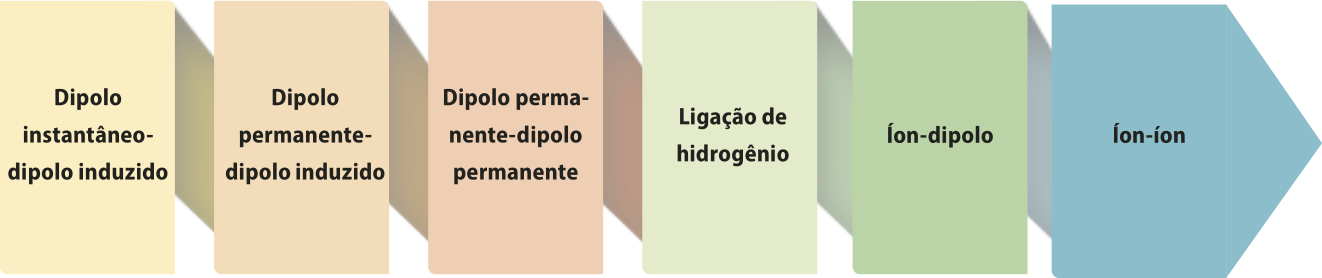
Para exemplificar, considere duas substâncias quê apresentam estrutura molecular muito parecida, o propano, de fórmula C3 H8, apolar e gasoso à tempera-túra ambiente, e o propanal, de fórmula C3 H6 O, polar e líquido à tempera-túra ambiente.
O propano tem tempera-túra de fusão de −187,8 °C e tempera-túra de ebulição de −42,1 °C, enquanto o propanal apresenta tempera-túras mais altas, sêndo a de fusão −80 °C e a de ebulição 48 °C. Essa diferença póde sêr explicada, em parte, pelo fato de a molécula de propanal apresentar um átomo de oxigênio quê, em razão de sua eletronegatividade elevada, provoca uma distribuição de carga desigual na molécula e cria um dipolo elétrico permanente. Enquanto as moléculas de propano interagem umas com as outras por meio de forças de London, por serem apolares, as moléculas de propanal interagem umas com as outras por meio de interações dipolo permanente-dipolo permanente.
REFLITA
3 Em qual estado físico ocorrem interações intermoleculares com menor freqüência e intensidade?
Página cento e cinquenta e três
Para efeito de comparação, o combustível etanol (C2 H6 O), quê apresenta massa molar similar à do propano, apresenta moléculas quê interagem umas com as outras por ligações de hidrogênio e tem tempera-túra de fusão de −114,1 °C e de ebulição de 78,2 °C, enquanto o cloreto de sódio (NaC(éli)"), quê apresenta massa molar similar à do propanal e é formado por um retículo cristalino iônico (interações íon-íon), tem tempera-túra de fusão de 800,7 °C e tempera-túra de ebulição de 1.465 °C.
Assim, ao fazer comparações para explicar diferenças entre tempera-túras de fusão e de ebulição de substâncias, é importante levar em consideração outros fatores quê também influenciam a maneira pela qual as entidades químicas interagem entre si, como os valores de massa molar. Geralmente, nuvens eletrônicas de moléculas com massas maiores se deformam mais facilmente, possibilitando interações do tipo forças de London mais intensas. As geometrias moleculares também devem sêr analisadas, pois algumas delas podem desfavorecer a ocorrência de interações, contribuindo para a redução das tempera-túras de mudança de estado físico.
Existem moléculas capazes de interagir umas com as outras por mais de um tipo de interação. Por exemplo, aquelas quê têm regiões polares e apolares podem interagir umas com as outras por ligações de hidrogênio e por forças de London.
Comparação entre as propriedades de quatro substâncias
Substância |
Tipo de interação (ordem crescente de força) |
Massa molar |
Temperatura de fusão |
Temperatura de ebulição |
|---|---|---|---|---|
Propano |
Dipolo instantâneo-dipolo induzido |
44,1 g/mol |
−187,8 °C |
−42,1 °C |
Propanal |
Dipolo permanente-dipolo permanente |
58,1 g/mol |
−80 °C |
48 °C |
Etanol |
Ligação de hidrogênio |
46,1 g/mol |
−114,1 °C |
78,2 °C |
Cloreto de sódio |
Íon-íon |
58,4 g/mol |
800,7 °C |
1.465 °C |
Fonte: HAYNES, uílhãm M. (ed.). CRC Handbook ÓF chemistry ênd physics. 95th ed. Boca Raton: CRC Préss, 2014. p. 3-246, 3-464, 4-89. E-book. Tradução nossa.
SOBRE
O conceito de massa molar será aprofundado na próxima Unidade. Por enquanto, é suficiente saber quê ele significa quê uma substância tem certa massa para uma quantidade específica de matéria. Ele é útil quando se quêr comparar propriedades de diferentes entidades químicas, pois garante que a comparação seja feita com base em uma mesma quantidade de matéria.
ATIVIDADES
1. Represente, em seu caderno, a fórmula estrutural plana das substâncias listadas a seguir e indique os vetores das ligações químicas e o vetor resultante da molécula. Com base nessas representações, especifique quais delas são polares e quais são apolares.
a) CC(éli)"4
b) H2S
c) BC(éli)"3
d) NH3
e) CH4
f) HC(éli)"
2. dêz-creva como as interações entre as moléculas influenciam nos estados físicos da matéria.
3. O quê determina se uma molécula é polar ou apolar?
4. Analise a polaridade do tetracloreto de carbono (CC(éli)"4) no item 1 e dêz-creva se essa substância se dissolve em á gua, justificando sua resposta com base na polaridade das moléculas.
Página cento e cinquenta e quatro
ORGANIZANDO AS IDEIAS
Analise o esquema a seguir, quê apresenta e relaciona os principais conceitos estudados nesta Unidade.
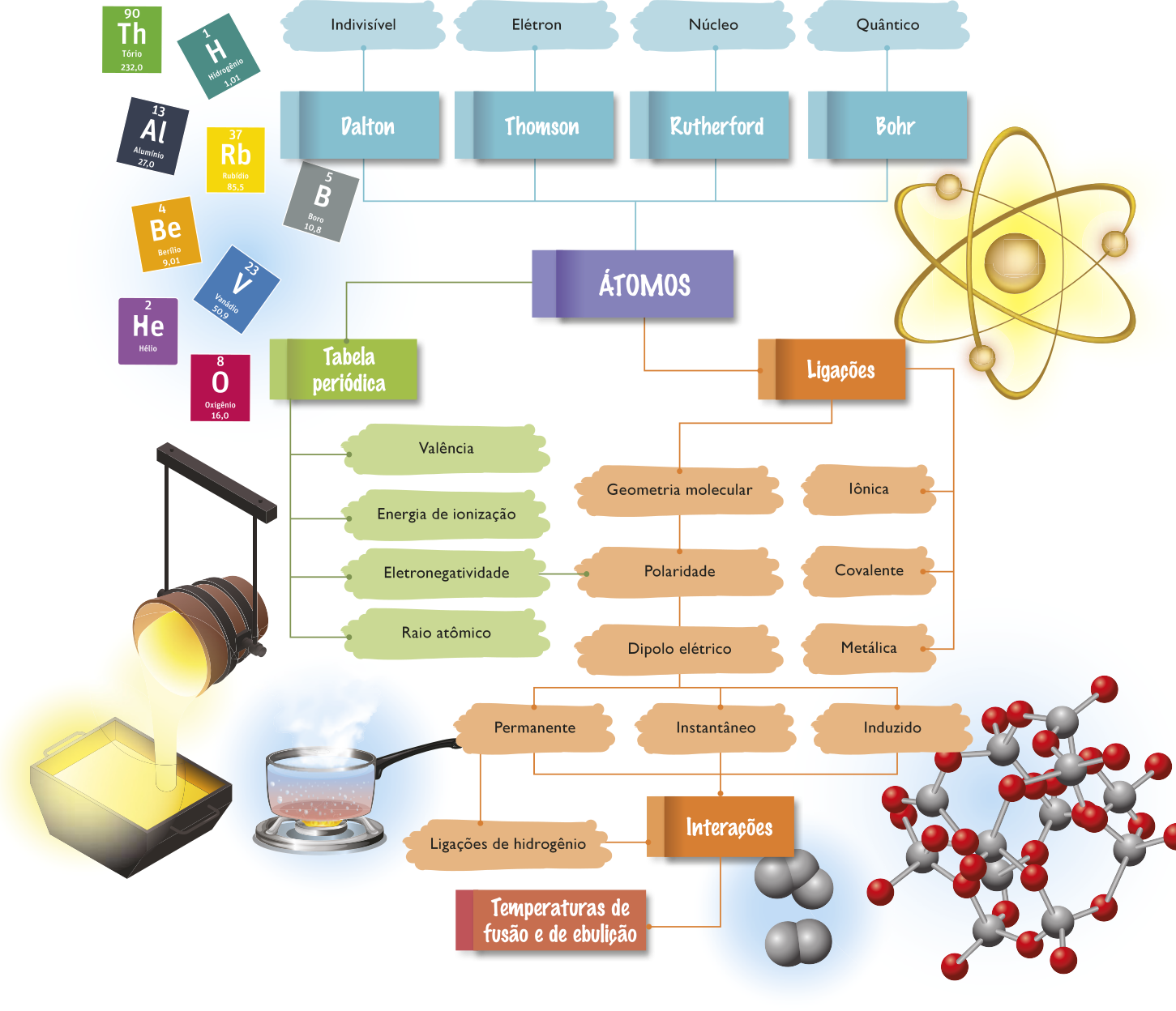
A relação entre os conceitos é uma característica do conhecimento formal, científico e escolar. Aqui, apresenta-se uma síntese esquemática dos principais conceitos trabalhados nesta Unidade. No caderno, elabore seu próprio esquema, organizando os principais conceitos da Unidade, incluindo nele outros termos e outras ideias quê se relacionam ao quê foi estudado e realizando as associações quê considerar importantes. Por fim, elabore um pequeno texto conectando os conceitos e as ideias presentes no esquema. Essa é uma boa forma de estudar e compreender melhor os conceitos.
Página cento e cinquenta e cinco
AIVIDADES COMPLEMENTARES
Respostas e comentários estão disponíveis nas Orientações para o professor.
Tema 7 – Modelando os hátomus
1. (ITA-SP) Em 1803, Diôn Dalton propôs um modelo de teoria atômica. Considere quê sobre a base conceitual dêêsse modelo sêjam feitas as seguintes afirmações:
I – O átomo apresenta a configuração de uma esféra rígida.
II – Os hátomus caracterizam os elemêntos químicos e somente os hátomus de um mesmo elemento são idênticos em todos os aspectos.
III – As transformações químicas consistem de combinação, separação e/ou rearranjo de hátomus.
IV – Compostos químicos são formados de hátomus de dois ou mais elemêntos unidos em uma razão fixa.
Qual das opções a seguir se refere a todas as afirmações corretas?
a) I e IV.
b) II e III.
c) II e IV.
d) II, III e IV.
e) I, II, III e IV.
Resposta: e)
2. (UFPA) A realização de experimentos com descargas elétricas em tubo de vidro fechado contendo gás a baixa pressão produz os raios catódicos.
Esses raios são constituídos por um feixe de:
a) nêutrons.
b) partículas.
c) raios Xís.
d) prótons.
e) elétrons.
Resposta: e)
3. (UEA-AM) O modelo atômico de thômsom resultou da interpretação de experimentos realizados por esse cientista quê envolveram
a) ampolas contendo gases rarefeitos submetidos a altas tensões elétricas.
b) a incidência de partículas alfa em lâminas metálicas delgadas.
c) proporções entre as massas de reagentes e produtos de reações químicas.
d) os efeitos magnéticos provocados pela corrente elétrica.
e) emissão de espectros luminosos por elemêntos químicos submetidos a aquecimento.
Resposta: a)
Tema 8 – Do modelo de Rutherford ao modelo quântico
4. (hú éfe ême gê) Dalton, Rutherford e Bohr propuseram, em diferentes épocas, modelos atômicos.
Algumas características dêêsses modelos são apresentadas no qüadro quê segue:
Modelo |
Característica |
|---|---|
I |
Núcleo atômico denso, com carga positiva. Elétrons em movimento. |
II |
Átomos maciços e indivisíveis. |
III |
Núcleo atômico denso, com carga positiva. Elétrons em órbitas circulares de energia quantizada. |
A associação modelo/cientista correta é:
a) I/Bohr; II/Dalton; III/Rutherford.
b) I/Dalton; II/Bohr; III/Rutherford.
c) I/Dalton; II/Rutherford; III/Bohr.
d) I/Rutherford; II/Bohr; III/Dalton.
e) I/Rutherford; II/Dalton; III/Bohr.
Resposta: e)
5. (UEG-GO) Em 1913, o cientista Niels Bohr propôs um modelo atômico quê conseguiu explicar o espectro atômico do elemento químico hidrogênio. De acôr-do com esse modelo atômico, se o átomo de hidrogênio absorver energia de uma fonte externa,
a) o elétron passará de um nível de energia E2 para um nível de menor energia E1, emitindo um fóton de energia igual a E2 − E1.
b) o elétron passará de um estado de maior energia para outro de menor energia, originando uma transição eletrônica do tipo emissão.
c) o elétron passará de um nível de energia E1 para um nível de maior energia E2, e ao retornar para o nível de energia E1 emitirá um fóton de energia igual a E2 − E1.
d) o elétron permanecerá no nível fundamental de energia porque é mais estável.
e) o elétron permanecerá em níveis energéticos mais próximos do núcleo para aumentar a estabilidade do átomo.
Resposta: c)
Página cento e cinquenta e seis
Tema 9 – tabéla periódica
6. (FGV-SP) Um professor propôs um trabalho a um grupo de alunos empregando um conjunto de 14 bolas de diferentes tipos de plásticos, para montar um modelo, com bolas e varetas, da estrutura molecular do acetato de etila, fórmula molecular C4 H8 O2. Para o experimento, os alunos dispuseram de balança e régua. Para representarem corretamente o modelo da molécula do C4 H8 O2, as bolas de plástico tí-nhão tamanhos diferentes (pequenas, médias e grandes). Suas massas, em gramas, eram iguais aos valores das massas molares dos elemêntos C, H e O. Em escala ampliada para centimetros, seus raios tí-nhão a mesma ordem de tamãnho dos raios atômicos dos hátomus quê representavam. Sobre essas bolas de plástico quê representam as características de tamãnho e massa dos hátomus de C, H e O, os alunos concluíram:
I. as bolas quê representam os hátomus de H eram as pequenas, e as quê representam os hátomus de O eram as grandes;
II. a massa total das bolas grandes correspondia a seis vezes a massa total das bolas de tamãnho pequeno;
III. a massa total das bolas pequenas correspondia a da massa total das bolas de tamãnho médio.
Classificando cada uma das conclusões como verdadeira (V) ou falsa (F), tem-se, correta e respectivamente:
a) F, V, V.
b) F, F, V.
c) V, V, F.
d) V, F, F.
e) V, F, V.
Resposta: a)
7. (Acafe-SC) Em relação à eletronegatividade, a alternativa verdadeira é:
a) Os metais, em geral, são os elemêntos mais eletronegativos.
b) Os elemêntos quê apresentam os maiores valores de eletronegatividade são os metais alcalinos.
c) Os elemêntos mais eletronegativos estão na parte superior direita da tabéla periódica.
d) Os gases nobres são estáveis devido à sua alta eletronegatividade.
e) Os elemêntos de transição são os elemêntos com os mais altos valores de eletronegatividade.
Resposta: c)
8. (Unésp)
Mineração oceânica
A abundância de lítio na forma de íons nas águas dos oceanos é cerca de 5.000 vezes maior do quê na crôsta terrestre, o quê tem estimulado a mineração oceânica. No entanto, apesar de mais abundante nas águas dos mares do quê na crôsta terrestre, o lítio nos oceanos está presente em concentrações extremamente baixas, cerca de 0,2 parte por milhão (ppm). Íons maiores, como sódio, magnésio e potássio, estão presentes na á gua do mar em concentrações muito mais altas quê a do íon Li+. Isso tem inviabilizado a extração de lítio dessa mistura, d fórma técnica ou economicamente viável.
Esse desafio acaba de sêr vencido por uma equipe de pesquisadores da Arábia Saudita, quê utilizam uma célula eletroquímica contendo uma membrana cerâmica porosa, quê permite a passagem dos íons de lítio, mas bloqueia eficientemente os íons dos outros elemêntos citados.
(https://livro.pw/geunc. Adaptado.)
Organizando em ordem crescente de tamãnho os íons maiores do quê o lítio, citados no texto, tem-se:
Dados: Li (Z = 3); Na (Z = 11); Mg (Z = 12);
K (Z = 19).
a) sódio – magnésio – potássio.
b) potássio – sódio – magnésio.
c) magnésio – sódio – potássio.
d) sódio – potássio – magnésio.
e) magnésio – potássio – sódio.
Resposta: c)
Tema 10 – Fundamentos da ligação química
9. (UEA-AM) A formulação de pós faciais usados em maquiagens contém dois compostos inorgânicos sólidos, um deles constituído pelo cátion Ca2+ e o ânion e o outro pelo cátion Zn2+ e o ânion O2−.
As fórmulas químicas dos compostos inorgânicos contidos em pós faciais são
a) CaSO3 e Zn2O
b) CaSO4 e ZnO
c) CaSO3 e ZnO2
d) CaSO2 e ZnO
e) CaSO4 e Zn2O
Resposta: b)
Tema 11 – Ligações covalentes e metálicas
10. (EsPCEx-SP) As substâncias ozônio (O3); dióxido de carbono (CO2); dióxido de enxofre (SO2); á gua (H2 O); e cianeto de hidrogênio (HCN) são
Página cento e cinquenta e sete
exemplos quê representam moléculas triatômicas. Entre elas, as quê apresentam geometria molecular linear são, apenas: Dados: 1H1; 6C12; 8O16; 16S32; 7N14
a) cianeto de hidrogênio e dióxido de carbono.
b) á gua e cianeto de hidrogênio.
c) ozônio e á gua.
d) dióxido de enxofre e dióxido de carbono.
e) ozônio e dióxido de enxofre.
Resposta: a)
11. (Cefet-MG) Para a realização de uma determinada atividade experimental, um estudante necessitou de um material quê possuísse propriedades típicas de substâncias dúcteis, maleáveis, insolúveis em á gua e boas condutoras térmicas. Um material com essas propriedades resulta da ligação entre hátomus de:
a) Cu e Zn.
b) Na e C(éli)".
c) Fe e O.
d) F e Xe.
e) C e Si.
Resposta: a)
12. (Integrado-PR) “Ligação química” foi um termo usado pela primeira vez por Gilbert níltom líuis no ano de 1920 em um artigo para explicar por quê os hátomus se mantêm unidos para formár as substâncias e também por quê eles permanecem unidos ao longo de milhares de anos.
Atualmente sabe-se quê a natureza de uma ligação química é determinada pêlos hátomus participantes e cada tipo de ligação química acarreta propriedades diferentes para as substâncias. Com relação ao tema, assinale a alternativa correta.
a) Em uma ligação iônica dois hátomus compartilham os elétrons da camada de valência.
b) Ligação metálica é a ligação entre ametais formando as chamadas ligas metálicas, quê são cada vez mais importantes para o nosso dia a dia.
c) Ligação covalente é definida pela transferência de prótons entre os hátomus.
d) Na ligação metálica se combinam elemêntos não metálicos entre si.
e) Em uma ligação iônica há transferência de elétrons entre os elemêntos.
Resposta: e)
Tema 12 – Polaridade e interações
13. (PUC-MG) As ligações covalentes podem sêr classificadas em dois tipos: ligações covalentes polares e ligações covalentes apolares. Observando a polaridade das ligações e a geometria da molécula, somos capazes de verificar se uma molécula será polar ou apolar. Com base nisso, indique a opção quê apresenta moléculas exclusivamente apolares.
a) HC(éli)", NO2 e O2.
b) C(éli)"2, NH3 e CO2.
c) C(éli)"2, CC(éli)"4 e CO2.
d) CC(éli)"4, BF3 e H2SO4.
Resposta: c)
14. (Acafe-SC) Indique a alternativa quê contém as respectivas geometrias e polaridades das espécies químicas a seguir.
SO2; SO3; H2 O e H2 Be
a) SO2: angular e polar; SO3: piramidal e polar; H2 O: angular e polar e H2 Be: linear e apolar.
b) SO2: angular e polar; SO3: trigonal plana e apolar; H2 O: angular e polar e H2 Be: angular e polar.
c) SO2: angular e polar; SO3: trigonal plana e apolar; H2 O: angular e polar e H2 Be: linear e apolar.
d) SO2: linear e apolar; SO3: piramidal e polar; H2 O: linear e apolar e H2 Be: angular e polar.
Resposta: c)
15. (Unioeste) As propriedades periódicas são responsáveis não apenas pelo tipo de ligação formada entre os hátomus, mas também pelo caráter e propriedades das substâncias formadas. Assim, H2 S e H2 O são substâncias cujas propriedades químicas e físicas são totalmente diferentes. Ao nível do mar, o primeiro é um gás tóxico e o segundo é um líquido não tóxico. No quê se refere às diferentes propriedades químicas e físicas das substâncias mencionadas anteriormente, assinale a alternativa CORRETA.
a) H2 S é um gás porque o enxofre possui um volume atômico maior quê o volume atômico do oxigênio.
b) H2 S é um gás porque suas moléculas formam ligações de hidrogênio fracas entre si.
c) H2 O é um gás somente a 1 atm de pressão e a tempera-túras abaixo de 100 °C.
d) Tanto H2 S como H2 O são moléculas apolares.
e) A diferença dos estados físicos líquido e gasoso destas substâncias se deve, principalmente, ao fato de as moléculas de H2 Oformarem ligações de hidrogênio entre si enquanto H2 S não as formam.
Resposta: e)
Página cento e cinquenta e oito
INTEGRANDO COM...
ár-te
A Química na impressão 3D
Você já se perguntou se seria possível imprimir uma imagem quê “sai do papel”, ou seja, um objeto em três dimensões? Quando se busca uma resposta para essa pergunta, pensa-se imediatamente em equipamentos modernos e futurísticos inventados recentemente, mas essa tecnologia já existe desde 1984 e vêm se popularizando em razão da diminuição do custo para a sua aquisição.
As impressoras 3D domésticas funcionam por meio de duas técnicas: a de modelagem por fusão e deposição, a quê mais se popularizou; e a de estereolitografia, quê utiliza uma substância líquida quê se solidifica sôbi ação de um laser.
A técnica de modelagem por fusão e deposição utiliza um fio de um material quê póde sêr derretido a uma tempera-túra controlada, por volta de 210 °C, depois resfriado, tomando a forma desejada. Esse tipo de fio recebe o nome de filamento. Nesse contexto, a Química está presente no estudo dos materiais mais adequados para os filamentos, como o acrilonitrilo-butadieno-estireno (ABS), e nos próprios objetos impressos, quê podem sêr úteis para o ensino de Química.

Página cento e cinquenta e nove
A análise de propriedades periódicas, como o raio atômico e a eletronegatividade, segue um padrão em duas dimensões: esquerda-direita e cima-baixo, correspondendo aos eixos x e y do plano cartesiano. A impressão 3D é capaz de adicionar o eixo z, a terceira dimensão, um eixo “saindo do papel”, enriquecendo a percepção.
A inserção da terceira dimensão auxilia na compreensão e na percepção de outros conceitos químicos, como a estrutura e a geometria de moléculas.
Esse equipamento é muito versátil e póde também sêr utilizado para o desenvolvimento da criatividade e de habilidades artísticas.


Agora, faça o quê se pede em cada item.
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Se você fosse usar a impressão 3D para explicar a um colega algum conceito de Química, qual seria ele? E, nas outras áreas de conhecimento, como a impressão 3D seria útil?
2. Imagine quê você e seus côlégas fizeram alguma atividade para se divertirem, como jogar futeból, jogar xadrez, assistir a um desenho ou anime, ler um livro ou mangá e tomar banho de rio. escrêeva o quê você gostaria de imprimir na impressora 3D quê representasse a atividade imaginada e como você personalizaria esse objeto.
3. Pensando na preservação de obras de; ár-te, em quase todos os museus, é proibido tokár nas esculturas, nos quadros e nas outras obras. Apresente como a impressão 3D poderia auxiliar nesse processo de preservação e, ao mesmo tempo, garantir quê pessoas com deficiência visual ou outra deficiência possam usufruir as exposições nos museus.
4. Como você acha quê é possível criar uma identidade artística única em um objeto impresso em uma impressora 3D?
Página cento e sessenta