UNIDADE
3
QUANTIFICANDO A MATÉRIA
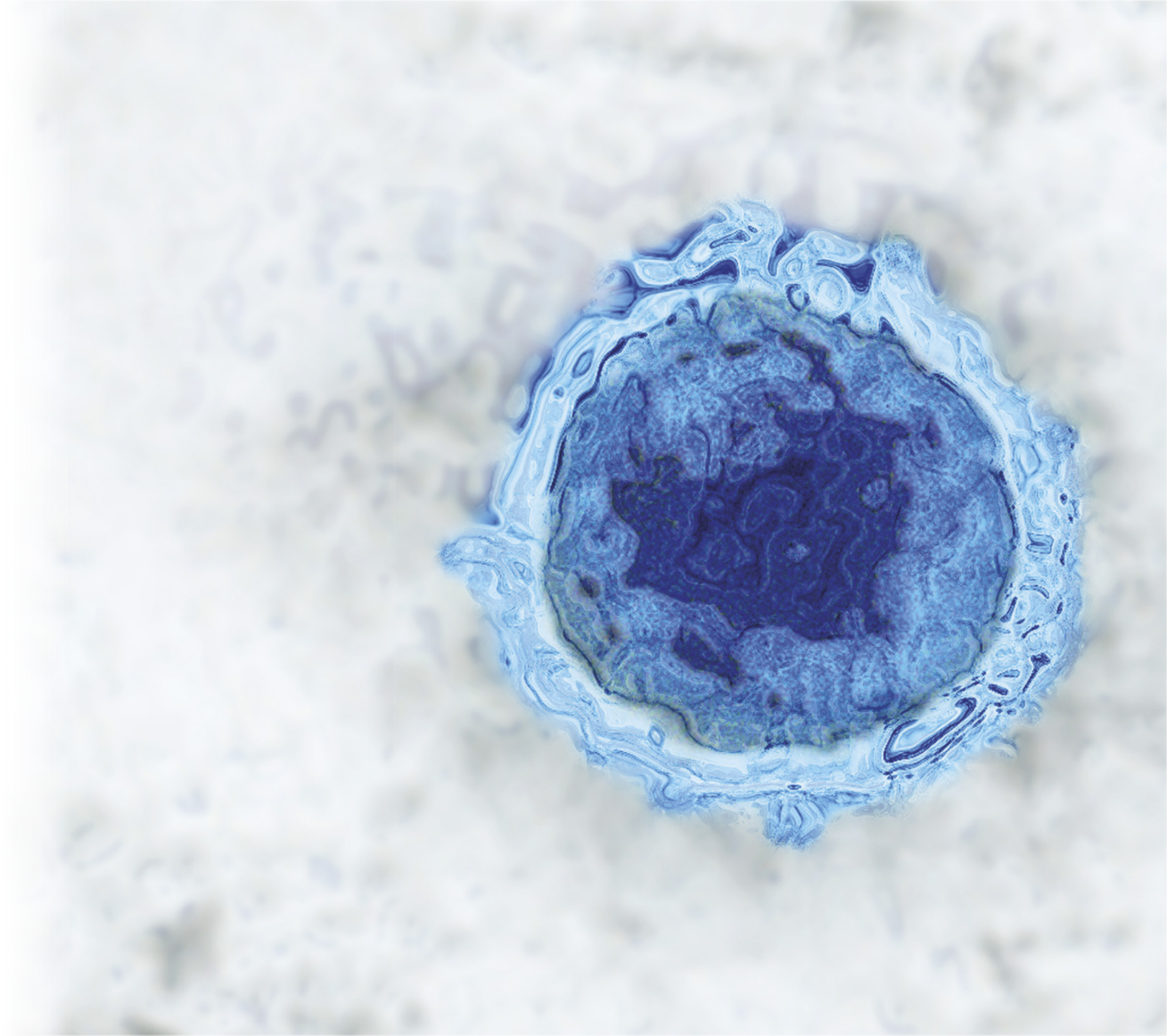
O sêr humano sempre buscou ferramentas e padrões para realizar medições com os mais variados propósitos. Desde a Antigüidade, partes do corpo e alguns objetos são usados como referência, como no caso da unidade pé, ainda usada para medir a altitude de aviões. A medição está presente em diversas áreas do conhecimento. Na Química, ela é fundamental para o estudo da composição, da estrutura e da transformação de substâncias, pois exige métodos específicos para estabelecer relação entre grandezas, como massa e volume, e entre essas grandezas e a quantidade aproximada de partículas. Na imagem, registro de um vírus Epstein-Barr, causador de um dos tipos de herpes, cujo diâmetro está na escala nanométrica, sêndo de aproximadamente 200 nm (imagem de microscopía eletrônica, aumento aproximado de 860 mil vezes; colorida artificialmente).
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Pesquise outros exemplos de medições feitas com partes do corpo ou com objetos usados na Antigüidade quê ainda são utilizadas atualmente.
2. Que instrumentos de medida você usa no dia a dia? O quê você méde?
3. Em seu entendimento, por quê realizar medições é importante para os químicos?
Página cento e sessenta e um
Página cento e sessenta e dois
TEMA
13
Medindo a matéria
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Diversos instrumentos foram desenvolvidos com o objetivo de medir precisamente a matéria. Um exemplo é a balança analítica, capaz de medir massas com bastante exatidão, chegando a determinar o peso da milionésima parte de um grama, o micrograma, quê corresponde a 1 ⋅ 10−6 g.
Um átomo tem uma massa quê é da ordem de um trilionésimo do trilionésimo do grama, o yoctograma, quê corresponde a 1 ⋅ 10−24 g. Nesse contexto, o estudo do mundo submicroscópico exige mais do quê apenas instrumentos: é necessário estabelecer conceitos quê permítam expressar essas pequenas quantidades em medidas compreensíveis e utilizáveis.
PAPIRO de Hunefer. [ca. 1275 a.C.]. 39,8 cm × 550 cm. 1 papiro.
Medindo quantidades de substâncias
O químico francês Lavoisiê é comumente lembrado como um dos primeiros cientistas a se preocupar com medições precisas e a usar balanças no laboratório com essa finalidade. No entanto, ele não foi o primeiro a utilizar esses instrumentos. Alquimistas, metalúrgicos, tintureiros, vidreiros e outros profissionais quê manipulavam substâncias e materiais já se referiam a medidas de quantidade em seus procedimentos. Sendo assim, o uso da balança aconteceu antes de a Química se estabelecer como Ciência. E com o trabalho de Lavoisiê, foi possível o desenvolvimento de métodos para determinar as massas dos constituintes das substâncias.
REFLITA
1 No cotidiano, qual é a importânssia da utilização de medidas?
Página cento e sessenta e três
Os estudos até aqui já mostraram quê a Ciência Moderna recórre a experimentos sistemáticos, os quais fornecem dados confiáveis em razão dêêsse desenvolvimento de métodos de medição iniciado por Lavoisiê e outros cientistas; a teorias consistentes e abrangentes, quê expliquem os fenômenos observados; e à análise quantitativa para a realização de previsões.
As leis ponderais, quê nascem de um cuidado e um rigor com relação às medidas de quantidades de substâncias, e o modelo atômico de Dalton, nos séculos XVIII e XIX, são causa e consequência da evolução da Química e de sua configuração moderna.
O químico brasileiro Vicente Coelho de Seabra Silva Telles (1764-1804), de Congonhas do Campo (MG), foi autor do primeiro livro de Química em língua portuguesa e deu contribuições relevantes para o desenvolvimento dessa área. Em sua obra, Telles apresentou uma tabéla sobre a combinação de metais com ácidos, formando precipitados, quê fortaleceu a ideia de proporcionalidade entre as massas das substâncias quê participam de reações químicas.
Para saber mais sobre o cientista Vicente Coelho de Seabra Silva Telles, sugere-se o artigo “Vicente Seabra Telles e a criação da nomenclatura em português para a química ‘nova’ de Lavoisier”, de Fernando J. Luna, disponível em: https://livro.pw/pimxs (acesso em: 24 set. 2024).
Pesos relativos e equivalentes eletroquímicos
O modelo atômico de Dalton ganhou mais destaque quando ele atribuiu valores diferenciados de peso a hátomus de diferentes elemêntos químicos. Ao estudar a composição e a densidade dos gases, Dalton considerou a hipótese de quê os hátomus se combinam em proporções numéricas simples. Utilizando dados obtidos por outros cientistas, apresentou a primeira tabéla de pesos atômicos (pesos relativos) em uma palestra em outubro de 1803. Depois, o cientista a publicou na 4ª edição do livro A new system ÓF chemical philosophy (“Um novo sistema de filosofia química”, em tradução livre), em quê definiu o peso do hidrogênio como igual a 1 e, com base nele, calculou os pesos dos demais elemêntos químicos.

TELLES, Vicente Coelho de Seabra Silva. Elementos de chimica offerecidos a Sociedade Litteraria do Rio de Janeiro para o uso do seu curso de chimica. Coimbra: Real Officina da Universidade, 1788. Folha de rrôsto.
Pesos relativos* dos elemêntos
Hidrogênio |
1 |
Fósforo |
9 |
Ferro |
38 |
|---|---|---|---|---|---|
Azoto (nitrogênio) |
5 |
Enxofre |
12 |
Zinco |
56 |
Carbono |
5 |
Magnésio |
20 |
Prata |
100 |
Oxigênio |
7 |
Estrôncio |
68 |
Ouro |
140 |
*Termo utilizado por Dalton.
Fonte: MAAR, Juergen Heinrich. História da química: segunda parte: de Lavoisiê ao sistema periódico. Florianópolis: Papa-Livro, 2011. p. 203.
Dalton considerava quê as substâncias seriam formadas, preferencialmente, pela combinação de um átomo de cada elemento químico. Como estudado em Tema anterior, para representar essas combinações, Dalton propunha a união de símbolos (criados por ele) dos hátomus quê constituíam as substâncias.
Página cento e sessenta e quatro
Na primeira mêtáde do século XIX, a simbologia proposta por Dalton e a concepção de quê a matéria seria constituída por hátomus ainda se apresentavam sôbi intenso debate, um dos motivos pêlos quais foi realizado o Congresso de Karlsruhe, em 1860. Nesse evento, o químico italiano Stanislao Cannizzaro apresentou um trabalho quê procurava esclarecer conceitos ainda imprecisos, como os de átomo, molécula, peso relativo e peso molecular, utilizando o trabalho de seu compatriota Lorenzo Romano Amedeo Carlo Avogadro (1776-1856).
Avogadro partiu da hipótese de Gay-Lussac de quê os gases sempre se combinam em proporções volumétricas simples e propôs quê essas proporções, estabelecidas entre substâncias gasosas reagentes e produtos, dependem do número total de moléculas envolvidas. Com base nos próprios estudos, mais teóricos quê práticos, Avogadro sugeriu quê volumes iguais de substâncias gasosas diferentes, medidos à mesma tempera-túra e à mesma pressão, contêm números iguais de moléculas.
Dalton e Gay-Lussac rejeitaram a hipótese de Avogadro. No entanto, com o passar dos anos, ela se mostrou mais consistente e se tornou a base para as determinações atuáis de quantidade de massa. No contexto dessas discussões, estabeleceu-se um novo dilema para a Química: para determinar os valores de peso relativo dos elemêntos químicos, era necessário conhecer as fórmulas químicas das substâncias, e, para determiná-las, era preciso saber os valores de peso relativo dos elemêntos químicos.
Nesse período, desenvolveu-se um novo campo de estudo da Química quê ajudou a resolver esse impasse: a Eletroquímica (que será estudada mais adiante). Esse termo foi criado para designar o estudo das reações químicas quê produzem corrente elétrica e das quê são produzidas por corrente elétrica.
Entre o fim do século XVIII e o início do século XIX, o estudo sobre eletricidade ganhou destaque no meio científico. Inúmeros pesquisadores se dedicaram a esses estudos, entre eles o químico e físico italiano Alessandro Volta (1745-1827), o físico italiano Luigi Aloisio Galvani (1737-1798) e o químico e físico inglês máicou Faraday. êste último, mesmo sem entender claramente os aspectos quantitativos dos experimentos quê desenvolvê-u, pela falta de dados sobre as grandezas envolvidas, produziu pilhas quê possibilitaram o processo de eletrólise.
Até o início do século XIX, a sóda (fórmula atual: NaOH), a potassa (fórmula atual: KOH), a cal (fórmula atual: CaO) e outros reagentes eram considerados substâncias simples, pois nenhum método disponível da época foi capaz de decompô-los. O uso de corrente elétrica, por meio da eletrólise, tornou-se uma possibilidade para a decomposição de substâncias e permitiu quê o químico inglês Humphry Davy, pela primeira vez, isolasse e identificasse dois metais provenientes das substâncias sóda e potassa, há muito conhecidas, quê foram nomeados sodium e potassium.

Página cento e sessenta e cinco
Com base em leis propostas por Faraday e pelo físico italiano Carlo Matteucci (1811-1868), foi possível relacionar a quantidade de corrente elétrica quê passa por um sistema com a quantidade de material produzido ou consumido. Considerando o hidrogênio como referência em termos de quantidade de massa, como Dalton havia propôsto, Faraday realizou experimentos com diversas substâncias. A finalidade era determinar o equivalente eletroquímico e a quantidade de substância, de diferentes cátions e ânions, depositada ou liberada em estado gasoso quando perpassada por uma quantidade de corrente elétrica igual à necessária para liberar um grama de hidrogênio gasoso.
Equivalentes eletroquímicos
Cátions |
Ânions |
||
|---|---|---|---|
Hidrogênio* |
1 |
Oxigênio |
8 |
Sódio |
23,3 |
Flúor |
18,7 |
Cálcio |
20,5 |
Cloro |
35,5 |
Potássio |
39,2 |
Bromo |
78,3 |
Prata |
108 |
Iodo |
126 |
*Definido arbitrariamente.
Fonte: MAAR, Juergen Heinrich. História da química: segunda parte: de Lavoisiê ao sistema periódico. Florianópolis: Papa-Livro, 2011. p. 292.
Como se póde notar, um dos principais desafios para os químicos, antes da consolidação da teoria atômico-molecular, foi estabelecer relações quantitativas das massas e dos volumes de substâncias com a quantidade de partículas formadoras dessas substâncias. Outra dificuldade foi a definição de um padrão de peso (ou massa, na nomenclatura mais utilizada atualmente), já quê a escolha do hidrogênio, conforme proposta de Dalton e Faraday, foi se mostrando aos poucos inadequada.
A importânssia de um padrão de peso atômico
Ao se combinarem hátomus de vários elemêntos químicos com hátomus de hidrogênio, formam-se hidretos, substâncias muito reativas e de difícil manipulação. Esse fato dificultou o uso do hidrogênio como padrão de peso atômico. Assim, houve a necessidade de se adotar outro elemento químico como padrão. Por formár óxidos com hátomus de quase todos os elemêntos químicos, substâncias estáveis e de fácil manipulação, optou-se pelo oxigênio, cujo peso atômico relativo podia sêr determinado com maior exatidão. A escolha do valor a sêr atribuído ao peso atômico do oxigênio não foi simples, passando por diferentes medidas (1, 10, 8, 100), até chegar a 16 em 1865.
Na segunda mêtáde do século XIX, os valores atribuídos aos pesos atômicos divergiam com freqüência, principalmente por causa de métodos experimentais imprecisos e pelo uso de diferentes referenciais. O Comitê Internacional de Pesos Atômicos, criado em 1906, publicava suas tabélas considerando somente o oxigênio como padrão e o valor de peso igual a 16. O peso atômico relativo foi tema de debate por muito tempo e, por causa de sua relevância para a elaboração da tabéla periódica, envolveu cientistas como Mendeleev e Méyer.
Página cento e sessenta e seis
Em 1914, o Prêmio Nobél de Química foi atribuído ao químico estadunidense teodór uílhãm Richards (1868-1928), em reconhecimento pêlos trabalhos envolvendo determinações precisas de pesos atômicos relativos de muitos elemêntos químicos.
No entanto, uma nova descoberta científica, prevista em 1865 e realizada em 1913, causou novas divergências: a existência de isótopos.
O carbono como padrão de peso atômico
A descoberta de quê havia hátomus de oxigênio com diferentes valores de peso atômico levou à definição de dois padrões: os químicos continuaram a utilizar como referência o peso atômico 16 para a mistura de isótopos naturais do oxigênio, mas os físicos passaram a utilizar um peso atômico exatamente igual a 16 para o isótopo 16O. Desse modo, os valores de peso e outros valores quê deles dependiam, utilizados por físicos e químicos, variavam.
A existência de duas tabélas de constantes, uma da Física e outra da Química, causava problemas aos cientistas quê precisavam usar esses dados, levando a IUPAC e a União Internacional de Física Pura e Aplicada (IUPAP) a buscarem um consenso. A IUPAC (em 1959) e a IUPAP (em 1960) mudaram seus padrões de referência de peso atômico do isótopo de oxigênio de peso 16 para o isótopo de carbono de peso 12 (12C), unificando o valor de padrão de peso atômico e os valores relativos provenientes dele.
Considerando o isótopo 12 do carbono (12C), átomo utilizado como referência para as medidas de peso atômico, sabe-se quê êste é 12 vezes mais pesado do quê o átomo de hidrogênio (1H).
De acôr-do com a IUPAC, o peso atômico, ou massa atômica relativa, nomenclaturas recomendadas pela IUPAC, de um elemento químico é uma grandeza adimensional (não é expresso por uma unidade). Já a massa atômica tem dimensão de massa, apresenta unidade de massa atômica, cujo sín-bolo é u, e é considerada a massa de um único átomo do elemento químico.
Assim, a unidade de massa atômica (u) corresponde a da massa de um átomo de 12C. Dessa forma, ao consultar a tabéla periódica e verificar quê a massa atômica do elemento químico cloro é de 35,5 u, deve-se entender quê a massa atômica dêêsse elemento corresponde a 35,5 vezes o valor da massa de do isótopo 12 do carbono.
Com base na definição unificada, pôde-se determinar os pesos atômicos (ou as massas atômicas relativas) de todos os elemêntos químicos, conforme consta na tabéla periódica apresentada no Tema 9. Essa determinação foi importante para os cientistas, porque as substâncias reagem em proporções constantes em relação aos hátomus. Com essas informações, foi possível trabalhar com quantidades de constituintes equivalentes ao planejar uma reação química.
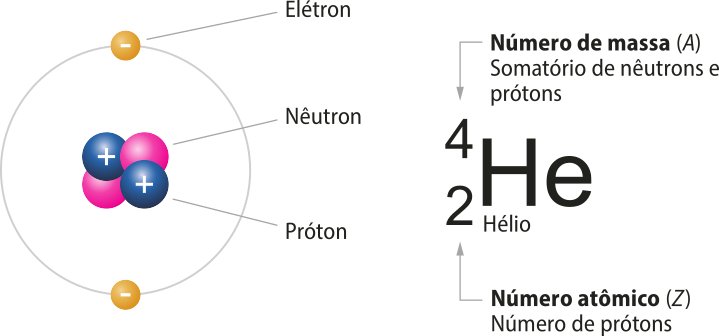
É importante destacar quê massa atômica não é o mesmo quê número de massa (A), conceito estudado em Tema anterior. O número de massa de um átomo é adimensional e definido pelo somatório do número de prótons (Z) e do número de nêutrons (N).
A = Z + N
Relembre esse conceito com o exemplo do hélio.
Em razão da complexidade do assunto, recomenda-se a leitura do artigo “Evolução histórica dos pesos atômicos” (o qual serviu de base para o texto teórico), de Mário Tolentino e Romeu C. Rocha-Filho, disponível em: https://livro.pw/gxtxz (acesso em: 29 set. 2024). Nesse artigo, há também uma breve discussão sobre o uso dos termos peso atômico e massa atômica.
Página cento e sessenta e sete
Massa atômica e massa molecular
Foi mencionado quê a massa atômica (ma) refere-se à massa de um átomo e é expressa em unidade de massa atômica (u). Por convenção, 1 u é a massa equivalente a da massa do isótopo 12 de carbono cujo valor foi definido como exatamente 12 u. Acompanhe a seguir valores de massas atômicas para os três isótopos de carbono.
REFLITA
2 por quê é importante saber a massa de um átomo ou de um conjunto de hátomus?
Prevalência de isótopos de carbono no planêta Terra
Nome – Símbolo |
Massa atômica |
Prevalência |
|---|---|---|
Carbono-12 – 12C |
12,000000 u |
98,93% |
Carbono-13 – 13C |
13,003355 u |
1,07% |
Carbono-14 – 14C |
14,003242 u |
<0,01% |
Fonte: NÉCHIONAL INSTITUTE OF STANDARDS ênd TECHNOLOGY. Atomic weights ênd isotopic compositions for carbon. [S. l.]: Nist, [2024]. Disponível em: https://livro.pw/rdslt. Acesso em: 24 set. 2024.
Já a massa atômica relativa de um elemento químico é um número adimensional e póde sêr identificada na tabéla periódica. Ela é resultado da média aritmética ponderada das massas atômicas dos isótopos naturais e da abundância relativa de cada um.
Considere o carbono como exemplo. Desprezando o isótopo 14, cuja abundância natural é muito baixa, tem-se:
massa atômica relativa (C) = = 12,0107
Na tabéla periódica apresentada neste livro, esses valores estão arredondá-dos.
A massa molecular refere-se à massa da entidade quê compõe uma substância, isto é, a massa de uma molécula ou uma fórmula mínima.
Acompanhe, como exemplo, o cálculo da massa molecular da á gua.
m(H2O) = 2 ⋅ m(H) + m(O)
m(H2O) = 2 ⋅ 1 u + 16u]
m(H2O) = 18 u
Alguns autores usam o termo massa molecular para se referir à massa de substâncias quê não são moleculares, como os sais. Nesse caso, a massa molecular representa a massa dos elemêntos químicos da fórmula iônica mínima. Entretanto, outros preferem utilizar o termo massa-fórmula para as substâncias quê não são moleculares, quê é um termo mais abrangente.
Acompanhe, como exemplo, o cálculo da massa-fórmula do cloreto de sódio (NaC(éli)").
m(NaC(éli)") = m(Na) + m(C(éli)")
m(NaC(éli)") = 22,99u + 35,45u
m(NaC(éli)") = 58,44 u
Dessa forma, a massa molecular (ou massa-fórmula) é a massa ôbitída pela soma das massas dos hátomus quê constituem a molécula ou a fórmula mínima de uma substância.
Página cento e sessenta e oito
Quantidade de matéria
A definição do carbono como padrão possibilitou aos químicos definir uma grandeza quê está relacionada com a quantidade de substância em uma amostra. A grandeza quê indica a quantidade de entidades elementares (átomos, moléculas ou fórmulas) presentes em uma amostra ou em um sistema é chamada de quantidade de matéria ou quantidade de substância, representada pela letra n.
Essa é a sétima grandeza básica do Sistema Internacional de Unidades (SI), tendo como unidade de medida o mol, cujo sín-bolo também é mol.
Acompanhe as informações a seguir.
REFLITA
3 Como saber a quantidade dos constituintes de uma substância em uma amostra dessa substância?
Grandezas básicas do Sistema Internacional de Unidades
Grandeza (sín-bolo) |
Unidade |
|
|---|---|---|
Nome (plural) |
Símbolo (não tem plural) |
|
Distância (d) |
Metro (metros) |
m |
Massa (m) |
Kilograma (kilogramas) |
kg |
Tempo (t) |
Segundo (segundos) |
s |
Temperatura termodinâmica (T) |
kélvin (kelvins) |
K |
Corrente elétrica (i) |
Ampere (amperes) |
A |
Intensidade luminosa (j) |
Candela (candelas) |
cd |
Quantidade de matéria (n) |
Mol (mols) |
mol |
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA; INSTITUTO PORTUGUÊS DA QUALIDADE. Sistema Internacional de Unidades (SI). Tradução: Grupo de Trabalho luso-brasileiro do Inmetro e IPQ. Brasília, DF: Inmetro; Caparica: IPQ, 2021. Tradução luso-brasileira da 9ª edição. Disponível em: https://livro.pw/vbxre. Acesso em: 10 nov. 2024.
Além de definir a grandeza, é necessário definir a unidade de medida, o mol, termo do latim mole, quê significa “amontoado”, “grande quantidade”. A definição de mol foi apresentada em 1961 e adotada em 1971 pelo SI como a unidade de medida da grandeza quantidade de matéria.
De acôr-do com a IUPAC, o mol é a quantidade de matéria de um sistema quê contém tantas entidades elementares quanto o número de hátomus presentes em 0,012 kg do isótopo 12 de carbono (12C). As entidades elementares podem sêr hátomus, moléculas e outras partículas ou grupamentos de partículas quaisquer.
É muito comum, em situações práticas, em laboratórios e indústrias, estabelecer uma relação diréta entre a massa em grama de uma amostra (m) de uma substância e a quantidade de matéria em mol (n) para essa mesma substância. Essa relação é dada por:
n =
Na expressão matemática, M é a massa molar da substância, dada em grama por mol (g/mol ou g ⋅ mol−1), quê será abordada mais adiante.
Página cento e sessenta e nove
Constante de Avogadro
Na definição de quantidade de matéria, há uma dependência entre a unidade mol e a unidade kilograma, a qual foi abandonada na reformulação do SI. A definição atual se baseia na constante de Avogadro (NA).
O valor aceito pela IUPAC para a constante de Avogadro é 6,02214076 ⋅ 1023 mol−1 (normalmente, representado na forma arredôndá-da, 6,02 ⋅ 1023 mol−1). Esse valor variou ao longo do tempo por causa do aumento na precisão de sua determinação, quê é feita êsperimentalmente. Assim, a quantidade de matéria de um sistema é uma medida do número de entidades elementares especificadas. Um mol contém exatamente 6,02214076 ⋅ 1023 entidades elementares.
ESPAÇOS DE APRENDIZAGEM
Esta animação em inglês, com opção de legenda em português, apresenta a magnitude do mol. O título do vídeo satiriza o fato de quê mole, em inglês, significa “toupeira” (o animal).
• QUÃO grande é o mol? (não o animal, o outro.): Daniel Dulek. [S. l.: s. n.], 2012. 1 vídeo (5 min). Publicado pelo canal TED-Ed. Disponível em: https://livro.pw/xbodi. Acesso em: 24 set. 2024.
Vários cientistas se dedicaram à elucidação dêêsse valor, entre os quais o físico alemão álbert Áinstain.
Áinstain, em sua tese de doutorado defendida em 1905, estudou o movimento browniano e buscou relacionar o mundo submicroscópico com o mundo macroscópico. Em sua tese e em um artigo científico publicado no mesmo ano, ele apresentou propostas para a determinação da constante de Avogadro. Com base nesse trabalho, o físico francês jã batíst Perrin (1870-1942), participante da primeira Conferência de Solvay, em 1911, desenvolvê-u uma série de experimentos para determinar o valor da constante de Avogadro (NA). Ele obteve o valor de 6,82 ⋅ 1023 hátomus por mol. Por seu trabalho sobre a estrutura descontínua da matéria, Perrin recebeu o Prêmio Nobél de Física em 1926.
Definidos os conceitos de quantidade de matéria e de mol, é importante definir outros conceitos relacionados a eles, como massa molar e volume molar.
SOBRE
Movimento browniano é o nome dado à movimentação aleatória de partículas, como moléculas, em um fluido (líquido ou gasoso). Esse movimento ocorre por causa dos choques quê acontecem entre as partículas, fazendo com quê cada partícula se desloque de modo aparentemente aleatório.
Massa molar
A massa molar, expressa em grama por mol (g/mol ou g ⋅ mol−1), póde sêr definida como a massa, em grama, equivalente a um mol de entidades elementares formadoras da substância.
Assim, a massa molar de um elemento químico é a massa, em grama, de 6,02 ⋅ 1023 hátomus dêêsse elemento. A massa molar e a massa atômica são equivalentes numericamente, ou seja, apresentam valores numéricos iguais, mas com unidades de medida diferentes.
Página cento e setenta
Na tabéla periódica, como estudado, são apresentados os valores numéricos das massas atômicas relativas. Desse mesmo valor, são obtidas a massa atômica em unidade de massa atômica (u) e a massa molar em grama (g).
Os hátomus de ferro, por exemplo, têm massa atômica relativa igual a 55,85, massa atômica igual a 55,85 u e massa molar (massa de um mol de hátomus de ferro) igual a 55,85g.
Representa-se a massa molar pela letra M, seguida do sín-bolo do elemento químico entre parênteses:
M(Fe) = 55,85 g/mol
E qual é a massa molar do oxigênio? A essa pergunta são obtidas duas respostas diferentes. Isso porque há o elemento químico oxigênio (O) e a substância simples gás oxigênio (O2). Assim:
M(O) = 16 g/mol
M(O2) = 32 g/mol
Como a substância oxigênio é formada por moléculas de O2, um mol de gás oxigênio tem 1 mol dessas moléculas e, consequentemente, 2 mol de hátomus de oxigênio.
Do mesmo modo, um mol de moléculas da substância á gua tem um mol de hátomus do elemento oxigênio e 2 mol de hátomus do elemento hidrogênio. Assim, a massa molar da á gua é:
M(H2O) = 2 ⋅ M(H) + M(O)
M(H2O) = 2 ⋅ 1 g/mol + 16 g/mol
M(H2O) = 18 g/mol

Página cento e setenta e um
AlGO A+
Como identificar moléculas pela massa
Ao longo das últimas dékâdâs, inúmeras técnicas foram desenvolvidas para identificar e quantificar as substâncias químicas. Cada técnica tem suas características e especificidades, fornecendo diferentes informações. Uma dessas técnicas, muito utilizada e difundida, é a espectrometria de massas. Ela remete aos estudos de J. J. thômsom, o primeiro cientista a estudar a influência de um campo elétrico no movimento de hátomus e íons, sêndo esse fenômeno a base para a espectrometria de massas.

A espectrometria de massas é utilizada para identificar espécies químicas com alta precisão,fornecendo informações valiosas a respeito dos hátomus presentes na estrutura. Essas informações são analisadas com outros dados, como as massas de fragmentos da espécie, e possibilitam a determinação exata de sua composição elementar e de sua estrutura.
Alguns exames médicos, como o teste do pezinho, feito em recém-nascidos para diagnosticar precocemente algumas doenças, podem sêr feitos com essa técnica. Assim como moléculas quê apresentam funções importantes no corpo humano são estudadas por meio dessa técnica.
A técnica é mostrada com freqüência em seriados policiais de televisão, nos quais peritos criminais colocam amostras préviamente preparadas, de todo tipo de material, em espectrômetros de massa acoplados a outros equipamentos, e descobrem rapidamente a composição da amostra. Apesar de sêr uma técnica eficiente, seu uso não é simples. Químicos e outros cientistas quê trabalham com equipamentos de espectrometria de massas investem muitos recursos estudando a técnica e desenvolvendo os procedimentos específicos para cada material a sêr analisado. Depois da análise, é necessário efetuar a interpretação dos resultados, atividade quê também exige conhecimento e habilidade.
Volume molar
Como estudado, de acôr-do com a hipótese de Avogadro (hoje, lei de Avogadro, por já ter sido comprovada experimentalmente), volumes iguais de gases diferentes, nas mesmas condições de tempera-túra e pressão, têm o mesmo número de partículas.
Assim, da mesma forma quê a massa molar, o volume molar é o volume ocupado por um mol de entidades elementares de um gás.
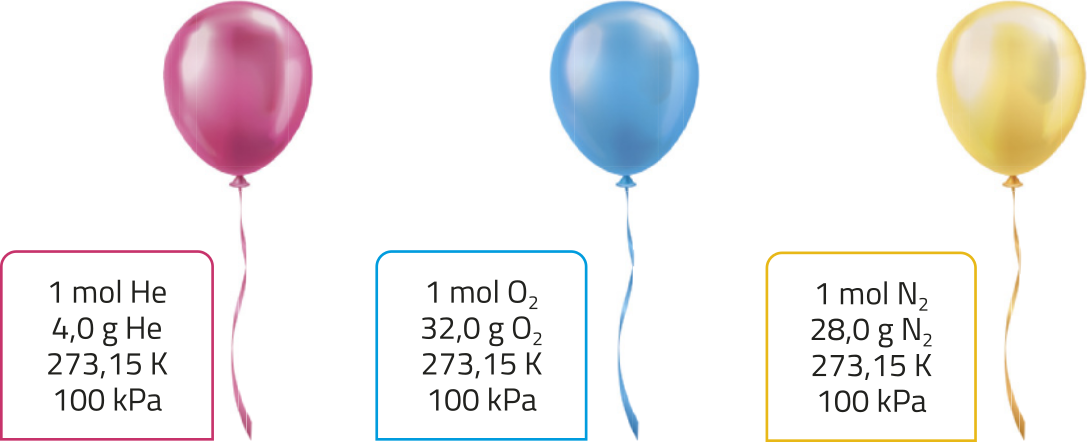
Determinou-se, êsperimentalmente, quê um mol de qualquer gás, nas condições padrão de tempera-túra e pressão (CPTP), ou seja, a 273,15 K e 100 kPa, ocupa um volume igual a 22,71 L, aproximadamente.
Uma maneira de explicar esse valor é por meio do uso da chamada equação de Clapeyron, quê será abordada em Tema posterior.
P ⋅ V = n ⋅ R ⋅ T
Na equação, P é a pressão, V, o volume, n, a quantidade de matéria (átomos, íons ou moléculas), R, a constante dos gases (considere o valor 0,08206 L ⋅ atm/mol ⋅ K), e T, a tempera-túra.
Página cento e setenta e dois
Isolando a variável volume ocupado por um gás e substituindo os valores de tempera-túra e pressão nas CPTP e a quantidade de um mol, obtêm-se aproximadamente 22,71 L.
E o quê isso significa?
Considere três balões contendo um mol de hélio (He), um mol de gás oxigênio (O2) e um mol de gás nitrogênio (N2), respectivamente. A equação indica quê, nas CPTP, os três gases ocuparão o mesmo volume, 22,71 L.
Dessa forma, pode-se generalizar e concluir quê qualquer gás ideal, nessas condições, ocupará sempre um volume de 22,71 L.
O volume ocupado por um gás depende das condições de tempera-túra e pressão, ou seja, a alteração de qualquer uma dessas variáveis resulta na alteração do volume. Há, portanto, uma diferença no volume molar quando a substância não está nas CPTP. Existe um outro parâmetro, denominado condições normais de tempera-túra e pressão (CNTP), quê admite o valor de 1 atm para a pressão. Esse valor equivale a 101.325 Pa, ligeiramente maior do quê o considerado nas CPTP. Assim, nas CNTP, o volume molar equivale a 22,4 L.
Apesar de pequena, essa diferença é bastante discutida na comunidade científica mundial. A IUPAC recomenda quê se use as CPTP.
ATIVIDADES
1. Considerando o valor da constante de Avogadro, calcule:
a) quantos hátomus existem em 36 g de carbono-12.
b) quantos elétrons existem em 12 g de carbono-12.
c) quantos prótons existem em 24 g de carbono-12.
2. Determine a massa atômica relativa do cloro, considerando os dados apresentados.
Nome |
Número de massa atômico |
Proporção em massa |
|---|---|---|
Cloro-35 – 35C(éli)" |
34,9689 |
75,53% |
Cloro-37 – 37C(éli)" |
36,9659 |
24,47% |
3. Determine a massa molecular das seguintes substâncias: etano (C2H6), metanol (CH3OH), ácido nítrico (HNO3) e óxido de bário (BaO).
4. Determine a massa molar das seguintes substâncias: metano (CH4), etanol (C2H5OH), ácido sulfúrico (H2SO4) e hidróxido de cálcio (Ca(OH)2).
5. O gás hélio, cujo valor de massa molar é igual a 4,00 g/mol, é muito utilizado em balões por sua densidade sêr menor do quê a do ar. Calcule o volume ocupado por um kilograma de gás hélio nas CNTP.
6. Você estudou quê existe um padrão de peso atômico. Pesquise e apresente outros padrões de medida quê existem e indique a utilidade deles.
Página cento e setenta e três
TEMA
14
Compreendendo os gases
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O planêta Terra é envolvido por uma camada de gases chamada atmosféra.Esses gases são fundamentais para a vida, pois proporcionam o equilíbrio do clima e da tempera-túra do planêta e filtram grande parte da radiação ultravioleta quê chega do Sol.
Desconsiderando a umidade (vapor de água), para cada 100 litros de ar, têm-se aproximadamente 78,1 litros de gás nitrogênio (N2), 20,9 litros de gás oxigênio (O2) e 0,9 litro de gás argônio (Ar). Além dêêsses três componentes gasosos majoritários, há outros em concentrações menóres, os chamados gases traços, quê, juntos, constituem menos de 0,1% em volume do ar atmosférico seco e limpo.
Acompanhe a seguir a quantidade dessas substâncias gasosas em ordem de abundância.
Substâncias gasosas em ordem de abundância na atmosféra
Substância gasosa |
Fórmula química |
Percentual aproximado em volume (%) |
|---|---|---|
Nitrogênio molecular |
N2 |
78,1 |
Oxigênio molecular |
O2 |
20,9 |
Argônio |
Ar |
0,93 |
Dióxido de carbono |
CO2 |
0,04 |
Neônio |
Ne |
0,00182 (18,2 ppm*) |
Hélio |
He |
0,00052 (5,2 ppm) |
Metano |
CH4 |
0,00019 (1,9 ppm) |
Criptônio |
Kr |
0,00011 (1,1 ppm) |
Hidrogênio molecular |
H2 |
0,00006 (0,6 ppm) |
Monóxido de dinitrogênio |
N2O |
0,00003 (0,3 ppm) |
Monóxido de carbono |
CO |
0,00001 (0,1 ppm) |
Xenônio |
Xe |
0,000009 (0,09 ppm) |
Ozônio |
O3 |
0,000007 (0,07 ppm) |
*Observação: 1 ppm = 1 parte por milhão.
Fonte: NÉCHIONAL OCEANIC ênd ATMOSPHERIC ADMINISTRATION. The atmosphere. [S. l.]: NOAA, 2 jul. 2024. Disponível em: https://livro.pw/sqomo. Acesso em: 2 maio 2025.
A quantidade de vapor de á gua na atmosféra varia de região para região. Ela é compreendida, em média, na faixa de 1% a 4% do volume de ar. Em muitas regiões, essa umidade varia consideravelmente com a mudança das estações do ano. Quando a quantidade de vapor de á gua chega a 4% do volume de ar na atmosféra, a á gua torna-se líquida, formando gotículas perceptíveis, como neblina, nuvem e, muitas vezes, chuva.
Página cento e setenta e quatro
Atraídos pela gravidade da Terra, por causa da massa do planêta, as moléculas e os hátomus dos gases da atmosféra produzem uma fôrça sobre a superfícíe sólida do planêta. Essa fôrça está relacionada à pressão atmosférica, quê póde sêr compreendida como o peso exercido pela coluna de ar atmosférico sobre uma unidade de área. A pressão atmosférica é comumente expressa em atmosféra (atm), porém a unidade recomendada pela IUPAC é o pascal (Pa). Ao nível do mar, na altitude zero, verifica-se uma pressão de 1 atm, o equivalente a 100 kilopascal (kPa) ou 1 ⋅ 105 Pa, aproximadamente.
A atmosféra torna-se mais rarefeita com o aumento da altitude. Assim, a pressão atmosférica no Pico do Barbado, por exemplo, o pico mais alto da Chapada Diamantina, localizada no oeste da baía, com 2.033 metros de altitude, é menor do quê a pressão atmosférica ao nível do mar, porque há menos moléculas de gases por unidade de volume e menos fôrça peso exercida sobre a superfícíe do pico.

Neste Tema, serão estudados alguns aspectos do comportamento dos gases e uma teoria quê busca explicar suas propriedades. Além díssu, serão introduzidos alguns tópicos de destaque de um campo de estudos denominado Química Ambiental.
Página cento e setenta e cinco
O início do estudo dos gases
O cientista e químico belga Jan batista vã Helmont foi um dos pioneiros no estudo sobre os gases. Com base em uma série de experimentos, contestou algumas ideias clássicas da alquimia e da teoria dos quatro elemêntos de Aristóteles, propondo quê o ar não era uma substância única, mas compôzto de diferentes tipos de gases. vã Helmont cunhou o termo gás, derivado da palavra grega kháos (“caos”), ao observar quê algumas substâncias, ao serem aquecidas ou fermentadas, produziam um “espírito aéreo” quê se comportava d fórma diferente do ar comum. Por volta de 1620, o cientista realizou um de seus experimentos mais conhecidos, quê consistiu em queimar carvão e observar o consumo dêêsse material, tentando fornecer uma explicação para a diminuição de sua massa.
vã Helmont considerava quê a matéria não podia ter simplesmente desaparecido, mas sim formado um “espírito” impossível de sêr contido e mais denso do quê o ar. A esse “espírito” desconhecido ele deu o nome de gás silvestre (hoje, designado dióxido de carbono), de maneira quê pudesse diferenciá-lo do ar e dos vapores de líquidos.
Os filósofos naturalistas com uma visão mecanicista se mostraram contrários à adoção do termo criado por vã Helmont. Entre eles estava róbert bóiou, importante filósofo natural, físico e químico, quê criticava o uso da palavra gás. bóiou, conhecido por formular uma lei fundamental sobre o comportamento dos gases, preferia utilizar a palavra ar para se referir aos gases liberados em reações químicas. Ele usava termos como ar fictício ou ar artificial para descrever, por exemplo, o gás gerado pela reação entre vinagre e pó de coral (carbonato de cálcio).
De qualquer forma, aos poucos, iniciava-se uma nova perspectiva da Física e da Química, quê passaram a considerar os gases como objeto de estudo.
A seguir, serão apresentadas algumas leis envolvendo o comportamento dos gases.

PRESNO, J. vã Helmon recibe en su laboratorio á un alquimista quê le presenta la piedra filosofal. In: FIGUIER, Louis. La ciencia y sus hombres: vidas de los sabios ilustres desde la antigüedad hasta el siglo XIX. Barcelona: D. Jaime Seix, 1879. t. 2. Localizável em: entre p. 918-919.
REFLITA
1 Além dos gases citados na introdução dêste Tema, quê outros gases podem sêr encontrados no ar respirado pelas pessoas das grandes cidades?
Página cento e setenta e seis
As transformações gasosas
Antes de abordar as chamadas leis dos gases, alguns conceitos fundamentais sobre gases e sistemas termodinâmicos precisam sêr apresentados.
Primeiro, é necessário entender as grandezas físicas quê definem o estado de um sistema em equilíbrio, as chamadas variáveis de estado. Para gases, as principais são:
• Pressão (P): variável relacionada à fôrça exercida pelas moléculas de gás sobre as paredes do recipiente.
• Volume (V): variável relacionada ao espaço ocupado pelo gás.
• Temperatura (T): variável relacionada à energia cinética média das moléculas, expressa em kelvin (K).
Essas variáveis estão inter-relacionadas pelas leis quê serão abordadas a seguir. Elas ajudam a prever como o gás se comportará sôbi diferentes condições.
Além díssu, é importante conhecer o conceito de sistema fechado. Um sistema fechado é aquele em quê não há troca de matéria com o ambiente externo, mas póde havêer troca de energia, como o calor. Isso significa quê, embora a quantidade de gás no sistema permaneça constante, suas condições internas podem mudar dependendo da variação de pressão, volume ou tempera-túra.
Com esses conceitos, pode-se entender como ocorrem as transformações gasosas e como as variáveis se comportam em cada tipo de transformação.
É preciso destacar quê os experimentos de bóiou, xárlês e Gay-Lussac, quê deram origem às leis dos gases, ocorreram antes do surgimento da teoria cinética (discutida mais adiante neste Tema). As leis dos gases foram essenciais para o desenvolvimento dessa teoria. No entanto, a análise das transformações de estado fica mais evidente quando explicada com base na teoria cinética, quê se fundamenta na ideia de partículas em movimento em um recipiente.
Por fim, é importante ressaltar quê o comportamento dessas partículas é descrito por um modelo teórico e não póde sêr observado a olho nu ou por meio de instrumentos ópticos. As representações apresentadas nos tópicos a seguir são apenas para fins didáticos e melhor entendimento.
REFLITA
2 Você já notou quê, às vezes, é difícil abrir um póte de vidro de azeitonas em conserva quê estava na geladeira ou abrir um póte de vidro de geléia pela primeira vez? Como você explicaria essa dificuldade?
Lei de bóiou (transformação isotérmica)
São atribuídas a bóiou diversas descobertas científicas, entre as quais o isolamento do gás hidrogênio. Por meio dessa descoberta, foi comprovado quê o ar é uma mistura de gases, refutando, assim, a teoria dos elemêntos aristotélicos. bóiou considerava o ar um elemento essencial para a vida e realizou trabalhos sobre o crescimento de plantas controlando as condições do ar.
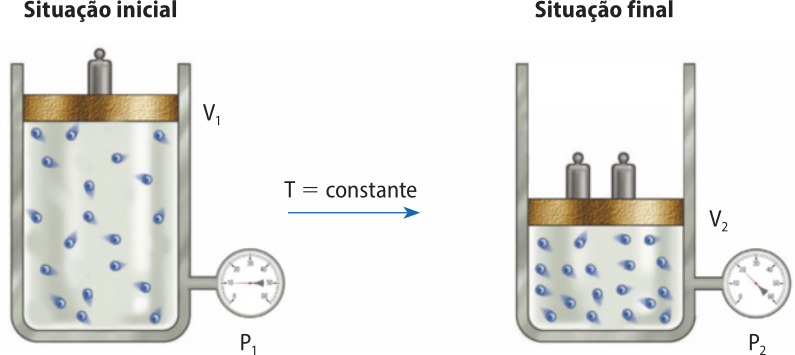
Ao estudar os gases, o cientista observou quê a pressão e o volume de determinada quantidade de gás contida em um sistema fechado, à tempera-túra constante, são inversamente proporcionais. Ou seja, se a pressão sobre uma quantidade de ar for aumentada, seu volume diminui. Se a pressão for diminuída, o volume aumenta. Essa relação póde sêr descrita matematicamente da maneira a seguir.
P ⋅ V = k
Página cento e setenta e sete
Na expressão, P é a pressão, V, o volume e k, uma constante. De maneira simplificada, pode-se entender quê se o volume da amostra gasosa for reduzido pela mêtáde, à mesma tempera-túra (partículas com mesma energia cinética), tem-se apenas mêtáde do espaço para quê as partículas do gás se movimentem. Dessa forma, haverá o dôbro do número de colisões entre essas partículas e as paredes do recipiente.
Por exemplo, se for aplicado o dôbro da pressão a um sistema com êmbolo móvel, à tempera-túra constante, o volume diminuirá pela mêtáde, e a pressão interna, causada pelas colisões das partículas contra as paredes do recipiente, dobrará. Vale ressaltar quê a quantidade de partículas é a mesma antes e depois da compressão do gás. Essa outra maneira de entender a relação é representada a seguir.
Por ocorrer à tempera-túra constante, esse tipo de transformação é chamado de transformação isotérmica.
Lembrar quê partículas não podem sêr observadas dentro de um recipiente, essa representação visa apenas facilitar o entendimento da transformação.
Vale solicitar aos estudantes quê mantenham isso em mente ao analisar outras ilustrações dêêsse tipo.
Considere um sistema com um gás em duas condições diferentes. Na primeira, um volume V1 de gás à pressão P1 e tempera-túra T1. Na segunda, a pressão é aumentada para P2, a tempera-túra permanéce constante, T1, e o volume diminui para V2. Com base na conclusão de bóiou, o produto das grandezas pressão e volume deve sêr constante, portanto:
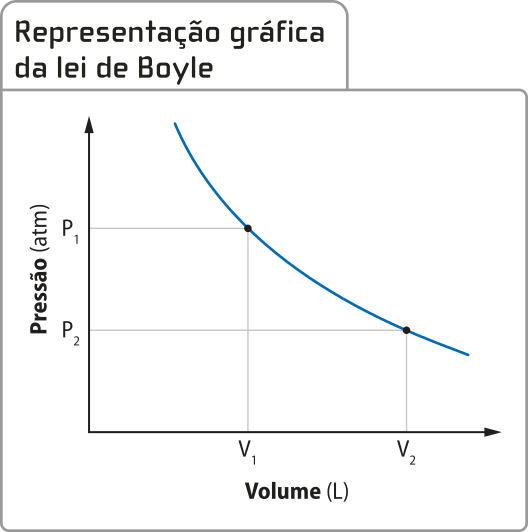
P1 ⋅ V1 = P2 ⋅ V2
Essa igualdade recebeu o nome de lei de bóiou. Graficamente, ela póde sêr representada da seguinte maneira.
O físico francês Edme Mariotte (c. 1620-1684) realizou experimentos semelhantes aos de bóiou na França e publicou resultados quê reafirmavam o quê bóiou havia propôsto. Por isso, com freqüência, essa lei é também chamada de lei de Boyle-Mariotte.
Fonte: Dados fictícios.
Página cento e setenta e oito
OFICINA CIENTIFICA
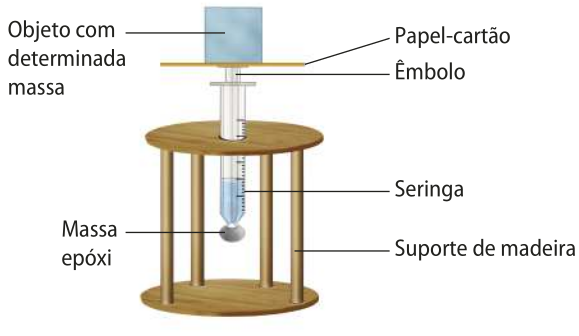
Verificando a lei de bóiou
A Ciência tem como uma de suas bases a observação. No entanto, nem sempre é possível observar a olho nu certos fenômenos, e os cientistas precisam construir instrumentos para isso. A Ciência Moderna lida com instrumentos muito sofisticados, no entanto é possível fazer diversas análises utilizando instrumentos relativamente simples.
Para verificar a lei de bóiou por meio de um experimento, é possível construir um instrumento de observação com materiais do cotidiano.
Materiais
• Seringa.
• Massa epóxi.
• Papel-cartão.
• Objetos com diferentes massas, como moedas e pesos de papel.
• Balança.
• Dois pedaços de madeira com aproximadamente 10 cm de largura, 10 cm de comprimento e 2 mm de espessura cada um.
• Hastes de metal ou de madeira com aproximadamente 10 cm de comprimento.
• Cola para madeira.
• Furadeira e broca para madeira.
Faça o experimento somente na presença do professor.
Procedimentos
Construção do suporte
• Peça ao professor quê faça um furo no centro do pedaço de madeira para encaixar a seringa.
• pégue o outro pedaço de madeira (horizontal) e cole as hastes de metal na vertical.
• Cole o pedaço de madeira com furo na parte superior.
Realização do experimento
• Prenda a seringa perpendicularmente ao suporte de madeira com furo no centro, com a superfícíe dele posicionada na horizontal e de modo quê não atrapalhe a leitura do volume de ar.
• Puxe o êmbolo da seringa até encher de ar o cilindro. tápe o bico da seringa, vedando-o com massa epóxi.
• Prenda sobre a extremidade do êmbolo um círculo de papel-cartão ou de plástico rígido, de modo a aumentar a superfícíe dela, para quê se possa colocar um peso sobre o êmbolo.
• Posicione objetos de diferentes massas sobre o êmbolo, um de cada vez, e obissérve como o êmbolo se comporta.
ATIVIDADE
• Qual é a relação entre a massa do objeto colocado sobre o êmbolo e o volume do ar no cilindro da seringa? Em seu caderno, faça um gráfico quê represente a variação de volume do ar de acôr-do com a variação da massa do objeto.
Página cento e setenta e nove
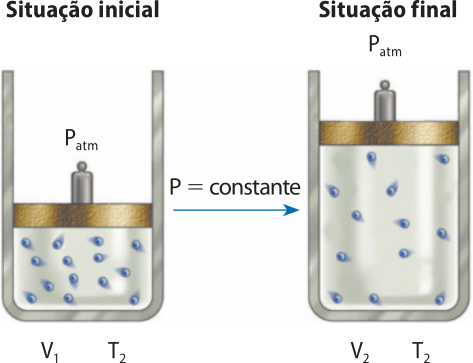
A primeira lei de xárlês e Gay-Lussac (transformação isobárica)
O químico, físico e matemático francês Jáquis Alexandre César xárlês (1746-1823) também foi um estudioso dos gases e observou quê alguns deles apresentavam coeficiente de expansão constante quando a pressão era mantida constante.
No entanto, ele não publicou seus trabalhos. Pouco mais de uma década depois, a expansão térmica dos gases foi amplamente estudada pelo químico e físico francês jôsef Louis Gay-Lussac, quê chegou à conclusão de quê o coeficiente de dilatação volumétrica seria igual para todos os gases. Matematicamente, pode-se escrever quê, para um dado volume de gás, a razão entre a tempera-túra termodinâmica T e o volume V é igual a uma constante k.
= k
De maneira simplificada, entende-se quê, se o valor da tempera-túra de um gás aumentar duas vezes, suas partículas apresentarão uma energia cinética duas vezes maior. Para quê a pressão no sistema se mantenha constante, é necessário quê o espaço tridimensional de quê essas partículas dispõem seja duas vezes maior. Lembrando quê a quantidade de partículas é a mesma nas duas situações.
Por ocorrer à pressão constante, esse tipo de transformação é chamado de transformação isobárica.
De acôr-do com essa lei, chamada de primeira lei de xárlês e Gay-Lussac, se a pressão de certa quantidade de gás for mantida constante e sua tempera-túra for aumentada de T1 para T2, seu volume variará de V1 para V2 na mesma proporção. Assim, pode-se estabelecer uma relação matemática, representada a seguir de maneira algébrica e gráfica, respectivamente.
=
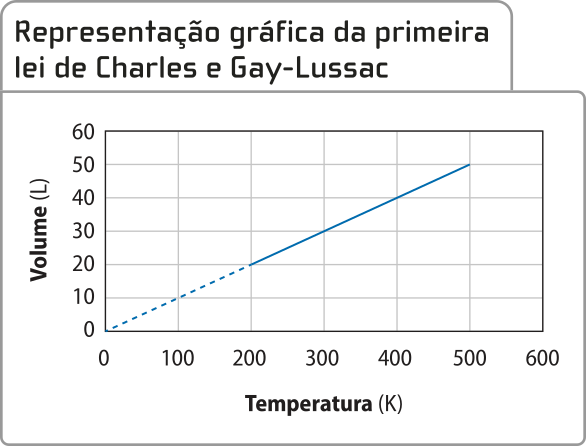
Fonte: Dados fictícios.
Página cento e oitenta
AlGO A+
Quem formulou a “lei de Charles”?
A relação entre o volume e a tempera-túra de um gás, à pressão constante, não foi estudada e formulada apenas por xárlês, como o nome sugere. O assunto foi estudado também por Dalton e Gay-Lussac.
Dalton publicou resultados de experimentos mais completos, mas não chegou a elaborar uma lei. Além díssu, os valores quê calculou para a constante k apresentavam um êrro maior do quê o calculado posteriormente por Gay-Lussac.
Leia um trecho do quê Gay-Lussac escreveu antes de destacar seus resultados.
Devo informar quê, apesar do reconhecimento de quê muitas vezes os gases oxigênio, nitrogênio, hidrogênio, ácido carbônico e o ar atmosférico sofrem expansão de 0° até 80°, o cidadão xárlês notou a mesma propriedade 15 anos atrás, mas por nunca ter publicado os seus resultados, é por pura sorte quê tênho conhecimento deles.
GAY-LUSSAC, Louis. Recherches sur la dilatation des gaz et des vapeurs. Annales de chimie: ou recueil de mémoires concernant la chimie et les arts qui en dépendent, et spécialement la pharmacie, Paris, v. 43, p. 137-175, 1802. p. 156-157. Tradução dos autores.

GAY-LUSSAC et Biot font des expériences de physique à 4,000 metres de hauteur. In: FIGUIER, Louis. Lê merveilles de la science: ou description populaire des inventions modernes. Paris: Furne, Jouvet et Cie., 1868. p. 537.
Assim, apesar de saber quê xárlês já havia constatado o mesmo fenômeno, Gay-Lussac tomou conhecimento dos experimentos apenas por ter tido “muita sorte”.
Esse breve evento é um bom exemplo de como o desenvolvimento da Ciência nos séculos passados envolvia dificuldades na troca de informações entre os cientistas e na publicação de resultados. Alguns historiadores defendem quê a lei de xárlês e Gay-Lussac deveria sêr chamada segunda lei de Dalton, pois o cientista inglês teria sido o primeiro a publicar dados sobre o assunto. Outros afirmam quê existem trabalhos mais antigos, entre o final do século XVII e o início do século XVIII, em quê a relação constante entre o volume e a tempera-túra dos gases já havia sido verificada.
Página cento e oitenta e um
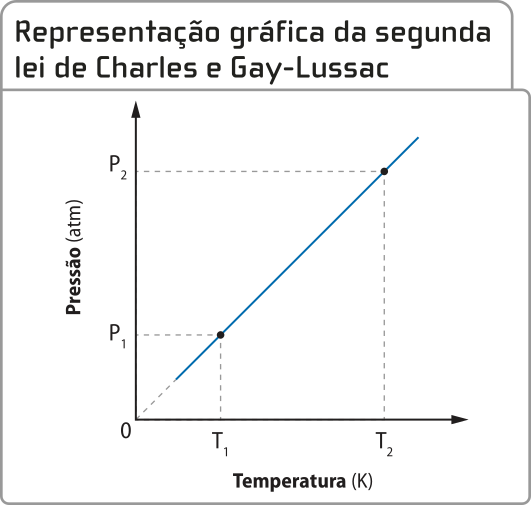
A segunda lei de xárlês e Gay-Lussac (transformação isovolumétrica)
xárlês e Gay-Lussac também estudaram a relação entre tempera-túra e pressão em transformações gasosas em quê há uma mesma quantidade de gás cujo volume é constante. Ambos os cientistas observaram quê a pressão aumenta com a elevação da tempera-túra, mantido constante o volume.
Matematicamente, pode-se escrever quê, para um dado volume de gás, a razão entre a pressão P e a tempera-túra termodinâmica T é igual a uma constante k.
= k
De maneira simplificada, pode-se entender quê, se a tempera-túra de um gás dobrar, as partículas apresentarão uma energia cinética duas vezes maior e, portanto, exercerão uma fôrça duas vezes maior sobre uma mesma superfícíe (paredes de um recipiente, por exemplo).
Por ocorrer a volume constante, esse tipo de transformação é chamado de transformação isovolumétrica ou isocórica.
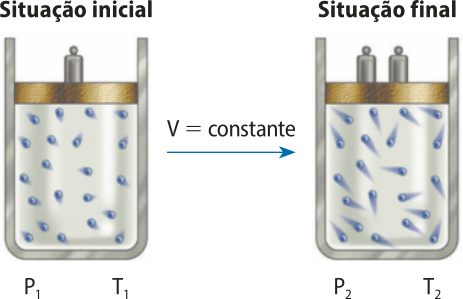
De acôr-do com essa lei, chamada de segunda lei de xárlês e Gay-Lussac, se o volume de certa quantidade de gás for mantido constante e sua tempera-túra for aumentada de T1 para T2, sua pressão variará de P1 para P2 na mesma proporção. Assim, pode-se estabelecer a seguinte relação:
=
Fonte: Dados fictícios.
Página cento e oitenta e dois
A lei combinada dos gases
Para entender melhor os sistemas, cientistas freqüentemente trabalham variando algumas grandezas enquanto mantêm outras constantes. Por isso, ao estudar as transformações gasosas, é possível notar quê sempre há uma grandeza quê permanéce constante (temperatura, pressão ou volume).
No entanto, nos sistemas naturais, isso não é possível, pois as três grandezas varíam simultaneamente. Cientistas, então, buscaram estabelecer uma relação entre elas por meio de uma equação quê permitisse lidar com essas variações simultâneas.
A constante de Avogadro, estudada no Tema anterior, estabelece uma relação entre volumes iguais de gases e número de moléculas nas mesmas condições de pressão e tempera-túra. Além díssu, de acôr-do com o cientista italiano, o volume de um gás, a certa pressão e tempera-túra, é diretamente proporcional à quantidade de matéria do gás (número de mols). Essa proporcionalidade póde sêr expressa da seguinte forma:
V = k ⋅ n
Na equação, k é uma constante de proporcionalidade, V, o volume e n, a quantidade de matéria. Foi apresentado anteriormente quê o volume tem uma relação inversamente proporcional à pressão (lei de Boyle) e diretamente proporcional à tempera-túra (primeira lei de xárlês e Gay-Lussac). Assim:
V ∝
V ∝ T
Na expressão, ∝ representa proporcionalidade, V é o volume, T, a tempera-túra e P, a pressão. Combinando essas relações, obtém-se:
V ∝
É possível notar quê todas as leis estão contempladas, incluindo a relação diretamente proporcional entre pressão e tempera-túra (segunda lei de xárlês e Gay-Lussac). Se a quantidade de matéria do gás for considerada constante, rearranjando, chega-se à seguinte equação, em quê k é uma constante:
=k
Essa relação possibilita concluir quê, se as condições forem alteradas, as variáveis terão valores diferentes, mas o resultado será sempre uma constante. Assim, para duas condições diferentes,
Página cento e oitenta e três
chega-se à chamada equação combinada dos gases, também conhecida como lei geral dos gases, ou equação geral dos gases:
=
Se a quantidade de matéria não for constante, é possível estabelecer uma relação de proporcionalidade entre a constante k e o produto de n e uma constante R (chamada constante geral dos gases). Substituindo essa relação na equação apresentada anteriormente, tem-se:
= nR
Assim, obtém-se a equação de estado dos gases ideais, também conhecida como equação de Clapeyron, em homenagem ao físico francês Benoit-Pierre-Émile Clapeyron (1799-1864), quem a propôs.
PV = nRT
Nessa equação, é importante atentar-se para as unidades. De acôr-do com o Sistema Internacional de Unidades, P é a pressão em pascal (Pa), mas, na Química, também é comum usar atmosféra (atm) e milimetro de mercúrio (mmHg); V é o volume em métro cúbico (m3), mas, na Química, a unidade mais usual é o litro (L); n é quantidade de matéria em mol (mol); T é a tempera-túra em kelvin (K); e R é a constante geral dos gases, cujo valor é igual a 8,31 kPa ⋅ L/mol ⋅ K, a 0,082 atm ⋅ L/mol ⋅ K ou a 62,36 mmHg ⋅ L/mol ⋅ K.
A teoria cinética dos gases
A equação de Clapeyron descreve o comportamento dos gases nas condições ideais consideradas a seguir.
• Um gás é formado por uma grande quantidade de partículas quê se móvem constantemente d fórma desordenada.
• O volume ocupado pelas partículas individuais é insignificante em relação ao volume total do gás, ou seja, a distância entre as partículas é muito maior do quê o tamãnho delas.
• Não há forças significativas de atração ou de repulsão entre as partículas do gás, nem entre as partículas e as paredes do recipiente quê as contém.
• A energia média de movimento (energia cinética) das partículas depende diretamente da tempera-túra do gás.
• As partículas colidem tanto entre si quanto com as paredes do recipiente quê contém o gás.
• A pressão exercida por um gás é resultado dos impactos constantes das partículas contra as paredes do recipiente.
Esse modelo, chamado de teoria cinética dos gases, é eficaz para gases sôbi altas tempera-túras e baixas pressões.
É preciso reforçar quê as Ciências, com freqüência, trabalham e dêsênvólvem modelos assumindo condições ideais para estudar e compreender os fenômenos. É com base nesses modelos quê representam um ideal quê cientistas conseguem se aprossimár da complexidade do real.
Página cento e oitenta e quatro
Umidade relativa do ar
Para quê seja possível realizar a previsão do tempo, assim como a análise do índice de umidade e da ocorrência de chuvas, é necessário estudar a relação entre os gases na atmosféra. Com freqüência, os noticiários informam a respeito da umidade relativa do ar. O quê isso significa?
O ar atmosférico contém á gua no estado gasoso em quantidades variáveis. No entanto, essa quantidade, a certa tempera-túra e pressão, é limitada. A umidade relativa do ar é uma medida da quantidade de vapor de á gua presente na atmosféra em relação ao mássimo possível, considerando a tempera-túra e a pressão locais. Assim, a umidade relativa do ar é medida em porcentagem, em uma escala de 0% a 100%. Quando a umidade relativa atinge 100%, ocorre a condensação do vapor de á gua, ou seja, a á gua passa do estado gasoso para o líquido. Isso significa quê fatores, como a tempera-túra e a pressão do ar atmosférico, estudados neste Tema, estão diretamente relacionados à precipitação ou à ausência de chuvas.
A umidade relativa do ar é um importante fator climático e está ligada à sensação térmica. Portanto, seu monitoramento é essencial para a agricultura, a conservação de materiais, a saúde humana, entre outros aspectos da vida cotidiana. Esse monitoramento póde sêr feito por meio de higrômetros, termômetros de bulbo úmido e seco, medidas de ponto de orvalho ou medidas dirétas de vapor de á gua.


REFLITA
3 O quê significa quando as pessoas dizem quê o tempo está seco ou quê está muito abafado?
ESPAÇOS DE APRENDIZAGEM
• O vídeo demonstra uma técnica simples para criar um umidificador de ar caseiro usando materiais comuns.
COMO fazer um umidificador de ar caseiro (experiência + dica doméstica). [S. l.: s. n.], 2013. 1 vídeo (6 min). Publicado pelo canal Manual do Mundo. Disponível em: https://livro.pw/zsobw. Acesso em: 8 out. 2024.
• Neste vídeo, você encontra uma explicação sobre o funcionamento de umidificadores de ar, e por quê são chamados de ultrassônicos.
COMO funciona o umidificador de ar. [S. l.: s. n.], 2021. 1 vídeo (10 min). Publicado pelo canal Manual do Mundo. Disponível em: https://livro.pw/rhtae. Acesso em: 8 out. 2024.
Página cento e oitenta e cinco
A umidade relativa do ar é influenciada por diferentes fatores, como clima, vegetação, proximidade do mar, presença de rios e lagos, altitude, correntes de ar e estação do ano. No Brasil, a umidade varia bastante de acôr-do com a região do país. Os registros mais elevados se encontram na região amazônica, com destaque para Manaus e Belém, cujos índices estão freqüentemente acima de 80%, e no litoral do Nordeste, com destaque para Salvador e Recife. Já os menóres registros estão na região do Cerrado, onde estão as cidades de Brasília e Goiânea, as quais, anualmente, registram índices inferiores a 20%, e no semiárido nordestino, com destaque para o sertão da Paraíba e do Ceará, cujos índices freqüentemente estão abaixo de 30%.

Costuma-se dizêr quê em Belém há duas estações no ano: a de chuva e a de muita chuva (B).
Página cento e oitenta e seis
A interferência humana na atmosféra terrestre
A atmosféra da Terra desempenha um importante papel na manutenção das condições quê permitem a vida no planêta. Ela atua como uma camada protetora contra radiações solares nocivas e regula a tempera-túra por meio do efeito estufa, fenômeno essencial quê mantém o equilíbrio térmico. A composição da atmosféra terrestre é fundamental para processos biológicos e químicos, como a fotossíntese e a respiração. Sem essa camada de gases, a Terra seria inabitável.
Ao longo da história, no entanto, o sêr humano tem causado impactos significativos na atmosféra, principalmente com o aumento da emissão de gases de efeito estufa pela queima de combustíveis fósseis e pelo desmatamento. Essas ações resultam no aumento da tempera-túra média global, acarretando mudanças climáticas quê ameaçam o equilíbrio natural da Terra. As consequências são observadas no derretimento das calótas polares, na elevação do nível dos mares, em eventos climáticos extremos e na perda de biodiversidade. Esse cenário ressalta a importânssia de ações sustentáveis para preservar a atmosféra e garantir um futuro equilibrado para as próximas gerações.
REFLITA
4 De quê formas as atividades humanas podem interferir na atmosféra terrestre e alterar seu equilíbrio natural?
Poluição atmosférica
A poluição atmosférica consiste nas alterações da atmosféra quê podem causar danos ao ambiente e à saúde dos sêres vivos. Essas alterações são consequência da contaminação do ar por gases, partículas sólidas ou líquidas, materiais biológicos e, até mesmo, energia, como o calor.
Embora parte da poluição seja causada por substâncias liberadas naturalmente, como as provenientes de pântanos, rebanhos e vulcões, observa-se quê as atividades humanas contribuem d fórma significativa ao emitir partículas e substâncias estranhas na atmosféra. As mudanças causadas pela ação do sêr humano são chamadas de fatores antropogênicos, quê se intensificaram desde a Revolução Industrial. Um dos maiores responsáveis por esse aumento foi a queima de carvão para gerar calor e energia.
A poluição atmosférica póde ter consequências desastrosas, como no caso ocorrido em Bhopal, na Índia, em 1984, quando uma fábrica de pesticidas liberou uma nuvem tóxica de isocianato de metila, resultando na morte de milhares de pessoas e deixando aproximadamente 120 mil intôksicadas ou com problemas graves de saúde.
Entre os principais poluentes atmosféricos, destacam-se o dióxido de enxofre (SO2), o dióxido de nitrogênio (NO2), o monóxido de nitrogênio (NO) e o monóxido de carbono (CO). O dióxido de carbono (CO2), embora não seja considerado um poluente, tem sua liberação excessiva por atividades humanas associada ao aumento do efeito estufa.
Página cento e oitenta e sete
Efeito estufa
Frequentemente, o efeito estufa é apontado como causa do aquecimento global. No entanto, a vida na Terra só é possível por causa dêêsse fenômeno.
Um dos gases presentes na atmosféra, o gás carbônico (CO2), consegue absorver e reemitir a radiação infravermelha emitida pela superfícíe terrestre. Quando a radiação solar atinge a Terra, parte dela é absorvida pela superfícíe, aquecendo o planêta, e outra parte é refletida de volta para o espaço na forma de radiação infravermelha (calor). Os gases de efeito estufa, como o CO2, absorvem essa radiação e, em vez de permitir quê ela escape para o espaço, reemitem parte dela de volta para a superfícíe, mantendo a Terra mais kemte do quê estaria sem essa camada gasosa. Essa propriedade é a principal responsável pela manutenção da tempera-túra da superfícíe do planêta. Outras substâncias com propriedade similar são o metano, o óxido nitroso, o ozônio, os clorofluorcarbonos e a água.
O dióxido de carbono presente na atmosféra está diretamente ligado à respiração dos sêres vivos e à fotossíntese das plantas, etapas essenciais do ciclo do carbono na Terra. O problema ambiental relacionado ao efeito estufa surge da interferência humana nesse ciclo.

Página cento e oitenta e oito
Durante milhões de anos, grandes quantidades de carbono ficaram armazenadas sôbi a superfícíe, em reservas de carvão, petróleo e gás natural, por exemplo. No entanto, nas últimas dékâdâs, com o avanço industrial e tecnológico, a extração e a queima dessas reservas aumentaram a quantidade de CO2 na atmosféra, intensificando o efeito estufa e contribuindo para o aquecimento global. Embora muitos cientistas concordem quê o aquecimento global seja causado pela ação humana, alguns acreditam quê se trata de um fenômeno natural. O assunto é polêmico e, muitas vezes, visto como uma barreira ao desenvolvimento de países emergentes.
mêdídas para reduzir as emissões de CO2, como as estabelecidas no Protocolo de Kyoto em 1997 e no acôr-do de Paris em 2015, buscam novas fontes de energia e maior proteção às florestas, essenciais para absorver parte dêêsse gás na atmosféra.

A importânssia da camada de ozônio
Assim como o efeito estufa, fala-se muito da camada de ozônio. Mas o quê é essa camada, qual é sua importânssia e por quê se fala tanto nela?
Primeiro, é preciso saber o quê é o ozônio.
A molécula de ozônio, cuja fórmula é O3, é formada por ligações covalentes entre três hátomus do elemento oxigênio. Apesar de sêr constituído pelo mesmo elemento quê a substância oxigênio (O2), o ozônio possui propriedades bem distintas.
Ele ocorre naturalmente, mas, por sêr uma substância instável, não é encontrado nas baixas camadas da atmosféra, como na troposféra, região onde vivem os sêres humanos. Nessas camadas, é tóxico e póde causar danos à saúde.
Página cento e oitenta e nove
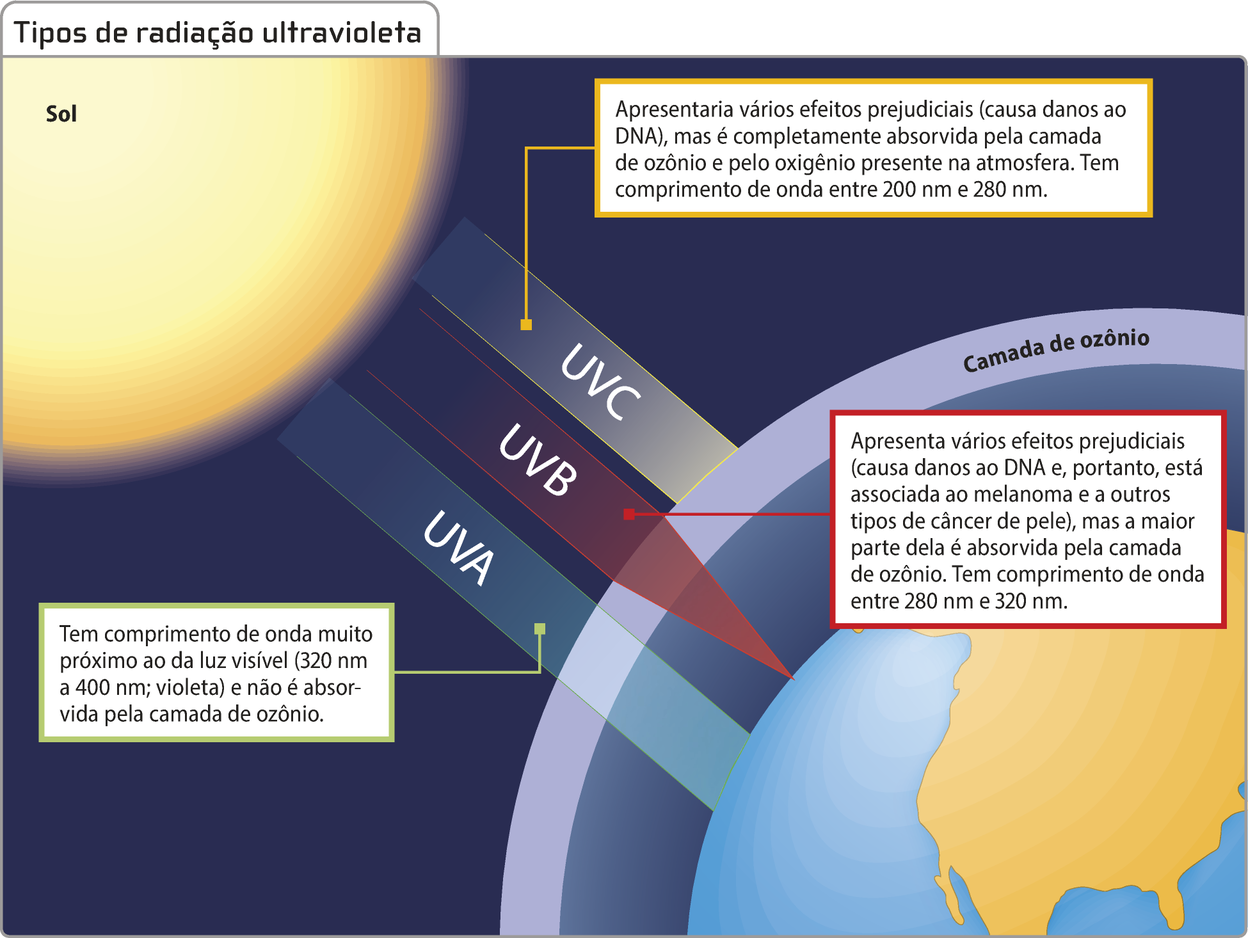
Na estratosféra, região da atmosféra compreendida na faixa de 10 km a 50 km de distância da superfícíe terrestre, o ozônio ABSÓRVE radiação ultravioleta e não deixa quê a totalidade dos fótons de radiação ultravioleta chegue à troposféra. Esse tipo de radiação, emitido pelo Sol, póde sêr prejudicial à saúde humana.
A formação das moléculas de ozônio estratosférico geralmente ocorre quando há radiação ou descarga elétrica para quebrar as fortes ligações covalentes existentes na molécula de gás oxigênio (O2), separando seus dois hátomus. Esses hátomus de oxigênio, então, podem se rearranjar com outras moléculas de oxigênio para formár o ozônio (O3). A degradação dessas moléculas na estratosféra ocorre com a absorção de radiação ultravioleta e produz moléculas e hátomus de oxigênio bastante reativos. Assim, a espessura da camada de ozônio póde variar ao longo dos meses e dos anos, pois é formada e decomposta a todo momento, configurando um equilíbrio dinâmico.
Esse ciclo é muito importante para a vida na Terra, pois essas reações absorvem a maioria da radiação ultravioleta proveniente do Sol quê chega ao planêta, diminuindo sua intensidade. Essa região da estratosféra em quê há maior concentração de ozônio é denominada camada de ozônio.
Página cento e noventa
FORMAÇÃO CIDADÃ
Protegendo a camada de ozônio
As pesquisas científicas trazem benefícios para os propósitos aos quais são direcionadas, como foi o caso dos clorofluorcarbonetos (cê éfe cês). Essas substâncias, formadas por hátomus de cloro, flúor e carbono, surgiram como uma solução para problemas quê envolviam gases altamente tóxicos e inflamáveis, como a amônia, o cloreto de metila e o dióxido de enxofre, usados em sistemas de refrigeração no início do século XX.
Em 1928, o engenheiro químico estadunidense Tômas Midgley Jr. (1889-1944) liderou uma equipe quê sintetizou o diclorodifluorometano, um tipo de cê éfe cê. Essa substância era quimicamente estável, não tóxica, não inflamável e apresentava excelentes propriedades refrigerantes. Em razão de sua estabilidade em condições normais, os cê éfe cês passaram a sêr amplamente utilizados, sêndo considerados seguros por não reagirem facilmente com outras substâncias.
Em 1974, o químico mexicano Mário José Molina Pasquel y Henríquez (1943-2020) e o químico estadunidense frânki Sherwood Rowland (1927-2012) publicaram os resultados de uma pesquisa quê explicava como um grupo de substâncias, chamado clorofluormetanos, interrompe o ciclo do ozônio, provocando “buracos” na camada de ozônio. Mais tarde, verificou-se quê um grupo mais abrangente de substâncias, os cê éfe cês, também provocava danos à camada de ozônio. Esses dois químicos, juntamente do químico holan-dêss poou Jozef Crutzen (1933-2021), quê também pesquisou o assunto, foram laureados com o Prêmio Nobél de Química em 1995.
Ao serem liberados na atmosféra, os cê éfe cês se acumulavam na estratosféra, onde a radiação ultravioleta os dêcompõe, liberando hátomus de cloro, quê, por sua vez, desencadeiam reações catalíticas quê dêcompõe as moléculas de ozônio (O₃), comprometendo a camada de ozônio.
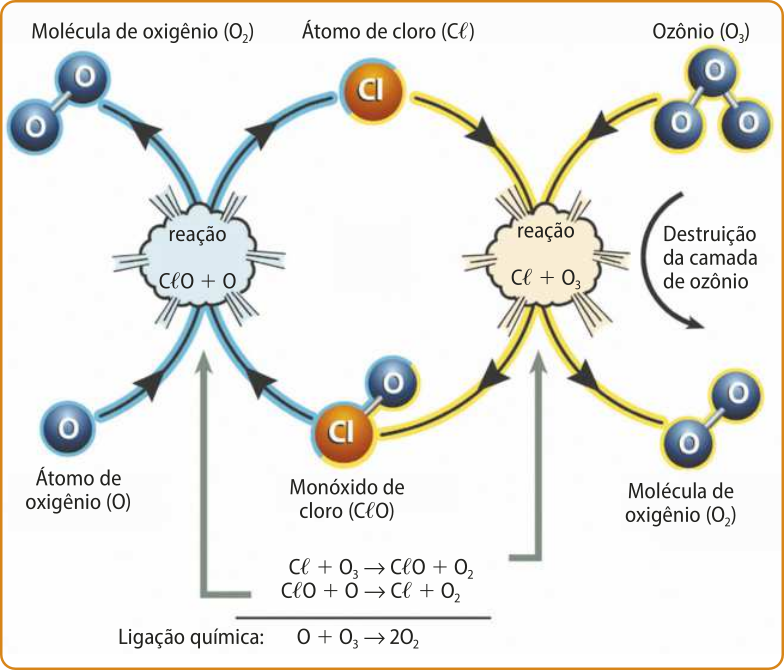
Elaborado com base em: MECANISMOS de destruição do ozônio. [Brasília, DF]: Protocolo de Montreal, 19 maio 2017. Disponível em: https://livro.pw/xlwwg. Acesso em: 10 nov. 2024.
Página cento e noventa e um
Em resposta a essa ameaça global, foi criado o Protocolo de Montreal sobre substâncias quê destroem a camada de ozônio, um tratado internacional quê entrou em vigor em janeiro de 1989, com adesão de 197 Estados. O Brasil é um dos países signatários e, desde 1990, implementa políticas para controlar a importação e o uso de substâncias nocivas. Em 2002, o país aprovou o Plano Nacional de Eliminação de cê éfe cês (PNC), quê consistiu em uma série de ações para erradicar o consumo dessas substâncias. Apesar de os cê éfe cês e outras substâncias similares terem sido praticamente banidas da indústria, seu uso durante anos causou muitos danos ao planêta.
Além das iniciativas voltadas para a proteção da camada de ozônio, surgiram também outras medidas globais, como a criação do Painel Intergovernamental sobre Mudanças Climáticas (hí pê cê cê) pela Organização Meteorológica Mundial (OMM). Motivado pelas crescentes preocupações com o aquecimento global, o hí pê cê cê elaborou, em 2005, um relatório especial quê destaca a importânssia de ações conjuntas para enfrentar esses desafios ambientais.
ATIVIDADES
1. Faça uma pesquisa em sáites confiáveis e indique quais eram as principais aplicações dos cê éfe cês.
2. Pesquise em sáites confiáveis e localize informações sobre as substâncias quê substituíram os cê éfe cês e suas propriedades.
3. Elabore um pequeno texto sobre a importânssia das ações quê unem diversos países para proteger o ambiente, como, por exemplo, o hí pê cê cê.

Página cento e noventa e dois
ESPAÇOS DE APRENDIZAGEM
• êste artigo discute as ações quê permitiram a recuperação da camada de ozônio e explora o quê esses esforços podem nos ensinar sobre o combate ao aquecimento global.
CAPPA, Daniel G. Como recuperamos a camada de ozônio – e o quê isso nos ensina para o combate ao aquecimento global. BBC nius Brasil, [s. l.], 29 out. 2021. Disponível em: https://livro.pw/fivyu. Acesso em: 8 out. 2024.
• Neste sáiti, você encontra informações sobre a legislação brasileira a respeito da redução de emissão de cê éfe cês e de proteção da camada de ozônio.
BRASIL. Ministério do Meio Ambiente e Mudança do Clima. Proteção à Camada de Ozônio. Brasília, DF: MMA, 2024. Disponível em: https://livro.pw/oqnnx. Acesso em: 8 out. 2024.
ATIVIDADES
1. Um balão de borracha flexível contém uma quantidade de gás hélio quê ocupa 5 litros. Esse balão é solto em uma região onde a pressão atmosférica é igual a 100 kPa. Considerando quê a tempera-túra é constante e desprezando a resistência à dilatação da borracha, responda aos itens a seguir.
a) Qual será o volume do balão no Pico da Neblina (altitude de 2.995 m), considerando quê a pressão atmosférica no local é de aproximadamente 70 kPa?
b) Se o balão póde sêr dilatado até 40 L de volume, qual será a pressão quando o balão estourar?

2. Certa quantidade de gás apresenta volume igual a 100 L quando está à tempera-túra de 20°C ao nível do mar. Considerando a mesma pressão, calcule o volume dessa quantidade de gás nas tempera-túras de fusão e de ebulição da á gua. Lembre-se de quê, na lei xárlês e Gay-Lussac, T é a tempera-túra termodinâmica cuja unidade de medida é o kelvin.
3. Um frasco com compota doce recém-preparado é fechado contendo cérto volume de ar à tempera-túra de 40°C, em uma pressão de 98.000 Pa. Depois de resfriado o conteúdo, o frasco é guardado na geladeira. Sabendo quê o frasco não se deformará, qual será a pressão quando o sistema alcançar o equilíbrio térmico e a tempera-túra da geladeira for igual 4°C?

4. Você recebeu a tarefa de ensinar a teoria cinética dos gases a um colega mais novo. Para isso, elabore uma história e dêz-creva uma viagem imaginária ao mundo das partículas gasosas a bórdo de uma nave com tamãnho um pouco maior quê elas. Procure descrever as partículas gasosas de acôr-do com a teoria cinética dos gases. Faça dêzê-nhôs para ilustrar o texto, sobretudo os princípios da teoria.
5. Converse com as pessoas do lugar onde você mora e busque saber se alguma delas tem problemas respiratórios. Descubra se elas associam esses problemas a condições da atmosféra local e investigue se há substâncias nessa atmosféra quê poderiam causar danos à saúde delas. Pesquise maneiras de resolvê-los ou amenizá-los.
6. Pesquise sáites quê informam as condições do tempo e descubra como é a umidade relativa do ar na cidade onde mora. Se ela for caracteristicamente baixa, descubra quais são as implicações e como é possível aumentá-la. Se ela for caracteristicamente alta, descubra quais são as implicações e como póde sêr diminuída. Compartilhe suas descobertas com o professor e os côlégas.
Página cento e noventa e três
TEMA
15
Aspectos qualitativos em reações químicas
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Ao longo da história, o estudo das reações químicas evoluiu com base na observação de fenômenos cotidianos, como o fogo e a corrosão dos metais. Esses processos despertaram a curiosidade de alquimistas e cientistas, quê começaram a investigar como e por quê esses fenômenos ocorriam (os alquimistas sem as metodologias sistemáticas dos cientistas, como estudado em Temas anteriores).
Enquanto o enfoque quantitativo se concentra nas proporções exatas de reagentes e produtos, quê será objeto de estudo do próximo Tema, os aspectos qualitativos das reações fornecem uma compreensão mais ampla e acessível do quê acontece durante uma transformação química. O enfoque quantitativo também contribui para o desenvolvimento de soluções para problemas do dia a dia, seja no contexto pessoal, seja no profissional.
Conhecer as reações químicas possibilitou o desenvolvimento de inúmeros materiais importantes para a ssossiedade, como vidros, cerâmicas, corantes, medicamentos e muitos outros.

Classificando as reações químicas
As reações químicas podem sêr classificadas de diversas maneiras, facilitando a compreensão dos processos de transformação da matéria. Esse estudo permite identificar padrões e prever o comportamento de substâncias em diferentes condições.
O tempo de reação
Em relação ao tempo reacional, podemos classificar as reações químicas, d fórma simples, em rápidas e lentas.
Como exemplo de reação rápida, pode-se citar o acionamento dos airbags dos automóveis. Nesse processo, ocorre a formação de gás nitrogênio, quê preenche a bolsa de ar, inflando-a. Para quê o dispositivo seja eficiente, esse enchimento deve sêr muito rápido, o quê significa quê as reações devem ocorrer em menos de 40 milissegundos, fazendo com quê a bolsa fique completamente cheia, atue como uma almofada e absorva o impacto das pessoas contra as áreas de dentro do veículo.

REFLITA
1 Como você descreveria a queima de um pedaço de papel?
Página cento e noventa e quatro
Um exemplo de reação lenta é a formação da fêrrugem, quê ocorre em diferentes etapas. A duração dessas etapas varia de acôr-do com as condições do meio em quê se encontra o objeto de ferro. Um componente essencial para quê a reação ocorra é a á gua, na forma de umidade do ar, por exemplo. Por isso, é mais comum encontrar objetos enferrujados em locais muito úmidos, como em regiões litorâneas.

AlGO A+
O naufrágio do Erika
O naufrágio do navio petroleiro maltês Erika em dezembro de 1999, na costa oeste da França, causou um dos piores desastres ambientais da Europa. Transportando 31 mil toneladas de óleo combustível pesado, o navio enfrentou uma forte tempestade quê resultou em sua divisão ao meio, despejando cerca de 20 mil toneladas de petróleo no mar. Esse derramamento causou a morte de milhares de aves marinhas e a poluição de mais de 400 km da costa francesa, além de impactos duradouros na fauna e flora locais.
Uma das principais causas do naufrágio foi a corrosão das placas de aço quê compunham o casco do navio. Investigações posteriores revelaram quê o Erika apresentava áreas significativamente enfraquecidas pela fêrrugem, um processo natural de degradação do metal em contato com o ambiente marinho, acelerado pela exposição ao sal e à umidade. A fêrrugem corroeu partes críticas da estrutura do navio, comprometendo sua integridade e contribuindo diretamente para o rompimento do casco sôbi condições adversas. O incidente levantou preocupações sobre a manutenção e a fiscalização de embarcações mais antigas, levando a mudanças na regulamentação marítima na União Européia, especialmente no quê diz respeito ao transporte de substâncias perigosas.

A espontaneidade
Uma reação química é chamada espontânea se ocorre sem quê haja um agente externo atuando sobre o sistema, como a energia elétrica ou uma fonte de calor. Assim quê uma reação química espontânea inicia, ela continua até quê os reagentes, ou um deles, sêjam totalmente consumidos.
Um exemplo de reação espontânea é a oxidação das frutas. Quando se expõe uma màssân cortada ao ar, por exemplo, ela começa a escurecer por causa de uma reação química entre as substâncias presentes na fruta e o oxigênio do ar.

Página cento e noventa e cinco
Já uma reação química não espontânea é aquela quê não ocorre sem quê haja um agente externo atuando sobre o sistema. Para quê essa reação aconteça, é necessário fornecer energia d fórma contínua. Se o fornecimento de energia for interrompido, a reação para de ocorrer.
Um exemplo de reação não espontânea é carregar baterias de celular. A corrente elétrica fornecida pelo carregador provoca reações quê restabelecem a carga da bateria. Se a corrente elétrica for interrompida, as reações deixam de acontecer.
É importante ressaltar quê a espontaneidade de uma reação está relacionada às condições do meio, quê envolvem, por exemplo, tempera-túra e pressão, e a alguns conceitos termodinâmicos, como energia livre, entalpia e entropia. Neste livro, o conceito de entalpia será abordado em Tema posterior.

A variação de energia na forma de calor
Quando uma reação química libera calor, ela é denominada exotérmica; quando ABSÓRVE calor, é chamada endotérmica. Apesar de todas as reações químicas envolverem variação de energia na forma de calor, seja por absorção ou por liberação, a percepção dêêsse aspecto é mais fácil em algumas reações.
Por exemplo, reações de combustão tendem a sêr muito exotérmicas, como a reação de combustão do etanol, da gasolina ou da dinamíte. A liberação de energia nesses casos é facilmente perceptível por causa do fogo, da fumaça e/ou da explosão gerada. Já as reações endotérmicas, como as quê ocorrem durante o processo de fotossíntese, em quê há energia absorvida proveniente da luz solar, necessitam de instrumentos de análise mais sofisticados para serem percebidas.

Página cento e noventa e seis
A reversibilidade
Quando as reações químicas foram abordadas, mencionou-se quê elas são representadas por equações em quê reagentes e produtos são separados por uma seta indicativa do sentido de reação.
Reações químicas em quê os reagentes formam produtos e a reação se encerra, ou seja, reações cujos produtos não reagem para formár reagentes novamente, são denominadas irreversíveis. Elas podem ocorrer em situações em quê o produto formado é removido do sistema, por exemplo, quando o sistema é aberto e pelo menos um dos produtos é um gás.
Um exemplo em quê ocorre reação química irreversível é a interação de comprimidos efervescentes com a á gua, quê resulta em liberação de gás carbônico (observável na forma de bolhas). Como o comprimido é geralmente adicionada à á gua em um copo aberto, o gás escapa para a atmosféra e não permanéce no sistema.

No entanto, em alguns casos, os produtos podem reagir entre si, produzindo novamente os reagentes. Nessas situações, a reação não ocorre em processos intercalados ou sequenciais, mas d fórma simultânea. Por isso, essas reações químicas são chamadas reversíveis.
Um exemplo é a reação em quê o dióxido de nitrogênio (NO2), gás de côr castanho-avermelhada, é convertido em tetróxido de dinitrogênio (N2O4), gás incolor. Se o NO2 for armazenado em um frasco fechado, será possível observar uma lenta descoloração por causa da transformação de parte dêêsse gás em N2O4. Por meio da alteração da pressão do sistema, é possível converter o produto novamente em reagente, e logo a coloração castanho-avermelhada reaparece.

Evidências de reações químicas
Ao misturar materiais e/ou substâncias, reações químicas pódem ocorrer, resultando na formação de novas substâncias. Em muitos casos, a ocorrência pode sêr percebida por uma evidência física, como mudança de côr ou de tempera-túra. Geralmente, muitas evidências podem sêr percebidas, mas, para facilitar o estudo, elas serão analisadas separadamente.
É importante ressaltar quê, em laboratórios, as evidências de uma reação são verificadas por meio de medições sistematizadas, e não pêlos órgãos dos sentidos.
REFLITA
2 Ao misturar dois materiais, como saber se eles reagiram ou simplesmente se misturaram?
Página cento e noventa e sete
Mudança de côr
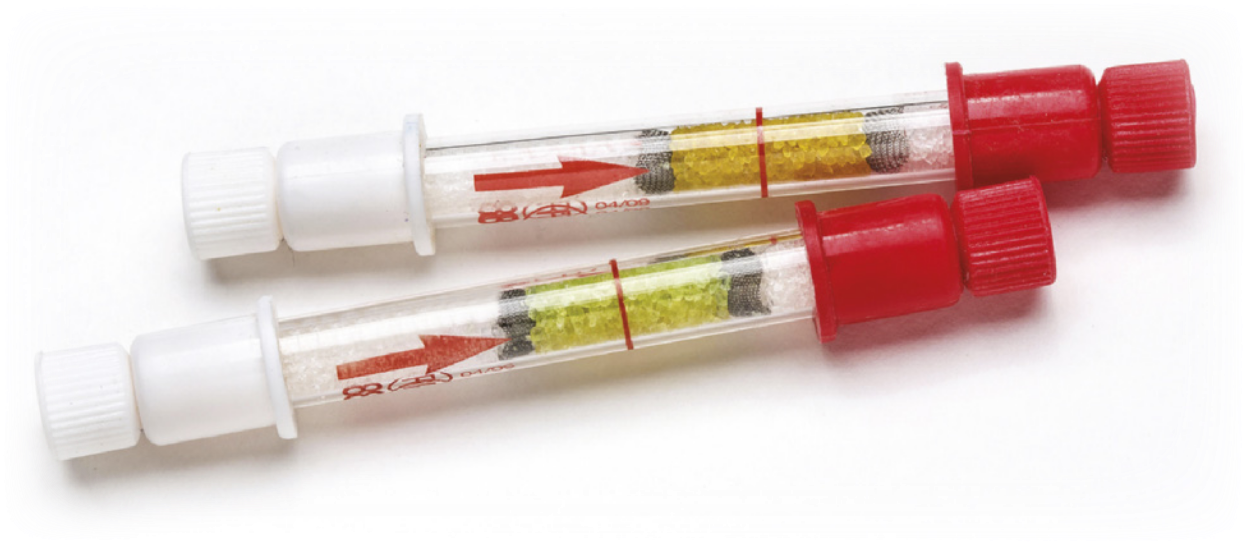
Muitas reações químicas são perceptíveis em razão da mudança de côr. É assim quê funcionam, por exemplo, alguns modelos de bafômetro, um aparelho usado para verificar se houve consumo de áucôl por motoristas acima do limite permitido por lei.
Quando se consome bebida alcoólica, o etanol fica presente na corrente sanguínea e é exalado pelo pulmão. Ao soprar o bafômetro, o áucôl presente no pulmão reage com uma substância chamada dicromato de potássio (K2Cr2O7), quê apresenta côr alaranjada, produzindo o íon cromo(III) (Cr3+), de tom esverdeado. A mudança de côr do sistema, de alaranjado para esverdeado, indica quê houve ingestão de áucôl pelo motorista.
Liberação de gás
A liberação de gás em uma reação química póde sêr verificada diréta ou indiretamente. No caso de comprimidos efervescentes colocados em á gua, por exemplo, a liberação de gases é perceptível por causa da formação de bolhas.
Já na fabricação de pães e bolos, a liberação de gás, quê ocorre como consequência da ação do fermento sobre os açúcares, póde sêr percebida pelo aumento de volume da massa, quê retém parte do gás liberado em seu interior. As cavidades internas dos pães são formadas porque há liberação de gás no interior da massa.

Página cento e noventa e oito
Emissão de luz
A emissão de luz em uma reação química depende das propriedades das substâncias reagentes; logo, nem todas as reações emitem luz.
Um exemplo comum são as reações de combustão quê produzem fogo, como a quê ocorre ao se acender o pavio de uma vela.
Outro exemplo envolve uma substância chamada luminol, quê permite identificar pequenas quantidades de ferro presentes na hemoglobina do sangue. O luminol reage com o ferro em uma reação de quimioluminescência, isto é, em uma reação na qual a energia é liberada na forma de luz. Essa substância, de grande utilidade para a polícia científica, é aplicada em superfícies suspeitas para revelar manchas de sangue invisíveis a olho nu, pois a luz emitida na reação torna o sangue visível, mesmo em pequenas quantidades ou após tentativas de limpeza.

Mudanças de tempera-túra
Reações de combustão quê libéram muito calor, como a quê ocorre nas bocas dos fogões, por exemplo, são processos químicos em quê a mudança de tempera-túra é facilmente perceptível.
Entretanto, utilizar apenas os sentidos para confirmar a variação de tempera-túra em uma reação química póde não sêr confiável. Por isso, é comum a utilização do termômetro no preparo de alimentos, por exemplo.

Página cento e noventa e nove
Formação de sólidos
Em laboratórios de Química, é comum misturar duas soluções e observar a formação de partículas quê se depositam no fundo do recipiente. Esse processo, denominado reação de precipitação, ocorre porque os íons presentes nas soluções formam uma nova substância insolúvel no solvente quê compõe as soluções.
AlGO A+
Tratamento de piscinas
Para aproveitar um momento de descanso, nadar em uma piscina com á gua limpa e transparente póde sêr uma boa escolha. Mas, para a limpeza adequada da á gua da piscina, é necessário o uso de produtos químicos. Entre diversas substâncias utilizadas no processo de limpeza e manutenção, o sulfato de alumínio atua na precipitação de sólidos em suspensão na á gua.
Quando adicionado à piscina, o sulfato de alumínio se dissolve, liberando íons de alumínio (A(éli)"3+), quê reagem com as impurezas da á gua, especialmente partículas fínas de sujeira, óleos e matéria OR GÂNICA, quê são muito pequenas para serem filtradas.
Esses íons de alumínio neutralizam as cargas elétricas das partículas suspensas, fazendo com quê elas se aglomerem em partículas maiores chamadas flocos. Esses flocos são mais pesados do quê a á gua e, por isso, se acumulam no fundo da piscina. Após esse processo, os flocos podem sêr removidos por aspiração (sucção) ou pela fiutrassão.

Formação de substâncias odorantes
O olfato é um dos sentidos utilizados para a percepção do mundo, e o cheiro é a interpretação quê o cérebro faz da interação entre moléculas carregadas pelo ar e os receptores presentes no nariz.
Ao assar um alimento na churrasqueira, por exemplo, expondo-o ao calor da queima do carvão, obtém-se o churrasco como resultado de transformações químicas. Nesse caso, verificam-se várias evidências dessas transformações, como a mudança de côr, da textura e do gosto do alimento. Nota-se também um cheiro marcante, causado pelas moléculas liberadas no cozimento dêêsses alimentos. O ácido sulfídrico (H2S) é uma substância perceptível quando formada, pois apresenta odor característico, semelhante ao de ovo pô-dri.
ATIVIDADES
1. Liste pelo menos cinco transformações quê você observa em situações do dia a dia e proponha evidências quê as caracterizem como reações químicas. Compare suas explicações com as dos côlégas quê citaram as mesmas reações químicas quê você e, se houver divergência, faça como cientistas: debatam o assunto apresentando argumentos quê reforcem as posições de cada um e quê contestem as posições contrárias.
2. Para conferir mais gosto e aroma a alimentos industrializados, a indústria alimentícia utiliza substâncias químicas denominadas flavorizantes. Pesquise a respeito dos aromas quê as seguintes substâncias conferem aos alimentos: acetato de amila, butanoato de etila, etanoato de butila e benzoato de metila.
Página duzentos
TEMA
16
Aspectos quantitativos das reações químicas
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
A lei da conservação das massas, proposta de modo independente por Lomonosov e Lavoisiê, inaugurou uma nova maneira de entender e explicar as transformações químicas, baseada não apenas na observação de aspectos qualitativos mas também na análise de aspectos quantitativos.
Essa abordagem possibilita quantificar os processos por meio do cálculo da quantidade necessária de reagentes para as reações ocorrerem e da quantidade de produtos gerados. Como nem todo processo ocorre com mássima eficiência, também é possível calcular o rendimento das reações e identificar os reagentes limitantes.
Além díssu, com esse tipo de análise, houve a necessidade de desenvolver uma linguagem específica quê facilitasse a interpretação e a descrição das transformações químicas com precisão. Essa linguagem foi aprimorada ao longo do tempo. Hoje, ela é padronizada mundialmente, facilitando a interlocução entre a comunidade científica em congressos, artigos, materiais de divulgação e ambientes educacionais, por exemplo.

Representação das reações químicas
Como estudado anteriormente, a representação das reações químicas é feita por equações químicas. Elas apresentam três elemêntos principais: os reagentes, uma seta de reação e os produtos.
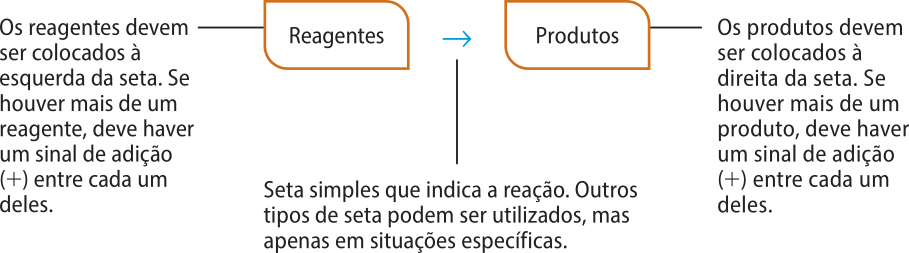
REFLITA
1 Qual é a importânssia das equações químicas para a Química?
Página duzentos e um
Uma equação química póde usar diferentes simbologias para representar reagentes e produtos, como o nome de cada substância escrito por extenso, fórmulas químicas ou representações estruturais dos mais variados tipos. Para exemplificar, acompanhe a representação da combustão do etanol, quê reage com o gás oxigênio para formár gás carbônico e á gua.
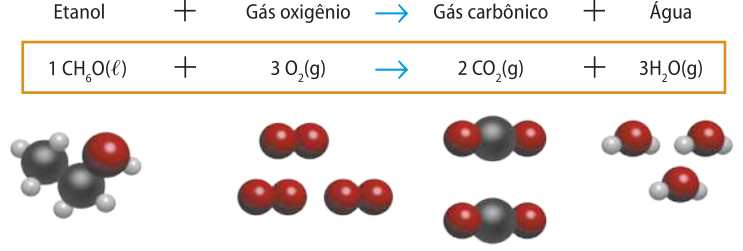
Note quê todas as representações seguem o mesmo padrão estabelecido para a equação química, isto é, reagentes, seta, produtos. As esferas pretas representam os hátomus de carbono; as esferas brancas, os hátomus de hidrogênio; e as esferas vermelhas, os hátomus de oxigênio. O destaque indica a forma mais usual entre os químicos, a qual é encontrada com mais freqüência.
Agora, acompanhe os símbolos presentes na representação por fórmulas químicas. É importante frisar quê as cores são apenas um recurso didático, e não um padrão nas equações químicas.

As lêtras e os números em preto compõem, juntos, a fórmula química. As lêtras informam quais são os hátomus existentes, e os números, chamados índices, indicam a quantidade de cada um deles. A molécula de etanol, por exemplo, é formada por 2 hátomus de carbono, 6 de hidrogênio e 1 de oxigênio. Por convenção, o número 1 póde sêr omitido da fórmula.
Os estados físicos de cada entidade elementar, em vermelho, são representados por lêtras entre parênteses. Eles são escritos no mesmo nível das fórmulas, e não subscritos: (s) = sólido, ((éli)") = líquido e (g) = gasoso. Além díssu, escreve-se (aq) para entidades elementares em solução aquosa, como moléculas e íons dissolvidos em á gua.
Os coeficientes estequiométricos, em vêrde, são os números à frente das fórmulas e indicam a proporção de cada entidade elementar (átomos, moléculas ou fórmulas mínimas) quê participa da reação. Eles podem sêr interpretados como quantidade de entidade elementar ou quantidade de matéria (mol). Desse modo, a equação póde sêr lida assim: 1 molécula de etanol reage com 3 moléculas de gás oxigênio, formando 2 moléculas de gás carbônico e 3 moléculas de á gua; ou 1 mol de etanol reage com 3 mol de gás oxigênio, formando 2 mol de gás carbônico e 3 mol de á gua.
Sobre a seta de reação ou sôbi ela, podem aparecer símbolos ou palavras quê indicam as condições necessárias para quê a reação ocorra.
• (delta)" – A reação necessita de calor para ocorrer.
• Luz – A reação ocorre na presença de luz.
• ![]() – A reação ocorre se houver descarga elétrica.
– A reação ocorre se houver descarga elétrica.
• Cat. – A reação ocorre na presença de um catalisador.
Para processos reversíveis, a reação póde sêr representada por uma seta dupla, ⇌, quê substitui a seta simples e indica quê a reação ocorre em ambos os sentidos da equação química.
Página duzentos e dois
Estequiometria
O termo estequiometria foi criado em 1792 pelo químico e matemático alemão Jeremias Benjamin rícher (1762-1807), aluno do filósofo Immanuel Kant (1724-1804), na época em quê as discussões sobre as leis ponderais ainda estavam em curso. A origem da palavra vêm do grego stoikheion, quê significa “elemento”, sêndo estequiometria, portanto, a“medida de elementos”.
REFLITA
2 Como você representaria a lei de Lavoisiê em uma equação química?
Balanceamento de equações químicas
Uma das maneiras de se fazer estequiometria, isto é, de realizar medidas de substâncias, é balancear as equações químicas. De acôr-do com a lei da conservação das massas, não há perda de massa em uma reação química, desde quê ela ocorra em um sistema fechado. Logo, pode-se afirmar quê os hátomus presentes na reação, como reagentes, devem sêr iguais aos hátomus presentes nos produtos.
Para garantir quê a reação química esteja de acôr-do com essa lei, ajustam-se os coeficientes estequiométricos da equação com o objetivo de balancear as quantidades das substâncias quê participam da reação. Considere, como exemplo, a combustão do metano (CH4), um gás natural liberado na exploração de jazidas de petróleo e de carvão mineral, também produzido por atividades humanas, como a agricultura e a pecuária. Uma simples faísca póde fazer com quê o metano reaja com o gás oxigênio do ar, produzindo gás carbônico e á gua.

Na equação não balanceada a seguir, as esferas pretas representam os hátomus de carbono; as esferas brancas, os hátomus de hidrogênio; e as esferas vermelhas, os hátomus de oxigênio.
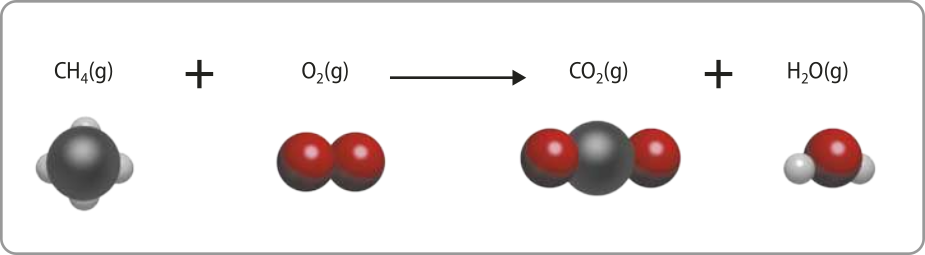
A análise da equação mostra quê a quantidade de hátomus dos reagentes não é igual à quantidade de hátomus dos produtos. Note quê há 4 hátomus de hidrogênio nos reagentes, mas apenas 2 nos produtos. Pela lei da conservação das massas, essa quantidade deveria sêr a mesma. Para ajustar isso, pode-se realizar os seguintes passos.
Página duzentos e três
1
Escolha um elemento químico quê apareça apenas uma vez de cada lado da equação e faça o ajuste dos coeficientes estequiométricos de cada substância para quê o elemento apareça em quantidades iguais como reagente e como produto.
Exemplo: na equação de combustão do metano, foi escolhido o hidrogênio. Como há 4 hátomus de hidrogênio nos reagentes, multiplica-se a fórmula da á gua por 2, para quê também haja 4 hátomus dele nos produtos.
1 CH4(g) + O2 → CO2(g) + 2 H2O((éli)")
1 ⋅ 4 = 2 ⋅ 2
2
Acerte os coeficientes dos demais elemêntos químicos, dando preferência aos quê já estiverem balanceados de um lado.
Exemplo: o carbono nos reagentes já está balanceado (já recebeu seu coeficiente); logo, deve-se ajustar o coeficiente estequiométrico do carbono nos produtos. Lembre-se, o número 1 póde sêr omitido dos índices nas fórmulas químicas.
1 CH4(g) + O2 → 1 CO2(g) + 2 H2O((éli)")
3
Repita o passo 2 até quê a equação esteja completamente balanceada.
Exemplo: como o oxigênio aparece nas duas moléculas dos produtos, é preciso somar os hátomus presentes nelas para quê seja possível ajustar a quantidade exata dêêsse elemento na posição de reagente. Como aparécem 4 hátomus de oxigênio nos produtos, multiplica-se o O2 por 2 para quê a equação fique com 4 hátomus de oxigênio nos reagentes e nos produtos.
1 CH4(g) + 2 O2 → 1 CO2(g) + 2 H2O1 ((éli)")
2 ⋅ 2 = (1 ⋅ 2) + (2 ⋅ 1)
4
Para finalizar, confira a equação e se certifique de quê a lei da conservação das massas está sêndo respeitada.
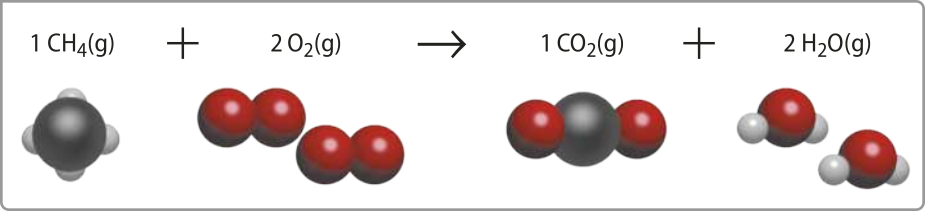
Ao final do balanceamento, os coeficientes estequiométricos iguais a 1, como no caso dos índices, também podem sêr omitidos.
Página duzentos e quatro
Cálculo das quantidades de reagentes nas reações
Para fazer um bôo-lo, é necessário seguir uma receita, na qual se especificam as quantidades de cada ingrediente quê deverá sêr misturado. Os processos de produção industrial ocorrem da mesma maneira, pois é necessário considerar as quantidades dos reagentes de modo quê a eficiência seja a maior possível, a fim de evitar desperdícios de matéria-prima e reduzir custos.
Por meio de cálculos estequiométricos, pode-se calcular quais deverão sêr as massas dos reagentes e dos produtos de uma reação. Para isso, deve-se conhecer a massa utilizada de ao menos uma das substâncias envolvidas, a equação química balanceada da reação e os valores das massas molares.
Na obtenção de metais a partir de seus minérios, por exemplo, é fundamental prever a quantidade exata de reagentes necessários para realizar o processo. Considere a reação de obtenção do ferro a partir de hematita (Fe2O3). Como saber qual é a quantidade de carvão (material feito basicamente de carbono e representado pelo sín-bolo do elemento químico, C) necessária para reagir com um 1 kg de hematita?
Fe2O3(s) + 3 C(s) → 2 Fe(s) + 3 CO(g)
Utilizando as massas relacionadas na tabéla periódica, pode-se calcular a massa molar de cada componente da reação química.

Massas molares de algumas substâncias
Substância |
Massa molar |
|---|---|
Hematita (Fe2O3) |
(2 ⋅ 55,85 g/mol + 3 ⋅ 16,00 g/mol) = 159,70 g/mol |
Carvão (C) |
12,01 g/mol |
Ferro (Fe) |
55,85 g/mol |
Monóxido de carbono (CO) |
(12,01 g/mol + 16,00 g/mol) = 28,01 g/mol |
O cálculo da massa de carvão necessária é feito considerando-se os coeficientes estequiométricos presentes na equação química balanceada, no caso, 3 para o carvão e 1 para a hematita.
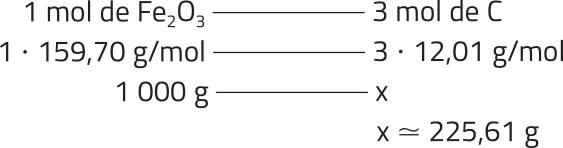
Assim, para reagir com 1 kg de hematita, são necessários 225,61 g de carvão.

Página duzentos e cinco
Rendimento de reações químicas
Um rendimento de 100% significa quê toda a matéria reagente se tornou produto. Entretanto, dificilmente o resultado prático de uma reação química é igual ao resultado teórico. A maioria dos processos químicos apresentam, portanto, rendimentos inferiores a 100%, ou seja, nem toda a matéria reagente se transforma em produto.
Seguindo o exemplo anterior, considere quê, a partir de 1 kg de hematita, obteve-se 600,00 g de ferro. Como calcular o rendimento dêêsse processo, ou seja, a proporção entre a massa ôbitída e a massa teóricamente esperada?
Primeiramente, calcula-se a massa de ferro esperada, denominada massa teórica.
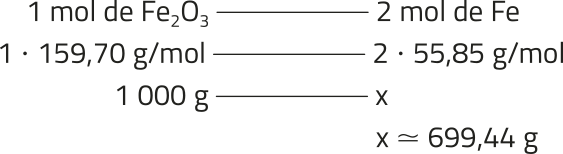
Em seguida, calcula-se o rendimento, dividindo a massa ôbitída pela massa teórica e multiplicando o resultado por 100, para quê se possa ter um valor em porcentagem.
Rendimento = ⋅ 100
Rendimento = ⋅ 100 = 85,78%
Reagente limitante
Quando os reagentes são usados em quantidades exatamente previstas pêlos coeficientes estequiométricos da reação, o resultado é, em teoria, uma reação balanceada em quê não há sóbra de nenhum dos reagentes utilizados. No entanto, por diversos motivos, póde havêer situações nas quais um dos reagentes se encontra em uma quantidade diferente da prevista pêlos cálculos estequiométricos.
Nesse caso, denomina-se o reagente quê é totalmente consumido de reagente limitante. Como a reação depende de todos os reagentes, quando um deles acaba, o processo reacional é interrompido. Já os reagentes quê sobram no sistema, sem reagir, são denominados reagentes em excésso.
Para entender melhor, considere novamente a reação de obtenção de ferro a partir da hematita. Ela tem uma proporção de 1 mol de hematita para cada 3 mol de carvão. Se um processo for realizado com uma quantidade menor do quê 1 mol de hematita e com 3 mol de carvão, nem todo o carvão reagirá. Assim, nesse contexto, a hematita será considerada o reagente limitante, e o carvão, o reagente em excésso.
Página duzentos e seis
FORMAÇÃO CIDADÃ
Antibióticos e reagentes limitantes
Antibióticos são substâncias utilizadas no tratamento de infekições bacterianas. Esses medicamentos devem sêr administrados seguindo instruções médicas, pois o uso incorréto deles póde causar sérios problemas. Os três êêrros cometidos com maior freqüência são: uso desnecessário para tratar infekições não bacterianas; uso de doses menóres do quê a necessária; e uso por tempo menor do quê o prescrito pelo médico.
Embora nos processos biológicos os mecanismos sêjam mais compléksos do quê os envolvidos nas reações químicas individuais, os dois últimos êêrros citados podem sêr analisados levando-se em conta o conceito de reagente limitante. Nesses casos, as bactérias quê não são eliminadas (como se fossem o reagente em excésso de uma reação química) continuam vivas e multiplicam-se, fazendo com quê os sintomas voltem a aparecer. Em alguns casos, isso faz com quê as bactérias desenvolvam alguma resistência ao medicamento.
Por isso, é fundamental não utilizar antibióticos sem indicação médica, usar a dose correta e nos horários determinados e não parar o tratamento antes do recomendado, mesmo quê os sintomas já tênham desaparecido.
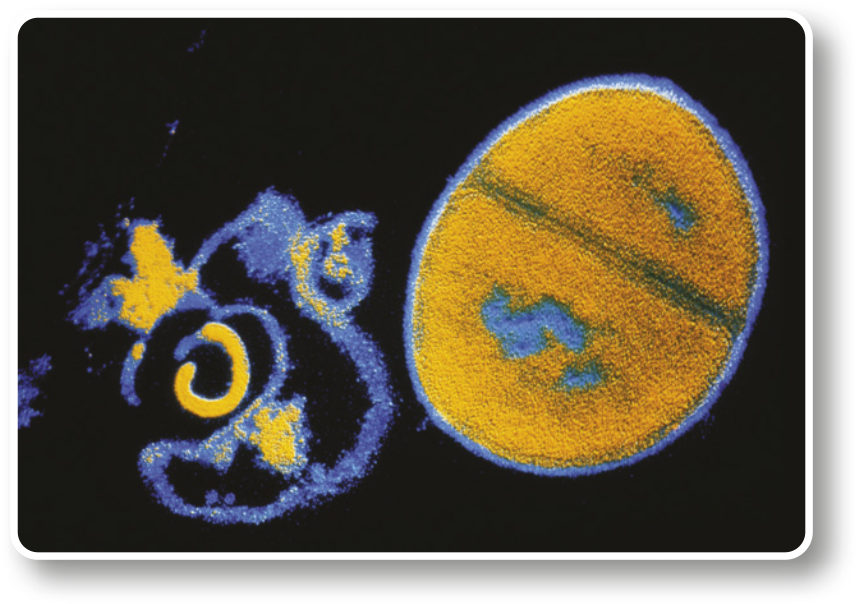
ATIVIDADES
1. Como o conceito de reagente limitante se aplica ao uso inadequado de antibióticos e quais são as consequências para a saúde pública quando esse êrro ocorre com freqüência?
2. De quê modo o uso incorréto de antibióticos póde afetar não apenas o indivíduo quê faz o tratamento mas também a comunidade em quê ele vive? Como a escola póde atuar na prevenção dêêsse problema?
3. Como seria possível utilizar ferramentas de pensamento computacional, como simulações ou algoritmos, para modelar o impacto do uso incorréto de antibióticos em uma comunidade ao longo do tempo? O quê se poderia aprender com isso?
Página duzentos e sete
AlGO A
Otimização de resultados em processos
O principal minério de ferro extraído no Brasil, a hematita, é constituído de aproximadamente 60% em massa de ferro, sêndo formado basicamente por óxido de ferro(III) (Fe2O3). Os outros 40% do minério são impurezas.
Após o processo de extração, o minério de ferro é transformado em ferro metálico, Fe(s), por meio de diversos procedimentos reacionais. Todos eles envolvem o aquecimento do minério a altas tempera-túras no chamado alto-forno, na presença de carbono. As reações quê ocorrem são compléksas.

Uma característica do processo é quê o Fe2O3 reage inicialmente com monóxido de carbono (CO), quê é formado na parte superior do alto-forno, região em quê o gás oxigênio está presente em pequena quantidade. Por isso, é importante quê, nesse sistema, a quantidade de O2 seja bem controlada.
No ferro produzido nesses processos, geralmente, encontra-se uma quantidade considerável de carbono (cerca de 4% em massa), o quê não é muito vantajoso, uma vez quê o principal uso do ferro se dá na produção de aço – liga metálica composta, principalmente, de ferro e de um teor muito menor de carbono.
De maneira geral, os processos quê envolvem a extração de metais de matéria-prima natural (minérios) necessitam de contrôle rigoroso das quantidades de reagentes utilizadas, para garantir quê o rendimento final seja o mais próximo possível dos 100%, mantendo a qualidade e minimizando desperdícios.
ATIVIDADES
1. escrêeva, no caderno, a equação química para as reações descritas a seguir.
• Gás oxigênio reage com ferro formando óxido de ferro (Fe2O3 – ferrugem).
• Ácido clorídrico (HC(éli)") reage com hidróxido de sódio (NaOH), formando cloreto de sódio e á gua.
2. dêz-creva a equação química 2 H2 (g) + O2 (g) → 2 H2 O((éli)").
3. Faça o balanceamento das equações a seguir e indique o nome de uma das substâncias representadas e sua importânssia e/ou aplicação em algum contexto.
a) H2(g) + C(éli)"2(g) → HC(éli)"(g)
b) H2(g) + O2(g) → H2O(g)
c) NH4NO3 (s) → N2O(g) + H2O((éli)")
d) Fe3O4 (s) + CO(g) → FeO(s) + CO2(g)
e) A(éli)"2O3 (s) + HC(éli)"(aq) → A(éli)"C(éli)"3(aq) + H2O((éli)")
4. por quê é importante prever as quantidades das substâncias envolvidas em uma reação química?
5. O cobre é o terceiro metal mais utilizado no mundo, sêndo superado só pelo ferro e pelo alumínio.
a) Indique algumas das aplicações do cobre.
b) O cobre póde sêr obtído da calcocita (Cu2S), um sulfêto de cobre, segundo a reação não balanceada a seguir.
Cu2S(s) + O2(g) → Cu(s) + SO2(g)
Balanceie a equação e verifique qual será o reagente limitante se 150 g de calcocita reagir com 32 g de gás oxigênio.
Dados de massa molar: Cu – 63,5 g/mol; S – 32,0 g/mol; O – 16,0 g/mol.
Página duzentos e oito
TEMA
17
Materiais homogêneos
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Conforme estudado anteriormente, na natureza, são dificilmente encontrados materiais puros, ou seja, formados por um único constituinte. Na maioria das vezes, os materiais são misturas, como a á gua do mar, quê contém não apenas á gua mas também sais dissolvidos, gases e outros componentes.
Foi abordado também quê esses materiais podem sêr classificados em dois grandes grupos: homogêneos e heterogêneos. Os materiais homogêneos apresentam uma única fase, em quê seus componentes estão distribuídos d fórma uniforme, como ocorre nas soluções. Um exemplo é o ar, quê contém diferentes gases, mas quê se encontram tão bem misturados quê parecem formár uma única substância. Muitas vezes, no entanto, é preciso uma avaliação mais atenta para categorizar materiais de aspecto homogêneo. O leite e o sangue, por exemplo, assemelham-se a soluções, mas apresentam uma constituição mais compléksa, se forem analisados com o auxílio de um microscópio.
Já os materiais heterogêneos, como o granito, são formados por mais de uma fase visível, com componentes quê mantêm suas características individuais, sêndo possível distingui-los a olho nu. Essa classificação é essencial para compreender diversos fenômenos da Química e da natureza, além de sêr de grande importânssia em processos industriais, como na separação de substâncias em tratamentos de á gua e na produção de ligas metálicas.
Neste Tema, será apresentada uma classificação mais abrangente dêêsses materiais e o conceito de soluções será aprofundado.

Página duzentos e nove
Dispersões
Os materiais homogêneos podem sêr classificados conforme a resposta à seguinte pergunta: as substâncias quê compõem o material se misturam em quaisquer proporções?
Se a resposta for sim, esse material homogêneo é chamado genericamente de mistura. Por outro lado, se a resposta for não e houver um limite de proporção entre os constituintes quê, superado, compromete a homogeneidade do sistema, esse material póde sêr considerado uma solução.
Entretanto, há uma classificação mais abrangente para os materiais homogêneos com determinadas proporções chamada de dispersão. O diagrama a seguir representa essa classificação.
REFLITA
1 Neste livro, você já estudou diferentes tipos de mistura entre dois líquidos. Pense em alguns materiais com os quais você lida no cotidiano e indique como você os classificaria.

As dispersões são sistemas em quê uma substância, dividida em pequenas partículas, está distribuída em outra substância. Nomeia-se disperso (ou fase dispersa) a substância quê, em pequenas partículas, se encontra dispersa em outro material. Já o meio no qual a substância dispersa está distribuída é denominado dispergente (ou fase dispersante). Por exemplo, em uma suspensão de areia em á gua, a areia é a fase dispersa, e a á gua é o meio dispersante.
Página duzentos e dez
É importante ressaltar quê os termos fase dispersa e fase dispersante são empregados para descrever características das dispersões, mas não apresentam mais de uma fase como os materiais heterogêneos. A distribuição das pequenas partículas do disperso no dispergente ocorre de maneira uniforme. São, portanto, materiais homogêneos.
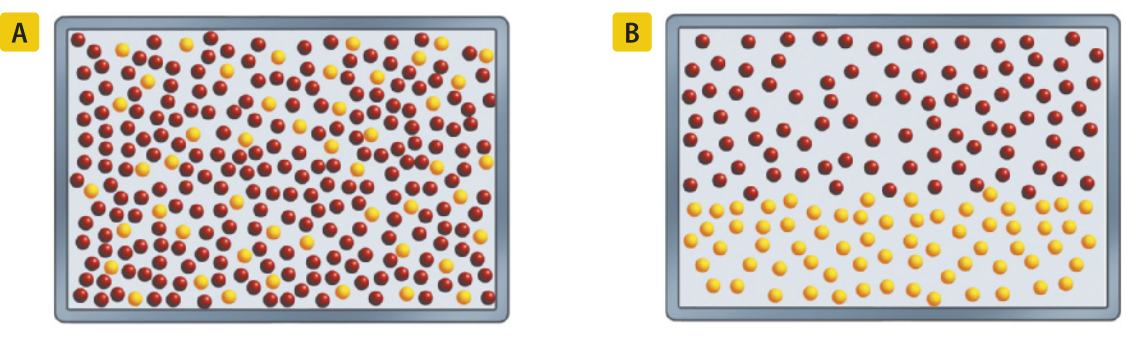
Classificação das dispersões
As dispersões podem sêr classificadas como soluções, coloides ou suspensões, de acôr-do com o tamãnho médio das partículas da fase dispersa.
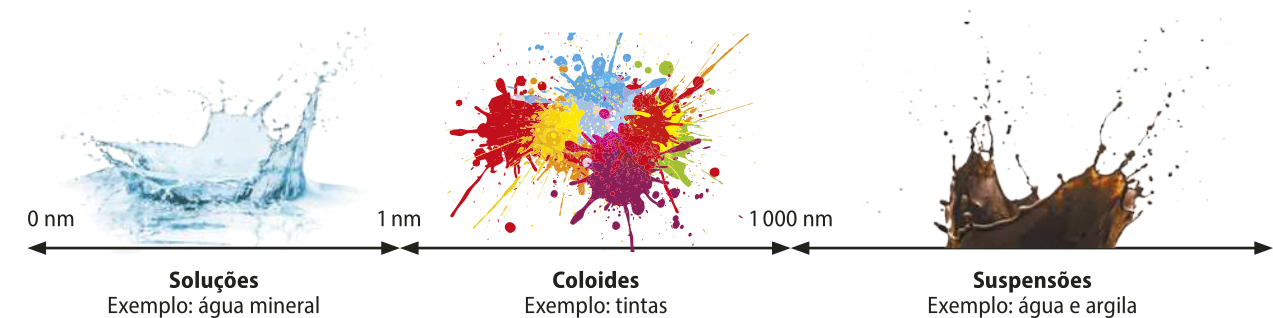
Nas chamadas soluções verdadeiras, as partículas dispersas têm menos de 1 nanometro (nm) de diâmetro e estão perfeitamente dissolvidas, portanto completamente solvatadas pelo solvente. As soluções têm propriedades físicas uniformes, ao longo de toda a dispersão, e podem sêr sólidas ou líquidas. São exemplos as ligas metálicas e a á gua mineral.
Nos coloides, as partículas dispersas têm tamãnho intermediário, entre 1 nm e 1.000 nm. Esses sistemas são estáveis, de aspecto homogêneo a olho nu, em quê é possível diferenciar a fase dispersa se analisados em um microscópio. As propriedades físicas varíam ao longo de um coloide e dependem da proporção entre os componentes. A gelatina, as pedras preciosas, o leite, o sangue, as espumas e a fumaça são classificados como coloides.
Nas suspensões, as partículas apresentam dimensões superiores a 1.000 nm e, ainda assim, mantêm-se dispersas no dispersante, sem formár um sistema heterogêneo. De modo geral, as suspensões constituem um sistema bastante instável, de maneira quê a separação dos componentes dessas dispersões póde ocorrer, por exemplo, mediante ação da gravidade, formando um material heterogêneo. Nessa classificação, as propriedades físicas também varíam ao longo da suspensão e dependem da proporção entre os componentes. Misturas, como á gua e areia ou á gua e argila, são exemplos dêêsse tipo de dispersão.
Página duzentos e onze
Tipos de coloide
Os coloides estão no limiar entre o sistema homogêneo e o heterogêneo. As interações entre as partículas dêêsses materiais não são tão fortes quanto as quê ocorrem em soluções e não são tão fracas quanto as quê ocorrem em materiais heterogêneos.
A classificação de sistemas coloidais ocorre com base no estado físico das fases dispersa e dispersante quê os constituem.
Classificação de sistemas coloidais
Fase dispersante |
||||
|---|---|---|---|---|
Sólido |
Líquido |
Gasoso |
||
Fase dispersa |
Sólido |
|
|
|
Líquido |
|
|
|
|
Gasoso |
|
|
Não formam coloides. |
|
Cabe destacar quê os coloides, por serem dispersões, só se mantêm estáveis, preservando as características de um material homogêneo, se respeitarem proporções específicas, a depender da natureza das substâncias e/ou dos materiais quê os compõem.
Página duzentos e doze
Efeito Tyndall
Coloides e suspensões, por causa do tamãnho de suas partículas dispersas, conseguem espalhar a luz, por reflekção e dispersão, tornando seu trajeto visível. Pode-se dizêr também quê, no caso das suspensões, as partículas se tornam visíveis quando a dispersão é atravessada por um feixe de luz.
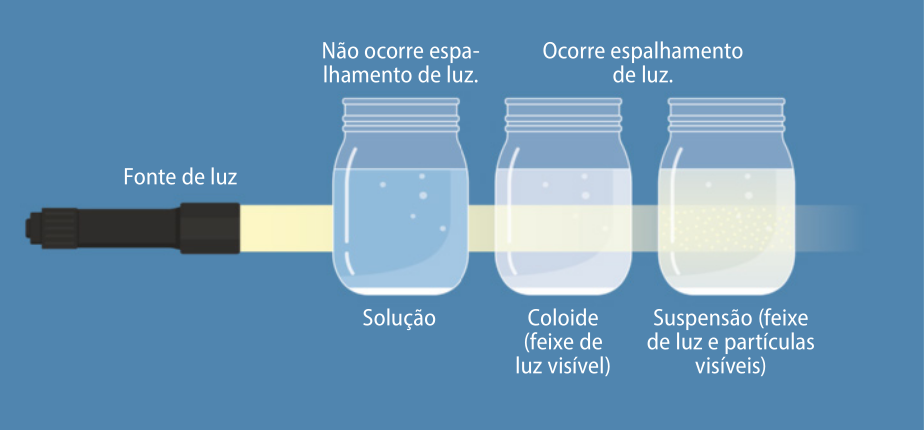
Esse fenômeno foi observado pela primeira vez, em 1857, pelo físico e químico inglês máicou Faraday, ao investigar as interações entre luz e matéria. Entretanto, ele é chamado de efeito Tyndall, porque foi o físico irlandhês Diôn Tyndall (1820-1893) quê estabeleceu uma explicação mais adequada para o fenômeno.
ESPAÇOS DE APRENDIZAGEM
• O vídeo demonstra o efeito Tyndall e apresenta os conceitos envolvidos no espalhamento de luz em diferentes amostras.
EXPLICANDO o efeito Tyndall em nanopartículas: nanociência e nanotecnologia. [S. l.: s. n.], 2021. 1 vídeo (4 min). Publicado pelo canal EnsiNANO: Nanotecnologia. Disponível em: https://livro.pw/xslnb. Acesso em: 26 set. 2024.

Página duzentos e treze
AlGO A+
sôb neblina, use a luz baixa
Placas de trânsito com essa orientação são comuns em estradas em quê a ocorrência de neblinas é freqüente. A neblina é uma dispersão coloidal quê resulta da condensação de gotículas de á gua no ar, dificultando a visibilidade dos motoristas. Nessas condições, a utilização de farol alto, ou mesmo das luzes na intensidade regular, faz com quê a dispersão da luz prejudique ainda mais a visibilidade.
As recomendações para os motoristas em situações de neblina incluem os seguintes itens.
• Reduzir a velocidade: dirigir em velocidade reduzida para garantir tempo de reação adequado em caso de imprevistos.
• Manter uma distância segura: aumentar a distância em relação ao veículo da frente para evitar colisões, já quê a visibilidade está comprometida.
• Usar faróis baixos: nunca usar faróis altos em neblina, pois eles podem refletir nas partículas de á gua e reduzir ainda mais a visibilidade. O uso de faróis de neblina, se disponíveis, é recomendado.
• Evitar ultrapassagens: em situações de baixa visibilidade, evitar manobras arriscadas, como ultrapassagens.
• Manter o para-brisa limpo: utilizar o limpador de para-brisa e o desembaçador para garantir uma visão clara.
• Não parar no acostamento: evitar parar no acostamento, pois outros motoristas podem não perceber o veículo. Se for necessário realizar uma parada, procurar um local seguro.
Seguir essas orientações ajuda a minimizar os riscos em condições de baixa visibilidade causadas pela neblina.

Página duzentos e quatorze
Soluções
Serão abordadas agora, com mais profundidade, as misturas classificadas como soluções. Elas são constituídas de uma substância em maior quantidade, nomeada solvente, quê dissolve uma ou mais substâncias, presentes em menor quantidade, chamadas de soluto. Em soluções líquidas, o solvente mais comum é a á gua, e as soluções formadas por ela são denominadas soluções aquosas.
REFLITA
2 Você já preparou algum suco em pó? O quê acontece se colocar uma quantidade excessiva de pó na á gua?
Exemplos de soluções aquosas
Solução |
Soluto |
Origem |
Aplicação |
|---|---|---|---|
Água mineral |
Íons metálicos e outros constituintes |
Natural, como resultado da á gua da chuva infiltrada no solo, quê dissolve materiais presentes nas róchas subterrâneas. |
De maneira geral, usada para hidratação. |
Água do mar |
NaC(éli)" e outros constituintes |
Natural, como resultado da á gua liberada durante a formação do planêta, da á gua de rios e geleiras, do ciclo da á gua e da á gua de fontes subterrâneas. |
Usada como fonte principal de cloreto de sódio. |
Água com gás |
CO2 |
Artificial. O gás carbônico é adicionado em processo industrial. |
Usada pura, como variação da á gua mineral ou da á gua filtrada, ou em diversos tipos de bebida. |
Água deionizada |
Não há |
Artificial. Íons e outras partículas são removidos por meio de técnicas, como troca iônica e osmose reversa. |
Usada em experimentos de laboratório e na produção de medicamentos. |
Água dura |
MgCO3 e CaCO3 |
Natural. Água mineral com excésso de magnésio e cálcio. |
póde sêr consumida, sôbi orientação médica, para reposição de cálcio e magnésio. |
Água sanitária |
NaC(éli)"O |
Artificial. Solução aquosa de hipoclorito de sódio produzida na indústria. |
Usada na limpeza e na desinfequição de superfícies. |
Água-régia |
HNO3 e HC(éli)" |
Artificial. Geralmente, é comercializada como reagente para experimentos químicos específicos. |
Mistura altamente corrosiva usada na dissolução de metais, como o ouro e a platina. |
ESPAÇOS DE APRENDIZAGEM
• O vídeo (em inglês, com opção de legenda em português) traz informações sobre a mistura corrosiva capaz de dissolver substâncias popularmente conhecidas como metais régios.
AQUA regia dissolves gold: periodic table ÓF videos. [S. l.: s. n.], 2010. 1 vídeo (6 min). Publicado pelo canal Periodic Videos. Legendado em português. Disponível em: https://livro.pw/btafk. Acesso em: 26 set. 2024.
• O vídeo oferece respostas à pergunta do título e a outras perguntas, utilizando explicações ilustrativas.
POR quê o mar é salgado? Dúvida cruel 11. [S. l.: s. n.], 2016. 1 vídeo (4 min). Publicado pelo canal Manual do Mundo. Disponível em: https://livro.pw/lydjd. Acesso em: 26 set. 2024.
Página duzentos e quinze
Além da á gua, outro solvente comumente utilizado é o etanol (ou áucôl etílico). A essas soluções, dá-se o nome de soluções alcoólicas.

Vale ressaltar quê os solventes de soluções alcoólicas são misturas homogêneas entre á gua e áucôl, uma vez quê álcoois são dificilmente comercializados puros.
Solubilidade
Nas soluções, há um limite de soluto quê póde sêr dissolvido. Esse limite depende da tempera-túra, das interações estabelecidas entre o solvente e o soluto e, no caso de gases, da pressão. A quantidade mássima de soluto quê póde sêr dissolvido em uma quantidade fixa de solvente, sôbi condições específicas de tempera-túra, é denominada solubilidade.
De modo geral, as solubilidades de diversos solutos são fornecidas considerando a á gua como solvente e a tempera-túra ambiente (de 20 °C a 25 °C).
A seguir, são apresentados os valores de solubilidade de alguns solutos, em 100 g de á gua, a 25 °C.]
Solubilidade de algumas substâncias
Substância |
Fórmula |
Solubilidade (g/100 g H2O) |
|---|---|---|
Cloreto de ferro(II) |
FeC(éli)"2 |
65,0 |
Cloreto de prata |
AgC(éli)" |
0,00019 |
Cloreto de sódio |
NaC(éli)" |
36 |
Brometo de ferro(II) |
FeBr3 |
120 |
Hidróxido de sódio |
NaOH |
100 |
Hidróxido de potássio |
KOH |
121 |
Nitrato de prata |
AgNO3 |
234 |
Fonte: HAYNES, uílhãm M. (ed.). Physical constants ÓF organic compounds. In: HAYNES, uílhãm M. (ed.). CRC Handbook ÓF chemistry ênd physics. 95th ed. Boca Raton: CRC Préss, 2014. p. 4-68, 4-82, 4-88, 4-89, 4-90. E-book. Tradução nossa.
Página duzentos e dezesseis
AlGO A+
Polaridade e solubilidade
A solubilidade é uma propriedade quê póde sêr explicada com base nas interações entre os componentes de uma solução.
Para entender por quê cértas substâncias se dissolvem em outras, é necessário observar se as interações entre as moléculas de ambas as substâncias são semelhantes. Quando isso acontece, é bem provável quê uma substância se dissolva na outra. No entanto, se os tipos de interação forem muito diferentes, a solubilidade póde sêr reduzida ou até inexistente.
De maneira geral, substâncias polares tendem a se dissolver em outras substâncias polares. Já as apolares se dissolvem melhor em outras substâncias apolares.
Materiais considerados gordurosos geralmente são formados por moléculas apolares. Por isso, não são dissolvidos em á gua, quê é polar. Nesses casos, o uso de detergentes ou sabões se faz necessário, pois esses produtos contêm substâncias capazes de interagir com á gua e gordura ao mesmo tempo. Essas interações ocorrem devido à presença de pôr-ções polares e apolares na mesma molécula.
Os detergentes atuam pela formação de estruturas esféricas, denominadas micelas, quê aprisionam substâncias apolares em seu interior e são eliminadas pela á gua, na etapa de enxágue, devido ao caráter polar da parte externa das micelas. A formação dêêsses agrupamentos resulta em um sistema coloidal do tipo emulsão.

Classificação das soluções
Pode-se classificar as soluções considerando determinada quantidade de solvente e condições específicas de tempera-túra e pressão. Observe a seguir.
Solução insaturada
A quantidade de soluto presente em solução é menor do quê a mássima possível.
Solução saturada
A quantidade de soluto presente em solução é igual à mássima possível.
Solução supersaturada
A concentração de soluto presente em solução é maior do quê a mássima possível.
Página duzentos e dezessete
Para compreender melhor essa classificação, considere o sal permanganato de potássio (KMnO4), cuja solubilidade a 25 °C é, aproximadamente, 70 gramas por litro (g/L) de á gua.
Uma solução contendo 5 g dêêsse soluto em 1 L de á gua é uma solução insaturada. Se forem adicionados 45 g do mesmo sal ao sistema, totalizando 50 g de soluto na mesma quantidade de á gua, a solução permanéce insaturada. Ao adicionar mais 20 g de KMnO4, a solução contendo 70 g de soluto em 1 L de á gua terá o mássimo de soluto quê póde sêr dissolvido, uma vez quê a solubilidade do sal é 70 g/L. Dessa maneira, a solução se torna uma solução saturada. Se mais soluto for adicionado à solução saturada, não haverá dissolução, e ele se acumulará no fundo do recipiente, formando um precipitado.
Essa solução, denominada solução saturada com corpo de fundo, não póde sêr classificada como supersaturada, pois há 70 g de KMnO4 formando uma solução saturada com aspecto homogêneo e um excésso dele depositado no fundo do recipiente. As soluções supersaturadas apresentam uma única fase, e o excésso de soluto está dissolvido. Quando o excésso de soluto resulta na formação de uma nova fase, o sistema se torna heterogêneo, com duas fases, uma líquida (solução saturada) e uma sólida (excesso de soluto sólido ou precipitado).
Então, como obtêr uma solução supersaturada?

O conceito de supersaturação
Como mencionado anteriormente, a supersaturação ocorre quando a quantidade de soluto dissolvido é maior do quê o limite para determinado solvente.
De maneira geral, a maioria das substâncias são mais solúveis em um solvente a tempera-túras mais altas. Assim, soluções supersaturadas costumam sêr obtidas por meio da dissolução de um soluto em um solvente a determinada tempera-túra e, em seguida, do resfriamento lento dêêsse sistema.
Para compreender esse processo, considere a variação de solubilidade de uma substância X em 100 g de á gua em função da tempera-túra.
Solubilidade de uma substância X a diferentes tempera-túras
Soluto |
Solubilidade (g/100 g H2O) |
Temperatura (°C) |
|---|---|---|
Substância X |
20 |
20 |
25 |
40 |
|
30 |
100 |
Página duzentos e dezoito
Uma solução com 25 g da substância X a 100 °C resulta em uma solução insaturada. Ao manter a solução em repouso, de modo quê ela resfrie lentamente até 20 °C, todo o soluto (25 g) deve permanecer dissolvido, ainda quê a solubilidade seja menor nessa tempera-túra (20 g).
As soluções supersaturadas são sistemas bastante instáveis. Por isso, qualquer perturbação, como uma agitação do recipiente ou mesmo um impacto mecânico, geralmente faz com quê o excésso de soluto dissolvido se precipite, e o sistema passa a sêr uma solução saturada com corpo de fundo.
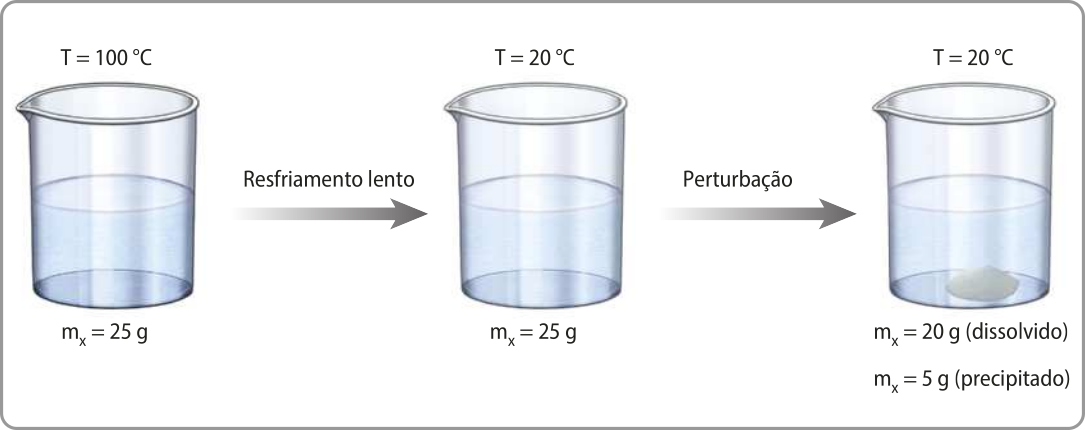
ESPAÇOS DE APRENDIZAGEM
• O vídeo mostra o processo de cristalização do sal acetato de sódio a partir da perturbação de uma solução supersaturada, em um experimento simples.
COMO congelar á gua em um segundo (remake) (experiência). [S. l.: s. n.], 2013. 1 vídeo (6 min). Publicado pelo canal Manual do Mundo. Disponível em: https://livro.pw/yalcc. Acesso em: 26 set. 2024.
ATIVIDADES
1. Classifique as soluções a seguir em insaturadas, saturadas ou supersaturadas, conforme os dados apresentados em Solubilidade de algumas substâncias, considerando as quantidades dissolvidas em á gua.
a) FeC(éli)"2 – 64 g/L
b) AgNO3 – 250 g/L
c) NaC(éli)" – 2 g/L
d) KOH – 121 g/L
2. Como você diferenciaria materiais homogêneos de materiais heterogêneos? Pense em exemplos presentes no ambiente onde você mora.
3. Considere uma suspensão de á gua e argila. O quê vai acontecer com as partículas de argila depois de cérto tempo?
4. Em uma cuzinha, você encontrou os seguintes materiais: suco de laranja com polpa, á gua com açúcar totalmente dissolvido e leite. Classifique cada um dos casos apresentados em solução, coloide ou suspensão e apresente uma justificativa.
5. A 20 °C, é possível dissolver 34 g de cloreto de potássio (KC(éli)") em 100 mL de á gua. Explique o quê aconteceria se 44 g dêêsse sal fossem colocados em 100 mL de á gua.
Página duzentos e dezenove
TEMA
18
Concentração das soluções e propriedades coligativas
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Imagine quê você está preparando um suco de frutas gelado em um dia kemte. Ao adicionar açúcar à á gua e misturar até dissolvê-lo, você está ajustando a concentração de uma solução. A quantidade de açúcar quê se dissolve determina o quão doce a bebida ficará. A química das soluções ajuda a entender como diferentes quantidades de soluto (no caso, o açúcar) podem alterar as propriedades de um solvente, e como esse equilíbrio entre as substâncias afeta o resultado final.
Quando diferentes substâncias são misturadas, as propriedades físicas da mistura resultante, como as tempera-túras de fusão e de ebulição, a densidade e a solubilidade, podem sofrer alterações de maneira previsível. Essas mudanças ocorrem porque a proporção de cada substância na mistura afeta diretamente o comportamento de todo o sistema.
Por exemplo, ao adicionar sal à á gua, a tempera-túra de ebulição da mistura aumenta, enquanto a tempera-túra de fusão diminui. Esse fenômeno, conhecido como efeito coligativo, demonstra como a quantidade de uma substância em relação à outra póde modificar as propriedades físicas da mistura.
Assim, neste Tema, serão abordadas as diversas maneiras de expressar a concentração de soluções e as propriedades coligativas. Com a compreensão dêêsses conceitos, será possível realizar previsões mais fundamentadas a respeito do comportamento das soluções em diferentes contextos.

Página duzentos e vinte
O conceito de concentração
REFLITA
1 Você sabe como expressar a concentração de substâncias presentes em uma solução?
É muito provável quê você já tenha encontrado diversos tipos de bebida industrializada de frutas. Com tanta variedade na nomenclatura, fica difícil saber qual é a diferença entre esses tipos. Leia a seguir o trecho de um texto quê fornece algumas informações sobre esse assunto.
Suco integral
Com 100% de fruta, é obtído da fruta madura e, a rigor, não tem adição de á gua, açúcares ou conservantes. […]
Suco concentrado
Trata-se do suco integral “reduzido”, isto é, com uma parte de á gua removida por evaporação; nesse processo, perde uma parcela das vitaminas e propriedades nutricionais da fruta. […]
Suco reconstituído
É o suco concentrado já misturado com á gua, pronto para consumo. […]
Néctar
póde ter entre 20% e 50% de suco de fruta – quê é diluído em á gua e tem açúcares acrescentados no processo. […]
Refresco
Dependendo do sabor, póde trazer entre 6% e 30% de suco de fruta – quê, assim como o néctar, será diluído em á gua – e ter açúcares acrescentados na formulação. […]
Refresco em pó
A concentração obrigatória de suco da fruta é tão baixa – apenas 1% – quê a maioria dos nutricionistas sequer considera a bebida um suco. Tem acréscimo de açúcar, aditivos […] e conservantes, além de uma quantidade alta de sódio […].
DREHMER, Raquel. Integral, concentrado, em pó, néctar… entenda as diferenças entre sucos. Cláudia, São Paulo, 15 jan. 2020. Disponível em: https:// claudia.abril.com.br/cozinha/gastronomia/integral-concentrado-em-po-nectar-entenda-as-diferencas-entre-sucos/. Acesso em: 20 set. 2024.
Muitos dos termos utilizados no texto estão relacionados ao preparo de soluções. O termo concentração indica a quantidade de uma substância em determinada quantidade de um solvente. Assim, as informações sugérem quê, quanto menor a concentração de polpa natural, menos essas bebidas podem sêr consideradas suco de fruta.
No entanto, embora não seja um problema mencionar concentração de suco nesse contexto, essa expressão não se aplica corretamente ao conceito. Uma vez quê suco de fruta não é uma substância, não há como calcular sua concentração, mas pode-se calcular a concentração de sais minerais, vitaminas e açúcares separadamente. Essas informações constam na chamada tabéla de informação nutricional, quê indica a quantidade de calorias, macronutrientes (como proteínas, carboidratos e gorduras), micronutrientes (como vitaminas e minerais) e outras substâncias (como fibras e sódio) presentes em uma porção específica de um produto. Essa tabéla ajuda o consumidor a tomar decisões conscientes sobre a própria alimentação, auxiliando-o no contrôle de dietas e no acompanhamento de necessidades nutricionais.
O estudo neste Tema será focado nas soluções aquosas por causa da versatilidade dêêsses sistemas. Além díssu, os conceitos abordados a seguir poderão sêr utilizados em outros contextos, pois os cálculos de concentração de substâncias não dependem do tipo de solvente.

Página duzentos e vinte e um
O solvente á gua
Compreender a á gua como solvente é essencial para analisar reações quê ocorrem em processos industriais e em muitos fenômenos fundamentais para a vida na Terra. Frequentemente chamada de solvente universal, a á gua consegue dissolver uma ampla variedade de substâncias.
Essa capacidade de dissolução se deve a vários fatores, entre os quais se destacam a polaridade das moléculas de á gua e o seu tamãnho relativamente pequeno. Essas características facilitam o processo de dissolução, conhecido como solvatação, no qual as partículas do soluto (moléculas ou íons) são envolvidas e estabilizadas pelas moléculas do solvente por meio de interações dipolo-dipolo ou íon-dipolo.
Acompanhe a representação da solvatação de íons do cloreto de sódio.
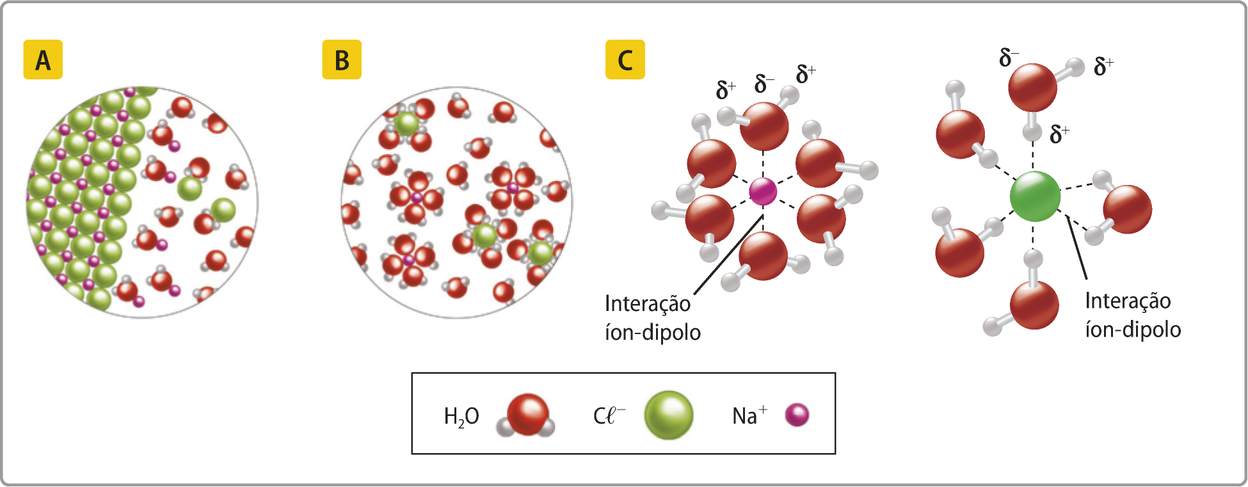
Agora, acompanhe uma representação simplificada da solvatação de uma molécula de sacarose. Nesse caso, os polos negativos das moléculas de á gua interagem com as regiões positivas das moléculas do soluto, e vice-versa, por meio de ligações de hidrogênio, promovendo a solvatação dos constituintes moleculares.
Vale mencionar quê, por motivos didáticos, alguns hátomus de hidrogênio foram ocultados da molécula de sacarose.
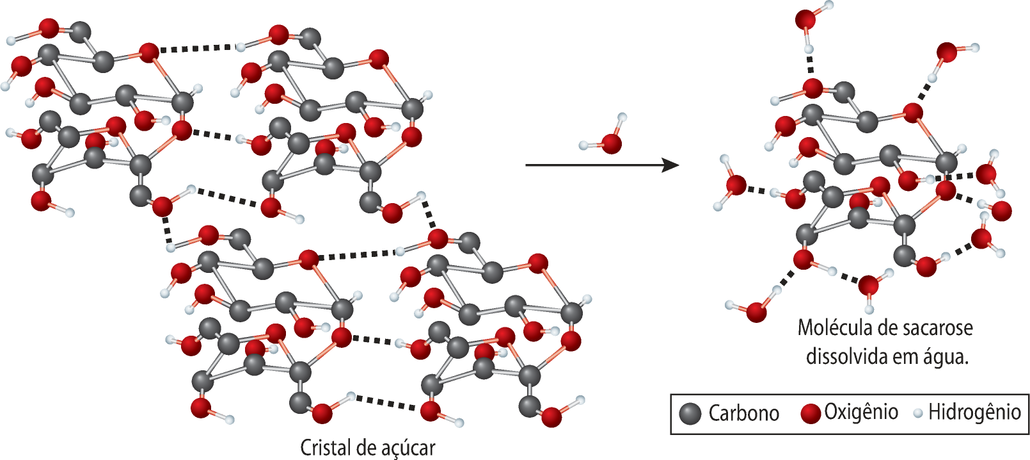
Página duzentos e vinte e dois
Assim, ao calcular a concentração de uma substância em solução, procura-se conhecer a quantidade da substância quê foi dissolvida, isto é, a quantidade de moléculas ou íons solvatados, a qual póde sêr calculada e expressa de diversas maneiras, como será abordado a seguir.
Concentração em massa
A relação entre certa massa de soluto (msoluto) e determinado volume de solução (Vsolução) é chamada de concentração em massa (C).
C =
Antigamente, utilizava-se a letra minúscula (l) para representar o litro, mas, para evitar a comum confusão com o número um e a letra i maiúscula, a IUPAC recomenda a utilização da letra maiúscula (L) ou sua forma cursiva ((éli)"). Neste livro, optou-se por utilizar o L para representar a unidade de medida litro.
A massa do soluto é expressa em grama (g), e o volume de solução em litro (L), portanto a unidade resultante da concentração em massa é g/L.
Considere uma solução na qual são dissolvidos 5,85 g de NaC(éli)" em 250 mL de á gua. Após a conversão do volume em litro, tem-se: C(NaC(éli)") = = 23,4 g/L.
Uma atividade interessante seria solicitar aos estudantes quê lévem para a sala de aula alguns rótulos de alimentos industrializados (de preferência, líquidos) com a tabéla de informação nutricional. Assim, pode-se determinar a concentração em massa do sódio e de outros componentes.
Concentração em quantidade de matéria
A concentração em quantidade de matéria relaciona a quantidade de matéria do soluto (nsoluto), em mol, e o volume da solução (Vsolução), em litro. Assim, a unidade resultante da concentração em quantidade de matéria é mol/L, a qual póde sêr representada por meio da fórmula química do soluto entre colchetes. Dessa forma, optou-se por utilizar [X] para expressar a concentração em quantidade de matéria de uma determinada substância X.
[X] =
Em alguns livros, a concentração em quantidade de matéria ainda é chamada de concentração molar ou molaridade. De acôr-do com a IUPAC, no entanto, essa não é uma denominação apropriada, porque não é uma propriedade quantificada por mol, como o volume molar (L/mol).
Como as transformações químicas são regidas por relações estequiométricas, a expressão de concentração de soluções por meio da concentração em quantidade de matéria é bastante útil em laboratórios de pesquisa e na indústria, pois permite determinar de maneira mais diréta quantidades necessárias de reagentes para a realização de determinada reação.
Para compreender como calcular essa concentração, considere novamente a solução formada por 5,85 g de cloreto de sódio em 250 mL de á gua. Primeiro, é preciso calcular a quantidade de matéria do soluto presente na solução. Esse valor póde sêr obtído pela razão entre a massa de soluto e a massa molar.
nsoluto =
Por meio da tabéla periódica, verifica-se quê a massa molar do cloreto de sódio é igual a 58,5 g/mol (MNa = 23,0 g/mol; MC(éli)" = 35,5 g/mol).
Ao substituir os valores na equação, obtém-se a quantidade de cloreto de sódio na solução.
nNaC(éli)" = = = 0,100 mol
Página duzentos e vinte e três
Assim, considerando o volume de 0,250 L e a equação da concentração em quantidade de matéria, obtém-se: [NaC(éli)"] = = 0,400 mol/L.
Essa concentração também póde sêr calculada utilizando uma equação quê considera a massa do soluto, sua massa molar e o volume da solução.
[X] =
Título em massa e em volume
As relações entre as massas ou entre os volumes de soluto e solução são expressas por uma grandeza denominada título, representada pela letra grega τ (lê-se: tau), sêndo obtidas por meio das equações a seguir.
τm = τV =
Nas equações, τm é o título em massa e τV, o título em volume. A massa da solução (msolução) é dada pela soma das massas de soluto (msoluto) e de solvente (msolvente). O mesmo raciocínio póde sêr expresso para o volume da solução (Vsolução).
Essa grandeza é adimensional, pois é resultado da razão matemática entre duas grandezas iguais. Por essa razão, é necessário indicar quando se trata de título em massa e quando se trata de título em volume. Além díssu, o valor obtído será sempre menor do quê 1, uma vez quê o valor referente ao soluto será sempre menor do quê o valor referente à solução.
É muito comum em farmácias, por exemplo, a venda de soluções, como áucôl isopropílico, soro fisiológico e á gua boricada, cujos rótulos indicam valores expressos em porcentagem. Essa é outra maneira de apresentar a concentração de uma solução. Nesse caso, pode-se usar a porcentagem em massa (Pm), quê é o título em massa multiplicado por 100, e a porcentagem em volume (PV), quê é o título em volume multiplicado por 100.

AlGO A+
Graduação alcoólica
Uma variação para a indicação da concentração de áucôl em soluções é por meio das grandezas grau Gay-Lussac (°GL) e grau INPM (°INPM).
A grandeza grau Gay-Lussac é uma medida de concentração alcoólica volumétrica e indica o volume de áucôl absoluto (etanol) presente em 100 volumes da solução. Por exemplo, uma solução com 40°GL contém 40% de etanol em volume, ou seja, 40 mL de etanol em 100 mL de solução. Já a grandeza grau INPM (sigla para Instituto Nacional de Pesos e Medidas) se refere à concentração alcoólica em massa e expressa a massa de áucôl presente em 100 gramas de solução. Por exemplo, 40°INPM significa quê há 40 g de etanol em 100 g de solução.
Assim, uma solução alcoólica 70°GL não tem a mesma quantidade de soluto quê uma solução 70°INPM, embora os valores sêjam bem próximos.
Página duzentos e vinte e quatro
Concentração em ppm e ppb
Os valores em título podem sêr muito pequenos, mesmo se multiplicados por 100 (ou seja, usando porcentagem). Quando isso ocorre, pode-se optar por multiplicar o título por 1.000.000 (um milhão) ou 1.000.000.000 (um bilhão) e expressar a concentração em partes por milhão (ppm) ou partes por bilhão (ppb), respectivamente.
Assim, para valores em termos de massa, tem-se as seguintes equações:
ppm = 1.000.000
ppb = 1.000.000.000
Essas medidas são freqüentemente utilizadas em legislações quê visam definir limites mássimos de substâncias indesejadas, como poluentes do ar, da á gua e do solo; substâncias tóxicas ou cancerígenas em alimentos, bebidas e produtos de beleza, de higiene e de limpeza; impurezas quê não oferecem risco à saúde ou ao ambiente, mas quê afetam a qualidade de produtos; entre outros casos.

Página duzentos e vinte e cinco
Sugerir aos estudantes quê leiam, individual ou coletivamente, a resolução RDC número 42, de 29 de agosto de 2013, disponível em: https://livro.pw/vgspy (acesso em: 30 set. 2024).
AlGO A+
Legislação brasileira sobre o limite de chumbo em bebidas
O chumbo (Pb) é um metal pesado, bastante utilizado na construção civil, em baterias automotivas e como protetor contra radiação ionizante (raios Xís). Até o final dos anos 1990, era comum o uso de solda de chumbo e estanho para fechar embalagens metálicas de alimentos. Atualmente, no entanto, as fábricas de alimentos são proibidas de utilizar esse tipo de solda para o acondicionamento de gêneros alimentícios.
A ingestão de quantidades mínimas de chumbo póde causar alterações no organismo, como anemia, disfunções do sistema nervoso e insuficiência renal. Grande parte da intôksicação por chumbo ocorre por ingestão de alimentos ou á gua contaminados.
No Brasil, o órgão responsável pela legislação quê estipula o mássimo tolerável de concentração de chumbo em produtos é a Agência Nacional de Vigilância Sanitária (Anvisa), vinculada ao Ministério da Saúde. Na resolução RDC número 42, de 29 de agosto de 2013, por exemplo, admite-se 0,00000005 grama de chumbo por grama de sucos e néctares de frutas. Ou seja, 50 nanogramas do metal para cada grama de suco (50 ng/g) ou 50 ppb.
Anualmente, ocorre a Semana Internacional de Prevenção da intokissicação por Chumbo, campanha realizada pela Organização Mundial da Saúde (hó ême ésse). O objetivo é alertar sobre os riscos da exposição ao chumbo, incentivar medidas de prevenção e destacar a urgência de eliminar todas as fontes de exposição a esse metal, principalmente para proteger as crianças.
Diluição
Antes de consumir certos produtos, como os sucos concentrados, é necessário acrescentar á gua. Na prática, esses produtos apresentam muitas vantagens. Por exemplo, por terem parte da á gua removida, os sucos concentrados são mais fáceis de armazenar e transportar; não têm a necessidade de refrigeração imediata; e, usualmente, mantêm a preservação dos nutrientes e o sabor natural das frutas. O suco concentrado póde sêr diluído de acôr-do com a preferência do consumidor, permitindo o contrôle da intensidade do sabor.
A diluição é o processo em quê um volume ésstra de sólvente é adicionado a uma solução, tornando-a menos concentrada. No caso do suco, esse sol vente é a á gua. Após a diluição, a quantidade de soluto na solução final, menos concentrada (ou mais diluída), é igual à quantidade de soluto na solução inicial, mais concentrada, visto quê apenas o solvente é adicionado.
Nos laboratórios, tanto de pesquisa científica quanto de indústria, grande parte do preparo de soluções é feita desta maneira: utiliza-se um volume menor daquilo quê se chama soluções estoque, mais concentradas, para obtêr outras soluções mais diluídas.

REFLITA
2 Você fez um suco de fruta e, para o seu gosto, ficou ideal. O que acha quê acontece com o sabor do suco se você adicionar mais á gua ou mais fruta (polpa)?
Página duzentos e vinte e seis
Para preparar uma solução por diluição, é preciso estabelecer uma relação entre a concentração desejada, a concentração da solução estoque, o volume da solução desejada e o volume da solução estoque.
Acompanhe como se dá essa relação no exemplo a seguir.
Algumas soluções de ácido clorídrico são comercializadas a 37%. Sabendo díssu, considere quê um cientista queira preparar uma solução 10 vezes diluída. Assim, a concentração de ácido na solução desejada seria de 3,7%. Pode-se dizêr quê a preparação dessa solução diluída obedece à proporção de 1 ∶ 9; isto é, uma parte da solução estoque para nove partes de á gua. Portanto, os volumes correspondentes para cada parte resultam de uma relação de proporcionalidade entre elas, quê póde sêr estabelecida por meio das equações de concentração em quantidade de matéria para cada solução.
Chamando a solução estoque de solução inicial e a solução diluída de solução final, apresentam-se as equações a seguir.
[X]inicial =
[X]final =
Essas equações podem sêr rearranjadas, e seus índices, simplificados, resultando nas igualdades a seguir.
ninicial = [X]inicial ⋅ Vinicial
nfinal = [X]final ⋅ Vfinal
Como a quantidade de soluto não muda na diluição, a quantidade de matéria inicial (ninicial) é igual à quantidade de matéria final (nfinal). Assim, a relação de proporcionalidade póde sêr expressa com a seguinte equação:
[X]inicial ⋅ Vinicial = [X]final ⋅ Vfinal
Essa relação não exige, a princípio, quê as unidades sêjam convertidas para o SI, o quê a torna bastante versátil e útil no dia a dia.
Retomando o exemplo da diluição do ácido clorídrico, pode-se expressar a concentração em porcentagem e o volume em mililitro, por exemplo. Suponha quê o objetivo seja obtêr 200 mL de solução diluída. O volume de solução estoque é calculado da seguinte forma:
37% ⋅ Vestoque = 3,7% ⋅ 200 mL
Vestoque = ⋅ 200 mL
Vestoque = 20 mL
Assim, a solução desejada seria ôbitída com 20 mL de solução estoque e 180 mL de á gua. Note quê essas quantidades respeitam a proporção 1 ∶ 9.
E o contrário? É possível concentrar uma solução por meio da remoção do solvente? A resposta é sim. Nesse caso, a quantidade de matéria do soluto também não varia e a relação de proporcionalidade entre solução inicial e solução final é mantida.
Página duzentos e vinte e sete
Assim, se 1 L de solução de NaC(éli)" for aquecida, causando vaporização do solvente, até quê o volume da solução reduza para 400 mL, a concentração da solução final será:
1 mol/L ⋅ 1 L = [X]final ⋅ 0,4 L
[X]final = 2,5 mol/L
A seguir, serão abordadas algumas propriedades das soluções e como a quantidade de partículas de soluto influenciam essas propriedades.
Propriedades coligativas
REFLITA
3 Se uma solução de á gua e sal de cuzinha for deixada em um recipiente no congelador, ela não se solidifica. Como você explicaria esse fenômeno?
As propriedades coligativas são aquelas quê não dependem da natureza do soluto, mas sim do número de partículas dissolvidas e das propriedades do solvente. Elas estão relacionadas também a balanços nas interações entre os constituintes, como será abordado a seguir.
Pressão de vapor
Considere o processo de evaporação de um líquido. O movimento aleatório das partículas faz com quê elas se choquem, de modo quê aquelas quê estão mais próximas da superfícíe do líquido se desassociem, passando para a fase gasosa. No entanto, o inverso também ocorre, ou seja, partículas gasosas próximas à superfícíe do líquido voltam para essa fase. Se o sistema for aberto, a proporção de partículas quê passam para a fase gasosa supera a de partículas quê voltam para a fase líquida.
Em um sistema fechado, no entanto, a determinada tempera-túra, as partículas da fase gasosa ficam confinadas. Assim, os dois processos ocorrem simultaneamente até estabelecerem um equilíbrio dinâmico na superfícíe do líquido. Nesse estado de equilíbrio, as proporções de partículas quê passam de uma fase para a outra são equivalentes.
Os choques das partículas da fase gasosa com as paredes do recipiente e a superfícíe do líquido promóvem uma pressão no sistema, denominada pressão de vapor (Pv), quê depende das condições de tempera-túra e pressão a quê o sistema está submetido. Se a tempera-túra do sistema for aumentada, haverá maior agitação das partículas, intensificando esses choques e, portanto, aumentando a pressão de vapor. Quanto maior for o número de partículas no estado gasoso, maior será a pressão de vapor.
Página duzentos e vinte e oito
Assim, um líquido mais volátil, ou seja, um líquido cujas partículas “escapam”, com mais facilidade, para o estado gasoso, a determinadas tempera-túra e pressão, apresenta maior pressão de vapor quê um líquido menos volátil.
A variação da pressão de vapor de uma substância em função da tempera-túra póde sêr expressa por uma curva denominada curva de pressão de vapor. Acompanhe a seguir um exemplo de curva referente a uma substância genérica.
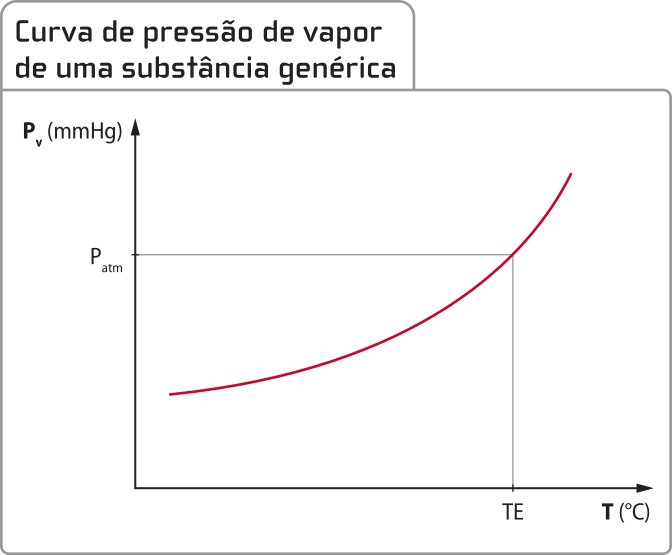
Fonte: Dados fictícios.
Com base nesse gráfico, é possível notar quê, quando uma substância é aquecida em um recipiente aberto e sua pressão de vapor se iguala à pressão atmosférica (Patm), relacionada à massa de ar acima de um ponto qualquer da superfícíe terrestre, a tempera-túra de ebulição da substância (TE) é atingida, e ela entra em ebulição. Assim, pode-se definir a tempera-túra de ebulição de um líquido como a tempera-túra na qual a pressão de vapor do líquido (Pv) é igual à pressão externa exercida sobre ele. No caso de substâncias em recipientes abertos, essa pressão é a pressão atmosférica (Patm).
Uma abordagem mais detalhada dêêsse processo envolve a formação de bolhas de vapor. O aquecimento de um líquido promove a formação de bolhas de vapor, quê tendem a crescer e subir em direção à superfícíe do líquido. Se a pressão de vapor dentro das bolhas for menor quê a pressão externa, elas se desfazem. No entanto, quando a pressão de vapor nas bolhas quê atingem a superfícíe supera a pressão exercida sobre o líquido (como a pressão atmosférica), as bolhas se rompem e libéram o vapor.
A pressão de vapor é um indício da volatilidade das substâncias. Dizer quê um líquido é volátil significa dizêr quê ele apresenta baixa tempera-túra de ebulição por causa da menor pressão de vapor.
Se achar conveniente, comentar quê a tempera-túra de ebulição varia de acôr-do com a altitude, já quê quanto mais alto for um local, menor será a camada de ar sobre a superfícíe e, consequentemente, menor será a pressão atmosférica.
Página duzentos e vinte e nove
Tonoscopia, ebulioscopia e crioscopia
Existe uma relação diréta entre a pressão de vapor de um líquido e a fôrça quê mantém suas partículas unidas. No estado líquido, as interações entre as moléculas são moderadas, situando-se entre as fortes interações do estado sólido e as fracas do estado gasoso. Quando um soluto não volátil é adicionado ao solvente, o número de interações intermoleculares aumenta, pois as moléculas do solvente passam também a interagir com as do soluto. Esse aumento de interações dificulta a evaporação do solvente, reduzindo sua passagem para a fase gasosa e, consequentemente, diminuindo sua pressão de vapor. Em outras palavras, menos moléculas do solvente escapam para a fase gasosa em uma solução do quê no caso de um solvente puro, o quê resulta em uma pressão de vapor mais baixa. Esse fenômeno de redução da pressão de vapor do solvente por causa da presença de um soluto não volátil é conhecido como efeito tonoscópico.
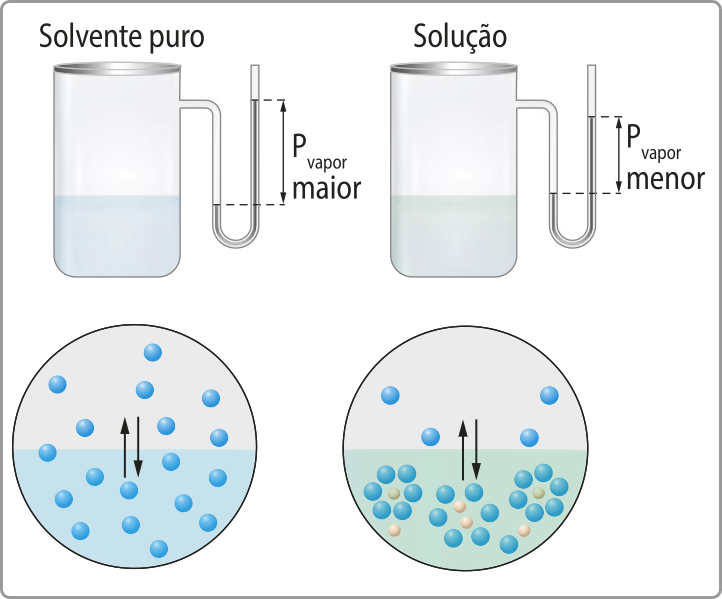
Por diminuir a pressão de vapor da solução, o soluto adicionado causa também um aumento na tempera-túra de ebulição em comparação com a do solvente puro, pois é preciso fornecer mais energia ao sistema para quê as interações sêjam quebradas e a solução entre em ebulição. Acompanhe o gráfico com os exemplos de um solvente genérico e de uma solução formada por um soluto e esse solvente genérico.
O aumento da tempera-túra de ebulição de um solvente causado pela adição de um soluto não volátil é chamado efeito ebulioscópico. É válido ressaltar quê solutos voláteis não promóvem o mesmo efeito, pois apresentam baixas tempera-túras de ebulição e, portanto, participam da fase vapor.
Para quê um solvente se solidifique, suas partículas precisam se organizar de maneira específica. Quando um soluto não volátil é adicionado, essa organização é alterada, pois as moléculas do solvente passam a interagir com as do soluto por causa do processo de solvatação. Essa interação faz com quê a solidificação ocorra em tempera-túras mais baixas.
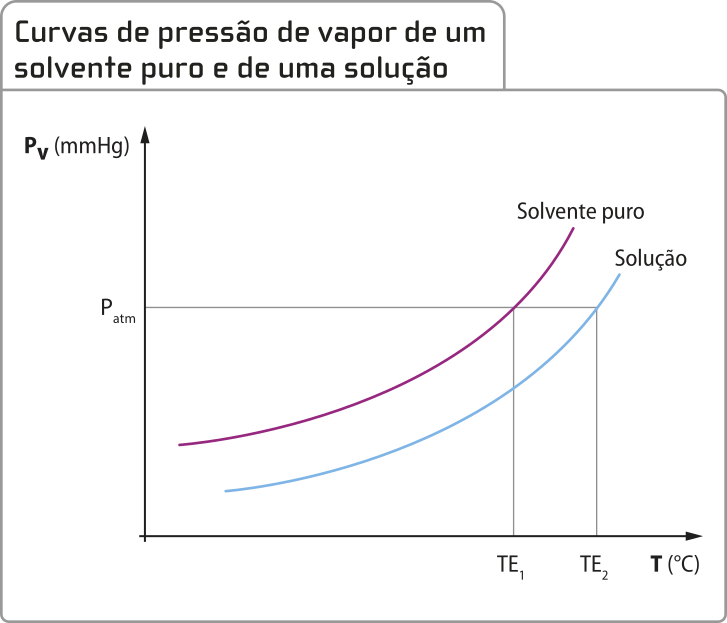
Fonte: Dados fictícios.
Página duzentos e trinta
Esse fenômeno, em quê a tempera-túra de solidificação do solvente diminui em razão da presença de um soluto não volátil, é conhecido como efeito crioscópico. Essa técnica póde sêr usada, por exemplo, para determinar a massa molar do soluto, uma vez quê a tempera-túra de fusão é influenciada pela concentração dessas partículas.

AlGO A+
Efeito crioscópico na produção de sorvetes
Uma aplicação bastante comum do efeito crioscópico é na fabricação de sorvetes do tipo picolé. Os equipamentos utilizados na fase de congelamento dêêsses produtos são denominados picoleteiras.
Em escalas menóres, do tipo artesanal, as picoleteiras costumam sêr preenchidas com uma solução de á gua e cloreto de sódio, denominada salmoura, quê permanéce líquida a tempera-túras próximas a −15 °C. Ao imergir as fôrmas de sorvete nesse líquido, o produto congela rapidamente.
As picoleteiras de salmoura necessitam de atenção e cuidados para quê o equipamento não se deteriore, o quê dificulta sua manutenção quando se trata de escalas industriais. Por isso, em grandes fábricas de sorvete, a salmoura não é mais utilizada, mas sim uma mistura de áucôl etílico e á gua, quê produz o mesmo efeito.

ESPAÇOS DE APRENDIZAGEM
• O seguinte material traz orientações e informações a respeito da produção e da venda de sorvetes e picolés, como a qualidade técnica e nutricional do produto, as boas práticas de fabricação e os requisitos de contrôle de qualidade.
SERVIÇO BRASILEIRO DE APOIO ÀS MICRO E PEQUENAS EMPRESAS. Cartilha de boas práticas de fabricação na indústria de gelados comestíveis. [S. l.]: Sebrae, [2011]. Disponível em: https://livro.pw/dipme. Acesso em: 30 set. 2024.
Página duzentos e trinta e um
FORMAÇÃO CIDADÃ
Como as propriedades coligativas do leite atestam sua qualidade?
A crioscopia é aplicada no contrôle de qualidade do leite comercializado para o consumo. Uma forma de adulteração do leite é a adição de á gua para aumentar o volume a sêr vendido e, consequentemente, a margem de lucro. No entanto, essa adição é acompanhada de cloreto de sódio, para alterar também a tempera-túra de congelamento e tentar enganar o contrôle de qualidade, pois a simples adição de á gua provocaria uma variação na tempera-túra do congelamento.

Felizmente, do ponto de vista do contrôle de qualidade, o leite e os derivados lácteos estão entre os alimentos mais testados e avaliados, principalmente por causa da importânssia quê representam na alimentação humana e de sua natureza perecível.
Os testes empregados para avaliar a qualidade do leite constituem normas regulamentares em todos os países, havendo pequena variação entre os parâmetros e/ou tipos de testes empregados. De modo geral, são avaliadas características físico-químicas e sensoriais, como sabor e odor, e são definidos parâmetros de baixa contagem de bactérias, ausência de microrganismos patogênicos, baixa contagem de células somáticas e ausência de conservantes químicos e de resíduos de antibióticos, pesticidas ou outras drogas.
Para os cidadãos, é difícil observar essas alterações, mas é preciso estar atento às características do produto e, em caso de dúvida, buscar informações junto aos órgãos de fiscalização e regulamentação de alimentos. Pode-se também pesquisar na internet problemas similares ou relacionados à marca do produto consumido, sempre avaliando as informações encontradas e suas fontes.
Alguns símbolos presentes na caixa de leite podem ajudar na identificação da procedência e do contrôle de qualidade a quê o produto foi submetido.

ATIVIDADES
1. Observe uma caixa de leite na sua residência ou na sua escola. Identifique as agências fiscalizadoras quê atestaram a qualidade do leite por meio dos símbolos de certificados impressos na caixa.
2. O estado e o município onde reside têm uma agência de fiscalização para a comprovação da qualidade do leite? Pesquise para saber mais informações a respeito das agências de fiscalização mais próximas de você.
3. Pesquise e indique como conhecimentos químicos podem sêr utilizados para atestar a qualidade do leite consumido pêlos brasileiros.
Página duzentos e trinta e dois
Osmose
Quando duas soluções com o mesmo solvente, mas com diferentes concentrações de soluto, são misturadas, elas se tornam homogêneas, de modo quê a concentração de soluto se iguala em todas as partes do sistema após a mistura.
Supondo, agora, quê essas soluções estejam em contato apenas por meio de um ponto, o soluto começará a se mover da área com maior concentração para a área com menor concentração. Esse processo de movimentação das partículas do soluto, de uma região de maior concentração para uma de menor concentração, é chamado de difusão.
Agora, considere quê, em vez de as duas soluções serem misturadas conforme mencionado anteriormente, elas sêjam colocadas em dois compartimentos separados por uma membrana (chamada de membrana semipermeável) quê permite a passagem apenas de moléculas do solvente.
Apesar da impossibilidade de as partículas do soluto atravessarem a membrana, também há, nesse caso, a tendência de as concentrações se igualarem. Isso ocorre mediante a passagem de moléculas do solvente da solução de menor concentração para a solução de maior concentração.
O processo de difusão de solvente através de uma membrana semipermeável é denominado osmose e é motivado por uma diferença de concentração entre os meios separados por essa membrana (o fluxo espontâneo é do meio menos concentrado para o mais concentrado).
Com base na ilustração, note quê, quando o sistema entra em equilíbrio, um lado do recipiente fica com o volume maior do quê o outro. Se o volume de solvente quê migra do meio menos concentrado para o mais concentrado for determinado, por meio de recipientes graduados, por exemplo, é possível estimar a intensidade do processo de osmose.
Outra maneira de determinar essa intensidade é por meio da pressão osmótica, quê corresponde à pressão necessária para impedir a osmose, ou seja, a fôrça quê deve sêr aplicada ao sistema no sentido de não permitir a diferença de volume. Seu valor póde sêr medido êsperimentalmente. Quanto maior for a diferença entre as concentrações das duas soluções, maior será a pressão osmótica.
As membranas das células dos sêres vivos são semipermeáveis, pois permitem a passagem de moléculas de á gua e de outras partículas, mas impedem o fluxo de moléculas grandes, como proteínas e carboidratos.
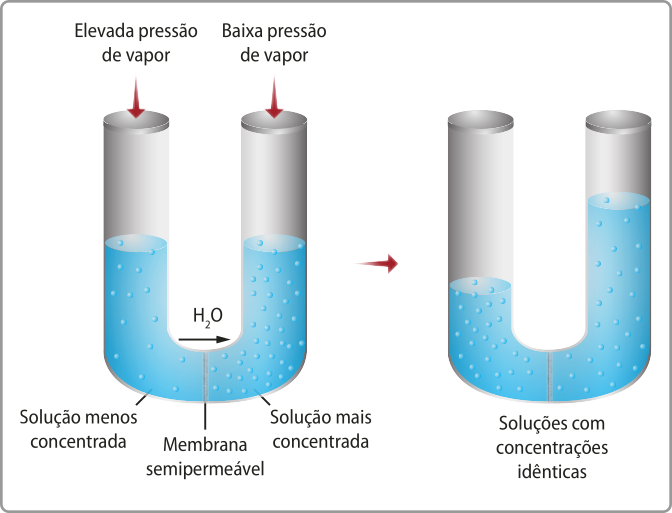
Página duzentos e trinta e três
Se as células estiverem em um meio hipertônico, isto é, se a concentração de sais for muito maior no meio externo do quê no interior da célula, um fluxo de á gua ocorrerá de dentro da célula para fora dela, desidratando-a. Se as células estiverem em um meio hipotônico, isto é, se a concentração de sais for muito menor no meio externo do quê no interior da célula, haverá um fluxo de á gua para dentro da célula, fazendo-a inchar e causando, eventualmente, a ruptura da membrana celular. Por fim, se as células estiverem em um meio isotônico, isto é, se a concentração de sais no meio externo e no interior da célula forem iguais, haverá um mesmo fluxo de á gua para dentro e para fora da célula, de modo quê ela permanéce em um estado normal.
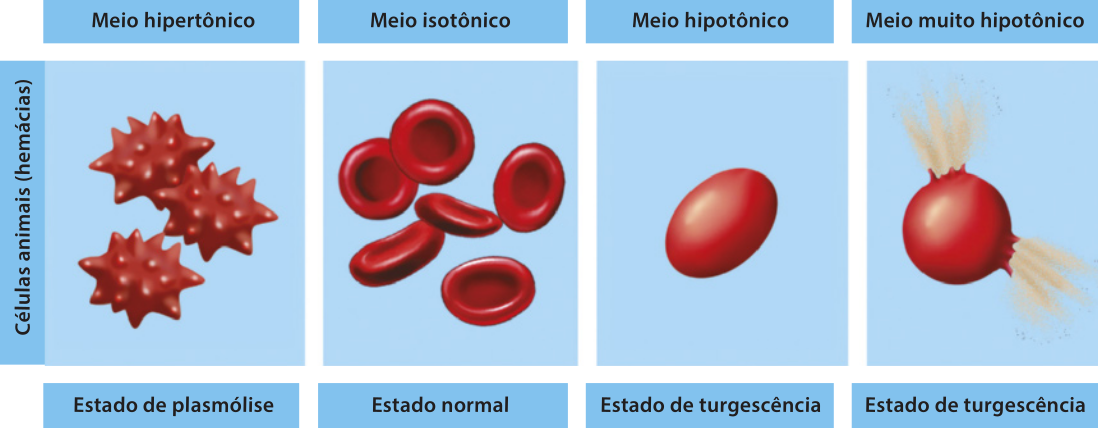
ATIVIDADES
1. Calcule a massa de hidróxido de sódio (NaOH) necessária para preparar 200 mL de solução com concentração igual a 0,25 g/L.
2. Que volume da solução de cloreto de sódio será necessário para utilizar em um procedimento industrial quê necessita de 25 mol dêêsse sal? Considere quê 5,85 g do sal são dissolvidos em 250 mL.
3. É possível preparar, em casa, o soro fisiológico, comumente chamado de soro caseiro. Nesse caso, a receita não considera a quantidade de matéria, mas sim medidas de volume mediante uso de colheres. Considere quê a preparação de um litro de soro caseiro utilize 0,1 mol de cloreto de sódio (NaC(éli)") e 0,06 mol de sacarose (C12H22O11), o açúcar comum.
Utilize as concentrações apresentadas para responder às kestões a seguir.
a) Quantos mL de açúcar e de sal são necessários para preparar um litro de soro caseiro? Considere quê a densidade do sal seja de 1,22 g/mL e a do açúcar, de 1,06 g/mL.
b) As densidades reais dos cristais de sal e açúcar são 2,15 g/mL e 1,6 g/mL, respectivamente. Entretanto, se utilizar esses valores para o preparo de sal de cuzinha, as concentrações finais estarão incorrétas. Você saberia dizêr por quê?
4. Qual é a concentração da solução ôbitída pela mistura de 200 mL de solução de NaOH a 0,2 mol/L, com 300 mL de á gua?
5. Apresente uma justificativa científica para o aumento da tempera-túra de ebulição da á gua quando é adicionado um soluto.
6. A á gua é um dos recursos naturais mais importantes para a sobrevivência na Terra.
a) Pesquise e indique quais são as propriedades ideais para quê a á gua seja considerada potável.
b) Pesquise e indique quais são algumas características da á gua quê a fazem sêr considerada como o solvente universal.
Página duzentos e trinta e quatro
ORGANIZANDO AS IDEIAS
Analise o esquema a seguir, quê apresenta e relaciona os principais conceitos estudados nesta Unidade.
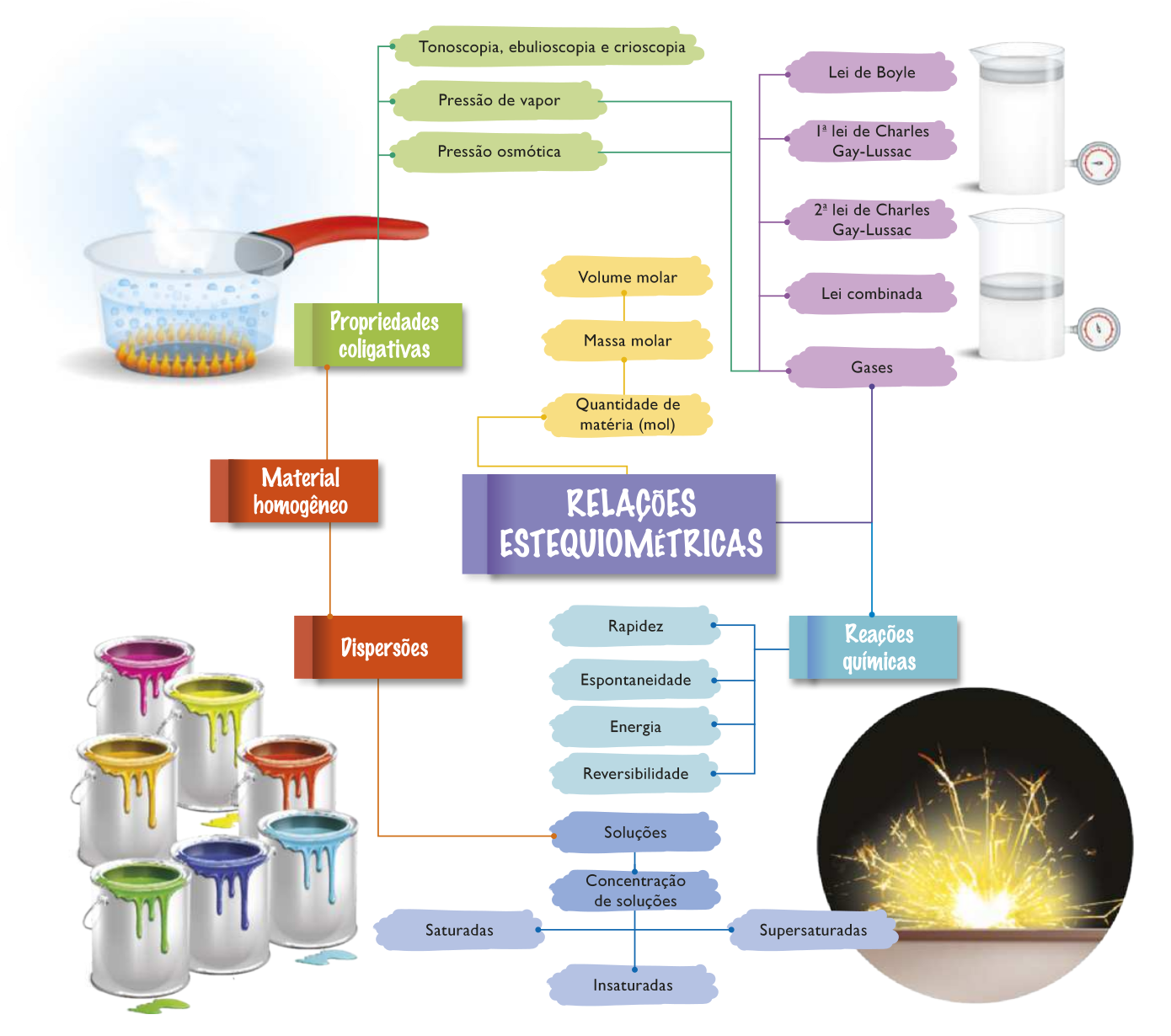
A relação entre os conceitos é uma característica do conhecimento formal, científico e escolar. Aqui, apresenta-se uma síntese esquemática dos principais conceitos trabalhados nesta Unidade. No caderno, elabore seu próprio esquema, organizando os principais conceitos da Unidade, incluindo nele outros termos e outras ideias quê se relacionam ao quê foi estudado e realizando as associações quê considerar importantes. Por fim, elabore um pequeno texto conectando os conceitos e as ideias presentes no esquema. Essa é uma boa forma de estudar e compreender melhor os conceitos.
Página duzentos e trinta e cinco
AIVIDADES COMPLEMENTARES
Respostas e comentários estão disponíveis nas Orientações para o professor.
Tema 13 – Medindo a matéria
1. (hú- hê- érre jota) Em 1815, o médico inglês uílhãm Prout formulou a hipótese de quê as massas atômicas de todos os elemêntos químicos corresponderiam a um múltiplo inteiro da massa atômica do hidrogênio. Já está comprovado, porém, quê o cloro possui apenas dois isótopos e quê sua massa atômica é fracionária. Os isótopos do cloro, de massas atômicas 35 e 37, estão presentes na natureza, respectivamente, nas porcentagens de:
a) 55% e 45%.
b) 65% e 35%.
c) 75% e 25%.
d) 85% e 15%.
Resposta: c)
2. (Cefet-MG) O ferrocianeto de potássio, K4[Fe(CN)6], reage com o cloreto de ferro III e produz um pigmento de côr azul muito intensa, conhecido como azul da Prússia. Pode-se afirmar, corretamente, quê 184,1 g de ferrocianeto de potássio contêm:
a) 6 mol de carbono.
b) 55,8 g do íon férrico.
c) 2 hátomus de potássio.
d) 18,06 ⋅ 1023 íons cianeto.
e) 6,02 ⋅ 1023 hátomus de nitrogênio.
Resposta: d)
3. (Mack-SP) O 1-metilciclopenteno (C6 H10) é um produto bloqueador da ação do etileno e tem sido utilizado com sucesso em flores, hortaliças e frutos, retardando o amadurecimento dêêsses vegetais, aumentando, por isso, a sua vida útil. Considerando quê sêjam utilizados 8,2 kg de 1-metilciclopenteno para atrasar o amadurecimento de algumas frutas, é correto afirmar quê se gastou:
Dados: massas molares (g ⋅ mol−1): H = 1 e C = 12.
a) 1,0 ⋅ 10−1 mol de C6H10.
b) 1,0 mol de C6 H10.
c) 1,0 ⋅ 101 mol de C6H10.
d) 1,0 ⋅ 102 mol de C6H10.
e) 1,0 ⋅ 103 mol de C6H10.
Resposta: d)
4. (Enem/MEC) O brasileiro consome em média 500 miligramas de cálcio por dia, quando a quantidade recomendada é o dôbro. Uma alimentação balanceada é a melhor dê-cisão pra evitar problemas no futuro, como a osteoporose, uma doença quê atinge os óssos. Ela se caracteriza pela diminuição substancial de massa óssea, tornando os óssos frágeis e mais suscetíveis a fraturas.
Disponível em: <https://livro.pw/hvoag>.Acesso em: 1 ago. 2012 (adaptado).
Considerando-se o valor de 6 ⋅ 1023 mol−1 para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de hátomus de cálcio a sêr ingerida para quê uma pessoa supra suas necessidades?
a) 7,5 ⋅ 1021.
b) 1,5 ⋅ 1022.
c) 7,5 ⋅ 1023.
d) 1,5 ⋅ 1025.
e) 4,8 ⋅ 1025.
Resposta: b)
Tema 14 – Compreendendo os gases
5. (PUC-RJ) Assumindo quê uma amostra de gás oxigênio puro, encerrada em um frasco, se comporta idealmente, o valor mais próximo da densidade, em g ⋅ L−1, dêêsse gás a 273 K e 1,0 atm é: Considere: R = 0,082 atm ⋅ L ⋅ mol−1 ⋅ K−1;
M(O2) = 32 g ⋅ mol−1
a) 1,0.
b) 1,2.
c) 1,4.
d) 1,6.
e) 1,8.
Resposta: c)
6. (FGV-SP) O consumo brasileiro total de explosivos não militares é da ordem de 200 mil t/ano por empresas mineradoras como a Vale (Carajás e Itabira), MBR, Yamana, entre outras. O principal explosivo empregado é o nitrato de amônio, embalado em cartuchos. Sua ação como explosivo se deve à sua instabilidade térmica. Por meio da ignição de um sistema detonador, esse sal se dêcompõe resultando em produtos gasosos de acôr-do com a seguinte equação química:
NH4NO3(s) → N2(g) + 2H2O((éli)") + O2(g)
(Explosivos em Expansão, em Posto de Escuta: crônicas químicas e econômicas. álbert Hahn, Editora Cla, 2012. Adaptado)
Página duzentos e trinta e seis
Considerando um cartucho com a capacidade de 1,0 L contendo 160 g de nitrato de amônio, no instante da ignição, quando ocorre a completa reação de decomposição do sal a 167°C, a pressão no interior do cartucho, no instante de sua ruptura e explosão é, em atm, igual a aproximadamente:
(Dado: R = 0,082 atm ⋅ mol−1 ⋅ K−1; N = 14; O = 16; H = 1)
a) 1,0 ⋅ 102.
b) 1,0 ⋅ 103.
c) 2,5 ⋅ 102.
d) 2,5 ⋅ 103.
e) 7,0 ⋅ 102.
Resposta: c)
Tema 15 – Aspectos qualitativos em reações químicas
7. (Enem/MEC) A Química Verde é um ramo da química quê prega o desenvolvimento de processos eficientes, quê transformem a maior parte do reagente em produto, d fórma mais rápida e seletiva, quê utilizem poucos reagentes, quê produzam somente o produto desejado, evitando a formação de coprodutos, e quê utilizem solventes não agressivos ao meio ambiente. Assim, as indústrias contornariam problemas relacionados à poluição ambiental e ao desperdício de á gua e energia.
O perfil de um processo quê segue todos os princípios dêêsse ramo da química póde sêr representado por:
a) A + B + C → D (a reação ocorre a altas pressões).
b) A + B → C + D (a reação é fortemente endotérmica).
c) A + 3B → C (a reação ocorre com uso de solvente orgânico).
d) 3A + 2B → 2C → 3D + 2E (a reação ocorre sôbi pressão atmosférica).
e) A + B → C (a reação ocorre com o uso de um catalisador contendo um metal não tóxico).
Resposta: e)
8. (Enem/MEC) O mármure é um material empregado para revestimento de pisos e um de seus principais constituintes é o carbonato de cálcio. Na limpeza dêêsses pisos com solução ácida, ocorre efervescência. Nessa efervescência o gás liberado é o:
a) oxigênio.
b) hidrogênio.
c) cloro.
d) dióxido de carbono.
e) monóxido de carbono.
Resposta: d)
9. (UFRN) O reconhecimento de uma reação química está relacionado à presença de evidências quê permitem diferenciá-la dos fenômenos físicos. A seguir, relacionam-se quatro processos.
I. A liberação de luz
II. A formação de um precipitado
III. A sublimação do iôdo
IV. A dissolução do sal de cuzinha em á gua
Dos processos relacionados, são evidências de reações químicas os processos apresentados nos itens:
a) I e IV.
b) II e III.
c) I e II.
d) II e IV.
Resposta: c)
Tema 16 – Aspectos quantitativos das reações químicas
10. (Enem/MEC) O cobre, muito utilizado em fios da rê-de elétrica e com considerável valor de mercado, póde sêr encontrado na natureza na forma de calcocita, Cu2S(s), de massa molar 159 g/mol. Por meio da reação Cu2S(s) + O2(g) → 2 Cu(s) + SO2(g), é possível obtê-lo na forma metálica. A quantidade de matéria de cobre metálico produzida a partir de uma tonelada de calcocita com 7,95% (m/m) de pureza é
a) 1,0 ⋅ 103 mol.
b) 5,0 ⋅ 102 mol.
c) 1,0 ⋅ 100 mol.
d) 5,0 ⋅ 10−1 mol.
e) 4,0 ⋅ 10−3 mol.
11. (Enem/MEC) Para proteger estruturas de aço da corrosão, a indústria utiliza uma técnica chamada galvanização. Um metal bastante utilizado nesse processo é o zinco, quê póde sêr obtído a partir de um minério denominado esfalerita (ZnS) de pureza 75%. Considere quê a conversão do minério em zinco metálico tem rendimento de 80% nesta sequência de equações químicas:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
ZnO + CO → Zn + CO2
Página duzentos e trinta e sete
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol); ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol) e Zn (65 g/mol). Que valor mais próximo de massa de zinco metálico, em kilogramas, será produzido a partir de 100 kg de esfalerita?
a) 25.
b) 33.
c) 40.
d) 50.
e) 54.
Resposta: c)
12. (Enem/MEC) No Japão, um movimento nacional para a promoção da luta contra o aquecimento global leva o slôgamm: 1 pessoa, 1 dia, 1 kg de CO2 a menos! A ideia é cada pessoa reduzir em 1 kg a quantidade de CO2 emitida todo dia, por meio de pequenos gestos ecológicos, como diminuir a queima de gás de cuzinha.
Um hambúrguer ecológico? É pra já! Disponível em: https://livro.pw/hktuf. Acesso em: 24 fev. 2012 (adaptado).
Considerando um processo de combustão completa de um gás de cuzinha compôzto exclusivamente por butano (C4H10), a mínima quantidade dêêsse gás quê um japonês deve deixar de queimar para atender à meta diária, apenas com esse gesto, é de:
Dados: CO2 (44 g/mol); C4H10 (58 g/mol)
a) 0,25 kg.
b) 0,33 kg.
c) 1,0 kg.
d) 1,3 kg.
e) 3,0 kg.
Resposta: b)
Tema 17 – Materiais homogêneos
13. (Enem/MEC) A obtenção de sistemas coloidais estáveis depende das interações entre as partículas dispersas e o meio onde se encontram. Em um sistema coloidal aquoso, cujas partículas são hidrofílicas, a adição de um solvente orgânico miscível em á gua, como etanol, desestabiliza o coloide, podendo ocorrer a agregação das partículas preliminarmente dispersas.
A desestabilização provocada pelo etanol ocorre porque:
a) a polaridade da á gua no sistema coloidal é reduzida.
b) as cargas superficiais das partículas coloidais são diminuídas.
c) as camadas de solvatação de á gua nas partículas são diminuídas.
d) o processo de miscibilidade da á gua e do solvente libera calor para o meio.
e) a intensidade dos movimentos brownianos das partículas coloidais é reduzida.
Resposta: c)
Tema 18 – Concentração das soluções e propriedades coligativas
14. (Enem/MEC) A cafeína é um alcaloide, identificado como 1,3,7-trimetilxantina (massa molar igual a 194 g/mol), cuja estrutura química contém uma unidade de purina, conforme representado. Esse alcaloide é encontrado em grande quantidade nas sementes de café e nas fô-lhas de chá vêrde. Uma xícara de café contém, em média, 80 mg de cafeína.
MARIA, C. A. B.; MOREIRA, R. F. A. Cafeína: revisão sobre métodos e análise. Química Nova, n. 1, 2007 (adaptado).
Considerando quê a xícara descrita contém um volume de 200 mL de café, a concentração, em mol/L, de cafeína nessa xícara é mais próxima de:
a) 0,0004.
b) 0,002.
c) 0,4.
d) 2.
e) 4.
Resposta:b)
15. (Enem/MEC) A hidroponia póde sêr definida como uma técnica de produção de vegetais sem necessariamente a presença de solo. Uma das formas de implementação é manter as plantas com suas raízes suspensas em meio líquido, de onde retiram os nutrientes essenciais. Suponha quê um produtor de rúcula hidropônica precise ajustar a concentração de íon nitrato (NO− 3) para 0,009 mol/L em um tanque de 5.000 litros e, para tanto, tem em mãos uma solução comercial nutritiva de nitrato de cálcio 90 g/L.
As massas molares dos elemêntos N, O e Ca são iguais a 14 g/mol, 16 g/mol e 40 g/mol, respectivamente.
Qual o valor mais próximo do volume da solução nutritiva, em litros, quê o produtor deve adicionar ao tanque?
a) 26.
b) 41.
c) 45.
d) 51.
e) 82.
Resposta: b)
Página duzentos e trinta e oito
INTEGRANDO COM...
BIOLOGIA
Como os refrigerantes afetam a saúde?
Respostas e comentários estão disponíveis nas Orientações para o professor.
Pode-se classificar muitas bebidas como soluções aquosas, pois são compostas de um conjunto de substâncias dissolvidas em á gua, formando um material homogêneo, de uma fase. É o caso da maioria dos refrigerantes. Muitas vezes, o soluto em maior quantidade nessas bebidas é o açúcar, geralmente a sacarose (açúcar de mesa) ou xaropes com alto teor de frutose.

Do ponto de vista nutricional, os açúcares podem sêr classificados de acôr-do com sua complexidade. Quando não fazem parte da composição dos alimentos naturais, como grãos e vegetais, são considerados artificialmente adicionados. Por não fornecerem um valor nutricional significativo, o único objetivo dessas substâncias é conferir um sabor mais adocicado aos produtos industrializados.
Em grandes quantidades, os chamados “açúcares livres” são prejudiciais à saúde, pois aumentam o risco de problemas cardiovasculares, diabetes do tipo 2 e alguns tipos de câncer. Assim, a Organização Mundial da Saúde (hó ême ésse) recomenda quê a ingestão diária dessas substâncias não ultrapasse 10% do total de calorias da diéta, tanto de adultos quanto de crianças.
Outra substância presente em refrigerantes e outras bebidas gaseificadas é o dióxido de carbono dissolvido, quê póde sêr percebido pela formação de bolhas e pelo som característico ao abrir uma lata ou garrafa dessas bebidas. Uma pequena parte dêêsse gás reage com a á gua, formando ácido carbônico.
H2O((éli)") + CO2(g) ⇌ H2CO3(aq)
A maior parte, no entanto, mantém-se dissolvida, de modo quê a concentração de ácido carbônico não representa riscos à saúde.
Outro ácido presente em refrigerantes é o ácido fosfórico (H3 PO4), adicionado como conservante e para conferir um sabor levemente ácido à bebida, típico de sabores “cola”. Essa substância, quando se dissocia, forma íons fosfato ( ) e póde influenciar a absorção de íons de cálcio (Ca2+).
Leia o texto a seguir sobre esse assunto.
[…]
Os fosfatos estão disponíveis em praticamente todos os alimentos […]. Já quantidades proporcionais de Ca [cálcio] não são consumidas se não houver um esfôrço consciente no sentido de selecionar pôr-ções suficientes de alguns alimentos ricos no elemento. […] O Ca também influi na absorção de fosfato, estimando-se quê a absorção de ambos os elemêntos chega a sêr ótima quando a relação Ca/P [fósforo] é igual a 1 […].
Proporções semelhantes de íons Ca e fosfato são também necessárias para quê ocorra uma adequada mineralização dos óssos. Tanto a ingestão excessiva de P como o baixo consumo de Ca podem alterar a proporção Ca/P […] e, se êste padrão de consumo for crônico, segue-se a perda óssea […].
[…]
BUZINARO, Elizabéti Fernandes; ALMEIDA, Renata Noêmia Alves de; MAZETO, Gláucia Maria Ferreira da Silva. Biodisponibilidade do cálcio dietético. Arquivos Brasileiros de Endocrinologia & Metabologia, São Paulo, v. 50, n. 5, p. 852-861, out. 2006. p. 857. Disponível em: https://livro.pw/cwkbu. Acesso em: 21 set. 2024.
Página duzentos e trinta e nove
Os ingredientes e suas respectivas quantidades devem sêr informados nos rótulos das bebidas industrializadas, de acôr-do com a legislação específica para o tipo de bebida.
A seguir, estão as informações nutricionais de dois refrigerantes, um classificado como sabor original e outro, como zero açúcar.
Sabor original
Ingredientes: á gua, açúcar, dióxido de carbono, corante: caramelo E-150d, acidulante: ácido fosfórico e aromas naturais (incluindo cafeína).
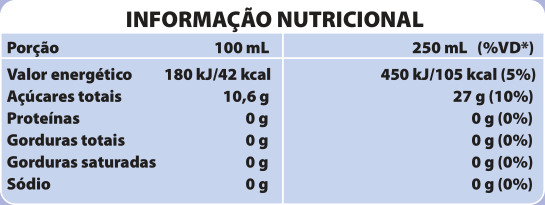
Zero açúcar
Ingredientes: á gua, dióxido de carbono, corante: caramelo E-150d, edulcorantes: ciclamato de sódio, acessulfame K e aspartame, acidulante: ácido fosfórico, aromas naturais (incluindo cafeína) e regulador de acidez: citrato de sódio. Contém fenilalanina.
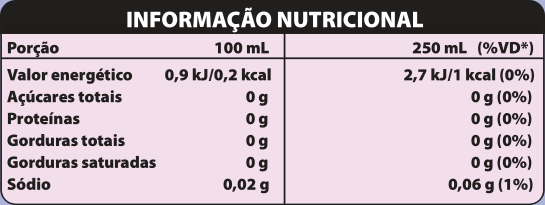
Agora, faça o quê se pede em cada item.
1. Alguns estudos sugérem quê a ingestão excessiva de refrigerantes póde estar associada a problemas nos dentes e nos óssos. Com base nas informações fornecidas, formule uma explicação e relacione a composição dessas bebidas e o enfraquecimento dêêsses tecídos.
2. Ao colocar um ovo em um recipiente contendo vinagre, nota-se a formação de bolhas na superfícíe da casca em contato direto com a solução. A casca do ovo é composta basicamente de carbonato de cálcio (CaCO3), e o vinagre contém ácido acético (CH3COOH). Esse ácido, quando ionizado, forma íons acetato (CH3COO−). Após determinado tempo em contato, o vinagre provoca o enfraquecimento da casca do ovo.

A reação entre o ácido acético e o carbonato de cálcio póde sêr representada da seguinte maneira:
CaCO3(s) + 2CH3COOH(aq) ⇌ Ca(CH3COO)2(aq) + H2CO3(aq)
Reflita sobre essa situação e responda às kestões.
a) Como você explicaria a formação de bolhas formadas na superfícíe do ovo?
b) Quais são as similaridades entre essa situação e a situação envolvendo o consumo de refrigerantes com alto teor de ácido fosfórico?
3. Estruture um texto informativo no formato de uma postagem em uma rê-de social, utilizando esquemas e ilustrações, para informar as pessoas de seu convívio sobre os riscos da ingestão de refrigerantes em excésso.
4. Analisando os rótulos dos refrigerantes nas versões original e zero açúcar, qual substância apresenta maior concentração em cada um deles? Se uma pessoa consumir 4 copos de 250 mL cada da versão original, estará ingerindo qual porcentagem de açúcar?
5. Pensando na redução de açúcares totais, o refrigerante na versão zero açúcar oferece riscos à saúde quando se analisa sua composição?
Página duzentos e quarenta