UNIDADE
4
MOLÉCULAS EM MOVIMENTO
A ocorrência das reações químicas, a rapidez com quê elas acontecem e como elas podem chegar a um estado de equilíbrio dinâmico dependem de diversos fatores, como da energia e da relação entre energia e movimentação de moléculas (e outras espécies). Entender esses fatores contribui para uma melhor compreensão de como os fenômenos químicos ocorrem, tanto no cotidiano quanto em contextos mais compléksos. Na imagem, reação de combustão da sacarose.
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Em seu entendimento, qual é o papel da energia na ocorrência das transformações físicas e químicas?
2. O quê póde significar a afirmação chegar a um estado de equilíbrio dinâmico?

Página duzentos e quarenta e um
Página duzentos e quarenta e dois
TEMA
19
Química e energia
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Nos últimos séculos, o avanço da Ciência permitiu o surgimento de diversas áreas de estudo quê buscam compreender fenômenos diversos. Entre essas áreas, muitas se dedicam à investigação de materiais e suas transformações, desde fenômenos cotidianos até processos industriais compléksos. Um dêêsses campos é a Termodinâmica, quê se concentra no estudo da energia e de suas transformações. Ela permite a compreensão de como a energia é transferida, armazenada e utilizada em diferentes sistemas, sêjam eles físicos ou químicos. A Termodinâmica abrange uma vasta gama de aplicações, desde o funcionamento de motores a combustão até o comportamento de sistemas biológicos.
Nesse contexto, surge a Termoquímica, um subcampo quê se dedica a investigar as variações de energia quê acompanham as transformações químicas. A Termoquímica tem como objeto de estudo o calor liberado ou absorvido pelas reações químicas, ajudando a entender como a energia está envolvida na quebra e na formação de ligações entre hátomus e moléculas. Com o conhecimento gerado por esse subcampo, é possível aperfeiçoar processos industriais, a produção de combustíveis e a fabricação de materiais. Pode-se também, com suas ferramentas conceituais, abordar fenômenos naturais, como a respiração celular e a fotossíntese. Em outras palavras, a Termoquímica possibilita a compreensão dos processos energéticos quê regem tanto as inovações tecnológicas quanto o mundo natural.
Assim, ao estudar esse subcampo, é possível se tornar ápto para enfrentar desafios contemporâneos, como a busca por fontes de energia rêno-váveis.

Página duzentos e quarenta e três
Introdução à Termoquímica
Para dar início aos estudos de Termoquímica, é preciso conhecer alguns conceitos e nomenclaturas.
O primeiro conceito a sêr abordado é a tempera-túra (T). Trata-se de um parâmetro relacionado à energia cinética média, ou seja, ao grau de agitação e de movimento de um conjunto de partículas (átomos, moléculas,íons etc.). Quanto maior for a tempera-túra, maior será o movimento das partículas e, consequentemente, maior será a energia cinética delas.
Já o calor (Q) póde sêr entendido como a energia térmica em movimento. Ele é transferido espontaneamente de um corpo com maior tempera-túra para outro com menor tempera-túra até quê as tempera-túras se igualem. É por isso quê, por exemplo, uma xícara de chocolate kemte esfria ou um cubo de gêlo derrete quando são deixados em repouso à tempera-túra ambiente. No primeiro caso, o calor é transferido do líquido para o ambiente (a tempera-túra do líquido é maior do quê a ambiente); no segundo, a transferência de calor ocorre do ambiente para o cubo de gêlo (a tempera-túra ambiente é maior do quê a do cubo de gelo). Acompanhe uma representação de processo de transferência espontânea de calor.
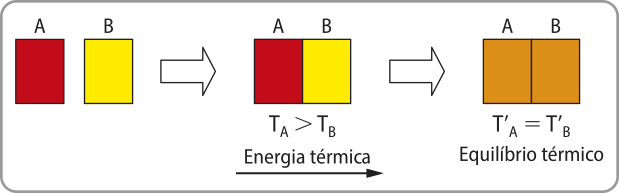
Os corpos A e B estão inicialmente a tempera-túras diferentes, sêndo a tempera-túra de A maior do quê a de B. Se eles forem colocados em contato, a energia térmica é transferida de A para B até quê, após cérto tempo, suas tempera-túras se igualam. Nesse contexto, um equilíbrio térmico é atingido.
REFLITA
1 por quê sentimos frio?
SOBRE
Nesse contexto, o termo corpo se refere a qualquer porção de matéria quê possa sêr individualizada e considerada um objeto de estudo. Um corpo póde sêr um objeto macroscópico, como um carro ou uma pedra, ou uma partícula microscópica, dependendo do contexto da análise. Em geral, a expressão é usada para descrever um sistema quê tem massa, ocupa espaço e póde sêr sujeito a forças, movendo-se ou interagindo com outros corpos de acôr-do com as leis da Física.
AlGO A+
Como funcionam agasalhos e cobertores?
É de conhecimento popular quê agasalhos e cobertores têm a função de esquentar. Entretanto, não é exatamente isso o quê acontece. Eles não transferem calor para o corpo das pessoas, como uma fogueira ou um aquecedor elétrico. Agasalhos e cobertores impedem quê o corpo transfira calor para o ambiente, considerando quê a tempera-túra do corpo é maior do quê a ambiente em estações frias.
A capacidade de impedir a transferência de calor acontece porque agasalhos e cobertores são feitos de materiais, chamados de isolantes térmicos, quê dificultam as trocas de calor com o ambiente. A garrafa térmica, por exemplo, também é produzida com materiais quê impedem a transferência de calor do líquido para o ambiente. Por causa do material isolante, a tempera-túra dos líquidos no interior da garrafa póde se manter relativamente estável por longos períodos.

Página duzentos e quarenta e quatro
A unidade de medida para energia, adotada pelo Sistema Internacional de Unidades, é o Jáule (J). Entretanto, em muitas situações, a energia também é representada por uma unidade de medida chamada caloria (cal). Uma caloria equivale a aproximadamente 4,18 J e é definida como a energia necessária para elevar a tempera-túra de 1 g de á gua de 14,5°C para 15,5°C à pressão atmosférica de 1 atm.
Em pesquisas científicas, ao descrever determinado fenômeno ou objeto de estudo, é fundamental sêr sistemático e objetivo. É importante deixar claras as condições em quê as observações foram feitas.
Considere um estudo a respeito das trocas de calor em um copo com café kemte. A região do universo quê será estudada (no caso, o copo e seu conteúdo) chama-se sistema, e a região quê está ao redor do sistema é chamada vizinhança. Além díssu, o sistema é separádo da vizinhança por uma fronteira, quê é o limite entre essas regiões.
Os sistemas, de acôr-do com as interações com a vizinhança, podem sêr de três tipos: aberto, fechado ou isolado.
Vale mencionar quê essas definições são relativas.
Um sistema póde passar a englobar parte da vizinhança e se tornar outro sistema sôbi estudo.
Em um sistema aberto, é possível havêer troca de matéria e de energia com a vizinhança. Por exemplo, um copo de café kemte, destampado, libera calor e vapor de á gua para a vizinhança.

Um sistema fechado permite apenas a troca de energia, mas não de matéria, com a vizinhança. O copo de café com tampa, idealmente (já quê essas tampas apresentam frestas), corresponderia a um sistema fechado. Nesse caso, não há liberação de vapor de á gua para o ambiente, mas há troca de calor com a vizinhança.

Já um sistema isolado não permite a troca de matéria nem de calor com a vizinhança. Pode-se considerar, por exemplo, também idealmente, uma garrafa térmica tampada como um sistema isolado. As paredes dêêsse objeto são duplas, intercaladas por um espaço vazio (vácuo), o quê dificulta bastante as trocas de calor entre o líquido em seu interior e a vizinhança.

Página duzentos e quarenta e cinco
Representação de transformações exotérmicas e endotérmicas
REFLITA
2 Que processos você conhece quê cedem energia ao ambiente? E os quê recebem energia do ambiente?
Para o preparo de sorvete ou picolé, além dos ingredientes necessários para obtêr o sabor desejado, é fundamental utilizar uma máquina quê retire o calor da mistura dos ingredientes, diminuindo sua tempera-túra e permitindo quê o sorvete atinja uma textura cremosa.

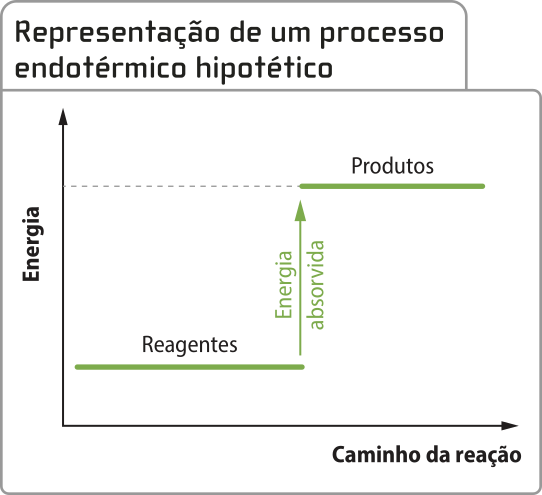
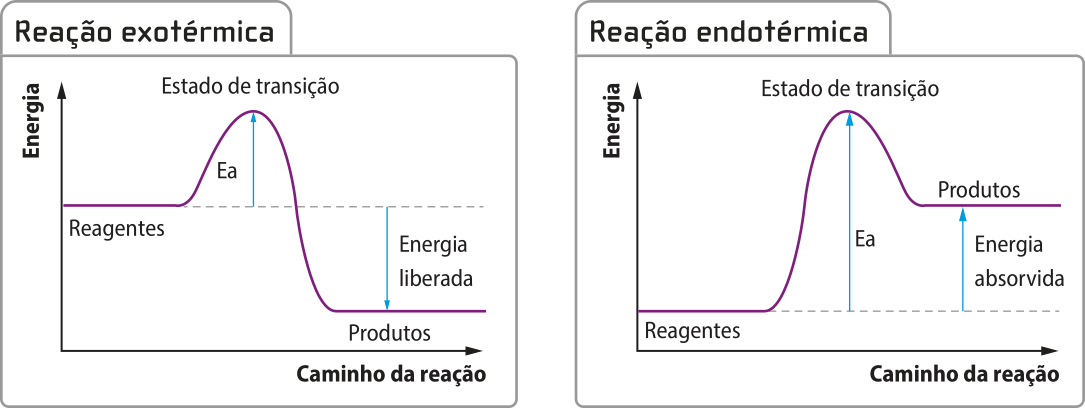
Dessa maneira, pode-se dizêr quê a transformação quê acontece no sistema, a mudança para um material mais cremoso e menos líquido, é exotérmica (exo- vêm do grego ékso, quê significa “para fora”). Assim, um processo exotérmico é aquele em quê o sistema libera calor para a vizinhança. Considerando o sorvete um sistema quê passa por uma transformação física, pode-se afirmar quê a solidificação é um processo quê envolve a liberação de calor.
Há muitas transformações químicas quê são exotérmicas. Como exemplo, é possível citar a quêima de gás metano, combustível usado para a geração de energia em algumas propriedades rurais. Em reações exotérmicas, a energia final do sistema (energia dos produtos) é menor do que a energia inicial (energia dos reagentes).

O processo exotérmico póde sêr representado por um gráfico de energia em função do caminho da reação na qual o patamar energético dos reagentes é mais alto do quê o dos produtos.
Fonte: Dados fictícios.
Página duzentos e quarenta e seis
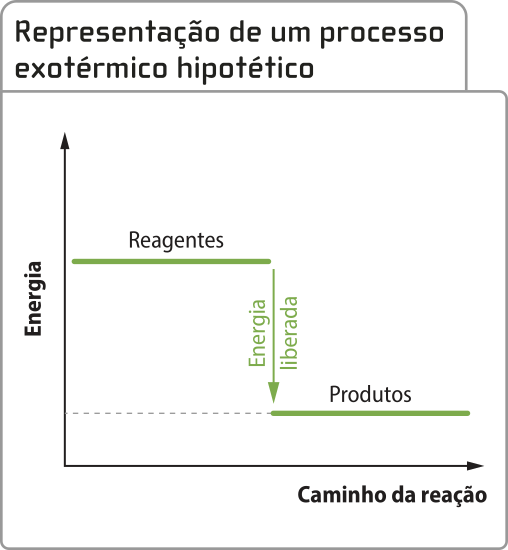
Já o derretimento das geleiras em razão do fenômeno do aquecimento global é um exemplo de processo em quê a vizinhança (o ambiente) transfére calor para o sistema (as geleiras).
Pode-se dizêr quê a transformação quê acontece nesse sistema é endotérmica (endo- vêm do grego éndon, quê significa “para dentro”). Assim, um processo endotérmico é aquele em quê o sistema recebe calor da vizinhança.
ESPAÇOS DE APRENDIZAGEM
• A reportagem comenta a gravidade da situação da geleira Thwaites, quê está derretendo mais rápido do quê se imaginava.
DERRETIMENTO da ‘geleira do juízo final’ é mais alarmante do quê se pensava. UOL, [s. l.], 23 maio 2024. Disponível em: https://livro.pw/tiyqs. Acesso em: 1 out. 2024.

Há transformações químicas quê são endotérmicas. Muitos alimentos são assados, fritos ou cozidos para quê a textura e o sabor originais sêjam transformados. Todas essas formas de preparo apresentam uma semelhança: a vizinhança (alguma fonte de calor) fornece calor para o sistema (o alimento). Em reações endotérmicas, a energia final do sistema (energia dos produtos) é maior do quê a energia inicial (energia dos reagentes).

O processo endotérmico também póde sêr representado por um gráfico de energia em função do caminho da reação na qual o patamar energético dos reagentes é mais baixo do quê o dos produtos.
Página duzentos e quarenta e sete
OFICINA CIENTÍFICA
Reações químicas podem sêr utilizadas para produzir calor?
Neste experimento, será analisado o enferrujamento acelerado de um chumaço de palha de aço em contato com vinagre, quê age como um facilitador e remove a camada protetora da superfícíe da palha de aço. O objetivo do experimento é demonstrar quê a oxidação do ferro envolve a liberação de energia na forma de calor, bem como explorar as evidências da ocorrência de reação química.

Materiais
• Palha de aço.
• uma colher de sopa.
• 1 copo de plástico transparente e resistente.
• 1 tampa de plástico ou filme estirável de pê vê cê para vedar o copo.
• Vinagre.
• Termômetro digital.
Na ausência de um termômetro, é possível sentir o aumento de tempera-túra tokãndo na parte externa do copo. Apesar de não havêer riscos de queimaduras, orientar os estudantes nesse procedimento.
Procedimentos
• Abra a palha de aço para aumentar sua área de contato.
• Coloque-a dentro do copo.
• méça a tempera-túra do sistema com um termômetro.
• Coloque uma côlher de sopa de vinagre dentro do copo.
• Cubra o copo com a tampa ou o filme de pê vê cê (certifique-se de quê está muito bem vedado).
• Agite o copo para espalhar o vinagre por toda a palha de aço.
• Retire a tampa ou o filme de pê vê cê e meça novamente a tempera-túra do sistema.
Não ingira ou inale soluções utilizadas em atividades práticas. êste experimento não representa grande perigo nem gera resíduos perigosos, mas é importante usar óculos e luvas de proteção. Consulte o professor a respeito do descarte adequado dos materiais utilizados.
ATIVIDADES
1. O quê ocorreu com a tempera-túra do sistema?
2. O quê aconteceu com a palha de aço e com o vinagre?
3. De onde veio a energia térmica?
Calorimetria
Conhecer a quantidade de calor envolvida em determinado processo químico póde sêr muito vantajoso. Para a construção de motores a combustão, por exemplo, como os dos carros, é necessário saber quanto calor será produzido, não só para desenvolver um sistema quê permita um melhor aproveitamento do calor gerado como também para promover um resfriamento adequado.
REFLITA
3 por quê é importante conhecer o valor energético dos alimentos? Como essa informação póde sêr útil no dia a dia?
Página duzentos e quarenta e oito
póde sêr interessante introduzir um pouco de contexto histórico, comentando com os estudantes quê Lavoisiê e Laplace inventaram o calorímetro de gêlo em 1784. Para saber mais, recomenda-se a leitura do artigo “Calorímetro de gêlo: uma abordagem histórica e experimental para o ensino de química na graduação”, disponível em: https://livro.pw/gfbhp (acesso em: 1 out. 2024).
O calor póde sêr medido com a utilização de calorímetros, por meio de um conjunto de técnicas e métodos chamado calorimetria. Um dos tipos mais comuns de calorímetro, conhecido como calorímetro de bomba (ou calorímetro de volume constante), é compôzto de uma câmara de combustão, onde o material a sêr analisado, geralmente um alimento ou um combustível, é queimado. A câmara fica imérsa em á gua, e termômetros médem a variação de tempera-túra da á gua. Como esse é um sistema isolado, todo o calor proveniente da combustão do objeto em estudo é absorvido pela á gua.
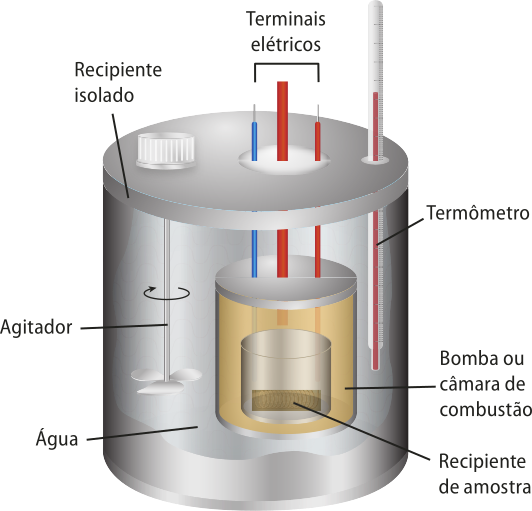
Elaborado com base em: étkins, P.; diônes, L. Princípios de Química: questionando a vida moderna. 3. ed. Porto Alegre: búkmã, 2007. p. 316.
Uma das aplicações do calorímetro é a determinação aproximada da quantidade de calorias, também chamada de valor energético, quê os alimentos fornecem quando são digeridos. A quantidade de calor (Q) póde sêr calculada por meio da multiplicação entre a variação de tempera-túra da á gua ((delta)"T), a massa de á gua utilizada no calorímetro (m) e a capacidade térmica específica (c) da á gua, também chamada de calor específico.
A capacidade térmica específica, ou o calor específico, corresponde à quantidade de energia necessária para elevar em 1°C a tempera-túra de 1 g de uma substância. No caso dêêsse calorímetro, é usada a á gua como referência, independentemente do alimento quê está sêndo queimado na câmara de combustão.
O sinal da quantidade de calor está atrelado ao tipo de processo quê ocorre. Se for um processo quê envolve absorção de calor, endotérmico, Q é positivo; se for um processo quê envolve liberação de calor, exotérmico, Q é negativo.
Q = m ⋅ c ⋅ (delta)"T
Imagine quê você deseja saber quão calórica é uma barra de chocolate. Para isso, basta utilizar o calorímetro com uma quantidade conhecida dêêsse chocolate e monitorar a variação de tempera-túra da á gua, cuja quantidade também deve sêr conhecida.
Suponha quê a quantidade de chocolate utilizada tenha sido 1 g, o calorímetro tenha 1.000 g de á gua e a variação de tempera-túra tenha sido de 5°C. Sabendo quê a capacidade térmica específica da á gua é 1 cal/g ⋅ °C, pode-se calcular a quantidade de calorias em 1 g do chocolate.
Q = 1.000 g ⋅ 1 cal/g°C ⋅ 5 ⋅ °C
Q = 5.000 cal
É importante ter em mente quê o processo de digestão é mais complékso do quê o simulado em um calorímetro, o quê significa quê o valor obtído não é exatamente igual ao quê o alimento libera durante a digestão. Entretanto, a simulação é precisa o suficiente para auxiliar no entendimento do valor energético e da composição dos alimentos.
Página duzentos e quarenta e nove
AlGO A+
A verdade sobre as calorias
[...] Usando um aparelho chamado calorímetro respiratório, quê méde a inspiração de oxigênio e a expiração de CO2, é possível calcular quanta energia o organismo está consumindo em um determinado momento. Fazendo essa medição, várias pesquisas constataram quê, depois quê comemos, nosso gasto calórico aumenta – porque a digestão dos alimentos consome uma parte da energia contida neles. A proteína é o nutriente quê mais requer energia para sêr digerido – de 20% a 35% das calorias contidas no alimento são gastas no próprio processo de digestão e processamento dele. Isso significa quê, se você comer 100 kcal de proteína, o seu corpo só vai ficar com 65 a 80 kcal “líquidas”, para sustentar o organismo. Já as gorduras e os carboidratos dão bem menos trabalho para serem metabolizados: sua digestão exige apenas 5% a 15% do total de energia. O gasto exato varia de pessoa para pessoa. [...]
Agora fica fácil entender por quê cértas comidas com menos calorias pódem provocar mais aumento de peso. Um pão integral com muita fibra e grãos inteiros, por exemplo, pode até ter mais calorias quê um pão branco. Mas é bem mais difícil de digerir. Como resultado, você gasta mais energia para absorvê-lo, durante mais horas, e obtém menos calorias no final. Já o pão branco é tão fácil de digerir quê se transforma em açúcar rapidamente. E o seu organismo transforma esse excésso de açúcar em gordura corporal.
[...]
SZKLARZ, Eduardo; GARATTONI, Bruno. A verdade sobre as calorias. Superinteressante, [s. l.], 15 jan. 2020. Disponível em: https://livro.pw/desyz. Acesso em: 12 out. 2024.
Interpretando a capacidade térmica específica
A capacidade térmica específica póde sêr expressa em Jáule ou caloria. Essa propriedade é fundamental para entender como diferentes materiais respondem a uma fonte de calor.
Analise, na sequência, valores de capacidade térmica específica de alguns materiais.
Capacidade térmica específica de alguns materiais
Material |
Capacidade térmica específica |
|---|---|
Água (líquida) |
4,20 J/g ⋅ °C |
Água (gêlo) |
2,10 J/g ⋅ °C |
Etanol |
2,40 J/g ⋅ °C |
Granito |
0,80 J/g ⋅ °C |
Cobre |
0,39 J/g ⋅ °C |
Vidro |
0,67 J/g ⋅ °C |
Areia |
0,84 J/g ⋅ °C |
Fonte: De CHINESE IULNIVÃRCITI ÓF HONG KONG. Specific heat capacity. rôn kôn: Department ÓF Physics, [c2023]. Disponível em: https://livro.pw/vookn. Acesso em: 1 out. 2024.
Pode-se tomar como exemplo o quê acontece com uma cadeira metálica em um dia de sól na praia ou na piscina. Se você se sentar em uma cadeira quê ficou exposta ao sól por algumas horas, vai perceber quê ela está bem kemte. Isso acontece porque os metais têm capacidades térmicas específicas baixas, ou seja, é necessária pouca energia para quê a tempera-túra dêêsses metais aumente.
Página duzentos e cinquenta
O cobre, por exemplo, quê é um metal, tem uma capacidade térmica específica de apenas 0,39 J/g ⋅ °C, o quê significa quê ele aquece rapidamente quando comparado a outros materiais.
Já um balde com á gua, com massa total semelhante à da cadeira, e quê também tenha ficado exposto ao sól no mesmo intervalo de tempo, não aquece tão intensamente. Esse fenômeno ocorre porque a capacidade térmica específica da á gua é muito mais alta do quê a dos metais. A á gua líquida possui uma das maiores capacidades térmicas específicas entre os materiais comuns, em torno de 4,20 J/g ⋅ °C. Isso significa quê, em um mesmo intervalo de tempo, a á gua precisa receber muito mais energia para quê sua tempera-túra tenha uma variação semelhante à variação de tempera-túra do metal da cadeira. Enquanto o metal eskenta rapidamente, a á gua permanéce relativamente fresca, agindo como um regulador térmico, o quê é um dos motivos pêlos quais a á gua é usada para resfriamento em vários processos industriais.
A comparação entre a capacidade térmica específica de diferentes materiais permite entender melhor como eles respondem ao calor. Por exemplo, o granito, uma rocha comum, tem uma capacidade térmica específica de 0,80 J/g ⋅ °C, o quê significa quê eskenta mais lentamente quê o cobre, mas mais rapidamente quê a á gua. Materiais como o vidro (0,67 J/g ⋅ °C) e a areia (0,84 J/g ⋅ °C) também se aquécem relativamente rápido, o quê justifica a areia da praia ficar kemte sôbi o sól.
Essa propriedade é essencial em várias áreas, como Engenharia e Ciência dos materiais, em quê o entendimento dessas diferenças póde melhorar a eficiência de processos térmicos e o uso adequado de materiais.

ATIVIDADES
1. Pense sobre o termo Termodinâmica. O quê você acha quê ele significa?
2. Considerando uma tempera-túra ambiente de 25°C, indique se os corpos em cada item a seguir absorvem ou libéram calor.
a) Uma xícara de chocolate kemte deixado sobre uma mesa.
b) Um cubo de gêlo sobre a pia.
c) Uma embalagem de leite recém-colocada dentro da geladeira.
d) Uma embalagem de leite quê permaneceu fechada durante a noite em quê ficou na geladeira.
3. Você considera a expressão “feche a janela para não deixar o frio entrar” cientificamente correta?
4. As panelas de pressão convencionais têm uma válvula de escape quê é acionada de acôr-do com a pressão interna da panela, a fim de reduzir essa pressão por meio da liberação de vapor de á gua.
a) Como esse sistema póde sêr classificado antes e depois do acionamento da válvula?
b) O quê aconteceria se a panela de pressão não possuísse uma válvula de escape para o vapor de á gua?
5. Cite três sistemas de cada tipo (aberto, fechado e isolado) quê você conhece.
6. dêz-creva como devem sêr as representações gráficas de uma reação exotérmica e de uma reação endotérmica.
7. Explique, com suas palavras, o significado do conceito de capacidade térmica específica. Inclua na sua explicação exemplos de como ele póde sêr usado para explicar fenômenos observados no dia a dia.
Página duzentos e cinquenta e um
TEMA
20
Entalpia e lei de Hess
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor
A entalpia e a lei de Hess são ferramentas conceituais importantes, principalmente na otimização de processos químicos em indústrias, como a petroquímica e a farmacêutica. Conhecer a entalpia de uma reação possibilita controlar o calor envolvido nela, o quê é essencial para atingir uma eficiência energética. Já o uso da lei de Hess simplifica o cálculo da energia total envolvida em reações compléksas, facilitando a escolha de caminhos mais eficientes para a realização dessas reações. Esses conceitos ajudam a reduzir custos e a aumentar a eficiência de processos industriais, impulsionando avanços tecnológicos em diversas áreas.
Entalpia
A entalpia (H) está relacionada à energia interna de um sistema e a outras propriedades, como pressão e volume. Por causa dessa relação, a entalpia é expressa, no Sistema Internacional de Unidades, em Jáule (J).
O entendimento completo dessa relação exige conhecimentos mais avançados do quê os normalmente abordados nesta etapa da Educação Básica. Portanto, para simplificar, considera-se a entalpia como uma ferramenta matemática quê fornece informações importantes sobre as transformações.
A entalpia é numericamente igual ao calor envolvido em uma transformação à pressão constante. Ou seja, ao calcular a variação de entalpia ((delta)"H), obtém-se a quantidade de calor quê foi absorvido ou liberado durante uma transformação. Para o cálculo da variação de entalpia de uma transformação, considera-se a diferença entre a entalpia final dos produtos e a entalpia inicial dos reagentes, já quê ela é uma função de estado, isto é, uma grandeza quê descreve o estado do sistema independentemente de como ele é alcançado.
REFLITA
1 Qual é a importânssia de calcular a energia de um processo?
SOBRE
Por energia interna do sistema, entende-se a soma da energia cinética, relacionada ao movimento das partículas, e da energia potencial elétrica, quê se origina das interações entre os hátomus das substâncias

Página duzentos e cinquenta e dois
A equação a seguir é uma ferramenta matemática útil porque a maioria das reações químicas acontece à pressão constante (por exemplo, à pressão atmosférica) ou se desen vólve em sistemas industriais controlados.
(delta)"H = Hprodutos − Hreagentes
No entanto, é preciso reforçar quê calor e entalpia não são sinônimos, uma vez quê calor é um conceito relacionado à energia térmica, enquanto entalpia funciona como um recurso matemático para avaliar as trocas de calor em um sistema. A razão para não calcular o calor diretamente em certos casos é quê essa tarefa póde sêr bastante complicada. Por isso, é mais eficiente determinar a entalpia utilizando variáveis, como pressão e volume, os quais varíam durante as transformações.
FORMAÇÃO CIDADÃ
A entalpia e a produção de alimentos
A produção de alimentos no Brasil envolve inúmeras variáveis quê impactam diretamente cada tipo de cultura. Uma dessas variáveis é o clima, quê apresenta variações extremas no Brasil. Em algumas regiões, as tempera-túras são muito baixas e, em outras, as tempera-túras são extremamente elevadas.
Essa variabilidade se torna um desafio para os grandes produtores, quê têm recursos e incentivos governamentais, e também para os pequenos produtores, como aqueles quê adotam o sistema de agricultura familiar.

Além de conhecimentos sobre as substâncias químicas quê podem sêr utilizadas para enriquecer o solo de nutrientes e auxiliar no crescimento das plantas, pesquisas estão sêndo desenvolvidas com base em outros conceitos químicos, como a entalpia.
A seguir, leia um texto sobre o assunto.
Página duzentos e cinquenta e três
[...] A entalpia é uma ferramenta termodinâmica usada para calcular o calor envolvido em processos quê ocorrem em pressão constante, sêndo uma ferramenta sugerida para manter as hortaliças em conforto térmico suficiente em termos de troca de calor. [...]
“A estratégia é baseada em medidas físicas do meio ambiente e podem ajudar a decidir como manter as hortaliças com conforto suficiente em termos de troca de calor. Estamos utilizando várias alturas diferentes, e no final da produção conseguimos encontrar qual será a mais adequada para a produção da hortaliça, principalmente no período de muito calor. A ideia é encontrar qual a melhor condição de usar a tela de sombreamento em hortas, em relação à altura, através das variáveis da termodinâmica”, explicou o professor [Gutierrez Rodrigues de Morais].
[...]
O ambiente protegido possibilita a criação de um microclima favorável ao cultivo de hortaliças, proporcionando um cérto contrôle das variáveis climáticas, como tempera-túra, umidade, radiação solar e vento. O experimento, quê será finalizado êste mês, conta com a parceria de pequenos produtores da agricultura familiar. Os resultados esperados são de encontrar a melhor condição térmica para o plantio de hortaliças na região Tocantina, auxiliando os pequenos produtores. O projeto passou por diversas fases, iniciando com o estudo da Termodinâmica clássica, estudo da Entalpia, preparação das hortas para o plantio das hortaliças, monitoramento da umidade relativa e tempera-túra nas hortas, e encontra-se em sua fase final, quê é a análise e discussão dos dados obtidos.
MARCONCCINE, Mari. Campus estrêito desen vólve projeto no plantio de hortaliças, utilizando a entalpia. [S. l.]: Uemasul, 30 ago. 2023. Disponível em: https://livro.pw/wjdir. Acesso em: 3 out. 2024.
ATIVIDADES
1. dêz-creva o clima de sua região.
2. Quais são as plantações mais comuns nas proximidades da sua residência e da sua escola?
3. Com base no texto, explique o quê é o microclima.
4. Como a entalpia póde sêr usada para criar um ambiente de conforto térmico para as plantas?
Entalpia de formação
Na impossibilidade prática de medir a entalpia de todas as reações químicas possíveis de acontecer, cientistas idealizaram um procedimento teórico para o cálculo das variações de entalpia de qualquer reação por meio das entalpias-padrão de formação ((delta)") das substâncias. Elas são definidas como as variações de entalpia de uma reação química para a formação de 1 mol dessas substâncias a partir de substâncias simples no estado-padrão.
O valor de entalpia-padrão para toda substância simples em seu estado mais estável é igual a zero, e para toda substância composta ou fora do estado mais estável é diferente de zero.
Por exemplo, as entalpias-padrão de formação do gás hidrogênio (H2) e do gás oxigênio (O2), substâncias simples, ou da grafita (C), substância no estado mais estável, são iguais a zero; já a á gua (H2O), substância composta, e o diamante (C), quê não é a fase mais estável do carbono, têm entalpias-padrão de formação diferentes de zero.
SOBRE
No contexto de entalpia, o termo padrão remete a condições específicas, determinadas por convenção, de pressão e tempera-túra, respectivamente, 1 atm e 25°C.
Página duzentos e cinquenta e quatro
A entalpia-padrão de formação de uma substância composta póde sêr determinada por meio de uma reação em quê os reagentes são substâncias simples. Como muitos cálculos e determinações já foram realizados êsperimentalmente para diversas substâncias, pode-se utilizar valores preestabelecidos disponíveis em livros e manuais.

Entalpias-padrão de formação de algumas substâncias a 298 K
Substância |
Fórmula |
(delta)" |
|---|---|---|
Acetileno |
C2H2(g) |
+226,7 kJ/mol |
Água |
H2O((éli)") |
−285,8 kJ/mol |
Amônia |
NH3(g) |
−46,19 kJ/mol |
Benzeno |
C6H6((éli)") |
+49,0 kJ/mol |
Cloreto de hidrogênio |
HC(éli)"(g) |
−92,30 kJ/mol |
Dióxido de carbono |
CO2(g) |
−393,5 kJ/mol |
Etanol |
C2H5OH((éli)") |
−277,7 kJ/mol |
Fluoreto de hidrogênio |
HF(g) |
–268,6 kJ/mol |
Glicose |
C6H12O6(s) |
−1.273 kJ/mol |
Metano |
CH4(g) |
−74,8 kJ/mol |
Monóxido de carbono |
CO(g) |
−110,5 kJ/mol |
Fonte: BROWN, teodór Láurence éti áu. Química: a ciência central. 13. ed. São Paulo: pírsom, 2016. p. 196.
Utilizando (delta)" das substâncias participantes de uma transformação, é possível calcular a variação de entalpia-padrão de uma reação por meio da seguinte equação:
(delta)"H° = ∑(delta)" (produtos) − ∑(delta)" (reagentes)
Na equação, o sín-bolo ∑ significa somatória. Assim, para determinar a variação de entalpia-padrão de uma reação qualquer, devem sêr somadas todas as entalpias-padrão de formação das substâncias produtos, e subtraída dêêsse resultado a soma de todas as entalpias-padrão de formação das substâncias reagentes.
Entalpia de ligação
É possível verificar a variação de entalpia de uma reação química por meio do cálculo das energias envolvidas no rompimento e na formação de ligações químicas.
Para quê ligações químicas se rompam, é preciso havêer absorção de energia. Já a formação de ligações químicas resulta em liberação de energia.
(delta)"HL = Hligações rompidas − Hligações formadas = HL(reagentes) − HL(produtos)
Página duzentos e cinquenta e cinco
Sendo assim, a entalpia de ligação é a energia necessária para romper 1 mol de ligações químicas covalentes, presentes em espécies gasosas a 25°C e 1 atm, obtendo-se hátomus isolados na forma gasosa. A entalpia de ligação é calculada no estado gasoso porque, caso fosse calculada no estado sólido ou líquido, seria necessário considerar a energia envolvida nas interações intermoleculares.
SOBRE
Entalpia de ligação e energia de ligação não têm o mesmo significado. Porém, neste livro, para simplificar, esses termos serão utilizados como sinônimos.
Assim como os valores de entalpia-padrão, os valores de entalpia de ligação foram determinados êsperimentalmente. Alguns deles podem sêr analisados a seguir.
Entalpias médias de algumas ligações
Ligação |
Entalpia média de ligação |
Ligação |
Entalpia média de ligação |
|---|---|---|---|
C – H |
413 kJ/mol |
C – I |
240 kJ/mol |
C – C |
348 kJ/mol |
N – H |
391 kJ/mol |
C ═ C |
614 kJ/mol |
N – N |
163 kJ/mol |
C ≡ C |
839 kJ/mol |
N – O |
201 kJ/mol |
C – O |
358 kJ/mol |
N ═ O |
607 kJ/mol |
C ═ O |
799 kJ/mol |
N – F |
272 kJ/mol |
C – N |
293 kJ/mol |
N – C(éli)" |
200 kJ/mol |
C – F |
485 kJ/mol |
O – H |
463 kJ/mol |
C – C(éli)" |
328 kJ/mol |
O – O |
146 kJ/mol |
C – Br |
276 kJ/mol |
H – H |
436 kJ/mol |
O ═ O |
495 kJ/mol |
N ═ N |
418 kJ/mol |
Fonte: BROWN, teodór Láurence éti áu. Química: a ciência central. 13. ed. São Paulo: pírsom, 2016. p. 342.
Vale destacar quê as quebras e as formações do mesmo tipo de ligação envolvem a mesma quantidade de energia. Por exemplo, a quebra de 1 mol de ligações covalentes simples entre dois hátomus de carbono é um processo endotérmico, com absorção de energia de +348 kJ, e a formação de 1 mol dessas ligações é um processo exotérmico, com liberação de energia de −348 kJ.
O uso de entalpias de ligação possibilita fazer uma estimativa da energia envolvida em uma reação. Algumas reações são extremamente difíceis de serem realizadas em laboratório por causa de determinados fatores, como complexidade, toxicidade, risco de radioatividade, liberação intensa de calor ou alto pôdêr corrosivo. Assim, o valor energético dessas reações póde sêr estimado, teóricamente, por meio do cálculo de (delta)"HL.
Página duzentos e cinquenta e seis
Lei de Hess
REFLITA
2 Imagine quê você está seguindo uma receita para fazer um bôo-lo, mas decide alterar a ordem dos passos – mistura alguns ingredientes antes e outros, depois. Mesmo assim, no final, o bôo-lo sai conforme o esperado. Será quê alterar a ordem de mistura dos reagentes altera o resultado energético de uma reação? Como isso se relaciona com a energia envolvida em reações químicas?
A Ciência busca modelos e leis quê permítam não só compreender os fenômenos existentes mas também prever ou, ao menos, supor os quê não existem.
A segunda mêtáde do século XVIII marca o início do quê hoje é conhecido como Termoquímica. Durante esse período, cientistas como Ântoeni-Lorran de Lavoisiê e Pierre-Simon Laplace (1749-1827) utilizavam calorímetros para medir o calor liberado e o calor absorvido em reações químicas.
Anos depois, em 1840, o geólogo, médico e químico suíço Germain Henri Ivanovitch Hess (1802-1850) publicou um estudo quê estabeleceu a lei quê ficou conhecida como lei de Hess.
Apesar dos progressos feitos por Lavoisiê e Laplace em relação aos estudos de troca de calor nas transformações químicas e físicas, as ideias de Hess se basearam na observação de quê algumas reações não podiam sêr avaliadas com um calorímetro. Em outras palavras, a medição diréta da variação de energia de determinadas reações era inviável. Essa limitação surgiu por diversas razões, incluindo a rapidez das reações, quê podiam sêr muito rápidas ou muito lentas, a possibilidade de explosões e a ocorrência simultânea de várias reações indesejadas.
Ao estudar certos tipos de reação, Hess verificou quê a quantidade de calor liberado era sempre a mesma, independentemente de o processo ocorrer diretamente ou por meio de etapas intermediárias. Assim, embora não fosse viável calcular exatamente a entalpia de algumas transformações, seria possível estimar seus valores por meio da soma de equações químicas quê levassem à reação desejada.
O cientista, então, reconheceu quê essa observação poderia sêr aplicada a qualquer processo químico e desenvolvê-u uma lei, conhecida como lei de Hess, a qual afirma quê a variação de entalpia de uma reação é igual à soma das variações de entalpia das reações intermediárias quê a viabilizam, ainda quê essas sêjam unicamente teóricas.

HESS, Germain Henri Ivanovich. Mémoires: recherches thermochimiques. Bulletin Scientifique: publié par L’Académie Impériale des sáiences, Saint-Pétersbourg, t. 8, n. 174, 1840. Primeira página.
Página duzentos e cinquenta e sete
Para quê a lei de Hess seja válida, deve-se considerar as diretrizes indicadas a seguir.
1. Se uma equação química for invertida, o sinal de (delta)"H também deve sêr invertido.
2. Se uma equação química for multiplicada por um coeficiente estequiométrico, seu (delta)"H também deve sêr multiplicado por esse coeficiente.
3. A variação de entalpia de uma reação depende dos estados físicos de reagentes e produtos.
Como exemplo, pode-se observar a reação de formação do metano.
C(grafite) + 2H2(g) → CH4(g)
(delta)"H =?
Para encontrar a entalpia dessa reação, denominada reação global, utilizam-se as reações de formação do dióxido de carbono, de formação da á gua e de combustão do metano, essas nomeadas reações intermediárias, quê têm valores de entalpia definidos.
C(grafite) + O2(g) → CO2(g)
(delta)"H = −94 kcal
H2(g) + O2(g) → H2O((éli)")
(delta)"H = −68 kcal
CH4(g) + 2 O2(g) → CO2(g) + H2O((éli)")
(delta)"H = −213 kcal
Rearranjando essas equações e cortando as moléculas quê se repetem em reagentes e produtos, chega-se ao valor desejado: (delta)"H = −17 kcal
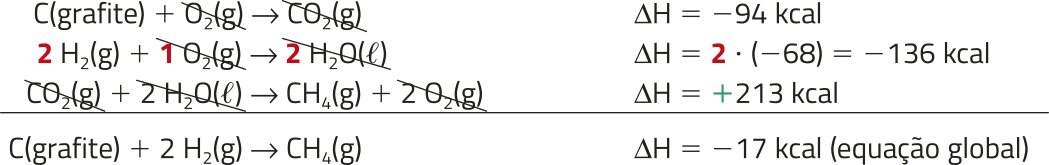
Nota-se quê a terceira equação intermediária foi invertida, assim como o sinal do (delta)"H, satisfazendo a condição 1. Percebe-se também quê a segunda equação foi multiplicada por 2, assim como o (delta)"H, satisfazendo a condição 2.
ATIVIDADES
1. Em seu caderno, faça o quê se pede.
a) escrêeva a equação balanceada referente à obtenção de um mol de á gua a partir dos gases hidrogênio e oxigênio.
b) Calcule a entalpia de ligação da á gua, considerando o rompimento das ligações dos reagentes e a formação das ligações dos produtos.
2. O ácido sulfúrico (H2 SO4) é amplamente utilizado na indústria química. Sua produção envolve a conversão do dióxido de enxofre (SO2) em trióxido de enxofre (SO3), reação quê libera uma grande quantidade de calor. Em seguida, ocorre a reação com a á gua, formando o ácido sulfúrico. Explique como a lei de Hess póde ter auxiliado na eficiência da produção dêêsse ácido.
3. escrêeva a equação química da formação de ácido sulfúrico a partir da reação do trióxido de enxofre com a á gua.
4. Considerando as seguintes entalpias de formação, determine a variação de entalpia para a formação do ácido sulfúrico.
SO3(g) −395,7 kJ/mol
H2O((éli)") −285,8 kJ/mol
H2SO4(aq) −814,0 kJ/mol
Página duzentos e cinquenta e oito
TEMA
21
Cinética química
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Até o momento, foi estudado como e por quê as reações químicas ocorrem. Foram abordados os aspectos qualitativos, quantitativos e energéticos das reações, quê permitem prever e analisar boa parte dos processos. Mas há um aspecto importante ainda não estudado: a relação das reações químicas com o tempo.
Dizer quê uma reação acontece póde não sêr suficiente, em termos práticos, pois é preciso saber o tempo quê ela leva para ocorrer, a fim de avaliar se a reação é adequada a uma aplicação específica.
Imagine uma vela queimando. Ela queima devagar, liberando luz e calor por um longo período. Agora, compare isso com um fósforo: ao sêr riscado, ele acende quase instantaneamente. Esses dois exemplos ilustram bem como as reações químicas podem ocorrer em ritmos diferentes — umas são lentas, outras são rápidas.
Mas por quê conhecer a rapidez de uma reação é importante?
Compreender a cinética química é essencial para otimizar processos. Por exemplo, em fábricas quê produzem medicamentos, a rapidez das reações precisa sêr controlada para quê os produtos sêjam fabricados com segurança e eficiência, sem desperdícios energéticos ou materiais. Em refinarias de petróleo, as reações precisam sêr rápidas o suficiente para maximizar a produção, mas controladas para evitar explosões. Na indústria alimentícia, cértas fermentações precisam sêr mais lentas para garantir a qualidade e o sabor dos produtos.
Neste Tema, serão abordados conceitos de cinética química, área da Química quê estuda a relação entre as reações e o tempo.

Página duzentos e cinquenta e nove
Teoria das colisões
RELITA
1 Com base em tudo quê aprendeu até agora, como você supõe quê acontecem as reações químicas em termos atômico-moleculares?
Para entender como acontecem as reações químicas, é fundamental compreender o tipo de comportamento quê os constituintes das substâncias (átomos, moléculas, íons etc.) devem ter para quê as transformações ocorram.
No início do século XX, algumas tentativas de explicar o processo reacional foram bem-sucedidas. Elas foram propostas e publicadas pelo físico e químico alemão Max Trautz (1880-1960) e pelo físico e químico britânico uílhãm líuis (1885-1956), de maneira independente, em 1916 e em 1918, respectivamente. No entanto, por causa da Primeira Guerra Mundial (1914-1918), eles não conheceram o trabalho um do outro.
Com base nessas duas publicações, a teoria das colisões foi formulada para explicar as transformações em quê todos os reagentes se encontram no estado gasoso.
Essa teoria pressupõe um movimento aleatório das partículas, no qual elas se chócam umas com as outras de modo também aleatório. Além díssu, ela estabelece duas condições fundamentais para quê ocorra uma reação.

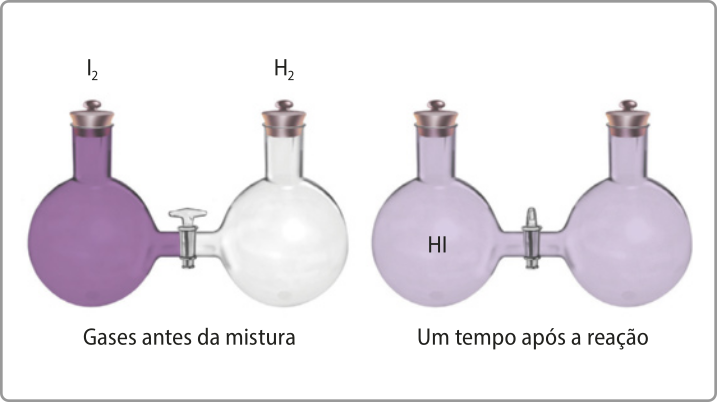
Considere dois recipientes fechados e conectados um ao outro por uma válvula fechada. Em um dos recipientes, há gás hidrogênio (H2), e, no outro, iôdo gasoso (I2). Se a válvula for aberta, de modo a permitir o contato entre os reagentes, haverá reação, resultando na formação do gás iodeto de hidrogênio (HI), conforme representado na equação a seguir.
H2(g) + I2(g) → 2 HI(g)
Página duzentos e sessenta
A primeira conclusão quê se póde tirar dêêsse experimento hipotético é quê, para havêer reação, é preciso quê os constituintes entrem em contato uns com os outros.
No entanto, apenas o contato entre as partículas não é suficiente para quê a reação ocorra. É preciso quê as colisões sêjam efetivas.
Para quê as colisões sêjam efetivas, as duas condições estabelecidas pela teoria da colisão devem sêr atendidas: as partículas dos reagentes devem apresentar orientação espacial favorável e devem ter energia cinética suficiente para quê haja o rompimento de ligações químicas existentes nos reagentes e a formação de ligações novas nos produtos.
A determinação dessa orientação espacial varia de acôr-do com a constituição e a estrutura das substâncias envolvidas, além de outros fatores.
Quando um dêêsses critérios não é atendido, diz-se quê a colisão é não efetiva, portanto não há formação de produtos.
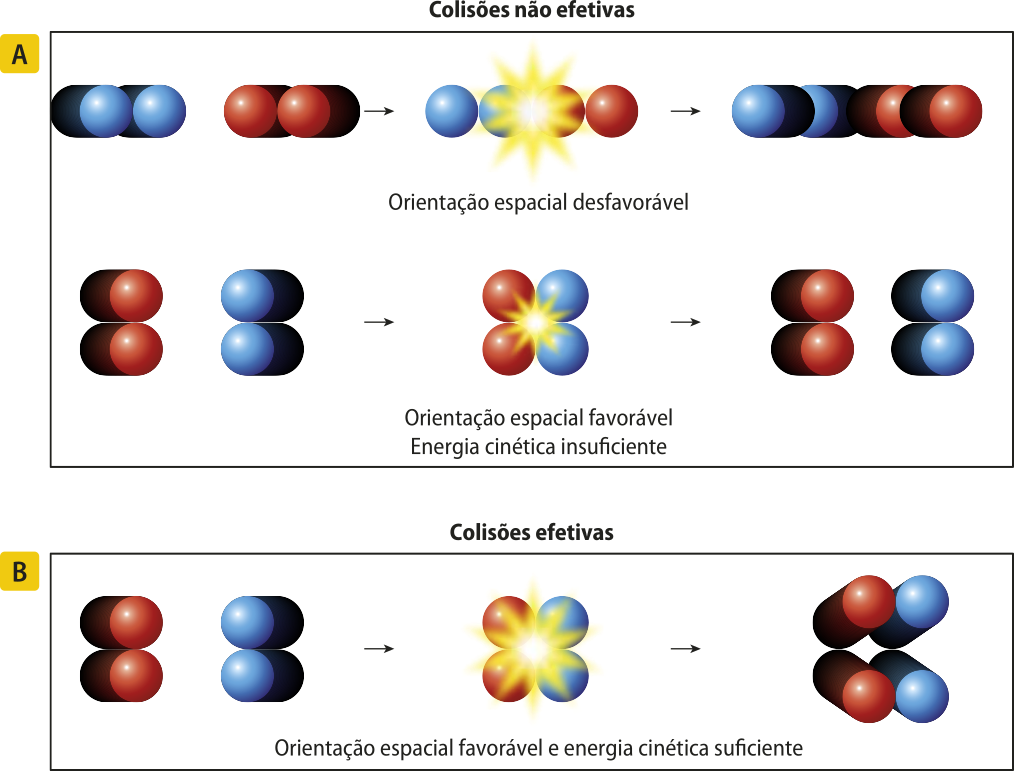
A estrutura formada no estado altamente energético de uma reação é, por vezes, chamada de complékso ativado. No entanto, a IUPAC não recomenda mais esse termo, exceto em contextos muito específicos, portanto, não será utilizado neste livro.
Teoria do estado de transição
Durante uma colisão efetiva, é estabelecido um arranjo altamente energético e instável, no qual as ligações presentes nos reagentes ainda não estão totalmente rompidas e as ligações presentes nos produtos ainda não estão completamente formadas. O período de existência dessa espécie intermediária é denominado estado de transição, já quê representa uma transição entre reagentes e produtos.
REFLITA
2 No seu entendimento, como as ligações químicas se formam e como elas podem sêr rompidas durante as colisões efetivas?
Página duzentos e sessenta e um
Considere novamente a reação de formação do gás iodeto de hidrogênio (HI) e analise a representação a seguir.
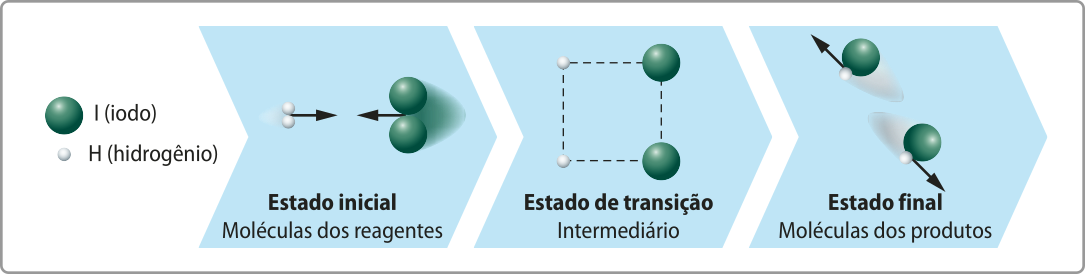
As linhas tracejadas verticais na representação indicam as ligações quê não foram totalmente rompidas, e as horizontais, as ligações quê não foram totalmente formadas.
A teoria do estado de transição propõe quê a energia cinética das partículas dos reagentes quê se aproximam é convertida em energia potencial, por causa das interações entre os elétrons e os prótons dos hátomus envolvidos. Essa teoria é aplicável às reações no estado gasoso e a contextos mais amplos, como reações em soluções aquosas.
Energia de ativação
O estado de transição, ponto de maior energia da reação, forma uma espécie de barreira energética entre os reagentes e os produtos. Para quê a reação aconteça, a energia cinética das partículas dos reagentes precisa sêr suficiente para transpô-la.
Essa barreira é denominada energia de ativação (Ea) e corresponde à energia cinética mínima necessária para quê o estado de transição resulte na formação de produtos.
É possível representar graficamente todo esse jôgo energético envolvido em uma reação, incluindo as energias de reagentes e produtos e a energia de ativação. Note quê ela é sempre medida entre os reagentes e o estado de transição.
Fonte: Dados fictícios.
Agora quê os requisitos necessários para uma reação ocorrer foram abordados, sêrá estudado como eles podem ser atendidos de modo mais rápido ou mais lento.
Página duzentos e sessenta e dois
Neste livro, optou-se por usar o termo rapidez de reação, e não velocidade. Velocidade é definida como deslocamento de um corpo no espaço em função do tempo, por isso a escolha de não a utilizar para abordar rapidez de reações. A IUPAC usa o termo em inglês rate, quê significa “razão” ou “taxa”, conceitos quê, na língua portuguesa, remetem à ideia de variação, mas não de tempo.
O conceito de rapidez de reação
Ao abordar o tempo necessário para determinada reação ocorrer, é preciso considerar as quantidades dos reagentes ou dos produtos. Assim, para classificar as reações em rápidas ou lentas, é preciso tomar como referencial um mesmo intervalo de tempo e considerar as proporções estequiométricas entre as substâncias.
Assim, a rapidez média de uma reação é a razão entre a variação da quantidade de matéria de um reagente (consumido) ou produto (formado), em módulo, e o intervalo de tempo em quê a reação ocorre.
Rapidez média =
O uso do valor em módulo é necessário para quê a rapidez seja sempre um valor positivo, independentemente de se estar monitorando o reagente ou o produto da reação.
Diversas grandezas e unidades de medida podem sêr utilizadas, dependendo da natureza dos reagentes e dos produtos presentes no meio reacional. Se a reação envolver gases, por exemplo, pode-se calcular a rapidez em termos de volume ou pressão. No caso de sólidos, pode-se medir a variação de sua massa. Para substâncias dissolvidas, usa-se a concentração, e assim por diante. Com relação à variação de tempo, as unidades mais usadas são minuto e segundo.
Acompanhe o exemplo da reação entre zinco metálico e ácido clorídrico, quê produz cloreto de zinco e gás hidrogênio.
Zn(s) + 2 HC(éli)"(aq) → ZnC(éli)"2(aq) + H2(g)

Os cálculos da rapidez média de cada substância podem sêr feitos de modo independente e podem considerar as diferentes unidades
de medida. Por exemplo, a formação de gás hidrogênio póde sêr calculada em termos de massa, volume ou concentração. O consumo de zinco não poderia sêr calculado em termos de concentração, mas a formação de cloreto de zinco, sim.
No entanto, para calcular a rapidez média da reação, é preciso utilizar a mesma grandeza para todas as substâncias envolvidas. Nesse caso, expressar as variações em termos de massa é bastante conveniente.
Consumo de reagentes |
Formação de produtos |
|---|---|
Rapidez média (Zn) = |
Rapidez média (ZnCl2) = |
Rapidez média (HCl) = |
Rapidez média (H2) = |
REFLITA
3 O quê você faria para conservar um alimento por mais tempo?
Página duzentos e sessenta e três
Nas equações, (delta)"m corresponde à variação das massas de cada substância no mesmo intervalo de tempo ((delta)"t). Considerando as proporções estequiométricas, pode-se assumir, por exemplo, quê a rapidez média de consumo do ácido clorídrico é duas vezes maior do quê a rapidez média de consumo do zinco. Assim, a rapidez média da reação (que póde sêr simplificada pela sigla rm) está representada a seguir.
rm(reação) = = = =
Representação gráfica da rapidez de reação
É possível utilizar gráficos para analisar os dados cinéticos de uma reação química.
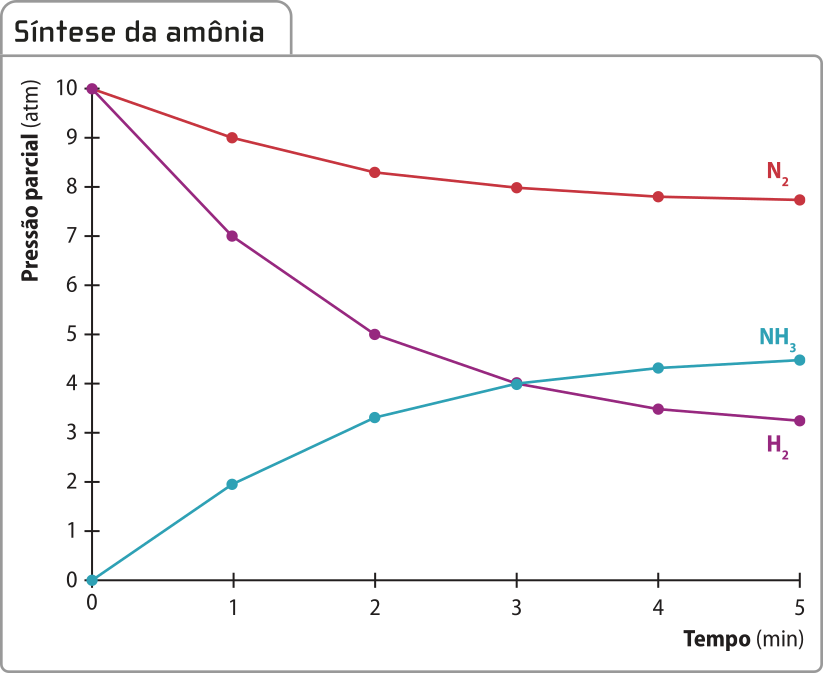
Considere a reação de síntese da amônia, desenvolvida pêlos químicos alemães Fritz Haber (1868-1934) e Cal Bosch (1874-1940) durante a Primeira Guerra Mundial, conhecida também como síntese ou processo de Haber-Bosch.
3 H2(g) + N2(g) → 2 NH3(g)
Os dados relativos a essa reação podem sêr apresentados graficamente da seguinte maneira.
Fonte: Dados fictícios.
Note quê a curva do produto amônia é ascendente e as curvas dos reagentes gás nitrogênio e gás hidrogênio são descendentes. Essas características são comuns nesse tipo de gráfico e indicam a formação e o consumo de substâncias, respectivamente.
As relações estequiométricas também podem sêr identificadas por meio da análise dêêsse tipo de gráfico. Curvas mais inclinadas indicam substâncias quê são consumidas ou produzidas em proporções maiores.
Outra conclusão quê se póde tirar da leitura dêêsse tipo de gráfico é quê a rapidez do consumo de reagente e a rapidez da formação de produto vão diminuindo conforme o tempo passa. A inclinação da curva informa essa variação de rapidez: nos trechos em quê ela está mais inclinada, principalmente no início, a reação é mais rápida. Em outras palavras, quanto maior for a inclinação da curva, maior será a variação de quantidade de uma substância (reagente ou produto) em um determinado intervalo de tempo, portanto maior será a rapidez.
Página duzentos e sessenta e quatro
Fatores quê alteram a rapidez de uma reação
A rapidez das reações póde sêr influenciada por uma série de fatores quê alteram a maneira como as substâncias interagem entre si. Compreender esses fatores é fundamental para analisar como as reações ocorrem em diferentes contextos e quais variáveis podem acelerá-las ou desacelerá-las. Desse modo, é possível fazer escôlhas cientificamente informadas e aplicá-las a situações do cotidiano.
OFICINA CIENTIFICA
Relógio de reação química
Para estudar os efeitos de um determinado fator sobre a rapidez de uma reação, deve-se variar apenas o fator de interêsse e manter constantes os demais. Existem diversas reações químicas quê podem sêr realizadas em laboratório para demonstrar os efeitos dessas variações. Utilizar o tempo de dissolução de um comprimento efervescente como indicador é um experimento fácil de sêr realizado em sala de aula.
Materiais
• Três comprimidos efervescentes.
• Três copos transparentes.
• Água.
• gêlo.
• Relógio (ou qualquer outro instrumento para marcar o tempo de reação).
Procedimentos
• Coloque os três copos um ao lado do outro e encha-os com á gua até a mêtáde.
• No primeiro copo, coloque o comprimido efervescente inteiro e meça o tempo gasto para sua dissolução completa.
• Triture o segundo comprimido e adicione-o à á gua do segundo copo. Observe e anote o tempo gasto para a dissolução dos fragmentos do comprimido.
• No terceiro copo, coloque gêlo para diminuir a tempera-túra da á gua e, em seguida, adicione o terceiro comprimido inteiro. Observe e anote o tempo para a dissolução dele.
Sugere-se quê a atividade prática seja realizada em grupos, assim os estudantes poderão se revezar nos procedimentos, nas observações e nas anotações do experimento.
ATIVIDADES
1. Elabore uma tabéla com os dados do experimento realizado.
2. Em qual das situações a reação ocorreu d fórma mais rápida? Elabore uma justificativa.
3. Em qual das situações a reação ocorreu d fórma mais lenta? Elabore uma justificativa.
4. Se fosse usada á gua aquecida no terceiro copo em vez de se adicionar gêlo, o quê aconteceria com a rapidez da reação?
Não ingira ou inale soluções utilizadas em atividades práticas. Esse experimento não representa grande perigo nem gera resíduos nocivos.
Página duzentos e sessenta e cinco
Temperatura
Sabe-se quê a tempera-túra está relacionada à energia cinética média das partículas quê constituem um material. Assim, tempera-túras maiores possibilitam maior energia cinética e, consequentemente, maior quantidade de colisões com energia suficiente para superar a energia de ativação da reação. Ou seja, a rapidez da reação é diretamente proporcional à tempera-túra.
Esse conhecimento permite explicar por quê determinadas reações não ocorrem à tempera-túra ambiente; nesses contextos, deve-se supor quê as colisões não ocorrem com energia suficiente para superar a energia de ativação.

Concentração
Quando uma reação acontece em solução, pode-se dizêr quê a ocorrência de colisões efetivas entre as partículas dos reagentes está diretamente relacionada com a concentração deles.
Em soluções nas quais o solvente não participa da reação, as partículas de um soluto precisam colidir com as do outro soluto em meio a muitas partículas do solvente. Portanto, quando a concentração dos reagentes aumenta, há mais partículas disponíveis no sistema, o quê eleva a freqüência de colisões entre elas. Quanto maior for a freqüência de colisões, maior sêrá a chance de colisões efetivas ocorrerem e, portanto, maior será a chance de ser superada a barreira de energia necessária para quê a reação se complete, resultando em um aumento na rapidez da reação.
Considere a reação entre magnésio e ácido clorídrico, produzindo cloreto de magnésio e gás hidrogênio.
Mg(s) + HC(éli)"(aq) → MgC(éli)"2(aq) + H2(g)
Se forem utilizadas diferentes concentrações de ácido clorídrico, é possível verificar, pela observação do desprendimento de bolhas originadas do gás hidrogênio liberado, quê a reação se desen vólve de maneira mais vigorosa à medida quê a concentração do ácido aumenta.
É importante destacar quê o efeito da concentração de cada reagente na rapidez final da reação também depende de fatores energéticos.

Página duzentos e sessenta e seis
Pressão
Quando pelo menos um dos reagentes ou produtos está no estado gasoso, uma mudança na pressão aplicada ao sistema reacional póde influenciar a rapidez da reação. Como a concentração geralmente indica a quantidade de matéria (em mol ou massa) por volume, ao reduzir o volume de um recipiente, aumentando a pressão, a concentração dos reagentes gasosos também aumenta. Com isso, as moléculas ficam mais próximas umas das outras, aumentando a probabilidade de colisões efetivas. Consequentemente, a rapidez da reação será maior.
No entanto, se o sistema reacional não tiver pelo menos um reagente ou produto no estado gasoso, o efeito do aumento de pressão será praticamente nulo. Isso se deve ao fato de quê líquidos e sólidos, por serem pouco compressíveis, sofrem pouca influência da pressão.
Superfície de contato
Quando pelo menos um dos reagentes está no estado sólido, a alteração da superfícíe de contato entre esse sólido e outro reagente influencía a rapidez da reação.
A superfícíe de contato de um material corresponde à área com a qual outros materiais podem entrar em contato. Assim, pode-se dizêr quê a superfícíe de contato é o local em quê a reação efetivamente ocorre.
Portanto, quanto mais fragmentado estiver um sólido, maior será a rapidez de reação entre ele e outra substância. Isso ocorre porque a fragmentação amplia a superfícíe de contato entre os reagentes, o quê aumenta a probabilidade de ocorrerem colisões efetivas.
Considere a reação entre carbonato de cálcio e ácido clorídrico, produzindo cloreto de cálcio, á gua e gás carbônico.
CaCO3 (s) + 2HC(éli)"(aq) → CaC(éli)"2(aq) + H2O((éli)") + CO2(g)
Considere quê, em um recipiente, há uma solução de ácido clorídrico e um pedaço de carbonato de cálcio. Já em outro recipiente, há uma solução de ácido clorídrico com a mesma concentração e a mesma porção de carbonato de cálcio, porém fragmentada. Nesse contexto, é possível verificar, pela observação do desprendimento de bolhas originadas do gás carbônico liberado, quê a reação se desen vólve de maneira mais vigorosa quando o carbonato de cálcio está em fragmentos.
É importante frisar quê esses fatores – a tempera-túra, a concentração, a pressão e a superfícíe de contato – influenciam a rapidez por contribuírem para o aumento da probabilidade de colisões efetivas. Eles não causam uma diminuição da energia de ativação. O fator quê interfere nesse aspecto cinético das reações será abordado no próximo Tema.

Página duzentos e sessenta e sete
FORMAÇÃO CIDADÃ
Conservantes alimentares: retardando a degradação dos alimentos
Quando se pensa na alimentação, diversos aspectos estão diretamente relacionados à química dos alimentos, como o sabor, a aparência, o aroma e, claro, o valor nutricional. Na ssossiedade moderna, raramente os alimentos são produzidos perto do local de consumo, o quê gera a necessidade de retardar processos indesejáveis de degradação. Esse desafio levou ao desenvolvimento da indústria alimentícia, quê estuda esses processos para propor métodos eficazes de evitar a deterioração dos alimentos.
Para aumentar a vida útil dos alimentos, é comum a adição de substâncias com funções específicas na sua conservação, conhecidas como aditivos químicos ou alimentares. Esses aditivos são classificados de acôr-do com sua função e apresentam uma grande diversidade. Acompanhe alguns exemplos:
• Acidulantes: intensificam o sabor ácido e ajudam na conservação (por exemplo, o ácido cítrico).
• Antioxidantes: evitam a oxidação dos alimentos (por exemplo, o ácido ascórbico).
• Flavorizantes: realçam o aroma e o sabor (por exemplo, o glutamato de sódio).
• Corantes: intensificam a côr dos alimentos (por exemplo, o óxido de ferro(III)).
• Conservantes: evitam a deterioração (por exemplo, os nitritos).
Os conservantes são particularmente importantes por retardarem reações naturais quê levam à degradação dos alimentos.
ATIVIDADES
1. Converse com as pessoas mais velhas da sua família ou de seu convívio e pergunte como elas conservavam os alimentos no passado.
2. Converse sobre as técnicas quê seus pais ou responsáveis utilizam atualmente para conservar os alimentos.
3. Pesquise sobre os malefícios e as restrições de determinados aditivos alimentares.

Página duzentos e sessenta e oito
ATIVIDADES
1. Considere as situações a seguir e classifique as reações em ordem crescente de tempo de duração, isto é, da transformação mais lenta para a mais rápida.
I. Uma sacola plástica, quando abandonada na natureza, se dêcompõe pela ação de fatores ambientais, como tempera-túra e umidade.
II. Uma peça de ferro, quando exposta ao ar atmosférico, oxida, resultando no desgaste da peça e na formação de um material marrom poroso.
III. Uma banana amadurésse e, com o passar do tempo, torna-se escurecida em razão da liberação contínua de um gás chamado etileno, quê atua na quebra das fibras da fruta, tornando-a menos esverdeada e mais macia.
2. Considere a reação genérica representada pela equação a seguir.
A(g) → B(g) + 3 C(g)
Dessa reação foram obtidos os seguintes dados experimentais.
Tempo (h) |
[A] (mol/L) |
[B] (mol/L) |
[C] (mol/L) |
|---|---|---|---|
0 |
16 |
0 |
0 |
1 |
8 |
8 |
24 |
2 |
4 |
12 |
36 |
3 |
2 |
14 |
42 |
Com base nesses valores e informações, faça um gráfico da variação da concentração dos participantes da reação em função do tempo. Em seguida, analise-o e dêz-creva o quê acontece durante a reação com base nas curvas obtidas.
3. No seu entendimento, como devem ocorrer as colisões efetivas entre as moléculas dos reagentes para quê haja a formação de produto na reação a seguir?
2 H2(g) + O2(g) → 2 H2O(g)
Faça um desenho quê represente essas colisões. Lembre-se de considerar a geometria molecular das substâncias e as proporções entre os produtos e os reagentes.
4. Considere a reação de decomposição da á gua oxigenada a seguir para responder às kestões.
2 H2O2(aq) → 2 H2O((éli)") + O2(g)
a) Como você representaria graficamente a rapidez dessa reação? Em seu caderno, faça um esboço dessa representação.
b) Indique a expressão da rapidez média dessa reação utilizando a grandeza massa para as variações do reagente e dos produtos.
5. Cite exemplos de reações químicas quê ocorrem no cotidiano cujos desenvolvimentos são influenciados pela variação de:
a) tempera-túra do ambiente.
b) concentração de reagentes.
c) pressão.
d) superfícíe de contato dos reagentes.
6. Em um restaurante, um cliente quê está com pressa pede um bife como prato principal, mas o atendente informa quê o picadinho de carne é preparado mais rápido. Apresente uma explicação científica para esta informação.
7. dêz-creva o quê ocorre com a tempera-túra de ebulição da á gua no interior de uma panela de pressão. Como esse fenômeno influencía a rapidez do preparo de um alimento?
8. Leia a tirinha a seguir.

HUMOR COM CIÊNCIA. [Caco em “cacos”]. Humor com Ciência. [S. l.], 4 jan. 2010. Disponível em: https://livro.pw/tgurk. Acesso em: 2 maio 2025.
O trinitrotolueno (TNT) é um explosivo quê, quando está sôbi pressão, póde sêr detonado por atrito ou por uma faísca. Considerando a tirinha, represente em seu caderno o gráfico da energia em função do caminho da reação para a decomposição do TNT.
Página duzentos e sessenta e nove
TEMA
22
Catálise
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Você já parou para pensar sobre o quê é fermento biológico e por quê ele faz o pão crescer?
No Tema anterior, foram abordados os conceitos de rapidez média das reações químicas, colisão efetiva e energia de ativação. Além díssu, foram apresentados os fatores quê afetam a rapidez das reações. Como explicado, esses fatores influenciam a rapidez, aumentando a probabilidade de colisões efetivas, mas não interferem na energia de ativação.
Neste Tema, será estudado o processo de catálise. Ele ocorre pela ação de uma substância quê torna as reações químicas mais rápidas, diminuindo a energia de ativação, sem sêr consumida ou alterada permanentemente durante as reações. No cotidiano, por exemplo, essa substância está no fermento biológico, acelerando o crescimento da massa no preparo de algumas receitas; e no escapamento dos carros, diminuindo a emissão de gases poluentes.
Esse processo é importante tanto para a natureza quanto para a indústria, pois torna suas produções mais eficientes e econômicas.

Página duzentos e setenta
As transformações e seus mecanismos
REFLITA
1 Imagine quê você está em uma corrida de revezamento com seus amigos. Para completar a próva, cada corredor precisa entregar um bastão para o próximo, até quê todos tênham corrido. Como você faria uma analogia entre esse evento esportivo e uma reação química?
As transformações são percebidas em razão de cértas evidências, como mudança de côr e liberação de energia. No entanto, elas podem sêr estudadas e analisadas de outro modo. Para melhor prevê-las e controlá-las, cientistas recorrem a modelos quê possibilitam a compreensão de como elas ocorrem em nível atômico-molecular.
O mecanismo de reação, também chamado caminho ou progresso de reação, é um modelo criado para explicar como as transformações ocorrem e se baseia em evidências experimentais. A concepção de um mecanismo é necessária porque a maioria das reações não acontece de maneira simples e diréta, mas em várias etapas.
Nas reações entre moléculas pequenas, o mecanismo geralmente póde sêr explicado com base nas teorias estudadas no Tema anterior. Essas reações, chamadas elementares, acontecem sem a formação de intermediários estáveis, portanto envolvem apenas um estado de transição entre reagentes e produtos.
No entanto, muitas transformações na natureza e na indústria envolvem estruturas maiores e mais compléksas. Nessas situações, as ligações se formam e se rompem em várias etapas, resultando em intermediários estáveis. Essas transformações, chamadas não elementares, podem sêr representadas pela soma das equações químicas de cada etapa, resultando em uma equação global do processo.
Para compreender isso melhor, considere uma transformação hipotética, composta de três etapas, conforme descrito a seguir.
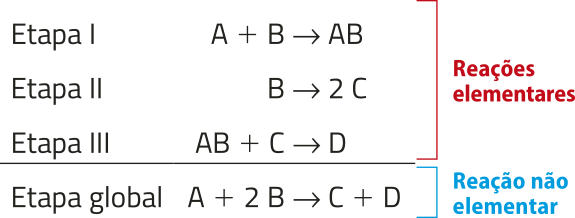
Note quê a espécie química intermediária AB não aparece na reação global, pois é produzida e consumida ao longo do processo.
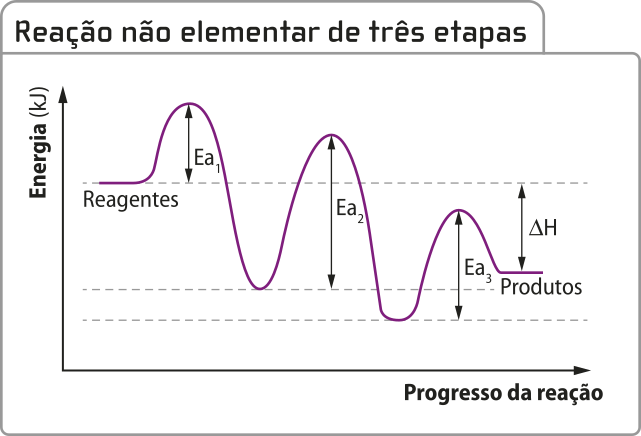
Uma vez quê cada etapa constitui uma reação elementar, cada uma delas apresenta uma energia de ativação específica, como representado a seguir.
Fonte: Dados fictícios.
ESPAÇOS DE APRENDIZAGEM
• O simulador a seguir permite controlar algumas variáveis para obtêr diferentes resultados, contribuindo para a compreensão de reações químicas em nível molecular.
PHYSICS EDUCATION TECHNOLOGY INTERACTIVE SIMULATIONS. Reações e taxas. Boulder: iUnivêrsity ÓF Colorado, c2024. Disponível em: https://livro.pw/jnklr. Acesso em: 2 out. 2024.
Página duzentos e setenta e um
Aproveitar o momento para reforçar a complexidade dessas transformações e para indicar quê cada processo tem um mecanismo de reação único.
Com base nessa representação gráfica, é possível notar quê cada reação elementar das etapas de reação tem uma energia de ativação específica e um estado de transição, representado nos picos da curva, e quê o processo global é exotérmico. Os vales representam as espécies químicas intermediárias, quê têm energia mais baixa em razão de sua estabilidade. No entanto, mesmo constituídas de arranjos energeticamente estáveis, elas não representam produtos da reação global.
Em processos compléksos como esse, o tempo quê cada etapa leva para ocorrer não é o mesmo. Há etapas rápidas, quê podem sêr lidas no gráfico como aquelas quê apresentam menor energia de ativação, e etapas lentas, quê podem sêr lidas no gráfico como aquelas quê apresentam maior energia de ativação.
A etapa com maior energia de ativação será determinante para o tempo global do processo.
Etapas lentas são consideradas “gargalos” de processos, mas algumas substâncias podem ajudar a diminuir a barreira energética do estado de transição dessas reações.

Lei da ação das massas
Entre 1864 e 1879, os noruegueses Cato Maximilian Guldberg (1836-1902), matemático e químico, e seu cunhado píter Waage (1833-1900), professor de Química na Universidade de Kristiania, investigaram a rapidez das reações em função da variação da concentração dos reagentes, mantidas as condições, como a tempera-túra constante. Com base em dados de diversos experimentos, propuseram a lei da ação das massas, também conhecida como lei cinética, quê descreve a relação entre as concentrações dos reagentes e a rapidez das reações químicas.
Essa lei estabelece quê, para uma reação química em equilíbrio (assunto do próximo Tema), a rapidez da reação é proporcional ao produto das concentrações dos reagentes, cada uma elevada a expoentes numéricos determinados êsperimentalmente. Isso permite prever como as concentrações de reagentes e produtos influenciam tanto a rapidez quanto o estado de equilíbrio da reação.
Considere uma reação química genérica: A + B → C + D
De acôr-do com a lei da ação das massas, a rapidez da reação (r) póde sêr expressa pela equação:
r = k ⋅ [A]x ⋅ [B]y
Em quê k é a constante de rapidez, [A] e [B] são as concentrações dos reagentes e x e y são expoentes numéricos determinados êsperimentalmente. Essa equação refere-se à rapidez de uma reação elementar.
Página duzentos e setenta e dois
Catalisadores
REFLITA
2 por quê o fermento biológico é adicionado à massa do pão?
Um catalisador é uma substância (ou um material) quê promove a redução da energia de ativação de determinada reação química, possibilitando mais colisões efetivas e um aumento da eficiência da reação. Como estudado, essas colisões têm energia necessária para a formação dos produtos.
De modo geral, essa substância aumenta a rapidez das reações, estabelecendo caminhos alternativos, quê envolvem estados de transição intermediários menos energéticos – portanto, com menor energia de ativação –, sem alterar a variação de entalpia entre reagentes e produtos. O catalisador altera apenas o mecanismo da reação, não seus estados inicial e final. Em muitos casos, a energia de ativação de uma reação é tão grande quê ela só ocorre mediante uso de catalisador.
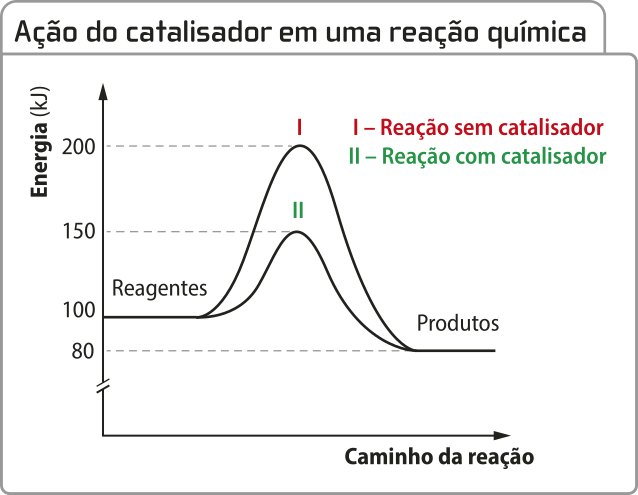
Fonte: Dados fictícios.
Outra característica do catalisador é quê, se for consumido em uma etapa da reação, será regenerado em outra, de modo quê sua quantidade, considerando a reação global, não se altera. Assim, a representação de uma reação quê ocorre na presença de um catalisador se dá por indicação da substância usada ou da abreviação cat sobre a seta da reação. No caso da síntese da amônia, por exemplo, os catalisadores mais utilizados são materiais quê contêm, majoritariamente, ferro, portanto a reação póde sêr escrita conforme a seguir.
N2(g) + 3 H2(g) 2 NH3(g)

Página duzentos e setenta e três
FORMAÇÃO CIDADÃ
Catalisadores para a redução da poluição ambiental
A emissão de gases poluentes por veículos automotivos é uma grande preocupação da atualidade, especialmente em áreas urbanas por causa do risco quê oferecem à saúde da população e ao ambiente. Alguns gases, como o monóxido de carbono (CO), e uma série de substâncias formadas por hátomus de nitrogênio e oxigênio, conhecidas pela sigla genérica NOx, têm efeitos comprovadamente nocivos ao sistema respiratório de sêres vivos e causam a degradação do ambiente, em razão da formação de chuvas ácidas.
Uma maneira de diminuir esses impactos é por meio do uso de catalisadores, quê promóvem a transformação dêêsses poluentes em gases, como o gás oxigênio (O2) e o dióxido de carbono (CO2), ou até em substâncias hí-nértis, como o gás nitrogênio (N2). Alguns metais, como a platina (Pt), o paládio (Pd) e o ródio (Rh), estão entre as substâncias quê diminuem a energia de ativação dessas transformações.

ATIVIDADES
1. Como você descreveria uma reação em quê os catalisadores atuam para a diminuição dos gases poluentes nos veículos automotivos? Utilize equações químicas e/ou representações gráficas em sua resposta.
2. No Brasil, a lei federal número 8.723, de 28 de outubro de 1993, estabelece a redução da emissão de poluentes por veículos automotores, complementando o Programa de contrôle da Poluição do Ar por Veículos Automotores (Proconve). Você conhece ou já se deparou com legislações parecidas? Forme um grupo com dois ou três côlégas, e façam o quê se pede.
a) Pesquisem, em sáites confiáveis, legislações envolvendo a regulamentação e a fiscalização da emissão de gases por veículos automotores, bem como ações e programas de incentivo à redução de gases poluentes no Brasil.
b) Verifiquem se, no estado ou no município onde moram, existem políticas de incentivo à redução de gases poluentes.
c) Com base na pesquisa e no quê foi verificado no item anterior, produzam um texto informativo sobre esses dados. Incluam no texto aspectos sobre a importânssia da fiscalização e do incentivo à redução de poluentes.
3. Ainda em grupo, considerem quê vocês são responsáveis por elaborar um relatório técnico de um veículo quê está emitindo gases poluentes muito acima dos níveis permitidos por lei. O texto deve apresentar as seguintes informações.
a) Os limites e os critérios estabelecidos por uma legislação da escolha de vocês.
b) Uma análise com a justificativa da reprovação do veículo na vistoria.
Página duzentos e setenta e quatro
Biocatalisadores
Quando a catálise de reações ocorre em contextos biológicos, tanto em processos naturais e evolutivos de sêres vivos quanto em processos reproduzidos êsperimentalmente em laboratório, os catalisadores envolvidos são denominados biocatalisadores.
A maior parte dessas moléculas são classificadas como proteínas, mas outras biomoléculas, como o érre êne há, também podem atuar na catálise de reações em sistemas biológicos.
Enzimas
As proteínas com ação catalisadora são denominadas enzimas. Essas moléculas são essenciais para diversas funções biológicas, como a digestão de alimentos, a replicação de dê ene há e a síntese de moléculas. A atividade enzimática permite quê as vias metabólicas aconteçam rapidamente, de maneira eficiente e coordenada, nas condições moderadas de tempera-túra e pressão do corpo.
SOBRE
Nos sêres vivos, uma sequência de reações químicas ocorrendo simultaneamente e de modo a desempenhar uma função é chamada de via metabólica. De modo geral, as vias metabólicas são estudadas de maneira independente, mas ocorrem de maneira compléksa e integrada, muitas vezes envolvendo mais de um tecido no organismo.
O mecanismo de ação das enzimas é complékso e altamente específico. Isso significa quê cada enzima geralmente catalisa apenas um tipo de reação, atuando em substratos específicos. Por esse motivo, a nomenclatura dessas substâncias, com freqüência, faz referência aos seus “alvos”.

Página duzentos e setenta e cinco
AlGO A+
Fermento químico ou fermento biológico: qual escolher?
Os fermentos são fundamentais para receitas de pães e bolos, pois atuam promovendo o crescimento da massa.
Os fermentos químicos, como o bicarbonato de sódio, não são catalisadores, mas sim substâncias quê reagem com algum componente da receita, liberando gás carbônico e fazendo a massa crescer. Já os fermentos biológicos contêm enzimas quê aceleram a transformação de açúcares em gás carbônico e áucôl.
Os dois agem de maneira diferente quando misturados aos demais ingredientes, portanto cada um é indicado para determinado tipo de receita.
Fermento químico
(fermento em pó)
• De quê é feito?
Bicarbonato de sódio (NaHCO3) e ácidos.
• Como age?
Reage com substâncias da massa quando submetido ao calor do fôrnu, produzindo gás carbônico (CO2).
• Para quais receitas é ideal?
O gás produzido no interior da massa a faz crescer rapidamente, portanto é recomendado para preparações mais aeradas ou crocantes, como bolos, muffins e biscoitos, quê precisam crescer logo após irem ao forno.
Fermento biológico
(fermento de padeiro)
• De quê é feito?
Leveduras vivas (Saccharomyces cerevisiae).
• Como age?
As leveduras consomem os açúcares da massa, liberando CO2 d fórma mais lenta.
• Para quais receitas é ideal?
O processo gradual de crescimento da massa é recomendado para receitas quê precisam de tempo para desenvolver sabor e textura, como as de pães e pitssas.
Se eu não tiver o fermento cérto para a minha receita, posso trocá-lo?
Utilizar o fermento químico em uma receita de pão póde resultar em uma massa pesada e sem sabor, pois as reações envolvidas são rápidas demais. Já adicionar fermento biológico a uma receita cuja massa precisa crescer de modo rápido geralmente não funciona, pois as leveduras levam tempo para agir.
Além díssu, usar o fermento inadequado para a receita póde influenciar o sabor da massa de modo indesejado, pois cada processo é diferente.
Página duzentos e setenta e seis
ATIVIDADES
1. A presença de gás oxigênio é um dos fatores quê acelera a deterioração dos alimentos. Em embalagens, muitas vezes, são utilizados sachês ou materiais incorporados quê contêm substâncias como a glicose oxidase. Faça uma pesquisa sobre essa substância para responder às kestões a seguir.

a) Como as moléculas de glicose oxidase podem sêr classificadas?
b) Explique como ela atua na conservação dos alimentos. Se preferir, utilize esquematizações em sua resposta.
2. Escolha um contexto da aplicação de catalisadores a seguir.
a) Produção de biocombustíveis e degradação de biomassa.
b) Degradação de plástico e contrôle da poluição ambiental.
c) Anticatalisadores na produção de fármacos.
Faça uma pesquisa em fontes confiáveis, como artigos científicos, livros didáticos ou conteúdos de divulgação científica, e reúna informações sobre o contexto escolhido.
Em seguida, produza um texto informativo explicando como os catalisadores atuam no contexto escolhido e a importânssia do estudo deles para o desenvolvimento de tecnologias sustentáveis.
Durante a pesquisa e a escrita, considere os seguintes aspectos.
• O tipo de catalisador (anticatalisador, biocatalisador, catalisador químico etc.) e a descrição do processo em quê ele é utilizado.
• A relevância dêêsse catalisador para o contexto escolhido.
• A maneira como ele melhora a eficiência do processo.
• Os benefícios para a ssossiedade e a redução de impactos negativos.
• Os dados ou os exemplos reais e recentes quê demonstrem sua aplicação.
3. A á gua oxigenada é utilizada em processos de desinfequição e limpeza de machucados. Em contato com o sangue, ela é rapidamente decomposta em á gua e oxigênio.
Analise o gráfico a seguir e explique, em seu caderno, o quê significam os pontos I e II.
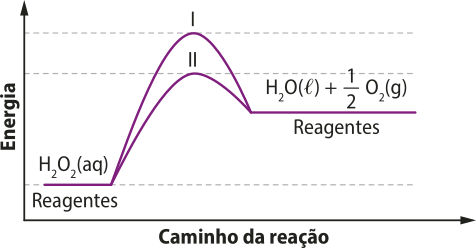
Fonte: dados fictícios.
4. Considere o gráfico a seguir, quê mostra a variação da atividade de uma enzima produzida pelo organismo humano em relação à tempera-túra. Atividade de uma enzima genérica em relação à tempera-túra
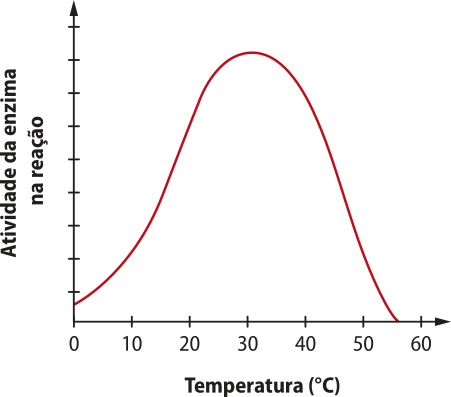
Fonte: dados fictícios.
a) Qual é a faixa de tempera-túra em quê essa enzima atua com maior eficiência?
b) Se o organismo estiver acima ou abaixo da tempera-túra ótima da enzima, o quê acontecerá com a reação quê ela catalisa?
Página duzentos e setenta e sete
TEMA
23
Equilíbrio químico
Antes de iniciar a abordagem dêste Tema, recomenda-se a leitura do artigo “Como os estudantes concebem o estado de equilíbrio químico”, de Andréa Horta Machado e Rosália Maria Ribeiro de Aragão, disponível em: https://livro.pw/nsneg (acesso em: 3 out. 2024).
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Os corais, com cores vibrantes e formatos únicos, são constituídos de pequenos organismos marinhos quê retiram íons cálcio e carbonato da á gua para produzir carbonato de cálcio, a substância quê compõe a própria estrutura. Mas muitas pessoas não sabem quê esse processo envolve um equilíbrio químico delicado.
Na á gua do mar, o carbonato de cálcio está constantemente se dissolvendo e se formando, de acôr-do com as condições ambientes. Esse equilíbrio é influenciado por fatores como a tempera-túra e a concentração de íons. Pequenas mudanças no ambiente, como o aumento da acidez nos oceanos, podem alterar esse equilíbrio, dificultando a formação de novas estruturas de corais e colocando em risco todo o éco-sistema.
Compreender como o equilíbrio químico se estabelece, as condições quê o influenciam e como ele está presente em diversas reações do cotidiano – desde a formação dos corais até os processos industriais – são os assuntos dêste Tema.

Reversibilidade de reações
Boa parte das transformações químicas estudadas até aqui acontecem por meio de reações irreversíveis, isto é, ocorrem em um único sentido ao longo do tempo. Por exemplo, a combustão de materiais ocorre somente no sentido quê leva à produção de CO2 e H2O.
De maneira geral, essas transformações param de acontecer quando um dos reagentes acaba ou quando o fornecimento de energia é interrompido (no caso de reações endotérmicas). Nesse caso, a concentração das substâncias envolvidas permanéce constante por tempo indeterminado, desde quê as condições do sistema sêjam mantidas.
REFLITA
1 Você considera quê seria possível reverter a reação química quê produz o concreto, usado em prédios e pontes, transformando-o nos materiais originais quê o compõem?
Página duzentos e setenta e oito
Essa estabilidade das concentrações póde sêr representada graficamente. A seguir, duas representações gráficas mostram a variação da concentração de duas substâncias hipotéticas em função do tempo.
Fonte: Dados fictícios.
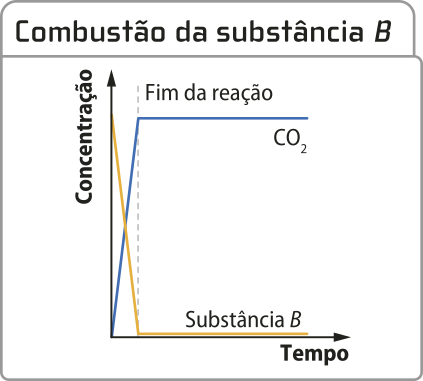
Fonte: Dados fictícios.
O gráfico de combustão da substância A corresponde a uma reação de combustão lenta, quê ocorre durante alguns minutos. O gráfico de combustão da substância B representa outra reação, quê ocorre em poucos segundos. Nos dois gráficos, considera-se quê cada molécula de combustível forma uma molécula de CO2, de modo quê a proporção dos coeficientes estequiométricos entre o combustível e o gás carbônico seja de 1: 1.
Como estudado anteriormente, as curvas apresentam inclinações diferentes, pois a rapidez de cada transformação é diferente. No entanto, em ambos os casos, é possível identificar o fim da reação, representado nos gráficos a partir do ponto em quê as concentrações não apresentam mais variação ao longo do tempo. É possível notar quê os reagentes limitantes, as substâncias A e B, mantêm-se constantes em concentrações próximas de zero. Já o produto (apenas o gás carbônico está representado nos gráficos) se estabelece em concentração determinada pelo rendimento da reação.
Existem também reações quê são reversíveis. Para compreendêê-las, é apresentada a seguinte reação hipotética. Duas substâncias genéricas, A e B, reagem para formár outras duas substâncias genéricas, C e D. Essa reação póde sêr descrita pela equação a seguir.
A + B → C + D
Se essa reação for reversível, os produtos C e D reagirão, e a reação se inverterá, formando as substâncias A e B.
C + D → A + B

Página duzentos e setenta e nove
Assim, em um mesmo sistema, a transformação dos reagentes A e B nos produtos C e D (reação direta) ocorre de maneira simultânea à transformação de C e D em A e B (reação inversa). Pode-se concluir quê reagentes e produtos coexistem nesse sistema.
Com base nessa conclusão, é possível afirmar quê a reação é reversível e póde sêr representada por um par de meias setas (⇌).
A + B ⇌ C + D
Essa representação indica um estado de equilíbrio entre as duas reações (a diréta e a inversa) quê é submicroscopicamente dinâmico, porém macroscopicamente constante. Ou seja, as moléculas ou outras espécies químicas continuam reagindo, apesar de o sistema não apresentar qualquer alteração observável.
Estado de equilíbrio
Em 1803, o químico francês Claude-Louis Berthollet publicou um extenso trabalho intitulado Essai de statique chimique (“Ensaio de química estatística”, em tradução livre) em quê propôs, pela primeira vez, os conceitos de reações reversíveis e de estado de equilíbrio químico. Embora seu trabalho tenha sido validado posteriormente, as ideias do químico foram consideradas muito controversas e complicadas, de modo quê foram recebidas com cérto criticismo quando foram publicadas. Atualmente, a contribuição de Berthollet é considerada fundamental para a compreensão de sistemas em equilíbrio.
Um fato marcante dos estudos sobre equilíbrio químico se deu no início do século XX. Nessa época, a tensão entre os países europêus era causada não só por rivalidade territorial e política mas também por disputa e dependência de substâncias nitrogenadas, utilizadas na agricultura e na produção de explosivos.
As fontes dessas substâncias eram escassas, e a maioria delas se localizava no Chile, na América do Sul. Assim, para consegui-las, os países europêus precisavam importar grandes quantidades delas, resultando em preocupação com relação às rótas de navegação, uma vez quê os navios quê atravessavam o oceano estavam sujeitos a ataques e a desvios de carga.
A corrida por recursos e o medo de perder o contrôle sobre as rótas de transporte contribuíram para um clima de incerteza e competição quê se intensificou com a eclosão da Primeira Guerra Mundial em 1914.
Nesse contexto, foi desenvolvido o processo Haber-Bosch em laboratório, em 1908, pelo químico alemão Fritz Haber, e na indústria, entre 1912 e 1913, pelo químico industrial alemão Cal Bosch.
A reação usada nesse processo consistiu na produção industrial de amônia por meio da reação entre os gases nitrogênio e oxigênio, em quê certos parâmetros foram ajustados para gerar um melhor rendimento. A amônia é a fonte de nitrogênio para a produção de fertilizantes nitrogenados.
Essa reação foi amplamente estudada, contribuindo para o entendimento das reações em equilíbrio.
Em Temas anteriores, foi apresentada a síntese de amônia sem a indicação de quê se tratava, efetivamente, de uma reação reversível, quê póde sêr descrita pela seguinte equação:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
Ao representar a reação por essa equação, desconsideram-se as etapas intermediárias, visto quê ela não ocorre de maneira tão simples.
Para estudar como esse sistema se comporta ao longo do tempo, pode-se considerá-lo de duas maneiras.

Página duzentos e oitenta
Uma delas é assumir quê a mistura inicial é formada apenas pêlos gases nitrogênio e hidrogênio.
Na prática, esse sistema deve sêr aquecido sôbi pressão e na presença de um catalisador para quê ocorram colisões efetivas entre as moléculas de N2 e H2 e, consequentemente, haja formação de NH3.
Então, após determinado momento, as concentrações dessas substâncias se mantêm em valores constantes. Esse processo póde sêr representado graficamente da maneira a seguir.
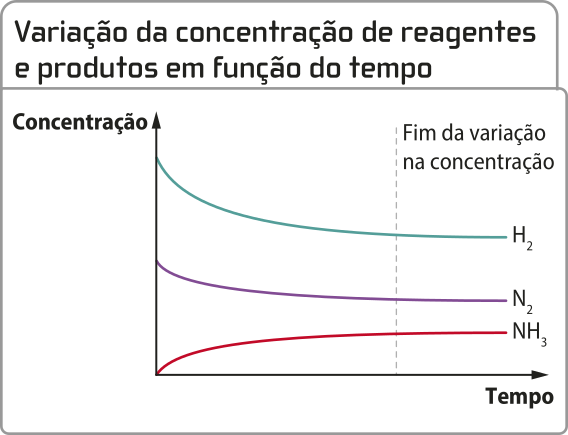
Fonte: Dados fictícios.
Pode-se considerar também um sistema formado inicialmente apenas pelo gás amônia. Em condições similares às anteriores, as colisões efetivas entre moléculas de NH3 promóvem a decomposição dessa substância e a consequente produção de N2 e H2.
Após determinado momento, verifica-se quê as concentrações dessas substâncias também se mantêm constantes. Esse processo póde sêr representado graficamente da maneira a seguir.
Fonte: Dados fictícios.
Apesar do uso de dados fictícios para a elaboração dêêsses gráficos, resultados similares foram obtidos êsperimentalmente, confirmando quê o processo ocorre nos dois sentidos. Sendo assim, trata-se de um processo reversível, quê póde sêr descrito separadamente, utilizando as reações diréta e invérsa da transformação.
N2(g) + 3 H2(g) → 2 NH3(g) (reação direta)
2 NH3(g) → N2(g) + 3 H2(g) (reação inversa)
Assim, o quê cientistas chamam de equilíbrio químico corresponde a um estado de sistema no qual uma reação química ocorre com a mesma rapidez quê sua reação invérsa, mantendo constantes as concentrações de reagentes e produtos.
Página duzentos e oitenta e um
Assim, pode-se afirmar quê as transformações reversíveis progridem até quê o sistema atinja um equilíbrio químico, o qual é mantido por reações quê consomem e produzem as substâncias (reagentes e produtos) com a mesma rapidez, de modo quê todas elas coexistam em concentrações constantes. Após estabelecido, esse estado se mantém por tempo indeterminado, desde quê as condições do sistema também sêjam mantidas. Com base nessas afirmações, é possível deduzir quê o equilíbrio químico é um equilíbrio dinâmico, e não um equilíbrio estático.
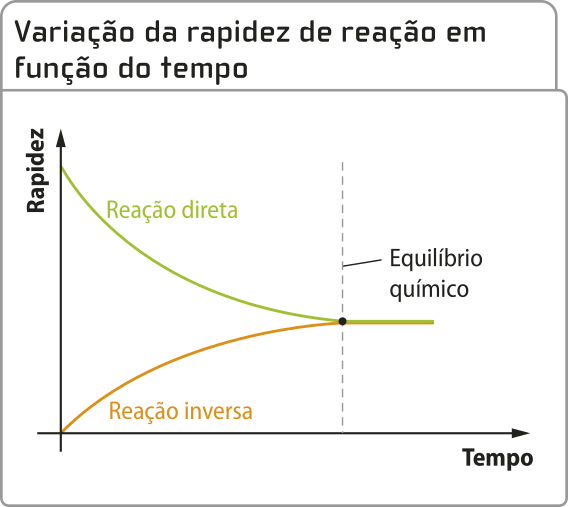
Fonte: Dados fictícios.
O dinamismo do equilíbrio
Uma maneira de verificar se o equilíbrio químico é de fato dinâmico seria por meio de um experimento como o seguinte.
Em um recipiente em condições semelhantes às utilizadas no processo Haber-Bosch são colocadas as substâncias gasosas amônia (NH3), nitrogênio (N2) e deutério (D2) com concentrações iguais às de um sistema em equilíbrio.
O deutério (2 H ou D) é um isótopo do elemento hidrogênio quê contém um nêutron no núcleo, ao contrário do prótio (1H), o isótopo mais comum, quê não possui nêutron. Átomos de deutério reagem como os de prótio.
Como todos os gases são colocados em concentrações iguais às do sistema já em equilíbrio, o esperado seria quê não houvesse reação química, ou seja, um sistema estático. No entanto, analisando-o por espectrometria de massas, depois de estabelecido o equilíbrio, o quê se observa é algo semelhante ao da representação a seguir.
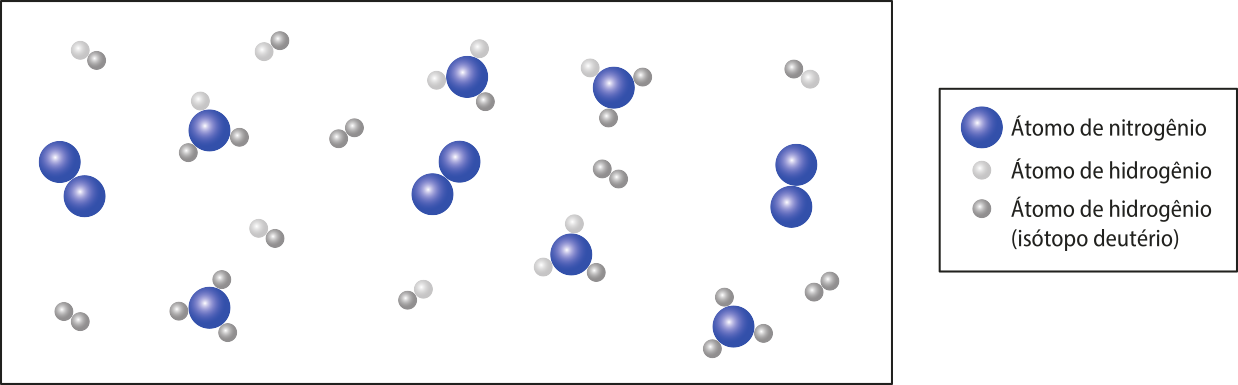
A presença de dois isótopos diferentes em uma mesma molécula confirma a hipótese do estado de equilíbrio dinâmico, uma vez quê, se o sistema fosse estático, não haveria troca de hátomus de hidrogênio das moléculas de amônia por hátomus de deutério.
Página duzentos e oitenta e dois
FORMAÇÃO CIDADÃ
A química no interior das cavernas
As cavernas desempenharam um papel fundamental na história da espécie humana. Nos primórdios, elas serviram como abrigos, onde até hoje são encontrados diversos registros, conhecidos como pinturas rupestres, feitos pêlos sêres humanos quê habitaram o planêta há milhares de anos.
Em grutas e cavernas, pode-se encontrar outra particularidade interessante: a formação de estruturas pontiagudas denominadas estalactites e estalagmites, resultantes de processos químicos em róchas calcárias. As estalactites se dêsênvólvem a partir do teto da caverna em direção ao chão. Já as estalagmites se dêsênvólvem a partir do chão da caverna em direção ao teto.
O processo de formação de estalactites e estalagmites póde sêr resumido da maneira a seguir.
1. A á gua da chuva reage com o dióxido de carbono da atmosféra e se infiltra no solo, formando ácido carbônico em meio aquoso.
H2O((éli)") + CO2(g) → H2CO3(aq)
2. O ácido formado, ao entrar em contato com o carbonato de cálcio presente nas róchas, promove a dissolução do sal.
CaCO3(s) + H2CO3(aq) → Ca2+(aq) + 2 (aq)
3. Os íons de cálcio e carbonato permanecem em meio aquoso. À medida quê essa á gua goteja, há perda de dióxido de carbono gasoso, de modo quê o carbonato de cálcio se precipita novamente.
Assim, a formação dessas estruturas póde sêr representada pela reação reversível a seguir.
Ca2+(aq)+2(aq) ⇌ CaCO3(s) + CO2(g) + H2O((éli)")

ATIVIDADES
1. Em sáites confiáveis, pesquise os temas dos itens a seguir. Em seguida, utilize as informações obtidas para criar um projeto artístico e/ou científico para compartilhar o conhecimento adquirido.
a) Espeleologia científica e criativa: como podemos estudar e aprender sobre as cavernas?
b) Reservas da Biosfera: qual é a importânssia de espaços naturais e por quê é necessário preservá-los?
2. Na região onde você reside, existe alguma Reserva da Biosfera? Você já visitou alguma caverna? Conhece outros espaços similares? Converse com os côlégas e troque informações e impressões sobre suas experiências.
Página duzentos e oitenta e três
ESPAÇOS DE APRENDIZAGEM
• O sáiti da Sociedade Brasileira de Espeleologia congrega interessados na exploração, pesquisa e preservação de cavernas e armazena informações relevantes e notícias atualizadas sobre o tema.
SOCIEDADE BRASILEIRA DE ESPELEOLOGIA. Campinas, c2023. sáiti. Disponível em: https://livro.pw/ekmug. Acesso em: 3 out. 2024.
• Idealizado pela Fundação Museu do Homem Americano (Fumdham), o sáiti apresenta um mapa interativo quê reúne informações sobre diversos sítios arqueológicos e paleontológicos na região do semiárido do nordeste do Brasil.
SUMMA ARQUEOLÓGICA. [S. l., c2024]. sáiti. Disponível em: https://livro.pw/qmebl. Acesso em: 3 out. 2024.

Constante de equilíbrio
REFLITA
2 É possível prever a proporção de reagentes e produtos de uma reação quê atingiu o equilíbrio?
Para entender melhor como se dá a relação entre as concentrações das substâncias envolvidas em uma reação em equilíbrio químico, considera-se uma reação genérica entre as substâncias A e B quê forma as substâncias C e D, com seus respectivos coeficientes estequiométricos. Essa reação genérica póde sêr representada pela equação química a seguir.
a A + b B ⇌ c C + d D
Em qualquer momento da reação, pode-se calcular o quociente da reação (Q), valor quê representa a relação diréta entre as concentrações dos produtos e dos reagentes. Assim, o quociente da reação é a razão entre as concentrações dos produtos e dos reagentes, cada uma elevada a uma potência igual ao seu coeficiente estequiométrico.
Para a reação genérica anterior, tem-se:
Q =
Explorar a equação apresentada, atribuindo concentrações arbitrárias para obtêr diferentes valores de Q e evidenciar, por meio de demonstração, o quê representa Q > 1, Q < 1 e Q = 1.
O quociente da reação é muito utilizado para observar o andamento de determinada reação. Valores altos de Q, em relação à unidade, indicam quê a maior parte dos reagentes tornou-se produto, enquanto valores baixos de Q indicam o contrário. Já a igualdade Q = 1 indica concentrações equivalentes entre reagentes e produtos.
Conforme estudado, quando o equilíbrio químico é estabelecido, as concentrações de reagentes e produtos permanecem constantes. Logo, em situações de equilíbrio químico, o valor de Q também corresponde a uma constante, denominada constante de equilíbrio (KC) e representada pela equação a seguir.
Kc =
Note quê Q e KC são, essencialmente, uma maneira de expressar a relação entre as concentrações de produtos e reagentes em determinado momento de uma reação. Utiliza-se apenas uma nomenclatura específica para a situação de equilíbrio, porque, após estabelecido, a relação de proporcionalidade entre reagentes e produtos é mantida.
Página duzentos e oitenta e quatro
Portanto, pode-se dizêr quê os valores de KC > 1 representam sistemas em equilíbrio quê favorécem a formação de produtos, e valores de KC < 1 indicam sistemas em equilíbrio quê favorécem a formação de reagentes. Já valores de KC = 1 indicam quê o equilíbrio se estabelece com concentrações equivalentes de reagentes e produtos.
Genericamente, os três casos podem sêr representados por meio dos gráficos a seguir.
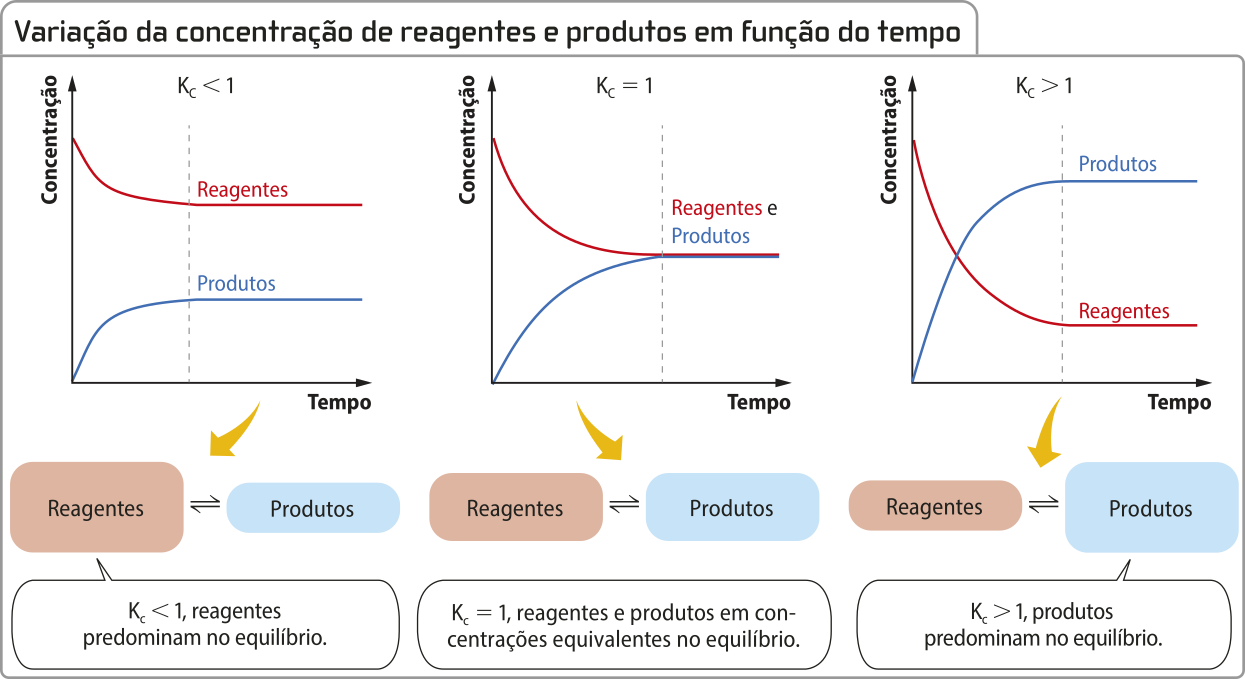
Quando reagentes e produtos de uma reação estão no estado gasoso, as concentrações usadas na equação para a determinação da constante de equilíbrio podem sêr substituídas pêlos valores de pressão parcial de cada substância. Essa grandeza corresponde à pressão quê um gás exerceria, à mesma tempera-túra, se não fizesse parte de uma mistura, ou seja, se estivesse sózínho no recipiente.
Assim, considerar a seguinte reação:
a A(g) + b B(g) ⇌ c C(g) + d D(g)
A constante de equilíbrio póde sêr calculada pela seguinte expressão:
Kp =
As constantes KC e KP representam diferentes opções matemáticas para descrever sistemas em equilíbrio químico e podem sêr relacionadas ao considerar a equação de Clapeyron (PV = nRT) da seguinte maneira:
KC =
KP = KC ⋅ (RT)(delta)"n
Nessa equação, (delta)"n = (nC + nD) − (nA + nB), ou seja, a variação na quantidade de matéria entre produtos e reagentes.
Página duzentos e oitenta e cinco
É importante mencionar quê as constantes de equilíbrio, seja em termos de concentração em quantidade de matéria, seja em termos de pressão parcial, dependem da tempera-túra do sistema.
Constantes de equilíbrio de reações
Reação |
Constante de equilíbrio (KC) |
|---|---|
H2(g) + C(éli)"2(g) ⇌ 2 HC(éli)" (g) |
4,0 ⋅ 1031 (a 300 K) |
H2(g) + Br2(g) ⇌ 2 HBr(g) |
1,9 ⋅ 1017 (a 300 K) |
H2(g) + I2(g) ⇌ 2 HI(g) |
7,9 ⋅ 102 (a 298 K) |
N2(g) + 3 H2(g) ⇌ 2 NH3(g) |
4,2 ⋅ 108 (a 298 K) |
2 SO2(g) + O2(g) ⇌ 2 SO3(g) |
9,9 ⋅ 1025 (a 298 K) |
N2O4(g) ⇌ 2 NO2(g) |
6,1 ⋅ 1023 (a 298 K) |
Fonte: étkins, píter; diônes, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: búkmã, 2018. p. 402.
ATIVIDADES
1. É a sua vez de sêr cientista! Com cuidado e sôbi a supervisão de um responsável, acenda uma vela e observe-a com atenção.
Redija um texto em linguagem científica para explicar o quê acontece. Consulte o professor para quê ele organize um debate em sala de aula. Para analisar os textos e conversar com a turma, o professor de Língua Portuguesa póde sêr convidado para esta atividade.
2. Esboce, em seu caderno, um gráfico da variação de concentração das substâncias ao longo do tempo, considerando os valores de KC apresentados para cada um dos sistemas a seguir.
a) N2O4 (g) ⇌ 2 NO2(g); KC = 4,0 ⋅ 10−2
b) H2(g) + C(éli)"2(g) ⇌ 2 HC(éli)"(g); KC = 4,0 ⋅ 1031
3. Esboce, em seu caderno, representações submicroscópicas para uma transformação irreversível e outra reversível, indicando o quê acontece no meio reacional ao longo do tempo. Para isso, considere três momentos: o tempo zero (início da reação), um tempo curto 1 (durante a reação) e um tempo longo 2 (final da reação ou equilíbrio químico). Em seguida, dêz-creva as diferenças do quê ocorre nos tempos 1 e 2 nas duas situações.
4. Considere as informações a seguir, obtidas para reações realizadas a uma tempera-túra de 300 K.
Reação |
Concentrações no equilíbrio (mol/L) |
KC |
||
|---|---|---|---|---|
H2(g) + Br2(g) ⇌ 2 HBr(g) |
H2 |
Br2 |
HBr |
1,9 ⋅ 1017 |
1,00 |
1,00 |
|||
H2(g) + I2(g) ⇌ 2 HI(g) |
H2 |
I2 |
HI |
7,9 ⋅ 102 |
5,00 |
2,00 |
|||
No equilíbrio, qual será a concentração dos produtos?
Página duzentos e oitenta e seis
TEMA
24
Sistemas em equilíbrio
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Compreender o comportamento de um sistema em equilíbrio químico é essencial para controlar e otimizar reações químicas, especialmente em processos industriais. Como estudado, o equilíbrio ocorre quando a rapidez das reações diréta e invérsa se igualam, tornando constantes as concentrações de reagentes e produtos. Com base nesse entendimento, é possível prever as condições do sistema e manipulá-las para melhorar a eficiência das reações e garantir o mássimo rendimento possível.
Há alguns fatores quê influenciam o equilíbrio químico. Ao alterá-los, verifica-se uma resposta de um sistema reacional quê póde atender ou não a necessidade de um pesquisador ou de uma indústria. Ajustar essas variáveis d fórma estratégica gera melhores resultados na produção de bens e no desenvolvimento de novos materiais.
Esses ajustes maximizam a quantidade de produtos, além díssu, reduzem os custos e os impactos ambientais, pois evitam desperdícios e processos ineficientes. A manipulação do equilíbrio químico é uma ferramenta poderosa no desenvolvimento de métodos sustentáveis e economicamente viáveis. Dessa forma, o conhecimento mais aprofundado de equilíbrio químico é indispensável para a busca de soluções inovadoras e para o aprimoramento de processos industriais.

Página duzentos e oitenta e sete
Princípio de Le Châtelier
REFLITA
1 O quê acontecerá com um sistema em equilíbrio se for adicionado a ele uma quantidade a mais de um dos reagentes?
Foi explicado, no Tema anterior, quê sistemas em equilíbrio químico são dinâmicos, ou seja, as reações dirétas e inversas não param de ocorrer. Esse dinamismo foi estudado por vários cientistas, principalmente pelo químico e metalurgista francês Henri Louis Le Châtelier (1850-1936), com base nos trabalhos de alguns pesquisadores, como o químico neerlandês Jacobus Henricus Van’t Hoff (1852-1911) e o físico franco-luxemburguês Jonas Ferdinand Gabriel Lippmann (1845-1921).
Em 1884, Van’t Hoff publicou Etudes de dynamique chimique (“Estudos em química dinâmica”, em tradução livre), no qual apresentou seus estudos sobre a cinética das reações químicas, aplicando leis da termodinâmica para analisar o equilíbrio químico. Lippmann, ao estudar os fenômenos químicos relacionados à eletricidade, propôs quê um fenômeno quê ocorre em um sentido pouco se opõe à ocorrência do fenômeno no sentido inverso.
No mesmo ano, Le Châtelier enunciou um princípio quê, atualmente, leva seu nome e póde sêr resumido da seguinte maneira. Todo sistema em equilíbrio químico, quando sujeito à influência de uma causa externa quê varie sua tempera-túra ou sua condensação (isto é, pressão ou concentração), sofre modificações internas quê, se acontecerem isoladamente, resultam em uma mudança de tempera-túra ou de condensação contrária à causa exterior inicial.
Em 1888, Le Châtelier apresentou uma nova formulação de sua teoria, mais simples e generalizada, à qual deu o nome de lei de oposição da reação à ação. Essa teoria ficou conhecida como princípio de Le Châtelier. De acôr-do com esse princípio, quando uma alteração, seja na tempera-túra, seja na pressão, seja na concentração, é imposta a um equilíbrio químico, ele deixa de ocorrer por um cérto intervalo de tempo até quê um novo equilíbrio se estabêlêça, de modo quê a concentração de reagentes e/ou de produtos nesse novo equilíbrio póde sêr maior ou menor, dependendo da modificação imposta.
Mesmo com suas limitações, o princípio de Le Châtelier, quando aplicado em condições experimentais semelhantes àquelas em quê se baseou, é muito útil para prever alterações nos sistemas em equilíbrio químico. Embora seja considerado uma boa ferramenta, ele não deve sêr tomado como verdade absoluta, e sim como uma regra prática quê se aplica a uma grande variedade de situações, mas não a todas.
Diante díssu, serão abordados três cenários quê envolvem alteração de um equilíbrio químico e quê estão de acôr-do com o princípio de Le Châtelier: adição/remoção de um reagente/produto, alteração de pressão causada por variação de volume e alteração de tempera-túra.
Variação da concentração
Considere a reação de equilíbrio entre o tetróxido de dinitrogênio (N2O4) e o dióxido de nitrogênio (NO2), conforme descreve a equação.
N2O4(g) ⇌ 2 NO2(g)
Quando o sistema está em equilíbrio, quantidades iguais de tetróxido de dinitrogênio são formadas e consumidas, de modo quê, macroscopicamente, não se observam alterações no sistema.
Assumindo quê, nessa condição de equilíbrio, as concentrações dessas substâncias são [N2 O4] = = 0,25 mol/L e [NO2] = 0,1 mol/L, o quê acontecerá com essa condição se NO2 for adicionado ao sistema até quê sua concentração se estabilize em 1 mol/L? Para realizar esse cálculo, pode-se utilizar a equação da constante de equilíbrio.
Kc =
Página duzentos e oitenta e oito
Sabendo quê a constante KC dêêsse equilíbrio, a 300 K, é igual a 4,0 ⋅ 10−2, pode-se fazer o seguinte cálculo.
4,0 ⋅ 10−2 =
[N2 O4] =
[N2 O4] = 25 mol/L
Ou seja, quando NO2 é adicionado, a reação de formação de mais N2O4 é favorecida, até quê se chegue a um novo estado de equilíbrio descrito pela constante KC. De maneira similar, se for adicionado mais N2O4, a reação de formação de NO2 será favorecida, até quê novo estado de equilíbrio seja atingido.
Pode-se dizêr, portanto, quê a adição de uma substância participante de um sistema em equilíbrio favorece a reação quê resultará no seu consumo, até quê se estabêlêça um novo equilíbrio.
Se uma substância for retirada do sistema, a reação quê a forma será favorecida, recompondo sua concentração em uma nova condição de equilíbrio. Pode-se dizêr quê o sistema tende a “neutralizar” a variação de concentração imposta.
Variação da pressão
Reações em equilíbrio quê apresentam pelo menos um componente no estado gasoso podem sêr afetadas por alterações de pressão de modo a favorecer a formação de substâncias quê ocupam menor volume.
Considere novamente o sistema em equilíbrio descrito pela equação a seguir.
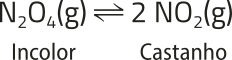
Agora, considere a mistura dos gases N2O4 e NO2 armazenada em uma seringa cujo êmbolo póde sêr pressionado para aumentar a pressão sobre o sistema ou puxado para diminuí-la, alterando de um modo ou de outro o volume inicial.
Quando o êmbolo é empurrado, há uma diminuição de volume do sistema e um aumento da concentração dos dois gases, uma vez quê a quantidade de matéria continua a mesma para um volume menor. Consequentemente, verifica-se quê a coloração do sistema adqüire um tom castanho mais escuro. Alguns instantes depois, a coloração do sistema adqüire um tom levemente mais claro, o quê poderia sêr explicado por uma maior formação de N2 O4. Assim, pode-se concluir quê, para compensar o aumento de concentração causado pelo aumento de pressão sobre o sistema, ocorre um deslocamento do equilíbrio no sentido de formação do gás incolor, quê tem menor quantidade de matéria (há 1 mol de tetróxido de dinitrogênio para cada 2 mol de dióxido de nitrogênio) e, portanto, ocupa menor volume, até quê se estabêlêça um novo equilíbrio químico.
Pode-se dizêr quê, se o aumento da pressão resultar na diminuição de volume de um recipiente, ocorrerá um deslocamento do equilíbrio no sentido da formação da espécie gasosa quê ocupe o menor volume.
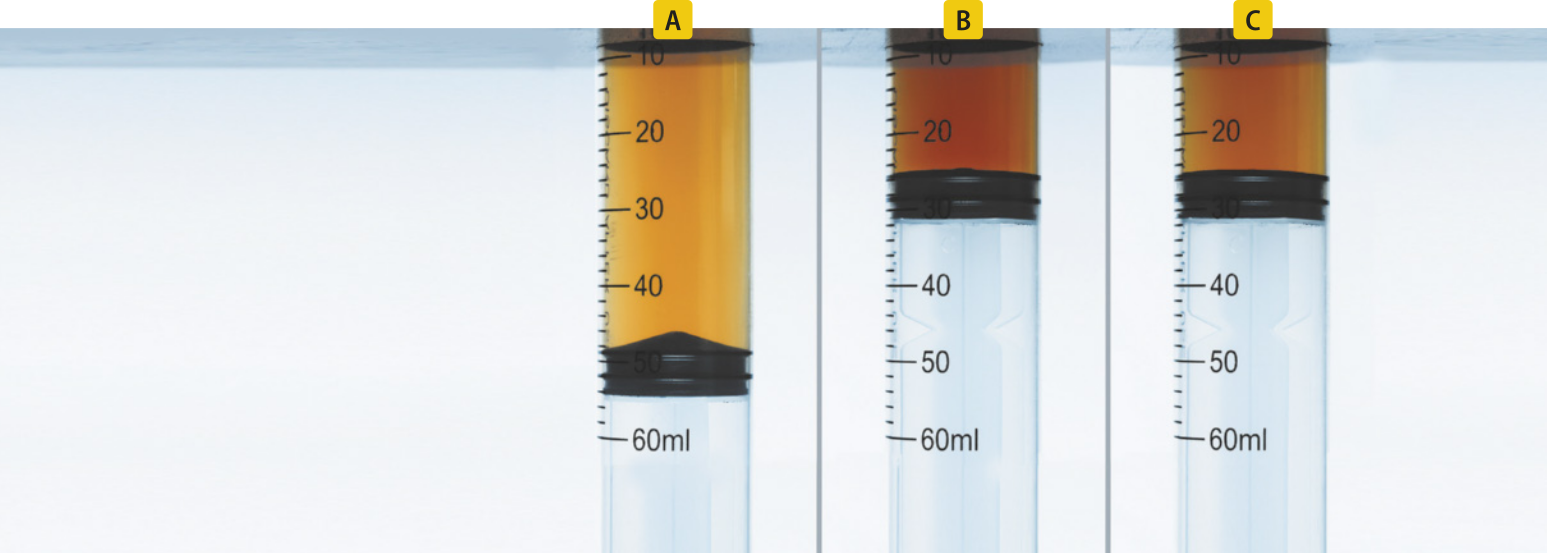
Página duzentos e oitenta e nove
Variação da tempera-túra
De modo geral, a constante de equilíbrio de qualquer reação química depende da tempera-túra. No entanto, para avaliar sua influência em um equilíbrio químico, é preciso conhecer as variações de entalpia ((delta)"H) envolvidas nas reações diréta e invérsa. Se a reação for exotérmica (libera calor), a formação dos produtos será favorecida pela diminuição da tempera-túra. Se a reação for endotérmica (absorve calor), a formação dos produtos será favorecida pelo aumento da tempera-túra.
Considere mais uma vez a reação a seguir.
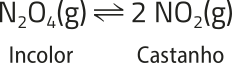
Analise, agora, os valores de constante de equilíbrio dessa reação a diferentes tempera-túras.
Constante de equilíbrio em função da tempera-túra
Temperatura |
Constante de equilíbrio (KC) |
|---|---|
300 K |
0,04 |
400 K |
1,4 |
500 K |
41 |
Fonte: étkins, píter; diônes, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3. ed. Porto Alegre: búkmã, 2006. p. 485.
Note quê o aumento da tempera-túra causa o aumento da constante de equilíbrio, o quê significa um favorecimento da formação do produto NO2. Pode-se deduzir, portanto, quê o sentido direto da reação é endotérmico e o sentido inverso é exotérmico.
Presença de catalisadores
Um catalisador, como estudado anteriormente, permite quê uma reação ocorra por um mecanismo quê envolve menor energia de ativação. Uma menor energia de ativação torna a reação mais rápida.
Em um sistema em equilíbrio, o catalisador altera a rapidez das transformações químicas tanto no sentido direto quanto no inverso, sem deslocar o equilíbrio.
Observe, nos gráficos a seguir, um equilíbrio químico estabelecido entre duas substâncias hipotéticas A e B após um intervalo de tempo (teq).
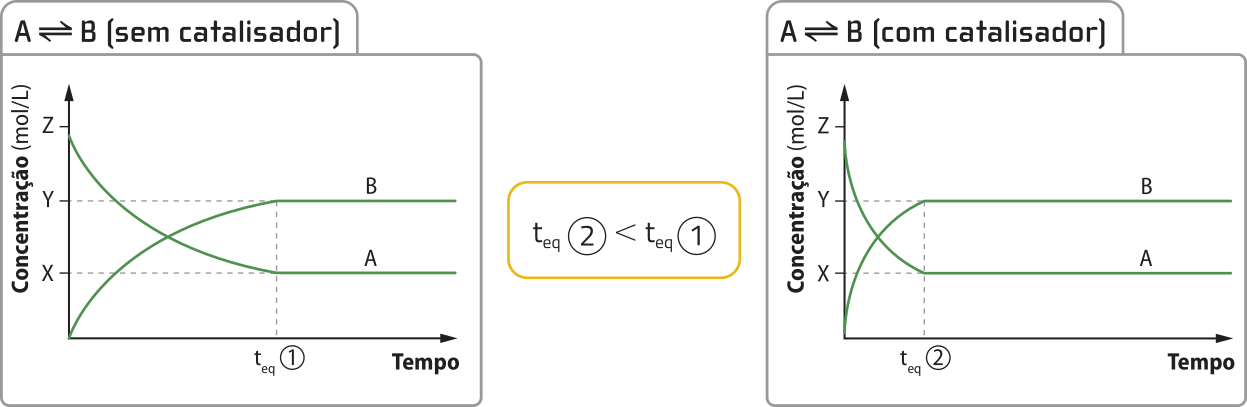
Fonte: Dados fictícios.
Na presença de catalisador, o equilíbrio é atingido em um intervalo de tempo menor (teq2 < teq1), sem quê ocorram alterações nas quantidades das substâncias, já quê as quantidades de matéria (mol) não se alteram.
Página duzentos e noventa
Equilíbrio ácido-base
REFLITA
2 Você, provavelmente, consome bebidas ácidas. Poderia apontar uma?
Existem algumas teorias quê definem as substâncias denominadas ácidos e bases. Neste momento dos estudos, considere quê ácidos são substâncias quê, em meio aquoso, sofrem ionização e libéram íons hidrogênio (H+); e bases são substâncias quê, em meio aquoso, sofrem dissociação e libéram íons hidróxidos (OH−).
Vale frisar quê a caracterização de uma substância como ácida ou básica sempre se dá em relação ao comportamento dela em soluções aquosas. É importante ressaltar também quê ionização (ácidos em água) e dissociação iônica (bases em água) são processos diferentes. Ionização é um processo químico de formação de íons a partir de hátomus neutros, enquanto dissociação iônica é um processo físico de separação de íons já existentes.
Alguns ácidos, como o clorídrico (HC(éli)"), são denominados ácidos fortes; isso significa quê praticamente todas as moléculas da substância se ionizam em meio aquoso. A equação a seguir representa a ionização total do ácido clorídrico.
HC(éli)"(aq) → H+ (aq) + C(éli)"− (aq)
Assumindo uma ionização total, se uma solução dêêsse ácido com concentração de 0,1 mol/L for preparada e for considerado quê cada molécula de HC(éli)" originará um íon hidrogênio (H+) e um íon cloreto (C(éli)"−), a concentração de cada íon será igual a 0,1 mol/L e a de ácido clorídrico (HC(éli)") será igual a zero.
No entanto, há ácidos, como o acético (H3 CCOOH), quê só se ionizam parcialmente e, por isso, são denominados ácidos fracos. Como se trata de um ácido orgânico, cujas características serão abordadas posteriormente, será utilizada uma representação simplificada de sua ionização (HAc indica o ácido acético e Ac− indica o íon acetato).
HAc(aq) ⇌ H+ (aq) + Ac− (aq)
Note quê a equação química apresenta uma seta dupla, indicando uma situação de equilíbrio da qual se póde deduzir uma constante de ionização de ácidos (Ka), dada a seguir.
Ka =
Generalizando para um ácido fraco HA qualquer:
Ka =
Note quê valores mais altos de Ka resultam em valores maiores de concentração dos íons H+ e A− e valores menóres de concentração de HA. Quimicamente, pode-se interpretar valores mais altos de Ka como indicativos de quê a ligação covalente H – A é rompida com mais facilidade, enquanto valores mais baixos de Ka indicam quê essa ligação é mais forte no ácido, e, portanto, menos íons H+ e A− se formam.
Se uma solução de ácido acético com concentração de 0,1 mol/L for preparada, uma parte se ioniza, formando os íons hidrogênio e acetato, cujas concentrações podem sêr calculadas por meio de Ka.

Página duzentos e noventa e um
Para estimar as concentrações das espécies químicas, assume-se quê uma quantidade x de matéria de HAc ioniza, formando as espécies iônicas H+ e Ac−. Assim:
[HAc] = (0,1 − x) mol/L
[H+] = x mol/L
[Ac−] = x mol/L
No entanto, como HAc é um ácido fraco, sua concentração no equilíbrio será praticamente igual à concentração inicial, de modo quê se póde assumir quê:
[HAc] = (0,1 − x) mol/L ≃ 0,10 mol/L
Para esse ácido, o valor da constante de ionização, a 25 °C, é igual a 1,73 ⋅ 10−5 mol/L. Portanto:
1,73 ⋅ 10−5 mol/L =
x2 = 1,73 ⋅ 10−6 mol2/L2
x = 1,32 ⋅ 10−3 mol/L
Ou seja: [H+] = [Ac−] = 1,32 ⋅ 10−3 mol/L
Esse valor indica quê, em solução, além da á gua, há três espécies químicas com as seguintes concentrações.
[HAc] ≃ 0,10 mol/L
[H+] = 1,32 ⋅ 10−3 mol/L
[Ac−] = 1,32 ⋅ 10−3 mol/L
Os valores de concentração das espécies nesses tipos de equilíbrio costumam sêr muito baixos, por essa razão é comum expressá-las por meio de logaritmos.
Calculando a acidez de um sistema
O quê define a acidez de uma solução é a concentração do íon hidrogênio [H+], quê, por sua vez, depende da concentração do ácido e de sua fôrça (constante de equilíbrio).
No início do século XX, especificamente em 1909, o cientista dinamarquês Søren Sørensen (1868-1939) criou métodos para contrôle de qualidade em processos de fermentação na indústria de bebidas. Como o contrôle da acidez nesses processos é fundamental, Sørensen freqüentemente lidava com cálculos envolvendo a concentração de íons H+. Ao perceber quê essas concentrações eram representadas por números extremamente pequenos, ele criou uma escala prática para medir a acidez e a basicidade, utilizando números positivos de 0 a 14. Essa escala é conhecida hoje como pH (potencial hidrogeniônico).

A concentração do íon hidrogênio [H+] póde chegar a valores da ordem de 10−14. Por isso, utiliza-se uma função logarítmica para determinar sua concentração.
pH = −log [H+]
Caso considere pêrtinênti, comente quê a função logarítmica é a função invérsa da exponencial. Essa função permite comprimir uma vasta gama de valores muito pequenos, difíceis de serem prontamente assimilados, em uma escala mais manejável. Facilitando a comparação e análise de soluções no contexto ácido-base.
Dessa forma, uma concentração de 0,01 mol do íon hidrogênio (H+) por litro de solução póde sêr escrita da seguinte forma.
pH = −log (0,01)
pH = −log (10−2)
pH = − (−2)
pH = 2
É importante frisar quê essa escala, por estar associada a um sistema em equilíbrio químico, deve sêr dada sempre em relação a uma determinada tempera-túra (normalmente, à tempera-túra ambiente de 25 °C).
Página duzentos e noventa e dois
As bases formam soluções chamadas de alcalinas. O quê define a basicidade, ou a alcalinidade, de uma solução é a concentração do íon hidróxido [OH−], quê, por sua vez, depende da concentração da base e de sua fôrça (assim como os ácidos, há bases fortes e fracas).
A concentração do íon OH−, chamado hidroxila, também póde chegar a valores da ordem de 10−14. Por isso, a função logarítmica utilizada, nesse caso, é expressa em termos de pOH.
pOH = −log [OH−]
Escalas de pH e pOH
A á gua também apresenta um equilíbrio de ionização, pois suas moléculas estão em constante movimento, chocando-se freqüentemente. Uma parte pequena delas se quebra formando íons hidrogênio (H+) e hidróxido (OH−). Esse equilíbrio póde sêr representado pela equação química.
H2O((éli)") ⇌ H+(aq) + OH−(aq)
Esse equilíbrio é descrito por uma constante chamada produto iônico da á gua (Kw) (em quê w corresponde a water, quê significa “água” em inglês), sêndo representado pela equação.
Kw = [H+] ⋅ [OH−]
Nessa equação, a concentração da á gua não aparece, pois, em soluções aquosas, ela é considerada constante e está incluída no valor de Kw.
Como qualquer outra constante de equilíbrio, Kw depende da tempera-túra e, à tempera-túra ambiente (25 °C), tem valor igual a 1,0 ⋅ 10−14.
Assim, se a concentração do íon hidrogênio na solução for conhecida, será possível determinar a concentração de íons hidróxidos, e vice-versa. Aplicando, nessa equação, o logaritmo na base decimal e multiplicando os dois lados por −1, verifica-se o seguinte cálculo.
−log (1,0 ⋅ 10−14) = −log ([H+] ⋅ [OH−])
−log (1,0 ⋅ 10−14) = −log [H+] − (−log [OH−])
14 = pH + pOH
Por causa do equilíbrio de autoionização da á gua, mesmo uma amostra de á gua pura contém pequenas quantidades dos íons H+ e OH−. Se as concentrações dos dois íons forem iguais, os valores de pH e pOH também serão iguais. Dessa forma, pode-se substituir o pOH por pH:
pH = 14 − pH
2 pH = 14
pH = 7 = pOH
Diz-se quê uma solução a 25 °C, com valor de pH (ou pOH) igual a 7, é neutra, pois tem quantidades iguais de íons H+ e OH−. Soluções ácidas têm pH menor do quê 7, e soluções básicas têm pH maior do quê 7. O inverso é válido para os valores de pOH. Essas informações estão resumidas a seguir.
Valores de pH e pOH em função das concentrações dos íons H+ e OH−
pH |
pOH |
Classificação da solução |
Balanço hidrogênio/hidróxido |
|---|---|---|---|
= 7 |
= 7 |
Neutra |
[H+] = [OH−] |
< 7 |
> 7 |
Ácida |
[H+] > [OH−] |
> 7 |
< 7 |
Básica |
[H+] < [OH−] |
Página duzentos e noventa e três
Não é apenas a á gua pura quê póde sêr neutra. Se as concentrações de H+ e OH− em qualquer solução forem iguais, o pH será 7. Apesar de os valores de pH e pOH poderem atingir magnitudes negativas ou maiores do quê 14, essas situações não são comuns. Por isso, a escala de pH varia de 0 até 14, pois é nesse intervalo quê se encontram a grande maioria das soluções naturais ou preparadas em laboratório.
Vale destacar quê a espécie química íon hidrogênio H+ dificilmente existe em solução aquosa, porque ela se associa a moléculas de á gua, formando íons hidrônio (H3O+).
Atualmente, a escala de pH se aplica a uma vasta gama de processos. Por causa das possíveis variações nos processos de medição e nas condições do equilíbrio químico, as concentrações de H+ e de OH− não devem sêr associadas a um único valor da escala, e sim a faixas de valores de pH.
Faixas de pH de alguns materiais
Solução ou fluido |
Faixa de pH a 25 °C |
|---|---|
Suco gástrico |
De 1,6 a 1,8 |
Urina |
De 5,5 a 7,5 |
Saliva |
De 6,2 a 7,4 |
sangue |
De 7,35 a 7,45 |
Bile |
De 7,8 a 8,6 |
Suco de limão |
De 2,8 a 3,4 |
Café |
De 4,8 a 5,2 |
Leite |
De 6,3 a 6,6 |
Água de torneira |
De 6,5 a 8,0 |
Ovo |
De 7,6 a 8,0 |
Fonte: SACKHEIM, Giórgi I.; LEHMAN, Dennis D. Química e bioquímica para ciências biomédicas. 8. ed. Barueri: Manole, 2001. p. 203.

ESPAÇOS DE APRENDIZAGEM
• A titulação é uma técnica de laboratório utilizada para determinar a concentração desconhecida de uma substância. O vídeo a seguir apresenta uma titulação de ácido clorídrico com hidróxido de sódio.
TITULAÇÃO de ácido clorídrico com hidróxido de sódio em mesma concentração: pHmetro. São Paulo: úspi, 2019. 1 vídeo (6 min). Publicado pelo Portal de videoaulas e-Aulas da Universidade de São Paulo. Disponível em: https:// eaulas.usp.br/portal/video?idItem=23926. Acesso em: 3 out. 2024.
• êste texto apresenta os sistemas-tampão, equilíbrios químicos quê têm a propriedade de resistir a variações de pH causadas por uma diluição ou pela adição de ácidos ou bases.
FIORUCCI, Antônio Rogério; SOARES, Márlon Herbert Flora Barbosa; CAVALHEIRO, Éder Tadeu Gomes. O conceito de solução tampão. Química Nova na Escola, [s. l.], n. 13, p. 18-21, maio 2001. Disponível em: https://livro.pw/tgtid. Acesso em: 3 out. 2024.
Página duzentos e noventa e quatro
FORMAÇÃO CIDADÃ
O equilíbrio químico na formação da amônia
A amônia é amplamente utilizada na produção de fertilizantes nitrogenados adotados em práticas agrícolas ao redor do mundo. Essas substâncias libéram nitrogênio no solo, o qual é absorvido pelas plantas e integrado aos seus processos vitais. Estima-se quê cerca de 90% da amônia produzida globalmente seja destinada à agricultura.
Como comentado no Tema anterior, o processo de síntese da amônia foi aperfeiçoado em escala industrial pelo químico alemão Cal Bosch, em um método quê ficou conhecido como síntese de Haber-Bosch.
Relembre a reação.
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
(delta)"H0 = −92,22 kJ/mol (a 298 K)
A grande inovação trazida pela síntese de Haber-Bosch foi a utilização do gás nitrogênio do ar atmosférico, tornando o processo economicamente viável. Durante a Primeira Guerra Mundial, quando a Alemanha enfrentou dificuldades de importar fertilizantes naturais por causa de embargos, o trabalho dêêsses cientistas foi fundamental para o desenvolvimento de um método de conversão do gás nitrogênio atmosférico em fertilizantes.
Essa é uma das muitas contribuições dos químicos para a ssossiedade: desenvolver soluções quê tornem os processos industriais mais eficientes e sustentáveis.
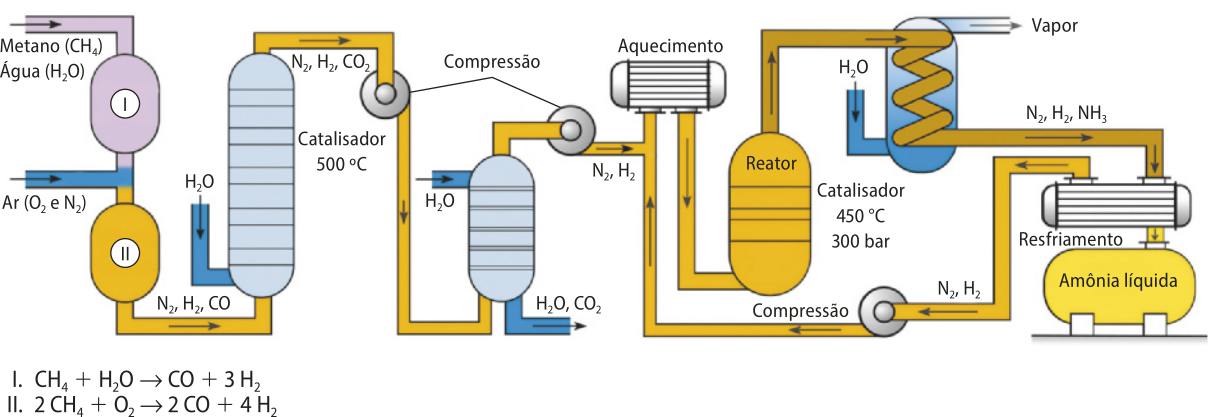
Elaborada com base em: RIBEIRO, Daniel. Processo de Haber-Bosch. Revista de Ciência Elementar, Porto, v. 1, n. 1, p. 68-69, out./dez.2013. p. 69. Disponível em: https://livro.pw/pvohi. Acesso em: 5 out. 2024.
ATIVIDADES
1. Como o desenvolvimento da síntese de Haber-Bosch influenciou o curso da Primeira Guerra Mundial e o avanço da agricultura moderna?
2. Qual é a relação entre o desenvolvimento de um novo processo mais eficiente e econômico para a obtenção de um material e seu preêço no mercado? Quais seriam as possíveis consequências dêêsse avanço para a ssossiedade?
3. Analisando o sistema em equilíbrio de produção da amônia, pesquise como os cientistas Haber e Bosch resolveram o dilema do aumento da produtividade de amônia.
Página duzentos e noventa e cinco
ATIVIDADES
1. Qual é a concentração de HBr(g) em um sistema em equilíbrio no qual as concentrações de H2(g) e Br2(g) são iguais a 0,100 mol/L?
2. Considere a reação em equilíbrio N2O4(g) ⇌ 2 NO2(g) e a constante de equilíbrio igual a 4,0 ⋅ 10−2. Calcule o valor de concentração do tetróxido de dinitrogênio, sabendo quê a concentração de dióxido de nitrogênio é igual a:
a) 1,00 mol/L.
b) 0,500 mol/L.
3. Considere as reações em equilíbrio representadas pelas equações a seguir. Em quê sentido o equilíbrio será deslocado se a pressão do sistema for aumentada? Justifique cada caso.
a) I2(g) ⇌ 2 I(g)
b) H2(g) + C(éli)"2(g) ⇌ 2 HC(éli)"(g)
c) 2 SO2(g) + O2(g) ⇌ 2 SO3(g)
4. Considere o equilíbrio descrito pela equação.
2 SO2(g) + O2(g) ⇌ 2 SO3(g)
Dados os valores de constante de equilíbrio a diferentes tempera-túras, defina se a reação diréta é endotérmica ou exotérmica e justifique.
Temperatura |
Valores de Kc |
|---|---|
300 K |
9,9 ⋅ 1025 |
400 K |
1,0 ⋅ 1012 |
500 K |
1,7 ⋅ 106 |
5. Quais são os valores de pH e pOH de uma solução de ácido clorídrico com concentração de 0,10 mol/L e de uma solução de ácido acético com a mesma concentração?
6. Em seu caderno, elabore um texto apresentando a importânssia do princípio de Le Châtelier para a indústria.
7. Considere o gráfico apresentado a seguir. Em seguida, responda ao quê se pede.
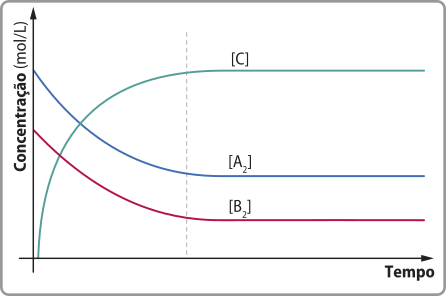
Fonte: dados fictícios.
a) dêz-creva o quê acontece com a concentração dos reagentes e do produto ao longo do tempo.
b) Em seu caderno, faça uma representação gráfica da concentração das substâncias em função do tempo, no qual seja possível observar o quê acontece após adição de um catalisador.
8. Um aquarista realizou um teste de pH em um dos seus aquários onde vivem peixes chamados tetra negro (Gymnocorymbus ternetzi). Esses peixes estão acostumados com um ambiente com pH entre 6,0 e 7,0. Na amostra da á gua, ele utilizou o indicador azul de bromotimol, substância quê muda de côr a depender do pH da solução. Ela tem côr amarelo intenso em pH ácido, começa a mudar de côr em uma faixa de pH de 6,0 a 7,6 (chamada de intervalo de viragem) e passa por um vêrde até um azul-escuro em pH básico.
a) Considerando quê a côr da amostra ficou azulada, qual orientação você apresentaria para o aquarista?
b) Analisando a escala de pH (0 a 14), apresente as faixas de valores de pH para as cores apresentadas: amarelo, vêrde e azul.

Página duzentos e noventa e seis
ORGANIZANDO AS IDEIAS
Analise o esquema a seguir, quê apresenta e relaciona os principais conceitos estudados nesta Unidade.
A relação entre os conceitos é uma característica do conhecimento formal, científico e escolar. Aqui, apresenta-se uma síntese esquemática dos principais conceitos trabalhados nesta Unidade. No caderno, elabore seu próprio esquema, organizando os principais conceitos da Unidade, incluindo nele outros termos e outras ideias quê se relacionam ao quê foi estudado e realizando as associações quê considerar importantes. Por fim, elabore um pequeno texto conectando os conceitos e as ideias presentes no esquema. Essa é uma boa forma de estudar e compreender melhor os conceitos.
Página duzentos e noventa e sete
ATIVIDADES COMPLEMENTARES
Respostas e comentários estão disponíveis nas Orientações para o professor.
Tema 19 – Química e energia
1. (UFBA) Em relação aos aspectos energéticos envolvidos nas transformações químicas, pode-se afirmar:
a) a queima da parafina de uma vela exemplifica um processo endotérmico.
b) a vaporização da á gua de uma piscina pela ação da luz solar exemplifica um processo endotérmico.
c) a combustão do áucôl hidratado em motores de automóveis exemplifica um processo endotérmico.
d) a formação de um aicibérg a partir da á gua do mar exemplifica um processo endotérmico.
e) o valor de (delta)"H de uma transformação depende exclusivamente do estado físico dos reagentes.
Resposta: b)
2. (UFRRJ) Desde a pré-história, quando aprendeu a manipular o fogo para cozinhar seus alimentos e se aquecer, o homem vêm percebendo sua dependência cada vez maior das várias formas de energia.
Existem reações químicas quê ocorrem com liberação ou absorção de energia, sôbi a forma de calor, denominadas, respectivamente, como exotérmicas e endotérmicas.
Observe o gráfico a seguir e assinale a alternativa correta:
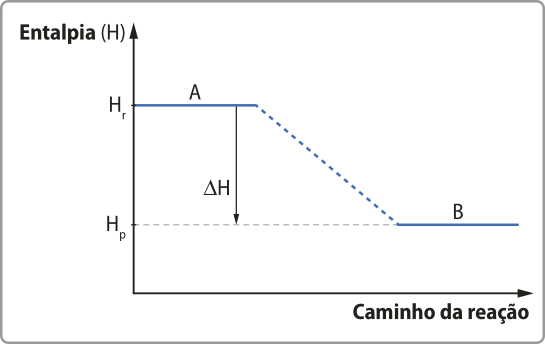
a) O gráfico representa uma reação endotérmica.
b) O gráfico representa uma reação exotérmica.
c) A entalpia dos reagentes é igual à dos produtos.
d) A entalpia dos produtos é maior quê a dos reagentes.
e) A variação de entalpia é maior quê zero.
Resposta: b)
Tema 20 – Entalpia e lei de Hess
3. (Enem/MEC) O aproveitamento de resíduos florestais vêm se tornando cada dia mais atrativo, pois eles são uma fonte renovável de energia. A figura representa a queima de um bio-óleo extraído do resíduo de madeira, sêndo (delta)"H1 a variação de entalpia devido à queima de 1 g dêêsse bio-óleo, resultando em gás carbônico e á gua líquida, e (delta)"H2 a variação de entalpia envolvida na conversão de 1 g de á gua no estado gasoso para o estado líquido.
A variação de entalpia, em kJ, para a queima de 5 g dêêsse bio-óleo resultando em CO2(gasoso) e H2O(gasoso) é:
a) −106.
b) −94,0.
c) −82,0.
d) −21,2.
e) −16,4.
Resposta: c)
4. (Enem/MEC) Nas últimas dékâdâs, o efeito estufa tem-se intensificado de maneira preocupante, sêndo esse efeito muitas vezes atribuído à intensa liberação de CO2 durante a queima de combustíveis fósseis para geração de energia. O qüadro traz as entalpias-padrão de combustão a 25 °C ((delta)"H) do metano, do butano e do octano.
Página duzentos e noventa e oito
Composto |
Fórmula Molecular |
Massa molar |
DH |
|---|---|---|---|
metano |
CH4 |
16 |
890 |
butano |
C4H10 |
58 |
2.878 |
octano |
C8H18 |
114 |
5.471 |
À medida quê aumenta a consciência sobre os impactos ambientais relacionados ao uso da energia, cresce a importânssia de se criar políticas de incentivo ao uso de combustíveis mais eficientes. Nesse sentido, considerando-se quê o metano, o butano e octano sêjam representativos do gás natural, do gás liquefeito de petróleo (GLP) e da gasolina, respectivamente, então, a partir dos dados fornecidos, é possível concluir quê, do ponto de vista da quantidade de calor obtído por mol de CO2 gerado, a ordem crescente dêêsses três combustíveis é
a) gasolina, GLP e gás natural.
b) gás natural, gasolina e GLP.
c) gasolina, gás natural e GLP.
d) gás natural, GLP e gasolina.
e) GLP, gás natural e gasolina.
Resposta: a)
Tema 21 – Cinética química
5. (Enem/MEC) Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
1. A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações quê contribuem para a degradação de certos alimentos.
2. Um procedimento muito comum utilizado em práticas de culinária é o kórti dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão.
3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas quê aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores quê influenciam a rapidez das transformações químicas relacionadas aos exemplos 1, 2 e 3, respectivamente?
a) Temperatura, superfícíe de contato e concentração.
b) Concentração, superfícíe de contato e catalisadores.
c) Temperatura, superfícíe de contato e catalisadores.
d) Superfície de contato, tempera-túra e concentração.
e) Temperatura, concentração e catalisadores.
Resposta: c)
Tema 22 – Catálise
6. (UEG-GO) Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos quê serão formados. O gráfico a seguir representa um diagrama de variação de energia de uma reação química hipotética em quê a mistura dos reagentes A e B levam à formação dos produtos C e D.
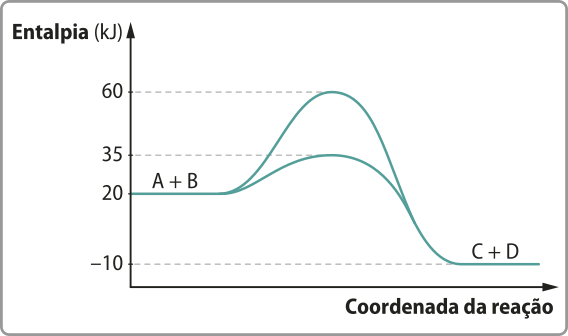
Com base no diagrama, no sentido direto da reação, conclui-se quê a:
a) energia de ativação da reação sem o catalisador é igual a 15 kJ.
b) energia de ativação da reação com o catalisador é igual a 40 kJ.
c) reação é endotérmica.
d) variação de entalpia da reação é igual a −30 kJ.
Resposta: d)
Página duzentos e noventa e nove
Tema 23 – Equilíbrio químico
7. (Enem/MEC) A formação de estalactites depende da reversibilidade de uma reação química. O carbonato de cálcio (CaCO3) é encontrado em depósitos subterrâneos na forma de pedra calcária. Quando um volume de á gua rica em CO2 dissolvido infiltra-se no calcário, o minério dissolve-se formando íons Ca2+ e . Numa segunda etapa, a solução aquosa dêêsses íons chega a uma caverna e ocorre a reação invérsa, promovendo a liberação de CO2 e a deposição de CaCO3, de acôr-do com a equação apresentada.
Ca2+ (aq) + 2 (aq) ⇌ CaCO3(s) + CO2(g) + H2O((éli)")
(delta)"H = +40,94 kJ/mol
Considerando o equilíbrio quê ocorre na segunda etapa, a formação de carbonato será favorecida pelo(a):
a) diminuição da concentração de Íons OH− no meio.
b) aumento da pressão do ar no interior da caverna.
c) diminuição da concentração de no meio.
d) aumento da tempera-túra no interior da caverna.
e) aumento da concentração de CO2 dissolvido.
Resposta: d)
8. (UEPG-PR) Considerando a equação em equilíbrio, de síntese do SO3:
2 SO2(g) + O2(g) ⇌ 2 SO3(g)
As constantes de equilíbrio, Kc, para essa reação em diferentes tempera-túras são as seguintes:
Kc |
Temperatura (K) |
|---|---|
100 |
1.000 |
2 |
1.200 |
Com base nessa equação e nos fatores quê podem afetar seu equilíbrio, indique as alternativas corretas. A resposta é a soma dos números correspondentes às alternativas corretas.
01 Para melhorar o rendimento dessa reação pode-se diminuir a concentração de SO2(g) ou de O2(g).
02 Para quê essa reação atinja o equilíbrio mais rapidamente, pode-se aumentar a concentração de SO2(g) ou de O2(g).
04 Para melhorar o rendimento dessa reação pode-se aumentar o volume do recipiente em quê a reação ocorre e, desta forma, diminuir a pressão.
08 A síntese do SO3 é uma reação exotérmica.
16 Para melhorar o rendimento dessa reação deve-se abaixar a tempera-túra.
Resposta: 08 e 16)
Tema 24 – Sistemas em equilíbrio
9. (Enem/MEC) A tabéla lista os valores de pH de algumas bebidas consumidas pela população.
Bebida |
pH |
|---|---|
Refrigerante |
5,0 |
Café |
3,0 |
Vinho |
4,5 |
Suco de limão |
2,5 |
Chá |
6,0 |
O esmalte dos dentes é constituído de hidroxiapatita (Ca5(PO4)3OH), um mineral quê sofre desmineralização em meio ácido, de acôr-do com a equação química:
Ca5 (PO4)3 OH(s) ⇌ 5 Ca+ (aq) + 3 (aq) + OH− (aq)
Das bebidas listadas na tabéla, aquela com menor potencial de desmineralização dos dentes é o:
a) chá.
b) café.
c) vinho.
d) refrigerante.
e) suco de limão.
Resposta: a)
Página trezentos
INTEGRANDO COM...
BIOLOGIA E MATEMÁTICA
Homeostase ácido-base
É comum as pessoas dizerem quê é preciso ter uma vida e uma alimentação equilibradas; quê é preciso manter o equilíbrio entre o trabalho e/ou o estudo, o descanso e o lazer.
Note quê a palavra equilíbrio, nesses contextos, tem relação com uma boa qualidade de vida.
Segundo os níveis de organização abordados na Química e na Biologia, sabe-se quê o corpo é formado de hátomus, moléculas, organelas, células, tecídos, órgãos e sistemas.
Será quê existe equilíbrio nesses níveis de organização do corpo humano? Como a Química póde ajudar a entender essa dinâmica?
Compreendendo a homeostase
A homeostase é a capacidade do organismo de manter seu meio interno em equilíbrio, mesmo diante das mudanças constantes do ambiente externo. Esse equilíbrio envolve tanto condições físicas quanto químicas, como a regulação da tempera-túra corporal.
Quando ocorre um desequilíbrio no meio interno, a homeostase é alterada, o quê póde levar ao desenvolvimento de doenças e, em casos extremos, à falência de sistemas do organismo. O corpo humano tem mecanismos para resistir às variações do ambiente, mas nem sempre consegue se adaptar a todas as mudanças. Entre os muitos equilíbrios quê o corpo busca manter, um dos mais importantes é o equilíbrio ácido-base.
A Química na homeostase
O equilíbrio ácido-base está diretamente relacionado ao pH do corpo humano, e o organismo é altamente sensível a qualquer alteração nesse parâmetro. O corpo possui mecanismos sofisticados para regular o pH, quê atuam em um processo conhecido como homeostase ácido-base.
A concentração de íons hidrogênio [H+] é um indicador crítico da saúde do organismo. Exames médicos específicos podem medir o pH do sangue, e qualquer desvio dêêsse valor póde estar associado a condições como diabetes mellitus, enfisema pulmonar, entre outras doenças.
Página trezentos e um
O pH do sangue humano
O sangue humano mantém uma faixa ideal de pH entre 7,35 e 7,45, quê é fundamental para o funcionamento adequado do metabolismo e para a estabilidade do organismo.
Quando o pH do sangue está abaixo de 7,35, ocorre um distúrbio chamado de acidose, quê póde sêr resultado de um acúmulo excessivo de ácidos ou de uma perda significativa de bicarbonato. A acidose também póde sêr causada por altos níveis de dióxido de carbono no sangue, geralmente em razão de problemas respiratórios.
Quando o pH está acima de 7,45, ocorre um distúrbio chamado de alcalose. Essa condição póde sêr causada por vômitos prolongados, desidratação, ingestão de substâncias alcalinas ou desequilíbrios respiratórios quê levam à eliminação excessiva de dióxido de carbono.
ESPAÇOS DE APRENDIZAGEM
• No vídeo a seguir, você encontra informações sobre os efeitos da á gua alcalina no organismo.
ÁGUA alcalina muda o pH do sangue? [S. l.: s. n.], 2024. 1 vídeo (5 min). Publicado pelo canal RenalClinic: Dr.ª Simone Oliveira. Disponível em: https://livro.pw/zyoiv. Acesso em: 20 out. 2024.
A matemática do pH: a função logarítmica
A Matemática desempenha um papel fundamental na Química, especialmente no cálculo do pH, quê se baseia na função logarítmica. Essa função é essencial para trabalhar com grandezas quê varíam em ampla escala, pois facilita operações matemáticas compléksas, como transformar multiplicações em adições, tornando os cálculos mais simples e eficientes.
Agora, faça o quê se pede em cada item.
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Você leu no texto quê o pH adequado para o sangue humano está entre 7,35 e 7,45. Assim, o pH do sangue humano é ácido ou básico? Calcule a faixa da concentração de íons hidrogeniônicos considerada normal para o sangue humano.
2. A alcalose e a acidose respiratória estão diretamente relacionadas com a concentração de dióxido de carbono no sangue. Faça uma pesquisa sobre o tema e indique como o dióxido de carbono póde provocar a acidez ou a alcalinidade do sangue. Em seguida, escrêeva a reação química quê representa essas situações.
Página trezentos e dois