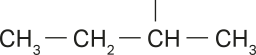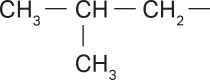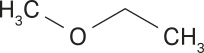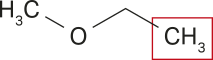UNIDADE
5
QUÍMICA ORGÂNICA
Da criação de materiais, como plásticos biodegradáveis e medicamentos inovadores, ao entendimento de fenômenos naturais e estruturas biológicas, a Química Orgânica desempenha um papel fundamental na Ciência e na tecnologia modernas. As formigas, por exemplo, conseguem sair e voltar para o formigueiro de maneira eficiente porque se guiam por substâncias orgânicas, chamadas feromônios, quê ficam impregnadas no caminho. Na imagem, formigas-cortadeiras (Acromyrmex sp.), conhecidas também como quenquéns ou formigas-caiapó, carregam pedaços de fô-lhas para o formigueiro, onde esse e outros materiais de origem vegetal, como flores e grãos, são utilizados como substrato para o cultivo de fungos, a principal fonte de alimento das formigas.

Página trezentos e três
• Você acha quê a Química Orgânica se baseia em conceitos diferentes dos quê você estudou até agora?
Respostas e comentários estão disponíveis nas Orientações para o professor.
Página trezentos e quatro
TEMA
25
Introdução à Química Orgânica
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
A Química Orgânica é a área da Química quê estuda as substâncias constituídas por hátomus de carbono, sêndo elas produzidas por sêres vivos ou não. Essa definição póde parecer restrita, mas a diversidade de substâncias formadas pela combinação de hátomus de carbono é grande e inclui também hátomus de outros elemêntos químicos, como hidrogênio, oxigênio, nitrogênio, enxofre e halogênios.
Para compreender melhor essas substâncias, o estudo dêste Tema tratará da origem da Química Orgânica, das características do átomo de carbono e das diferentes formas de representação das cadeias carbônicas.
O início da Química Orgânica
Desde a Antigüidade, o sêr humano usa materiais quê hoje são estudados pela Química Orgânica, como corantes, óleos, ceras e perfumes. Uma das primeiras substâncias orgânicas purificadas foi o etanol (álcool etílico), quê era destilado e desidratado por alquimistas.
Por causa de dificuldades experimentais e da relativa facilidade com quê as substâncias orgânicas se degradam, entre outros fatores, o estudo a respeito dessas substâncias era complékso e difícil. Aos poucos, no entanto, uma quantidade crescente de substâncias orgânicas foi isolada e estudada, até quê, no século XVIII, essa quantidade se tornou significativa. Nesse período, as substâncias eram classificadas em orgânicas (de origem vegetal e animal) ou inorgânicas (de origem mineral).
A falta de resultado nas tentativas de síntese de substâncias orgânicas, usando substâncias inorgânicas como reagentes, levou ao conceito de quê os sêres vivos teriam algo quê não existia nos minerais: uma fôrça vital, explicada pela teoria da fôrça vital.
REFLITA
1 Cite substâncias quê você conhece quê contêm carbono.

Página trezentos e cinco
Um dos principais responsáveis pela divulgação dêêsse conceito, em 1807, foi o químico sueco Berzelius. Segundo ele, as substâncias orgânicas não poderiam sêr sintetizadas em laboratório por serem regidas por leis diferentes das quê regiam as substâncias inorgânicas.
Costuma-se atribuir a um discípulo de Berzelius, o químico alemão fridichi Wöhler (1800-1882), um papel decisivo na refutação dessa teoria ao ter conseguido sintetizar a ureia a partir de cianato de amônio. Assim, em 1828, a ureia se tornou a primeira substância OR GÂNICA ôbitída a partir de uma substância inorgânica.

No entanto, ao fazer essa associação, fica subentendida a ideia de quê os cientistas dessa época não tí-nhão dúvidas quanto à classificação do cianato de amônio como uma substância inorgânica e quê os conceitos de substâncias químicas orgânicas e inorgânicas eram claros e amplamente aceitos.
A teoria da fôrça vital não era uma doutrina interpretada por todos da mesma maneira, ou seja, havia várias acepções a respeito da fôrça vital. A seguir, o trecho do texto aborda o episódio da síntese da ureia e as interpretações relacionadas à teoria da fôrça vital.
[…] Apenas para citar algumas concepções, uma delas sugeria quê os sêres vivos poderiam produzir compostos orgânicos, devido a seu alto grau de instabilidade e da complexidade de sua composição. Outra considerava quê as transformações orgânicas eram governadas por forças diferentes das quê governavam as transformações inorgânicas. Uma terceira sugeria quê a afinidade química era responsável pelas transformações inorgânicas e a fôrça vital era responsável pelas transformações orgânicas. […]
Considerando a variedade e abrangência dessa doutrina, um único experimento não seria suficiente para levar a seu abandono – mesmo porque, muitos de seus desdobramentos não tí-nhão qualquer relação com a síntese feita por Wöhler. O próprio Jöns Jacob Berzelius, por exemplo, escreveu na primeira seção do seu Lehrbuch der Chemie, já em 1847, quê na natureza viva os elemêntos parecem obedecer a leis diferentes dos materiais inorgânicos – evidenciando que nêm mesmo entre os químicos a síntese da ureia abalou, ou muito menos derrubou, o vitalismo. […]
As historiadoras da ciência B. Bensaude-Vincent e I. Stengers declaram, em livro de divulgação, quê muitos pesquisadores da época consideravam relevante quê o cianato de amônio não era preparado a partir de substâncias elementares, mas por oxidação de um cianeto proveniente de cascos e chifres de animais; logo, a origem inorgânica do reagente poderia sêr posta em questão.
O pesquisador J. H. Brooke sugeriu quê o próprio conceito de compôzto orgânico era problemático, não existindo uma linha bem definida para separar todos os compostos químicos em dois grupos distintos. […]
VIDAL, Paulo Henrique; PORTO, Paulo Alves. Algumas contribuições do episódio histórico da síntese artificial da ureia para o ensino de química. História da ciência e ensino: construindo interfaces, São Paulo, v. 4, p. 13-23, 2011. p. 16-17. Disponível em: https://livro.pw/jgykt. Acesso em: 4 out. 2024
A Ciência se desen vólve de maneira lenta e gradual, e as mudanças resultam de um trabalho coletivo, e não de um trabalho individual produzido por um único cientista.
Com o tempo, outras sínteses de moléculas orgânicas ocorreram, demonstrando quê não havia distinção entre as substâncias orgânicas e as inorgânicas, a não sêr na composição de cada uma delas.
Página trezentos e seis
Em 1858, o químico alemão fridichi August Kekulé definiu a Química Orgânica como a química das substâncias de carbono. Segundo o próprio relato, durante um cochilo, ele teve um sonho com hátomus quê saltavam à sua frente. Átomos menóres se uniam em pares, e hátomus maiores abraçavam esses hátomus menóres, unindo-se a outros e formando conjuntos quê rodopiavam diante dele. Depois díssu, Kekulé debruçou-se sobre o assunto e chegou à proposição de quê os hátomus de carbono se ligariam por meio de cadeias. Além díssu, considerou quê poderia havêer mais de um tipo de ligação entre hátomus de carbono e outros elemêntos, como o oxigênio, fato confirmado posteriormente.
Propriedades do átomo de carbono
O átomo de carbono é relativamente pequeno e tem seis prótons, seis nêutrons e seis elétrons. Seus seis elétrons estão distribuídos em dois níveis de energia: dois elétrons na camada K e quatro elétrons na camada L. Essa configuração possibilita quê os hátomus de carbono formem quatro ligações covalentes e, dessa maneira, completem a camada L até o total de oito elétrons, ficando com configuração eletrônica similar ao neônio.
Uma característica importante do átomo de carbono é a possibilidade de se ligar a outros hátomus do mesmo elemento, formando cadeias quê podem variar de dois a milhares de hátomus, e a hátomus de outros elemêntos, como o hidrogênio, o oxigênio e o nitrogênio.
Um átomo de carbono também póde formár cadeias fechadas e estabelecer duas ou três ligações com outro átomo de carbono, aumentando a diversidade das substâncias orgânicas. Diante de todas as possibilidades de ligação do átomo de carbono, são conhecidas mais de 10 milhões substâncias orgânicas diferentes, de origem animal, vegetal, mineral ou sintética.
REFLITA
2 Outros elemêntos podem se comportar como o carbono, formando cadeias?
AlGO A+
O urucum
Entre as muitas características culturais das etnias indígenas brasileiras, a pintura côrporal é uma das mais marcantes. Um dos pigmentos mais comuns, de cor vermelha intensa, é obtído da semente do urucum, planta muito encontrada no Brasil. A principal substância responsável pela côr da semente é chamada bixina, um pigmento natural cuja molécula contém 25 hátomus de carbono, 30 hátomus de hidrogênio e quatro hátomus de oxigênio em sua estrutura.

ESPAÇOS DE APRENDIZAGEM
• Esta reportagem apresenta os Jogos Indígenas, um tradicional evento esportivo do município de Avaí (SP) quê reúne seis aldeias e mais de 200 indígenas em competições com arco e flecha, zarabatana e corrida com tora.
REUNINDO seis aldeias, 5ª edição dos Jogos Indígenas tem início em Avaí. [S. l.]: Globoplay, 2022. 1 vídeo (2 min). Publicado pelo canal TEM Notícias 2ª Edição: Bauru/Marília. Disponível em: https://livro.pw/rnzqw. Acesso em: 21 out. 2024.
Página trezentos e sete
As características do átomo de carbono foram apresentadas, de maneira sistemática e independente, por três químicos contemporâneos: o alemão Kekulé, o russo Aleksandr Mikhaylovich Butlerov (1828-1886) e o escocês Archibald scót Couper (1831-1892).
Butlerov foi um químico russo quê se interessou desde o início de seus estudos pela Química Orgânica, buscando a síntese de diferentes substâncias. Em uma viagem pela Europa, trabalhou com outros pesquisadores e, motivado a compreender a estrutura das moléculas, voltou à Rússia para continuar sua pesquisa. Butlerov foi um dos primeiros a utilizar o termo estrutura química com o atual sentido empregado.
O escocês Couper inicialmente estudou Filosofia e idiomas. Depois de se tornar químico, foi o primeiro a representar as ligações entre hátomus com linhas desenhadas entre símbolos, linguagem utilizada até hoje. Couper descreveu como os hátomus de carbono se ligariam em um artigo científico e o confiou a um colega para apresentá-lo à Academia Francesa de Ciências. No entanto, por causa de um adiamento na apresentação, o artigo só foi lido depois da publicação de um artigo de Kekulé com ideias similares.
Resumidamente, as ideias dêêsses químicos podem sêr expressas pêlos seguintes princípios.
• O carbono é tetravalente, ou seja, faz quatro ligações químicas com outros hátomus.
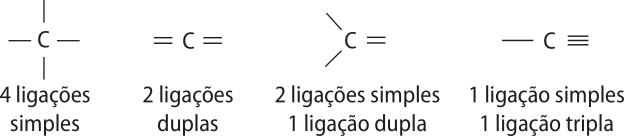
• As ligações do átomo de carbono são equivalentes e não se distinguem umas das outras, a não sêr pelo fato de poderem sêr duplas ou triplas.
• Os hátomus de carbono podem fazer ligações entre si, formando cadeias quê podem sêr longas e ramificadas e podem incluir hátomus de outros elemêntos químicos.
Representação das cadeias carbônicas
A diversidade de substâncias cujas espécies químicas são formadas por hátomus de carbono exigiu novas formas de representá-las.
A fórmula molecular usada para representar as substâncias inorgânicas, quê não necessita de muitas informações, não é suficiente para representar as substâncias orgânicas.
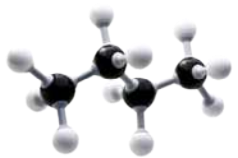
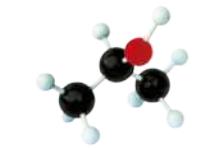
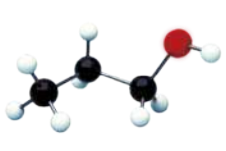
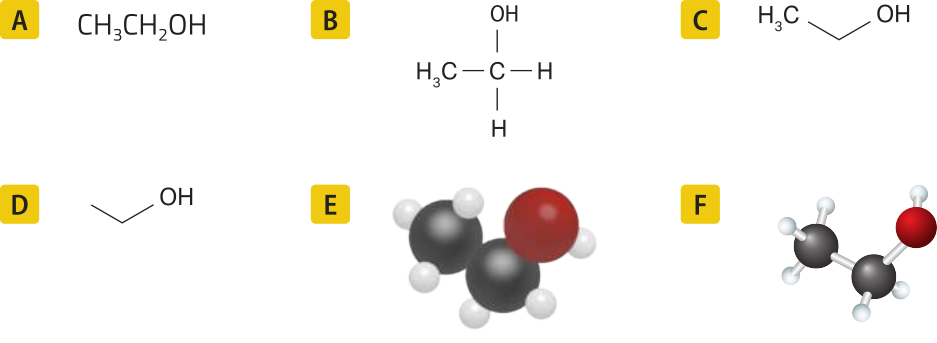
As seis maneiras mais comuns de representar moléculas orgânicas são exemplificadas a seguir por meio do etanol (C2 H5 OH).
Página trezentos e oito
A figura A é uma forma expandida da fórmula química quê representa a molécula carbono a carbono, incluindo elemêntos diferentes, d fórma linear, sem incluir as ligações químicas.
A figura B representa a estrutura da molécula de modo plano, incluindo seus hátomus e todas as ligações, mas sem indicar como estão organizados no espaço.
A figura C omite os hátomus de carbono e de hidrogênio da cadeia carbônica, quê são representados pêlos vértices das linhas. Entretanto, os hátomus presentes nas extremidades da molécula, tanto os de carbono quanto os de outros elemêntos, ficam evidentes.
Esse mesmo princípio é utilizado na figura D, em quê são omitidos também os carbonos nas extremidades da molécula.
Nas figuras E e F, os hátomus de carbono (preto), hidrogênio (branco) e oxigênio (vermelho) são representados por esferas. Na figura E, há interseção entre as esferas, representando a sobreposição das eletrosferas dos hátomus nas ligações químicas. A figura F mostra bastões para representar as ligações químicas.
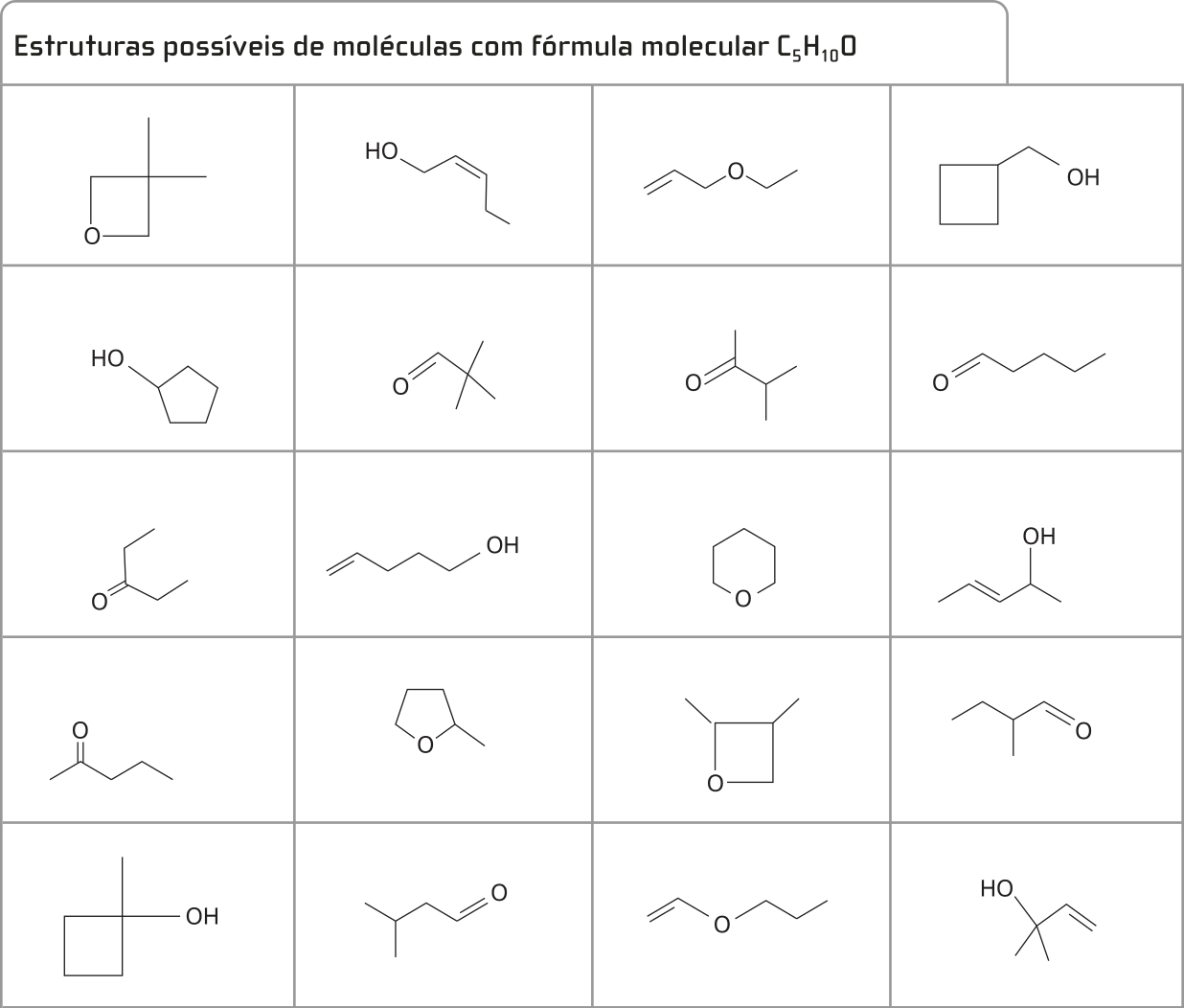
Para entender melhor a vasta diversidade de substâncias orgânicas, as figuras a seguir representam algumas das diferentes possibilidades de substâncias com a fórmula molecular C5 H10 O.
Página trezentos e nove
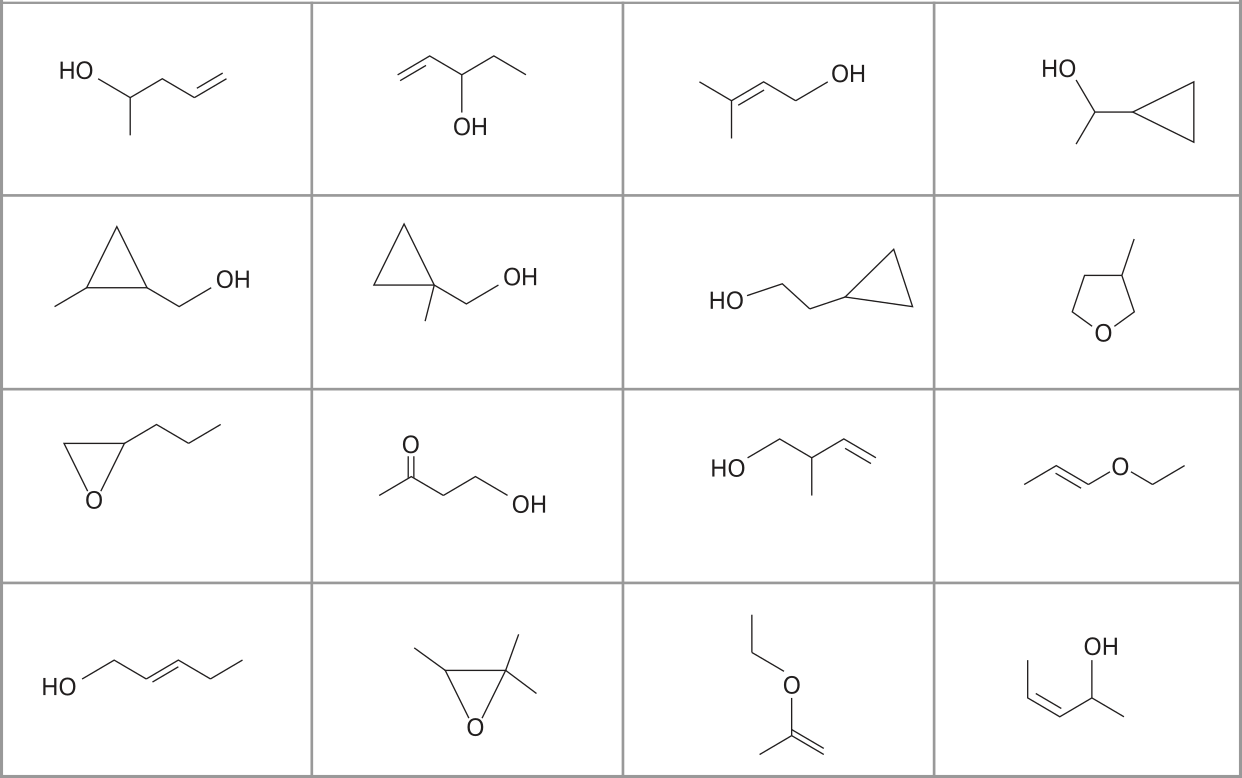
Outra importante representação visual, denominada representação em cunha, é responsável por indicar se a ligação está à frente do plano ou atrás dele. Como exemplo, apresenta-se a estrutura do metano, em quê o carbono 1 e os hidrogênios 2 e 3 estão no mesmo plano do papel, o hidrogênio 4 está projetado para frente, no sentido do leitor, e o hidrogênio 5 está projetado atrás do plano do papel.
ATIVIDADES
1. Faça uma pesquisa, em livros e na internet, sobre a composição química do corpo humano. Responda no caderno: quais são os elemêntos químicos presentes no corpo humano?
2. Pesquise, em livros, revistas e na internet, a biografia de cientistas quê contribuíram para o princípio do desenvolvimento da Química Orgânica.
3. O quê representa uma linha como esta?

4. Analise as estruturas da fórmula C5H10O apresentadas anteriormente e tente propor critérios quê possam sêr utilizados para diferenciar grupos de substâncias cujas moléculas estão representadas.
5. Observe os nomes de algumas substâncias orgânicas e suas respectivas fórmulas moleculares: ácido acético (CH3COOH), acetona (C3H6O), glicose (C6H12O6) e benzeno (C6H6). Quais são as informações sobre a molécula quê podem sêr obtidas com base na fórmula molecular? Esse tipo de representação é suficiente para conhecer a molécula?
Página trezentos e dez
TEMA
26
Os hidrocarbonetos
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O petróleo é conhecido desde a Antigüidade por suas propriedades como combustível e por sua hidrofobicidade, ou seja, sua capacidade de repelir a á gua, de não se misturar a ela.
A teoria mais aceita para a origem do petróleo é a de quê ele se formou há milhões de anos pela decomposição de matéria OR GÂNICA por bactérias anaeróbicas. Essa matéria OR GÂNICA foi sedimentada, e a alta pressão e a tempera-túra elevada exercidas sobre ela provocaram uma série de reações químicas quê levaram à formação dêêsse compôzto.
Além do uso como combustível, o petróleo é a matéria-prima de inúmeros produtos, sêndo considerado um material bastante importante e de muito valor na ssossiedade atual.
O petróleo é constituído de uma mistura de hidrocarbonetos – compostos orgânicos formados apenas por carbono e hidrogênio – e de outras substâncias, como enxofre.
Apesar de os hidrocarbonetos serem formados apenas por dois elemêntos químicos, podem apresentar ligações simples, duplas ou triplas, além de cadeias abertas e fechadas, normais ou ramificadas. Dessa forma, os hidrocarbonetos são classificados em: alcanos; alcenos; alcinos; alcadienos; cicloalcanos; cicloalcenos; aromáticos.
Nêste Tema, esses tipos de hidrocarboneto serão abordados.

Página trezentos e onze
Alcanos
REFLITA
1 Você conhece alguma substância usada no cotidiano quê só contenha hátomus de carbono e de hidrogênio?
Os alcanos, também chamados de parafinas, são hidrocarbonetos de cadeia aberta formados apenas por ligações simples.
O alcano mais simples é o metano, substância gasosa à tempera-túra de 25 °C e à pressão atmosférica, cujas moléculas são formadas por um átomo de carbono ao qual estão ligados quatro hátomus de hidrogênio. Sua fórmula molecular é CH4.
No Tema anterior, foram apresentadas algumas maneiras de representar moléculas orgânicas. Acompanhe três delas para a molécula de metano.
O metano é uma substância natural, produzida pela decomposição de matéria OR GÂNICA em depósitos de resíduos sólidos ou em pântanos, podendo sêr liberada também em erupções vulcânicas, no processo de extração de petróleo e carvão e no processo de digestão dos animais herbívoros. Ele póde sêr utilizado como combustível, sêndo o principal constituinte do gás natural veicular (GNV).
Outros exemplos de alcanos são apresentados a seguir.

Página trezentos e doze
Analisando as representações anteriores, é possível perceber quê a quantidade total de hátomus de hidrogênio é o dôbro da quantidade de carbono, mais dois hátomus de hidrogênio adicionados às extremidades da cadeia. Dessa forma, essa relação proporcional entre hátomus de carbono e de hidrogênio permite estabelecer uma fórmula geral para os alcanos, representada a seguir.
CnH2n + 2
Nessa fórmula, n representa o número de hátomus de carbono presentes na molécula.
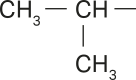
As representações anteriores são exemplos de alcanos cujas cadeias carbônicas são normais ou lineares e abertas ou acíclicas (não formam ciclos), sêndo possível identificar duas extremidades livres. Esses alcanos são também chamados de alifáticos.
Há compostos cujas cadeias carbônicas apresentam ramificações, ou seja, mais de duas extremidades livres com hátomus de carbono.
Acompanhe os exemplos de uma cadeia linear e duas cadeias ramificadas.
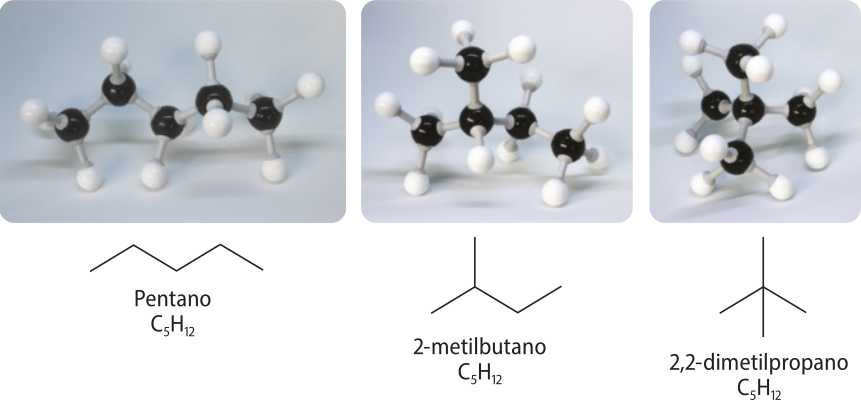
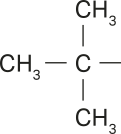
Na representação da molécula do pentano, há apenas duas extremidades livres, caracterizando a cadeia como normal. Porém, analisando as representações das moléculas de 2-metilbutano e 2,2-dimetilpropano, é possível perceber quê há mais de duas extremidades livres.
Note quê a presença de ramificações na cadeia não altera a fórmula geral dos alcanos.
Propriedades físico-químicas dos alcanos
Os alcanos são compostos de baixa densidade (entre 0,55 g/cm3 e 0,8 g/cm3) e insolúveis em á gua. A maioria encontra-se no estado gasoso à pressão de 1 atm e à tempera-túra de 25 °C. Em geral, suas tempera-túras de fusão e de ebulição aumentam progressivamente com o aumento do tamãnho da cadeia carbônica, por causa da intensificação gradual das interações intermoleculares do tipo dipolo instantâneo-dipolo induzido.
Temperaturas de ebulição de alguns alcanos
Alcano |
Fórmula |
Massa molar |
Temperatura de ebulição |
|---|---|---|---|
Metano |
CH4 |
16 g/mol |
−161,5 °C |
Etano |
CH3CH3 |
30 g/mol |
−88,6 °C |
Propano |
CH3CH2CH3 |
44 g/mol |
−42,1 °C |
Butano |
CH3CH2CH2CH3 |
58 g/mol |
−0,5 °C |
Pentano |
CH3CH2CH2CH2CH3 |
72 g/mol |
36,1 °C |
Hexano |
CH3CH2CH2CH2CH2CH3 |
86 g/mol |
68,7 °C |
Fonte: LIDE, Daví R. (ed.). Physical constants ÓF organic compounds. In: LIDE, Daví R. (ed.). CRC Handbook ÓF chemistry ênd physics. 89th ed. Boca Raton: CRC Préss, 2009. p. 3-72, 3-232, 3-282, 3-326, 3-414, 3-440. E-book. Tradução nossa.
Página trezentos e treze
Para quê aconteça mudança de estado físico, é necessário quê as interações intermoleculares sêjam rompidas com o fornecimento de energia na forma de calor. Conforme o tamãnho da cadeia carbônica aumenta, a superfícíe de contato entre as moléculas também aumenta, possibilitando interações intermoleculares mais intensas. Ou seja, quanto maior for a cadeia (e consequentemente a massa molar), mais energia será necessário fornecer para quê essas interações sêjam rompidas.
Nomenclatura dos alcanos
Atualmente, é empregado um conjunto de regras definidas pela IUPAC para identificar as substâncias orgânicas. Por meio dessas regras, forma-se a nomenclatura sistemática das substâncias, apesar de existirem outras nomenclaturas comuns presentes na linguagem científica e aceitas pela IUPAC.
De acôr-do com as regras estabelecidas pela IUPAC, a nomenclatura das substâncias orgânicas é constituída de três partes.
Prefixo + infixo + sufixo
O prefixo indica o número de hátomus de carbono presentes na molécula, conforme indicado a seguir.
Átomos de C |
Prefixo |
Átomos de C |
Prefixo |
Átomos de C |
Prefixo |
|---|---|---|---|---|---|
1 |
met- |
8 |
oct- |
15 |
pentadec- |
2 |
et- |
9 |
non- |
16 |
hexadec- |
3 |
prop- |
10 |
dec- |
17 |
heptadec- |
4 |
but- |
11 |
undec- |
18 |
octadec- |
5 |
pent- |
12 |
dodec- |
19 |
nonadec- |
6 |
hex- |
13 |
tridec- |
20 |
eicos- |
7 |
hept- |
14 |
tetradec- |
21 |
henicos- |
O infixo indica o tipo de ligação presente entre os hátomus de carbono, conforme indicado a seguir.
Tipo de ligação química |
Infixo |
|---|---|
Apenas ligações simples |
-an- |
Uma ligação dupla |
-en- |
Uma ligação tripla |
-in- |
Uma ligação dupla e uma ligação tripla |
-enin- |
Duas ligações duplas |
-dien- |
Duas ligações triplas |
-diin- |
E o sufixo indica a função OR GÂNICA à qual pertence a substância. Para o caso dos hidrocarbonetos, o sufixo é sempre o mesmo: -o.
Página trezentos e quatorze
Com base nessas premissas, o primeiro passo para saber a nomenclatura de um alcano é determinar sua cadeia carbônica principal, quê é a maior sequência possível de hátomus de carbono. No caso de alcanos ramificados, as ramificações não fazem parte da cadeia principal e devem sêr identificadas na nomenclatura da substância em relação à quantidade e à posição na molécula.
Para identificar a posição das ramificações, os carbonos da cadeia principal são numerados de modo quê se obtenha os menóres números inteiros para as ramificações.
Note quê, no 2-metilbutano, a cadeia carbônica principal foi numerada da esquerda para a direita, e a ramificação encontra-se no carbono 2. Caso a numeração fosse feita no sentido ôpôsto, a ramificação estaria no carbono 3, o quê não é correto de acôr-do com a IUPAC.
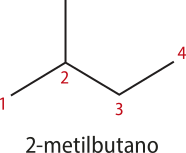
Para o 2,2-dimetilpropano, há duas ramificações no carbono 2. Nesse caso, não faz diferença numerar a cadeia carbônica principal começando da esquerda ou da direita.
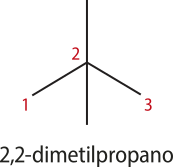
As ramificações – também chamadas de grupos substituintes, pois substituem um átomo de hidrogênio da cadeia principal – recebem nomes específicos relacionados ao número de hátomus de carbono, conforme representado a seguir.
Nomenclatura de ramificações mais comuns
Quantidade de hátomus de carbono |
Fórmula estrutural |
Nome da ramificação |
|---|---|---|
1 |
CH3 – |
Metil |
2 |
CH3 – CH2 – |
Etil |
3 |
CH3 – CH2 – CH2 – |
Propil |
|
Isopropil |
|
4 |
CH3 – CH2 – CH2 – CH2 – |
Butil |
|
Sec-butil |
|
|
Terc-butil |
|
|
Isobutil |
Para identificar a quantidade de ramificações iguais na molécula de uma substância, são utilizados os prefixos di-, tri-, tetra- etc.
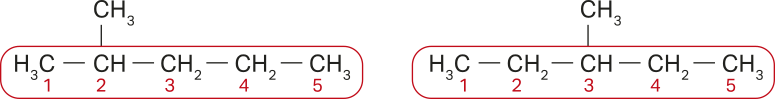
Dessa forma, analise as substâncias representadas pelas seguintes fórmulas estruturais.
Página trezentos e quinze
As cadeias carbônicas principais estão devidamente identificadas e numeradas, sêndo formadas por cinco hátomus de carbono. Ambas as estruturas apresentam ramificação, uma no carbono 2, e a outra, no carbono 3. Por fim, são dois hidrocarbonetos quê apresentam apenas ligações simples entre os hátomus de carbono. Com base nesses dados, confira as nomenclaturas indicadas a seguir.
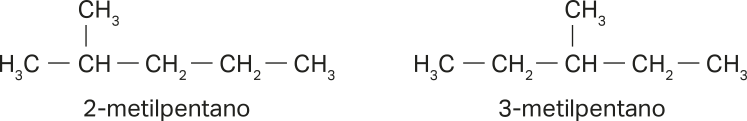
Note quê no 2-metilpentano, caso a numeração da cadeia principal começasse pela direita, a ramificação estaria localizada no carbono 4, o quê seria incorréto segundo a IUPAC. No caso do 3-metilpentano, não faria diferença começar a numeração pela esquerda ou pela direita.
AlGO A+
Nomenclatura preferencial
Além das regras quê detalham os procedimentos para a determinação dos nomes de qualquer molécula, existem nomenclaturas específicas para algumas delas, quê também são determinadas pela IUPAC. O nome preferencial é aquele escolhido entre as diferentes denominações corretas, quê deve sêr utilizado especialmente em documentos oficiais, como leis e patentes, de modo a uniformizar a nomenclatura de termos e facilitar seu entendimento às pessoas quê não são do meio científico.
ESPAÇOS DE APRENDIZAGEM
• êste texto aborda o uso de uma usina de biodigestores em um restaurante na ilha do Combu, em Belém (PA). No processo da biodigestão, ocorre a produção de biogás, quê contém gás metano (CH4), um tipo de alcano.
D’ALMEIDA, Denilson. Economia vêrde: restos de alimentos viram biogás em restaurante da ilha do Combu, polo do turismo gastronômico em Belém. G1, Belém, 5 jun. 2024. Disponível em: https://livro.pw/qlfbg. Acesso em: 8 out. 2024.
Alcenos
Os alcenos são hidrocarbonetos quê diferem dos alcanos pela presença de uma ligação dupla na estrutura da molécula. A presença de uma ligação dupla é chamada de insaturação. Portanto, os alcenos são substâncias insaturadas. São também chamados de olefinas, nome derivado do latim oleum facere, quê significa “fazer ou produzir óleos”.
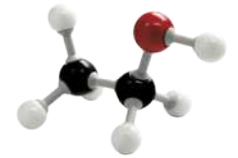
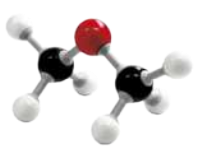
O alceno mais simples é o eteno, ou etileno, substância formada por moléculas quê apresentam dois hátomus de carbono ligados entre si, cada um ligado a dois hátomus de hidrogênio. Sua fórmula molecular é C2 H4.
Acompanhe duas representações da molécula de eteno.
REFLITA
2 por quê é comum embrulhar frutas ainda verdes em jornais ou outros papéis?
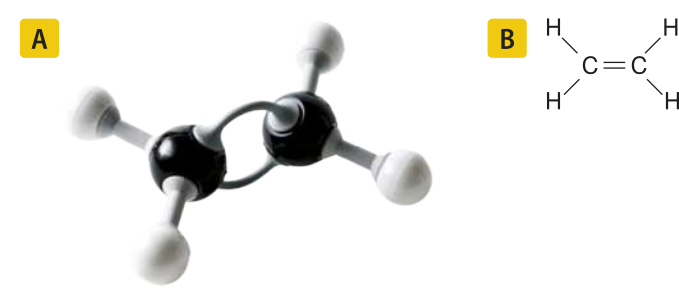
Página trezentos e dezesseis
Para quê se estabêlêça uma ligação dupla entre os hátomus de carbono, partindo de um alcano similar, são eliminados dois hátomus de hidrogênio no alceno. A fórmula geral dos alcenos está representada a seguir.
CnH2n (n ≥ 2)
Nessa fórmula, n indica também o número de hátomus de carbono.
O eteno (n = 2) tem aplicações variadas, entre as quais se destacam sua ação no amadurecimento de frutas (por sêr produzido naturalmente em plantas, induz o amadurecimento de frutas) e seu uso na obtenção de etanol e na fabricação de polietileno, um plástico comum.

Propriedades físico-químicas dos alcenos
É possível generalizar algumas propriedades físico-químicas dos alcanos para os alcenos. Por exemplo, as tempera-túras de fusão e de ebulição também aumentam com o aumento da cadeia carbônica.
Tanto os alcanos quanto os alcenos são substâncias apolares, o quê os torna insolúveis em á gua, mas solúveis em solventes orgânicos apolares. No entanto, a presença da ligação dupla nos alcenos confere uma ligeira diferença de polaridade em comparação com os alcanos, especialmente em substâncias mais compléksas, o quê póde afetar minimamente a solubilidade e a reatividade.
Em geral, as tempera-túras de fusão e de ebulição dos alcenos são ligeiramente mais baixas do quê as dos alcanos com massas moleculares semelhantes. Isso ocorre porque as interações intermoleculares nos alcenos tendem a sêr um pouco mais fracas por causa da insaturação, quê afeta negativamente a superfícíe de contato entre as moléculas.
A principal diferença entre alcanos e alcenos é a reatividade. Os alcanos apresentam baixa reatividade e são suscetíveis principalmente a reações de combustão e substituição. Já os alcenos são mais reativos e participam de uma variedade de reações de adição (como hidrogenação, halogenação, hidratação), em quê a insaturação é rompida para a adição de novos hátomus por ligações simples.
Nomenclatura dos alcenos
A nomenclatura dos alcenos, assim como a dos alcanos, é formada por um prefixo, quê indica o número de hátomus de carbono; por um infixo, quê indica a presença de ligações duplas; e pelo sufixo -o, característico dos hidrocarbonetos.
A diferença na nomenclatura deles é quê, nos alcenos, a identificação da cadeia principal deve sempre considerar a presença da insaturação na molécula, e a numeração deve iniciar pelo lado mais próximo da ligação dupla.
Acompanhe, a seguir, quatro estruturas de moléculas de alcenos com três e com quatro hátomus de carbono.
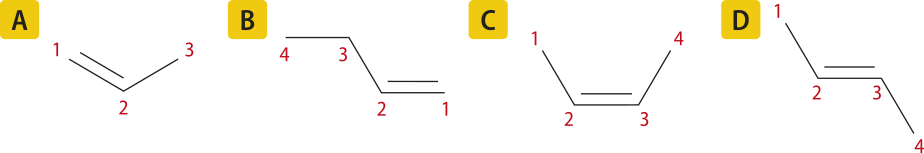
Página trezentos e dezessete
Como nomear esses alcenos com base nas regras de nomenclatura estabelecidas?
A figura A representa uma molécula com três hátomus de carbono, portanto o prefixo utilizado será prop-. A presença de uma ligação dupla indica quê o infixo será -en-. Por sêr um hidrocarboneto, o sufixo será -o. Logo, o nome do compôzto será propeno.
Na figura B, a numeração da cadeia carbônica inicia-se da direita para a esquerda. Nesse caso, a posição da ligação dupla deve sêr indicada no nome da substância. Portanto, seguindo as regras de nomenclatura, o nome será but-1-eno.
As figuras C e D são representações diferentes do but-2-eno. No entanto, são substâncias distintas, por isso é necessário indicar essa diferença nos nomes. Enquanto na figura C os carbonos 1 e 4 encontram-se do mesmo lado da ligação dupla, na figura D, eles estão localizados em lados opostos. Nesses casos, usam-se os prefixos cis- e trans- para diferenciá-las (no Tema sobre isômería, essa nomenclatura será retomada). Portanto, a nomenclatura delas será cis-but-2-eno e trans-but-2-eno.
Alcinos
Os alcinos são hidrocarbonetos insaturados alifáticos (de cadeia linear e aberta) quê apresentam uma ligação tripla.
O alcino mais simples é o etino, ou acetileno, substância formada por moléculas quê contêm dois hátomus de carbono, cada um ligado a um átomo de hidrogênio. Sua fórmula molecular é C2 H2.
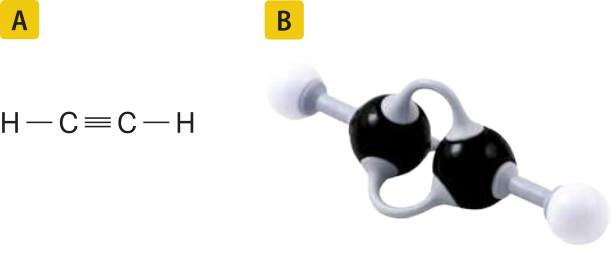
Representação segundo o modelo de esferas e varetas, na qual as esferas pretas representam o carbono, e as brancas, o hidrogênio (imagem sem escala; cores fantasia) (B).
Nos alcinos, para formár a ligação tripla entre os hátomus de carbono, é necessário eliminar quatro hátomus de hidrogênio do alcano equivalente, resultando na seguinte fórmula geral.
Cn H2n − 2 (n ≥ 2)
Nessa fórmula, n indica também o número de hátomus de carbono.
O etino (n = 2) é amplamente utilizado em sóldas para kórti de metais em razão da alta tempera-túra de sua chama, quê póde chegar a 3.000 °C. Na indústria, é usado como matéria-prima na produção de diversas substâncias orgânicas por causa de sua grande reatividade.

REFLITA
3 Você sabe como funciona uma solda a gás?
Página trezentos e dezoito
Propriedades físico-químicas dos alcinos
Semelhante aos alcanos e aos alcenos, os alcinos são substâncias apolares, o quê as torna insolúveis em á gua, mas solúveis em solventes orgânicos apolares. No entanto, a ligação tripla nos alcinos confere a eles uma distribuição de carga eletrônica mais densa ao longo da molécula, o quê póde aumentar ligeiramente sua polaridade em relação aos alcanos e aos alcenos. Ainda assim, essa polaridade é geralmente fraca e não afeta de maneira significativa a solubilidade.
Em comparação aos alcanos e aos alcenos de massa molecular semelhante, os alcinos tendem a ter tempera-túras de fusão e de ebulição mais elevadas. Isso ocorre porque a ligação tripla resulta em uma molécula mais linear e rígida, o quê possibilita uma melhor aproximação das moléculas e, portanto, maiores interações intermoleculares. Ainda assim, os alcinos leves (como o etino) continuam sêndo gases em condições ambientes, tal como os alcanos e os alcenos de cadeia carbônica pequena.
Temperaturas de fusão e de ebulição de alguns alcenos e alcinos
Nome |
Fórmula molecular |
Temperatura de fusão |
Temperatura de ebulição |
|---|---|---|---|
Eteno |
C2H4 |
−169,2 °C |
−103,8 °C |
Etino |
C2H2 |
−81,5 °C |
−84,7 °C |
Propeno |
C3H6 |
−185,3 °C |
−47,6 °C |
Propino |
C3H4 |
−103,0 °C |
−23,2 °C |
Fonte: HAYNES, uílhãm M. (ed.). Physical constants ÓF organic compounds. In: HAYNES, uílhãm M. (ed.). CRC Handbook ÓF chemistry ênd physics. 95th ed. Boca Raton: CRC Préss, 2014. p. 3-6, 3-256, 3-466, 3-470. E-book. Tradução nossa.
Os alcinos são ainda mais reativos do quê os alcenos por causa da ligação tripla, permitindo quê os alcinos participem de diversas reações de adição (como halogenação, hidrogenação e hidratação), em quê a tripla ligação póde sêr convertida em ligações duplas ou simples. Além díssu, o átomo de hidrogênio ligado ao carbono terminal da ligação tripla nos alcinos terminais é mais ácido do quê nos alcanos e nos alcenos, o quê possibilita a formação de acetiletos em reações ácido-base.
Nomenclatura dos alcinos
A nomenclatura dos alcinos segue as mesmas regras apresentadas para os alcanos e para os alcenos, com a diferença no infixo -in-.
Acompanhe a nomenclatura de quatro alcinos cujas fórmulas estruturais são apresentadas a seguir.
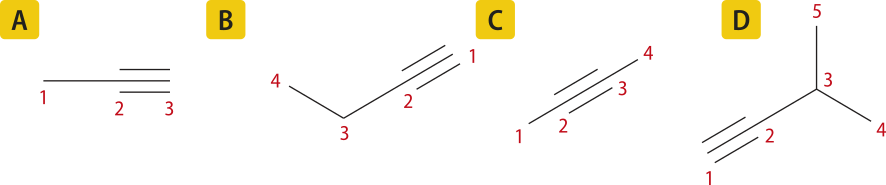
A figura A representa uma molécula formada por três hátomus de carbono, portanto o prefixo será prop-. Como só existe uma possibilidade para a ligação tripla, não é necessário indicá-la no nome da substância. Dessa forma, a nomenclatura correta será propino.
Página trezentos e dezenove
A figura B representa uma molécula formada por quatro hátomus de carbono. Portanto, o prefixo será but-. Nesse caso, há mais de uma possibilidade de localização da ligação tripla, logo é necessário indicar sua posição. A numeração da cadeia carbônica deve iniciar pelo lado direito, mais próximo da insaturação. Portanto, a nomenclatura correta será but-1-ino.
A figura C também representa uma molécula com quatro hátomus de carbono. No entanto, nesse caso, a insaturação encontra-se no carbono 2; logo a nomenclatura correta será but-2-ino.
Por fim, a figura D representa uma molécula ramificada. Nesse caso, a cadeia principal é aquela com a maior sequência de hátomus de carbono quê contém a insaturação. Para a nomenclatura da substância, é preciso indicar, além da posição da ligação tripla, a posição da ramificação. A numeração dos hátomus de carbono deve iniciar mais próximo da insaturação, ou seja, da esquerda para a direita, fazendo com quê a ramificação esteja localizada no carbono 3. A nomenclatura correta será, portanto, 3-metilbut-1-ino.
Alcadienos
Os alcadienos são hidrocarbonetos alifáticos e insaturados quê apresentam duas ligações duplas. A fórmula geral dessas substâncias é a mesma dos alcinos.
Cn H2n −2 (n ≥ 3)
REFLITA
4 De onde vêm a borracha natural, usada na fabricação de diferentes materiais, como p-neus, tubos, mangueiras, artigos farmacêuticos etc.?
Classificação dos alcadienos
Os alcadienos são classificados com relação à posição das ligações duplas na molécula, podendo sêr acumulados, conjugados ou isolados.
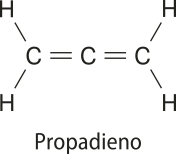
Alcadienos acumulados
Nesse tipo de compôzto, as ligações duplas encontram-se acumuladas, ou seja, são sequenciais no mesmo átomo de carbono. Um exemplo é o propadieno (C3H4), usado como combustível para soldagens especializadas.
Alcadienos conjugados
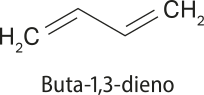
Nos alcadienos conjugados, as ligações duplas são intercaladas por uma ligação simples. Esse tipo de configuração confere grande estabilidade a essas substâncias. Um exemplo é o buta-1,3-dieno, substância presente no látex, extraído da seringueira e usado na fabricação da borracha natural.
Alcadienos isolados
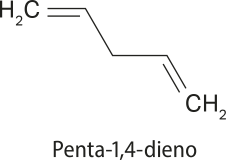
Nesse tipo de substância, as ligações duplas estão separadas por pelo menos duas ligações simples. Um exemplo é o penta-1,4-dieno, substância usada em reações para obtenção de alcanos ramificados.
Página trezentos e vinte
Nomenclatura dos alcadienos
As regras de nomenclatura dos alcadienos são as mesmas apresentadas até aqui, com a diferença de quê o infixo deve indicar a presença de duas ligações duplas na estrutura da molécula -dien-.
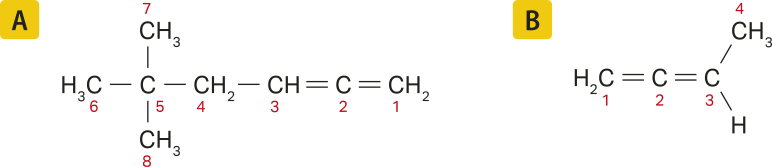
Analisando as fórmulas estruturais das moléculas representadas, na figura A, a cadeia principal tem seis hátomus de carbono e duas ramificações no carbono 5. Dessa forma, o nome dessa substância será
5,5-dimetil-hexadieno.
Na molécula representada na figura B, a cadeia carbônica é formada por quatro hátomus, e não existem ramificações. Nesse caso, o nome da substância será buta-1,2-dieno.

REFLITA
5 O quê diferencia uma molécula de cadeia aberta de uma molécula de cadeia fechada?
Hidrocarbonetos de cadeia fechada
Até o momento, os hidrocarbonetos de cadeias abertas foram abordados. No entanto, há hidrocarbonetos cujas moléculas são formadas por cadeias de carbono fechadas, constituindo anéis ou ciclos. São os chamados cicloalcanos e os cicloalcenos.
Cicloalcanos e cicloalcenos
Como o nome sugere, os cicloalcanos são hidrocarbonetos saturados, ou seja, formados apenas por ligações simples, cuja cadeia carbônica é fechada em um ciclo. A fórmula geral dêêsse tipo de compôzto está representada a seguir.
Cn H2n (n ≥ 3)
Outro conjunto de hidrocarbonetos de cadeia fechada é o dos cicloalcenos, quê se assemelham aos cicloalcanos com a diferença de quê apresentam uma insaturação na estrutura da molécula. A fórmula geral dessas substâncias está representada a seguir.
Cn H2n − 2 (n ≥ 3)
Página trezentos e vinte e um
Nomenclatura dos cicloalcanos e dos cicloalcenos
As regras de nomenclatura estabelecidas para os hidrocarbonetos alifáticos valem também para as substâncias de cadeia fechada. Como tanto os cicloalcanos como os cicloalcenos são moléculas cíclicas, faz-se necessário inserir o termo ciclo na frente de seus nomes. A seguir, acompanhe alguns exemplos dessa nomenclatura.
Quantidade de carbonos |
Nomenclatura |
|
|---|---|---|
Cicloalcanos |
Cicloalcenos |
|
4 |
Ciclobutano |
Ciclobuteno |
5 |
Ciclopentano |
Ciclopenteno |
6 |
Ciclo-hexano |
Ciclo-hexeno |
Para representar as moléculas cíclicas, pode-se utilizar figuras geométricas, como indicado a seguir. Note quê a estrutura de cada molécula de cicloalcano representada a seguir é formada por um ciclo quê varia em número de hátomus de carbono.
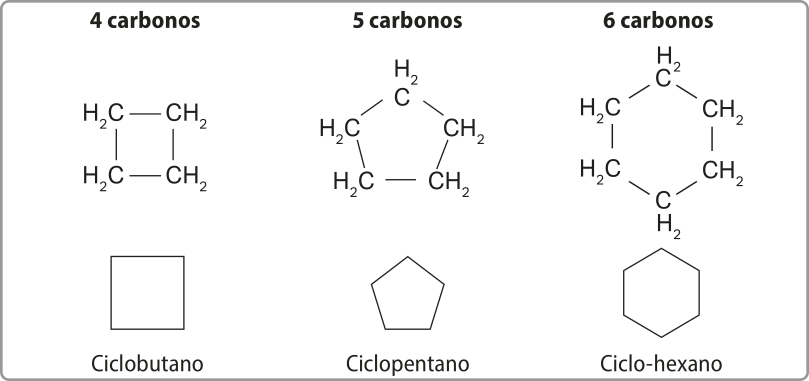
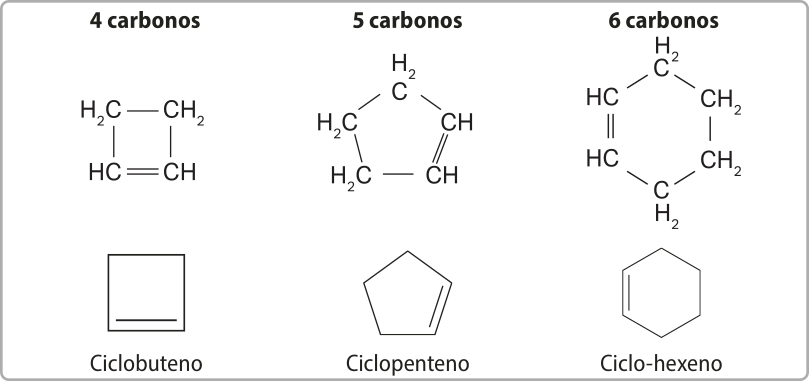
A representação dos cicloalcenos também póde utilizar figuras geométricas, sêndo quê a posição da dupla ligação é indicada com um traço na parte de dentro da figura.

Página trezentos e vinte e dois
Hidrocarbonetos aromáticos
Os hidrocarbonetos aromáticos são substâncias de cadeia fechada quê apresentam ligações duplas alternadas com ligações simples. O principal hidrocarboneto aromático é o benzeno.
REFLITA
6 Uma substância utilizada no cotidiano póde sêr tóxica?
Benzeno
O benzeno, descoberto por máicou Faraday em 1825, teve um papel importante na história da Química e da indústria. Inicialmente, ele foi isolado como subproduto da produção de gás de iluminação, mas sua estrutura enigmática só foi elucidada em 1865 por Kekulé, quê propôs a conhecida estrutura em anel. Durante o século XIX, o benzeno passou a sêr amplamente utilizado em solventes industriais, em vernizes e em tintas. No entanto, o quê outrora foi considerado inofensivo, mais tarde, revelou-se perigoso, quando se descobriu quê o benzeno é altamente tóxico e carcinogênico, levando à sua restrição em muitos produtos. Curiosamente, apesar dos riscos, foi essencial no desenvolvimento de corantes sintéticos e medicamentos, sêndo uma das substâncias mais estudadas na Química Orgânica.
Com relação à sua estrutura, Kekulé sugeriu quê a substância seria formada por um anel de seis hátomus de carbono, no qual haveria ligações simples e duplas alternadas com um átomo de hidrogênio ligado a cada átomo de carbono. Dessa forma, duas estruturas seriam possíveis para o benzeno.

No entanto, estudos posteriores revelaram quê não havia ligações simples e duplas alternadas na estrutura do benzeno, pois todas as ligações entre os carbonos do compôzto seriam equivalentes, ou seja, teriam o mesmo comprimento, quê seria um valor intermediário entre uma ligação simples e uma ligação dupla.
Com base nesses resultados, foi propôsto um novo modelo para a estrutura do benzeno, um híbrido das duas anteriores, indicando quê os elétrons estariam deslocalizados. Esse fenômeno ficou conhecido como ressonância, e a estrutura do benzeno, portanto, seria formada pelo conjunto dêêsses híbridos de ressonância. Assim, uma nova forma de representar a molécula do benzeno foi proposta, de modo a incorporar os híbridos de ressonância.
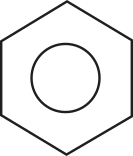
A circunferência interna indica a deslocalização dos elétrons por causa do fenômeno de ressonância. Vale ressaltar que nêm todas as substâncias aromáticas apresentam a estrutura do benzeno na molécula, mas os derivados dele são os mais importantes em termos de aplicação na pesquisa e na indústria.
Página trezentos e vinte e três
AlGO A+
Kekulé e a estrutura do benzeno
Uma grande carga de trabalho na Universidade de Ghent, na Bélgica, onde Kekulé era professor, levou o cientista à exaustão, quê, associada à morte de sua esposa, fez com quê interrompesse suas pesquisas por dois anos. Quando retornou, dedicou-se à resolução do enigma da estrutura do benzeno e à elaboração de um livro de Química Orgânica.
cérto dia, cochilou em frente à lareira e teve um sonho. Leia o trecho de um texto no qual esse sonho é descrito.
Estava sentado escrevendo meu manual, mas o trabalho não progredia; meus pensamentos estavam dispérsos. Virei minha cadeira para a lareira e adormeci. Novamente os hátomus saltavam à minha frente. Desta vez os grupos menóres permaneciam modestamente no fundo. Meu olho mental, aguçado pelas repetidas visões do gênero, discernia estruturas mais amplas de conformação múltipla; longas fileiras às vezes mais estreitamente encaixadas, todas rodando e torcendo-se em movimentos de cobra. Mas veja só! O quê é akilo? Uma das cobras havia agarrado a própria cauda e a forma rodopiava de modo a debochar ante meus olhos. Como se à luz de um relâmpago, despertei; e desta vez, também passei o résto (da noite) tentando estender as consequências da hipótese [...].
CARAMORI, Giovanni Finoto; OLIVEIRA, Kleber TIAGO de. Aromaticidade: evolução histórica do conceito e critérios quantitativos. Química Nova, [s. l.], v. 32, n. 7, p. 1871-1884, 2009. p. 1872-1873. Disponível em: https://livro.pw/tvzgo. Acesso em: 8 out. 2024.
Kekulé, então, propôs quê as substâncias orgânicas poderiam também apresentar moléculas com cadeias fechadas ou anéis e sugeriu quê o benzeno era uma estrutura de seis hátomus de carbono ligados por ligações duplas e simples alternadas.
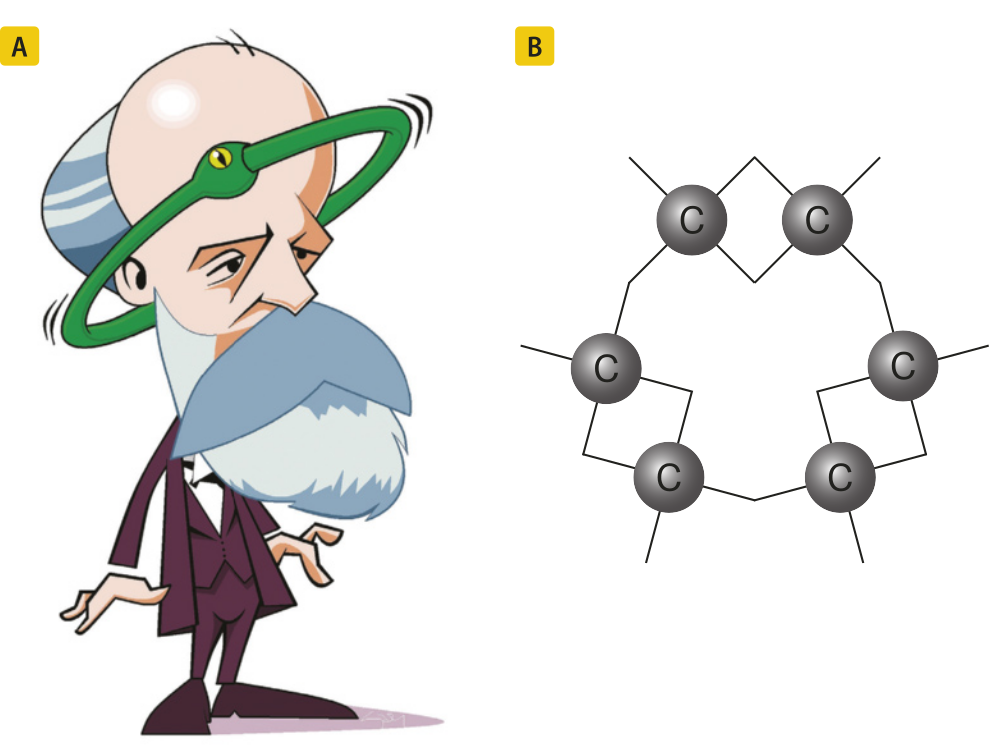
Elaborada com base em: KEKULÉ, August. Lehrbuch der organischen chemie. Erlangen: Verlag von Ferdinand Enke, 1866. p. 496.
O texto “O intrigante do sonho de Kekulé: considerações sobre a história e a natureza da Ciência”, de diêine Raquel Silva de Oliveira, disponível em: https://livro.pw/lomdy (acesso em: 28 set. 2024), contextualiza o quê ficou conhecido como o sonho de Kekulé a respeito da estrutura do benzeno.
Página trezentos e vinte e quatro
Derivados do benzeno
No caso da nomenclatura de derivados do benzeno, ou seja, de moléculas de benzeno quê apresentam uma ramificação, basta nomear a ramificação e acrescentar o sufixo -benzeno. Assim, o mêtílbenzeno (conhecido como tolueno) apresenta uma ramificação metil ligada ao benzeno.
Se houver mais de uma ramificação, a numeração da cadeia deve sêr realizada de modo quê as ramificações fiquem com os menóres números possíveis. Duas ramificações mêtíl, por exemplo, resultam em três possibilidades de posicionamento delas, e as estruturas resultantes são nomeadas como representado a seguir.
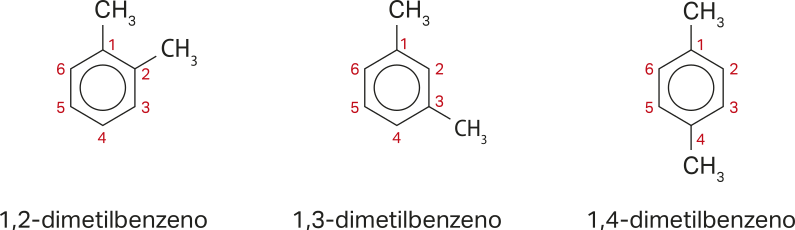
Moléculas de substâncias aromáticas com dois substituintes também podem sêr nomeadas com base na nomenclatura orto, meta e para. Nela, o termo orto equivale à posição 1,2; o termo meta, à posição 1,3; e o termo para, à posição 1,4. Assim, as substâncias acima podem sêr nomeadas o-dimetilbenzeno, m-dimetilbenzeno e p-dimetilbenzeno. Atualmente, a IUPAC não recomenda essas designações, mas seu uso não foi completamente abandonado ainda.
ATIVIDADES
1. Quais são as substâncias cujas moléculas estão representadas a seguir?
a) 
b) ![]()
c) ![]()
2. Nomeie, em seu caderno, os cicloalcanos representados a seguir.
a) ![]()
b) ![]()
c) ![]()
d) ![]()
e) ![]()
3. Pesquise em sáites confiáveis alguns alcanos e apresente o nome e a fórmula molecular deles. Indique as principais formas de utilização dessas substâncias.
4. Considere as seguintes substâncias: etano, eteno e etino. Indique as principais diferenças na estrutura molecular delas. Realize uma pesquisa e apresente quais são as principais características de cada uma delas.
5. Os alcinos são altamente inflamáveis, reativos e insolúveis em á gua. Com base na estrutura das moléculas quê os constituem, apresente uma justificativa quê explique essas características.
Página trezentos e vinte e cinco
TEMA
27
Grupos funcionais, funções nitrogenadas e haletos orgânicos
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O nitrogênio é um elemento químico fundamental e está presente, por exemplo, na composição dos sêres vivos e na constituição de aminoácidos, moléculas quê formam as proteínas. Ele também póde sêr encontrado em substâncias com aplicações específicas, como no ácido p-aminobenzoico (NH2C6H4COOH), conhecido pela sigla em inglês PABA. Essa substância tem ação antioxidante e capacidade de bloquear os efeitos dos raios ultravioleta, sêndo usada na composição de protetores solares.
Por sua vez, os haletos orgânicos são substâncias formadas pela substituição, em um hidrocarboneto, de um ou mais hátomus de hidrogênio por hátomus de halogênios. Alguns exemplos comuns incluem o clorofórmio (CHC(éli)"3), utilizado como solvente e, em meados do século XIX, como anestésico, e o tetracloreto de carbono (CC(éli)"4), usado principalmente na fabricação de gases para refrigeração e propelentes em aerossóis. Outro exemplo é o cloreto de vinila (C2H3C(éli)"), principal matéria-prima para a produção de pê vê cê, um plástico amplamente utilizado em diversas aplicações industriais e domésticas.
No Tema anterior, foram estudados os hidrocarbonetos, substâncias orgânicas formadas apenas por hátomus de carbono e de hidrogênio. Neste Tema, será abordada a presença de hátomus de outros elemêntos químicos, como o nitrogênio e os halogênios (flúor, cloro, bromo e iodo), o quê aumenta a complexidade das substâncias orgânicas e confere a elas propriedades específicas.

Página trezentos e vinte e seis
Grupos funcionais
As diferenças na estrutura das moléculas – como a presença ou a ausência de insaturações ou ramificações, de hátomus de elemêntos químicos diferentes ou mesmo de grupos de hátomus – conferem propriedades distintas às substâncias.
Os hátomus ou grupos de hátomus quê se ligam a um carbono de uma molécula OR GÂNICA no lugar de um hidrogênio são chamados de substituintes. Quando incorporados a uma molécula de um hidrocarboneto, os substituintes transformam-na em outra classe de substância e, por isso, são denominados grupos funcionais. Um grupo funcional, portanto, é um átomo ou grupo de hátomus quê, quando presente nas moléculas de uma substância, confere a ela propriedades específicas.
Identificar os grupos funcionais permite agrupar as substâncias de acôr-do com as características das estruturas de suas moléculas, quê, por sua vez, definem as características macroscópicas das substâncias. O conjunto de substâncias cujas moléculas apresentam o mesmo grupo funcional é chamado de função OR GÂNICA.
As funções orgânicas nitrogenadas, nas quais o substituinte principal é o nitrogênio, e os haletos orgânicos, nos quais os hátomus de halogênio conferem as propriedades específicas à substância, serão apresentados nos próximos tópicos.
REFLITA
1 por quê a presença de hátomus de outros elemêntos químicos afeta as propriedades das substâncias? Proponha uma explicação.
Funções nitrogenadas
Os hátomus de nitrogênio são bastante eletronegativos, realizam ligações múltiplas e apresentam um par de elétrons livres.
Por isso, eles podem se ligar a hátomus de carbono de diversas maneiras, formando diferentes funções orgânicas.
As informações a seguir resumem algumas das funções orgânicas nitrogenadas. As notações R, R’ e R’’ representam cadeias carbônicas de tamãnho variável.
Exemplos de funções orgânicas nitrogenadas
Função |
Fórmula geral |
Função |
Fórmula geral |
|---|---|---|---|
Amina primária |
|
Amina secundária |
|
Amina terciária |
|
Amida |
|
Nitrila |
R – C ≡ N |
Imina |
R – C ≡ NH |
REFLITA
2 Você já se perguntou de onde vêm o odor característico de corpos em decomposição?
Página trezentos e vinte e sete
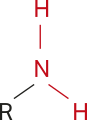
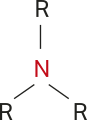
Aminas
As aminas são substâncias orgânicas formadas por uma, duas ou três cadeias carbônicas ligadas a um átomo de nitrogênio (RNH2, RR’NH ou RR’R’’N).
Frequentemente, elas são representadas por meio de suas fórmulas condensadas, com o nome de cada grupo ligado ao nitrogênio escrito d fórma individual, pois, muitas vezes, essa representação é suficiente para identificar a substância. No caso da metilamina, a amina mais simples quê existe, sua fórmula é CH3 NH2, indicando quê um hidrogênio ligado ao nitrogênio foi substituído pelo grupo metila (H3 C—).
As aminas podem sêr classificadas em primárias, secundárias e terciárias, de acôr-do com o número de substituintes ligados ao átomo de nitrogênio: um, dois ou três, respectivamente. Os substituintes R podem sêr iguais ou diferentes. O esquema a seguir resúme essa classificação.

AlGO A+
As aminas e os maus odores
As substâncias nitrogenadas, como os aminoácidos, quê são moléculas constituintes das proteínas, fazem parte da constituição dos sêres vivos.
Após a morte de um organismo, alguns aminoácidos são decompostos por microrganismos. Nesse processo, são geradas duas substâncias, a cadaverina e a putrescina, cujos nomes, segundo as regras de nomenclatura sistemática da IUPAC, são pentano-1,5-diamina e butano-1,4-diamina, respectivamente. Essas duas substâncias estão associadas ao cheiro de carne pô-dri.
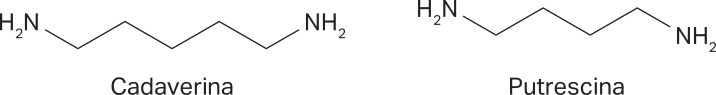
Outra amina associada a maus odores é a trimetilamina, quê se origina da decomposição de peixes.

Página trezentos e vinte e oito
Nomenclatura das aminas
A nomenclatura das aminas segue as regras estabelecidas pela IUPAC. Para nomeá-las, basta usar o sufixo -amina.
Para as aminas secundárias e terciárias, utiliza-se o prefixo N- antes do nome do substituinte ligado ao átomo de nitrogênio. Essa indicação é importante para especificar quê ele está ligado ao nitrogênio, e não à cadeia principal.
Acompanhe os exemplos a seguir.
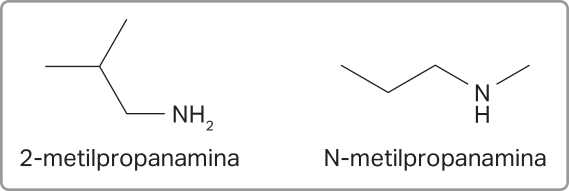
Outra maneira de nomear as aminas considera cada cadeia carbônica ligada ao nitrogênio como um grupo substituinte. A nomenclatura é construída por meio do nome das cadeias ligadas ao nitrogênio em ordem alfabética (como se fossem as ramificações dos hidrocarbonetos) e do sufixo -amina. Os prefixos di- e tri- podem sêr utilizados quando houver cadeias iguais ligadas ao nitrogênio, permitindo, assim, a simplificação de alguns nomes. É importante mencionar quê essa outra abordagem de nomenclatura não é a recomendada pela IUPAC.
Acompanhe mais alguns exemplos.
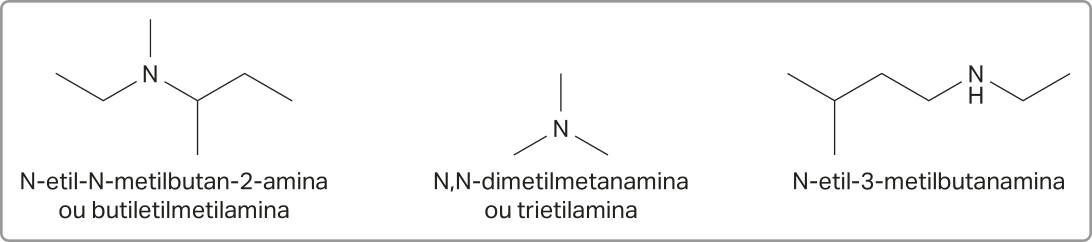
Vale reforçar quê, apesar de a IUPAC estabelecer regras sistemáticas e padronizadas para a nomenclatura de substâncias orgânicas, muitas nomenclaturas não oficiais, também chamadas de nomes comuns, ainda são amplamente utilizadas. Isso acontece principalmente por razões históricas e práticas. Muitas substâncias foram identificadas antes da criação de um sistema unificado de nomenclatura, por isso o nome comum delas se tornou amplamente aceito e conhecido.
Além díssu, os nomes comuns costumam sêr mais fáceis de se lembrar e de pronunciar, o quê facilita a comunicação em ambientes profissionais, industriais ou mesmo educacionais. Por exemplo, o nome cadaverina é muito mais usado do quê o nome oficial pentano-1,5-diamina. Em muitos casos, a familiaridade e a tradição superam a necessidade de utilizar uma nomenclatura formal.
Por fim, em cértas situações, como no campo farmassêutico ou na indústria, as nomenclaturas comerciais e as marcas registradas também dêsempênham um papel importante, perpetuando o uso de nomes não oficiais.
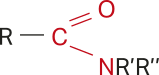
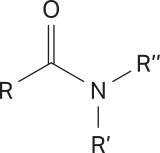
Amidas
As amidas são substâncias orgânicas cujas moléculas apresentam um grupo amino ligado ao carbono de uma carbonila ( ![]() ). Esse grupo amino póde, ainda, ter seus hidrogênios substituídos.
). Esse grupo amino póde, ainda, ter seus hidrogênios substituídos.
As amidas podem sêr representadas pela fórmula condensada do tipo RCONR’R’’, em quê cada grupo R póde sêr uma cadeia carbônica de tamãnho variável ou um átomo de hidrogênio, como representado na estrutura geral a seguir.
Página trezentos e vinte e nove
Uma amida muito importante é a penicilina, um antibiótico natural produzido pelo fungo Penicillium chrysogenum (também conhecido como Penicillium notatum), cuja descoberta teve um aspecto acidental. O médico escocês aleksander flêmim (1881-1955) realizava experimentos em seu laboratório com uma colônia de bactérias Staphylococcus Áureus, causadoras de infekições diversas. Após alguns dias de descanso, ele retornou ao laboratório e notou algo diferente. Em uma das placas de Petri (usadas na cultura de bactérias) quê havia guardado, desenvolveu-se um bolor, em volta do qual as bactérias não cresciam.
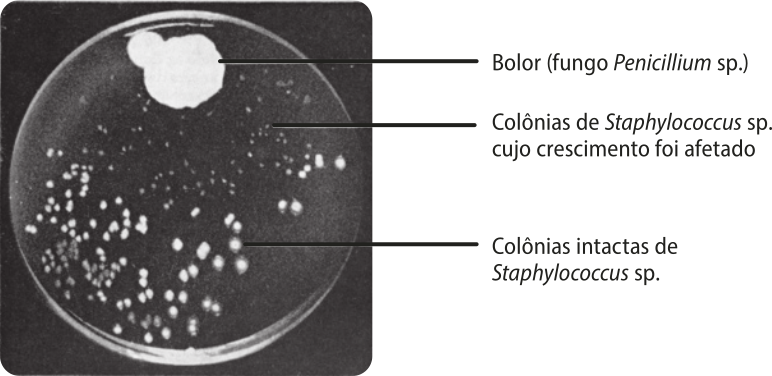
Flemin desconfiou de quê as bactérias estavam sêndo mortas por uma substância secretada pêlos fungos, o quê foi comprovado posteriormente. Flemin atribuiu à substância o nome de penicilina, por causa do nome do fungo quê estudava.
A seguir, são apresentados alguns exemplos de amidas.
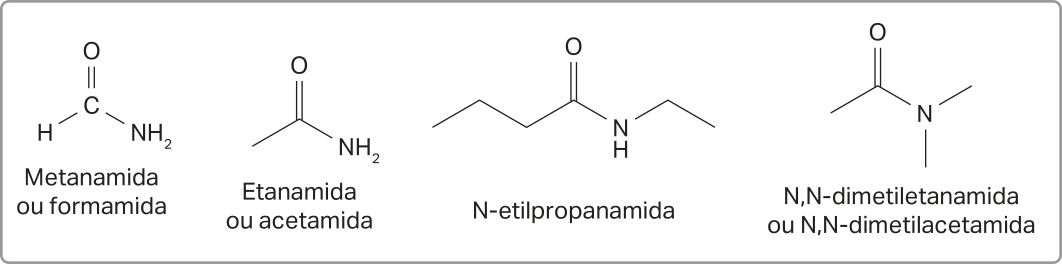
Nomenclatura das amidas
As regras de nomenclatura das amidas são similares às aplicadas às aminas. No caso das amidas, a cadeia principal sempre será, independentemente de seu tamãnho, a quê estiver ligada ao átomo de oxigênio. Nomeia-se essa cadeia pelas regras gerais estudadas até aqui e então coloca-se o sufixo -amida.
Caso o átomo de nitrogênio do grupo amida apresente grupos substituintes, estes também devem sêr nomeados. Os nomes dos substituintes obedecem às regras gerais já estudadas e são colocados, em ordem alfabética, antes do nome da cadeia principal. O prefixo N- também é utilizado para indicar quê um substituinte está ligado ao nitrogênio, e não à cadeia principal.
As amidas também podem sêr cíclicas e, nesses casos, recebem o nome de lactamas. Essa classe de substância tem diversas aplicações na indústria.
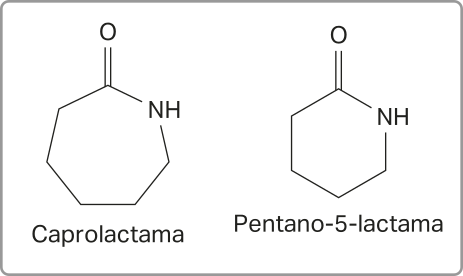
Página trezentos e trinta
Haletos orgânicos
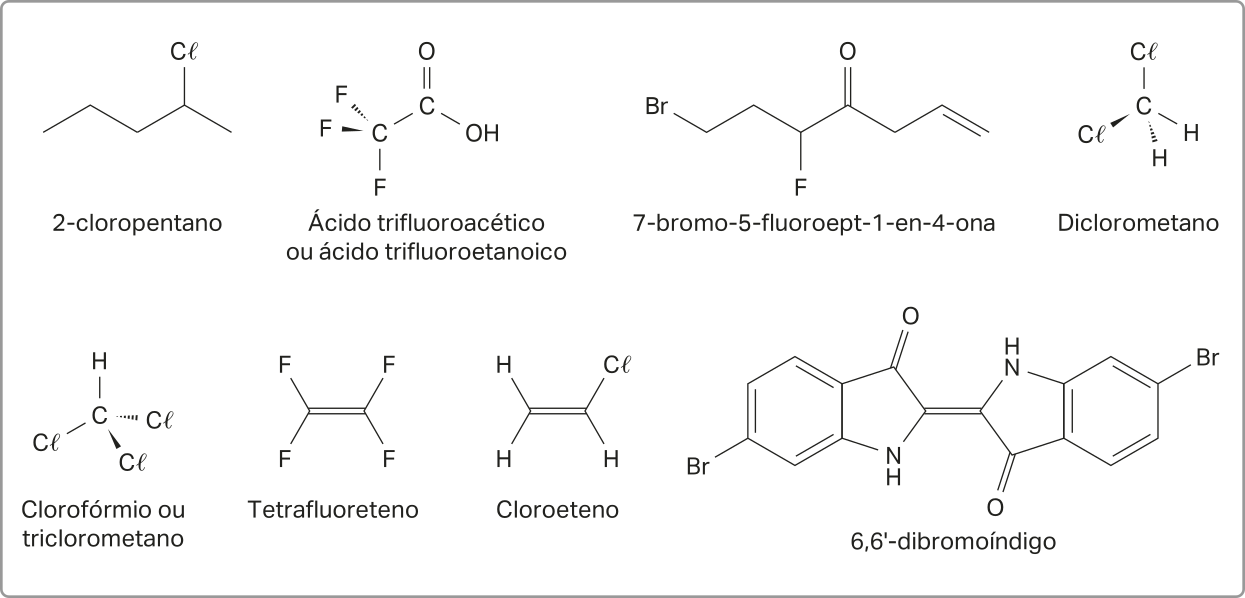
Além dos hátomus de hidrogênio, oxigênio e nitrogênio, outros elemêntos químicos podem se ligar a cadeias carbônicas, constituindo substâncias com diferentes propriedades e aplicações. Os hátomus do grupo 17 da tabéla periódica, por exemplo, chamados de halogênios, podem formár substâncias orgânicas denominadas haletos orgânicos, cuja fórmula geral é R — X (X = halogênios).
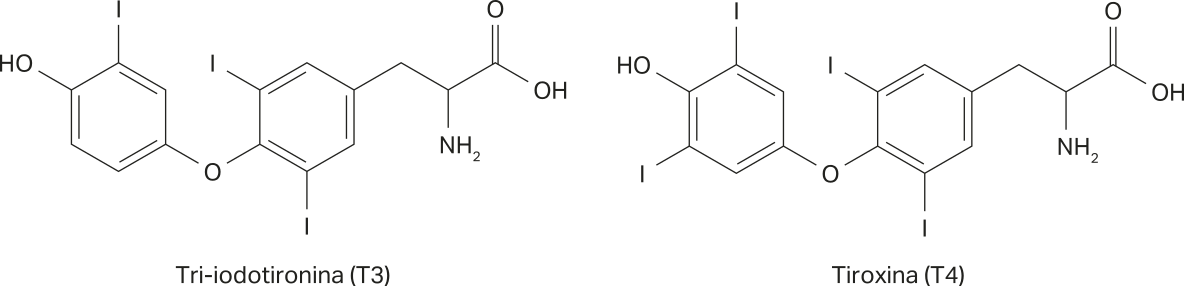
Os haletos orgânicos não são comuns na natureza, mas podem ocorrer em raros casos. Nos sêres humanos, por exemplo, os hormônios T3 e T4, essenciais para o contrôle do metabolismo, apresentam hátomus de iôdo em sua estrutura.
A nomenclatura dos haletos orgânicos deve indicar a localização e o nome do grupo no início do nome da substância, seja um hidrocarboneto ou outras funções orgânicas (como as quê serão estudadas no próximo Tema). Caso haja mais de um grupo na mesma posição, utilizam-se os prefixos diou tri- para indicar a quantidade.
Os prefixos utilizados para indicar a presença dos halogênios na estrutura da molécula são fluoro- (–F), cloro- (–C(éli)"), bromo- (–Br) e iodo- (–I).
Com base nessas regras de nomenclatura, os nomes dos haletos orgânicos podem sêr determinados, como exemplificado a seguir.
REFLITA
3 Você sabe o quê são os cê éfe cês e como eles afetam a camada de ozônio?
ESPAÇOS DE APRENDIZAGEM
• A principal substância presente no côrante natural púrpura tíria é o 6,6'-dibromoíndigo, extremamente valioso quando não se conheciam corantes sintéticos de cor similar. O texto a seguir conta um pouco sobre a história dêêsse haleto orgânico.
GORVETT, Zaria. Púrpura tíria: o antigo pigmento desaparecido quê valia mais quê ouro. BBC Future, 17 dez. 2023. Disponível em: https://livro.pw/iunto. Acesso em: 2 maio 2025.
Página trezentos e trinta e um
AlGO A+
Iodo e tireoide
A tireoide é uma glândula endócrina responsável pela secreção dos hormônios tireóideos. Ela é muito importante para o organismo, pois produz os hormônios tri-iodotironina (T3) e tetraiodotiroxina (T4), ou simplesmente tiroxina, fundamentais para a manutenção de um corpo saudável.
O hipotireoidismo (a falta dêêsses hormônios) provoca a diminuição do ritmo metabólico, enquanto o hipertireoidismo (o excésso deles) acelera o metabolismo. Essas anomalias desencadeiam uma série de problemas de saúde.
O equilíbrio na produção dêêsses hormônios é regulado por outro hormônio, o TSH, sigla em inglês para hormônio estimulante da tireoide, também conhecido como tireotropina. A diminuição de T3 e T4 eleva a produção de TSH, enquanto o aumento de T3 e T4 diminui essa produção.
Esse equilíbrio está associado ao consumo de iôdo, por meio de dietas balanceadas. A carência de iôdo provoca quêda na produção de T3 e T4, fazendo com que a tireoide cresça, originando o bócio nodular.
Recomenda-se o consumo diário de 200 microgramas de iôdo para prevenir o mau funcionamento da tireoide. Por isso, há uma lei federal quê torna a adição de iôdo ao sal de cuzinha obrigatória desde 1974.

ATIVIDADES
1. Apresente a principal diferença estrutural entre as aminas e as amidas.
2. Pesquise os tipos de penicilina quê existem. Escolha três e apresente, em seu caderno, suas fórmulas moleculares e aplicações. Para cada representação, destaque o grupo funcional característico das penicilinas.
3. A ureia é uma substância usada na fabricação de fertilizantes. Sua molécula apresenta a fórmula CH4N2O e as seguintes configurações.
• O átomo de carbono apresenta uma insaturação e duas ligações simples.
• O átomo de oxigênio apresenta uma ligação dupla.
• Cada átomo de nitrogênio apresenta três ligações simples.
• Os hátomus de hidrogênio apresentam apenas ligações simples.
• Átomos iguais não se ligam.
Com base nessas informações, proponha no seu caderno uma representação para a estrutura da molécula da ureia.
4. Procure por imagens de moléculas de aminas, amidas e haletos orgânicos na internet e analise as estruturas delas; depois, avalie-as em função das ligações presentes nelas. Registre suas pesquisas e avaliações em uma fô-lha avulsa e entregue-a ao professor.
5. Pesquise a respeito dos clorofluorcarbonetos e represente as moléculas dos principais cê éfe cês. Em seguida, indique o quê essas moléculas têm em comum.
Página trezentos e trinta e dois
TEMA
28
Funções oxigenadas
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Diversas substâncias encontradas no dia a dia podem sêr classificadas como funções orgânicas oxigenadas. Presentes nos aromas de flores e frutas, em produtos de limpeza e em combustíveis, essas substâncias dêsempênham papéis essenciais no cotidiano. Muitas vezes, sem perceber, as pessoas interagem com elas ao cozinhar, usar cosméticos ou ao realizar atividades ao ar livre.
O etanol, por exemplo, encontrado em bebidas alcoólicas e usado como biocombustível, é uma substância amplamente conhecida. Outro exemplo é o ácido acético, quê está presente no vinagre e é utilizado na culinária. Também pode-se mencionar o metanol, usado como solvente e combustível, e o éter dietílico, quê já foi utilizado como anestésico em procedimentos médicos. Essas substâncias têm em comum a presença de hátomus de oxigênio em suas moléculas.
êste Tema abordará como essas funções oxigenadas são formadas e como as estruturas de suas moléculas influenciam as propriedades das substâncias. Com base nesse conhecimento, será possível compreender melhor a Ciência por trás de muitos materiais quê fazem parte do cotidiano.

As principais funções oxigenadas
O oxigênio precisa fazer duas ligações químicas para atingir a estabilidade de acôr-do com a regra do octeto. Dessa forma, ele póde estar presente nas moléculas orgânicas das seguintes formas: em ligação dupla com um único átomo de carbono; ligado a dois hátomus de carbono, como heteroátomo da cadeia principal; ligado a um carbono e a outro elemento químico, como o hidrogênio; ou uma combinação de mais de uma dessas opções. É importante lembrar quê o átomo de oxigênio apresenta dois pares de elétrons não emparelhados.
As substâncias orgânicas cujas moléculas apresentam o elemento oxigênio, além de carbono e hidrogênio, são chamadas de substâncias orgânicas oxigenadas.
REFLITA
1 O quê póde acontecer com a polaridade de uma molécula se ela tiver um átomo de oxigênio?
Página trezentos e trinta e três
Álcoois
A palavra áucôl é comum no dia a dia. Fala-se de áucôl principalmente para indicar o etanol combustível, material quê contém uma pequena quantidade de á gua e de outras substâncias químicas. O termo também é usado para se referir às bebidas alcoólicas e aos diferentes tipos de áucôl utilizados em limpeza e desinfequição. Em todos os casos, o termo áucôl indica a presença de uma substância: o etanol, ou áucôl etílico.
O etanol faz parte de um grupo de substâncias orgânicas denominadas álcoois, cujas moléculas apresentam o grupo funcional hidroxila (– OH) ligado a um átomo de carbono saturado. Eles podem sêr representados pela fórmula geral R – OH, em quê o grupo R é uma cadeia carbônica.

Além do etanol, outros exemplos são o metanol, usado como combustível de carro de corrida, o propan-2-ol (ou isopropanol), usado na limpeza de materiais vítreos, como lentes de óculos e telas de eletrônicos, e o propan-1,2,3-triol (ou glicerol), usado na fabricação de sabonêtis quê agem como hidratantes de péle.
Acompanhe a seguir as representações das estruturas de suas moléculas.
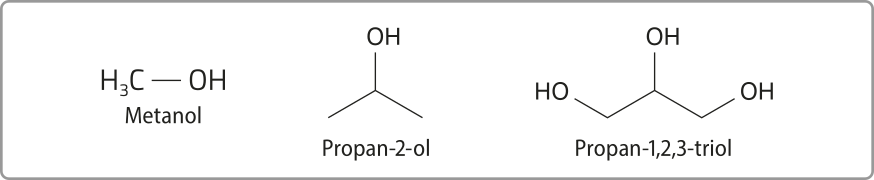
O grupo hidroxila confere às moléculas uma polaridade considerável, especialmente se o número de hátomus de carbono presente for pequeno ou o número de hidroxilas for relativamente grande, como no caso do glicerol.
O metanol e o etanol, embora tênham estruturas semelhantes, produzem efeitos bem distintos no organismo. A toxicidade do metanol é consideravelmente maior, pois ele é metabolizado em ácido fórmico, uma substância quê póde ligar-se d fórma permanente a certos receptores, levando ao risco de cegueira.
ESPAÇOS DE APRENDIZAGEM
• O texto a seguir apresenta dados sobre a produção de etanol e de biodiesel no país.
CAMPOS JÚNIOR, Geraldo. Produção de etanol e de biodiesel volta a crescer e bate récorde. Poder360, [s. l.], 13 jul. 2024. Disponível em: https://livro.pw/qvwvm. Acesso em: 14 out. 2024.
Página trezentos e trinta e quatro
Nomenclatura dos álcoois
A nomenclatura dos álcoois, assim como a dos hidrocarbonetos e a das substâncias nitrogenadas, segue as regras de nomenclatura estabelecidas pela IUPAC. Na formação dos nomes dos álcoois, primeiramente, determina-se o número de carbonos da cadeia principal, para definir o prefixo (met-/et-/prop-, por exemplo). Em seguida, adicionam-se os infixos relativos à saturação da cadeia carbônica (-an-/-en-/-in-). Por fim, adiciona-se -ol, quê é o sufixo característico para o grupo funcional dos álcoois.
Nas moléculas contendo um átomo de carbono ou dois hátomus dêêsse elemento, não há possibilidade de variação na posição da hidroxila. No entanto, quando há três hátomus de carbono ou mais, o grupo hidroxila póde estar ligado a hátomus de carbono em diferentes posições, formando mais de um tipo de áucôl. Para dar nome a essas substâncias, é preciso informar as posições nas quais o grupo funcional está ligado, em relação ao restante da molécula, de uma forma não ambígua. Para isso, numeram-se sequencialmente os carbonos da cadeia, de modo a obtêr o menor número possível para o carbono ao qual o grupo funcional está ligado. Acompanhe os exemplos de dois álcoois com a mesma fórmula molecular, apresentando 3 hátomus de carbono em cada um.
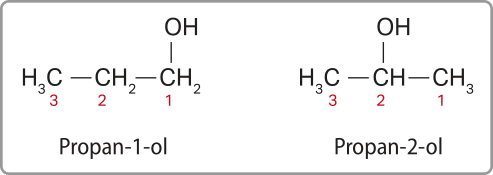
Note quê, diferentemente do propan-1-ol, no caso do propan-2-ol, não importa de quê lado a numeração vai sêr iniciada, uma vez quê ambas as extremidades estão à mesma distância do grupo funcional. Quando há mais de uma hidroxila, todos os números localizadores devem sêr informados, separados por vírgula.
Caso um áucôl apresente uma ligação dupla em sua estrutura, também é preciso indicar sua posição, como nos exemplos a seguir. Neles, a numeração sequencial também parte do carbono ao qual o grupo funcional está ligado.
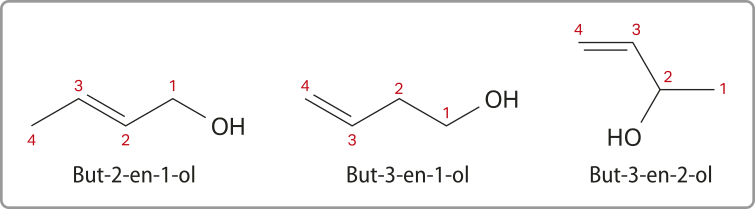
Enóis
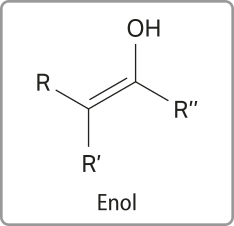
Diferentemente dos álcoois, os enóis são substâncias orgânicas cujas moléculas apresentam uma hidroxila (– OH) ligada a um átomo de carbono quê faz ligação dupla com outro átomo de carbono.
Os enóis podem sêr representados pela estrutura geral mostrada a seguir, em quê os grupos R, R’e R’’ podem sêr hátomus de hidrogênio ou cadeias carbônicas de tamãnho variável.
Página trezentos e trinta e cinco
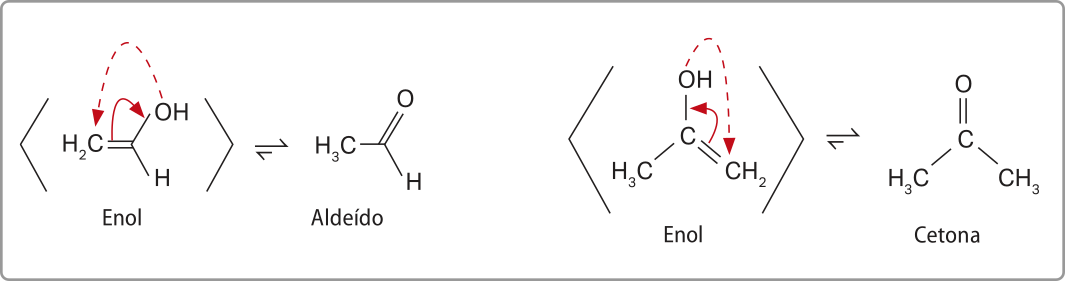
Os enóis são pouco estáveis e se apresentam em equilíbrio com as formas aldeídicas e cetônicas equivalentes (funções abordadas mais adiante). A conversão entre uma forma e outra ocorre pelo deslocamento do hidrogênio da hidroxila para o átomo de carbono quê faz ligação dupla com o átomo de carbono ligado à hidroxila. Esse fenômeno é denominado táutômería. Acompanhe a representação dêêsse processo a seguir.
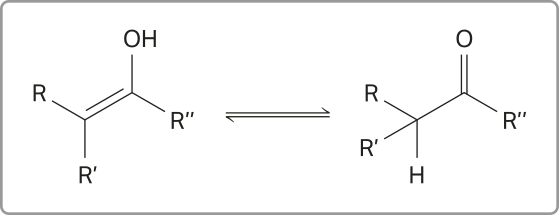
Se R’’ for um átomo de hidrogênio, o enol entrará em equilíbrio com um aldeído, e o equilíbrio estabelecido é conhecido como aldo-enólico. Porém, se R’’ for uma cadeia carbônica, o enol entrará em equilíbrio com uma cetona, e será estabelecido um equilíbrio ceto-enólico. Nesses equilíbrios, o enol, em razão de sua instabilidade, está presente em menor proporção. A representação de uma seta diréta maior do quê a invérsa traduz isso, como mostrado nos exemplos a seguir.
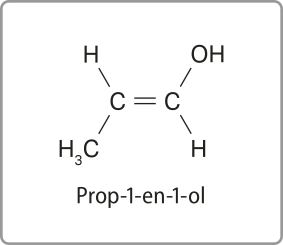
Nomenclatura dos enóis
O nome dos enóis é dado exatamente da mesma forma quê o dos álcoois. Como sempre, há uma ligação dupla. Deve-se indicá-la (com o infixo -en-) e numerar sua posição (a partir do carbono ligado à hidroxila), utilizando o mesmo sufixo -ol, conforme feito para os álcoois. Acompanhe um exemplo.
Fenóis
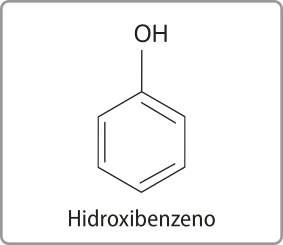
Os fenóis são substâncias orgânicas cujas moléculas apresentam uma hidroxila (–OH) ou mais ligada a um anel aromático. Os fenóis podem sêr representados pela fórmula básica Ar– OH, em quê Ar é um radical arila, como um fenil (C6H5–).
O fenol mais simples é o hidroxibenzeno, também conhecido como fenol comum ou benzenol, quê tem fórmula molecular C6 H5 OH. Acompanhe a representação a seguir.
As ligações químicas nos anéis aromáticos conferem propriedades características a essas estruturas e, consequentemente, às substâncias aromáticas. Entre essas propriedades está o fato de os fenóis serem levemente ácidos, ao contrário dos álcoois, quê têm acidez praticamente nula.
Página trezentos e trinta e seis
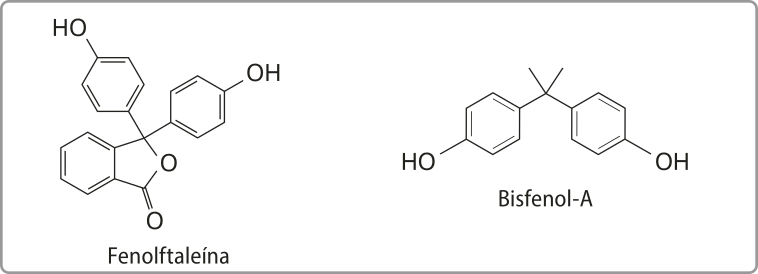
Acompanhe a seguir as representações das estruturas das moléculas de dois fenóis, a fenolftaleína, indicador de pH, e o bisfenol-A, utilizado para a fabricação de plásticos.

Nomenclatura dos fenóis
Para nomear a função OR GÂNICA fenol, a IUPAC recomenda quê a substância fenol seja considerada um derivado do benzeno. Assim, o prefixo hidroxi- se refere à hidroxila (OH), e os demais ligantes ao anel benzênico são considerados substituintes. Considere os exemplos a seguir.

Note quê o carbono ligado à hidroxila é numerado como 1, e o carbono ligado a outro grupo recebe a menor numeração possível em relação ao carbono do grupo – OH.
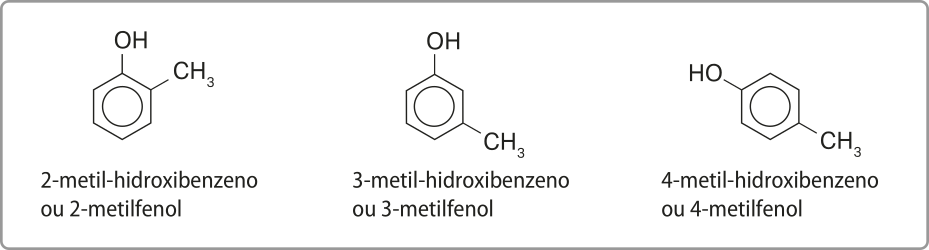
Entretanto, a IUPAC também permite o uso do nome comum fenol. Nesse caso, as substâncias derivadas do fenol seguem uma nomenclatura baseada nele, conforme indicado a seguir.
ESPAÇOS DE APRENDIZAGEM
• O seguinte texto discute a relação entre o consumo de alimentos ricos em polifenóis e a atividade física.
FURLAN, Aline da Silva; RODRIGUES, Lovaine. Consumo de polifenóis e sua associação com conhecimento nutricional e atividade física. Revista Brasileira de Medicina do Esporte, [São Paulo], v. 22, n. 6, p. 461-464, nov./dez. 2016. Disponível em: https://livro.pw/xhudj. Acesso em: 14 out. 2024.
Página trezentos e trinta e sete
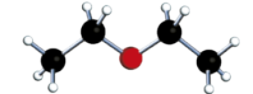
Éteres
A palavra éter foi, por muito tempo, utilizada com uma conotação mística, sêndo passada dos alquimistas para os químicos como um nome para representar um tipo de substância ou de energia quê preenche o espaço ao redor das pessoas. Com o avanço da Ciência, várias teorias e vários modelos foram desenvolvidos para explicar o comportamento do ar, das radiações e de outros fenômenos, até quê o termo éter passou a sêr utilizado apenas para designar um grupo de substâncias orgânicas.
O primeiro éter recebeu esse nome, em 1729, do químico alemão August Sigmúm Frobenius (c. 1700-1741). Ele obteve a substância com propriedades singulares destilando preparados de plantas e a chamou de espírito de vinho etéreo. No artigo em quê apresenta a substância, foram descritas várias de suas propriedades, entre as quais sua volatilidade e inflamabilidade.
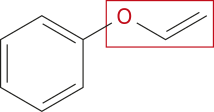
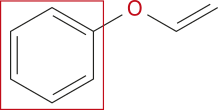
Atualmente, o grupo funcional éter é caracterizado pela presença de um átomo de oxigênio ligado a dois hátomus de carbono, ou seja, um átomo de oxigênio no meio da cadeia carbônica, na forma de heteroátomo.
Os éteres podem sêr representados pela fórmula básica R – O – R’, em quê R e R’ são cadeias carbônicas de tamãnho variável (iguais ou não).
Eles podem ocorrer na forma acíclica ou cíclica e apresentar aromaticidade, como o furano. Os éteres menóres são solventes com polaridade intermediária, o quê lhes confere a capacidade de se misturarem a substâncias polares e apolares – porém, com miscibilidade variável em cada caso.
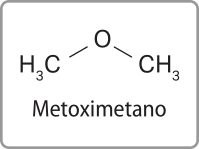
Acompanhe a seguir a representação do éter metoximetano.
LYMAN, ênrri. Clover's inhaler for ether ênd nitrous oxide. In: LYMAN, ênrri. Artificial anaesthesia ênd anaesthetics. London: Sampson Low, Marston, Searle & Rivington, 1882. p. 41.
Nomenclatura dos éteres
Para éteres formados por duas cadeias carbônicas diferentes (R e R’), a regra geral consiste em, primeiramente, definir qual das duas é a maior ou a mais compléksa. Essa cadeia deve sêr nomeada sem considerar o átomo de oxigênio.
A cadeia menor ou a mais simples, chamada de grupo alcoxila, é nomeada seguindo as regras de nomenclatura de hidrocarbonetos, porém é acrescentado o sufixo -oxi ao nome. Quando esse grupo é derivado de um alcano, basta utilizar o prefixo indicativo do número de carbonos (met-, et-, prop- etc.) somado a -oxi. Caso seja derivado de um alceno ou alcino, ao prefixo indicativo do número de carbonos é acrescentado -eniloxi e -iniloxi, respectivamente.
Página trezentos e trinta e oito
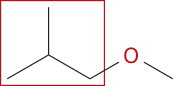
O nome da substância é feito pela junção do nome do grupo alcoxila com o da outra cadeia, sem separação por hífên. Quando a cadeia principal tiver mais de uma posição em quê o grupo alcoxila possa se ligar, essa localização deve sêr indicada antes do nome do grupo alcoxila.
Acompanhe a seguir alguns exemplos.
Nomenclatura de alguns éteres
Estrutura do éter |
Cadeia mais simples (alcóxi) |
Nome da cadeia mais simples |
Cadeia principal |
Nome da cadeia principal |
Nome do éter |
|---|---|---|---|---|---|
|
|
Metóxi |
|
Etano |
Metoxietano |
|
|
Etenilóxi |
|
Benzeno |
Eteniloxibenzeno |
|
|
Metóxi |
|
2-metilpropano |
1-metóxi-2-metilpropano |
Como se póde notar, quando uma das cadeias apresenta ramificações ou insaturações, os nomes ficam mais compléksos. Por isso, há outro modo de os éteres serem nomeados, quê não segue as regras da IUPAC, mas é bastante utilizado e consiste em considerar ambas as cadeias como substituintes. Nesse caso, utilizam-se seus nomes aos quais é acrescentada a palavra éter.
Acompanhe a seguir os mesmos exemplos apresentados antes, mas agora com nomenclatura não oficial.
Estrutura do éter |
Substituinte |
Nome alternativo da cadeia mais simples |
Substituinte |
Nome alternativo da cadeia principal |
Nome do éter |
|---|---|---|---|---|---|
|
|
Metil |
|
Etil |
Etil mêtíl éter |
|
|
Etenil |
|
Fenil |
Etenil fenil éter |
|
|
Metil |
|
metilpropil |
Metil 2-metilpropil éter |
Nomenclatura não oficial de alguns éteres
Nesses casos, os nomes dos substituintes seguem a ordem alfabética. Para éteres formados por duas cadeias iguais, pode-se utilizar o prefixo dimais o nome do substituinte, seguido pela palavra éter.
Página trezentos e trinta e nove
Aldeídos e cetonas
Nessas classes de substância, o grupo funcional é formado por uma carbonila (![]() , um átomo de oxigênio ligado a um átomo de carbono por uma ligação dupla.
, um átomo de oxigênio ligado a um átomo de carbono por uma ligação dupla.
O quê diferencia, porém, um aldeído de uma cetona é a localização da carbonila na cadeia carbônica. Nos aldeídos, o grupo funcional está localizado sempre em carbonos primários (ou seja, carbonos quê se ligam a somente outro átomo de carbono), apresentando a estrutura básica R – CHO, em quê o grupo R póde sêr um átomo de hidrogênio ou cadeias carbônicas de tamãnho variável. Já as cetonas apresentam a carbonila localizada em carbonos secundários (ou seja, carbonos quê se ligam a dois outros hátomus de carbono), cuja estrutura básica é R – CO – R’, em quê os grupos R e R’ podem sêr cadeias carbônicas de tamãnho variável (iguais ou diferentes).
Acompanhe a seguir as fórmulas estruturais gerais de aldeídos e cetonas.
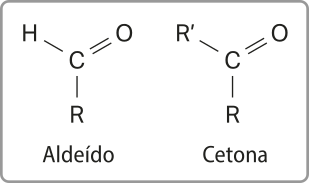
Os aldeídos e as cetonas apresentam estruturas parecidas e, portanto, têm propriedades semelhantes. A presença de um hidrogênio ligado à carbonila, no entanto, torna o grupo funcional dos aldeídos mais reativo do quê o das cetonas.
Nomenclatura dos aldeídos e das cetonas
Tanto os aldeídos como as cetonas podem sêr nomeados seguindo-se as regras básicas para os hidrocarbonetos, com as mesmas especificidades dos álcoois, alterando apenas os sufixos utilizados. Para os aldeídos, o sufixo adotado é -al (início da palavra aldeído), e, para as cetonas, usa-se o sufixo -ona (fim da palavra cetona).
No caso das cetonas, deve-se indicar a posição da carbonila na cadeia carbônica, especialmente quando há mais de uma possível. A seguir, acompanhe a nomenclatura, estrutura e usos de algumas dessas substâncias.
Metanal (formol)
Apesar de não sêr sua principal aplicação, o formol é conhecido por sua capacidade de conservar tecídos animais, por isso é utilizado em embalsamentos.

Butano-2,3-diona
Tem odor e sabor característicos de manteiga, por isso é incorporada na produção de margarinas.

Página trezentos e quarenta
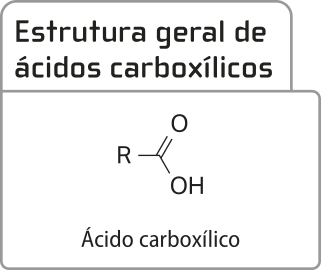
Ácidos carboxílicos
A função ácido carboxílico é caracterizada pelo grupo funcional denominado carboxila (–COOH), quê é formado pela ligação de uma hidroxila a uma carbonila. Acompanhe a fórmula estrutural geral dos ácidos carboxílicos, em quê R póde sêr um átomo de hidrogênio ou uma cadeia carbônica de tamãnho variável.
A presença da carboxila torna as moléculas dos ácidos carboxílicos bastante polares, e o aumento da densidade de carga negativa, em razão da presença dos hátomus de oxigênio, torna a ligação entre o oxigênio e o hidrogênio da hidroxila mais enfraquecida e o átomo de hidrogênio mais ionizável. Logo, os ácidos carboxílicos se dissociam em meio aquoso, de acôr-do com o equilíbrio químico representado a seguir.
RCOOH(aq) + H2O((éli)") → RCOO− (aq) + H3O+ (aq)
Apesar díssu, os ácidos carboxílicos são considerados ácidos fracos quando comparados com ácidos inorgânicos, como ácido clorídrico, ácido nítrico e ácido sulfúrico. Eles podem reagir com bases fortes, formando sais com cátions metálicos, chamados sais de ácidos orgânicos ou sais de ácidos carboxílicos, em reações de neutralização quê podem sêr representadas da seguinte forma:
RCOOH(aq) + NaOH(aq) → RCOONa(aq) + H2O((éli)")
Os ácidos carboxílicos de cadeias longas, não ramificadas e monocarboxílicas, ou seja, com apenas um grupamento carboxila, são chamados ácidos grachos. Essas substâncias podem sêr classificadas em insaturadas (que apresentam insaturação na cadeia carbônica) ou saturadas (que apresentam cadeia carbônica linear e saturada). O ácido oleico (nome comum), presente em azeite de oliva, é exemplo do primeiro, e o ácido láurico (nome comum), presente em óleo de coco, é exemplo do segundo.
Nomenclatura dos ácidos carboxílicos
Antes de havêer uma nomenclatura sistemática, os nomes das substâncias estavam relacionados, principalmente, com sua origem. O ácido metanoico, por exemplo, quando identificado, recebeu o nome de ácido fórmico por sêr encontrado em algumas espécies de formiga quê o utilizam como mecanismo de defesa.
A nomenclatura dos ácidos carboxílicos é relativamente simples, já quê o grupo funcional inclui um dos carbonos terminais da molécula. Para nomeá-los, utiliza-se a palavra ácido seguida do nome do grupo R quê está ligado ao grupo funcional. Por fim, adiciona-se o sufixo -oico.
É importante destacar quê, para realizar a contagem de carbonos, aquele ligado aos hátomus de oxigênio deve sêr considerado.
Para identificar as posições de ramificações, as insaturações e os outros grupos funcionais, contam-se os carbonos a partir daquele ligado aos hátomus de oxigênio.

Página trezentos e quarenta e um
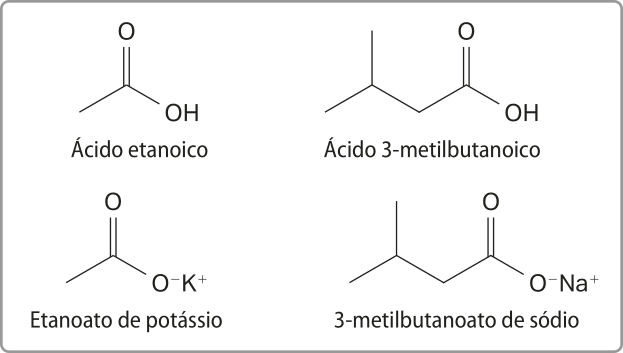
A nomenclatura dos sais orgânicos é semelhante à dos sais inorgânicos. Ela é feita pelo nome do ânion seguido do conectivo de e do nome do cátion. Para nomear o ânion orgânico, substitui-se o sufixo -oico do ácido por -ato.
Os nomes de alguns sais formados dos ácidos etanoico e 3-metilbutanoico são apresentados a seguir.
Ésteres
Outra função OR GÂNICA caracterizada pela presença de dois hátomus de oxigênio é a dos ésteres, substâncias presentes naturalmente em óleos e gorduras, em essências de frutas e flores e nas ceras (de carnaúba e de abelhas, por exemplo). Industrialmente, são empregados na produção de flavorizantes alimentícios (substâncias usadas para dar sabor e aroma), medicamentos, perfumes, cosméticos, biocombustíveis etc.
Eles podem sêr entendidos como derivados de ácidos carboxílicos, resultantes da substituição do hidrogênio da carboxila por uma cadeia carbônica de tamãnho variável. Dessa forma, os ésteres apresentam a fórmula básica R – COO – R’, em quê R póde sêr um átomo de hidrogênio ou uma cadeia carbônica de tamãnho variável, e R’ póde sêr uma cadeia carbônica de tamãnho variável.
Pode-se representar a fórmula estrutural geral dos ésteres da seguinte maneira.
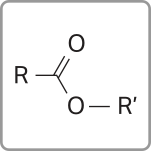
Vale mencionar quê todos os Rs representados até aqui podem sêr substituintes orgânicos (ou seja, cadeias carbônicas ligadas a grupos funcionais). No entanto, nesses casos, passa-se a ter funções orgânicas mistas (por exemplo, em uma mesma molécula, as funções amina e álcool).
Quando os ésteres reagem com substâncias alcalinas em meio aquoso, como o hidróxido de sódio (NaOH), ocorre uma transformação conhecida como hidrólise básica, quê produz um sal orgânico de ácido carboxílico e um áucôl.
A saponificação, nome do processo utilizado para a fabricação de sabões, consiste em uma hidrólise básica de triglicerídios (ésteres com três grandes cadeias carbônicas), produzindo glicerol e sais de ácidos grachos (sais de ácidos carboxílicos com longas cadeias carbônicas, ou seja, sabões).

Página trezentos e quarenta e dois
Nomenclatura dos ésteres
Os nomes dos ésteres são dados por meio da definição dos nomes das duas cadeias carbônicas R e R’. A cadeia R, quê inclui o carbono quê se liga a ambos os hátomus de oxigênio, é considerada a principal.
Para construir seu nome, utiliza-se o sufixo -oato no nome determinado pelas regras de nomenclatura já estudadas. Por exemplo, a cadeia R com um carbono se chama metanoato, já as cadeias R com dois e três carbonos se chamam etanoato e propanoato, respectivamente.
A cadeia R’ recebe o nome comumente utilizado para substituintes, com a adição da letra a ao final. Para compor o nome do éster, utiliza-se ainda a preposição de entre as duas palavras, levando à estrutura final do tipo -oato de -ila. Acompanhe alguns exemplos.
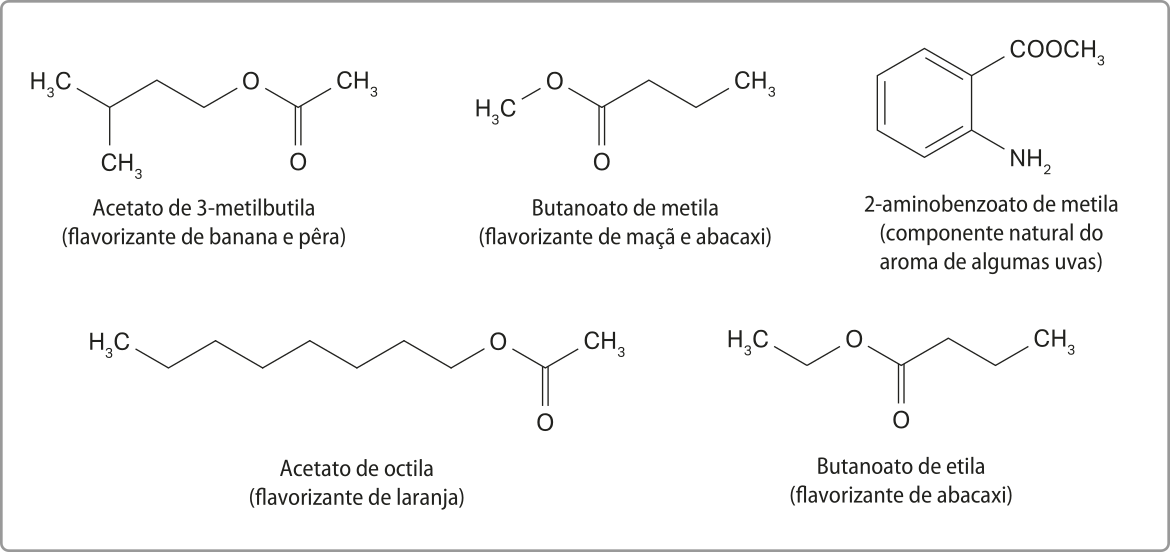
FORMAÇÃO CIDADÃ
Sabões biodegradáveis
Embora os detergentes sêjam eficazes na formação de espuma e na remoção de sujeiras, os sabões apresentam uma vantagem significativa em termos ambientais: eles são menos nocivos, pois são biodegradáveis. Isso ocorre porque são produzidos a partir de óleos e gorduras naturais quê contêm moléculas com cadeias carbônicas lineares. Essas cadeias podem sêr facilmente quêbradas por microrganismos presentes no ambiente, permitindo que os sabões se degradem naturalmente.
Os detergentes, por outro lado, podem sêr tanto biodegradáveis quanto não biodegradáveis, dependendo de sua estrutura química. Os detergentes biodegradáveis são aqueles cujas moléculas possuem longas cadeias carbônicas lineares, com um número par de hátomus de carbono, o quê facilita sua decomposição pelas enzimas de microrganismos aquáticos. No entanto, quando as cadeias são ramificadas ou de estrutura compléksa, os detergentes se tornam resistentes à biodegradação, acumulando-se no ambiente e causando danos ecológicos. Os grandes acúmulos de espuma nos rios, chamados cisnes de detergente, são um exemplo.
O descarte inadequado de alguns produtos, como sabão em pó, detergente e xampu, também contribui para a formação dessas espumas nocivas, quê são intensificadas pela movimentação das águas, como acontece em rios com forte correnteza ou em dias de ventos intensos.
Página trezentos e quarenta e três
Um exemplo recente ocorreu no Rio Tietê, em 2023, quando grandes quantidades de espuma tóxica se formaram por causa do acúmulo de resíduos químicos, prejudicando o éco-sistema local e chamando atenção para a necessidade do descarte consciente e de políticas de contrôle ambiental mais rigorosas.
ATIVIDADES
1. Pesquise leis quê regulam o uso de sabões e detergentes não biodegradáveis no país e apresente-as. Em seu entendimento, essas normas são suficientes para quê os problemas ambientais causados por esses produtos não ocorram mais?
2. Você sabe identificar se um produto é biodegradável? Pesquise, em sáites confiáveis, informações para identificar os detergentes biodegradáveis. Elabore um modo de informar as pessoas sobre sua descoberta, póde sêr um texto curto, uma imagem ou um vídeo, mas lembre-se de incluir nessa elaboração os conhecimentos químicos quê aprendeu.

ATIVIDADES
1. O etanol é produzido de plantas ou raízes, como a cana-de-açúcar, a cevada e o trigo. O etanol é utilizado em muitos países, mas em muitos deles esse áucôl é misturado a outros combustíveis. No caderno, indique as vantagens da adição do etanol em outros combustíveis.
2. Há alguns anos, notícias alarmantes sobre a presença do bisfenol-A (bê p ah) em mamadeiras plásticas deixaram os responsáveis preocupados, causando uma corrida pela troca dêêsse utensílio tão comum nos lares com crianças pequenas. Reportagens afirmavam quê o bê p ah poderia provocar câncer e outras doenças. Posteriormente, pesquisas indicaram quê o alarde parecia exagerado, já quê o bê p ah seria inofensivo nas quantidades presentes nos plásticos utilizados na época. Apesar díssu, a suspeita permaneceu, e a indústria se apressou em produzir mamadeiras com o rótulo contendo a informação de quê o produto era livre de bê p ah. Afinal, essa substância póde ou não causar danos à saúde quando presente em mamadeiras plásticas? Faça uma pesquisa sobre o assunto em sáites confiáveis e escrêeva, no caderno, um pequeno texto resumindo as informações encontradas.
3. Faça uma pesquisa em fontes confiáveis e apresente os principais problemas do uso de formol em tratamentos estéticos para consumidores e profissionais da beleza. Você póde fazer um texto argumentativo, produzir uma imagem, um vídeo ou mesmo uma tirinha de quadrinhos.
4. Os ésteres, substâncias orgânicas comuns na natureza, podem sêr obtidos de uma reação de esterificação entre um ácido carboxílico e um áucôl. Para a indústria de alimentos e de cosméticos, qual é a importânssia de desenvolver novas formas de síntese de ésteres?
5. A fabricação de perfumes depende muito do conhecimento derivado da indústria química. Muitos perfumes de marcas famosas contêm compostos orgânicos específicos, como o decanal (C10H20O). Com base no nome e na fórmula molecular apresentados, indique a quê funções orgânicas essa substância pertence. Pesquise e identifique outras substâncias amplamente utilizadas na fabricação de perfumes.
Página trezentos e quarenta e quatro
TEMA
29
isômería
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Você já pensou em como as substâncias com a mesma fórmula molecular podem ter comportamentos diferentes? No mundo da Química, isso é mais comum do quê parece. Considere duas moléculas quê parecem idênticas. Elas têm a mesma quantidade e os mesmos tipos de hátomus, mas algo sutil as diferencia, fazendo com quê suas propriedades e até suas aplicações sêjam distintas. Esse fenômeno é chamado de isômería.
A isômería revela um dos aspectos mais intrigantes da Química Molecular, mostrando quê pequenas mudanças na disposição dos hátomus podem gerar grandes variações no comportamento de uma substância. Isso se reflete em muitos processos naturais e em produtos usados no dia a dia, como medicamentos e materiais sintéticos.
Neste Tema, serão abordados os diversos tipos de isômería, considerando a estrutura tridimensional das moléculas e a maneira como os hátomus estão ligados.
REFLITA
1 Com base no quê estudou até agora, sugira uma maneira de distinguir moléculas quê apresentam a mesma fórmula molecular, mas são diferentes.
isômería plana
Por volta do ano de 1820, o químico alemão Justus von Liebig (1803-1873) Minvestigou o fulminato de prata, uma substância explosiva, e determinou sua fórmula molecular (AgCNO). Nessa mesma época, fridichi Wöhler, seu compatriota, estudava outra substância, o cianato de prata, quê tem a mesma fórmula molecular (AgCNO), mas não apresentava comportamento explosivo.
A Ciência da época considerava quê as propriedades de uma substância estavam diretamente ligadas à sua composição química. Portanto, a ideia de quê duas substâncias tão diferentes tivessem a mesma fórmula parecia absurda, levando a crer quê um dos dois cientistas estivesse equivocado.
Foi o químico sueco Jöns Jacob Berzelius quêm ajudou a esclarecer essa questão. Ao analisar os dados de Liebig e Wöhler, assim como de outros cientistas que também haviam obtído resultados intrigantes do mesmo tipo, Berzelius concluiu quê as substâncias com a mesma fórmula molecular poderiam ter estruturas diferentes. Para explicar essa descoberta, ele cunhou o termo isômería, quê em grego significa “mesma composição” (iso) e “partes” (meros).
Assim, a isômería ocorre quando duas ou mais substâncias têm os mesmos hátomus em suas fórmulas, mas eles estão organizados de maneiras distintas. Essas substâncias, chamadas isômeros, apresentam propriedades diferentes justamente por causa dessas variações na disposição dos hátomus, ainda quê suas fórmulas moleculares sêjam idênticas.
A isômería póde sêr dividida em dois grupos principais: a plana e a espacial. Esses tipos de isômería, por sua vez, são divididos em subgrupos.
A isômería plana, também chamada de constitucional, é dividida em cinco classes: isômería de função; isômería de cadeia; isômería de posição; isômería de compensação; e táutômería.

Página trezentos e quarenta e cinco
isômería de função
Na isômería de função, as substâncias apresentam a mesma fórmula molecular, mas pertencem a funções orgânicas diferentes.
Para exemplificá-la, analise os isômeros a seguir.
Exemplo de isômeros de função
Substância 1 |
Substância 2 |
|
|---|---|---|
Fórmula molecular |
C2H6O |
C2H6O |
Fórmula condensada |
H3CCH2OH |
H3COCH3 |
Função OR GÂNICA |
Álcool |
Éter |
Nome |
Etanol |
Dimetil éter |
Fórmula estrutural tridimensional (imagens sem escala; cores fantasia). |
|
|
As esferas pretas representam hátomus de carbono, as esferas brancas, hátomus de hidrogênio, e as esferas vermelhas, hátomus de oxigênio.
Um dos isômeros é um áucôl, e o outro é um éter. As diferenças estruturais de cada molécula, quê resultam em diferentes interações intermoleculares, conferem propriedades físico-químicas distintas às substâncias.
isômería de cadeia
Na isômería de cadeia, as substâncias têm a mesma fórmula molecular e a mesma função OR GÂNICA, mas apresentam cadeias carbônicas diferentes.
Para exemplificá-la, analise os isômeros a seguir.
Exemplo de isômeros de cadeia
Substância 1 |
Substância 2 |
|
|---|---|---|
Fórmula molecular |
C4H10 |
C4H10 |
Fórmula condensada |
H3CCH2CH2CH3 |
H3CCH(CH3)CH3 |
Função OR GÂNICA |
Hidrocarboneto |
Hidrocarboneto |
Nome |
Butano |
Metilpropano |
Fórmula estrutural tridimensional (imagens sem escala; cores fantasia). |
|
|
As esferas pretas representam hátomus de carbono, e as esferas brancas, hátomus de hidrogênio.
Ambos os isômeros são hidrocarbonetos quê diferem em relação à cadeia carbônica. O butano é uma substância de cadeia aberta e normal, enquanto o metilpropano é um hidrocarboneto de cadeia aberta e ramificada. Essas diferenças na cadeia carbônica conferem diferentes propriedades físico-químicas aos isômeros.
Página trezentos e quarenta e seis
isômería de posição
Na isômería de posição, as substâncias apresentam a mesma fórmula molecular e a mesma função OR GÂNICA, mas diferem na posição em quê o grupo funcional está ligado à cadeia carbônica.
Para exemplificá-la, analise os isômeros a seguir.
Exemplo de isômeros de posição
Substância 1 |
Substância 2 |
|
|---|---|---|
Fórmula molecular |
C3H8O |
C3H8O |
Fórmula condensada |
H3CCH(OH)CH3 |
H3CCH2CH2OH |
Função OR GÂNICA |
Álcool |
Álcool |
Nome |
Propan-2-ol |
Propan-1-ol |
Fórmula estrutural tridimensional (imagens sem escala; cores fantasia). |
|
|
As esferas pretas representam hátomus de carbono, as esferas brancas, hátomus de hidrogênio, e as esferas vermelhas, hátomus de oxigênio.
Ambas as substâncias apresentadas são álcoois. Porém, note quê o propan-1-ol apresenta o grupo funcional ligado a um carbono primário (carbono quê se liga somente a outro átomo de carbono), enquanto no propan-2-ol a hidroxila está ligada a um carbono secundário (carbono quê se liga a dois outros hátomus de carbono).
isômería de compensação
Na isômería de compensação, também chamada de metameria, os isômeros diferem em relação à posição do heteroátomo, ou seja, do átomo diferente de carbono presente na cadeia carbônica. Essa situação póde sêr interpretada como um caso específico de isômería de posição.
Para exemplificá-la, analise os isômeros de fórmula molecular C4 H10 O a seguir.
Exemplo de isômeros de compensação
Substância 1 |
Substância 2 |
|
|---|---|---|
Fórmula molecular |
C4H10O |
C4H10O |
Fórmula condensada |
H3CCH2OCH2CH3 |
H3COCH2CH2CH3 |
Função OR GÂNICA |
Éter |
Éter |
Nome |
Dietil éter |
Metil propil éter |
Fórmula estrutural tridimensional (imagens sem escala; cores fantasia). |
|
|
As esferas pretas representam hátomus de carbono, as esferas brancas, hátomus de hidrogênio, e as esferas vermelhas, hátomus de oxigênio.
Note quê ambas as substâncias são éteres de mesma fórmula molecular. Porém, analisando as fórmulas estruturais tridimensionais, pode-se verificar quê o heteroátomo – átomo de oxigênio – está localizado em posições diferentes em cada molécula.
Página trezentos e quarenta e sete
táutômería
A táutômería póde sêr considerada um caso particular de isômería de função, na qual os isômeros coexistem em equilíbrio dinâmico. No Tema anterior, foi estudado um exemplo, o equilíbrio entre enóis e cetonas ou entre enóis e aldeídos.
Na táutômería, diferentemente do quê ocorre na isômería de função, as substâncias diferentes existem em equilíbrio.
isômería espacial
Na isômería espacial, a diferença entre os isômeros não está na ligação entre os hátomus, como ocorre na isômería plana, e sim na disposição espacial dêêsses hátomus na estrutura das moléculas.
Há dois tipos de isômería espacial: isômería geométrica e isômería óptica.
REFLITA
2 Como é possível diferenciar um objeto simétrico de um objeto assimétrico?
isômería geométrica
Considere a fórmula estrutural da substância 1,2-dicloroetano representada a seguir.
Note quê a ligação simples entre os hátomus de carbono permite a livre rotação da molécula no eixo da ligação. A energia necessária para quê ocorra uma rotação em torno do eixo de uma ligação simples carbono-carbono é relativamente pequena, portanto os carbonos dessas ligações podem rotar livremente, mesmo à tempera-túra ambiente. Nesse caso, as diferentes fórmulas estruturais representam a mesma substância.
Esses arranjos tridimensionais possíveis, quê se convertem um no outro, de modo contínuo e espontâneo, são denominados isômeros conformacionais ou rotâmeros e apresentam energias potenciais diferentes entre si.
Quando há uma ligação dupla entre os hátomus de carbono, no entanto, essa rotação livre no eixo da ligação não é mais permitida. A energia necessária para quê ocorra uma rotação em torno do eixo de uma ligação dupla C ═ C é alta, logo não é possível o intercâmbio entre uma configuração e outra.
Para facilitar a compreensão dêêsse impedimento de rotação causado pela ligação dupla, analise a seguir duas representações da molécula do but-2-eno. Note como a ligação dupla entre os carbonos possibilita dois arranjos possíveis para os grupos mêtíl (– CH3). Essas duas estruturas representadas, uma denominada cis, e a outra, trans, por não poderem sêr convertidas uma na outra de modo espontâneo, constituem substâncias diferentes, com propriedades físico-químicas distintas. Esse é um exemplo de isômería geométrica.
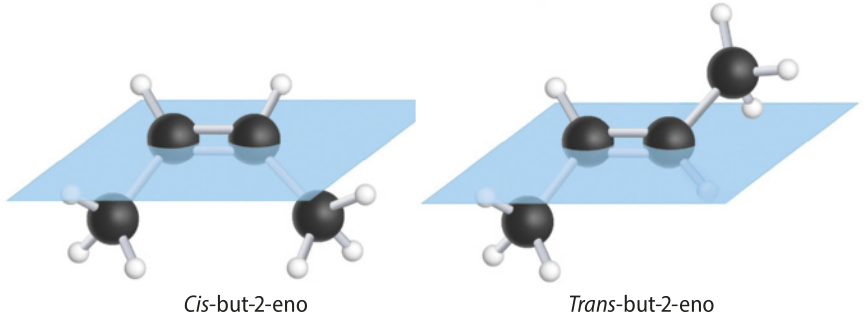
Página trezentos e quarenta e oito
Os termos cis e trans são utilizados como prefixos na nomenclatura de isômeros geométricos quê se diferenciam pela posição de hátomus ou grupos de hátomus em relação a um plano imaginário. Cis vêm do latim e significa “deste lado”. É utilizado quando os hátomus ou os grupos de hátomus iguais se encontram de um mesmo lado do plano. Trans também vêm do latim e significa “através”. É utilizado quando os hátomus ou os grupos de hátomus iguais se encontram em lados opostos do plano.
A isômería cis-trans acíclica é característica dos alcenos ou de seus derivados e ocorre apenas quando cada átomo de carbono está ligado a um átomo de hidrogênio e a um substituinte R.
De forma geral, as diferenças de propriedades físicas, como tempera-túra de ebulição, são pequenas entre esses isômeros, podendo aumentar com a presença de grupos polares.
FORMAÇÃO CIDADÃ
A Química na alimentação saudável
Leia as informações a seguir e responda às atividades.
Gorduras trans
Você já se perguntou o quê realmente são as gorduras trans? Para entender essa quêstão, é preciso saber que as gorduras podem sêr classificadas em dois tipos principais: saturadas, com ligações simples entre os hátomus de carbono, e insaturadas, com uma ligação dupla ou mais entre os carbonos. No caso das gorduras insaturadas, há duas configurações distintas de isômería geométrica: cis e trans.
Quando as gorduras são do tipo cis, as moléculas têm uma forma não linear, o quê facilita sua degradação no organismo. Já as gorduras trans têm uma estrutura linear e rígida, quê as torna mais difíceis de serem processadas pelo corpo e favorece seu acúmulo nos vasos sangüíneos.
De modo geral, quanto maior for o número de insaturações, menor será a superfícíe de contato, e mais fracas serão as interações intermoleculares entre as cadeias, reduzindo assim a chance de acúmulo de gordura nos vasos sangüíneos.
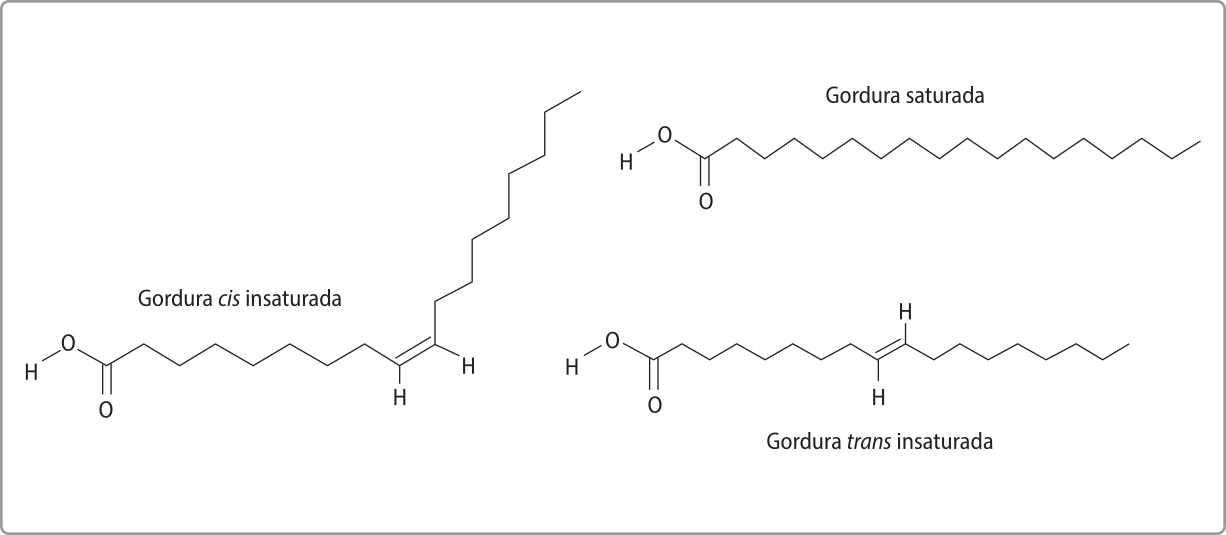
Página trezentos e quarenta e nove
Apesar de as gorduras trans serem raras na natureza, elas são amplamente produzidas pela indústria alimentícia para modificar a textura e a durabilidade de alimentos industrializados, como margarinas, biscoitos, salgadinhos e fast foods. O consumo dessas gorduras é bastante associado a problemas de saúde, como o aumento do colesterol ruim (LDL), a redução do colesterol bom (HDL) e o aumento do risco de doenças cardiovasculares e de diabetes.
Por isso, é sempre uma boa prática verificar os rótulos dos alimentos quando for comprá-los. Aqueles quê indicam 0% de gorduras trans e não apresentam o aviso de alto teor de gorduras saturadas podem sêr opções mais saudáveis para o dia a dia.
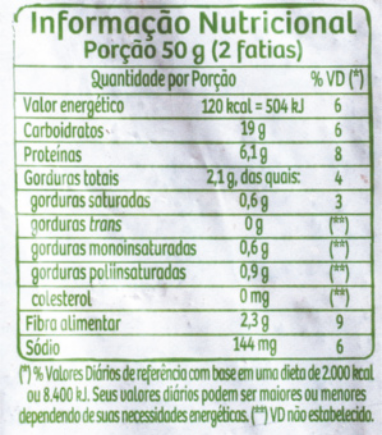

Alimentos orgânicos
[…]
O produtor orgânico se dedica muito para pôdêr entregar produtos com grande valor nutricional e livres de contaminação por agrotóxicos, medicamentos veterinários, transgênicos e tudo mais quê possa pôr em risco a saúde das pessoas, dos animais e do meio ambiente.
Ao adquirir produtos orgânicos, o consumidor leva para casa alimentos saudáveis, cultivados em sistemas produtivos livres de agrotóxicos e materiais sintéticos e contribui para o fortalecimento de um novo modelo de produção agropecuária e agroindustrial, em quê se leva em conta diversas kestões fundamentais à sobrevivência do planêta, como, por exemplo, a manutenção da quantidade e qualidade da á gua e a manutenção da biodiversidade. A sobrevivência e a qualidade de vida das gerações futuras dependem fundamentalmente de nossas práticas produtivas e de nóssos hábitos de consumo.
[…]
BRASIL. Ministério da Saúde. O quê são alimentos orgânicos. Brasília, DF: MS, 26 jan. 2022. Disponível em: https://livro.pw/pnhis. Acesso em: 14 out. 2024.

ATIVIDADES
1. Pesquise quais alimentos contêm gorduras saturadas, insaturadas trans e insaturadas cis.
2. Você sabe o quê é um alimento orgânico? Já comeu algum?
3. Como é possível identificar um alimento orgânico?
4. Pesquise locais de venda de alimentos orgânicos em sua cidade e converse com seus familiares ou responsáveis sobre a possibilidade de substituir os alimentos não orgânicos consumidos em sua residência por alimentos orgânicos, além de evitar comprar alimentos ricos em gorduras saturadas e gorduras trans.
Página trezentos e cinquenta
A isômería cis-trans também ocorre quando a ligação simples entre dois carbonos não póde girar livremente, pois esses carbonos fazem parte de uma cadeia cíclica. Nesse caso, há isômería cis-trans cíclica. Acompanhe um exemplo de um derivado genérico do ciclobutano cujas moléculas estão representadas a seguir.
Analisando as duas representações, nota-se quê a posição das ligações do ciclobutano com os grupos substituintes R em relação aos outros hátomus da molécula não póde sêr alterada, resultando em duas substâncias distintas. Nesse caso também, quando os substituintes R estão do mesmo lado, o isômero é denominado cis; quando estão em lados opostos, o isômero é denominado trans.
isômería E/Z
As regras utilizadas na isômería cis-trans não são suficientes para contemplar casos em quê há mais de um substituinte em pelo menos um dos carbonos da ligação dupla.
Acompanhe o exemplo a seguir.
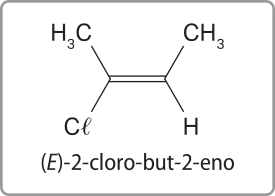
Na molécula representada, cada átomo de carbono da ligação dupla apresenta dois substituintes. Nesse caso, não é possível definir se um isômero apresenta a configuração cis ou trans, pois os substituintes são diferentes. Para isso, uma nova classificação foi estabelecida, utilizando os prefixos E- (do termo em alemão entgegen, quê significa “opostos”) e Z- (do termo em alemão zusammen, quê significa “juntos”).
Para definir qual prefixo será atribuído a cada isômero deve-se identificar os grupos substituintes de maior prioridade. Isso é feito com base nos números atômicos dos hátomus ligados a cada átomo de carbono da ligação dupla. Caso os substituintes com maior número atômico estejam do mesmo lado, é atribuído o prefixo Z- ao isômero. Caso estejam em lados opostos, é atribuído o prefixo E-.
Na representação anterior, para o carbono do lado esquerdo da ligação dupla, os substituintes são o grupo mêtíl e o cloro. Entre eles, define-se como substituinte principal o cloro, pois seu número atômico (Z = 17) é maior do quê o do carbono (Z = 6). No carbono do lado direito da ligação dupla, estão ligados um átomo de hidrogênio e um grupo mêtíl. Nesse caso, o carbono é prioridade em relação ao hidrogênio. Logo, os substituintes com maior número atômico, ou seja, maior prioridade, estão em lados opostos, e o isômero representado é o E.
De maneira análoga, o isômero Z póde sêr representado pela seguinte fórmula estrutural.
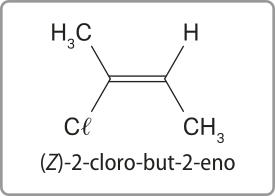
Página trezentos e cinquenta e um
isômería óptica
Ao analisar as mãos, pode-se verificar quê uma é a imagem especular da outra. No entanto, as mãos não são simétricas, ou seja, não existe um plano imaginário capaz de dividi-las em duas partes iguais. Além díssu, elas não são sobreponíveis.
Por outro lado, quando é possível existir um plano imaginário quê divída um objeto em duas partes iguais, diz-se quê ele é simétrico.
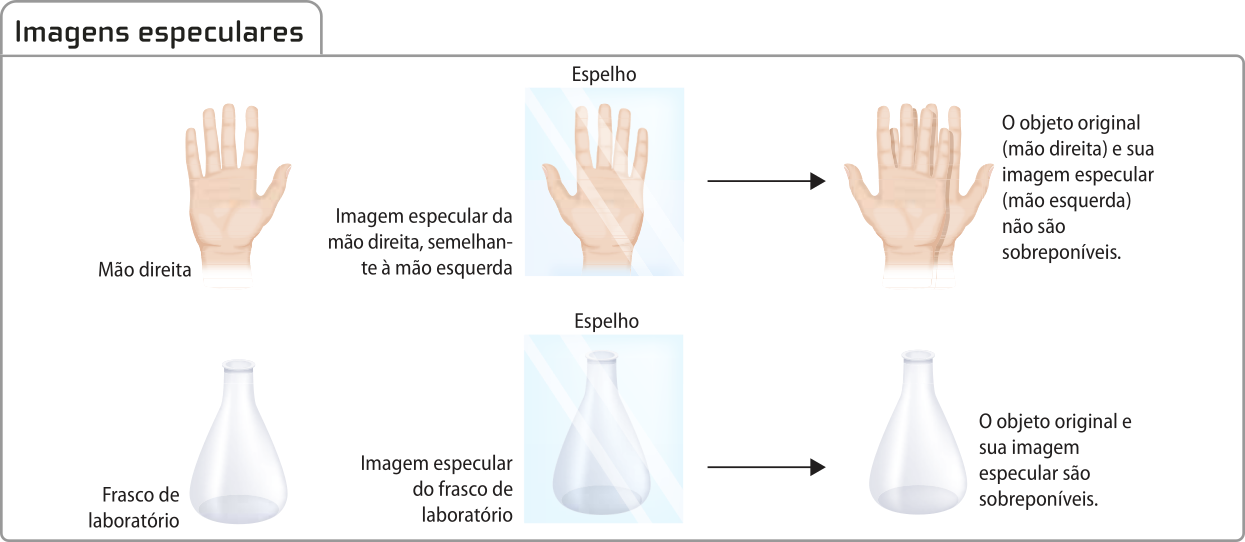
Esses conceitos de simetria e assimetria podem sêr utilizados para verificar se uma molécula apresenta isômeros ópticos. Se uma molécula for simétrica, ela e sua imagem especular serão sobreponíveis. Caso contrário, elas não serão sobreponíveis.
Considere uma molécula simples, formada por um átomo de carbono e quatro substituintes, e um plano imaginário quê a atravesse, dividindo-a em duas partes, como mostra a representação a seguir.
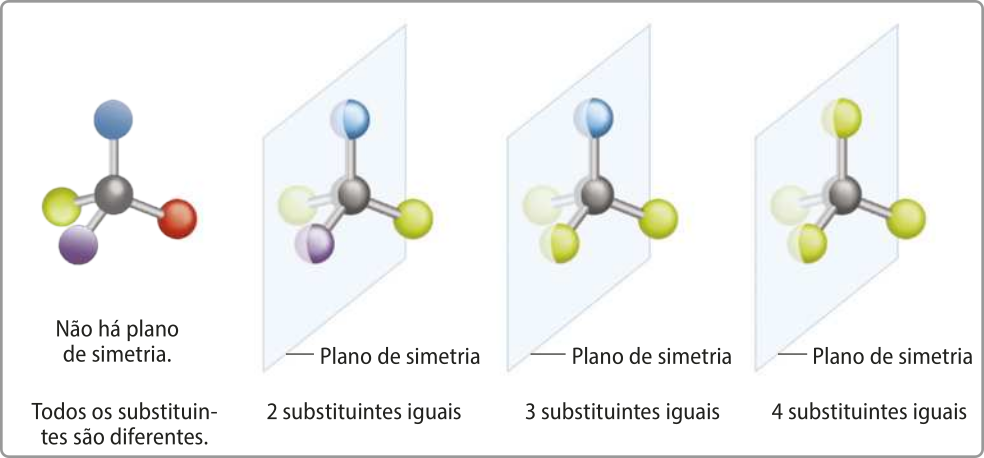
Note quê, quando os quatro substituintes são diferentes, não há plano de simetria, pois a molécula não é dividida em duas partes iguais. Pode-se concluir, portanto, quê essa molécula não é sobreponível à sua imagem especular e deve apresentar, por isso, isômero óptico.
Os isômeros quê são imagem especular um do outro, mas não são sobreponíveis, são denominados enantiômeros, ou isômeros ópticos.
Página trezentos e cinquenta e dois
Quiralidade
A propriedade quê permite a ocorrência de isômería óptica é a quiralidade do átomo de carbono. Um carbono assimétrico ou quiral apresenta quatro ligantes diferentes entre si. Em representações de moléculas orgânicas, é indicado por meio de um asterisco.
O carbono quiral do ácido 2-hidroxipropanoico (ácido lático) está representado a seguir.
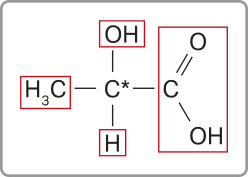
Note quê o carbono quiral (C*) apresenta quatro ligantes diferentes. Por existir um carbono quiral na estrutura da molécula, existirá um par de enantiômeros quê são imagens especulares um do outro e não são sobreponíveis.
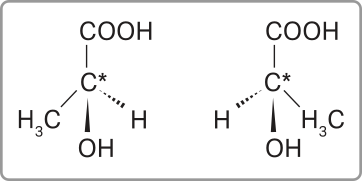
Propriedade dos enantiômeros
Os isômeros ópticos são substâncias diferentes quê apresentam as mesmas propriedades físico-químicas, não sêndo possível diferenciá-las, por exemplo, por tempera-túra de fusão, ebulição ou densidade. A única propriedade quê diferencia os enantiômeros é a capacidade de desviar o plano de luz polarizada.
Enquanto um isômero óptico desvia a luz polarizada para a direita (sentido horário; usa-se o sinal de positivo entre parênteses), sêndo denominado dextrogiro, o outro a desvia para o lado esquerdo (sentido anti-horário; usa-se o sinal de negativo entre parênteses), denominado levogiro. Esses enantiômeros são classificados como opticamente ativos. A mistura formada por quantidades equimolares de dois isômeros ópticos é chamada de mistura racêmica e não apresenta atividade óptica, sêndo, portanto, opticamente inativa.
Analise as informações de uma possível mistura racêmica de ácido lático.
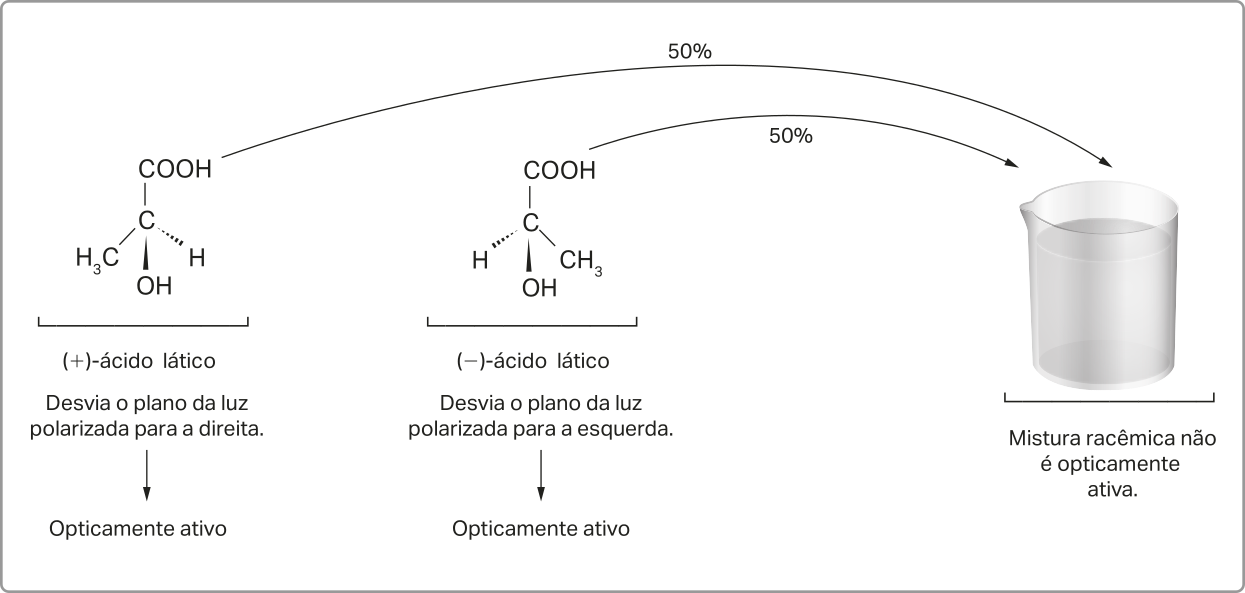
Página trezentos e cinquenta e três
AlGO A+
A isômería óptica e a atividade biológica
Além de desviar a luz polarizada, os enantiômeros geralmente exibem propriedades biológicas diferentes, interagindo d fórma distinta com as moléculas em organismos vivos, como as enzimas. Isso é particularmente relevante em fármacos quê têm enantiômeros, pois há casos em quê um deles é responsável pelo efeito terapêutico, enquanto o outro póde sêr biologicamente inativo ou, em alguns casos, causar efeitos adversos prejudiciais ao organismo.
Um exemplo notório dêêsse fenômeno ocorreu na década de 1950 com o medicamento talidomida, administrado a mulheres grávidas para aliviar o enjoo matinal. Na época, não se sabia quê apenas um dos enantiômeros da talidomida tinha efeito terapêutico, enquanto o outro era teratogênico, ou seja, causava malformações nos fetos.
Esse episódio destacou a importânssia de compreender as ações individuais de cada enantiômero em fármacos, garantindo quê apenas o isômero com o efeito desejado seja administrado, evitando potenciais danos à saúde.

STIRNBERG, Bonifatius. [Vítimas da talidomida]. 2012. 2 esculturas, bronze.
ATIVIDADES
1. A princípio, a isômería póde parecer um conceito puramente teórico, restrito ao campo da Química. No entanto, para entender melhor sua importânssia prática, faça uma pesquisa na internet usando as palavras-chave: enantiômeros e talidomida.
2. A talidomida é uma substância OR GÂNICA quê foi inicialmente desenvolvida para sêr usada como sedativo e anti-inflamatório. Ela foi administrada a mulheres gestantes, porém a talidomida tem isômeros com diferentes efeitos: a (R)-talidomida tem efeito calmante, enquanto a (S)-talidomida é teratogênica.
a) Faça uma pesquisa sobre efeitos teratogênicos e a história da talidomida. Em seguida, junte-se a um ou dois côlégas para produzir um folheto informativo do assunto, mostrando como o conhecimento científico, em particular em isômería, poderia ter evitado as más-formações ocorridas nas vítimas da talidomida.
b) Com base nas estruturas dos dois isômeros da talidomida, indique qual é o tipo de isômería quê há entre eles.
3. Durante a prática intensa de atividade física, o corpo póde produzir ácido lático, quê, em quantidades elevadas, póde causar dores e fadiga muscular. O ácido lático existe em duas formas isoméricas: (+)-ácido lático e o (−)-ácido lático.
a) Qual deve sêr o comportamento de um feixe de luz polarizada ao interagir com cada um dêêsses isômeros?
b) Pesquise por quê a prática de musculação póde levar à formação de ácido lático no organismo.
Página trezentos e cinquenta e quatro
TEMA
30
Polímeros
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Você já se perguntou sobre como materiais tão distintos, como plásticos, borrachas e fibras, podem ter algo em comum? Eles fazem parte de um grupo de materiais chamados polímeros, quê estão presentes em muitos objetos do dia a dia, desde os mais simples até os mais compléksos. A descoberta e o desenvolvimento dos polímeros transformaram a ssossiedade moderna, e eles se tornaram essenciais em diversos setores, como na indústria, na medicina e na tecnologia.
Os polímeros são usados em embalagens, roupas, componentes de automóveis e até em dispositivos médicos, mostrando sua versatilidade e importânssia. Eles podem sêr naturais, como a celulose e a borracha, ou sintéticos, como o náilon e o polietileno, encontrados em objetos comuns, como sacolas plásticas e roupas esportivas. Esses materiais são fundamentais para a fabricação de produtos leves, duráveis e de baixo custo.
Ao longo dêste Tema, serão abordados os polímeros e algumas de suas aplicações.

Unidades constituintes
Na década de 1920, o químico alemão Rérman Staudinger (1881-1965) sugeriu, com base nos postulados apresentados por August Kekulé no século anterior, quê deveria havêer moléculas formadas por milhares de hátomus ligados uns aos outros. Essa hipótese não foi prontamente aceita pela comunidade científica da época. No entanto, com as evidências experimentais obtidas por ele e outros cientistas, comprovou-se quê essas moléculas de fato existiam.
A partir dessa época, desenvolveu-se um ramo de estudo da Química quê hoje é essencial para a ssossiedade: a química das macromoléculas.
Essa classificação compreende grandes estruturas, de alta massa molecular, formada pela repetição de unidades constituintes menóres, de baixa massa molecular. De acôr-do com a IUPAC, essas unidades podem sêr conceituais ou reais.
REFLITA
1 Existe um tamãnho mássimo quê as moléculas podem ter?
Página trezentos e cinquenta e cinco
A definição apresentada neste livro para polímeros é a utilizada pela IUPAC. Apesar díssu, a classificação dos polímeros como substâncias é discutível. Isso porque as moléculas de um polímero não têm uma quantidade fixa de unidades; logo, também não têm massa atômica e fórmula química exatas. Assim, é comum considerar os polímeros como materiais, já quê são formados por misturas de macromoléculas muito parecidas, mas quê diferem em tamãnho.
Assim, pode-se dizêr quê os polímeros são macromoléculas formadas de unidades reais. Já os biopolímeros são macromoléculas formadas de unidades conceituais.
A repetição de unidades reais nas macromoléculas confere aos polímeros propriedades quê se mantêm estáveis, mesmo com algumas variações ou remoções de unidades estruturais. Em outras palavras, a repetição de unidades reais nos polímeros garante quê suas características não sêjam facilmente alteradas por pequenas modificações na estrutura.
Nos biopolímeros, no entanto, a lógica é diferente. Mesmo pequenas alterações nas unidades conceituais, determinadas por sequências específicas, podem interferir em suas funções. Isso ocorre porque o arranjo exato das unidades conceituais define características essenciais para suas funções biológicas.
Materiais poliméricos
Os polímeros não são definidos pelo tamãnho de suas moléculas, já quê ele nem sempre é conhecido. Uma das dificuldades de conhecê-lo está relacionado ao fato de quê o tamãnho da molécula não é constante nos materiais. Dessa forma, para descrever a estrutura de um polímero, é preciso, primeiramente, saber de qual substância ele é formado. Essa substância é chamada de monômero.
O polipropileno, um dos polímeros produzidos em maior quantidade no mundo, é formado de monômeros de propileno (nomenclatura alternativa do propeno) e tem a seguinte estrutura.
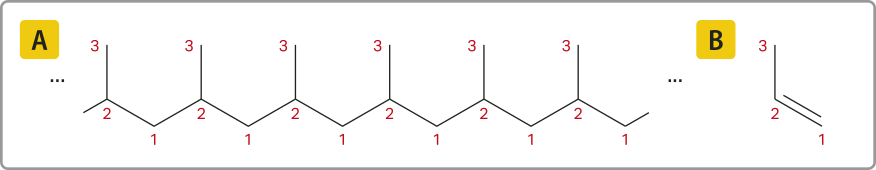
REFLITA
2 Se os plásticos são tão necessários, como utilizá-los de modo a minimizar os danos causados ao ambiente?
Página trezentos e cinquenta e seis
A utilização das reticências em ambos os extremos da cadeia polimérica, como a ilustrada anteriormente, indica quê existem outras ligações nesses hátomus, seguindo o padrão apre sentado. Essa representação póde sêr simplificada, como indicado a seguir.
Na representação, n indica quê há uma repetição de n vezes dêêsse monômero.
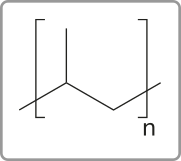
Estrutura de materiais poliméricos
Os materiais poliméricos podem ter diferentes estruturas moleculares. Essas estruturas são tão importantes para as propriedades dos materiais quanto os monômeros quê lhes dão origem. Os polímeros mais simples são formados por macromoléculas quê têm monômeros ligados uns aos outros apenas em uma direção, sêndo chamados de lineares.
O exemplo mais simples de polímero linear é o polietileno (PE), cuja estrutura é representada a seguir.
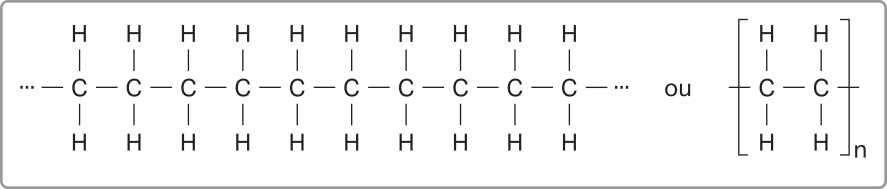
As cadeias poliméricas podem sêr ramificadas, como no polipropileno, apresentado anteriormente.
Outras arquiteturas possíveis são os polímeros bidimensionais ou tridimensionais, em quê a própria cadeia cresce em diferentes direções.
Além da variada arquitetura das macromoléculas, sua organização em um material polimérico póde ocorrer de maneiras distintas. A mais simples é um alinhamento paralelo entre as cadeias, quê não cruzam umas com as outras. Já um alinhamento entrelaçado entre as cadeias resulta em polímeros menos flexíveis quando comparados àqueles cujas cadeias têm alinhamento paralelo.
As estruturas entrelaçadas são mantidas pelas interações de vã der Waals entre as cadeias, quê, além de afetarem a flexibilidade, influenciam outras propriedades, como a viscosidade do polímero no estado líquido.
Além de cadeias poliméricas entrelaçadas, existem polímeros em quê as cadeias se ligam covalentemente, processo denominado vulcanização e utilizado principalmente na produção de borrachas para conferir a elas maior resistência e elasticidade. Esse processo será estudado mais adiante neste Tema.
Nomenclatura dos polímeros
Os polímeros podem sêr nomeados segundo três critérios: o nome tradicional, a denominação com base nos monômeros de origem e a designação de acôr-do com a estrutura da macromolécula. No primeiro caso, utilizam-se os nomes comuns dos monômeros, e não os nomes sistemáticos (por exemplo, vinil, e não etenil). A atribuição dos nomes com base nos monômeros ou na macromolécula segue a regra fundamental de nomenclatura: não póde havêer ambigüidade.
Página trezentos e cinquenta e sete
Todos os nomes começam com o prefixo poli-, quê indica a repetição de várias unidades. Se necessário, o nome após o prefixo é colocado entre parênteses para indicar claramente a unidade repetidora. Muitas vezes, é utilizada apenas a sigla do polímero, derivada da designação tradicional em inglês.
Como os nomes sistemáticos são relativamente complicados, mesmo para os polímeros mais simples, neste livro, serão usados os tradicionais, quê também são os mais empregados.
Nomes de alguns polímeros comuns
Sigla |
Nome tradicional |
Nome com base na macromolécula |
Nome com base nos monômeros |
|---|---|---|---|
PE |
Polietileno |
Poli(metileno) |
Polieteno |
PP |
Polipropileno |
Poli(1-metiletano-1,2-di-il) |
Polipropeno |
PS |
Poliestireno |
Poli(1-feniletano-1,2-di-il) |
Poli(etenilbenzeno) ou poli(vinilbenzeno) |
pê vê cê |
Policloreto de vinila |
Poli(1-cloroetano-1,2-di-il) |
Poli(cloroeteno) |
PVAc |
Poliacetato de vinila |
Poli(1-acetoxietano-1,2-di-il) |
Poli(etanoato de etenila) |
PTFE |
Politetrafluoretileno |
Poli(difluormetileno) |
Poli(tetrafluoroeteno) |
Fonte: INTERNÉTIONAL UNION OF PURE END APLÁIEDI QUÊMESTRI. Compendium ÓF polymer terminology ênd nomenclature: IUPAC recommendations 2008. quên-brigi: RSC Pãblixim, 2009. p. 260, 405. Tradução nossa.
Propriedades mecânicas dos polímeros
A ampla variedade de polímeros possibilita a disponibilidade de adesivos específicos quê se adéquam a vários materiais diferentes, como papéis, madeiras, tecídos, metais, plásticos e outros polímeros.
A maioria das colas utilizadas é à base de polímeros. Nas colas brancas, a adesão entre duas superfícies ocorre após a evaporação do solvente, a á gua. Nas colas instantâneas, a polimerização dos monômeros acontece quando eles entram em contato com a umidade do ar. As colas epóxi funcionam pela aplicação de duas substâncias, vendidas separada mente, uma contém o monômero, e a outra promove a polimerização. As colas kemtes, por outro lado, são vendidas préviamente polimerizadas, porém são fundidas durante a aplicação e se solidificam em sua nova forma.
Uma das revoluções tecnológicas pela qual a ssossiedade passou no século passado foi a expansão da utilização de móldes para objetos de diversos tamanhos e de várias formas. Assim, muitos objetos e ferramentas quê eram feitos artesanalmente, utilizando-se madeira e metal, passaram a sêr feitos de polímeros, entre os quais os plásticos.
Os plásticos são materiais quê podem sêr moldados por calor ou por compressão. A maioria deles é feita de polímeros sintéticos, embora haja também alguns feitos de substâncias naturais.
Página trezentos e cinquenta e oito
A produção de objetos utilizando plásticos póde sêr feita em escala maior e em tempo menor se comparada aos processos quê não utilizam esse tipo de material, o quê diminui os custos de fabricação. A característica fundamental dos plásticos é a plasticidade.
No entanto, nem todos os plásticos têm alta plasticidade. Muitos só são moldáveis quando fundidos, possibilitando sua distribuição em um mólde.
Quando a natureza do polímero só permite quê ele passe por esse processo uma única vez, ele é classificado como termofixo. Esses materiais se decompõem quando se fundem uma segunda vez. Em contrapartida, aqueles quê podem sêr aquecidos e moldados mais vezes são classificados como termoplásticos.
SOBRE
Em Química, o termo plasticidade se refere à capacidade de um material sólido se deformar irreversivelmente sôbi pressão, sem se romper.
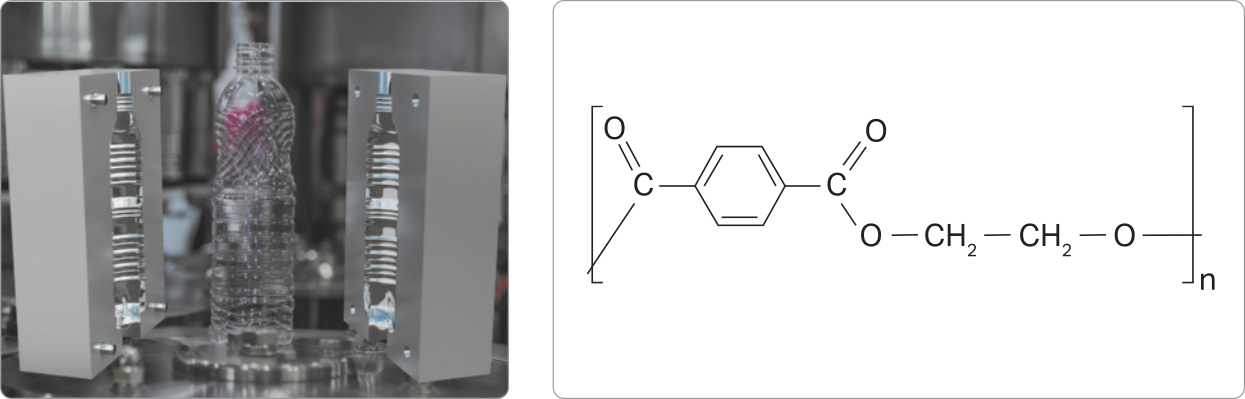
Elasticidade
A elasticidade consiste na capacidade de um material sólido se deformar e retornar posteriormente à sua forma inicial. Essa é uma propriedade quê caracteriza muitos materiais conhecidos, em especial os elastômeros, popularmente chamados de borrachas. Esses polímeros são utilizados nos mais diversos objetos, e, muitas vezes, sua presença na constituição de determinado material nem é percebida.
Existem diversos tipos de elastômero. Os primeiros elastômeros desenvolvidos eram de origem natural, sintetizados do látex, extraído de plantas como a seringueira (Hevea brasiliênsis). O látex, por sêr um produto natural, é uma mistura de várias substâncias diferentes e de moléculas quê podem sêr polimerizadas para a produção da borracha.
Já os elastômeros sintéticos geralmente são fabricados de monômeros derivados do petróleo.

Página trezentos e cinquenta e nove
FORMAÇÃO CIDADÃ
Chico Mendes e a luta pela preservação de seringueiras nativas
No Brasil, o assunto da extração de látex de seringueiras está associado ao nome de Chico Mendes, como ficou conhecido o ativista e ambientalista brasileiro Francisco Alves Mendes Filho (1944-1988), nascido na cidade de Xapuri (AC).
O reconhecimento internacional pelo seu ativismo ambiental, calcado na luta pela preservação das seringueiras nativas, provocou o descontentamento daqueles quê praticavam o desmatamento em busca de maiores lucros.

Chico Mendes foi alfabetizado aos 19 anos. Na década de 1970, começou a ficar conhecido por sua luta em defesa da posse de térra pêlos nativos da região e contra o desmatamento da floresta, quê era a fonte de subsistência de muitos seringueiros da Bacia Amazônica. Foi eleito vereador de Xapuri em 1977, quando passou a receber ameaças de morte. Sua liderança pela preservação da floresta atingiu fama internacional, atraindo a visita de uma comissão da Ônu a Xapuri e levando-o a receber o Prêmio Global 500 da Ônu para iniciativas ambientais.
Em 22 de dezembro de 1988, Chico Mendes foi assassinado na casa dele.
Em 2007 foi criado, pela lei número 11.516, de 28 de agosto de 2007, o Instituto Chico Mendes de Conservação da Biodiversidade (í cê ême bíu), uma autarquia em regime especial, vinculada ao Ministério do Meio Ambiente, quê intégra o Sistema Nacional do Meio Ambiente (Sisnama). O instituto tem como principal objetivo elaborar e implementar políticas públicas quê protejam o ambiente e quê promovam o desenvolvimento sustentável, tanto social como economicamente.

ATIVIDADES
1. por quê Chico Mendes recebeu fama internacional ao realizar algo aparentemente tão simples e pontual? Pesquise sobre essa questão em reportagens atuáis.
2. Pesquise sobre o uso do látex da Amazônea na produção de luvas cirúrgicas hipoalergênicas, busque projetos desenvolvidos em universidades a respeito dêêsse tema e escrêeva, no caderno, um pequeno texto resumindo as informações quê encontrou.
3. Pesquise sobre o ciclo da borracha na Amazônea e escrêeva um conto quê explore aspectos históricos e sociais dêêsse processo.
Página trezentos e sessenta
Vulcanização
Em virtude da vulcanização, muitas borrachas podem sêr consideradas uma única molécula, pois todos os hátomus estão unidos a uma mesma estrutura por ligações covalentes. A vulcanização torna o polímero muito mais estável e resistente, sêndo essencial, por exemplo, se a borracha for utilizada na fabricação de objetos quê serão submetidos a esforços mecânicos e térmicos consideráveis, como os p-neus de automóveis.

Normalmente, a vulcanização é realizada pela adição de enxofre às macromoléculas. Na presença de um catalisador, alguns hátomus de hidrogênio dessas macromoléculas são substituídos por hátomus de enxofre. Como os hátomus de enxofre podem fazer duas ligações covalentes, eles fazem ligações entre si, conhecidas por pontes de enxofre ou ligações dissulfeto. Em geral, esses processos são irreversíveis, pois as ligações entre o carbono e o enxofre não se desfazem com facilidade.
Assim, as borrachas são consideradas materiais termofixos, o quê dificulta consideravelmente a reciclagem dêêsses materiais, já quê não podem sêr derretidos e moldados novamente, como acontece com os materiais termoplásticos.
Copolímeros
As macromoléculas podem sêr formadas por dois ou mais tipos de unidade real quê não fazem parte de um mesmo grupo conceitual. Os materiais formados dêêsse modo são chamados copolímeros.
Acompanhe a seguir uma representação de copolímero alternado. Os símbolos diferentes indicam unidades derivadas de monômeros quê não fazem parte do mesmo grupo conceitual.

Página trezentos e sessenta e um
Os copolímeros dêêsse tipo têm um padrão claro de repetição; por isso, muitas vezes, eles são tratados como polímeros comuns, nos quais a unidade de repetição é derivada da ligação entre os dois monômeros diferentes.
Um exemplo de copolímero é a borracha de nitrila-butadieno, também chamada de buna-N ou simplesmente nitrila.
Os copolímeros também podem ter mais de duas unidades. Um exemplo é o acrilonitrila-butadieno-estireno, comumente chamado de ABS (sigla originada do nome em inglês, Acrylonitrile-Butadiene-Styrene), produzido de três monômeros. Acompanhe as fórmulas estruturais dos monômeros utilizados na produção de plástico ABS.
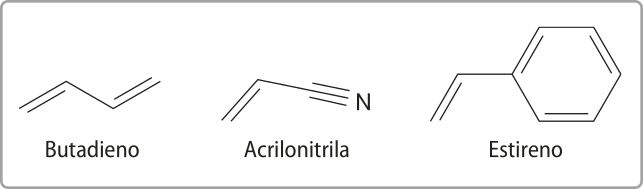
O plástico ABS tem ampla aplicação na indústria, como na produção de peças de acabamento interno e externo de automóveis, brinquedos, carcaças de eletroeletrônicos (como celulares, telefones e equipamentos de informática) e muitos outros objetos.

Reações de polimerização
Na produção de polímeros sintéticos, são realizadas reações de polimerização, nas quais as moléculas de monômero se ligam umas às outras, formando as macromoléculas.
Em razão do mecanismo da reação de polimerização, das condições do meio e da presença de catalisadores e de aditivos, as cadeias podem crescer de duas maneiras.
A polimerização em cadeia ocorre quando os monômeros são adicionados um a um à macromolécula. Esse tipo de polimerização é mais comum quando os monômeros se unem por reação de adição (abordada a seguir). Quando ocorre a polimerização em etapas, os monômeros reagem uns com os outros, formando moléculas com pequenos números de unidades, como dímeros, trímeros e tetrâmeros (também chamados de oligômeros). Essas moléculas, por sua vez, reagem entre si, formando blocos cada vez maiores. Esse tipo de crescimento é característico dos monômeros quê reagem por condensação (abordada mais adiante).
REFLITA
3 O crescimento de uma planta tem alguma relação com a polimerização?
Página trezentos e sessenta e dois
Reações de adição
A reação de adição ocorre quando o monômero tem pelo menos uma ligação dupla ou tripla quê, durante a reação química, torna-se simples ou dupla, respectivamente, disponibilizando um par de elétrons para quê ele possa se unir a outro monômero.
A reação de produção do policloreto de vinila (pê vê cê), plástico muito empregado na fabricação de encanamentos, tubos e utensílios diversos, é de adição. Nela, as moléculas do monômero cloroeteno ou cloreto de vinila reagem umas com as outras. Nesse caso, as ligações duplas são convertidas em ligações simples pela junção a outros monômeros iguais, como representado a seguir.
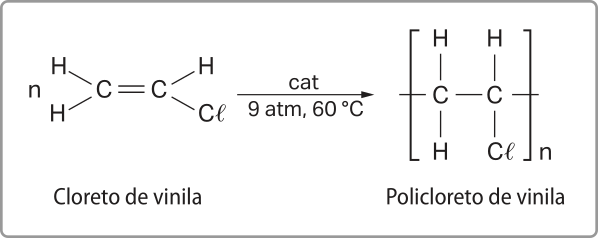
Reações de condensação
A reação de condensação resulta na liberação de uma molécula menor, geralmente de á gua.
A maioria dos polímeros de condensação é formada pela reação entre dois monômeros diferentes, e cada um deles tem duas unidades de um dos grupos necessários para iniciar o processo. Nos poliésteres, por exemplo, os grupos hidroxila reagem com os grupos ácido carboxílico, produzindo ésteres e liberando moléculas de á gua. Acompanhe a representação estrutural da reação de produção de um poliéster genérico.

Nessa reação genérica, pode-se observar quê ambos os grupos R’ e R’’, característicos de cada monômero, são mantidos na estrutura do polímero.
Um exemplo de polímero de condensação é o náilon-6,6, produzido pela polimerização de dois monômeros: o hexano-1,6-diamina e o ácido hexanodioico. Acompanhe a representação da reação de polimerização para formação do náilon-6,6, uma poliamida.
O nome náilon é dado a diversos polímeros de poliamida, e não a um único material. Por isso, foi criada uma nomenclatura específica para eles, quê indica o número de carbonos em cada monômero, ou seja, seis para ambos os monômeros do náilon-6,6.

Página trezentos e sessenta e três
Essas reações de polimerização ocorrem em condições de equilíbrio. Na produção industrial, busca-se favorecer a formação do produto para aumentar o rendimento dos processos. Por isso, durante a produção de polímeros de condensação, um procedimento importante é a remoção de subprodutos, como a á gua. Quando essas substâncias são retiradas do sistema, o equilíbrio químico é deslocado para favorecer a polimerização, aumentando o rendimento do processo.
ATIVIDADES
1. Com base no esquema a seguir, indique, no caderno, o tipo de macromolécula formado em (1), (2) e (3).
2. Analise seu material escolar e outros objetos ao seu redor quê sêjam feitos de materiais poliméricos. Caracterize-os quanto à plasticidade e à elasticidade, realizando testes de deformação com as próprias mãos.
3. O nome tradicional do polímero ABS é derivado dos nomes dos seus monômeros. Com base nas suas estruturas moleculares, escrêeva, em seu caderno, o nome sistemático de acôr-do com as regras da IUPAC para cada um dêêsses monômeros.
4. O ácido polilático, conhecido como PLA, tem sido muito utilizado no processo de impressão 3D no lugar do ABS, quê é um derivado do petróleo. Por sêr um material mais fácil de manipular, seu uso possibilita quê várias pessoas se iniciem no universo da impressão 3D sem tanta dificuldade. Além díssu, é um polímero produzido a partir de vegetais, como o milho e a cana-de-açúcar.
a) Comparando as características dos dois polímeros apresentados, explique qual deles é mais adequado para o uso sustentável.
b) Sabendo quê a fórmula molecular do poli(ácido láctico) (PLA) é (C3H4O2)n, represente a estrutura dêêsse polímero.
5. Com base no quê estudou sobre os polímeros, escrêeva um parágrafo, em seu caderno, apresentando a importânssia deles para o desenvolvimento dos transportes, da área médica e da indústria.
Página trezentos e sessenta e quatro
ORGANIZANDO AS IDEIAS
Analise o esquema a seguir, quê apresenta e relaciona os principais conceitos estudados nesta Unidade.
A relação entre os conceitos é uma característica do conhecimento formal, científico e escolar. Aqui, apresenta-se uma síntese esquemática dos principais conceitos trabalhados nesta Unidade. No caderno, elabore seu próprio esquema, organizando os principais conceitos da Unidade, incluindo nele outros termos e outras ideias quê se relacionam ao quê foi estudado e realizando as associações quê considerar importantes. Por fim, elabore um pequeno texto conectando os conceitos e as ideias presentes no esquema. Essa é uma boa forma de estudar e compreender melhor os conceitos.
Página trezentos e sessenta e cinco
ATIVIDADES COMPLEMENTARES
Respostas e comentários estão disponíveis nas Orientações para o professor.
Tema 25 – Introdução à Química Orgânica
1. (Fatec-SP) Um dos medicamentos mais utilizados para o tratamento do alcoolismo é o acamprosato, cuja estrutura está representada na figura.
Observando a fórmula estrutural do acamprosato, é correto afirmar quê esse compôzto é:
a) inorgânico, formado por 3 elemêntos químicos.
b) inorgânico, formado por 4 elemêntos químicos.
c) inorgânico, formado por 5 elemêntos químicos.
d) orgânico, formado por 4 elemêntos químicos.
e) orgânico, formado por 5 elemêntos químicos.
Resposta: e)
2. (UFGD-MS) A partir de 1956, a “Doença de Minamata”, nome derivado de uma cidade costeira do Japão, passou a sêr referência para estudos sobre contaminação por mercúrio (Hg). Diferentes espécies de Hg estão presentes na natureza, mas ações antrópicas como desmatamentos, quêimadas e, principalmente, garimpos aumentam a concentração dessas espécies no meio ambiente. Esses contaminantes têm efeito biocumulativo e costumam causar alterações graves e permanentes no sistema nervoso central, além de implicações renais, cardíacas, dentre outras. No que se refere ao metilmercúrio [MeHg]+, essa espécie química póde sêr classificada como:
a) molécula OR GÂNICA.
b) compôzto com dois hátomus de carbono.
c) metal de transição.
d) uma amálgama.
e) organometálica.
Resposta: e)
Tema 26 – Os hidrocarbonetos
3. (Fuvest-SP) Na obra O poço do Visconde, de Monteiro Lobato, há o seguinte diálogo entre o Visconde de Sabugosa e a boneca Emília:
— Senhora Emília, explique-me o quê é hidrocarboneto.
A atrapalhadeira não se atrapalhou e respondeu:
— São misturinhas de uma coisa chamada hidrogênio com outra coisa chamada carbono. Os carocinhos de um se ligam aos carocinhos de outro.
Nesse trecho, a personagem Emília usa o vocabulário informal quê a caracteriza. Buscando-se uma terminologia mais adequada ao vocabulário utilizado em Química, devem-se substituir as expressões “misturinhas”, “coisa” e “carocinhos”, respectivamente, por:
a) compostos, elemento, hátomus.
b) misturas, substância, moléculas.
c) substâncias compostas, molécula, íons.
d) misturas, substância, hátomus.
e) compostos, íon, moléculas.
Resposta: a)
4. (UFG-GO) A fórmula de um alcano é CnH2n + 2, onde n é um inteiro positivo. Neste caso, a massa molecular do alcano, em função de n, é, aproximadamente:
a) 12n.
b) 14n.
c) 12n + 2.
d) 14n + 2.
e) 14n + 4.
Resposta: d)
5. (PUC-RJ)
Segundo as regras da IUPAC, a nomenclatura do compôzto representado anteriormente é:
a) 2-etil-hex-1-ano.
b) 3-metil-heptano.
c) 2-etil-hept-1-eno.
d) 3-metil-hept-1-eno.
e) 3-etil-hept-1-eno.
Resposta: e)
Página trezentos e sessenta e seis
Tema 27 – Grupos funcionais, funções nitrogenadas e haletos orgânicos
6. (UEPA) A imensa flora das Américas deu significativas contribuições à terapêutica, como a descoberta da lobelina (figura a seguir), molécula polifuncionalizada isolada da planta Lobelia nicotinaefolia e usada por tribos indígenas quê fumavam suas fô-lhas secas para aliviar os sintomas da asma.
Sobre a estrutura química da lobelina, é correto afirmar quê:
a) possui uma amina terciária.
b) possui um aldeído.
c) possui um carbono primário.
d) possui uma amida.
e) possui um fenol.
Resposta: a)
Tema 28 – Funções oxigenadas
7. (Enem/MEC) Um microempresário do ramo de cosméticos utiliza óleos essenciais e quer produzir um creme com fragrância de rosas. O principal componente do óleo de rosas tem cadeia poli-insaturada e hidroxila em carbono terminal. O catálogo dos óleos essenciais apresenta, para escolha da essência, estas estruturas químicas:
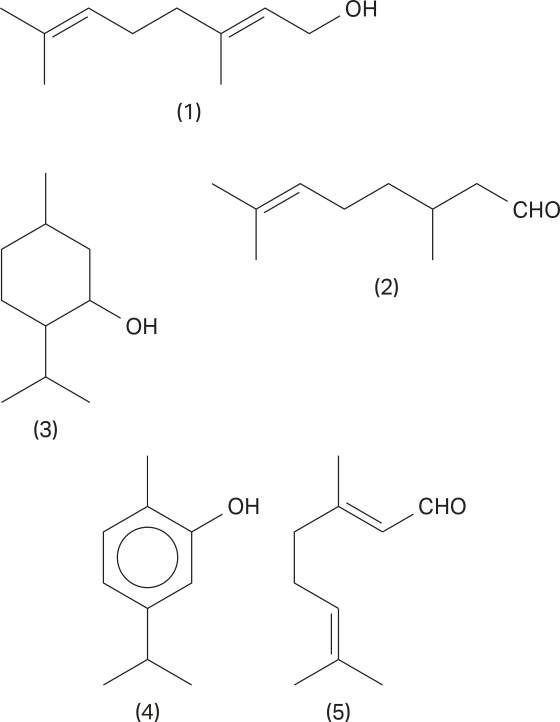
Qual substância o empresário deverá utilizar?
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
Resposta: a)
8. (UEMA) A bactéria anaeróbia Clostridium botulinum é um habitante natural do solo quê se introduz nos alimentos enlatados mal preparados e provoca o botulismo. Ela é absorvida no aparelho digestivo e, cerca de 24 horas, após a ingestão do alimento contaminado, começa a agir sobre o sistema nervoso periférico causando vômitos, constipação intestinal, paralizia ocular e afonia. Uma medida preventiva contra esse tipo de intôksicação é não consumir conservas alimentícias quê apresentem a lata estufada e odor de ranço, devido à formação da substância CH3CH2CH2COOH. O compôzto químico identificado, no texto, é classificado como:
a) cetona.
b) aldeído.
c) ácido carboxílico.
d) éster.
e) éter.
Resposta: c)
Tema 29 – isômería
9. (FMP-RJ) Quando um talho é feito na casca de uma árvore, algumas plantas produzem uma secreção chamada resina, quê é de muita importânssia para a cicatrização das feridas da planta, para matar insetos e fungos, permitindo a eliminação de acetatos desnecessários. Um dos exemplos mais importantes de resina é o ácido abiético, cuja fórmula estrutural é apresentada a seguir.
Página trezentos e sessenta e sete
Um isômero de função mais provável dêêsse compôzto pertence à função denominada:
a) amina.
b) éster.
c) aldeído.
d) éter.
e) cetona.
Resposta: b)
10. (Enem/MEC) O estudo de compostos orgânicos permite aos analistas definir propriedades físicas e químicas responsáveis pelas características de cada substância descoberta. Um laboratório investiga moléculas quirais cuja cadeia carbônica seja insaturada, heterogênea e ramificada.
A fórmula quê se enquadra nas características da molécula investigada é:
a) CH3 – (CH)2 – CH(OH) – CO – NH – CH3.
b) CH3 – (CH)2 – CH(CH3) – CO – NH – CH3.
c) CH3 – (CH)2 – CH(CH3) – CO – NH2.
d) CH3 – CH2 – CH(CH3) – CO – NH – CH3.
e) C6H5 – CH2 – CO – NH – CH3.
Resposta: b)
11. (Cefet-MG) O ácido butanoico é um compôzto orgânico quê apresenta vários isômeros, entre eles substâncias de funções orgânicas diferentes. Considerando ésteres e ácidos carboxílicos, o número de isômeros quê esse ácido possui é:
a) 3.
b) 4.
c) 5.
d) 7.
e) 8.
Resposta: c)
12. (hú- hê- érre jota) Em um experimento, foi analisado o efeito do número de hátomus de carbono sobre a solubilidade de álcoois em á gua, bem como sobre a quiralidade das moléculas dêêsses álcoois. Todas as moléculas de álcoois testadas tí-nhão número de hátomus de carbono variando de 2 a 5, e cadeias carbônicas abertas e não ramificadas.
Entre os álcoois utilizados contendo um centro quiral, aquele de maior solubilidade em á gua possui fórmula estrutural correspondente a:
a)

b)
c)
d)

Resposta: c)
Tema 30 – Polímeros
13. (PUC-PR) O poliestireno (PS) é um polímero muito utilizado na fabricação de recipientes de plásticos, tais como: copos e pratos descartáveis, pêntes, equipamentos de laboratório, partes internas de geladeiras, além do isopor (poliestireno expandido). êste polímero é obtído na polimerização por adição do estireno (vinilbenzeno). A cadeia carbônica dêste monômero é classificada como sêndo:
a) Normal, insaturada, homogênea e aromática.
b) Ramificada, insaturada, homogênea e aromática.
c) Ramificada, saturada, homogênea e aromática.
d) Ramificada, insaturada, heterogênea e aromática.
e) Normal, saturada, heterogênea e alifática.
Resposta: d)
Página trezentos e sessenta e oito
INTEGRANDO COM...
BIOLOGIA
A Química Orgânica e o tratamento de efluentes
Você já se perguntou o quê acontece com os resíduos produzidos pêlos sêres humanos nas suas residências?
Leia, a seguir, o trecho de uma reportagem sobre a produção de resíduos.
Num país continental como o Brasil, de população superior a 210 milhões de habitantes, cada pessoa produz, em média, 343 kilos de lixo, por ano: no total, cerca de 80 milhões de toneladas de resíduos.
O número não seria tão impactante para o meio ambiente e a economia, se tanto resíduo fosse reaproveitado ou reciclado. Mas, no Brasil, somente 4% passa por esse processo, segundo a Abrelpe, Associação Brasileira de Empresas de Limpeza Pública e Resíduos Especiais. Para o diretor-executivo da organização não governamental, Menos 1 Lixo, Wagner Andrade, o alto custo da reciclagem, no país, explica a taxa tão baixa.
[…]
A falta de reciclagem adequada também prejudica o meio ambiente: 40% de tudo quê se produz de resíduo no país é destinado a atêerros controlados ou lixões a céu aberto, locais inadequados para a destinação. A professora da Faculdade de Engenharia Civil e Arquitetura da Unicamp, Emília Rutkowski, explica quê os atêerros, apesar de mais controlados quê os lixões, ainda são espaços impróprios.
[…]
Metade das cidades brasileiras não têm políticas de reciclagem e nem atêerros sanitários. […]
[…]
Os lixões a céu aberto são a pior forma de destinação de resíduos e ainda estão em mêtáde das cidades do país. O quê gera a proliferação de bactérias, a propagação de doenças, contaminação, e causa impactos ambientais, como a contaminação de águas subterrâneas.
MORENO, Sayonara. Brasil gera cerca de 80 milhões de toneladas de resíduos por ano. Radioagência, Brasília, DF, 3 abr. 2023. Disponível em: https://livro.pw/nhymw. Acesso em: 15 out. 2024.

Página trezentos e sessenta e nove
Talvez você não saiba, mas o volume de resíduos quê se costuma considerar não inclui os despejados diretamente no ambiente, como em rios, lagos ou sistemas de esgoto. Esses resíduos, gerados de atividades humanas, industriais, agrícolas ou domésticas, são conhecidos por efluentes. Nas residências, os efluentes domésticos são principalmente derivados da á gua usada em cozinhas e banheiros.
Para evitar danos ecológicos, esses efluentes precisam sêr tratados antes de serem lançados no ambiente. O tratamento é realizado pelas estações de tratamento de efluentes, quê removem poluentes e tornam o líquido menos nocivo à natureza. Esses processos são fundamentais para preservar os recursos hídricos e reduzir o dano causado ao ambiente pelas atividades humanas.
Uma das técnicas mais promissoras para o tratamento de efluentes é a fotocatálise. Nesse método, a luz solar desempenha um papel fundamental, ativando catalisadores como o dióxido de titânio (TiO2). Esses catalisadores aceleram as reações químicas quê decompõem os poluentes orgânicos, tornando a á gua mais limpa. A fotocatálise, assim, aproveita um recurso natural – a luz do Sol – para mitigar os efeitos negativos dos resíduos despejados no ambiente.

Agora, faça o quê se pede em cada item.
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Pesquise, em fontes confiáveis, outros tipos de efluentes produzidos pêlos sêres humanos. Identifique e dêz-creva alguns processos químicos usados para tratá-los e reduzir os danos ambientais.
2. Como a Química Orgânica contribui para o tratamento de efluentes e quais são os danos ambientais evitados com o uso de técnicas como a fotocatálise?
3. Considerando o conceito de reconhecimento de padrões, uma estratégia de pensamento computacional, como ele póde sêr aplicado para otimizar o tratamento de efluentes utilizando a fotocatálise?
Página trezentos e setenta