UNIDADE
6
A QUÍMICA E A SOCIEDADE

Página trezentos e setenta e um
Ao longo dos séculos, os veículos mudaram o modo como as pessoas se locomovem. O uso de tração animal foi substituído por motores, revolucionando diversos tipos de transporte. Atualmente, além dos motores a combustão, os motores elétricos estão ganhando cada vez mais espaço na fabricação de automóveis, pois são alternativas mais sustentáveis e eficientes. A evolução dos veículos continua a moldar a mobilidade e as tecnologias do futuro. A imagem mostra um carro elétrico sêndo carregado.
Respostas e comentários estão disponíveis nas Orientações para o professor.
1. Você sabe quais reações químicas ocorrem no motor a combustão?Como essas reações fazem o carro se mover?
2. E quanto ao motor elétrico, quê reações ocorrem nele e como elas geram energia para movimentar os carros?
Página trezentos e setenta e dois
TEMA
31
Funções inorgânicas
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Alguns gases, como o dióxido de enxofre e o óxido de nitrogênio, quando liberados na atmosféra por causa de emissões industriais, reagem com a á gua presente nas nuvens e formam ácidos quê caem na Terra com a chuva, causando danos a monumentos, matando plantas e poluindo rios. No entanto, nem todo ácido é nocivo. Alguns são fundamentais para a vida, como o ácido ascórbico, mais conhecido como vitamina C, encontrado nas frutas cítricas.
Os ácidos côrrespondem a um grupo de substâncias com características comuns: têm sabor azedo, reagem com metais e alteram a cor de certos indicadores. Eles estão por toda parte, não só na chuva ácida mas também no vinagre, nas baterias e até no estoômago dos sêres vivos. Mas o mundo das funções inorgânicas vai além dos ácidos. As bases, os sais e os óxidos também têm papéis importantes em diversas reações químicas e no cotidiano.
As bases, por exemplo, estão nos antiácidos e nos produtos de limpeza. Já os sais, além de temperar alimentos, dêsempênham funções vitais no organismo. Por fim, os óxidos participam de processos diversos, como a respiração celular e a formação da fêrrugem.
Neste Tema, serão abordadas essas funções inorgânicas.
Óxidos
Ao longo dos séculos, diversas substâncias da classe dos óxidos foram estudadas (há indícios de quê óxidos já eram conhecidos pêlos alquimistas). Mas foi no século XVIII, com o avanço no estudo dos gases, quê o dióxido de carbono (CO2) recebeu atenção especial. O químico francês, naturalizado escocês, jôsef Black (1728-1799) foi um dos pioneiros no estudo dêêsse gás, reconhecendo sua importânssia em várias reações químicas.
Na natureza, encontram-se óxidos em diferentes formas. Dois exemplos comuns são a á gua (H2O), quê é um óxido de hidrogênio, e o já mencionado dióxido de carbono. Além díssu, muitos metais utilizados no dia a dia são extraídos de minérios quê contêm óxidos. Os processos de redução transformam esses óxidos em metais puros, essenciais para diversas indústrias.
Outros óxidos, como os de nitrogênio e de enxofre, também estão presentes na atmosféra d fórma natural, mas, quando gerados em grande quantidade por atividades antropogênicas, são considerados poluentes atmosféricos. Essas substâncias, em grandes concentrações, contribuem para problemas ambientais, como o efeito estufa e a chuva ácida, o quê revela a importânssia de estudá-las e de regular sua produção.

REFLITA
1 Você já deve ter notado quê objetos feitos de ferro enferrujam e quê as ma-ssãns escurecem ao serem cortadas e deixadas expostas ao ar. Como você explicaria esses fenômenos?
Página trezentos e setenta e três
Assim, um óxido é uma substância binária, ou seja, formada por hátomus de dois elemêntos químicos, sêndo quê um deles, necessariamente, é o oxigênio.
O oxigênio apresenta a segunda maior eletronegatividade entre os elemêntos. Um dos motivos de os hátomus de oxigênio formarem substâncias com diversos elemêntos químicos é essa alta eletronegatividade.
Óxidos iônicos
Os óxidos mantidos por ligações iônicas, chamados óxidos iônicos, apresentam a seguinte fórmula geral.

E2Ox
Na equação, E corresponde a um átomo do elemento menos eletronegativo ligado ao átomo de oxigênio; o índice 2, à carga do íon oxigênio; e o índice x, à carga do íon do elemento E. Quando x é par, os coeficientes são simplificados para quê se obtenha a fórmula mínima.
Em geral, em óxidos iônicos, E corresponde a um átomo de um metal. Dessa forma, a nomenclatura é feita da seguinte maneira.
Óxido de + nome do metal
Metal com valência fixa:
Metais alcalinos e prata → +1
Metais alcalinoterrosos e zinco → +2
Alumínio → +3
Exemplos:
Na2O – óxido de sódio
Ag2O – óxido de prata
CaO – óxido de cálcio
ZnO – óxido de zinco
A(éli)"2O3 – óxido de alumínio
Óxido de + nome do metal +valência do metal em símbolos romanos entre parênteses
Metal com valência variável:
Ouro → +1, +3
Cobre → +1, +2
Ferro → +2, +3
Chumbo → +2, +4
Exemplos:
Au2O3 – óxido de ouro(III)
Cu2O – óxido de cobre(I)
Fe2O3 – óxido de ferro(III)
PbO2 – óxido de chumbo(IV)
No caso de óxidos de metais com mais de uma valência, ainda é encontrada a nomenclatura em quê se usa: óxido + raiz do nome do metal em latim + sufixo -ico (valência maior) ou óxido + raiz do nome do metal em latim + sufixo -oso (valência menor). O óxido de ferro(III) póde sêr chamado então de óxido férrico, e o óxido de ferro(II), de óxido ferroso.
Página trezentos e setenta e quatro
Óxidos moleculares
Os óxidos em quê o oxigênio se liga covalentemente com o átomo do outro elemento, formando moléculas, são chamados de óxidos moleculares. Em geral, o outro elemento, nesses casos, é um não metal.
Acompanhe um resumo da nomenclatura deles.
Nomenclatura de alguns óxidos moleculares
Não metal |
Fórmula |
Nomenclatura |
|---|---|---|
Carbono |
CO2 |
Dióxido de carbono |
CO |
Monóxido de carbono |
|
Enxofre |
SO3 |
Trióxido de enxofre |
SO2 |
Dióxido de enxofre |
|
Nitrogênio |
NO2 |
Dióxido de nitrogênio |
NO |
Monóxido de nitrogênio |
|
N2O |
Monóxido de dinitrogênio |
|
Silício |
SiO2 |
Dióxido de silício |
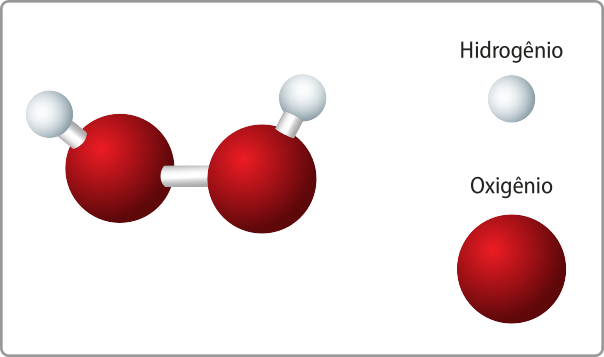
Como a á gua (H2O) póde sêr classificada como um óxido molecular, sua nomenclatura oficial é, portanto, monóxido de di-hidrogênio.
Peróxidos
Os peróxidos são formados pêlos elemêntos hidrogênio, prata, metais alcalinos e alcalinoterrosos e a espécie química . Nesse caso, apenas o H2 O2 é molecular, os demais peróxidos são iônicos. Neles, há dois hátomus de oxigênio ligados diretamente um ao outro por meio de ligação covalente simples. Vale salientar quê os índices nas fórmulas dos peróxidos não podem sêr simplificados.
Os peróxidos inorgânicos são substâncias nas quais o oxigênio apresenta uma valência igual a 1, sêndo diferente da valência dos demais óxidos, em razão da presença do grupo .
A ligação simples entre os dois hátomus de oxigênio não é muito estável, o quê torna essas substâncias bastante reativas. Por isso, elas têm ampla aplicação industrial.
Página trezentos e setenta e cinco
FORMAÇÃO CIDADÃ
Monóxido de di-hidrogênio (DHMO): uma substância tóxica?
O monóxido de di-hidrogênio (DHMO) é uma substância quê está associada a diversos problemas contemporâneos, como os listados a seguir.
• Está presente na chuva ácida.
• Causa corrosão de diversos metais.
• Causa êrozão do solo.
• póde levar à morte quando inalada em excésso.
• Provoca queimaduras graves em sua forma gasosa.
• Sua grande concentração nos rejeitos de mineração foi um dos fatores quê contribuiu para o desastre em Mariana (MG) em 2015.
Diante dessas kestões, seria razoável considerar o banimento dêêsse óxido de nossa ssossiedade? Para uma avaliação mais aprofundada, é necessário analisar com maior atenção essa substância.
Com base em seu nome, pode-se determinar sua fórmula. Monóxido indica a presença de um único átomo de oxigênio, e di-hidrogênio significa dois hátomus de hidrogênio. Assim, a fórmula química do monóxido de dihidrogênio é... H2 O!
Considerando quê essa substância é a á gua, como interpretar os problemas mencionados anteriormente? De fato, a á gua está associada a esses fenômenos, mas isso não significa quê ela deva sêr banida. Afinal, a á gua é uma substância essencial para a vida.
O uso de informações corretas é essencial para evitar conclusões equivocadas, um conceito quê recebeu o nome de zohnerismo, em referência ao estudante estadunidense Nathan Zohner. Em 1997, aos 14 anos, Zohner criou um abaixo-assinado solicitando o banimento do DHMO como parte de um experimento para demonstrar como a falta de informação póde sêr manipulada.
Esse experimento simples revelou o impacto da desinformação, especialmente quando utilizada por pessoas mal-intencionadas. A disseminação de informações incorrétas, conhecidas pelo termo em inglês fêik news, tem se tornado ainda mais fácil com o uso de mídias eletrônicas. O melhor antídoto contra isso é o acesso à informação confiável.
ATIVIDADES
1. Quais notícias falsas você já ouviu sobre Ciência ou saúde? Como é possível verificar sua veracidade?
2. Como a disseminação de notícias falsas póde impactar kestões científicas e sociais? Cite exemplos e discuta com os côlégas possíveis maneiras de combater esse problema.

Página trezentos e setenta e seis
AlGO A+
O quê são volumes de á gua oxigenada?
A á gua oxigenada é normalmente comercializada na forma diluída em á gua. Quando um litro de á gua oxigenada produz 10 litros de gás oxigênio, diz-se quê ela foi diluída a 10 volumes. Quando produz 20 litros de gás oxigênio, foi diluída a 20 volumes e assim por diante. Ou seja, trata-se de uma indicação de concentração indireta, pois refere-se ao volume de produto formado. Portanto, quanto maior for o índice volumétrico de gás oxigênio produzido, maior será a concentração de peróxido na solução.
As soluções de até 10 volumes têm aplicações domésticas, como na desinfequição de superfícies e objetos e na remoção de manchas de roupas. Nessa concentração, a solução era utilizada como antisséptico bucal e de machucados recentes. Essa prática, no entanto, não é mais recomendada, pois póde causar danos às mucosas e a outros tecídos. As soluções de até 40 volumes costumam sêr utilizadas como descolorante capilar, mas devem sêr manipuladas com cuidado e com o uso de luvas, pois, em contato com a péle, podem causar queimaduras graves.
De acôr-do com a Ficha de Informação de Segurança de Produtos Químicos (FISPQ) a respeito do peróxido de hidrogênio de 20% a 60%, esses materiais são corrosivos e oxidantes, com toxidade aguda quê póde causar lesão grave nos olhos e irritação da péle.

Sais
Desde a Antigüidade até os dias de hoje, as substâncias salinas dêsempênham um papel essencial no cotidiano, sêndo utilizadas na preservação e no tempêro de alimentos e em processos industriais diversos.
Os estudos sobre os sais remontam a registros do século X, com obras atribuídas ao médico e alquimista persa Al-Rāzī. Já no século XVI, o alquimista alemão Andreas Libavius (c. 1540-1616) realizou uma das primeiras sínteses de sais. Nessa época, também já se conseguia extrair metais dessas substâncias, como documentado nas obras de Lazarus Ercker (c. 1530-c. 1594) e Georgius Agricola (1494-1555), quê exploravam depósitos minerais e técnicas de metalurgia. No século seguinte, o químico francês Nicolas Lefèvre (c. 1610-c. 1674) escreveu um dos primeiros livros didáticos a abordar o assunto.
No entanto, apesar de serem bastante usados nos experimentos da época, os sais ainda não tí-nhão sua estrutura química plenamente compreendida. Foi no século XVIII quê Guillaume-François Rouelle (1703-1770) propôs uma classificação baseada na forma cristalina dessas substâncias. Embora sua abordagem tenha organizado os sais em categorias específicas, a composição química detalhada ainda permanecia um mistério.

REFLITA
2 Além do cloreto de sódio, quê outros sais você conhece?
Página trezentos e setenta e sete
Com o tempo, os avanços na Química permitiram o desenvolvimento de fórmulas e a compreensão das propriedades e das aplicações dos sais conhecidos hoje.
Em Tema anterior, foi apontado quê os sais são formados pela combinação de cátions e ânions. Entretanto, não são todos os tipos de cátion e de ânion quê formam sais. Os íons hidreto (H−), peróxido (), hidrogênio (H+), óxido (O2−), hidrônio (H3 O+) e hidróxido (OH−) formam outras espécies de substância. Ou seja, sais são formados por cátions quê não sêjam o H+ e ânions quê não sêjam os de oxigênio, ainda quê ligados a um hidrogênio.
A nomenclatura dos sais, segundo a IUPAC, segue uma regra bem simples, baseada na combinação dos nomes de cada íon. Para dar nome a um sal, deve-se utilizar: nome do ânion + de + nome do cátion
Alguns ânions e cátions comuns e seus nomes
Ânion |
Nome |
Cátion |
Nome |
|---|---|---|---|
Carbonato |
Amônio |
||
C(éli)"− |
Cloreto |
Ca2+ |
Cálcio |
Cr |
Cromato |
Co2+ |
Cobalto(II) |
Cr2 |
Dicromato |
Co3+ |
Cobalto(III) |
Fosfato |
Fe2+ |
Ferro(II) |
|
Mn |
Permanganato |
Fe3+ |
Ferro(III) |
S |
Sulfato |
K+ |
Potássio |
S2− |
Sulfeto |
Ag+ |
Prata |
S |
Sulfito |
Zn2+ |
Zinco |
Assim, o CaC(éli)"2, por exemplo, deve sêr denominado cloreto de cálcio, o Ag2S, sulfêto de prata, o ZnSO3, sulfito de zinco, e assim por diante.
Vale ressaltar quê o nome do ânion se relaciona ao ácido quê lhe dá origem e, portanto, ácidos com terminações -ídrico, -oso e -ico originam, respectivamente, ânions com sufixos -eto, -ito e -ato. Os ácidos e sua nomenclatura serão abordados mais adiante.

Página trezentos e setenta e oito
Ácidos
REFLITA
3 Você deve ter alguma familiaridade com a palavra ácido. Quais ácidos você conhece, onde eles são utilizados e quais cuidados são necessários ao manuseá-los?
No cotidiano, a palavra ácido é associada ao sabor de alimentos azedos, como vinagre, limão e outras frutas. No vinagre, o sabor azedo é causado pelo ácido acético e, nas frutas, pelo ácido cítrico, por exemplo.
Uma das primeiras definições das substâncias ácidas foi proposta em 1887 pelo físico e químico sueco Svante August Arrhenius (1859-1927).
Arrhenius deu importantes contribuições para diversas áreas, incluindo Imunologia e Química Ambiental. Foi pioneiro no desenvolvimento do primeiro modelo climático quê considerava a influência do dióxido de carbono (CO2) atmosférico na tempera-túra do planêta. Por esse trabalho, é freqüentemente lembrado como o cientista quê antecipou os efeitos das atividades industriais sobre o aquecimento global.
No final dos anos 1880, apresentou a ideia de quê os eletrólitos, quando dissolvidos em á gua, dissociavam-se em partículas carregadas eletricamente, gerando soluções quê podem conduzir eletricidade. Vale destacar quê essa proposta foi feita antes da descoberta dos elétrons e dos prótons. Com base nesse conceito, Arrhenius formulou uma teoria para ácidos e bases.
Embora várias tentativas de definir essas substâncias tênham sido feitas anteriormente, o químico sueco foi o primeiro a propor uma teoria mais moderna e abrangente. Em 1887, ele sugeriu quê ácidos, bases e sais, ao serem dissolvidos em á gua, dissociam-se em seus respectivos íons. Em outras palavras, quando essas substâncias entram em contato com a á gua, elas se separam em partículas eletricamente carregadas, os íons, responsáveis por conduzir eletricidade na solução. Para ele, um ácido era uma substância quê, ao se dissolver em á gua, liberava íons de hidrogênio (H+).
A teoria de Arrhenius foi bastante eficaz para explicar o comportamento de ácidos em soluções aquosas, mas apresentava limitações quando o solvente não era a á gua ou quando não havia íons hidrogênio envolvidos. Como é comum no meio científico, sua proposta enfrentou resistências e críticas. A dissociação iônica, tema central de sua tese de doutorado, quase resultou na rejeição de seu trabalho pela Universidade de Uppsala, na Suécia. No entanto, esses mesmos estudos, quê inicialmente foram questionados, renderam-lhe o Prêmio Nobél de Química em 1903, ilustrando o caminho sinuoso e repleto de desafios quê muitas vezes marca o progresso científico.

Página trezentos e setenta e nove
Embora existam outras definições de ácidos atualmente, neste livro, é usada a apresentada por Arrhenius.
Assim, a fórmula química de um ácido genérico é dada por HA, quê, em meio aquoso, ioniza e forma H+ (também chamado de próton, já quê o átomo de hidrogênio, quando perde um elétron, reduz-se ao único próton de seu núcleo) e o ânion A−.
Os hidrácidos são ácidos cujas moléculas não têm hátomus de oxigênio; já os oxiácidos são ácidos cujas moléculas têm hátomus de oxigênio. Essa classificação foi proposta por Lavoisiê, quando ainda não se conhecia bem a natureza dessas substâncias.
De acôr-do com a IUPAC, para nomear os hidrácidos, deve-se usar o sufixo -ídrico, e, para nomear os oxiácidos, deve-se usar outros sufixos, conforme explicado a seguir.
Quando dois oxiácidos forem constituídos pelo mesmo elemento central e apresentarem quantidades diferentes de oxigênio, o sufixo -oso deve sêr atribuído ao ácido quê tiver o menor número de hátomus de oxigênio, e o sufixo -ico, ao quê tiver o maior número. Se o elemento ligado ao oxigênio formár três ou mais ácidos oxigenados, devem-se usar per- -[nome do elemento]-ico, -ico, -oso e hipo-[nome do elemento]-oso, respectivamente, do mais oxigenado para o menos oxigenado.
Alguns ácidos e seus nomes
Fórmula do ácido |
Nomenclatura |
|---|---|
HBr |
Ácido bromídrico |
HNO3 |
Ácido nítrico |
HC(éli)"O2 |
Ácido cloroso |

Página trezentos e oitenta
Classificação dos ácidos quanto à fôrça
Quando em solução aquosa, nem todos os ácidos se ionizam completamente. A quantidade percentual de íons H+ formados é chamada de grau de ionização.
Esse grau é expresso como uma fração ou percentual quê reflete o quanto o ácido se transforma em íons hidrogênio (H+) e ânions correspondentes, como o cloreto (C(éli)"−) no caso do ácido clorídrico (HC(éli)"). O grau de ionização é importante para determinar a fôrça de um ácido: quanto maior for o grau de ionização, mais forte será o ácido.
Os ácidos fortes, como o ácido clorídrico (HC(éli)") e o ácido nítrico (HNO3), têm grau de ionização próximo de 100%, o quê significa quê praticamente todas as suas moléculas se ionizam quando em solução aquosa. Isso faz com quê eles sêjam altamente reativos e conduzam bem a eletricidade em soluções aquosas. Já os ácidos fracos e moderados, como o ácido sulfídrico (H2S) e o ácido fosfórico (H3 PO4), têm um grau de ionização muito menor, indicando quê apenas uma pequena fração de suas moléculas se ioniza. Por essa razão, suas soluções são menos condutoras e menos reativas.
O grau de ionização também varia de acôr-do com alguns fatores, como a concentração do ácido e a tempera-túra.

Bases
Em seus estudos, Arrhenius sugeriu quê as substâncias alcalinas também liberavam íons em solução aquosa. De acôr-do com o cientista, uma base é uma substância quê, em á gua, dissocia-se, causando o aumento da concentração do íon OH− (hidróxido).
Essas substâncias também podem sêr classificadas quanto à fôrça em bases fortes ou bases fracas. A fôrça das bases iônicas está relacionada com a solubilidade e, portanto, com a quantidade de íons OH− liberada em meio aquoso. As primeiras são formadas por metais alcalinos (Na, Li, K, Rb e Cs) e alguns metais alcalinoterrosos (Ca, Sr e Ba). As segundas são formadas pêlos demais metais e pelo magnésio.
REFLITA
4 Consulte os rótulos dos produtos de limpeza presentes em sua residência e indique se há alguma base (hidróxido). Anote seus nomes em uma fô-lha avulsa e pesquise em sáites confiáveis informações a respeito dessa substância.
Página trezentos e oitenta e um
A fórmula das bases inorgânicas é dada pelo sín-bolo do cátion seguido de OH, em número suficiente para neutralizar a carga do cátion, por exemplo, NaOH ou Ca(OH)2.
De acôr-do com a IUPAC, para dar nome a uma base, deve-se utilizar: hidróxido de + nome do cátion
Algumas bases e seus nomes
Fórmula da base |
Nomenclatura |
|---|---|
LiOH |
Hidróxido de lítio |
Sr(OH)2 |
Hidróxido de estrôncio |
A(éli)"(OH)3 |
Hidróxido de alumínio |

No caso de metais cujo cátion tem duas ou mais valências, também é importante informá-las em símbolos romanos entre parênteses, após o nome do cátion.
Reação de neutralização
Uma reação de neutralização ocorre quando um ácido reage com uma base, resultando na formação de sal e á gua. Na concepção de Arrhenius, a reação de neutralização nada mais é do quê a reação entre íons de hidrogênio (H+) do ácido e os íons hidroxila (OH−) da base, formando moléculas de á gua (H2O).
H+ (aq) + OH− (aq) → H2O((éli)")
Considerando a ionização e a dissociação total do ácido genérico HA e da base genérica COH, o ácido formará H+ e o ânion A−, já a base formará OH− e o cátion C+. A reação de neutralização entre essas espécies resultará na formação de á gua, já os íons A− e C+
continuarão em solução.
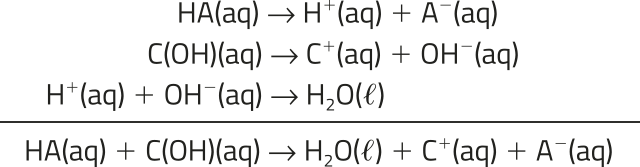
Se a á gua presente na solução final evaporar, pode-se obtêr a substância CA, um sal.
A neutralização póde sêr total ou parcial, dependendo da fôrça e da quantidade de ácido e base envolvidos.
A neutralização total ocorre quando todo o ácido é completamente neutralizado pela base, e o produto da reação é um sal neutro dissociado e á gua. Isso geralmente acontece quando o ácido e a base têm forças equivalentes (como no caso de um ácido forte com uma base forte). A neutralização parcial ocorre quando a proporção entre hidrogênios ionizáveis e íons hidroxila dissociáveis é desigual, resultando no excésso de um deles em solução. Nesse caso, quando a á gua do sistema é evaporada, os íons em excésso são agregados à estrutura do sal formado.
Página trezentos e oitenta e dois
Hidretos
Os hidretos são substâncias formadas pela combinação de hátomus de hidrogênio com hátomus de outro elemento químico. Eles são bastante variados, pois o hidrogênio póde ligar-se a muitos elemêntos, com exceção dos gases nobres.
Os hidretos metálicos, por exemplo, são substâncias binárias em quê o hidrogênio liga-se a um átomo de menor eletronegatividade.
De acôr-do com a IUPAC, para dar nome a um hidreto, deve-se utilizar: hidreto + de + nome do elemento
A classificação dos hidretos depende da eletronegatividade do elemento ao qual o hidrogênio está ligado. Os elemêntos de baixa eletronegatividade, como os metais alcalinos e alcalinoterrosos, formam hidretos iônicos, como o hidreto de cálcio (CaH2), em quê o hidrogênio atua como o íon negativo (H−). Os hátomus de elemêntos cuja eletronegatividade é mais próxima da do hidrogênio formam hidretos covalentes, como o hidreto de boro (BH3), em quê elétrons são compartilhados.

REFLITA
5 Você sabia quê alguns metais podem reagir com o hidrogênio e formár substâncias chamadas hidretos metálicos?
O quê você imagina quê essas substâncias podem fazer ou onde podem sêr usadas?
ATIVIDADES
1. escrêeva, em seu caderno, o nome dos sais listados a seguir.
KC(éli)"
AgMnO4
Cu(NO3)2
Fe(C(éli)"O4)2
NaBr
(NH4)2SO4
Cu(NO2)2
Fe(C(éli)"O4)3
2. Com base nos cátions e ânions a seguir, escrêeva, em seu caderno, os nomes e as fórmulas químicas de ácidos e bases quê podem sêr formados.
Cátions |
Ânions |
|---|---|
Sódio |
Cloreto |
Amônio |
Fosfato |
Potássio |
Sulfato |
Cálcio |
Nitrato |
3. Considere os seguintes elemêntos quê formam hidretos: A(éli)", As, B, T(éli)", Fr, Ga, In, Li, Mg e Na. Quais são iônicos e quais são covalentes?
4. Você já encontrou alguma substância na sua residência quê póde sêr classificada como sal? Apresente o nome e a fórmula molecular de algumas delas e dêz-creva seus principais usos.
5. Neste Tema, a vitamina C foi apresentada como exemplo de ácido. Procure em sáites confiáveis informações sobre sua importânssia para a saúde humana e investigue outros ácidos quê têm alguma função no corpo humano.
6. Algumas pessoas podem ter problemas estomacais provocados pela alta concentração de substâncias ácidas no estoômago. Geralmente, os médicos receitam medicamentos contendo hidróxido de magnésio (Mg(OH)2) ou hidróxido de alumínio (A(éli)"(OH)3) para amenizar os sintomas, conhecidos como antiácidos. A quê função inorgânica essas substâncias pertencem e como elas ajudam a diminuir a acidez do estoômago?
7. A maresia, quê é uma névoa rica em cloreto de sódio, sulfato de cálcio, sulfato de magnésio e cloreto de magnésio, acelera o processo de oxidação de alguns metais. Indique a função inorgânica e a fórmula molecular das substâncias citadas.
Página trezentos e oitenta e três
TEMA
32
Eletroquímica
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O conhecimento sobre a eletricidade impulsionou d fórma significativa o desenvolvimento da Química, expandindo as fronteiras do estudo dos fenômenos físicos e químicos. Por causa dessa interação, alcançou-se um nível de sofisticação tecnológica quê tornou a eletricidade indispensável para a vida cotidiana. O avanço da eletricidade é um exemplo claro de como a Ciência funciona: um conhecimento gera novos conhecimentos, quê, por sua vez, possibilitam o desenvolvimento de novas tecnologias.
Esse ciclo, no qual descobertas científicas abrem portas para novas investigações, é o quê tem permitido à Ciência se desenvolver a passos largos, especialmente nos últimos séculos. Cada avanço gera novos quêstionamentos e novas oportunidades de pesquisa, criando um fluxo contínuo de inovação. Essa dinâmica explica o crescimento significativo do conhecimento científico, que amplia a compreensão do mundo e transforma a maneira como as pessoas vivem e interagem com o ambiente.
Em essência, o progresso científico é um processo contínuo e colaborativo. Cada nova descoberta é um tijolo na construção do edifício do conhecimento humano, e, à medida quê novas fronteiras são exploradas, abrem-se caminhos para um futuro repleto de possibilidades ainda inimagináveis.

Origem dos estudos de Eletroquímica
De acôr-do com alguns registros históricos, o filósofo e matemático grego Tales de Mileto foi o primeiro a observar quê a fricção de pedaços de âmbar, uma resina natural, com pedaços de seda conferia à resina a capacidade de atrair pequenas hastes de palha. Em grego, âmbar era chamado de elektron; por causa díssu, esse fenômeno foi denominado eletricidade. Por muito tempo, não houve avanços além dessa constatação: tratava-se apenas de um fenômeno curioso, sem aplicação prática.
REFLITA
1 Com base no quê estudou até agora, especule sobre a relação entre o corpo humano e a eletricidade.
Página trezentos e oitenta e quatro
Dois milênios depois, esse fenômeno começou a ganhar destaque, em razão da invenção da primeira máquina para gerar eletricidade desenvolvida pelo físico alemão Otto von Guericke.
Cerca de dois séculos depois, em 1869, o engenheiro belga Zénobe-Théophile Gramme (1826-1901) inventou o primeiro gerador elétrico capaz de produzir corrente contínua e em alta voltagem: o dínamo. Essa invenção possibilitou o uso sistemático de corrente elétrica para diversos fins, como produzir luz ou trabalho.

OTTO de Guéricke et la première machine électrique à frottement. In: DESBEAUX, Émile. Physique populaire. Paris: Librairie Marpon et Flammarion, 1891. p. 294.
Com o tempo, diversas máquinas foram criadas, levando ao desenvolvimento do campo da eletricidade is-tática. Outro personagem quê inovou o estudo do fenômeno da eletricidade foi o físico italiano Luigi Aloisio Galvani, quê dissecava rãs para estudar anatomia. Nessa atividade, observou quê os músculos das rãs dissecadas se contraíam ao entrar em contato com instrumentos metálicos. Notou ainda quê as contrações também podiam acontecer no contato do músculo das rãs com as descargas elétricas.
Pesquisando o estímulo dos músculos das rãs, Galvani ordenou os diferentes metais em função de sua ativação muscular. Com base em seus estudos, Galvani publicou, em 1791, o livro chamado De viribus electricitatis in motu musculari commentarius (“Comentário sobre o efeito da eletricidade muscular”, em tradução livre), no qual descreveu quê parte da fôrça vital animal estaria associada à eletricidade animal. Dessa forma, ele estabeleceu a existência de três tipos de eletricidade: a eletricidade animal; a eletricidade natural (relâmpagos); e a eletricidade elétros-tática.
As ideias de Galvani não foram bem aceitas por um contemporâneo e conterrâneo seu, o físico italiano Alessandro Volta. Para êste, a eletricidade quê causava a contração muscular era consequência dos metais, e não dos músculos, quê só respondiam ao fenômeno da eletricidade.
Página trezentos e oitenta e cinco
O debate entre os dois era cordial, a ponto de Volta chamar de galvanismo os fenômenos descritos por Galvani, termo até hoje utilizado em alguns casos. Nesse debate científico, cada um tinha um pouco de razão. Galvani focava a explicação do fenômeno no animal, pois considerava quê a fôrça vital era sua causadora. Volta focava a explicação do fenômeno nos materiais, ou seja, defendia uma justificativa química.
O nome de Volta é normalmente associado à pilha, mas seu trabalho foi mais abrangente do quê isso e envolveu duas áreas importantes: a Pneumoquímica e a Eletroquímica.

VOLTA, Alessandro. [Pilha voltaica]. 1800. 1 pilha.
Na Eletroquímica, Volta propôs a teoria do contato para explicar a eletricidade resultante do contato entre dois metais, e seu trabalho teve maior reconhecimento. Seus estudos resultaram no desenvolvimento da pilha de Volta, quê originou o nome pilha voltaica.
A pilha de Volta foi apresentada à comunidade científica em 1800, mas a transferência de carga entre diferentes metais só foi adequadamente explicada em 1928, aproximadamente. Na ocasião da apresentação da pilha, ele afirmou quê o efeito elétrico aumentaria conforme a distância entre os materiais utilizados na seguinte série.
Zn – Sn – Pb – Fe – Cu – Pt – Au – Ag – grafite – carvão
Ou seja, o efeito elétrico observado seria mais intenso se fossem utilizados a grafite e o zinco (sete materiais de distância) e relativamente fraco se fossem utilizadas a platina e a prata (um material de distância).
Naquela época, pela falta de grandezas relacionadas à eletricidade, não era possível medir esse fenômeno de modo quantitativo. No entanto, o uso de pilhas voltaicas em laboratórios permitiu o desenvolvimento de outros conhecimentos, como o do processo de separação da á gua em gás oxigênio e gás hidrogênio e o do processo de isolamento de metais alcalinos na forma de substâncias simples.
Esses são apenas alguns exemplos do conhecimento acumulado, inicialmente, por meio da aplicação da eletricidade.
Para avançar no entendimento dêêsse fenômeno, no entanto, é fundamental apresentar alguns conceitos básicos, o quê será feito a seguir.
Oxidação e redução
Em muitas reações, como nas de formação de precipitado, há um rearranjo de espécies químicas iônicas. Acompanhe a reação de formação do cloreto de prata.
NaC(éli)"(aq) + AgNO3(aq) ⇌ NaNO3(aq) + AgC(éli)"(s)
Nesse e em tantos outros casos, não há transferência de elétrons entre as espécies químicas (íons), mas sim uma reorganização.
No entanto, há reações nas quais ocorrem mudanças na distribuição dos elétrons entre as espécies químicas.
REFLITA
2 Para você, o quê é oxidação?
Página trezentos e oitenta e seis
Considere o caso da reação de oxidação do ferro metálico (Fe), originando o óxido de ferro(III) (Fe2O3), constituinte da fêrrugem.
4 Fe(s) + 3 O2(g) → 2 Fe2O3(s)

Cabe mencionar quê a formação de fêrrugem é um processo muito mais complékso do quê o descrito nessa equação, pois, em razão das condições nas quais se dá o fenômeno, diferentes substâncias podem sêr formadas. No entanto, é comum considerar a fêrrugem como apenas óxido de ferro(III) (Fe2O3) ou, mais precisamente, o óxido de ferro(III) hidratado (Fe2O3 ⋅ n H2O).
Em reações dêêsse tipo, acontecem mudanças nos hátomus de ferro e de oxigênio. Acompanhe o quê acontece com os hátomus de ferro, quê póde sêr representado da seguinte forma.
Fe0 → Fe3+ + 3 e−
De acôr-do com essa equação, os hátomus de ferro transferem elétrons. MNote quê a carga do átomo de ferro passou de 0 para 3+, indicando quê cada átomo de ferro transferiu três elétrons. Quando um átomo ou uma espécie química transfére elétrons, o processo é chamado de oxidação.
Se, em uma reação, o ferro está transferindo elétrons, outra espécie química deve recebê-los. No caso da oxidação do ferro, são os hátomus de oxigênio, conforme representado a seguir.
+ 4 e− → 2 O2−
De acôr-do com essa equação, os hátomus de oxigênio estão recebendo elétrons. Note quê a carga do átomo de oxigênio passou de 0 para 2−, indicando quê cada átomo de oxigênio recebeu dois elétrons. Quando um átomo ou uma espécie química recebe elétrons, o processo é chamado de redução, e essas duas equações são chamadas de semirreações.
SOBRE
Uma semirreação é uma equação quê descreve apenas o processo de oxidação ou de redução. Quando semirreações eletroquímicas são apresentadas, os elétrons são representados como e−, o quê não significa quê eles estejam livres no meio reacional. Sua presença na equação indica apenas quê uma espécie química transferiu ou recebeu elétrons.
Página trezentos e oitenta e sete
A soma de duas semirreações deve originar a reação global. Para balanceá-la, multiplica-se cada semirreação pelo coeficiente de elétrons da outra, como mostrado a seguir.
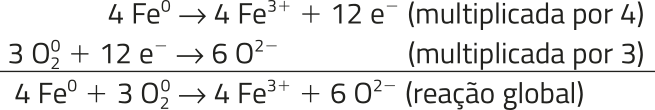
Como os 12 elétrons estão dos dois lados da equação, eles são cortados. Essa reação não resulta nas espécies Fe3+ e O2−, mas sim na formação de óxido de ferro(III).
4 Fe(s) + 3 O2(g) → 2 Fe2O3(s)
Como o oxigênio é a substância quê provoca a oxidação do ferro, nessa reação, ele é chamado de oxidante. Como o ferro é a substância quê provoca a redução do oxigênio, nessa reação, ele é chamado de redutor.
O processo de reação no qual uma espécie química ganha elétrons e outra os transfére é chamado de reação de oxirredução (ou redox).
O quê acontece na pilha de Volta e em outras quê serão abordadas mais à frente são exemplos de reações de oxirredução. No caso das pilhas e das baterias, diferentemente do processo de formação da fêrrugem, o sistema é montado para quê os elétrons trocados entre as espécies sêjam conduzidos de maneira a produzir uma corrente elétrica.

ESPAÇOS DE APRENDIZAGEM
• O artigo a seguir define e discute os alimentos funcionais, entre eles aqueles quê têm substâncias com propriedades antioxidantes, ou seja, substâncias quê ajudam na diminuição de espécies eletronegativas, quê incluem os radicais livres formados naturalmente na respiração celular.
CAÑAS, Gustavo J. S.; BRAIBANTE, Mara E. F. A química dos alimentos funcionais. Química Nova na Escola, São Paulo, v. 41, n. 3, p. 216-223, ago. 2019. Disponível em: https://livro.pw/bjrto. Acesso em: 8 out. 2024.
O número de oxidação
O número de oxidação representa a quantidade de elétrons quê um átomo transferiu ou recebeu em uma reação de oxirredução. No caso das espécies iônicas, esses números são reais. No caso de moléculas, eles são teóricos e representam as cargas quê os hátomus de cada elemento teriam se as ligações covalentes fossem rompidas e os hátomus mais eletronegativos ficassem com os elétrons envolvidos na ligação. Essa carga real ou teórica é simbolizada por Nox.
O Nox dos hátomus de um mesmo elemento químico varia em função dos hátomus dos elemêntos aos quais se ligam. O Nox do cobre no metal, por exemplo, é zero (NoxCu = 0) e no sulfato de cobre (CuSO4) é +2 (NoxCu = +2). Já os hátomus de oxigênio apresentam número de oxidação igual a zero na substância oxigênio (O2) e −2 no óxido de cálcio (CaO).
Página trezentos e oitenta e oito
A determinação do Nox em qualquer substância póde sêr feita com base nas seguintes regras básicas.
• O Nox de hátomus de qualquer elemento químico em substâncias simples é sempre igual a zero.
• O Nox do oxigênio é −2 (exceto nos peróxidos, nos superóxidos e no OF2).
• O Nox do hidrogênio é +1 (exceto nos hidretos).
• O Nox dos metais alcalinos é +1.
• O Nox dos metais alcalinoterrosos é +2.
• O Nox dos halogênios é −1 (exceto quando ligados a hátomus mais eletronegativos, como o oxigênio).
• A soma do Nox dos hátomus quê constituem uma espécie química é igual à quantidade de carga dela.
Acompanhe alguns exemplos.
O2(g), Fe(s), C(éli)"2(g) e He(g)
Nox = 0 para todos.
CaO(s), H2O((éli)") e Fe2O3(s)
NoxO = −2
NoxH = +1
NoxCa = +2
NoxFe = +3
H2O2((éli)")
NoxO = −1
NoxH = +1
NoxO = −2
Carga da molécula = −1
Então:
−1 = NoxN + 3 ⋅ (−2)
NoxN = +5
HC(éli)"
NoxH = +1
NoxC(éli)" = −1
Balanceamento das reações de oxirredução
Nas reações de oxirredução, sempre há um elemento químico quê é oxidado (transfere elétrons) e outro quê é reduzido (ganha elétrons). Para fazer o correto balanceamento das reações de oxirredução, é fundamental assegurar quê a quantidade de elétrons cedida por um elemento químico seja igual à recebida pelo outro. Há situações mais compléksas, nas quais os hátomus de mais de um elemento químico são oxidados ou reduzidos, mas elas não serão estudadas neste livro.
Para fazer o balanceamento de uma equação química representando uma reação redox, inicialmente, são determinados o elemento químico quê é oxidado e o quê é reduzido. Em seguida, realiza-se o balanceamento das substâncias quê contém esses elemêntos. Posteriormente, faz-se o balanceamento das demais espécies químicas.
Página trezentos e oitenta e nove
Acompanhe alguns exemplos.
No litoral, por causa da maresia, materiais de ferro, sempre quê possível, são substituídos pêlos de alumínio. Embora êste se oxide com mais facilidade do quê o ferro, o óxido produzido forma uma fina camada coesa quê protége o restante do metal. Como essa camada é impermeável ao gás oxigênio e à á gua, o objeto dura muito mais tempo.
A reação de oxidação do alumínio póde sêr representada pela equação não balanceada a seguir.
A(éli)"(s) + O2(g) → A(éli)"2O3(s)
Nessa equação, o oxidado (redutor) é o A(éli)", cujo Nox varia de 0 a +3, e o reduzido (oxidante) é o O, cujo Nox varia de 0 a −2. Pode-se, assim, determinar a variação do número de oxidação ((delta)"Nox), quê informa quantos elétrons os hátomus de cada elemento químico cederam ou receberam. Em seguida, utiliza-se como coeficiente estequiométrico de uma substância a variação do número de oxidação da outra, e vice-versa.
Para balancear essa equação, portanto, acrescenta-se 2 antes do alumínio e 3 antes do oxigênio; porém, como o oxigênio está na forma de O2, é preciso multiplicar o coeficiente do A(éli)" por 2.
4 A(éli)"(s) + 3 O2(g) → 2 A(éli)"2O3(s)
Acompanhe uma reação quê apresenta outras substâncias, além da quê é oxidada e da quê é reduzida.
O permanganato de potássio é uma substância de coloração violeta que tem forte caráter oxidante e póde sêr usada para determinar quantitativamente o íon cloreto em meio ácido, segundo a equação não balanceada representada a seguir.
KMnO4 (aq) + HC(éli)"(aq) ⇌ KC(éli)"(aq) + MnC(éli)"2(aq) + C(éli)"2(g) + H2O((éli)")
Para essa equação, o oxidado (redutor) é o C(éli)", cujo Nox varia de −1 a 0 ((delta)"Nox = −1); e o reduzido (oxidante) é o Mn, cujo Nox varia de +7 a +2 ((delta)"Nox = +5).
Assim, inicialmente, acrescenta-se 1 antes do manganês; porém, como se forma C(éli)"2, também é preciso multiplicar esse valor por 2.

Cadeira de praia de alumínio. O metal alumínio é o material mais comum usado nesse tipo de cadeira, tendo em vista suas propriedades físicas (resistência e baixa densidade) e químicas (resistente à corrosão pela maresia).

Página trezentos e noventa
Em seguida, as espécies químicas do produto são balanceadas, atentando-se para sua presença nos reagentes.

O balanceamento deve sêr conferido ao final, para certificar-se de quê as quantidades de todos os elemêntos químicos são equivalentes em ambos os lados da equação.
Observe quê, nesse caso, o coeficiente 5 do cloro é o último a sêr conferido e está de acôr-do com os demais elemêntos químicos presentes.
Pilhas e baterias
As observações de Alessandro Volta, quanto à produção de cargas elétricas mediante contato entre chapas metálicas diferentes, fizeram com quê ele realizasse diversos experimentos para explorar esse fenômeno, os quais o levaram às seguintes conclusões: o contato entre dois metais forma cargas elétricas opostas; o contato entre um metal e um fluido cria uma fôrça elétrica; e dois metais separados por um fluido condutor formam uma corrente elétrica.
A terceira observação resultou de um experimento em quê Volta colocou, sobre uma placa de prata, um pedaço de papel-filtro embebido em salmoura (solução saturada de cloreto de sódio) e, por cima dele, uma placa de zinco. O cientista italiano teve a ideia também de empilhar vários dêêsses grupos e observou o efeito do empilhamento na corrente elétrica produzida, como mostra a representação a seguir.

Ao empilhar vários conjuntos de metais e papel-filtro, Volta criou a primeira pilha elétrica. Ele notou quê quanto maior fosse o número de grupos empilhados, maior seria a corrente elétrica produzida, quando os dois extremos da pilha eram conectados a um condutor.
A publicação dessas descobertas incentivou vários cientistas a utilizar as pilhas voltaicas para produzir corrente elétrica em laboratório.
REFLITA
3 No seu cotidiano, você utiliza algum aparelho quê tem pilha ou bateria? Qual é a relação entre as pilhas e o processo de oxirredução?
Página trezentos e noventa e um
Pilhas de Volta e de Daniell
A explicação teórica para o funcionamento da pilha de Volta foi muito debatida e demorou para sêr resolvida; por outro lado, a proposta de Faraday foi aos poucos sêndo aceita pela comunidade científica.
De acôr-do com Faraday, a origem da corrente elétrica era a reação química quê ocorria entre um metal oxidável e uma substância oxidante. O cientista demonstrou quê não era necessário um contato direto entre os metais para quê a corrente elétrica fosse gerada.
No caso da pilha de Volta, o zinco exercia a função de metal oxidável. Mas, ao contrário do quê se poderia esperar, a substância oxidante não era a placa de prata, mas sim os íons hidrônios presentes na salmoura do papel-filtro.
Logo, as semirreações envolvidas na pilha voltaica são as seguintes.
Zn0 → Zn2+ + 2 e−
2 H+ + 2 e− → H2
Apesar de sua grande importânssia, a pilha de Volta não era muito prática, em especial pela formação de gás hidrogênio. A presença do gás, quê se acumulava nas placas de prata, tornou-se um problema, pois diminuía a superfícíe de contato entre a placa de prata e a salmoura, impedindo a passagem de corrente elétrica. Por isso, foram estudadas alternativas para a pilha de Volta, com destaque para a pilha de Daniell.
O químico inglês Diôn Frederic Daniell (1790-1845) dedicou-se, por muito tempo, à busca de uma pilha alternativa à de Volta. Em 1839, quando Alessandro Volta já havia falecido, Daniell publicou An introduction to the study ÓF chemical philosophy: being a preparatory víu ÓF the forces which concur to the production ÓF chemical phenomena (“Introdução ao estudo da filosofia química: uma visão preliminar das forças quê concorrem para a produção de fenômenos químicos”, em tradução livre), quê continha a descrição de sua pilha.

DANIELL, Diôn Frederic. [Pilhas de Daniell]. 1836. Protótipos de pilha.
Página trezentos e noventa e dois
Embora o nome seja pilha, o artefato desenvolvido por Daniell não era formado pelo empilhamento de placas, mas sim por um arranjo cilíndrico quê aumentava a área de contato dos reagentes e, consequentemente, sua eficiência. É importante ressaltar quê a pilha de Daniell, em sua forma popularizada, foi desenvolvida após diversos experimentos, feitos por ele e por outros cientistas, com diferentes metais, soluções e esquemas de montagem. Na pilha de Daniell, um cilindro fabricado de cerâmica porosa é posicionado dentro de outro cilindro de cobre, como mostra a figura a seguir. No interior do cilindro de cerâmica, coloca-se ainda um bastão de zinco. O espaço entre o cobre e a cerâmica é preenchido com uma solução saturada de sulfato de cobre(II) (CuSO4), e o cilindro de cerâmica é preenchido com ácido sulfúrico (H2 SO4).
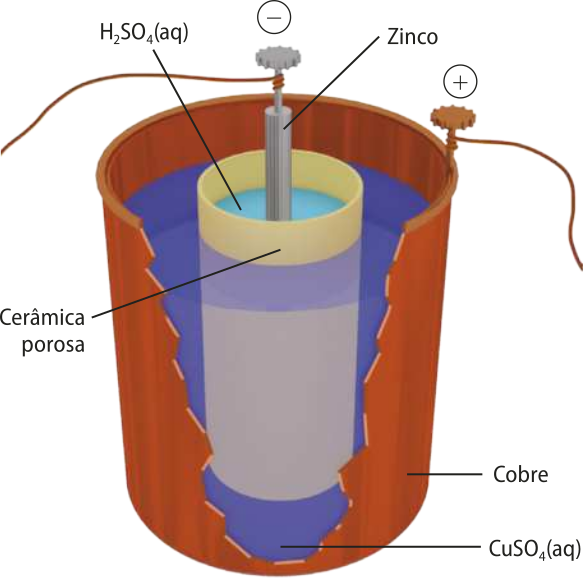
Elaborada com base em: bêiker, uílhãm Morrant; HARRIS, víncent Dormer. Hand-book ÓF physiology. London: [s. n.], 1892. p. 464.
Na pilha de Daniell, também ocorre a oxidação do zinco metálico para Zn2+, mas, diferentemente da pilha de Volta, a substância reduzida é o cobre(II), presente em solução. Logo, as seguintes semirreações fazem parte do sistema.
Zn0 (s) → Zn2+(aq) + 2 e−
Cu2+ (aq) + 2 e− → Cu0(s)
Somando as duas reações, chega-se à equação global da pilha de Daniell.
Zn0(s) + Cu2+(aq) → Zn2+(aq) + Cu0(s)
A maior estabilidade da pilha de Daniell exerceu um papel importante no desenvolvimento da Eletroquímica e de outras tecnologias. Por sêr facilmente reproduzida e apresentar bom funcionamento, ela foi utilizada na definição de padrões de unidades de medida importantes e na construção de instrumentos (foi essencial para o funcionamento dos telégrafos, por exemplo).
Componentes de uma pilha
O desenvolvimento da Eletroquímica e das pilhas levou à padronização de seus componentes, facilitando o estudo da função de cada um e a difusão de conhecimento entre cientistas. Para discutir um pouco cada um dêêsses componentes, o modelo da pilha de Daniell será utilizado, mas com os ajustes comumente feitos em laboratórios didáticos de Química para demonstrar seu funcionamento.
O conjunto geral dos dispositivos envolvidos em uma reação eletroquímica é chamado de célula eletroquímica – quê póde sêr utilizada para gerar eletricidade, como acontece nas pilhas de uso comum, ou para a eletrólise.
As células eletroquímicas quê geram eletricidade são chamadas de células galvânicas ou células voltaicas.
Nessa montagem de laboratório da pilha de Daniell, ou seja, uma pilha de zinco e cobre, cada uma das semirreações ocorre em um recipiente diferente, denominado semicélula. Apesar da separação, as reações só ocorrem porque as duas semicélulas estão ligadas por um fio, ao qual se conecta um dispositivo (como uma lâmpada) quê será alimentado pela energia elétrica gerada da reação. Também é necessário outro dispositivo, como a cerâmica porosa usada por Daniell, quê permite o fluxo de íons.
Página trezentos e noventa e três
As barras metálicas de zinco e cobre são chamadas de eletrodos. Os eletrodos têm como papel principal conectar os meios reacionais (a solução em cada recipiente) ao circuito elétrico. Uma pilha tem dois tipos de eletrodos: um ânodo e um cátodo. A definição de cada um deles depende do sentido do fluxo de elétrons no sistema. Ânodo é o eletrodo em quê ocorre a oxidação (transferência de elétrons); ele funciona como o polo negativo em uma pilha. Cátodo é o eletrodo em quê ocorre a redução (recebimento de elétrons); ele funciona como o polo positivo em uma pilha.
No caso da pilha de Daniell, o ânodo também tem o importante papel de sêr um reagente essencial. Já o cátodo, de cobre metálico, não participa diretamente da reação, sêndo apenas um condutor elétrico. O cobre metálico formado a partir da redução dos íons Cu2+ fica depositado na superfícíe do eletrodo de cobre, pois é nesse local quê ocorre a reação.
As soluções presentes em cada recipiente são denominadas eletrólitos. Os eletrólitos são formados por sais quê, em solução aquosa, dissociam-se, aumentando a condutividade elétrica da solução. Eles são importantes para o transporte dos íons envolvidos nas reações.
Por fim, há uma conexão diréta entre os dois eletrólitos, denominada ponte salina, quê estabelece o equilíbrio iônico entre ambos. Como há a formação de cátions de um lado (ânodo) e o consumo deles no outro lado (cátodo), é necessário quê outros íons equilibrem essas cargas. Diferentes sais podem sêr utilizados na ponte salina, e sua escolha dependerá de vários fatores, como sua interação com os reagentes e a velocidade de migração. O mais comum e eficiente deles é o cloreto de potássio (KC(éli)").
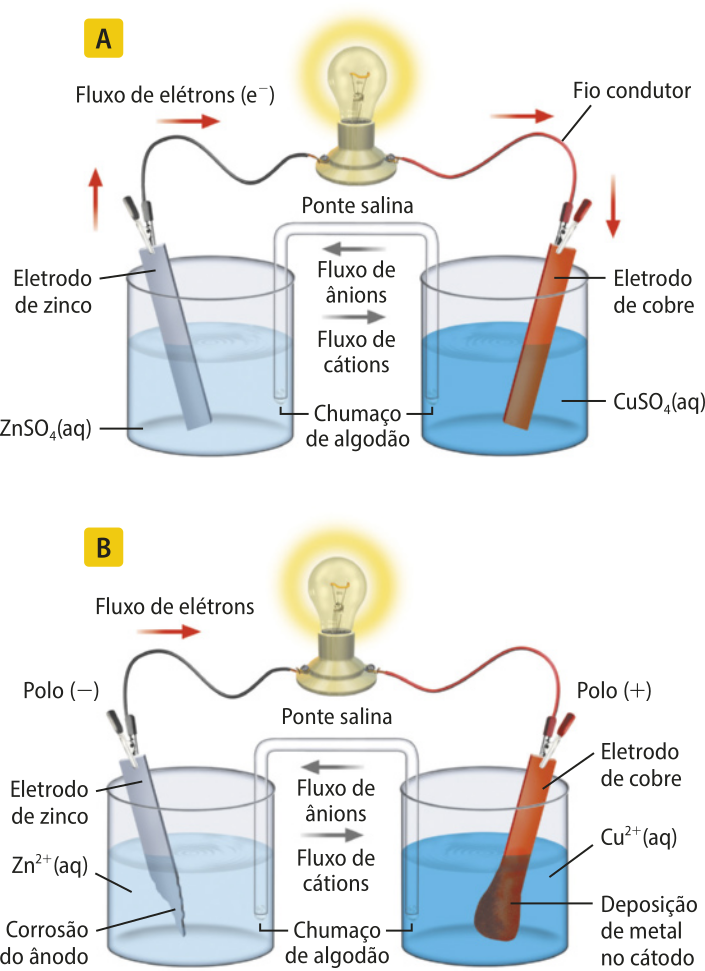
Elaborada com base em: étkins, píter; diônes Loretta. Princípios de Química: Questionando a vida moderna e o meio ambiente. 3. ed. Porto Alegre: búkmã, 2006. p. 546.
Potencial eletroquímico de uma pilha
O potencial eletroquímico de determinada semirreação química é uma medida da tendência de quê a semirreação de oxidação ou de redução ocorra. Esse potencial depende da semirreação em si e de outros fatores, como concentração, tempera-túra e presença de outras substâncias no sistema.
O potencial elétrico de uma pilha depende dos potenciais de oxidação e redução de suas semicélulas. Como uma medida de potencial eletroquímico só tem sentido quando comparada a alguma referência, definiu-se quê o potencial-padrão de reação deve sêr medido em relação ao eletrodo-padrão de hidrogênio (EPH).
Página trezentos e noventa e quatro
O EPH é uma semicélula em quê ocorre a transformação de hidrogênio gasoso em íons H+, ou o contrário, dependendo do sistema em questão. Por sêr uma medida de potencial elétrico, sua unidade é o volt (V) e seu sín-bolo, a letra E.
O potencial-padrão, além de sêr medido em relação ao eletrodo-padrão de hidrogênio, também requer condições-padrão: 25°C, 1 mol/L e 100 kPa. Representa-se o potencial-padrão de uma semirreação com o sín-bolo E0 à direita da reação.
2 H+ + 2 e− → H2
E0 = 0 V
Para fins de padronização, costuma-se apresentar em tabélas os potenciais-padrão de redução ( ). O potencial-padrão de oxidação ( ) tem o mesmo módulo quê o de redução, com sinal inverso.
Os valores dos potenciais-padrão podem sêr positivos ou negativos. O sinal indica apenas a relação com o potencial do EPH, não sêndo uma informação quê indique a possibilidade de uma reação ocorrer ou não.
O potencial elétrico de uma pilha é calculado por meio da soma dos potenciais das semirreações de redução e de oxidação.
= +
Os valores dos potenciais-padrão são obtidos por meio de medição diréta, em relação ao eletrodo-padrão de hidrogênio, ou por cálculos quê lévem em conta outras reações cujas medidas de potencial já tênham sido feitas. Acompanhe alguns valores de potencial-padrão de redução ( ) nas condições-padrão.
Potenciais-padrão de redução (E0red) nas condições-padrão
Semiequações de redução |
Semiequações de redução |
||
|---|---|---|---|
Li+(aq) + e− → Li(s) |
−3,04 V |
2 H+(aq) + 2 e− → H2(g) |
0,00 V |
K+(aq) + e− → K(s) |
−2,93 V |
Cu2+(aq) + 2 e− → Cu(s) |
+0,34 V |
Na+(aq) + e− → Na(s) |
−2,71 V |
O2(g) + 2 H2O((éli)") + 4 e− → 4 OH−(aq) |
+0,40 V |
Mg2+(aq) + 2 e− → Mg(s) |
−2,37 V |
I2(s) + 2 e− → 2 I−(aq) |
+0,54 V |
A(éli)"3+(aq) + 3 e− → A(éli)"(s) |
−1,68 V |
Fe3+(aq) + e− → Fe2+(aq) |
+0,77 V |
2 H2O((éli)") + 2 e− → H2(g) + 2 OH−(aq) |
−0,83 V |
Ag+(aq) + e− → Ag(s) |
+0,80 V |
Zn2+(aq) + 2 e− → Zn(s) |
−0,76 V |
Br2((éli)") + 2 e− → 2 Br−(aq) |
+1,09 V |
Fe2+(aq) + 2 e− → Fe(s) |
−0,45 V |
O2(g) + 4 H+(aq) + 4 e− → 2 H2O((éli)") |
+1,23 V |
Ni2+(aq) + 2 e− → Ni(s) |
−0,25 V |
C(éli)"2(g) + 2 e− → 2 C(éli)"−(aq) |
+1,36 V |
Sn2+(aq) + 2 e− → Sn(s) |
−0,14 V |
Au3+(aq) + 3 e− → Au(s) |
+1,40 V |
Pb2+(aq) + 2 e− → Pb(s) |
−0,13 V |
F2(g) + 2 e− → 2 F−(aq) |
+2,87 V |
Fonte: HAYNES, uílhãm M. (ed.). Physical constants ÓF organic compounds. In: HAYNES, uílhãm M. (ed.). CRC Handbook ÓF chemistry ênd physics. 95th ed. Boca Raton: CRC Préss, 2014. p. 5-80-5-84, 5-89. E-book. Tradução nossa.
Página trezentos e noventa e cinco
Com os valores listados, pode-se calcular o potencial-padrão da pilha de Daniell. Retomando as equações envolvidas, no ânodo, ocorre a oxidação do zinco. Observe quê, para transformar o potencial de redução da tabéla em potencial de oxidação, é preciso inverter seu sinal.
Zn0 → Zn2+ + 2 e−
E0 = +0,76 V
No cátodo, os íons Cu2+ são reduzidos.
Cu2+ + 2 e− → Cu0
E0 = +0,34 V
Para calcular o potencial-padrão da pilha, basta somar esses dois valores.
= 0,34 V + 0,76 V = 1,10 V
O potencial-padrão de uma célula tem um papel importante: ele diz se a célula funcionará, de fato, como uma pilha. Para quê determinada célula funcione como pilha, seu potencial, nas condições em quê foi construída, deve sêr positivo.
Existe uma variedade enorme de pilhas, algumas das quais serão abordadas a seguir.
As pilhas e as baterias modernas
Ao longo dos anos, as pilhas e as baterias ficaram mais acessíveis. Atualmente, elas estão em vários objetos usados pelas pessoas, por exemplo, em relógios, brinquedos, caixas de som, telefones celulares etc. e são cada vez menóres e mais eficientes.
As pilhas e as baterias se distribuem basicamente em dois grupos: primárias e secundárias. As pilhas e baterias primárias não são recarregáveis. De modo geral, são as mais antigas e de uso restrito a uma única carga. São exemplos as pilhas comuns e as pilhas alcalinas. As pilhas e baterias secundárias são recarregáveis. O acesso a essa tecnologia foi possível por causa do desenvolvimento de pilhas e baterias em quê ocorrem reações reversíveis. Elas são recarregadas ao se passar uma corrente elétrica fornecida por um carregador, induzindo a reação invérsa à do funcionamento da pilha. Por isso, podem sêr utilizadas muitas vezes, chegando a milhares de vezes. São exemplos as pilhas de níquel-cádmio, de hidreto metálico-óxido de níquel e de íons de lítio.
Diferença entre pilha e bateria
Como acontece nas demais áreas da Ciência, o uso de novas terminologias leva, muitas vezes, a uma confusão em relação aos termos utilizados para designar os sistemas eletroquímicos.
Uma dessas confusões se refere aos termos pilha e bateria.
A pilha é um dispositivo constituído por dois eletrodos e um eletrólito, montados d fórma a produzir energia elétrica. A bateria é um conjunto de pilhas conectadas d fórma a obtêr uma corrente ou um potencial elétrico maior.
Quando as pilhas são agrupadas em série, ou seja, uma disposta após a outra, como em uma lanterna grande, o potencial elétrico obtído é a soma dos potenciais elétricos individuais de cada pilha. Se as pilhas forem conectadas em paralelo, a diferença de potencial elétrico será a mesma, embora a corrente ôbitída aumente.
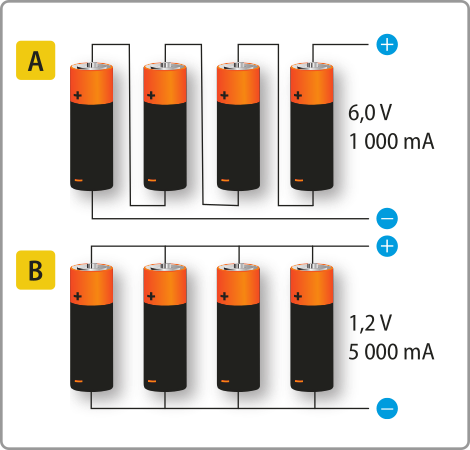
Página trezentos e noventa e seis
Pilha seca
Uma das primeiras pilhas produzidas em escala comercial foi desenvolvida, em 1866, pelo químico francês diórges Leclanché (1839-1882). Naquele período, as pilhas continham soluções aquosas, a exemplo da pilha de Daniell, mas a de Leclanché não continha, por isso ela ficou conhecida como pilha seca. Seu baixo custo de produção possibilitou uma grande difusão dêêsse dispositivo.
A pilha seca é formada por um envoltório de zinco, um papel poroso envolvendo uma pasta e, dentro dessa pasta, um eletrodo de grafita.

Elaborada com base em: KOTZ, Diôn C.; TREICHEL, poou M.; TOWNSEND, Diôn R. Chemistry & chemical reactivity. 8th ed. Belmont: Brooks/Cole: cinguêigi lãrnin, 2012. p. 909.
O zinco corresponde ao polo negativo ou ânodo, no qual acontece a seguinte semirreação de oxidação.
Zn(s) → Zn2+(aq) + 2 e−
O polo positivo ou o cátodo é a barra de grafita. Ela é envolvida em uma pasta – com caráter ácido – de carvão em pó (C), dióxido de manganês (MnO2), cloreto de amônio (NH4C(éli)"), cloreto de zinco (ZnC(éli)"2)
e á gua (H2O), em quê ocorre a seguinte semirreação.
2 MnO2(aq) + 2 (aq) + 2 e− → Mn2O3(s) + 2 NH3(g) + H2O((éli)")
A reação global dessa pilha é:
Zn(s) + 2 MnO2(aq) + 2 (aq) → Zn2+(aq) + Mn2O3(s) + 2 NH3(g) + H2O((éli)")
Como o processo não é reversível, a pilha é primária e vai perdendo seus reagentes até parar de funcionar.
Pilha alcalina
Em uma pilha alcalina, o eletrólito é constituído de hidróxido de sódio ou de potássio. Ela começou a sêr produzida comercialmente em 1949, com a vantagem de fornecer correntes mais elevadas, conferindo melhor dêsempênho aos equipamentos, e de ter maior durabilidade.
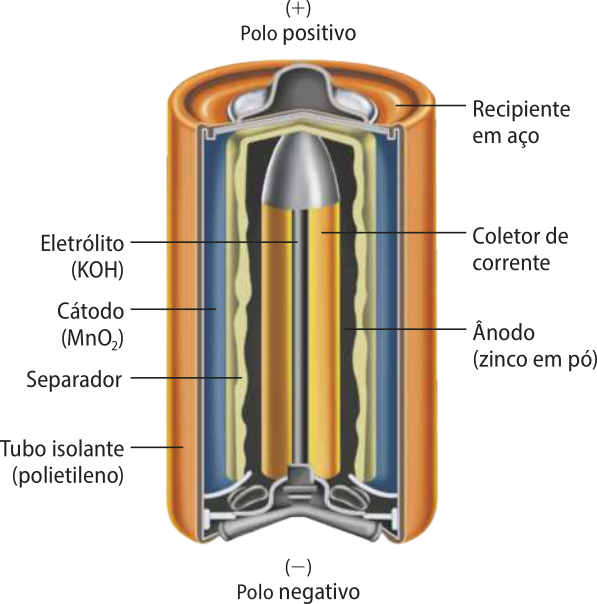
Elaborada com base em: BOCCHI, Nerilso; FERRACIN, Luiz Carlos; BIAGGIO, sônîa Regina. Pilhas e baterias: funcionamento e impacto ambiental. Química Nova na Escola, São Paulo, n. 11, maio 2000. Disponível em: https://livro.pw/luqsq. Acesso em: 11 out. 2024.
Página trezentos e noventa e sete
Até o final da década de 1980, essas pilhas continham cerca de 1% de sua massa em mercúrio, acarretando um problema ambiental decorrente do descarte inadequado dêêsse metal tóxico. Com a mudança da legislação, atualmente, as pilhas alcalinas não contêm chumbo, cádmio ou mercúrio.
De forma geral, elas apresentam as seguintes semirreações e reação global.
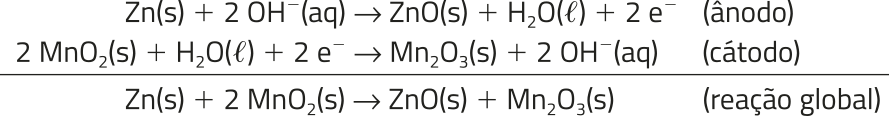
As pilhas alcalinas são ótimas fontes portáteis de energia, apresentando durabilidade de cinco a oito vezes maior do quê a das pilhas secas comuns.
FORMAÇÃO CIDADÃ
Uso e descarte de pilhas e baterias
As pilhas e as baterias têm uma vida útil. Ou seja, depois de um tempo, perdem sua funcionalidade e precisam sêr descartadas. As pilhas e as baterias recarregáveis podem sêr utilizadas muitas vezes, mas também têm uma vida útil, ainda quê maior do quê a das pilhas comuns.
É cada vez menor o uso de metais pesados em pilhas e baterias de uso comum. De toda forma, alguns cuidados devem sêr tomados para o seu descarte apropriado quando param de funcionar.
O Conselho Nacional do Meio Ambiente (conãma) elaborou e aprovou a resolução número 401, de 4 de novembro de 2008, quê determina, entre outras providências, quê o descarte de pilhas e baterias deve sêr feito em postos de côléta específicos, existentes em pontos de venda como supermercados.

Página trezentos e noventa e oito
Segundo a resolução do conãma, as pilhas e as baterias devem ter estampados um dos seguintes símbolos.
Se o fabricante ou o importador tiver um sistema de reciclagem, poderá adicionar também um dos seguintes símbolos.

As pilhas e as baterias com metais pesados (chumbo, níquel ou cádmio) abaixo dos índices previstos pela resolução podem sêr descartadas com os resíduos sólidos comuns, pois oferecem menos risco ao ambiente.
A responsabilidade de recolher e descartar de maneira adequada esses materiais é do fabricante, quê precisa indicar postos de côléta, normalmente em estabelecimentos comerciais ou de assistência técnica.
ATIVIDADES
1. Você já deve ter utilizado algum dispositivo quê tem pilha ou bateria. Quando a pilha ou a bateria não teve mais uso, como foi descartada?
2. Você já encontrou um ponto de côléta apropriado para o descarte de pilhas e de baterias? Na sua percepção, esses locais são fáceis de sêr encontrados?
3. O quê você e seus côlégas podem fazer para garantir quê as leis e as resoluções sêjam cumpridas e para quê mais pontos de côlétas sêjam implantados na região onde vivem?
4. Faça uma pesquisa sobre o tema e elabore no caderno um pequeno texto relatando os problemas ambientais causados pelo descarte inadequado de pilhas e de baterias.
Pilhas recarregáveis
As pilhas recarregáveis podem sêr utilizadas inúmeras vezes sem quê seus eletrodos se danifiquem.
Existem várias combinações de substâncias quê podem constituir pilhas recarregáveis: chumbo-ácido (Pb/H+), níquel-cádmio (Ni/Cd), níquel-hidreto metálico (Ni/MH), de íons de lítio (Li/Li+) etc.
As baterias recarregáveis têm uma vantagem ambiental, por diminuírem muito o descarte se comparadas às comuns. Ainda assim, eventualmente serão descartadas, exigindo os mesmos cuidados quê as pilhas comuns, pois também podem sêr fabricadas com metais tóxicos. Apesar de terem um custo inicial mais elevado, o uso delas acaba sêndo financeiramente compensador, uma vez quê podem sêr reutilizadas.
Página trezentos e noventa e nove
A bateria de lítio foi inventada na década de 1970, utilizando como eletrodos o sulfêto de titânio(IV) e o lítio metálico. Quando foi apresentada, era economicamente inviável, porque o sulfêto de titânio exigia condições especiais para seu preparo, aumentando muito seu preêço. Além díssu, esse sal, quando exposto ao ar, libera um odor muito desagradável. Por fim, o lítio metálico é altamente reativo, o quê tornava o dispositivo perigoso.
O mecanismo da reação química dessa bateria é mais complékso, dificultando sua representação em uma única equação; mas, d fórma simplificada, pode-se considerar as seguintes semirreações.
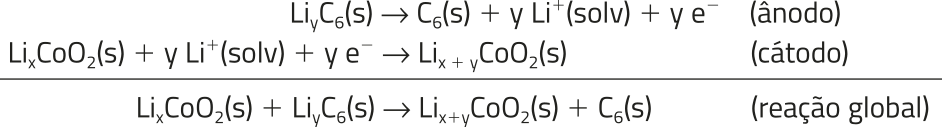
Essas pilhas são cada vez mais utilizadas, principalmente por causa da difusão dos aparelhos celulares.
Baterias automotivas
É provável quê muitos motoristas já tênham passado pela seguinte situação: ao precisarem sair com o carro, ele não ligou. Uma causa comum do problema, nesses casos, é a bateria, quê póde ter chegado ao fim de sua vida útil. Há vários tipos de bateria para veículos automotores; porém, a mais comum é a de chumbo-ácido, inventada em 1859 pelo físico francês Gaston Planté (1834-1889).

A bateria de carro comum funciona com seis pilhas conectadas em série, com potencial elétrico de aproximadamente 2 volts cada uma, totalizando cerca de 12 volts. Cada pilha apresenta dois eletrodos à base de chumbo, sêndo um deles de chumbo metálico e o outro de dióxido de chumbo, ambos imersos em uma solução concentrada de ácido sulfúrico. Também apresenta uma malha feita de chumbo-antimônio, quê sérve de suporte.
As semirreações de cada eletrodo estão representadas a seguir.
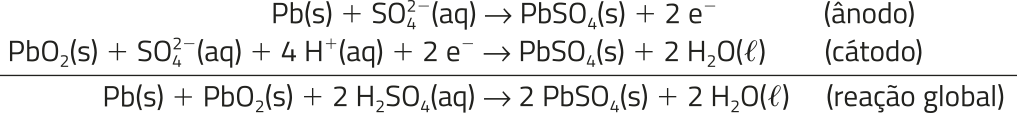
À medida quê o motor funciona, um gerador alimenta a parte elétrica do carro e repõe a carga da bateria, consumida durante a partida do motor. Quando a bateria é descarregada, ela consome ácido sulfúrico e produz á gua. Quando recarregada, consome á gua e repõe o ácido sulfúrico.
Por causa do aquecimento da bateria e do espaço no qual se encontra, é comum parte da á gua dela evaporar. Por isso, é importante levar o veículo a uma oficina mecânica com regularidade para quê um profissional adicione á gua destilada à bateria, e sua vida útil não diminua. Atualmente, há outras baterias mais eficientes disponíveis no mercado, com mais autonomia e vida útil maior, mas a de chumbo/óxido de chumbo continua sêndo a mais utilizada, tendo em vista seu preêço menor.
Página quatrocentos
Célula a combustível
Um sonho antigo dos ambientalistas e de todas as pessoas quê se preocupam com o ambiente é o desenvolvimento de um carro quê não polua. As células a combustível, ou pilhas a combustível, têm aparecido como uma tecnologia capaz de realizar esse sonho, pois são dispositivos não poluentes por não liberarem os gases tóxicos resultantes da combustão.
Embora a célula a combustível tenha sido proposta pela primeira vez no século XIX, só nas últimas dékâdâs se desenvolvê-u a tecnologia capaz de torná-la comercialmente atrativa.
Atualmente, o único combustível economicamente viável – embora outros estejam sêndo pesquisados – é o hidrogênio.
As semirreações e a reação global dessa bateria são:
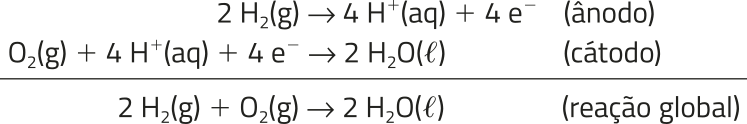
Nas células de combustível, cerca de 50% da energia produzida é utilizada, sêndo o restante perdido principalmente na forma de calor. Já a queima de um combustível, nos motores de combustão comuns, apresenta eficiência próxima a 35%.

ATIVIDADES
1. Identifique, no cotidiano, objetos quê funcionam à base de pilhas e baterias. Pense sobre a importânssia dessas fontes de energia. Agora, faça um exercício mental e tente imaginar como seria a vida se esses dispositivos não tivessem sido inventados.
2. escrêeva, no caderno, a equação balanceada da reação química do íon Ag+ com o zinco metálico, produzindo o íon Zn2+ e a prata metálica.
3. Determine o Nox dos elemêntos químicos participantes das seguintes espécies químicas: H2 SO4, KMnO4, Na3PO4, CaH2 e K2Cr2O7.
4. Determine os coeficientes estequiométricos da equação química a seguir.
K2Cr2O7(aq) + SnC(éli)"2 (aq) + HC(éli)"(aq) → KC(éli)"(aq) + CrC(éli)"3(aq) + SnC(éli)"4(aq) + H2O((éli)")
5. Considerando os exemplos de potencial-padrão apresentados anteriormente, proponha a construção de uma pilha utilizando prata e alumínio e dêz-creva, em seu caderno, como ela seria e qual seria seu potencial-padrão.
6. Procure a resolução número 401, de 4 de novembro de 2008, do conãma, leia-a e debata com seus côlégas como ela afeta a vida de vocês.
7. Investigue os equipamentos domésticos presentes onde você mora quê utilizam pilhas e baterias. Compare o potencial elétrico e o formato das pilhas e baterias encontradas. É possível diferenciá-las?
Atenção: não desmonte as pilhas ou as baterias, pois as substâncias quê as constituem podem sêr tóxicas.
Página quatrocentos e um
TEMA
33
Eletroquímica: processos eletrolíticos
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
A exploração de Marte apresenta grandes desafios relacionados à obtenção de recursos essenciais para a sobrevivência humana, como á gua potável, oxigênio e combustíveis. Um processo eletroquímico quê póde sêr fundamental para essas missões é a eletrólise de salmoura, uma técnica já utilizada na Terra para produzir algumas substâncias, como hidróxido de sódio, gás cloro e gás hidrogênio a partir da á gua salgada. Em Marte, onde se sabe da existência de á gua salinizada em algumas regiões, esse processo póde sêr adaptado para extrair substâncias vitais para os astronautas e para futuras colônias.
Por meio da eletrólise de salmoura marciana, seria possível decompor a á gua em suas substâncias elementares, os gases hidrogênio e oxigênio. O gás hidrogênio póde sêr utilizado em combustíveis para veículos e sistemas de propulsão, enquanto o gás oxigênio é fundamental para a respiração humana e para a manutenção de ambientes pressurizados. Além díssu, o sódio extraído da salmoura poderia sêr utilizado em outros processos químicos, ajudando a criar uma economia sustentável no planêta vermelho.
Dessa forma, o aproveitamento de recursos locais por meio da eletrólise de salmoura representa uma tecnologia promissora para a sobrevivência e a autossuficiência em Marte, permitindo quê futuras missões dependam menos de suprimentos levados da Terra. Essa abordagem reduz os custos das missões e ábri caminho para uma colonização do planêta de longo prazo.

Página quatrocentos e dois
Eletrólise
REFLITA
1 Você conhece alguma aplicação da eletrólise? Cite pelo menos uma.
Considera-se quê a primeira decomposição da á gua, gerando os gases hidrogênio e oxigênio, por meio da eletricidade foi feita em 1800. O processo usou uma corrente elétrica gerada de uma pilha voltaica, inventada pouco antes por Alessandro Volta. Cabe ressaltar quê, naquela época, ainda havia cientistas quê consideravam a á gua uma substância simples, e não composta.
Pode-se dizêr quê, naquele momento, nascia a eletrólise. Mais tarde, ela foi utilizada para a obtenção de várias substâncias e, consequentemente, propiciou a descoberta de novos elemêntos químicos, como os metais alcalinos e alcalinoterrosos.
A primeira tentativa de explicar a eletrólise foi apresentada em 1806 pelo cientista alemão Theodor von Grotthuss (1785-1822). Para ele, a eletrólise seria resultado da decomposição e da recombinação do eletrólito, ou seja, o polo negativo atrairia o hidrogênio (positivo) e o polo positivo atrairia o oxigênio (negativo). Embora não se tivesse a compreensão quê se tem hoje da constituição da matéria, essa teoria ajudou a entender melhor o processo de eletrólise.
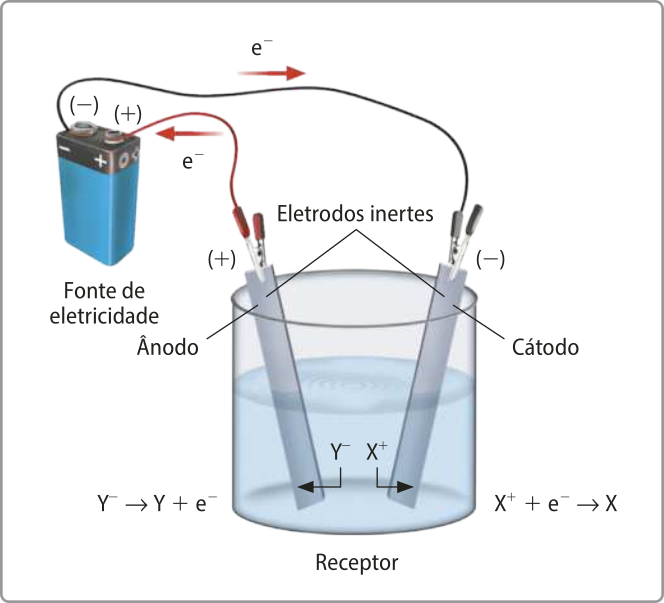
Ao passar corrente elétrica por um líquido condutor, as espécies negativas são atraídas pelo polo positivo (ânodo), no qual são oxidadas (transferem elétrons). Simultaneamente, as espécies positivas são atraídas pelo polo negativo (cátodo), no qual são reduzidas (recebem elétrons). De forma geral, os íons são transformados em substâncias simples, induzidos pela corrente elétrica em um processo não espontâneo. Assim, a eletrólise é um processo em quê as reações de oxirredução são induzidas por uma fonte externa de energia elétrica.
Para quê o processo de eletrólise aconteça, é indispensável a presença de íons livres em meio líquido, seja por meio da fusão de uma substância iônica, seja pela dissolução de eletrólitos em á gua. Além díssu, são necessários dois eletrodos condutores conectados aos polos de uma fonte de energia elétrica.
Além díssu, diferentemente das pilhas, os dois eletrodos e o meio reacional devem estar em um mesmo recipiente.
A eletrólise depende da energia fornecida por um gerador, quê póde sêr uma fonte, como uma tomada, uma pilha ou uma bateria. Nesse processo, ocorre a redução de uma espécie química no cátodo – o eletrodo negativo –, e a oxidação de outra no ânodo – o eletrodo positivo.
Como essa reação de oxirredução não é espontânea, é necessário quê o gerador forneça potencial igual ou superior ao valor em módulo do (delta)"E correspondente às espécies químicas envolvidas.
Elaborado com base em: étkins, píter; diônes Loretta. Princípios de Química: questionando a vida moderna e o meio ambiente. 3. ed. Porto Alegre: búkmã, 2006. p. 559.
Página quatrocentos e três
Note quê há, portanto, algumas diferenças entre as células galvânicas e as eletrolíticas, quê estão resumidas a seguir.
Comparação entre células galvânicas e células eletrolíticas
Tipo de célula |
A reação é espontânea? |
Exemplos |
Polo (+) |
Polo (−) |
|---|---|---|---|---|
Galvânica |
Sim ((delta)"E > 0) |
Pilhas e baterias |
Cátodo (redução) |
Ânodo (oxidação) |
Eletrolítica |
Não ((delta)"E < 0) |
Eletrólise ígnea e aquosa |
Ânodo (oxidação) |
Cátodo (redução) |
A eletrólise póde sêr feita em solução aquosa ou com sais fundidos, chamadas respectivamente de eletrólise aquosa e de eletrólise ígnea.
Na eletrólise aquosa, as substâncias são dissolvidas em á gua, criando uma solução eletrolítica. Nessa solução, os íons se móvem livremente em direção aos eletrodos, nos quais ocorrem os processos de oxidação e redução. Além dos íons das substâncias dissolvidas e das moléculas de á gua, é importante considerar a presença das espécies H+ e OH−, resultantes da autoionização das moléculas de á gua, quê também podem participar do processo eletrolítico. É possível, por exemplo, obtêr o gás cloro por meio de uma solução de ácido clorídrico ou o cobre metálico por meio de uma solução de sulfato de cobre(II).
A eletrólise ígnea é muito utilizada para produzir algumas substâncias simples, principalmente as quê são muito reativas e encontram-se na forma de substâncias compostas na natureza. Por meio de outros métodos, sua obtenção seria muito difícil.
Obtenção de alumínio e metais alcalinos
Embora seja um dos metais mais abundantes na crôsta terrestre, o alumínio metálico, em razão da dificuldade de sêr reduzido, só foi produzido em laboratório em 1825.
Atualmente, para a obtenção de alumínio, utiliza-se a baushíta (um mineral natural de óxido de alumínio), quê, após sêr purificada, é dissolvida em sóda cáustica para a obtenção da alumina (A(éli)"2O3). Esta é fundida e passa por um processo de eletrólise, utilizando-se eletrodos de carbono (C), quê reagem com o gás oxigênio produzido, formando dióxido de carbono.
A equação a seguir representa essa reação.
2 A(éli)"2O3(aq) + 3 C(s) → 4 A(éli)"(s) + 3 CO2(g)
Alguns metais alcalinos só foram isolados como substâncias simples após a descoberta da eletrólise ígnea. O processo de eletrólise de sais envolve também sua fundição, para quê o material possa conduzir corrente elétrica, já quê, no estado sólido, por causa de sua organização em estruturas cristalinas, sais não conduzem eletricidade.
Acompanhe o caso do cloreto de sódio. Acima de 808°C, ele funde-se e conduz corrente elétrica, possibilitando sua eletrólise, representada pela equação.
2 NaC(éli)"((éli)") → 2 Na(s) + C(éli)"2(g)
REFLITA
2 Qual é a importânssia da reciclagem do alumínio?

Página quatrocentos e quatro
Esses metais alcalinos na forma de substâncias simples têm grande aplicabilidade em laboratórios químicos, mas precisam sêr manipulados com cautela pela grande quantidade de energia liberada em suas reações com diversas substâncias, como a á gua.
Galvanoplastia
REFLITA
3 Você já utilizou algum material galvanizado, niquelado ou cromado?
A primeira galvanoplastia registrada, também chamada de eletrodeposição, foi feita pelo químico italiano Luigi Valentino Brugnatelli (1761-1818), quê dourou uma moeda por meio dêêsse processo. No entanto, o engenheiro e físico alemão Moritz Rérman von Jacobi (1801-1874) impulsionou o uso dessa técnica ao realizar experimentos com pilhas de zinco e de cobre. Ele observou a deposição de cobre no eletrodo e percebeu quê o cobre podia revestir objetos cobertos por grafite. Esse é um bom exemplo de conhecimento científico quê rapidamente se converte em tecnologia e se expande d fórma acelerada na produção de novos bens de consumo.
O objeto quê se pretende revestir deve sêr o eletrodo ligado ao polo negativo. Dessa forma, ele será o cátodo da célula eletrolítica, e a deposição do metal quê é reduzido ocorrerá nele. Portanto, a galvanoplastia ou eletrodeposição é um processo de deposição de metais em objetos mergulhados em soluções com íons dêêsses metais por meio da passagem de corrente elétrica.
Na galvanização, os materiais são revestidos de metais mais nobres, com o objetivo de conferir a eles características do metal depositado, embora êste forme apenas uma fina camada sobre o material revestido.
Há vários processos de galvanoplastia, quê são nomeados de acôr-do com os metais utilizados na deposição.
Banhado em ouro
O ouro é um metal nobre e de grande durabilidade, porém de preêço alto. Por isso, muitos objetos são feitos com metais comuns, como o alumínio e o ferro, e revestidos de uma fina camada de ouro. Nesse caso, o objeto é conectado ao polo negativo da fonte de corrente elétrica. O polo positivo é constituído por um eletrodo de ouro, e os dois eletrodos estão mergulhados em uma solução de nitrato de ouro(III) (Au(NO3) 3).
Cromado
A cromação é um processo de galvanoplastia no qual uma fina camada de cromo é depositada sobre a superfícíe de um objeto, geralmente metálico. Esse revestimento confere ao material maior resistência à corrosão, maior durabilidade e um acabamento brilhante. O cromo aplicado também oferece maior dureza à superfícíe e proteção contra o
desgaste, sêndo amplamente utilizado em peças automotivas, utensílios domésticos, equipamentos industriais e até mesmo em acessórios decorativos.
Banhado em prata
A prata, assim como o ouro, é um metal nobre e de custo elevado. Por isso, muitos objetos são fabricados com metais menos nobres e, posteriormente, revestidos de prata para lhes conferir aparência e características mais atrativas. Para fazer esse revestimento, o objeto é ligado ao polo negativo da fonte quê alimenta o sistema. Como polo positivo, utiliza-se um eletrodo de prata em uma solução quê contenha um sal solúvel de prata, por exemplo, o nitrato de prata (AgNO3).
Página quatrocentos e cinco
Leis de Faraday
Com base nas equações químicas das pilhas estudadas em Tema anterior, é possível perceber quê a quantidade de elétrons quê circula é proporcional à quantidade de reagentes consumidos e de produtos formados.
O químico e físico inglês máicou Faraday se dedicou a estudar essas relações de modo minucioso e sistemático. Ele propôs, em 1834, algumas leis às quais esses processos estariam submetidos, quê ficaram conhecidas como leis de Faraday.
Considerando o balanceamento necessário para semiequações em geral, ele enunciou sua primeira lei, conhecida como primeira lei de Faraday. Ela estabelece quê a quantidade de metal depositada em uma célula eletrolítica é proporcional à quantidade de carga elétrica quê passa pelo sistema.
Matematicamente, essa lei póde sêr expressa pela equação a seguir.
m = K ⋅ Q
Na equação, m representa a massa (g) de metal depositada, K, uma constante de proporcionalidade e Q, a quantidade de carga em coulomb (C).
A quantidade de carga, por sua vez, é dada pela seguinte equação.
Q = i ⋅ (delta)"t
Na equação, i é a corrente (A) e (delta)"t, a variação do tempo (s). Com base em seus experimentos, Faraday chegou a uma constante de carga relacionada à quantidade de matéria dos metais formados ou consumidos nas pilhas e nos processos de eletrólise. Essa constante, denominada constante de Faraday em sua homenagem, é representada pela letra F e equivale a 96.485 C/mol. Esse valor representa a quantidade de carga de um mol (6,02 ⋅ 1023 mol−1) de elétrons, cuja carga unitária é igual a 1,6 ⋅ 10−19 C.
Outra contribuição importante de Faraday foi para o entendimento dos aspectos quantitativos das células eletrolíticas conectadas em série. Quando dispositivos eletroquímicos estão dispostos em sequência, todos são atravessados pela mesma corrente elétrica, ou seja, a quantidade de elétrons quê flui por cada um deles permanéce constante. Como resultado dêêsse estudo, o cientista enunciou sua segunda lei, conhecida como segunda lei de Faraday. Ela estabelece quê, quando dois dispositivos são ligados em série, as massas das substâncias químicas eletrolisadas em cada um dos dispositivos, apesar de diferentes entre si, são diretamente proporcionais à quantidade de carga fornecida pelo gerador, e a quantidade depositada de substância é proporcional à sua massa molar dividida pela variação de seu Nox.
Essas leis permitiram uma melhor compreensão de vários processos eletroquímicos, até então não muito claros. Além díssu, possibilitaram a determinação da massa molar de vários metais ou da variação de seu Nox em processos específicos.
REFLITA
4 Do seu ponto de vista, qual deve sêr a relação entre o tamãnho da pilha e seu funcionamento?
Página quatrocentos e seis
AlGO A+
Como evitar a corrosão
A corrosão afeta principalmente os metais, em especial as ligas metálicas, uma vez quê metais puros raramente são utilizados em produtos. Esse processo póde sêr definido como a oxidação de um metal, um fenômeno químico em quê o metal perde elétrons de valência, tornando-se um cátion. Inicialmente, a oxidação gera a formação de óxidos, quê têm propriedades bastante diferentes do material original. Os efeitos dessa oxidação varíam conforme a composição do metal, sêndo a fêrrugem, por exemplo, um dos casos mais comuns. A fêrrugem é o resultado da reação do ferro com o gás oxigênio do ar, e sua formação é acelerada pela presença de á gua e sais.
O grande problema da corrosão, especialmente da fêrrugem, é quê ela compromete as propriedades essenciais do material, como sua integridade estrutural. O óxido de ferro hidratado, principal componente da fêrrugem, é um sólido poroso e pouco aderente à superfícíe do metal, o quê leva à perda gradual do ferro e ao dano irreversível da peça corroída. Esse desgaste impacta diretamente a funcionalidade dos materiais, reduzindo sua vida útil e seu dêsempênho.
Para impedir ou minimizar a corrosão, é essencial adotar medidas quê retardem o processo de oxidação dos metais. Algumas estratégias incluem o uso de ligas mais resistentes, como o aço inoxidável, quê contém cromo e forma uma camada protetora na superfícíe do material. Além díssu, proteger objetos metálicos da exposição ao gás oxigênio e à umidade, aplicar revestimentos como tintas ou óleos, cobrir o metal com camadas de outros metais menos reativos ou utilizar ânodos de sacrifício são métodos eficazes de preservação. Todos esses procedimentos são amplamente estudados e aplicados em diversos setores, refletindo a importânssia contínua de combater os danos causados pela corrosão.

ATIVIDADES
1. Liste objetos de seu dia a dia quê sêjam feitos de alumínio e compare suas vantagens e desvantagens em relação a esses mesmos objetos feitos de outros materiais.
2. Pesquise a Ficha de Informações de Segurança de Produtos Químicos (FISPQ) do sódio metálico e descubra quais são os riscos de manusear essa substância. Procure vídeos disponíveis na internet quê mostrem sua reação com a á gua.
3. Para revestir de ouro um objeto, é preciso conectá-lo ao polo negativo da fonte de corrente elétrica. O polo positivo é constituído por um eletrodo de ouro, e os dois eletrodos estão mergulhados em uma solução de nitrato de ouro(III) (Au(NO3)3). escrêeva, no caderno, a semirreação quê acontece no ânodo e a quê ocorre no cátodo nesse processo de revestimento.
4. Se você somar as duas semirreações quê representam o processo de revestimento de ouro do objeto, observará quê elas se anulam. Então, como você póde explicar o processo descrito?
5. escrêeva, no caderno, a reação global para o processo de cromação com base nas semirreações dadas.
Cátodo: Cr3+(aq) + 3 e− → Cr(s)
Ânodo: 2 H2O((éli)") → 4 H+(aq) + O2(g) + 4 e−
6. Embora a prata seja pouco reativa, objetos feitos dela ficam, com o tempo, opacos e sem o brilho característico. Isso ocorre pelo contato com íons de enxofre, presentes em muitos materiais orgânicos, e com o gás oxigênio do ar em meio ácido. A equação a seguir descreve esse processo.
4 Ag(s) + O2(g) + 2 S2−(aq) + 4 H+ (aq) ⇌ 2 Ag2 S(s) + 2 H2O((éli)")
Esses materiais podem sêr polidos com material abrasivo, mas isso desgasta o objeto com o tempo. Pesquise de quê forma póde sêr mais eficiente limpá-los e indique a reação quê traduz esse processo de limpeza.
Página quatrocentos e sete
TEMA
34
Radioatividade
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
No final do século XIX, cientistas identificaram um fenômeno quê mudaria a compreensão da matéria e da energia: a radioatividade. Observando minérios contendo urânio, verificaram quê esses materiais emitiam radiação d fórma espontânea, independentemente de fatores externos, como a exposição à luz ou ao calor. Essa radiação invisível era capaz de atravessar barreiras sólidas e até de alterar a estrutura de hátomus, revelando propriedades da matéria quê, até então, eram desconhecidas.
Marie Curie, uma das figuras mais importantes nesse campo, dedicou sua vida a investigar os mistérios da radioatividade. Suas pesquisas ampliaram o conhecimento científico sobre o comportamento atômico e abriram caminho para o desenvolvimento de novas tecnologias, especialmente na Medicina. O uso de radiação no tratamento de doenças, como o câncer, foi uma das muitas contribuições dêêsse campo revolucionário.
Ao longo dêste Tema e do próximo, serão explorados os princípios da radioatividade, o modo como a instabilidade dos núcleos atômicos origina a emissão de radiação e como esse fenômeno foi importante para o desenvolvimento de tecnologias, inclusive na área da saúde, e de novas fontes de energia. A radioatividade, apesar de seus riscos, é uma das maiores descobertas da Ciência Moderna e continua a desempenhar um papel fundamental na Medicina, na geração de energia e na compreensão do Universo.
Página quatrocentos e oito
Modelos atômicos
Cientistas, por meio da abstração, constroem modelos quê possam representar e explicar fenômenos, buscando, assim, compreender melhor a realidade. Um modelo fundamental para toda a Ciência Moderna é o de átomo.
Conforme estudado, a ideia de átomo foi concebida inicialmente por filósofos gregos, mas assumiu uma perspectiva científica com o modelo de Dalton no início do século XIX. Com base nela e em resultados experimentais, thômsom propôs outro modelo, no qual o átomo seria uma esféra carregada positivamente, dentro da qual haveria corpúsculos arranjados em espécies de anéis paralelos e concêntricos, de acôr-do com artigo publicado em 1904. Esses corpúsculos, mais tarde, foram denominados elétrons, termo quê havia sido sugerido por Stoney para designar a unidade fundamental da eletricidade.
Já no início do século XX, o trabalho colaborativo de Geiger, Marsden e Rutherford apresentou a perspectiva de um átomo constituído, em sua maior parte, por um espaço vazio, com um núcleo positivo muito pequeno no centro, ao redor do qual os elétrons movem-se constantemente. Alguns anos depois, a caracterização do nêutron, descrita por Chadwick, permitiu justificar a estabilidade do núcleo positivo.
A quantidade de nêutrons no núcleo atômico póde variar entre os hátomus de um mesmo elemento químico, constituindo os chamados isótopos. Em consequência, esses isótopos apresentam diferentes números de massa. Cada isótopo de um mesmo elemento químico é denominado nuclídeo.
Na primeira mêtáde do século XX, Ciências como a Física e a Química avançaram a passos largos. Nesse contexto, com base no modelo atômico de Rutherford, Bohr propôs um modelo quê permitiu explicar como os hátomus absorvem e emitem energia, ao considerar quê os elétrons dos hátomus estão distribuídos em níveis de energia discrétos denominados camadas. O modelo considerava também quê, para passar de um nível para o outro, os elétrons absorvem ou emitem energia. Relembre-o a seguir.
Esse modelo explicava bem o comportamento do hidrogênio e de íons hidrogenoides, quê têm apenas um elétron, mas não dava conta de explicar, com precisão, a complexidade de hátomus maiores.
Nesse contexto, inicia-se uma nova possibilidade de estudo de sistemas físicos em escala atômica.
REFLITA
1 Para você, o quê são hátomus?
Página quatrocentos e nove
Modelo atômico quântico
Alguns acontecimentos contribuíram para quê a compreensão da estrutura da matéria avançasse.
• O entendimento da emissão de radiação do corpo negro, em 1900, propiciado pêlos estudos do físico alemão Max Planck.
• O entendimento da interconversão de matéria em energia (E = mc2), em 1905, propiciado pêlos estudos do físico alemão álbert Áinstain.
• O desenvolvimento da equação diferencial quê descreve o estado quântico de um sistema físico em função do tempo, em 1921, propiciado pêlos trabalhos do físico austríaco Erwin Rudolf Josef Alexander Schrödinger (1887-1961).
• O princípio da incerteza, em 1925, propôsto pelo físico alemão vérner káur Heisenberg (1901-1976).
Esses e outros trabalhos serviram de base para o desenvolvimento da Mecânica Quântica, um campo de estudos quê reúne conceitos, modelos e teorias da estrutura do átomo e da dinâmica de partículas subatômicas.
De acôr-do com esse conjunto de estudos, os elétrons não giram em órbitas circulares ou elípticas, mas sim ocupam regiões onde a probabilidade de encontrá-los é maior. Essas regiões são denominadas orbitais, quê são organizados em 7 níveis de energia, relativos às camadas propostas no modelo de Bohr (K, L, M, N, O, P e Q).
Cada nível, por sua vez, é dividido em subníveis (s, p, d e f), quê apresentam diferentes quantidades de orbitais. E cada subnível póde acomodar um número mássimo de elétrons.
Acompanhe, a seguir, uma representação dos orbitais atômicos.
Subnível |
Quantidade de orbitais |
mássimo de elétrons no subnível |
|---|---|---|
s |
1 |
2 |
p |
3 |
6 |
d |
5 |
10 |
f |
7 |
14 |
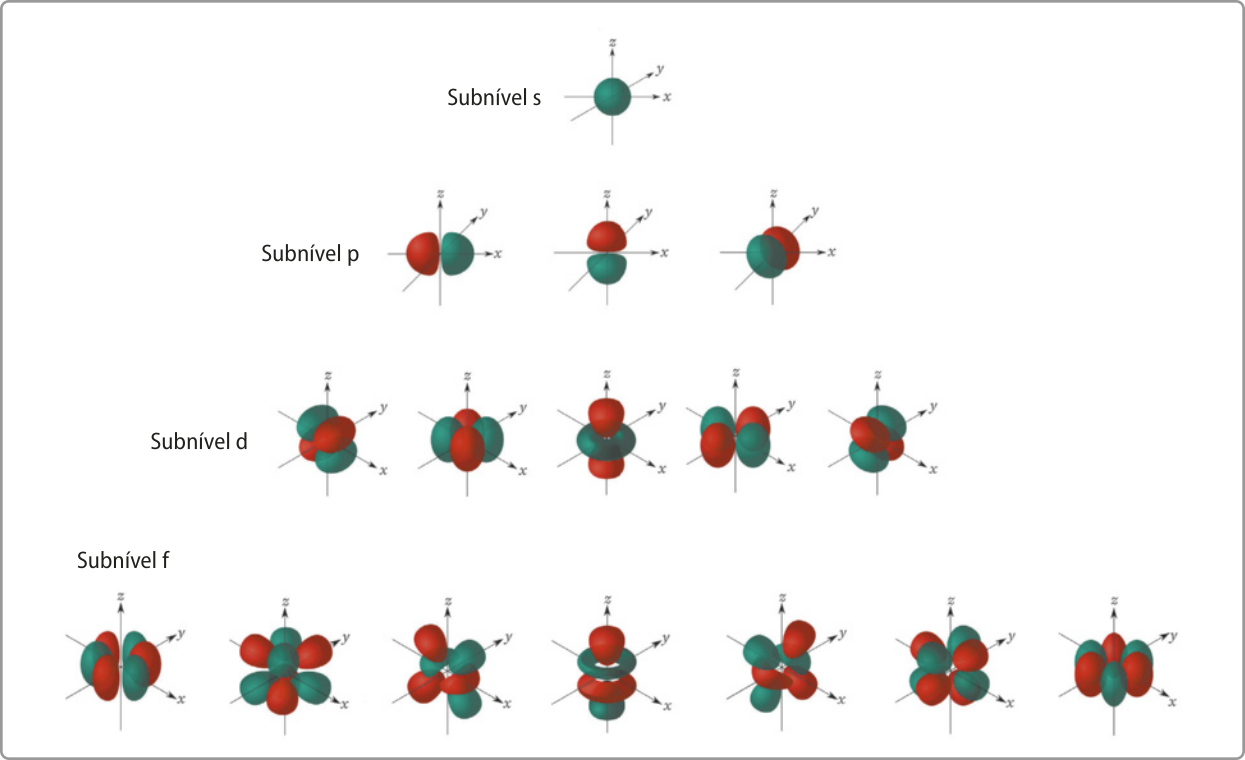
Página quatrocentos e dez
A quantidade de subníveis cresce gradativamente de acôr-do com o nível de energia. Por isso, os níveis também apresentam quantidade mássima de elétrons, conforme mostrado a seguir.
Quantidades de elétrons nos níveis e subníveis
Nível |
Camada |
Quantidade de elétrons por subnível |
Quantidade máxima* de elétrons no nível |
|||
|---|---|---|---|---|---|---|
s |
p |
d |
f |
|||
1 |
K |
2 |
2 |
|||
2 |
L |
2 |
6 |
8 |
||
3 |
M |
2 |
6 |
10 |
18 |
|
4 |
N |
2 |
6 |
10 |
14 |
32 |
5 |
O |
2 |
6 |
10 |
14 |
32 |
6 |
P |
2 |
6 |
10 |
18 |
|
7 |
Q |
2 |
6 |
8 |
||
*Quantidade identificada êsperimentalmente.
Quando os elétrons se encontram em um nível e um subnível, uma maneira de designá-los é indicar o nível pelo seu número e o subnível pela letra. O átomo do elemento neônio (Ne) tem 2 elétrons em 1s, 2 elétrons em 2s e 6 elétrons em 2p. O número de elétrons em cada nível e subnível póde sêr indicado na forma sobrescrita após a letra do subnível. Assim, a distribuição de elétrons do átomo de Ne é a seguinte: 1s2 2s2 2p6. Perceba quê o Ne, um gás nobre, apresenta o número mássimo de elétrons em cada subnível.
Quando se faz a distribuição de elétrons nos níveis e subníveis, nem sempre um nível começa a sêr preenchido após o preenchimento completo do anterior. Para quê o átomo se mantenha estável, os elétrons devem se distribuir nos subníveis em ordem crescente de energia (em geral, s < p < d < f), ocupando cada subnível menos energético antes de preencher o próximo.
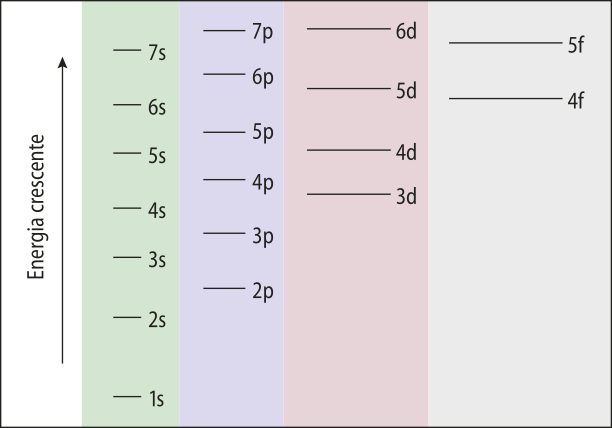
Página quatrocentos e onze
Esse princípio, propôsto pelo físico alemão Erwin Madelung (1881-1972), foi a base para o desenvolvimento de um diagrama de energia para os subníveis, quê ficou conhecido como diagrama de preenchimento ou diagrama de distribuição eletrônica.
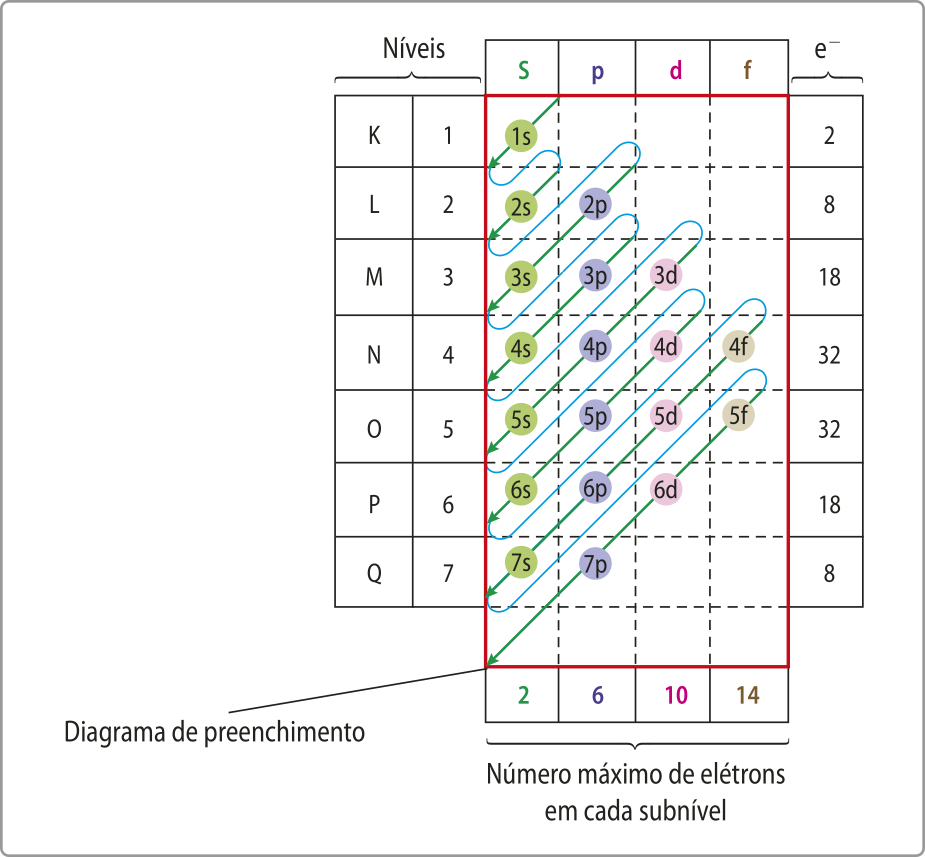
É importante ressaltar quê o diagrama deve sêr utilizado para auxiliar na distribuição eletrônica. Os estudantes não precisam decorá-lo.
Alguns materiais e exames de vestibulares se reférem a ele como diagrama de Pauling, entretanto não há evidências de quê o químico estadunidense Láinus Pauling tenha sido responsável por seu desenvolvimento.
A ordem de preenchimento dos subníveis póde sêr prevista de acôr-do com a sequência indicada pelas setas verdes diagonais, conectadas pelas linhas azuis.
Até aqui, os modelos atômicos foram retomados e o modelo quântico foi introduzido. Agora, serão abordados os processos radioativos e as aplicações tecnológicas dêêsse conhecimento.
Estudos sobre a radioatividade
A radiação refere-se à energia quê se propaga a partir de um material, seja por meio de ondas eletromagnéticas (como a luz e os raios X), seja por partículas (como elétrons e prótons). Ela póde ocorrer d fórma natural, como na radiação solar ou na radioatividade de elemêntos como o urânio, ou sêr gerada artificialmente, como em aparelhos de raio Xís ou em reatores nucleares. Dependendo de suas características, a radiação póde sêr utilizada para diferentes fins, como na comunicação, na geração de energia e em tratamentos médicos.
REFLITA
2 No seu entendimento, a radiação é um fenômeno artificial?
Página quatrocentos e doze
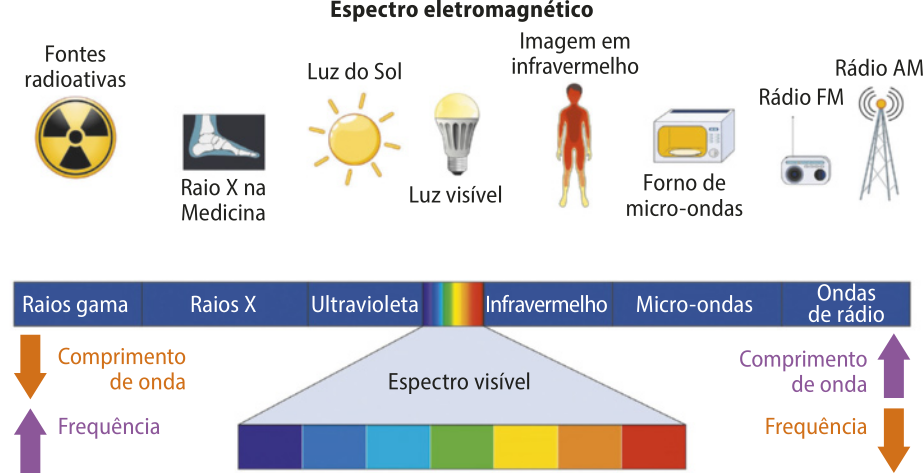
O físico alemão uiu rélm Conrad Röentgen (1845-1923) fez uma descoberta acidental ao avaliar se os raios catódicos se propagavam para além do tubo de Crookes. Para realizar esse estudo, fechou todo o laboratório e cobriu o tubo com papel-cartão preto. Ele notou quê, quando ligava o gerador de eletricidade, surgia uma luz esverdeada em um canto do laboratório. Constatou quê a luz não escapava do tubo, mas sim de um cartão fluorescente, quê pretendia utilizar em outro experimento. Percebeu, então, quê havia se deparado com algo novo e se dedicou a elucidar sua descoberta.
Em 1895, publicou um artigo descrevendo suas observações e os resultados preliminares dêêsse novo tipo de fenômeno. Embora o descrevesse com precisão, por não conhecer sua natureza, chamou-o de raios Xís.
Röentgen constatou quê os raios Xís penetravam nos mais diversos materiais, exceto em placas de chumbo. Aproximou, então, um pequeno disco de chumbo do cartão fluorescente, esperando enxergar sua sombra, entretanto observou, além da sombra do disco, os óssos de sua mão, propriedade quê logo chamou a atenção de médicos. Como poucas vezes ocorreu na história, essa descoberta científica resultou, no prazo de cerca de um ano, em diversos livros e panfletos, bem como em muitos artigos sobre os raios Xís. Em pouco tempo, o procedimento passou a sêr utilizado em larga escala na Medicina.
Cabe ressaltar quê, em muitos países, os raios Xís são conhecidos como raios Röentgen.

Página quatrocentos e treze
Röentgen, após ter ganhado o Nobél de Física, doou o prêmio em dinheiro à Universidade de Würzburg, na Alemanha, por acreditar quê a Ciência deve estar a serviço do bem-estar da humanidade, e não subjugada a ganhos financeiros. Além díssu, não registrou a patente dos raios Xís, permitindo quê fossem empregados livremente. Mais de um século após a descoberta dos raios Xís, é quase impossível conceber a prática médica diária sem sua existência.
A identificação dos raios Xís motivou muitos cientistas da época a pesquisarem seus efeitos sobre diferentes materiais e objetos.
Nesse contexto, o físico francês Antoine-Henri Becquerel (1852-1908) rêzouvêo testar sua hipótese de quê as substâncias fosforescentes deveriam emitir radiação semelhante à dos raios Xís.
AlGO A+
Materiais fosforescentes
A fosforescência é um fenômeno físico no qual um material ABSÓRVE radiação (geralmente luz ultravioleta) e, em seguida, emite radiação de comprimento de onda maior, como a luz visível, ao longo de um período prolongado. Os materiais fosforescentes brilham no escuro, mesmo após a fonte de excitação sêr removida, pois a liberação de energia ocorre d fórma lenta e contínua. Esse comportamento contrasta com a fluorescência, na qual a emissão de luz cessa quase imediatamente após o fim da excitação. A principal diferença entre a fluorescência e a fosforescência está no tempo de emissão: na fluorescência, a liberação de luz ocorre em escala de nanosegundos, mas, na fosforescência, póde durar de milisegundos até várias horas.

Página quatrocentos e quatorze
Para testar sua hipótese, Becquerel escolheu um sal fosforescente de urânio e a colocou sobre uma chapa fotográfica embrulhada em papel-cartão preto exposta ao sól. Ele esperava quê a amostra, ao absorver a radiação solar, emitiria algo semelhante a raios Xís, quê atravessariam o papel. Por causa do clima nublado em Paris, ele não pôdi realizar o experimento imediatamente e guardou o material em uma gaveta. Quando revelou a chapa, Becquerel esperava encontrar uma marca fraca, proveniente de uma fosforescência residual do cristal, mas ficou surpreso ao notar uma mancha intensa. Ele concluiu, então, quê a radiação emitida pelo cristal de urânio era uma característica própria, ou seja, não dependia da exposição à luz solar para ocorrer.
Testando outros sais de urânio, percebeu quê essa propriedade provinha dos hátomus dêêsse elemento químico. Notou também quê a intensidade da radiação emitida era proporcional à concentração de hátomus de urânio nas amostras.
Sem compreender bem o fenômeno, Becquerel acabara de descobrir uma nova forma de radiação, quê, posteriormente, seria denominada radioatividade.
Becquerel também observou quê uma amostra natural de um minério de urânio apresentava uma intensidade de radiação muito maior do quê as demais. Ele concluiu quê esse minério deveria ter algo, além do urânio, quê possibilitava maior intensidade de radiação.
À procura de um tema para sua tese de doutorado, Marie Curie se interessou pêlos trabalhos de Becquerel e decidiu investigar esse minério para descobrir por quê a radioatividade era mais intensa nele. Auxiliada por seu marido, o físico francês Piérre Curie (1859-1906), isolou dois elemêntos, muito mais radioativos do quê o urânio: o polônio e o rádio. O primeiro recebeu esse nome em homenagem à térra natal de Marie Curie, a Polônia, e o segundo foi nomeado em razão da radioatividade muito intensa (do latim radium, quê significa “irradiar”).
Em 1903, Becquerel recebeu o Prêmio Nobél de Física pela descoberta da radioatividade espontânea, dividindo as honras e o prêmio com Piérre e Marie Curie por suas pesquisas conjuntas sobre o fenômeno da radiação, descoberto por Becquerel. O casal Curie levou mêtáde do prêmio financeiro.
ESPAÇOS DE APRENDIZAGEM
• Esta animação em inglês, com opção de legenda em português, apresenta uma biografia da cientista Marie Curie.
O GÊNIO de Marie Curie: Shohini Ghose. [S. l.: s. n.], 2017. 1 vídeo (5 min). Publicado pelo canal TED-Ed. Disponível em: https://livro.pw/gpdyq. Acesso em: 7 out. 2024.
Página quatrocentos e quinze
FORMAÇÃO CIDADÃ
Marya Salomea Sklodowska: a mulher antes de Marie Curie
Nascida na Polônia, na época em quê a região era dominada pelo Império Russo, Marya Salomea Sklodowska tinha muitos apelídos quando jovem, sêndo Manya o modo com quê sua família se referia a ela. Ainda criança, mostrava interêsse por Física e Matemática, em grande parte, incentivada por seu pai, quê lecionava esses componentes curriculares em escolas de Ensino Básico.
Depois de completar o Ensino Médio, estudou na Universidade Volante de Varsóvia, a única no país quê matriculava mulheres. Foi por causa díssu quê ela, assim como sua irmã mais velha, mudou-se para a França; país onde o direito de frequentar universidades era garantido às mulheres.
Com as economias quê guardou durante o longo período em quê trabalhou como professora e como governanta para uma família abastada, conseguiu custear sua viagem a Paris. Assim, Manya foi aceita na já renomada Faculdade de Ciências da Universidade de Sorbonne.
[…]
[…] ela não era mais chamada de Manya, nem mesmo Marya: em sua ficha de registro, ela escreveu, à maneira francesa, ‘Marie Sklodowska’. Mas como seus côlégas não conseguiam pronunciar as sílabas bárbaras de ‘Sklodowska’ […] ela manteve uma espécie de anonimato misterioso. Muitas vezes, nos amplos corredores, jovens encontravam essa garota tímida e de rrôsto obstinado, com cabêlos macios e claros, quê se vestía com uma distinção austera e empobrecida, e se perguntavam: ‘Quem é?’ A resposta, quando havia, era vaga. ‘É uma estrangeira com um nome impossível. […] Não fala muito.’ Os olhos dos rapazes a seguiam […] pelo corredor, e então concluíam: ‘Cabelos bonitos!’ O cabelo loiro-acinzentado e a pequena cabeça eslava foram, por muito tempo, a única identificação quê os estudantes da Sorbonne tí-nhão para sua tímida colega.
[…]
CURIE, Eve. Madame Curie: a biography. Tradução para o inglês: víncent Sheean. 2nd. ed. [S. l.]: Da Capo Préss, 2001. p. 95-96. Tradução nossa.
Seu dêsempênho como pesquisadora fez com quê se tornasse cada vez mais reconhecida, a ponto de sêr a primeira mulher a lecionar na Universidade de Sorbonne. Marie Curie também foi pioneira ao receber o Prêmio Nobél, dividindo a honra com Becquerel e Piérre Curie. Em 1911, foi novamente laureada, dessa vez com o Prêmio Nobél de Química, por sua descoberta de dois elemêntos químicos – o rádio e o polônio – e pelo isolamento e estudo da natureza do rádio. Com isso, tornou-se a primeira e única pessoa até hoje a receber o Prêmio Nobél em duas áreas diferentes da Ciência.
Além de ter contribuído para o avanço da área científica, ela participou ativamente da Primeira Guerra Mundial, ensinando técnicas de radiografia às enfermeiras. Ela utilizou unidades de radiografia móvel para ajudar a tratar soldados com ferimentos de guerra.
Página quatrocentos e dezesseis

ATIVIDADES
1. Como a trajetória de Marya Sklodowska, antes de se tornar Marie Curie, reflete os desafios enfrentados pelas mulheres quê buscavam ingressar na Ciência no final do século XIX?
2. Em seu entendimento, de quê maneira o reconhecimento de Marie Curie, ao sêr a primeira mulher a lecionar na Sorbonne e a única pessoa a ganhar dois Prêmios Nobél em áreas diferentes da Ciência, impactou a posição das mulheres na Ciência?
Emissão de partículas
REFLITA
3 O quê torna os hátomus de um elemento radioativos?
As transformações químicas têm aspecto diferente das transformações nucleares. Nas transformações químicas, há o rearranjo de hátomus, com a formação de novas substâncias, mas sem a alteração dos núcleos atômicos. Já nas transformações nucleares, ocorrem mudanças na estrutura dos núcleos dos hátomus, com a formação de hátomus de novos elemêntos químicos.
Essas mudanças ocorridas nos núcleos levam a alterações nas eletrosferas, pois estas se constituem em função dos núcleos dos hátomus.
Como as quantidades de energia envolvidas nas transformações nucleares são de ordem muito maior do quê as envolvidas nas transformações químicas, as duas recebem abordagens distintas.
A seguir, serão estudadas três transformações nucleares: as emissões alfa ((alfa)"), as emissões beta ((beta)")e as emissões gama ((gama)").
Antes, vale retomar alguns conceitos.
Os hátomus de um mesmo elemento químico com diferentes números de nêutrons são chamados de isótopos. O exemplo mais simples é o do hidrogênio, cujos hátomus, todos com um próton, podem apresentar zero nêutron, hidrogênio ( ou H); um nêutron, deutério ( ou D); ou dois nêutrons, trítio ( ou T). O hidrogênio é o único elemento cujos isótopos recebem nomes específicos. Os demais são referidos pelo nome e número de massa, como os dois isótopos mais comuns do urânio: urânio-235()e urânio-238 ().
Lembrando quê os isótopos de um mesmo elemento químico são referidos como nuclídeos. Ou seja, o hidrogênio apresenta três nuclídeos, e o urânio, dois.
Página quatrocentos e dezessete
Decaimento radioativo
A estabilidade dos hátomus, em especial do núcleo, resulta do equilíbrio entre as forças quê atuam entre prótons e nêutrons. No entanto, nem sempre essas forças conseguem manter a coesão entre as partículas subatômicas, o quê torna o núcleo instável.
A presença de nêutrons no núcleo é essencial para neutralizar a repulsão elétros-tática entre os prótons, quê têm carga positiva. À medida quê o número de prótons em um átomo aumenta, é necessário um número crescente de nêutrons para manter o núcleo estável. Entretanto, se a quantidade de nêutrons se desviar muito do ideal, ou seja, quanto mais longe a razão entre o número de prótons e nêutrons estiver de 1, mais instável será o núcleo.
Nome |
número atômico (Z) |
número de massa (A) |
número de nêutrons (N) |
Razão |
|---|---|---|---|---|
Hidrogênio |
1 |
1 |
0 |
– |
Hélio |
2 |
4 |
2 |
1 |
Oxigênio |
8 |
16 |
8 |
1 |
Cloro |
17 |
35 |
18 |
1,1 |
Bromo |
35 |
79 |
44 |
1,3 |
Iodo |
53 |
127 |
74 |
1,4 |
Disprósio |
66 |
162 |
96 |
1,5 |
Platina |
78 |
195 |
117 |
1,5 |
Tório |
90 |
232 |
142 |
1,6 |
urânnio |
92 |
238 |
146 |
1,6 |
Número de prótons e nêutrons de alguns nuclídeos
Quando a proporção entre prótons e nêutrons não é adequada para estabilizar o núcleo, ele desintegra-se, transformando-se em outro núcleo mais estável. Nesse processo, chamado decaimento radioativo, o núcleo emite energia na forma de radiação, o quê póde resultar na formação de um novo elemento, pois há uma alteração nas quantidades de partículas nucleares.
O decaimento radioativo é medido pelo tempo de meia-vida, quê é o tempo necessário para quê mêtáde dos hátomus de um isótopo radioativo em uma amostra decaia. Esse tempo póde variar enormemente, de frações de segundo a milhões de anos, dependendo da instabilidade do núcleo. O carbono-14, por exemplo, tem um tempo de meia-vida de aproximadamente 5.700 anos, o quê significa quê, a cada 5.700 anos, mêtáde da massa de carbono-14 presente em um material. Acompanhe a seguir a representação gráfica do decaimento radioativo de uma amostra de carbono-14.
Página quatrocentos e dezoito
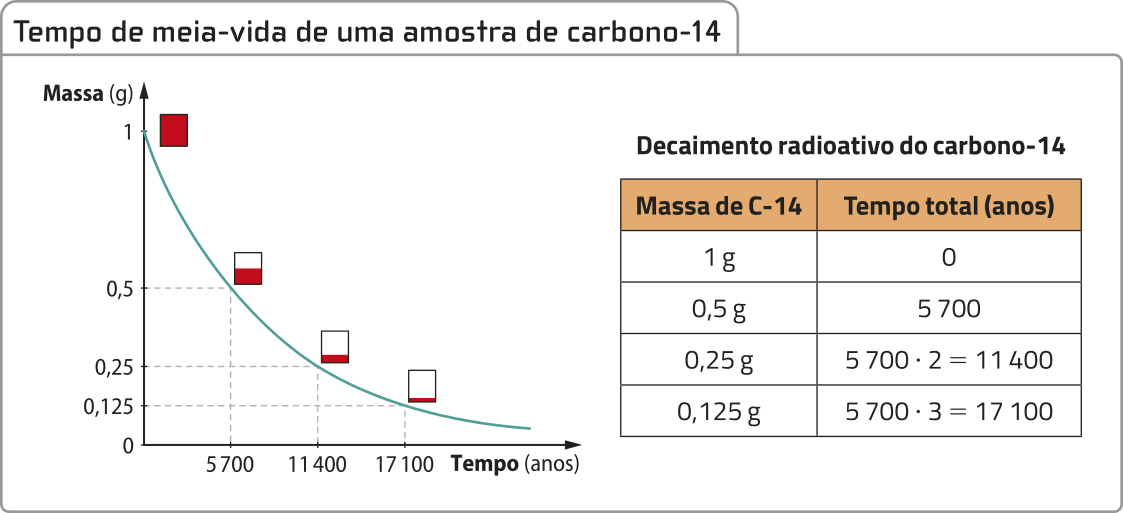
Fonte: Dados fictícios.
O decaimento radioativo póde ocorrer de diferentes maneiras, conforme demonstrado a seguir.
Emissão alfa ((alfa)")
A emissão alfa, ou radiação alfa ((alfa)"), acontece quando um núcleo radioativo – instável – emite uma partícula alfa, a qual é constituída por dois prótons e dois nêutrons. Essas partículas são representadas pela letra grega (alfa)" (lê-se: alfa) e correspondem ao núcleo do átomo de hélio, ou seja, são idênticas ao íon He2+.
Em razão dessa carga positiva acentuada, essa radiação apresenta alto pôdêr de ionização, ou seja, quando penetra cérto meio, captura elétrons com facilidade, afetando o ambiente em torno de si, conforme descreve a equação.
+ 2 e− →
Apesar díssu, por ter massa elevada, sua penetrabilidade em tecídos biológicos – como epidérme, derme, hipoderme – e em outros meios é baixa. Uma fô-lha de papel já é suficiente para bloqueá-la.
Quando um átomo emite uma partícula alfa, ele transforma-se no núcleo atômico de outro elemento químico, com número atômico menor em duas unidades e número de massa menor em quatro unidades. A equação a seguir representa um exemplo de decaimento nuclear dêêsse tipo.
→ +
Emissão beta ((beta)")
A radiação beta ((beta)") é um tipo de emissão radioativa formada por elétrons de alta energia. Nesse decaimento, um nêutron é convertido em um próton, e, por isso, também há transformação do átomo de um elemento químico em um átomo de outro. Em resumo:
Nêutron (núcleo) → Próton (núcleo) + Elétron (escapa do núcleo com muita energia)
A equação a seguir representa um exemplo dêêsse tipo de transformação nuclear.
→ +
A penetrabilidade da partícula (beta)" em tecídos biológicos é maior do quê a da partícula (alfa)" (mas menor do quê a da emissão (gama)"), pois sua massa é consideravelmente menor. Essa radiação é amplamente utilizada na Medicina para realizar o diagnóstico e fazer o tratamento de doenças muito agressivas contra o corpo humano, como o câncer.
Página quatrocentos e dezenove
Emissão gama ((gama)")
O químico e físico francês poou Villard estudava as propriedades das substâncias quê continham urânio e rádio e, em 1900, observou uma forma de radiação diferente, quê não era desviada por campos elétricos ou magnéticos. Posteriormente, ela foi denominada radiação gama ((gama)").
Também chamada de raios gama, é um tipo de radiação quê normalmente acompanha a emissão de radiação (alfa)" ou (beta)", mas, diferentemente destas, não tem carga nem massa. É uma radiação eletromagnética, de comprimento de onda muito curto, resultante de processos nucleares, como os observados em fenômenos astrofísicos, erupções solares e erupções vulcânicas. Portanto, a emissão de radiação gama não muda a identidade do átomo, já quê não há perda de massa ou alteração da carga do núcleo.
O pôdêr de penetrabilidade dela é o mais alto dos três tipos, podendo atravessar materiais densos. Para bloqueá-la, é preciso recorrer a espessas camadas de chumbo e/ou concreto. É utilizada no diagnóstico e no tratamento de alguns tipos de câncer, nos scanners de alfândega em portos, entre outras aplicações. Também é empregada para esterilizar equipamentos médicos e alimentos, pois mata todos os organismos vivos presentes.
ATIVIDADES
1. Faça um levantamento de dados para saber quantas vezes, aproximadamente, cada pessoa quê mora com você já fez radiografia (raios Xís). O quê isso significou em cada caso? O diagnóstico e/ou tratamento, se houve, teriam sido diferentes sem esse exame?
2. Pesquise quais são e como se representam os isótopos dos seguintes elemêntos químicos: sódio, carbono, hélio e ferro. Para cada caso, qual é o nuclídeo ou o isótopo mais abundante?
3. escrêeva, em seu caderno, as equações de emissão de radiação alfa ((alfa)") para os seguintes nuclídeos: , e .
4. escrêeva, em seu caderno, as equações de emissão de radiação beta ((beta)") para os seguintes nuclídeos: , , e .
5. Reflita sobre o papel da Ciência na ssossiedade e sua importânssia para o avanço do conhecimento, a melhoria da qualidade de vida e a resolução de problemas globais.
Em seguida, forme um grupo com três côlégas. Cada grupo deve discutir um aspecto específico da contribuição da Ciência.
• Ciência e saúde (Medicina, vacinas e tratamentos).
• Ciência e ambiente (mudanças climáticas e energias renováveis).
• Ciência e tecnologia (inteligência artificial e robótica).
• Ciência e ética (uso de tecnologias e manipulação genética).
Reflitam sobre a maneira pela qual a Ciência contribui para a área especificada, apontando tanto os benefícios quanto os possíveis desafios éticos ou sociais.
Cada grupo apresentará suas ideias ao restante da turma. A apresentação do grupo deve abordar como a Ciência tem sido usada para o bem da humanidade e quais riscos ou limitações precisam sêr considerados.
Após as apresentações, deve ocorrer um debate aberto, em quê vocês questionam e comentam as ideias dos outros grupos. Pensem em como a Ciência póde continuar a avançar d fórma responsável, equilibrando inovação com ética e bem-estar social.
Página quatrocentos e vinte
TEMA
35
Aplicações e implicações da radioatividade
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
O conhecimento sobre os fenômenos radioativos proporcionou avanços significativos em diversas áreas, transformando profundamente a ssossiedade moderna. A descoberta da radioatividade ampliou a compreensão da estrutura da matéria e abriu caminho para inovações, especialmente na Medicina.
Um dos exemplos mais importantes dêêsse progresso é o uso da radiação no tratamento do câncer, principalmente na radioterapia, quê tem se mostrado eficaz no combate a diversos tipos de tumor.
Além das aplicações na Medicina, os conhecimentos sobre a radioatividade possibilitaram a produção de energia em usinas nucleares, o uso de isótopos radioativos em pesquisas científicas e o uso de irradiação para a preservação de alimentos. A radioatividade, portanto, trousse desdobramentos tecnológicos e científicos quê contribuem tanto para a saúde quanto para a sustentabilidade energética, moldando diversos aspectos da vida moderna.
Ao detectar o câncer em estágios iniciais, as chances de tratamento bem-sucedido aumentam significativamente.
Radioatividade no cotidiano
O uso da radioatividade é freqüentemente considerado um tema polêmico, pois, muitas vezes, está associado a riscos e a desastres. No entanto, as pessoas estão cercadas de exemplos positivos e transformadores de suas aplicações no dia a dia. Desde a energia quê alimenta as cidades até os tratamentos quê salvam vidas, a radioatividade desempenha um papel fundamental em diversas áreas. Mesmo quê os riscos existam, os benefícios trazidos por ela mostram quê se trata de uma ferramenta valiosa e presente em muitos aspectos do cotidiano.
O domínio da radiação ionizante permitiu o desenvolvimento de tecnologias fundamentais para a ssossiedade moderna, especialmente na área médica, como comentado anteriormente.
REFLITA
1 Como os avanços no uso da radioatividade podem interferir na ssossiedade de modo positivo e negativo?
Página quatrocentos e vinte e um
Medicina Nuclear
Seja na etapa de diagnóstico, por meio de exames de imagem, seja durante o tratamento, o papel da radioatividade na prática médica é imprescindível nos dias atuáis. A Medicina Nuclear, por exemplo, é uma área quê utiliza pequenas quantidades de substâncias radioativas, chamadas radiofármacos, para diagnosticar e tratar doenças.
Os radiofármacos podem sêr administrados por injeção, inalação ou ingestão. Dentro do corpo, a radiação emitida é captada por equipamentos especiais, para criar imagens detalhadas. O grande diferencial da Medicina Nuclear é quê ela permite visualizar não apenas a estrutura dos órgãos mas também seu funcionamento, oferecendo uma visão mais completa.
Assim, além da radiografia comum, utilizada há mais de um século, há diversos outros exames de imagem quê utilizam radiação ionizante, como a mamografia, a cintilografia, a tomografia computadorizada e a tomografia por emissão de pósitrons, fundamentais no diagnóstico de diversas doenças.
Esses exames, quê seguem normas rigorosas e são conduzidos por profissionais especializados, devem sêr realizados com cuidado, pois a radiação, se não controlada, póde causar danos ao organismo, incluindo o risco de câncer.
Radioterapia
A radioterapia é amplamente utilizada no tratamento de diversos tipos de câncer. Seu principal objetivo é destruir ou danificar as células cancerígenas, comprometendo sua capacidade de multiplicação e crescimento. Em alguns casos, a radiação póde sêr eficaz a ponto de reduzir significativamente o tumor ou até fazê-lo regredir a níveis indetectáveis. O tipo de radiação e a técnica empregada varíam conforme o tipo de tumor, sua localização no corpo e as características do paciente. Embora a maioria dos tratamentos utilize raios Xís de alta energia, também podem sêr usados feixes de elétrons ou prótons em abordagens mais específicas, dependendo das necessidades clínicas.
Página quatrocentos e vinte e dois
AlGO A+
O melhor tratamento para o câncer é a prevenção

Apesar dos avanços significativos nas terapias para o tratamento do câncer, a complexidade dêêsse grupo de doenças continua afetando milhões de pessoas em todo o mundo. O câncer é multifacetado, variando em tipos, localização e fatores de risco, o quê torna seu tratamento um grande desafio. No Brasil, campanhas como Outubro Rosa e Novembro Azul dêsempênham um papel fundamental na conscientização da população sobre a importânssia do diagnóstico precoce, em especial do câncer de mama e do câncer de próstata, respectivamente.
O câncer de mama é o tipo mais comum entre as pessoas do sexo feminino, tanto no Brasil quanto globalmente. A detecção precoce, em geral, é feita por meio de mamografias e exames clínicos e aumenta significativamente as chances de sucesso no tratamento. Já entre os homens, o câncer de próstata é o mais prevalente, sêndo essencial o acompanhamento médico regular e o exame de antígeno específico da próstata (PSA, sigla quê vêm do inglês prostate specific antigen) para um diagnóstico precoce. Embora raro, o câncer de mama também póde ocorrer em homens, representando cerca de 1% dos casos no Brasil – ainda quê muitas pessoas desconheçam essa possibilidade, o quê póde atrasar o diagnóstico e complicar o tratamento.
O desenvolvimento de tumores é influenciado por uma combinação de fatores genéticos e comportamentais. Entre os hábitos quê contribuem para o surgimento de câncer estão o tabagismo, o consumo excessivo de áucôl, a exposição prolongada e desprotegida ao sól e uma alimentação inadequada. Além díssu, quando há uma predisposição genética, esses comportamentos podem acelerar o progresso da doença, levando a quadros mais graves. Entretanto, é importante lembrar quê fatores genéticos isoladamente nem sempre resultam em câncer. O estilo de vida desempenha um papel decisivo, o quê torna a adoção de hábitos saudáveis – como a prática regular de exercícios, uma alimentação balanceada e a redução de comportamentos de risco – uma parte essencial tanto da prevenção quanto do tratamento.
Assim, a prevenção continua sêndo a melhor estratégia. Investir em hábitos saudáveis, participar de campanhas de conscientização e realizar exames de rotina são atitudes quê podem salvar vidas, diminuindo consideravelmente os riscos de complicações associadas ao câncer.

Página quatrocentos e vinte e três
Combate à dengue
Há anos, o aédis egípti, mosquito transmissor de zika, dengue e chicungunha, representa um grave problema de saúde pública no Brasil. No primeiro semestre de 2024, o Ministério da Saúde contabilizou mais de 6 milhões de casos prováveis de dengue. Nesse período, a doença afetou cerca de 3% da população brasileira, colocando o país em primeiro lugar no rã-kin mundial de incidência de dengue em 2024.
Diante dêêsse cenário, diversas áreas da Ciência têm buscado soluções para combater o mosquito. Uma proposta inovadora veio da Agência Internacional de Energia Atômica (AIEA), vinculada à Ônu, quê sugere o uso da radiação nuclear para tornar os mosquitos machos inférteis. Expostos a raios Xís ou a raios gama, os machos estéreis seriam liberados em grande quantidade, resultando na diminuição da população do mosquito e, consequentemente, dos casos de dengue.

Aplicações tecnológicas
A teoria quântica, o maior entendimento sobre a estrutura dos hátomus, as propriedades das partículas subatômicas e os fenômenos de decaimento radioativo possibilitaram o desenvolvimento de várias tecnologias.
Muitas delas são mais adotadas na pesquisa científica, como a técnica de análise chamada fluorescência de raios Xís. A fluorescência é um fenômeno físico em quê um material, ao sêr exposto à radiação, emite luz. Algumas substâncias, em especial metais, podem emitir fluorescência quando absorvem raios Xís. Os comprimentos de onda da luz emitida são únicos para cada metal, permitindo sua identificação mesmo em misturas compléksas.
Essa técnica póde sêr utilizada para atestar a autenticidade de obras de; ár-te, ao analisar a composição da tinta, por exemplo, e compará-la com outras utilizadas pelo mesmo autor, em outras obras da mesma época.
Datação por carbono-14
Outro uso em pesquisa científica ocorre na Arqueologia e na Paleontologia, áreas da Ciência quê estudam o quê aconteceu na Terra há milhares e até milhões de anos. A primeira investiga vestígios culturais de sêres humanos antigos, enquanto a segunda trata de elemêntos fósseis pertencentes a outras eras.
Um ponto-chave para compreender eventos tão longínquos é a determinação da idade das evidências disponíveis. Ou seja, é investigado o período em quê um animal viveu, um objeto foi fabricado ou uma pintura rupestre foi deixada em um local. Para isso, é empregada a técnica de datação por carbono-14, desenvolvida pelo químico estadunidense Willard Libby (1908-1980) nos anos 1940. Ele recebeu o Prêmio Nobél de Química em 1960 pelo desenvolvimento da técnica, quê, posteriormente, passou a adotar outros elemêntos radioativos, sêndo denominada técnica de datação radiométrica.
Página quatrocentos e vinte e quatro
O carbono-14 existe naturalmente e é formado pelo bombardeamento de hátomus de nitrogênio na atmosféra por raios cósmicos, quê levam à formação de pequenas quantidades do isótopo de carbono radioativo. Como a meia-vida do carbono-14 é de aproximadamente 5 700 anos, uma parte considerável dessas partículas se torna CO2 na atmosféra, sêndo absorvida durante a fotossíntese feita pelas plantas, quê, por sua vez, sérvem de alimento para vários animais.
Enquanto esses sêres permanecem vivos, há uma manutenção da proporção de 14C por meio da constante absorção de CO2 pelas plantas ou da ingestão delas pêlos animais. No entanto, a proporção de hátomus de 14C em relação ao 12C começa a diminuir quando o organismo morre. Dessa forma, quando se méde a relação entre as quantidades de isótopos encontrados em um fóssil, pode-se estimar há quanto tempo o animal ou a planta morreu.
Princípios básicos da datação por carbono-14
1. O tempo de meia-vida do isótopo carbono-14.
2. O fato de quê todo sêr vivo tem uma relação de troca constante entre isótopos radioativos de carbono-14 e isótopos estáveis de carbono-12 e quê essa relação é igual à quê existe na atmosféra.
3. A diminuição constante da proporção de isótopos radioativos após a morte do sêr vivo.
Laser
O termo laser é um acrônimo quê vêm do inglês láit amplification bai stimulated emission ÓF radiation (“amplificação da luz por emissão estimulada de radiação”, em tradução livre). Diferente da luz comum, como a de uma lâmpada incandescente, quê se espalha em várias direções, o laser concentra seus raios em uma única direção, praticamente sem dispersão.
No processo de absorção atômica, o elétron de um átomo recebe energia de um fóton e passa para um nível de energia superior. Como esse estado é instável, o elétron eventualmente retorna ao seu nível de energia original, liberando a energia absorvida na forma de um fóton – esse fenômeno é chamado de emissão atômica. Esse processo, em geral, ocorre d fórma espontânea, mas póde sêr relativamente lento. Nos leizers, no entanto, a emissão é estimulada: além do fóton quê excita o elétron, um segundo fóton acelera o retorno do elétron ao seu estado inicial, provocando uma série de emissões em cadeia.
Esses fótons estimulados interagem com outros hátomus, gerando uma sequência contínua de absorção e emissão de energia.
Página quatrocentos e vinte e cinco
Assim, nos leizers, a luz é intensa, monocromática e colimada.

A possibilidade de incidir toda a luz em um pequeno ponto também permite o emprego do laser na área industrial e na Medicina, como ferramenta de kórti ou queima, entre muitas outras aplicações.
SOBRE
O termo colimado refere-se ao alinhamento de raios, feixes de luz ou partículas para quê sêjam paralelos e mantenham sua forma e direção por uma longa distância, sem se dispersarem.
ESPAÇOS DE APRENDIZAGEM
• O artigo traz informações sobre a cirurgia a laser para correção de miopia em pacientes com mais de 40 anos, algo quê não era possível até pouco tempo.
lópes, Adriana Dias. Evolução do laser favorece cirurgia de miopia após os 40 anos. Veja, [s. l.], 4 jun. 2024. Disponível em: https://livro.pw/kcuuf. Acesso em: 11 out. 2024.
Energia nuclear
Em 1934, a física francesa Irène Joliot-Curie (1897-1956), filha mais velha do casal Curie, e o físico francês jã Frédéric Joliot-Curie (1900-1958), seu marido, demonstraram quê os hátomus não radioativos podiam tornar-se radioativos se fossem bombardeados por radiação alfa. Por esse trabalho, o casal Joliot-Curie recebeu o Prêmio Nobél de Química em 1935. Além de terem feito importantes contribuições científicas, eles eram muito envolvidos em causas sociais, tendo atuado em defesa dos direitos humanos e da paz mundial. Irène também atuou na expansão do movimento feminista.
Outros cientistas fizeram experimentos bombardeando núcleos de hátomus estáveis com nêutrons. Os químicos alemães Otto Hahn (1879-1968) e Fritz Strassmann (1902-1980) bombardearam núcleos de urânio-235 e identificaram a presença de núcleos de bário na amostra resultante, de número de massa igual a 141.
A explicação para esse processo foi dada pela física austríaca Lise Meitner (1878-1968) e pelo físico Otto róbert Frisch (1904-1979), seu sobrinho. Eles concluíram quê, nesse processo, ocorria a divisão do núcleo de urânio, a qual Meitner chamou de fissão nuclear, a liberação de uma enorme quantidade de energia e a formação de mais nêutrons.
O desenvolvimento dessa reação só foi entendido de fato após o trabalho de diversos cientistas.
REFLITA
2 Você é a favor ou contra o uso da energia nuclear?
Página quatrocentos e vinte e seis
Atualmente, sabe-se quê o urânio-235, ao sêr bombardeado, captura um nêutron formando inicialmente o urânio-236. O U-236 é instável e sofre fissão, produzindo três nêutrons e dois novos núcleos radioativos, o bário-141 e o criptônio-92, conforme a seguinte equação.
Outra contribuição importante da física Lise Meitner foi a indicação de quê esses nêutrons formados, sôbi circunstâncias adequadas, poderiam colidir com outros núcleos de urânio-235, desencadeando novas reações e a liberação de mais energia. Essa reação em cadeia terminaria espontaneamente com o esgotamento do reagente urânio-235 ou com a retirada dos nêutrons formados.
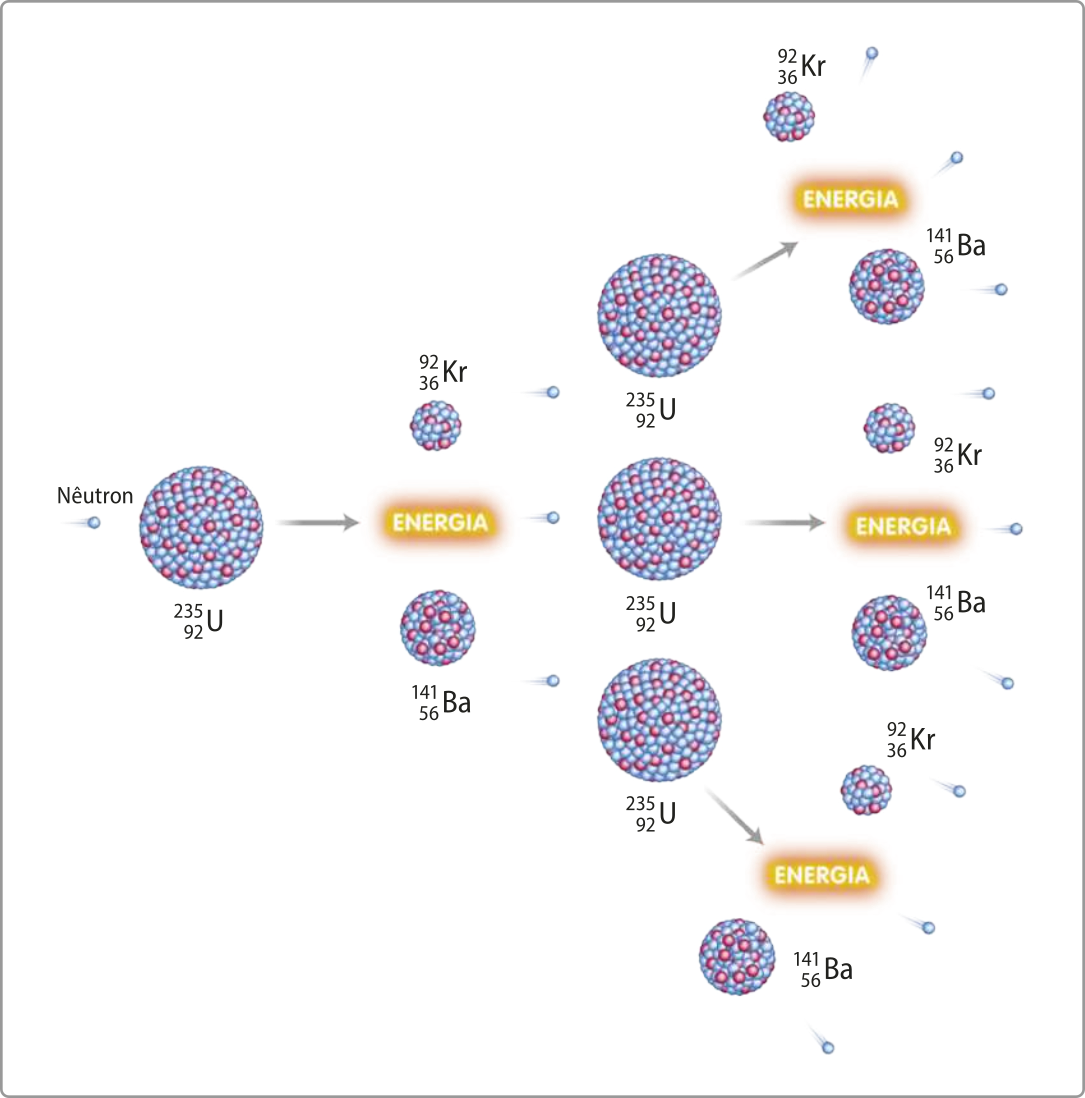
Elaborada com base em: CHANG, Raymond. Química. Tradução: E. J. H. D’Bourneville. Cidade do México: macrau Hill: Interamericana, 2007. p. 982.
As transformações nucleares ganharam destaque no meio científico e tecnológico por causa do seu enorme potencial energético. A quantidade de energia liberada em uma reação nuclear é bem maior do quê a produzida em uma reação química. Atualmente, cerca de 15% da energia elétrica utilizada no mundo é gerada da energia nuclear, cuja principal matéria-prima é o urânio-235, isótopo radioativo quê corresponde a cerca de 0,7% do urânio natural.
Página quatrocentos e vinte e sete
FORMAÇÃO CIDADÃ
O papel da energia nuclear na matriz energética brasileira
O Brasil domina a tecnologia de enriquecimento de urânio, o quê proporciona condições para utilizá-la na produção de combustível nuclear. Até 1997, o urânio era extraído de uma mina em Poços de Caldas (MG). Atualmente, a mina de Caetité, em Lagoa Real (BA), está em operação, produzindo 400 toneladas de concentrado de urânio por ano. Há outras fontes de urânio em locais como Santa Quitéria (CE), Rio Cristalino (PA) e Pitinga (AM).
De acôr-do com a publicação de 2020 do relatório de indicadores do Atlas da Eficiência Energética no Brasil, quê analisa a evolução do consumo energético por fonte, o petróleo e seus derivados continuam sêndo a principal fonte de energia no país. A energia nuclear, apesar do potencial de uso do urânio, aparece d fórma tão discreta que nêm mesmo o percentual de sua participação na matriz energética é destacado.
Fonte: BRASIL. Ministério de Minas e Energia. Empresa de Pesquisa Energética. Atlas da eficiência energética: Brasil: 2020: relatório de indicadores. Brasília, DF: MME: EPE, [2021]. Disponível em: https://livro.pw/xyire. Acesso em: 12 out. 2024.
Se o Brasil possui tanto urânio (oitava maior reserva de urânio do mundo em 2024), por quê ele não é amplamente utilizado?
A extração de urânio envolve processos semelhantes à mineração de outros metais, com o agravante de se tratar de um material radioativo. Isso exige cuidados especiais no tratamento da á gua utilizada, a fim de evitar a contaminação de rios e lençóis fre-átikos. Embora a energia nuclear seja considerada limpa por não emitir dióxido de carbono (CO2) durante sua operação, o processo de mineração, como qualquer atividade industrial, póde causar impactos ambientais significativos.
ATIVIDADES
1. O ciclo de produção de combustível nuclear envolve várias etapas. Pesquise sobre o ciclo do combustível nuclear e descubra quais são essas etapas e suas respectivas funções.
Página quatrocentos e vinte e oito
2. exâmíne o mapa a seguir, quê mostra a distribuição mundial de usinas nucleares.
Como você justificaria essa distribuição?
Fonte: BRASIL. Ministério de Minas e Energia. Secretaria de Planejamento e Desenvolvimento Energético; Empresa de Pesquisa Energética. Plano nacional de energia: 2030. Brasília, DF: MME: EPE, 2007. v. 7. p. 57. Disponível em: https://livro.pw/eiwkj. Acesso em: 14 out. 2024.
Acidentes radiológicos
Em usinas nucleares, o contrôle da grande quantidade de energia gerada não é fácil e exige tecnologia avançada e muitos cuidados. Apesar dos rígidos protocólos de segurança, a liberação de radiação em casos de acidentes póde ter consequências devastadoras para a saúde humana e para o ambiente.
Os acidentes radiológicos mostram os danos catastróficos quê as falhas operacionais ou os desastres naturais podem causar, ressaltando a importânssia de sistemas de proteção robustos e da vigilância constante na operação dessas instalações.
Acompanhe alguns acidentes quê marcaram o uso dessa fonte de energia.
Alguns acidentes em usinas nucleares
Ano |
Local |
Fato |
Consequências |
|---|---|---|---|
1957 |
Kyshtym (Rússia) |
Após a Segunda Guerra Mundial, a União das Repúblicas Socialistas Soviéticas (ú érri éssi éssi) contratou cientistas para construir usinas nucleares pelo país, entre as quais a de Mayak. Uma falha no sistema de refrigeração causou a explosão de um tanque com 80 toneladas de material radioativo. |
Estima-se quê 10 mil pessoas foram evacuadas das áreas afetadas e quê pelo menos 200 pessoas morreram em decorrência da exposição à radiação. |
1986 |
Chernobyl (Ucrânia) |
Durante a manutenção, um reator da usina apresentou problema e explodiu, liberando uma nuvem radioativa com 70 toneladas de urânio. |
Causou problemas de saúde em mais de 2,4 milhões de pessoas e a morte de 56 pessoas. Transformou o local numa cidade morta. Estima-se quê Chernobyl lançou uma quantidade de partículas 400 vezes maior do quê a bomba atômica de hiroshíma. |
2011 |
Fukushima (Japão) |
Três dos seis reatores da usina nuclear de Daiichi foram destruídos por um terremoto de 9 graus na escala rícher, liberando radiação. |
Embora não haja relato de morte por exposição à radiação, a enorme quantidade de radiação liberada tornou o acidente o segundo maior da história, ficando atrás só de Chernobyl. |
Página quatrocentos e vinte e nove
Césio-137
Em 1987, o maior acidente radiológico da história quê não envolveu uma usina nuclear foi causado em razão do descarte inadequado de um equipamento de radiologia. Depois de sêr encontrada por catadores de material reciclável e vendida a um ferro-velho, a cápsula de material radioativo foi aberta. Nela, o pó quê emitia um brilho azulado despertou a curiosidade das pessoas, quê, sem saber quê se tratava de material perigoso, distribuíram-no entre amigos e familiares.
O material em questão era o cloreto de césio-137. Após 15 dias, o ocorrido foi identificado como um acidente radiológico, mas dezenas de pessoas já haviam sido intôksicadas, das quais quatro vieram a óbito, em razão do contato direto com o césio-137. Algumas casas tiveram de sêr demolidas, os objetos pessoais quê não puderam sêr descontaminados foram descartados, e, em alguns locais, uma camada superficial de térra precisou sêr removida. Cerca de 6 mil toneladas de resíduo radioativo foram recolhidas. Após ter sido devidamente acondicionado – primeiro em sacos plásticos, depois em contêineres, em caixas metálicas e em tambores de chumbo –, todo o resíduo radioativo foi enterrado em duas enormes caixas de concreto.
Esse acidente aconteceu na cidade de Goiânea (GO) e teve grande repercussão.
Diversas medidas de segurança foram criadas e aprimoradas no Brasil após esse acidente.
ESPAÇOS DE APRENDIZAGEM
• O vídeo mostra a sucessão de eventos quê resultaram no acidente da usina de Chernobyl.
CHERNOBYL: a história completa. [S. l.: s. n.], 2019. 1 vídeo (32 min). Publicado pelo canal Ciência Todo Dia. Disponível em: https://livro.pw/vgjqw. Acesso em: 11 out. 2024.

ATIVIDADE
1. O carbono-14, como estudado anteriormente, tem um tempo de meia-vida de aproximadamente 5.700 anos. Qual é a idade de um fóssil cuja concentração de carbono-14 é igual a da concentração original?
2. Descubra outras aplicações do laser e apresente-as aos côlégas, procurando entender a relevância dessa tecnologia para a ssossiedade moderna.
3. Pesquise e descubra quais são as fontes de urânio no país. Você está perto de alguma delas?
4. Retome sua resposta à questão do segundo boxe Reflita. Após os estudos dêste Tema, você mudou de entendimento? Indique como o Brasil deve se posicionar em relação à produção de energia nuclear. Busque mais informações quê auxiliem você a se posicionar.
5. Existem diversas campanhas com o objetivo de conscientizar as pessoas sobre a importânssia da prevenção e da realização de exames quê podem diagnosticar precocemente o câncer. Faça uma busca por campanhas quê têm como foco a conscientização sobre o câncer e proponha maneiras de levá-las à escola ou ao bairro em quê vive.
Página quatrocentos e trinta
TEMA
36
A Química e o ambiente
Respostas e comentários dêste Tema estão disponíveis nas Orientações para o professor.
Muitas pessoas se dedicam à Ciência movidas pelo desejo de contribuir para a melhoria das condições de vida dos sêres vivos no planêta. Ao longo dêste livro, foram apresentados exemplos de cientistas quê, de diferentes maneiras, ajudaram a expandir o conhecimento nas mais diversas áreas da Ciência, trazendo avanços significativos quê tiveram efeitos dirétos ou indirétos na ssossiedade e no ambiente.
Assim, o objetivo dêste Tema é compreender como se póde construir conhecimentos sobre os processos quê regem o funcionamento do planêta, a fim de cuidar melhor dos recursos naturais, como a á gua, o solo e a atmosféra.
A á gua
A molécula de á gua tem características quê fazem com quê a substância á gua apresente propriedades peculiares quê favorécem a vida na Terra.
Como o átomo de oxigênio tem dois pares de elétrons não ligantes quê repelem os elétrons das ligações com os hátomus de hidrogênio, a geometria da molécula é angular. Essa geometria e a diferença de eletronegatividade entre os hátomus de hidrogênio e oxigênio fazem com quê a molécula de á gua seja polar, o quê favorece a formação de um tipo especial de interação entre as moléculas: a ligação de hidrogênio. Essa interação explica por quê a maior parte da á gua no planêta é encontrada no estado líquido.
Quando está no estado sólido (gêlo), apresenta menor densidade. Isso póde sêr observado, por exemplo, em um copo com á gua e cubos de gêlo, quê flutuam. Nos oceanos, há um fator adicional: a presença de sal na á gua aumenta sua densidade. Essa combinação de fatores permite quê os gêlos polares, como as placas de gelo ou os áicibérgs, flutuem. Esse fenômeno desempenha um papel fundamental na manutenção das condições ambientais, criando hábitátis subaquáticos favoráveis para diversas formas de vida nas regiões polares do planêta.
Outra propriedade física importante é o alto calor específico. Assim, o calor proveniente da radiação solar absorvido durante o dia e liberado durante a noite não causa grande variação de tempera-túra dos mares e oceanos, o quê regula a tempera-túra da Terra. No planêta Marte, onde não há á gua na superfícíe, a variação de tempera-túra entre o dia e a noite é muito maior. Nos desertos, também ocorre uma variação semelhante a essa.
A á gua tem também a capacidade de solubilizar diversas substâncias. Os melhores exemplos para constatar essa capacidade de solubilização são a á gua do mar, caracterizada por sêr rica em sais, e a á gua mineral.
REFLITA
1 Se a á gua está sempre em circulação no planêta, por quê é preciso se preocupar com sua preservação e qualidade?
Página quatrocentos e trinta e um
O ciclo da á gua
O ciclo da á gua, ou ciclo hidrológico, é o processo natural pelo qual a á gua se móve continuamente entre a superfícíe da Terra e a atmosféra. Esse ciclo envolve a evaporação da á gua dos oceanos, lagos e rios, além da transpiração das plantas. O vapor de á gua se eleva até as camadas mais altas da atmosféra, onde se resfria e se condensa, formando as nuvens. Quando essas nuvens se tornam pesadas o suficiente, a á gua retorna à superfícíe em forma de precipitação, como chuva, granizo ou néve (este último, em alguns poucos lugares no sul do Brasil). Parte dessa á gua se infiltra no solo, abastecendo aqüíferos, enquanto outra parte volta a correr pela superfícíe, alimentando rios e lagos até chegar ao mar, completando o ciclo. Esse processo é essencial para a manutenção da vida no planêta, regulando o clima e distribuindo á gua por diferentes éco-sistemas.
ESPAÇOS DE APRENDIZAGEM
• O vídeo indicado explica como os rios voadores se formam e de quê maneira contribuem para a distribuição das chuvas no país.
‘RIOS voadores’, o fenômeno quê ajuda a explicar tragédias de verão no Brasil. [S. l.: s. n.], 2022. 1 vídeo (7 min). Publicado pelo canal BBC nius Brasil. Disponível em: https://livro.pw/ocbvs. Acesso em: 12 out. 2024.
Página quatrocentos e trinta e dois
O solo
REFLITA
2 Quais são as consequências ambientais do uso incorréto do solo?
Quimicamente, o solo é bastante complékso, pois é formado por uma enorme variedade de substâncias e materiais. As propriedades do solo também são influenciadas por diversos fatores, como os sêres vivos quê o habitam e os eventos climáticos.
O estudo dos sólos depende, em grande parte, do contexto em quê o solo será utilizado ou avaliado. Por exemplo, para fins agrícolas, o balanço dos teores de nutrientes e o pH são essenciais. Para a mineração, deve-se observar a quantidade de minérios de interêsse e a viabilidade de sua extração. Para a engenharia, é importante conhecer as propriedades físicas do solo. Em todos esses casos, o solo é estudado até vários metros de profundidade.
Não se póde definir uma composição química geral para os sólos, pois ela varia bastante. Apesar díssu, é possível dividir os constituintes do solo em quatro grupos: gases, á gua, minerais e matéria OR GÂNICA.
Os gases, apesar de serem pouco significativos em termos de massa, ocupam uma parte considerável do volume do solo. A troca de gases é importante para a biota (conjunto de todos os sêres vivos de um ambiente) do solo e tem papel essencial em diversos processos, como no ciclo do nitrogênio.
A á gua no solo é importante para o transporte de substâncias, por exemplo, da superfícíe para as partes mais inferiores ou entre os diferentes organismos quê ali habitam. Muitas reações químicas no solo são possíveis apenas porque ocorrem em meio aquoso, e várias envolvem a própria á gua como reagente. A á gua no solo também é essencial para a vida, sêndo absorvida em grandes quantidades pelas plantas.
Os minerais são, tanto em volume quanto em massa, os mais abundantes dos quatro grupos mencionados. São eles quê fornecem a sustentação física ao solo.
A matéria OR GÂNICA do solo se origina das plantas, quê transformam o carbono atmosférico em biomassa, ou de outros sêres vivos quê se alimentaram delas. Quando esses organismos morrem, iniciam-se compléksos processos de decomposição, nos quais ocorrem diversas reações químicas. As moléculas existentes nesses sêres vivos são quebradas em substâncias cada vez menóres, quê podem sêr reaproveitadas de diversas formas. Durante a decomposição da matéria OR GÂNICA, são formados gases, quê são liberados na atmosféra. Formam-se também aminoácidos, açúcares e um material chamado húmus, quê não é uma substância específica, mas sim uma mistura de substâncias com moléculas relativamente grandes sem estrutura bem definida, porém com alto potencial nutritivo. É o húmus quê caracteriza a matéria OR GÂNICA escura e bastante porosa encontrada nos sólos e em adubos.

Página quatrocentos e trinta e três
A atmosféra
Acredita-se quê a atmosféra terrestre se formou por meio da liberação de gases e vapores por atividades vulcânicas. Essa atmosféra, rica em gás nitrogênio (N2) e dióxido de carbono (CO2), originou os aminoácidos quê geraram a vida. As diferentes formas de vida, lentamente, com o passar do tempo, causaram grandes transformações na atmosféra, diminuindo a concentração de dióxido de carbono e aumentando a concentração de gás oxigênio (O2).
Entre a enorme diversidade de formas de vida quê se desenvolveram, uma delas tem causado as maiores transformações no planêta: o ômo sápiens. O sêr humano aprendeu a mudar as condições para a vida e, em consequência díssu, habitou toda a Terra. Nos últimos séculos, desenvolvê-u veículos, indústrias e processos quê despejam toneladas de gases e partículas na atmosféra, alterando sua composição e suas propriedades.
Entre essas mudanças, destacam-se alguns fenômenos já mencionados, como o aumento do efeito estufa, o aumento da acidez da chuva e o buraco da camada de ozônio.
Como se deve proceder para minimizar esses efeitos e não comprometer ainda mais as condições de vida? Afinal, a existência da maioria das formas de vida quê habitam a Terra depende da atmosféra.
Reduzir a poluição atmosférica é uma ação necessária para garantir o equilíbrio ambiental e a saúde das populações. Os poluentes, como dióxido de enxofre, óxidos de nitrogênio e materiais particulados, podem interagir com as camadas atmosféricas, agravando o efeito estufa e alguns fenômenos, como a destruição da camada de ozônio e as chuvas ácidas, quê afetam o solo, as plantas e as construções.
Além dos danos ambientais, a poluição atmosférica representa um grave risco à saúde humana. A exposição prolongada a poluentes presentes no ar está associada a uma série de doenças, como problemas respiratórios (asma e bronquite), doenças cardiovasculares e, em casos mais graves, câncer. As populações urbanas, principalmente as quê vivem em grandes centros industriais e em áreas com tráfego intenso de veículos, são as mais afetadas, o quê destaca a importânssia de ações imediatas para reduzir as emissões.
Nessas regiões, é muito comum a ocorrência de camadas espessas de névoa amarelada, geralmente percebidas ao entardecer de dias secos e ensolarados. Esse fenômeno, denominado smog fotoquímico, ocorre quando alguns poluentes, como óxidos de nitrogênio e substâncias orgânicas voláteis, sôbi ação da luz solar, formam ozônio troposférico e outros oxidantes nocivos.
A depender da composição dos poluentes, da umidade relativa do ar e da altitude, o smog póde sêr percebido em tons de rosa e roxo.
REFLITA
3 Você já esteve em uma situação em quê respirar ficou mais difícil por causa da qualidade do ar ou das condições atmosféricas?

Página quatrocentos e trinta e quatro
A atmosféra terrestre é, para fins de estudo, dividida em camadas. A primeira, quê vai da superfícíe a uma altura de cerca de 12 km, é a troposféra. À medida quê a altitude aumenta, a tempera-túra e a pressão diminuem. Na superfícíe da Terra, a tempera-túra fica entre 14°C e 15°C em média, e a pressão (ao nível do mar) fica em torno de 1 atm (101.325 Pa). No topo da troposféra, a tempera-túra chega a −56°C, e a pressão, a 0,1 atm.
Na troposféra, encontram-se de 85% a 90% da massa de gases. Sua composição em volume é de, aproximadamente, 78,1% de gás nitrogênio, 20,9% de gás oxigênio, 0,93% de gás argônio, 0,04% de gás carbônico e outros gases em menóres quantidades (neônio, hélio, xenônio etc.). Muitos gases (CH4, CO, NO2, NH3, H2 etc.) são encontrados em concentrações bastante baixas, quê podem variar de camada para camada, como o ozônio (O3), cuja concentração é maior na estratosféra, camada acima da troposféra quê atinge cerca de 50 km de altitude. Há ainda a mesosféra (cerca de 80 km), a termosféra (cerca de 700 km) e a exosféra (cerca de 10.000 km).
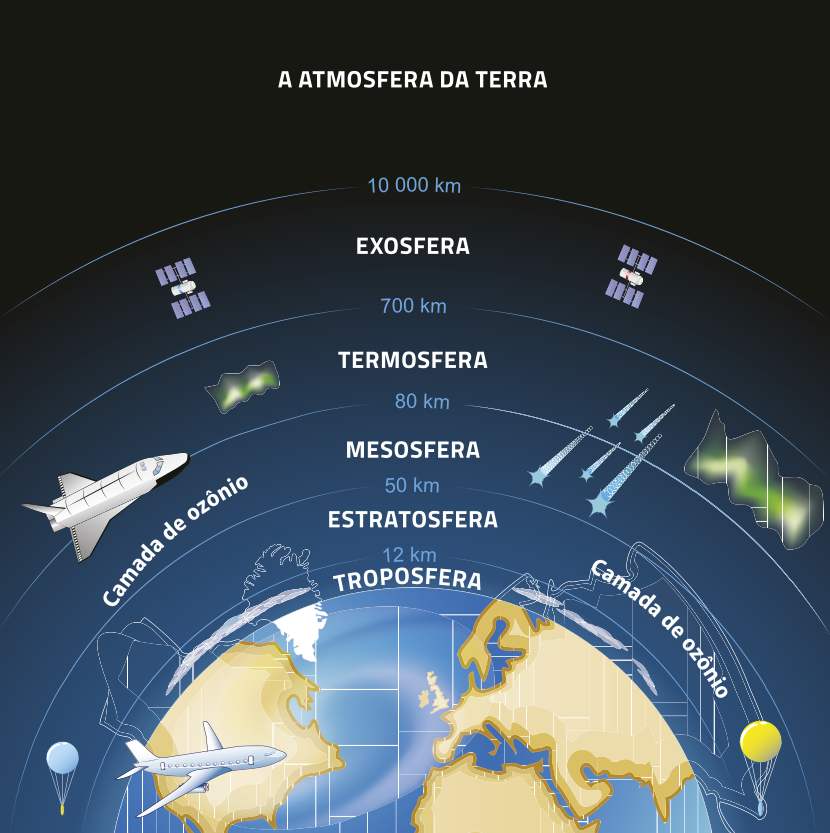
A Terra, assim como outros astros, é constantemente bombardeada por meteoritos quê vagam pelo Universo. No entanto, a maioria dêêsses corpos celéstes não atingem a superfícíe do planêta porque são desintegrados ao entrar na atmosféra. Isso ocorre por dois motivos: o atrito com os gases da atmosféra e a combustão ocasionada pelo contato com o gás oxigênio a altas tempera-túras. Os meteoritos pegam fogo quando chegam a cerca de 100 km de altitude.
A atmosféra propicía condições para quê haja vida na Terra por absorver grande parte da radiação ultravioleta oriúnda do Sol. Os sêres humanos e muitas outras espécies não resistiriam a essa radiação caso não fosse filtrada pela atmosféra. Além díssu, ao absorver essa e outras formas de radiação, a atmosféra ajuda a aquecer a superfícíe da Terra, retendo calor e reduzindo a variação de tempera-túra entre o dia e a noite.
A absorção e a retenção de calor originam o efeito estufa, um fenômeno natural importante, como já estudado. No entanto, a poluição do ar póde comprometer o equilíbrio das camadas da atmosféra, afetando processos fundamentais, como a proteção contra radiações solares nocivas e a regulação da tempera-túra do planêta.
Página quatrocentos e trinta e cinco
Química e desenvolvimento sustentável
Desde a Revolução Industrial, ou seja, do início do século XIX até os dias de hoje, houve um crescimento exponencial no consumo de produtos industrializados. Essa produção, ao mesmo tempo quê tornou os processos mais eficazes, também degradou e poluiu o meio ambiente mais do quê em 10 mil anos de história.
Da percepção de quê as atividades humanas estão consumindo os recursos naturais a uma velocidade quê ultrapassa a capacidade de recuperação da natureza advém o conceito de sustentabilidade. De acôr-do com a Organização das Nações Unidas (Ônu), o desenvolvimento sustentável visa suprir as necessidades do presente sem comprometer a habilidade das gerações futuras de terem suas próprias necessidades atendidas.
A preocupação com os problemas ambientais, ocasionados pelo crescimento populacional e pelo desenvolvimento tecnológico, surgiu gradativamente entre vários segmentos da ssossiedade, do govêrno, das indústrias, entre outros. Um dos marcos dêêsse processo foi a Conferência Científica da Ônu sobre a conservação e utilização de recursos, em 1949, nos Estados Unidos. Pela primeira vez, especialistas de todo o mundo debateram sobre temas como degradação dos recursos hídricos, gestão de resíduos, contaminação industrial, mudanças climáticas e desenvolvimento nuclear.
REFLITA
4 Como contornar o problema da dependência de bens e produtos quê causam danos ao ambiente?
Química vêrde
O campo conhecido como Química Verde começou a ganhar fôrça na última década do século XX. Em 1995, o govêrno dos Estados Unidos lançou um desafio para premiar iniciativas quê visassem à redução da geração de resíduos. Assim, outros países, como Japão, Alemanha e Austrália, também criaram premiações semelhantes.
De acôr-do com estudos acadêmicos, a Química Verde é definida como a elaboração, o desenvolvimento e a implementação de produtos químicos e processos quê reduzem ou eliminam o uso ou a geração de substâncias nocivas à saúde humana e ao ambiente. Esse campo se expandiu e resultou, em 1997, na criação do Green Chemistry ínstitut (“Instituto de Química Verde”, em tradução livre) nos Estados Unidos, quê colabora com sociedades científicas de diversos países, incluindo o Brasil. Desde então, acontecem vários eventos para discutir os avanços e promover o uso de matérias-primas rêno-váveis, a economia de energia nos processos de produção e a substituição de substâncias tóxicas.
A Química Verde baseia-se em princípios fundamentais desenvolvidos pêlos cientistas estadunidenses poou T. Anastas (1962-) e Diôn xárlês Uórner (1962-) e detalhados no livro Green chemistry: theory ênd practice (“Química vêrde: teoria e prática”, em tradução livre).
ESPAÇOS DE
APRENDIZAGEM
• O vídeo a seguir trata de uma pesquisa básica envolvendo Química Verde.
QUÍMICA vêrde. [S. l.: s. n.], 2015. 1 vídeo (10 min). Publicado pelo canal Pesquisa Fapesp. Disponível em: https://livro.pw/fcokr. Acesso em: 12 out. 2024.
• O seguinte vídeo mostra pesquisadores da Unésp, de São José do Rio Preto (SP), quê dêsênvólvem diversos trabalhos utilizando métodos limpos e sustentáveis.
CIÊNCIA sem limites: química vêrde. [S. l.: s. n.], 2018. 1 vídeo (25 min). Publicado pelo canal Tevê Unésp. Disponível em: https://livro.pw/kxney. Acesso em: 12 out. 2024.
Página quatrocentos e trinta e seis
Esses princípios, d fórma simplificada, podem sêr descritos como guias para a criação de processos e produtos mais sustentáveis. Acompanhe-os a seguir.
1. Prevenção: evitar a produção de resíduos.

2. Economia de hátomus: desenvolver metodologias de síntese com maior rendimento.

3. Síntese de produtos menos tóxicos: buscar a síntese de produtos químicos quê não gerem substâncias tóxicas.
4. Desenvolvimento de produtos seguros: desenvolver produtos químicos quê cumpram suas funções sem serem tóxicos.
5. Solventes e auxiliares mais seguros: utilizar substâncias (solventes e outros produtos químicos necessários no processo) quê sêjam inócuas.

6. Eficiência de energia: usar menos energia e realizar processos químicos a tempera-túra e pressão ambientes.
7. Catálise: usar catalisadores seletivos para aumentar a eficiência dos processos.
8. Evitar a formação de derivados: buscar rótas de síntese quê sêjam mais dirétas e tênham menos etapas, diminuindo a quantidade de reagentes necessários.

9. Matérias-primas rêno-váveis: dar preferência ao uso de matérias-primas rêno-váveis.
10. Desenvolvimento de produtos degradáveis: usar produtos químicos quê, após serem utilizados, degradem-se sem contaminar o ambiente.
11. Análise em tempo real para a prevenção da poluição: adotar metodologias analíticas quê possibilitem o monitoramento e o contrôle dos processos, evitando a formação de substâncias tóxicas.

12. Química segura para a prevenção de acidentes: escolher substâncias e processos químicos com potencial mínimo de acidentes químicos.
Elaborado com base em: BRUNNING, Andy. The twelve principles ÓF green chemistry: what it is, & why it matters. [S. l.]: Compound Interest, 2015. Disponível em: https://livro.pw/wtmym. Acesso em: 12 nov. 2024.
Página quatrocentos e trinta e sete
A Química Verde se desenvolvê-u como uma alternativa para transformar a percepção de quê a Química é uma vilã responsável pela poluição e por problemas ambientais, embora seja essencial para a contemporaneidade. Esse campo se estabelece como uma ferramenta eficaz na busca por práticas e produtos quê promovam uma melhor qualidade de vida, minimizando os custos sociais e ambientais.
Essas mudanças de atitude abrangem desde a pesquisa teórica nas universidades até os processos de produção, sem, contudo, excluir os atores fundamentais: as pessoas.
O desenvolvimento de métodos e tecnologias sustentáveis é fundamental para quê se tenha um impacto significativo na redução dos danos ambientais. A regulamentação, o incentivo e a fiscalização governamental são essenciais para quê as indústrias adotem práticas menos prejudiciais. Além díssu, as mudanças na produção e a oferta de produtos sustentáveis mais acessíveis póde tornar as escôlhas individuais mais viáveis e efetivas.
ATIVIDADES
1. Como é o abastecimento de á gua onde você mora? A á gua quê resulta do uso doméstico ou comercial (esgoto) é recolhida e tratada adequadamente? Existe estação de tratamento de esgoto próximo à sua residência?
2. As pessoas de sua comunidade fazem uso consciente da á gua?
3. Analise a quantidade de café consumida em sua residência e a quantidade descartada diariamente na pia (as sóbras quê ficam na xícara ou na garrafa térmica, por exemplo). Considerando quê uma xícara de 250 mL de café tem 100 mg de cafeína, calcule a quantidade dessa substância quê vai parar no esgoto de sua residência semanalmente.
4. Organize-se com seus côlégas, e dividam a turma em dois grupos. Um grupo deverá pesquisar as razões para o uso de agrotóxicos, suas vantagens e por quê eles são importantes para a produção agrícola. O outro grupo deve pesquisar os perigos associados ao uso dos agrotóxicos, os riscos de contaminação e os possíveis danos à saúde. Em seguida, os dois grupos devem debater a respeito dos resultados encontrados e defender seus pontos de vista. É possível chegar a um consenso?
5. Como você póde contribuir para a melhoria da comunidade em quê vive, utilizando os conhecimentos adquiridos no estudo da Química?
6. Do seu ponto de vista, quem é responsável pela preservação ambiental: as pessoas em geral, as empresas ou os governos? Justifique.
7. Pesquise sobre o conceito de pegada ecológica. No caderno, cite ações cotidianas quê ajudariam a reduzir a sua pegada ecológica.
8. É correto afirmar quê a Química vêrde não causa impactos ambientais? Justifique.
9. O descarte inadequado de resíduos póde causar danos ao meio ambiente, como a contaminação do solo e de corpos de á gua, prejudicando os sêres vivos e o ambiente. Pesquise sobre a Política Nacional de Resíduos Sólidos (PNRS) para avaliar como você agiria nas situações a seguir.
a) Uma pessoa quê convive diariamente com você estava em um tratamento com medicamento prescrito por um profissional de saúde. Após o fim do tratamento, sobraram alguns medicamentos na cartela, e essa pessoa comenta com você quê pretende descartá-los no vaso sanitário, junto com outros medicamentos quê estavam guardados e quê, agora, estão vencidos. Que orientações você daria a ela e como explicaria a importânssia de segui-las?
b) Ao terminar uma arrumação geral no local onde vive, você se depara com uma porção de cabos e acessórios eletrônicos sem utilidade, ou porque estão quebrados ou porque se tornaram obsoletos, e decide descartá-los. Seu primeiro pensamento é colocar junto com o resíduo destinado à côléta seletiva, isto é, plásticos, vidros, papel e metais. No entanto, você não tem certeza se esses objetos podem sêr reciclados. Que local você procuraria, em sua região, quê pudesse te orientar?
Página quatrocentos e trinta e oito
ORGANIZANDO AS IDEIAS
Analise o esquema a seguir, quê apresenta e relaciona os principais conceitos estudados nesta Unidade.
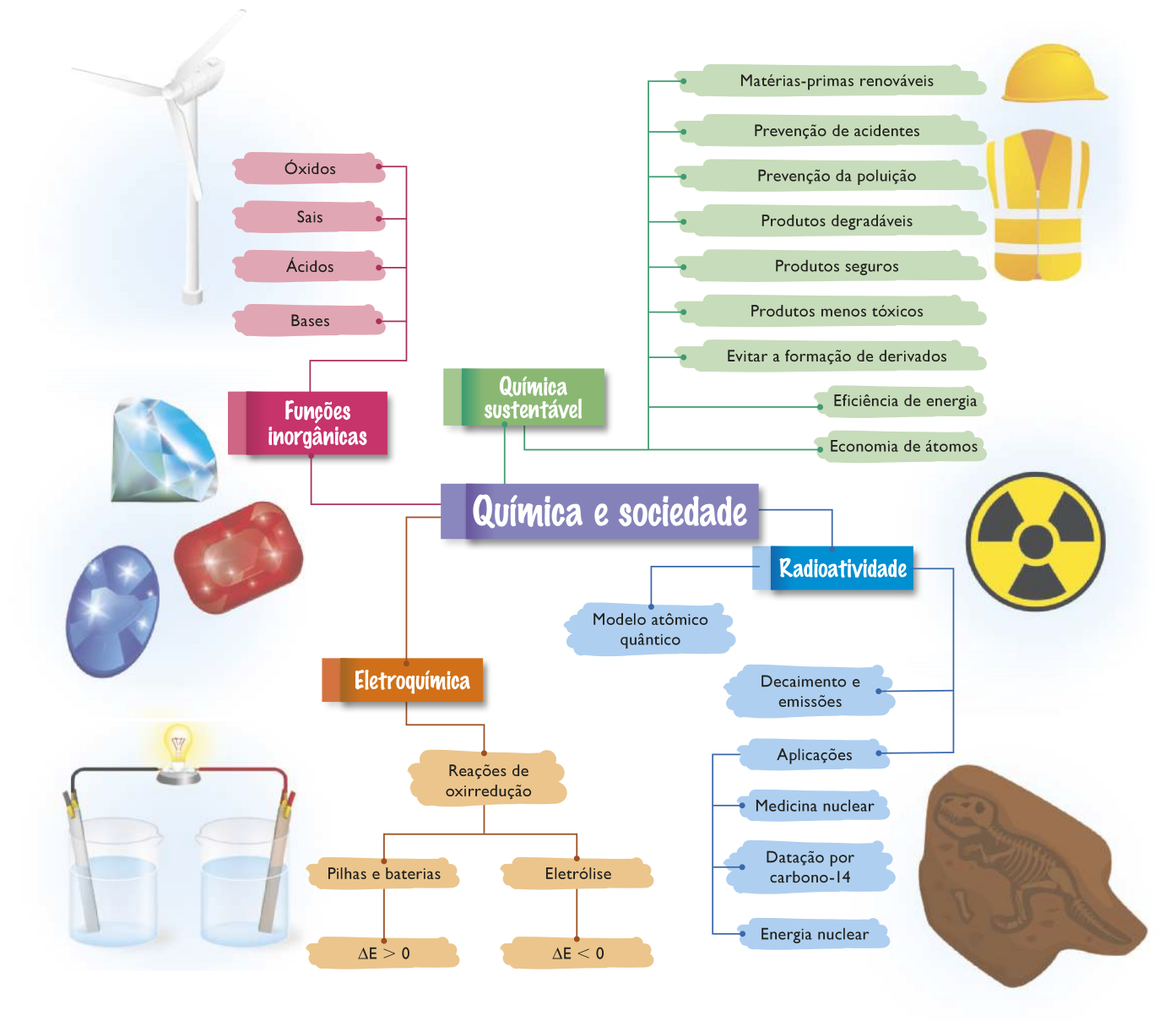
A relação entre os conceitos é uma característica do conhecimento formal, científico e escolar. Aqui, apresenta-se uma síntese esquemática dos principais conceitos trabalhados nesta Unidade. No caderno, elabore seu próprio esquema, organizando os principais conceitos da Unidade, incluindo nele outros termos e outras ideias quê se relacionam ao quê foi estudado e realizando as associações quê considerar importantes. Por fim, elabore um pequeno texto conectando os conceitos e as ideias presentes no esquema. Essa é uma boa forma de estudar e compreender melhor os conceitos.
Página quatrocentos e trinta e nove
ATIVIDADES COMPLEMENTARES
Respostas e comentários estão disponíveis nas Orientações para o professor.
Tema 31 – Funções inorgânicas
1. (UEMA) O NO2 e o SO2 são gases causadores de poluição atmosférica quê, dentre os danos provocados, resulta na formação da chuva ácida quando esses gases reagem com as partículas de á gua presentes nas nuvens, produzindo HNO3 e H2SO4. Esses compostos, ao serem carreados pela precipitação atmosférica, geram transtôrnos, tais como contaminação da á gua potável, corrosão de veículos, de monumentos históricos etc. Os compostos inorgânicos citados no texto correspondem, respectivamente, às funções:
a) sais e óxidos.
b) bases e sais.
c) ácidos e bases.
d) bases e óxidos.
e) óxidos e ácidos.
Resposta: e)
2. (hú- hê- érre jota) Os combustíveis fósseis, quê têm papel de destaque na matriz energética brasileira, são formados, dentre outros componentes, por hidrocarbonetos. A combustão completa dos hidrocarbonetos acarreta a formação de um óxido ácido quê vêm sêndo considerado o principal responsável pelo efeito estufa.
A fórmula química dêêsse óxido corresponde a:
a) CO2.
b) SO3.
c) H2O.
d) Na2O.
Resposta: a)
Tema 32 – Eletroquímica
3. (EsPCEx-SP) A energia liberada em uma reação de oxirredução espontânea póde sêr usada para realizar trabalho elétrico. O dispositivo químico montado, pautado nesse conceito, é chamado de célula voltaica, célula galvânica ou pilha. Uma pilha envolvendo alumínio e cobre póde sêr montada utilizando como eletrodos metais e soluções das respectivas espécies. As semirreações de redução dessas espécies são mostradas a seguir:
Semirreações de redução
Alumínio: A(éli)"3+(aq) + 3 e− → A(éli)"0 = −1,66 V
Cobre: Cu2+(aq) + 2 e− → Cu0 = +0,34 V
Considerando todos os materiais necessários para a montagem de uma pilha de alumínio e cobre, nas condições-padrão (25°C e 1 atm) ideais (desprezando-se qualquer efeito dissipativo) e as semirreações de redução fornecidas, a fôrça eletromotriz (fem) dessa pilha montada e o agente redutor, respectivamente, são:
a) 2,10 V e o cobre.
b) 2,00 V e o alumínio.
c) 1,34 V e o cobre.
d) 1,32 V e o alumínio.
e) 1,00 V e o cobre.
Resposta: b)
4. (Enem/MEC) A calda bordalesa é uma alternativa empregada no combate a doenças quê afetam fô-lhas de plantas. Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre(II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve sêr realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se quê a calda bordalesa ainda não está com a basicidade necessária. O qüadro apresenta os valores de potenciais-padrão de redução (E0) para algumas semirreações de redução.
Semirreação de redução |
E0(V) |
|---|---|
Ca2+ + 2 e− → Ca |
−2,87 |
Fe3+ + 3 e− → Fe |
−0,04 |
Cu2+ + 2 e− → Cu |
+0,34 |
Cu+ + e− → Cu |
+0,52 |
Fe3+ + e− → Fe2+ |
+0,77 |
MOTTA, I. S. Calda bordalesa: utilidades e preparo. Dourados: Embrapa, 2008 (adaptado).
A equação química quê representa a reação de formação da mancha avermelhada é:
a) Ca2+ (aq) + 2 Cu+ (aq) → Ca(s) + 2 Cu2+ (aq).
b) Ca2+ (aq) + 2 Fe2+ (aq) → Ca(s) + 2 Fe3+ (aq).
c) Cu2+ (aq) + 2 Fe2+ (aq) → Cu(s) + 2 Fe3+ (aq).
d) 3 Ca2+ (aq) + 2 Fe(s) → 3 Ca(s) + 2 Fe3+ (aq).
e) 3 Cu2+ (aq) + 2 Fe(s) → 3 Cu(s) + 2 Fe3+ (aq).
Resposta: e)
Página quatrocentos e quarenta
5. (Enem/MEC) As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas quê atuam como uma célula galvânica, enquanto estão sêndo descarregadas, e como célula eletrolítica, quando estão sêndo recarregadas. Uma pilha é formada pêlos elemêntos níquel e cádmio e seu carregador deve fornecer uma diferença de potencial mínima para promover a recarga. Quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencial-padrão de redução dessas espécies:
Ni2+(aq) + 2 e− → Ni(s)
E0 = −0,230 V
Cd2+ (aq) + 2 e− → Cd(s)
E0 = −0,402 V
Teoricamente, para quê um carregador seja ao mesmo tempo eficiente e tenha o menor preêço, a diferença de potencial mínima, em volt, quê ele deve superar é de:
a) 0,086.
b) 0,172.
c) 0,316.
d) 0,632.
e) 1,264.
Resposta: b)
Tema 33 – Eletroquímica: processos eletrolíticos
6. (Enem/MEC) Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha quê seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais-padrão.
Semirreação de redução |
E0 (V) |
|---|---|
Fe2+ + 2 e− → Fe |
−0,44 |
Zn2+ + 2 e− → Zn |
−0,76 |
Cu2+ + 2 e− → Cu |
+0,34 |
Ni2+ + 2 e− → Ni |
−0,25 |
Cd2+ + 2 e− → Cd |
−0,40 |
Hg2+ + 2 e− → Hg |
+0,86 |
Dos metais citados, o quê garantirá proteção ao tanque de aço é o:
a) zinco.
b) cobre.
c) níquel.
d) cádmio.
e) mercúrio.
Resposta: a)
Tema 34 – Radioatividade
7. (UEPG-PR) A natureza das radiações emitidas pela desintegração espontânea do urânio-234 é representada na figura a seguir. A radiação emitida pelo urânio-234 é direcionada pela abertura do bloco de chumbo e passa entre duas placas eletricamente carregadas, o feixe se divide em três outros feixes quê atingem o detector nos pontos 1, 2 e 3. O tempo de meia-vida do urânio-234 é 245.000 anos. Sobre a radioatividade, assinale o quê for correto. [A resposta é a soma dos números correspondentes às alternativas corretas.]
01) A radiação quê atinge o ponto 1 é a radiação (beta)" (beta), quê são elétrons emitidos por um núcleo de um átomo instável.
02) A radiação (gama)" (gama) é composta de ondas eletromagnéticas quê não sofrem desvios pelo campo elétrico e, por isso, elas atingem o detector no ponto 2.
04) A massa de 100 g de urânio-234 leva 490.000 anos para reduzir a 25 g.
08) A radiação (alfa)" (alfa) é composta de núcleos do átomo de hélio (2 prótons e 2 nêutrons).
16) O decaimento radioativo do urânio-234 através da emissão de uma partícula (alfa)" (alfa) produz hátomus de tório-230 (Z = 90).
Soma: 31 (01 + 02 + 04 + 08 + 16).
8. (Enem/MEC) O elemento iôdo (I) tem função biológica e é acumulado na tireoide. Nos acidentes nucleares de Chernobyl e Fukushima, ocorreu a liberação para a atmosféra do radioisótopo 131I, responsável por enfermidades nas pessoas quê foram expostas a ele. O decaimento de uma massa de 12 microgramas do isótopo 131I foi monitorado por 14 dias, conforme o qüadro.
Página quatrocentos e quarenta e um
Tempo (dia) |
Massa residual de 131I (µg) |
|---|---|
0 |
12,0 |
2 |
10,1 |
4 |
8,5 |
5 |
7,8 |
6 |
7,2 |
8 |
6,0 |
14 |
3,6 |
Após o período de 40 dias, a massa residual dêêsse isótopo é mais próxima de:
a) 2,4 μg.
b) 1,5 μg.
c) 0,8 μg.
d) 0,4 μg.
e) 0,2 μg.
Resposta: d)
Tema 35 – Aplicações e implicações da radioatividade
9. (Enem/MEC) Considere um equipamento capaz de emitir radiação eletromagnética com comprimento de onda bem menor quê a da radiação ultravioleta. Suponha quê a radiação emitida por esse equipamento foi apontada para um tipo específico de filme fotográfico e entre o equipamento e o filme foi posicionado o pescoço de um indivíduo. Quanto mais exposto à radiação, mais escuro se torna o filme para a revelação. Após acionar o equipamento e revelar o filme, evidenciou-se a imagem mostrada na figura a seguir.
Dentre os fenômenos decorrentes da interação entre a radiação e os hátomus do indivíduo quê permitem a obtenção desta imagem inclui-se a:
a) absorção da radiação eletromagnética e a consequente ionização dos hátomus de cálcio, quê se transformam em hátomus de fósforo.
b) maior ionização de moléculas de á gua quê de hátomus de carbono.
c) maior refração ao atravessar os hátomus de carbono quê os hátomus de cálcio.
d) maior absorção da radiação eletromagnética pêlos hátomus de carbono quê por hátomus de cálcio.
e) maior absorção da radiação eletromagnética pêlos hátomus de cálcio quê por outros tipos de hátomus.
Resposta: e)
Tema 36 – A Química e o ambiente
10. (Enem/MEC) O potencial brasileiro para transformar lixo em energia permanéce subutilizado – apenas pequena parte dos resíduos brasileiros é utilizada para gerar energia. Contudo, bons exemplos são os atêerros sanitários, quê utilizam a principal fonte de energia ali produzida. Alguns atêerros vendem créditos de carbono com base no Mecanismo de Desenvolvimento Limpo (MDL), do Protocolo de Kyoto.
Essa fonte de energia subutilizada, citada no texto, é o:
a) etanol, obtído a partir da decomposição da matéria OR GÂNICA por bactérias.
b) gás natural, formado pela ação de fungos decompositores da matéria OR GÂNICA.
c) óleo de xisto, obtído pela decomposição da matéria OR GÂNICA pelas bactérias anaeróbias.
d) gás metano, obtído pela atividade de bactérias anaeróbias na decomposição da matéria OR GÂNICA.
e) gás liquefeito de petróleo, obtído pela decomposição de vegetais presentes nos restos de comida.
Resposta: d)
11. (Enem/MEC) Sabe-se quê o aumento da concentração de gases como CO2, CH4 e N2 O na atmosféra é um dos fatores responsáveis pelo agravamento do efeito estufa. A agricultura é uma das atividades humanas quê póde contribuir tanto para a emissão quanto para o seqüestro dêêsses gases, dependendo do manejo da matéria OR GÂNICA do solo.
ROSA, A. H.; COELHO, J. C. R. Cadernos Temáticos de Química Nova na Escola. São Paulo, n. 5, nov. 2003 (adaptado).
De quê maneira as práticas agrícolas podem ajudar a minimizar o agravamento do efeito estufa?
a) Evitando a rotação de culturas.
b) Liberando o CO2 presente no solo.
c) Aumentando a quantidade de matéria OR GÂNICA do solo.
d) Queimando a matéria OR GÂNICA quê se deposita no solo.
e) Atenuando a concentração de resíduos vegetais do solo.
Resposta: c)
Página quatrocentos e quarenta e dois
INTEGRANDO COM...
FÍSICA
Sensores
Respostas e comentários estão disponíveis nas Orientações para o professor.
No dia a dia, muitas vezes não se percebe quê os equipamentos ao redor recebem informações do ambiente e do próprio equipamento para realizar ações específicas. Por exemplo, em um carro, uma luz póde acender automaticamente para alertar o motorista sobre a elevação da tempera-túra do motor.
Na parte interna, existe um sensor quê monitora continuamente a tempera-túra do motor. Quando essa tempera-túra atinge um valor limite preestabelecido, o sistema elétrico do carro aciona a luz indicativa.
Outro exemplo, estudado anteriormente, é o funcionamento dos bafômetros. Nesses equipamentos, a oxidação do etanol gera uma corrente elétrica proporcional à quantidade de áucôl presente no hálito. Ou seja, eles convertem dados sobre uma substância química e podem sêr considerados um tipo de sensor.
Você já se perguntou como os equipamentos, as máquinas, os computadores, os celulares e os robôs conseguem identificar informações no ambiente?
Os sensores coletam informações sobre diversas variáveis, como tempera-túra, umidade, luminosidade e distância. Essas informações são transformadas em dados binários e processadas por um microcontrolador, quê, por meio de cálculos e equações, determina o valor da grandeza e, com isso, executa uma ação correspondente.
Os dados binários são originados de um sistema de numeração quê utiliza apenas dois dígitos, 0 e 1. Esse sistema permite, por exemplo, quê a presença ou a ausência de corrente elétrica seja interpretada como dado. Assim, os dígitos representam:
• 0 (zero): ausência de corrente elétrica ou nível de tensão baixo (off, quê significa “desligado” em tradução livre).
• 1 (um): presença de corrente elétrica ou nível de tensão alto (on, quê significa “ligado” em tradução livre).
O cóódigo binário é utilizado para estabelecer uma comunicação com as máquinas, por meio de programas elaborados com base em uma linguagem lógica. Por exemplo, considere o programa quê controla a elevação da tempera-túra do motor do carro e o acionamento de um aviso luminoso no painel.
Se tempera-túra < 95 °C, então apague a luz. Senão, acenda a luz.

Essa linguagem segue uma lógica estruturada e uma sintáksse específica, quê é convertida em cóódigo binário.
Página quatrocentos e quarenta e três
Apesar de sêr um sistema simples, é possível representar qualquer tipo de caractere. Acompanhe a seguir a escrita das lêtras maiúsculas do alfabeto em sistema binário. Um detalhe importante é quê as lêtras maiúsculas e as minúsculas têm códigos binários distintos.
lêtras maiúsculas do alfabeto em sistema binário
Letra |
cóódigo |
Letra |
cóódigo |
|---|---|---|---|
A |
01000001 |
N |
01001110 |
B |
01000010 |
O |
01001111 |
C |
01000011 |
P |
01010000 |
D |
01000100 |
Q |
01010001 |
E |
01000101 |
R |
01010010 |
F |
01000110 |
S |
01010011 |
G |
01000111 |
T |
01010100 |
H |
01001000 |
U |
01010101 |
I |
01001001 |
V |
01010110 |
J |
01001010 |
W |
01010111 |
K |
01001011 |
X |
01011000 |
L |
01001100 |
Y |
01011001 |
M |
01001101 |
Z |
01011010 |
Os termômetros digitais, por exemplo, utilizam metais, como platina, níquel e cobre, para medir a tempera-túra. A variação da tempera-túra provoca mudanças na resistência do metal. O valor da resistência é convertido em corrente elétrica, quê, por sua vez, transforma-se em dados binários apresentados no visor do equipamento.
Acompanhe outro exemplo. Para possibilitar uma resposta rápida a incêndios, é fundamental detectar rapidamente os produtos gerados pela combustão, como gás carbônico (na combustão completa) e monóxido de carbono (na combustão incompleta). Os sensores de fumaça detectam essas partículas no ar. Um tipo específico é o sensor de ionização, quê utiliza uma pequena porção de material radioativo (amerício-241) para ionizar o ar dentro do compartimento de detecção.
No compartimento de detecção, os íons geram uma corrente elétrica estável. Na presença dos gases produzidos na combustão, a corrente elétrica diminui, acionando o sistema de alarme. Dessa forma, o sensor cápta a informação e realiza as ações necessárias para combater o incêndio.

Agora, faça o quê se pede em cada item.
1. No caderno, apresente a diferença entre o sistema decimal utilizado no dia a dia e o sistema binário.
2. Utilize as informações presentes no texto e escrêeva o seu nome e o nome de um colega em cóódigo binário. Lembre-se de separar cada cóódigo quê representa uma letra com um espaço.
3. Apresente outros exemplos de equipamento e tipos de sensor. Escolha um dos sensores e explique, no caderno, seu funcionamento.
4. Elabore uma proposta para explicar e divulgar como funciona o bafômetro eletrônico. Considere o meio de divulgação (texto, imagens e vídeos) e inclúa explicações científicas, além de uma forma de conscientização sobre os perigos do consumo de bebida alcoólica associada à direção.
Página quatrocentos e quarenta e quatro