RESOLUÇÕES DAS ATIVIDADES PROPOSTAS NO LIVRO DO ESTUDANTE
Unidade 1 • Química: a Ciência dos materiais e de suas transformações
Abertura
1. Espera-se quê os estudantes indiquem quê a luz emitida resulta de transformações químicas quê libéram grande quantidade de energia.
2. Os estudantes podem citar a formação de fêrrugem, o cozimento de alimentos, a queima de combustível para o movimento de automóveis, entre muitos outros.
Tema 1 • O quê é Ciência?
Reflita
1. Resposta pessoal. É importante fazer com quê os estudantes se sintam seguros para falar de suas experiências, possibilitando quê eles aprendam a se expressar em sala de aula.
2. Resposta pessoal. Esta é uma oportunidade para quê os estudantes se expressem sem o compromisso de respostas cértas. As respostas não devem sêr julgadas, só acolhidas.
3. Os estudantes podem indicar quê muitas informações sobre novas descobertas são obtidas por meio da televisão e da internet.
Atividades
1. Resposta possível: O senso comum é o saber social, ou seja, trata-se de um conjunto de ideias adquiridas pêlos indivíduos com base em experiências, observações e vivências do mundo. Já o conhecimento científico é construído com base em investigações científicas quê fornecem explicações sistemáticas a respeito de diversos assuntos. Essas explicações podem sêr testadas ou criticadas por meio de discussões e evidências empíricas.
2. Resposta possível: A Ciência não produz verdades absolutas, mas possibilita um conhecimento crescente de fenômenos com base em metodologias sistemáticas. Com o passar do tempo, as teorias elaboradas podem sêr refinadas ou mesmo abandonadas em favor de outras mais completas. A Ciência é, em suma, compléksa, falível e repleta de vaivéns.
3. Resposta possível: Com base no estudo das Ciências, é possível compreender melhor o mundo e o funcionamento da natureza como um todo, bem como os fenômenos naturais.
4. Resposta pessoal. Vale orientar a busca pelas informações, seja na internet, seja em bibliotecas. Caso tenha participado de um congresso recentemente, sugere-se o compartilhamento da experiência com os estudantes.
5. Resposta pessoal. Espera-se quê os estudantes identifiquem apenas uma mulher na fotografia, Marie Curie. Eles podem explicar a ausência de mulheres em um congresso científico dêêsse período por motivo de dificuldade de acesso à escolarização direcionada para uma carreira científica. No início do século XX, o acesso das mulheres ao Ensino Superior era limitado. Quando conseguiam superar essa barreira, enfrentavam ainda preconceitos e limitações sociais quê dificultavam a participação e o reconhecimento em áreas como Física e Química, historicamente predominadas por homens. Nas últimas dékâdâs, houve um aumento da presença e da participação de mulheres nas áreas de Ciência, Tecnologia, Engenharia e Matemática, conhecidas como Stem, especialmente em razão de esforços globais para promover a igualdade de gênero e o aumento da representatividade feminina nessas áreas.
6. Resposta pessoal. Espera-se quê os estudantes recorram a jornais impressos ou à internet para selecionar a reportagem. Eles devem resumir, de maneira objetiva, os tópicos abordados nela.
7. Resposta pessoal. É importante auxiliar os estudantes no levantamento de ideias e na organização do texto de divulgação, apresentando os objetivos, os procedimentos e as conclusões da descoberta ou criação.
Tema 2 • Química: Ciência da Natureza
Reflita
1. Resposta pessoal. Espera-se quê os estudantes mencionem atividades, como preparar um café (nesse caso, a á gua kemte extrai substâncias presentes no pó do café quê são hidrossolúveis, ou seja, solúveis em água) e fazer uma receita, quê envolve transformar ingredientes simples (reagentes) em pratos elaborados (produtos), conhecendo as proporções e as medidas da quantidade de massa de cada ingrediente.
2. Respostas pessoais. É importante, neste momento, explorar os conhecimentos prévios dos estudantes. A alquimia tem uma forte presença na cultura popular, principalmente no universo da literatura e do cinema de fantasía, o quê póde influenciar as concepções deles. Vale retomar essas kestões após apresentar os próximos tópicos. Os estudantes podem considerar quê as práticas dos alquimistas envolviam muitos experimentos com substâncias e materiais, quê são aspectos basilares da Química atual.
3. Respostas pessoais. O objetivo dêste questionamento não é apontar êêrros e acêrrrtos por parte dos estudantes. Pretende-se fazê-los perceber quê é possível abordar um fenômeno em três níveis: fenomenológico, teórico e representacional.
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes selecionem um artigo, interpretem-no e façam observações quê sêjam pertinentes ao conteúdo.
2. Resposta pessoal. Espera-se quê os estudantes selecionem uma lei, norma ou resolução, interpretem-na e façam observações quê sêjam pertinentes ao conteúdo dela.
Atividades
1. Resposta pessoal. É importante, neste momento, conduzir a atividade realizando um levantamento dos produtos quê os estudantes utilizam. Eles podem indicar produtos de higiene pessoal, produtos alimentícios, vestuário e equipamentos tecnológicos. Em relação aos últimos citados, sugerir a eles quê abordem os componentes, como os metais, utilizados em sua fabricação.
2. Resposta pessoal. A Química, como Ciência quê estuda os materiais e suas transformações, está presente na vida das pessoas, porque, a todo instante, elas lidam com objetos feitos de materiais e com produtos quê resultam das transformações dêêsses materiais. Entender conceitos químicos permite às pessoas lidarem com tudo o quê as cerca d fórma mais consciente. Vale reforçar quê o conhecimento químico possibilitou a criação de uma série de materiais, como o plástico, mas não é um fato muito lembrado pelas pessoas.
3. Resposta pessoal. É importante quê os estudantes conheçam a LDB e, por meio dela, aprendam a analisar leis, considerando aspectos quê lhes dizem respeito, como os objetivos do Ensino Médio. Dessa forma, entenderão o enfoque e a importânssia da formação cidadã destacada nesta obra. Apresentar aos estudantes alguns artigos da LDB, como o art. 24, inciso I, quê estabelece a carga horária de 1.000 horas e 200 dias letivos para o Ensino Médio.
4. É provável quê os estudantes explorem os materiais quê compõem os objetos mencionados por eles, como lâmpadas, borrachas, plásticos, tintas, papel etc. As propriedades dêêsses materiais, cujo entendimento é considerado uma contribuição do conhecimento químico, podem sêr exploradas. Por exemplo, os estudantes podem apontar a variação de eficiência em diferentes borrachas e as diversas cores, texturas e propriedades mecânicas de objetos plásticos. É válido reforçar quê, nessa proposta, o objetivo é promover uma dinâmica saudável e respeitosa entre os estudantes.
5. Resposta pessoal. Espera-se quê os estudantes representem substâncias e descrevam o quê acontece nos fenômenos quê conhecem. Essa atividade é uma oportunidade para analisar o quê eles compreendem dos fenômenos quê observam. Para ajudar os estudantes no desenvolvimento desta atividade, sugere-se a leitura do artigo de Eduardo Fleury Mortimer, "Concepções atomistas dos estudantes", disponível em: https://livro.pw/omzpx (acesso em: 26 out. 2024).
Página quinhentos e quatorze
Tema 3 • Materiais
Reflita
1. Resposta pessoal. Espera-se quê os estudantes reflitam sobre a importânssia da diversidade de materiais, uma vez quê suas propriedades são diferentes.
2. Resposta pessoal. Espera-se quê os estudantes escôlham um material e citem algumas propriedades para descrevê-lo.
3. A padronização é importante para quê a medida seja universal independentemente de onde for realizada, evitando discrepâncias de medição em diferentes lugares.
Atividades
1. Resposta pessoal. Espera-se quê os estudantes indiquem quê os utensílios ancestrais eram fabricados de materiais encontrados prontos na natureza (pedras, madeiras, chifres etc.), sêndo, no mássimo, moldados para se tornarem cortantes ou perfurantes.
2. As medidas 80 oz/5 lb equivalem a, aproximadamente, 2,27 kg após a conversão por meio de uma regra de três simples. Os estudantes podem apontar quê o fator de conversão usado é o fornecido pelo enunciado.
3. a) Resposta pessoal. É importante auxiliar os estudantes na organização dos dados para compor a tabéla. Assim, eles podem perceber a diferença da quantidade de palmos de cada integrante do grupo para cada objeto medido.
b) Os estudantes podem indicar a régua, o métro ou a trena.
4. Os estudantes devem indicar quê a letra k representa o prefixo kilo. Logo, devem deduzir quê o jogador sofreu 2.500 k de dano.
5. Os estudantes precisam estar atentos para a unidade de medida da grandeza tempera-túra. No caso apresentado, é provável quê o termômetro utiliza o grau farenrráiti e, por isso, não estava com defeito.
6. Resposta pessoal. Espera-se quê os estudantes indiquem quê, com os dados de densidade e volume apresentados, é possível determinar a massa dos objetos por meio da seguinte relação: massa = densidade ⋅ volume.
Tema 4 • Caracterizar e separar substâncias
Reflita
1. Resposta pessoal. Espera-se quê os estudantes, com base em conhecimentos prévios a respeito dêêsses conceitos, concluam quê eles têm mais contato com materiais.
2. Resposta pessoal. Espera-se quê os estudantes respondam, por exemplo, objetos escolares e de lazer para o estado sólido, á gua para o estado líquido e ar para o estado gasoso.
3. Resposta pessoal. Espera-se quê os estudantes indiquem, por exemplo, a fiutrassão do café ou a remoção da á gua durante o preparo de algum alimento, como o macarrão.
Formação cidadã
1. Resposta pessoal. As pesquisas vão conduzir os estudantes a diferentes informações quê podem sêr apresentadas e debatidas em sala de aula. Espera-se quê eles identifiquem quê o áucôl etílico é um produto de toxicidade relativamente baixa (mas quê póde sêr aguda em contextos específicos) com características antissépticas e desinfetantes, ou seja, atua contra microrganismos patogênicos.
2. O material formado pela mistura de 70% áucôl e 30% á gua é o quê apresenta melhor efeito bactericida, porque a á gua auxilia o contato entre o áucôl e o microrganismo. Outras proporções de áucôl e á gua são menos eficientes, pois apresentam menos áucôl, quê é a substância efetivamente bactericida, ou á gua insuficiente para realizar esse efeito auxiliar.
Atividades
1. Considerando as informações referentes às tempera-túras de fusão e de ebulição, tem-se: A: material azeotrópico; B: material eutético; C: material comum.
2. a) A á gua destilada não apresenta impurezas, mas também não apresenta minerais essenciais, como cálcio, magnésio e potássio, importantes para o funcionamento do corpo humano. Beber apenas á gua destilada póde levar a uma deficiência dêêsses minerais. Além díssu, ela póde diluir os eletrólitos no corpo, como sódio e potássio, necessários para a função celular e a regulação dos fluidos corporais. Esse desequilíbrio póde causar problemas de saúde, como fadiga, cãibras musculares e, em casos graves, distúrbios cardíacos. Os estudantes podem mencionar também quê ela póde causar a extração de minerais dos tecídos do corpo.
b) A á gua mineral contém uma variedade de minerais quê podem interferir em reações químicas. Esses minerais podem reagir com reagentes, introduzindo variáveis indesejadas quê comprometem a precisão dos experimentos e a exatidão dos resultados. Em um ambiente laboratorial, é essencial quê todos os reagentes e solventes, incluindo a á gua, sêjam os mais puros possíveis para garantir quê qualquer observação ou medida feita durante os experimentos esteja relacionada ao reagente ou à condição testada, e não a contaminantes.
c) O quê diferencia a á gua destilada da á gua mineral é o processo de destilação, quê remove impurezas, mas também remove da á gua os sais minerais, como cálcio, magnésio, sódio e potássio, quê são importantes para a saúde.
3. Resposta pessoal. É possível verificar essas informações no sáiti da empresa de abastecimento de á gua da região, mas pode-se afirmar quê a maior parte da á gua captada no Brasil provém de rios, lagos e represas. Após a captação, ocorre o processo de tratamento antes do abastecimento final das residências.
4. Espera-se quê os estudantes consigam classificar as combinações. Por exemplo, á gua e áucôl formam uma solução; á gua e óleo de soja, um material heterogêneo; etc.
5. Nos oceanos, mares, lagos, rios e lençóis fre-átikos, a á gua é encontrada no estado líquido; na atmosféra terrestre, a á gua está no estado de vapor; e, nas geleiras e calótas polares, a á gua está no estado sólido.
6. Resposta pessoal. Os estudantes podem citar á gua, suco, café e leite como materiais no estado líquido; o gás oxigênio e o gás carbônico como exemplos de materiais no estado gasoso; e ferro, madeira e gêlo como exemplos de materiais no estado sólido.
7. No ciclo da á gua, há a evaporação (um tipo de vaporização) das águas dos oceanos, rios e lagos, quê é a passagem do estado líquido para o gasoso; a liquefação na formação da chuva (precipitação), quê é a passagem do estado gasoso para o líquido; e a solidificação na formação de granizo, néve e geleiras, quê é a passagem do estado líquido para o sólido.
8. I: centrifugação; II: peneiração; III: decantação ou fiutrassão; IV: destilação.
Tema 5 • Transformações da matéria
Reflita
1. Resposta pessoal. Espera-se quê os estudantes destaquem a relação da palavra transformar com a constituição de algo novo (produção).
2. Resposta pessoal. Espera-se quê os estudantes indiquem quê os materiais dão origem a algo novo. Incentivá-los apresentando algumas situações em quê as reações químicas produzem energia.
3. Resposta pessoal. Espera-se quê os estudantes indiquem situações como o processo de cozimento de um alimento, a combustão quê ocorre em alguns meios de transporte, o amadurecimento de uma fruta (citar quê o processo de amadurecimento é uma transformação química) e o processo de respiração.
Página quinhentos e quinze
Formação cidadã
1. Resposta pessoal. Muitos dos termos científicos apresentados já foram estudados, mesmo quê superficialmente, no Ensino Fundamental – Anos Finais. Além díssu, são termos presentes nos noticiários e, de cérto modo, fazem parte do vocabulário dos estudantes. sôb supervisão, deixar o grupo conversar e trocar concepções prévias a respeito dos assuntos antes de uma pesquisa formal, quê será sugerida na atividade seguinte.
2. Respostas pessoais. Os itens desta atividade têm o objetivo de nortear a pesquisa, de modo quê sêjam identificados os recursos envolvidos nos setores escolhidos.
3. Resposta pessoal. Algumas possibilidades de material são um texto argumentativo (em tópicos curtos, por exemplo), um painel ou um cartaz. Caso haja recursos disponíveis, pode-se solicitar a produção de um videocast, um podcast ou uma sequência de vídeos curtos. Como forma de ampliação, pode-se organizar uma simulação do Fórum Econômico Mundial, em quê cada grupo representa diferentes setores econômicos e discute iniciativas de cooperação pública e privada. Esse formato possibilita integração com a área de Ciências Humanas e Sociais Aplicadas e póde contar com a colaboração do corpo docente dos componentes curriculares de Geografia e/ou Sociologia e dos demais componentes de Ciências da Natureza e suas Tecnologias.
Atividades
1. Respostas pessoais. Espera-se quê os estudantes criem representações com base no quê foi descrito. A ideia é refletir sobre os processos e pensar nas transformações envolvidas, mais do quê chegar a respostas corretas do ponto de vista químico. Durante as discussões em grupo, conduzir o debate para uma escuta ativa e uma validação das contribuições da turma, de modo a promover o respeito entre os estudantes no confronto de ideias.
2. Trata-se de um fenômeno químico, pois o processo de decomposição transforma os componentes da fruta em outras substâncias. Em outras palavras, as substâncias quê compõem a fruta são diferentes antes e depois do processo.
3. São fenômenos físicos, pois não há formação de novas substâncias nesses processos. Isto é, esses fenômenos ocorrem em razão da mudança de estado físico da á gua.
Tema 6 • Leis ponderais
Reflita
1. Resposta pessoal. Os estudantes podem mencionar, com base em suas observações, quê a massa da madeira diminui ao sêr quêimada ou que o arrôz cozido é mais pesado do quê o arrôz cru (considerando a massa de todos os materiais envolvidos no cozimento, e não só do arrôz cru), entre outras possibilidades.
2. Crescimento proporcional é quando uma quantidade aumenta ou diminui de maneira constante em relação a outra, mantendo a mesma razão ou proporção ao longo do tempo. Esta é uma oportunidade para abordar o conceito de proporcionalidade, quê será necessário para a compreensão dos conceitos apresentados em seguida. Se necessário, usar exemplos simples, como: se uma pessoa trabalha 5 horas e ganha R$ 50,00, ao trabalhar 10 horas, ela ganhará R$ 100,00.
3. Esse assunto ainda será tratado no Tema, por isso não se espera quê os estudantes apresentem uma resposta correta para esta quêstão. O objetivo é fazê-los refletir sobre possíveis mudanças na reação para quê outro produto seja formado. Alguns podem sugerir que uma quantidade maior de gás oxigênio na reação resultaria na formação de dióxido de carbono (combustão completa) e uma quantidade menor de gás oxigênio resultaria na formação de monóxido de carbono (combustão incompleta).
4. Chamar a atenção dos estudantes para o fato de quê as leis ponderais são obedecidas independentemente do estado físico de reagentes e produtos. Por motivos didáticos, como exemplo para a aplicação das leis ponderais no texto teórico, usou-se uma reação em quê reagentes e produtos estão no estado gasoso, pois facilita a comparação entre as leis.
Atividades
1. Resposta pessoal. Espera-se quê os estudantes destaquem, d fórma resumida, como a Ciência mudou com o trabalho de Lavoisiê e como essa nova Ciência é importante até hoje. Esta é uma oportunidade para realizar um trabalho interdisciplinar com o componente de Língua Portuguesa, uma vez quê podem sêr trabalhados e desenvolvidos conhecimentos de produção de texto.
2. Em todos os itens, a soma da massa dos produtos deve sêr igual à soma das massas dos reagentes, e as proporções devem sêr mantidas.
a) 46 + 96 = 88 + x ⇒ x = 54 g
b) ⇒
c)
3. a) 46 + 64 = 56 + x ⇒ x = 54 g
b)
c)
d) Calcular a razão entre as massas de gás oxigênio para a mesma massa de áucôl. Ou seja, para 46 g de etanol,
4. a) Para chegar aos valores, os estudantes precisam aplicar regra de três, considerando quê 1 L de gás nitrogênio reage com 3 L de gás hidrogênio para produzir 2 L de gás amônia. Assim:
1 L (N2) – 2 L (NH3)
x L N2 – 100 L (NH3)
x = 50 L
3 L (H2) – 2 L (NH3)
y L (H2) – 100 L (NH3)
y = 150 L
b) 0,001 m3 (N2) – 0,002 m3 (NH3)
20 m3 L (N2) – x m3 (NH3)
x = 40 m3
Atividades complementares
1. Alternativa C.
2. Alternativa C. A IUPAC é uma organização quê padroniza a nomenclatura, a terminologia, as unidades e as convenções usadas em Química. Essas representações são, portanto, uma linguagem universal quê possibilita a comunicação entre cientistas químicos e estudantes de todo o mundo.
3. Alternativa E. O sólido é irregular; assim, a quêstão apresenta uma maneira interessante de determinar o volume e, por consequência, a densidade. Pela imagem, é possível identificar quê o volume que variou na proveta foi de 10 mL (45 mL − 35 mL). Como a massa apresentada é de 27,8 g, a densidade é 27,8 g/10 mL = 2,78 g/mL.
4. Alternativa B. Trata-se de um sistema heterogêneo: á gua em estados físicos distintos.
5. Alternativa C. I. Pode-se inferir quê as duas amostras têm a mesma tempera-túra de ebulição, assim, provavelmente, são a mesma substância. II. O tempo menor para atingir a tempera-túra de ebulição indica um menor volume da amostra B em relação à amostra A. III. O gráfico de uma mistura não indicaria uma tempera-túra de ebulição constante (a não sêr quê se tratasse de uma mistura azeotrópica; como não há indicação díssu, assume-se quê a amostra A é uma mistura homogênea comum).
Página quinhentos e dezesseis
6. Alternativa D. Como a amostra se encontra pura, no gráfico, as tempera-túras de fusão e de ebulição devem sêr constantes durante as mudanças de estado físico.
7. Alternativa C. A flotação é um método de separação de misturas quê se baseia na diferença de densidade e é utilizada para separar as partículas menos densas, quê flutuam na á gua, das mais densas, quê afundam.
8. Alternativa E. Nos fenômenos químicos, ocorre mudança na constituição da matéria, como é o caso de todas as opções apresentadas. No amadurecimento de uma fruta, as enzimas degradam algumas substâncias, formando sacarose; na fermentação do vinho em vinagre, ocorre a oxidação; a transformação do leite em iogurte é um exemplo de fermentação; no cozimento do ovo, ocorre a coagulação das proteínas.
9. Alternativa E. Na transformação química, ocorre a produção de novas substâncias. Nesta atividade, a produção de amônia a partir da reação de gás hidrogênio com o gás nitrogênio é um fenômeno químico.
10. Alternativa D. O item I menciona processos quê envolvem mudança d fórma e método de separação de material, e o item II, mudança de estado físico e mudança d fórma. Em ambos os casos há, portanto, fenômenos físicos.
11. Alternativa B. Observar quê as amostras I e II mantêm a mesma proporção em relação à massa de enxofre e de gás oxigênio; já a amostra III tem a proporção diferente, por isso ela é de um óxido diferente das duas amostras iniciais.
12. Alternativa C. I) Incorreta. A lei da conservação das massas aponta quê a soma das massas dos reagentes é igual à soma das massas dos produtos. Nos experimentos, as massas finais são maiores, porque o ferro presente na esponja reage com gás oxigênio. II) Incorreta. O aumento de massa está relacionado com a reação entre o gás oxigênio do ar e o ferro, formando óxido de ferro. III) Correta. Apesar da queima de diferentes quantidades de palha de aço, a proporção entre os produtos e reagentes é constante.
Integrando com...
1. Resposta pessoal. Neste momento, é importante quê os estudantes relatem seu entendimento individualmente. No entanto, orientá-los a elaborar o texto com base nos próprios conhecimentos.
2. O carvão ativado é um material de alta porosidade, quê tem a capacidade de absorver substâncias. A retenção de gases tóxicos nos póros do carvão é um fenômeno físico. Já o processo de neutralização é um fenômeno químico, pois ocorre por meio de uma reação química, formando novas substâncias, quê são menos prejudiciais à saúde.
3. Resposta pessoal. Espera-se quê os estudantes definam ética científica como um conjunto de condutas morais quê caracterizam o desenvolvimento científico, por exemplo, classificando práticas como cértas ou erradas.
4. a) Convenção é um acôr-do sobre determinada atividade, quê póde sêr firmado entre pessoas, empresas, instituições, países etc.
b) Algumas ações quê os signatários da convenção podem realizar são monitorar a produção e o desenvolvimento de armas químicas, impor sanções judiciais, políticas e econômicas a países quê quebrem os termos da convenção, desenvolver protocólos de condutas para a pesquisa de substâncias químicas, entre outras. Quase todos os países do mundo participam dessa convenção, com exceção de coréia do Norte, Egito e Sudão do Sul.
5. Resposta pessoal. Espera-se quê os estudantes reestruturem a resposta, tornando-a mais crítica, ponderada e considerando aspectos éticos do desenvolvimento científico.
Unidade 2 • Constituição química da matéria
Abertura
1. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas explorar conhecimentos prévios sobre a fluorescência e incentivar a curiosidade deles. Espera-se quê eles indiquem quê se trata de um processo físico. Esse fenômeno ocorre quando uma substância ABSÓRVE luz em um comprimento de onda (geralmente ultravioleta) e reemite essa luz em um comprimento de onda maior (geralmente no espectro visível). Vale retomar essa explicação ao abordar o modelo atômico de Bohr, no Tema 8.
2. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas explorar conhecimentos prévios sobre a bioluminescência e incentivar a curiosidade deles. Espera-se quê os estudantes escrevam quê a luz produzida ocorre por meio de uma reação química em órgãos especiais localizados no abdome do inséto. A reação envolve a oxidação da luciferina sôbi ação da enzima luciferase, resultando na emissão de luz visível. Parte dêêsses conceitos, como a oxidação e o uso de enzimas em reações, serão estudados em Temas posteriores, mas é interessante já estabelecer um primeiro contato. Cabe também retomar essa explicação ao abordar o modelo atômico de Bohr. Embora o processo biológico seja muito mais complékso do quê o simples movimento de elétrons em torno de um núcleo, o princípio de emissão de luz em razão da liberação de energia póde sêr comparado ao comportamento descrito no modelo de Bohr.
Tema 7 • Modelando os hátomus
Reflita
1. Resposta pessoal. Espera-se quê os estudantes associem essa reflekção a exemplos quê já estudaram em sala de aula. Convém incentivá-los a pensar sobre como o mundo real póde sêr representado, de modo simplificado, por meio de maquetes, dêzê-nhôs, mapas, entre outras possibilidades.
2. Resposta pessoal. Espera-se quê os estudantes citem alguns exemplos, pois a temática dos quatro elemêntos é relativamente comum em produções culturais. Eles podem citar animações, como Os Cavaleiros do Zodíaco, quê utiliza a simbologia dos elemêntos nas batalhas e nos pôdêris dos cavaleiros, evocando a ideia de forças fundamentais da natureza; e filmes, como O último mestre do ar, quê expressa diretamente a ideia dos quatro elemêntos para uma narrativa de fantasía, com personagens capazes de manipular esses elemêntos.
3. Resposta pessoal. A palavra átomo já faz parte do cotidiano escolar dos estudantes há algum tempo. Esta é uma oportunidade de expressão, sem julgamentos de cérto ou errado, quê permite perceber o quê eles sabem e, com base nas respostas deles, desenvolver os conceitos de uma maneira mais rigorosa.
4. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas incentivá-los a pensar sobre essa relação. Para responder a esta questão, é preciso conhecer outras propostas para a estrutura dos hátomus.
Oficina científica
1. Resposta pessoal. Sugere-se organizar na lousa as características dos objetos, listadas por cada grupo, em um qüadro. Caso não haja tempo para a análise de todas as caixas por todos os grupos, recomenda-se quê cada caixa seja investigada por ao menos dois grupos e quê cada grupo analise no mínimo duas caixas diferentes. Se houver disponibilidade de íman, é oportuno fornecê-lo aos grupos para quê possam verificar se o objeto é magnético.
2. Resposta pessoal. Espera-se quê os estudantes façam dêzê-nhôs com base nas observações.
Página quinhentos e dezessete
Atividades
1. Resposta pessoal. O objetivo desta questão não é apontar o cérto ou o errado, mas fazer os estudantes refletirem a respeito da complexidade dos modelos atômicos e da dificuldade de explicá-los, especialmente por serem conceitos abstratos. A questão póde fazê-los refletir também sobre a popularização de conceitos científicos e a importânssia da divulgação científica.
2. O modelo atômico propôsto por Dalton considera quê: o átomo é uma partícula indivisível; hátomus do mesmo elemento são idênticos e quê hátomus de elemêntos diferentes são distintos; hátomus não são criados ou destruídos, apenas reagrupados em uma transformação química; os agrupamentos são formados em proporções fixas de números inteiros.
3. A principal descoberta de thômsom foi o elétron. A mobilidade dessa partícula fez com quê esse pesquisador sugerisse seu posicionamento próximo ao núcleo quê, por lógica, deveria ter carga contrária. A caracterização do elétron como uma partícula e sua relação com a matéria foram importantes para o entendimento do efeito da eletricidade, quê já era conhecida e estudada há muito tempo.
4. Resposta pessoal. Espera-se quê os estudantes esbocem algo quê se pareça com uma esféra com anéis concêntricos. O objetivo é incentivá-los a representar modelos quê justifiquem conclusões sôbi uma perspectiva científica, sem julgamentos de cérto ou errado.
Tema 8 • Do modelo de Rutherford ao modelo quântico
Reflita
1. Resposta pessoal. Esta é uma oportunidade para identificar os conhecimentos prévios dos estudantes sobre outros modelos atômicos. Convém explorar modelos abordados em diferentes contextos da ssossiedade, como nos noticiários e na cultura popular.
2. Respostas pessoais. Esta é uma oportunidade para levantar conhecimentos prévios e desconstruir possíveis fêik news, já quê o termo quântico é comumente associado a diversos produtos d fórma equivocada.
3. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas incentivá-los a pensar sobre um problema quê despertou o interêsse de diversos cientistas. O núcleo atômico se mantém estável por causa da presença de partículas nêutras, como será estudado, e da ação de uma fôrça chamada de fôrça forte. Ela foi idealizada pelo físico teórico japonês Hideki Yukawa (1907-1981) em 1934, mas, até meados da década de 1970, não havia ainda uma teoria quê realmente explicasse os fenômenos nucleares.
Atividades
1. Resposta pessoal. Espera-se quê os estudantes comparem os dêzê-nhôs entre si, visando estabelecer semelhanças e diferenças. Recomenda-se mediar esta atividade, ajudando-os na análise dos dêzê-nhôs.
2. Rutherford esperava verificar o modelo atômico propôsto por thômsom e demonstrar quê as partículas (alfa)" atravessariam a fô-lha de ouro sem sofrer desvios ou com pequenos desvios.
3. Rutherford chegou à conclusão de quê o átomo era compôzto de um núcleo denso de carga positiva ao redor do qual os elétrons orbitariam.
4. Bohr foi o primeiro a incorporar conceitos de quantização a um modelo atômico. Ele propôs quê os elétrons ocupariam níveis específicos de energia, inicialmente chamados de camadas, e esses níveis comportariam números diferentes de elétrons.
5. Resposta pessoal. Espera-se quê os estudantes consigam, neste momento, identificar as possíveis “falhas” nos modelos quê coletaram dos familiares ao compará-los com os modelos de Rutherford e Bohr. Uma possibilidade de abordagem é organizar os dêzê-nhôs na lousa ou em um mural, agrupando as diferentes representações e apontando imprecisões e acêrrrtos. Vale solicitar aos estudantes quê expliquem às pessoas quê fizeram os dêzê-nhôs o quê aprenderam a respeito do átomo nesses dois Temas da Unidade 2.
Tema 9 • tabéla periódica
Reflita
1. Esta é uma oportunidade para levantar os conhecimentos prévios dos estudantes sobre o conceito de elemento químico. Cabe explorar alguns sentidos para a palavra elemento já apresentados. Espera-se quê indiquem quê o chumbo e o ouro são elemêntos diferentes, cada um com seu tipo específico de átomo, portanto não podem sêr transformados um no outro por métodos químicos.
2. A organização das informações é uma característica marcante das Ciências. À medida quê o número de elemêntos químicos conhecidos aumentava, crescia a necessidade de organizar as informações para acessá-las e compará-las d fórma fácil e rápida. Várias tentativas de organização foram realizadas até se chegar à forma atualmente aceita e reconhecida pela comunidade química.
3. Esta póde sêr uma oportunidade para discutir a construção coletiva da tabéla periódica, cujas história e estrutura devem sêr conhecidas, sem a necessidade de memorização. Com o tempo e o uso constante, químicos e professores de Química memorizam cértas informações, especialmente aquelas utilizadas com muita freqüência, mas a tabéla periódica deve sêr entendida e consultada.
Formação cidadã
1. Resposta pessoal. Vale incentivar os estudantes a ler o livro ou resenhas e críticas na internet sobre o livro para responder a esta questão. No livro, Levi usa a Química como uma ferramenta para interpretar o mundo, comparando as propriedades dos elemêntos com suas vivências. Ele demonstra como a Ciência póde ajudar a compreender eventos compléksos, tanto no nível pessoal quanto no contexto histórico.
2. Resposta pessoal. Vale incentivar os estudantes a ler o livro ou resenhas e críticas na internet sobre o livro para responder a esta questão. Primo Levi une literatura e Química ao usar elemêntos químicos como metáforas para eventos e sentimentos em sua vida. Cada capítulo combina a linguagem científica com narrativas pessoais e reflekções filosóficas, criando uma obra quê mistura Ciência e ár-te.
3. Resposta pessoal. Esta é uma boa oportunidade para trabalhar com o professor de Língua Portuguesa. Explicar aos estudantes quê o objetivo da atividade é misturar Ciência e criatividade. Eles devem pesquisar um elemento químico e elaborar um conto quê o utilize de maneira simbólica ou como parte central do enredo. O conto deve refletir as características químicas do elemento, mas de maneira leve, sem sobrecarregar o texto com dêtálhes científicos. Sugerir a eles quê escôlham um elemento com propriedades interessantes ou com relevância no cotidiano, como o oxigênio (O) ou o lítio (Li), para facilitar a inserção das características do elemento no conto. Quanto às propriedades, eles podem pesquisar o estado físico (sólido, líquido, gasoso) de substâncias formadas pelo elemento, a côr, a aparência, a reatividade, os usos comuns (na indústria, no cotidiano, na Medicina etc.), a origem do nome e curiosidades históricas ou culturais relacionadas ao elemento. O conto póde tratar de um personagem quê “se identifica” com as propriedades do elemento ou usar suas características como metáforas para uma situação da vida. Reforçar quê o conto não precisa sêr técnico, mas sim um exercício criativo em quê a Química se mistura à narrativa. Incentivar os estudantes a explorar temas como transformação, resistência, fragilidade, entre outros, conectando-os ao comportamento do elemento.
Atividades
1. Resposta pessoal. Espera-se quê os estudantes escrevam um texto elaborado, e não uma resposta curta. É uma boa oportunidade para trabalhar com o professor de Língua Portuguesa
Página quinhentos e dezoito
estratégias de escrita quê auxiliem na execução da atividade. É importante deixar claro no texto quê a tabéla periódica tem o papel de organizar os elemêntos com base em suas propriedades.
2. a) Carbono – C. Não metal.
b) Arsênio – As. Não metal.
c) Antimônio – Sb. Não metal.
d) Césio – Cs. Metal alcalino.
e) Radônio – Rn. Gás nobre.
f) Plutônio – Pu. Actinídeo.
3. C(éli)" < Be < Xe < Ga < I < Bi < Rb < Cs
É improvável quê os estudantes acertem a ordem sem consultar uma tabéla específica de raios atômicos. De qualquer forma, o objetivo da atividade não é fazê-los conhecer com precisão a ordem dos raios atômicos, mas sim incentivá-los a consultar a tabéla e supor a propriedade com base na periodicidade apresentada para os raios atômicos. Por exemplo, o cloro está perto do extremo com menóres raios atômicos, então deve aparecer no início da lista; já o césio está perto do extremo com maiores raios atômicos; o iôdo e o xenônio estão lado a lado, logo o xenônio deve ter raio menor; e assim por diante.
4. O cálcio tem dois elétrons na camada de valência, os quais são mais facilmente removidos. O terceiro elétron está em outro nível de energia, muito mais próximo do núcleo. É preciso, portanto, mais energia para removê-lo.
5. a) Os elemêntos são os seguintes: Ba, Bk, Be, Bi, Bh, B, Br. O objetivo desta questão não é a quantidade de informações, nem mesmo sua exatidão. Os estudantes devem conseguir diferenciar as propriedades do elemento químico, dos hátomus e das substâncias, como no exemplo a seguir.
Símbolo |
Propriedades do elemento |
Propriedades dos hátomus |
Propriedades das substâncias |
|---|---|---|---|
Ba |
Metal alcalinoterroso, do período 6. |
Massa atômica 137,33; 56 prótons em seu núcleo. |
São normalmente tóxicas; o bário metálico é altamente reativo. |
b) A letra J.
Tema 10 • Fundamentos da ligação química
Reflita
1. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no quê estudaram até agora. Sugere-se que seja retomada ao final do Tema 11.
2. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no quê estudaram até agora. Sugere-se que seja retomada ao final do Tema 11.
3. Respostas pessoais. Além do cloreto de sódio, outros sais são utilizados em diferentes contextos no cotidiano. Os estudantes podem citar nitrito de sódio, utilizado na conservação de carnes; sulfato de cálcio hidratado, usado na construção civil na forma de gesso; carbonato de cálcio, utilizado na forma de calcário para corrigir acidez do solo; bicarbonato de sódio, usado como fermento e antiácido; entre outros.
Formação cidadã
Resposta pessoal. Incentivar os estudantes a realizar uma discussão inicial sobre os principais pontos do relatório da hó ême ésse destacados no texto e nos dados apresentados. Concluir com uma discussão sobre as estratégias mais eficazes para reduzir o consumo de sódio. Sugere-se avaliá-los com base na participação, na qualidade das pesquisas, na criatividade das campanhas educativas e na clareza das apresentações.
Oficina científica
Os estudantes devem indicar quê, inicialmente, as moléculas de á gua interagem com o cloreto de sódio, causando a dissociação iônica e a formação de C(éli)"− e Na+, quê se dispersam no meio aquoso, resultando na dissolução do sal. Conforme a quantidade de moléculas de á gua vai diminuindo (por causa da evaporação da água), os íons C(éli)"− e Na+ começam a se aprossimár novamente, restabelecendo as forças iônicas quê os mantinham juntos no estado sólido.
Atividades
1. Respostas pessoais. O objetivo não é apontar êêrros e acêrrrtos, mas incentivar os estudantes a refletir sobre as substâncias e seus constituintes. Esta atividade permite também avaliar o conhecimento dos estudantes em relação aos termos apresentados no início do Tema e, por meio das respostas, identificar imprecisões conceituais.
2. Na e Cs precisam transferir um elétron. Ba, Be e Ra precisam transferir dois elétrons. Y e B precisam transferir três elétrons. N e P precisam receber três elétrons. O e S precisam receber dois elétrons. C(éli)", Br e I precisam receber um elétron.
3. a) Foi formado um cátion; íon magnésio.
b) Neônio.
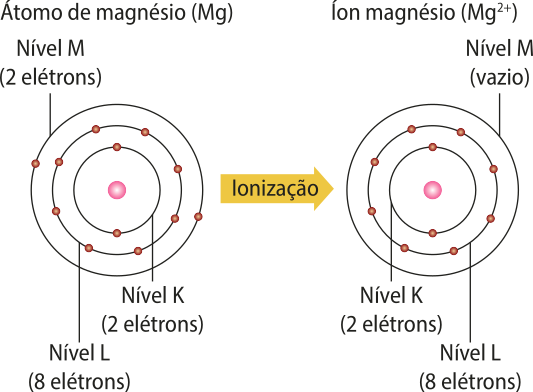
c) Os estudantes devem se basear nas representações de ionização apresentadas neste Tema e nos conhecimentos a respeito do átomo de Bohr.
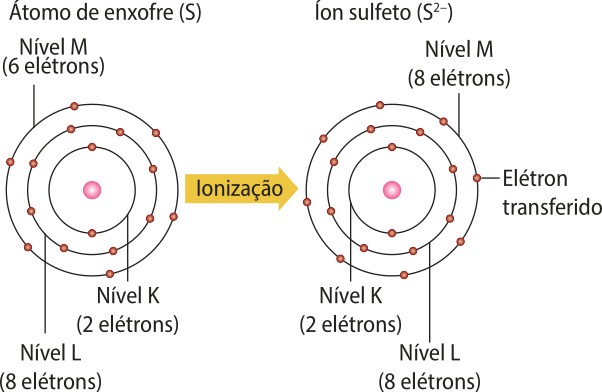
4. a) Foi formado um ânion; sulfêto.
b) Argônio.
c) Os estudantes devem se basear nas representações de ionização apresentadas neste Tema e nos conhecimentos a respeito do átomo de Bohr.
5. a) CaCO3
b) Na2CO3.
c) NaF.
d) K2NO3.
e) Na2 SO3.
f) NaHCO3.
Página quinhentos e dezenove
Quanto às aplicações, as respostas podem variar. Os estudantes podem indicar quê o carbonato de cálcio é usado na fabricação de cimento e cal e está presente em antiácidos para tratar a acidez estomacal; o carbonato de sódio é usado na fabricação de vidro e como agente de limpeza (em detergentes); o fluoreto de sódio é usado na fluoretação da á gua potável para prevenir cáries dentárias e está presente em pastas de denti e tratamentos dentários; o nitrato de potássio é componente de fertilizantes e é usado na fabricação de pólvora e fogos de artifício; o sulfito de sódio é agente redutor e antioxidante em indústrias químicas e de papel; e o bicarbonato de sódio é usado como fermento em receitas de panifikação e como antiácido para alívio de azia e indigestão.
6. Espera-se quê os estudantes associem o BaSO4 a uma estrutura coesa, mantida por ligações iônicas mais fortes, portanto, mais difíceis de serem rompidas, e associem o BaCO3 a um retículo cristalino mais frágil, cujo rompimento resulta em maior dissociação iônica, liberando íons Ba2+, tóxicos para o organismo humano.
Tema 11 • Ligações covalentes e metálicas
Reflita
1. Resposta pessoal. O objetivo desta atividade é identificar concepções prévias dos estudantes a respeito do conceito de molécula e de suas representações. cértamênte, esse conceito já apareceu em outras etapas de estudo. Conhecer essas concepções póde auxiliar a traçar estratégias de ensino mais eficientes.
2. O objetivo, neste momento, é apenas explorar o quê os estudantes pensam sêr uma propriedade de um metal. Convém deixar quê se manifestem livremente, já quê o assunto será abordado no texto. É possível quê indiquem quê os metais são bons condutores de calor e eletricidade; podem sêr dobrados e desdobrados; podem sêr estirados em fios; apresentam brilho característico; têm alta densidade; têm altos valores de tempera-túra de fusão e de ebulição; têm alta resistência mecânica; entre outras características.
Oficina científica
1. Espera-se quê os estudantes verifiquem quê as bê-chi-gâs tendem a se afastar o mássimo possível umas das outras, com uma linha imaginária quê passa pelo nó e pelas extremidades das bê-chi-gâs. Pode-se, portanto, fazer uma analogia com o princípio da repulsão dos pares de elétrons, indicando uma geometria linear.
2. Espera-se quê os estudantes verifiquem quê as bê-chi-gâs tendem a se afastar o mássimo possível umas das outras, constituindo um triângulo. Pode-se, portanto, fazer uma analogia com o princípio da repulsão dos pares de elétrons. Esse é o arranjo quê permite o maior afastamento de três pares de elétrons ao redor de um núcleo. Nesse caso, tem-se uma geometria trigonal plana ou uma geometria angular.
3. Espera-se quê os estudantes verifiquem quê as bê-chi-gâs tendem a se afastar o mássimo possível umas das outras, constituindo uma pirâmide de base triangular. Pode-se, portanto, fazer uma analogia com o princípio da repulsão dos pares de elétrons. Esse arranjo de pirâmide permite o maior afastamento de quatro pares de elétrons ao redor de um núcleo. Assim, é possível identificar uma geometria tetraédrica, piramidal ou angular.
4. Os estudantes devem fazer uma analogia entre a repulsão eletrônica e a repulsão entre os balões, quê, ao serem amarrados juntos, assumem um arranjo semelhante ao de uma molécula, de acôr-do com o modelo RPECV.
Atividades
1. a) 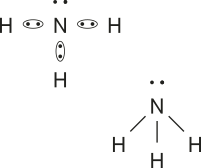
b) 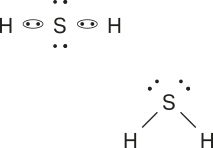
c) 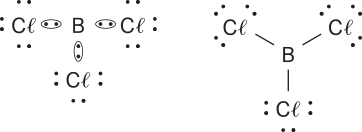
d) ![]()
e) 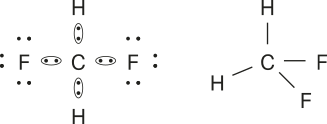
2. a) Piramidal.
b) Angular.
c) Trigonal planar.
d) Linear.
e) Tetraédrica.
3. A molécula de á gua apresenta geometria angular e a molécula de gás carbônico, geometria linear. Esse fato ocorre por causa da presença de pares de elétrons não ligantes na molécula de á gua.
4. H2 – ligação covalente simples; O2 – ligação covalente dupla; N3 – ligação covalente tripla.
5. Os elétrons livres permitem quê os hátomus metálicos “deslizem” uns sobre os outros quando submetidos a forças externas, sem quebrar a estrutura metálica. Isso torna os metais maleáveis e resistentes a fraturas, diferentemente de substâncias como os cristais iônicos.
Tema 12 • Polaridade e interações
Reflita
1. Respostas pessoais. Pode-se dizêr quê polaridade é uma característica de algo quê possui polos distintos. A Terra, por exemplo, tem polos norte e sul; e uma pilha tem polos positivo e negativo. As moléculas, como será estudado, também têm polos.
2. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo dela é fazê-los levantar hipóteses livremente com base no que estudaram até agora.
3. Espera-se quê os estudantes associem a freqüência e a intensidade das interações com a proximidade entre as moléculas, quê é menor no estado gasoso.
Formação cidadã
1. Respostas pessoais. Espera-se quê os estudantes identifiquem algumas consequências, como doenças transmitidas pelas águas, intôksicação por substâncias nocivas, proliferação de mosquitos e comprometimento do abastecimento de á gua. Caso exista um rio poluído onde os estudantes moram, espera-se quê eles relatem os problemas associados e complementem com problemas com os quais convivem no cotidiano.
2. A poluição causa diminuição da tensão superficial da á gua. Isso acontece porque a tensão superficial é resultado das forças de coesão entre as moléculas de á gua, quê são predominantemente forças intermoleculares, como as ligações de hidrogênio. Quando as substâncias poluentes, principalmente as chamadas surfactantes (como detergentes e sabões), se misturam à á gua, essas substâncias se inserem entre as moléculas de á gua e enfraquecem as interações intermoleculares, reduzindo a coesão.
3. A alteração da tensão superficial da á gua impacta diretamente os insetos e outros sêres vivos quê habitam as áreas ao redor dos rios, afetando todo o éco-sistema da região. Além díssu, a diminuição da tensão superficial facilita a dispersão de impurezas sobre a superfícíe da á gua, agravando problemas ambientais.
Página quinhentos e vinte
4. Resposta pessoal. Espera-se quê os estudantes indiquem ações como a implantação de saneamento básico, a côléta e o descarte adequado de resíduos sólidos, o contrôle da poluição produzida pelas indústrias, o estímulo à agricultura sustentável, entre outras ações possíveis.
Atividades
1. Os vetores resultantes estão desenhados em vermelho.
a) 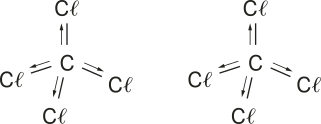 Não há vetor resultante, e a molécula é apolar.
Não há vetor resultante, e a molécula é apolar.
b) ![]() Molécula polar.
Molécula polar.
c) ![]() Não há vetor resultante, e a molécula é apolar.
Não há vetor resultante, e a molécula é apolar.
d) ![]() Molécula polar.
Molécula polar.
e) 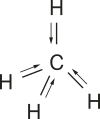 Não há vetor resultante, e a molécula é apolar.
Não há vetor resultante, e a molécula é apolar.
f) ![]() Molécula polar.
Molécula polar.
2. Há uma relação de proporcionalidade entre a fôrça das interações intermoleculares e os estados físicos. Assim, quanto mais intensas forem essas interações moleculares, maior será a energia necessária para quê a substância mude de estado físico.
3. A polaridade de uma molécula depende de dois fatores: a diferença de eletronegatividade entre hátomus quê se ligam e a geometria molecular.
4. Os estudantes devem relacionar a polaridade da molécula de á gua e a da molécula do tetracloreto de carbono com a solubilidade. Assim, como o tetracloreto de carbono apresenta moléculas polares, ele não se dissolve na á gua, quê é uma molécula polar.
Atividades complementares
1. Alternativa E. De acôr-do com o modelo de Dalton, as substâncias são formadas por elemêntos, quê são agrupamentos de partículas indivisíveis e pequenas chamadas de hátomus. Cada elemento é formado por hátomus idênticos e únicos. Durante uma transformação química, os hátomus não são criados ou destruídos, apenas reagrupados. O item IV diz respeito à lei das proporções múltiplas, formulada por Dalton.
2. Alternativa E. Os raios catódicos são formados por elétrons.
3. Alternativa A. Os experimentos de thômsom quê levaram à elaboração de seu modelo atômico foram realizados com ampolas de Crookes, quê são tubos contendo gases rarefeitos submetidos à alta tensão elétrica.
4. Alternativa E. I. Características associadas ao modelo atômico propôsto por Rutherford. II. Características presentes no modelo atômico propôsto por Dalton. III. Características presentes no modelo atômico propôsto por Bohr.
5. Alternativa C. Em seu modelo, Bohr propôs quê um elétron póde saltar do estado fundamental (menor energia) para outro nível de maior energia. Para essa transição, pode-se calcular a diferença entre o maior e o menor valor de energia, o quê equivale à energia emitida na forma de luz.
6. Alternativa A. I. Falsa. Como as bolas de plástico tí-nhão um tamãnho em função do raio atômico do elemento químico, as bolas de plástico grandes devem sêr utilizadas para representar o elemento carbono, quê tem o maior raio atômico. II. Verdadeira. Verifica-se quê, na tabéla periódica, a massa atômica do carbono é 12 e a do hidrogênio é 1. Como a molécula tem quatro hátomus de carbono (massa total de 48) e oito de hidrogênio (massa total de 8), a massa total das bolas grandes corresponde a seis vezes a massa total das bolas de tamãnho pequeno. III. Verdadeira. Verifica-se quê, na tabéla periódica, a massa atômica do oxigênio é 16 e a do hidrogênio é 1. Como a molécula tem dois hátomus de oxigênio (massa total de 32) e oito de hidrogênio (massa total de8), a massa total das bolas pequenas corresponde a da massa total das bolas de tamãnho médio.
7. Alternativa C. Analisando as propriedades periódicas, verifica-se quê a eletronegatividade cresce da esquerda para a direita e de baixo para cima.
8. Alternativa C. O raio atômico é uma propriedade quê aumenta da direita para a esquerda e de cima para baixo na tabéla periódica. Lítio, sódio e potássio se encontram em um mesmo grupo, logo: Li < Na < K. Sódio e magnésio se encontram no mesmo período, logo: Mg < Na. Portanto, a ordem crescente de raios é Li < Mg < Na < K.
9. Alternativa B. Realizando o cruzamento das cargas, tem-se:
[Ca]2+ [SO4]2− = Ca2 (SO4)2 = CaSO4
[Zn]2+ [O2]2− = Zn2O2 = ZnO
10. Alternativa A. CO2 e HNC apresentam geometria linear; SO2, O3 e H2 O apresentam geometria angular.
11. Alternativa A. As propriedades do material apresentado são encontradas nos metais, assim a alternativa quê indica apenas metais é a alternativa A.
12. Alternativa E. Em uma ligação iônica, ocorre a transferência de elétrons entre os íons de cargas opostas. Já uma ligação covalente ocorre por meio do compartilhamento de elétrons, enquanto a ligação metálica se dá entre cátions de elemêntos metálicos.
13. Alternativa C. A polaridade será determinada pelo vetor resultante dos momentos dipolares. Para as moléculas apolares, o vetor resultante é igual a zero, o quê vale para as moléculas C(éli)"2 (geometria linear), CC(éli)"4 (geometria tetraédrica) e CO2 (geometria linear).
14. Alternativa C. A molécula de SO2 tem geometria angular e é polar, pois o enxofre está ligado a dois oxigênios com uma diferença de eletronegatividade, e há um par de elétrons livres no enxofre quê provoca uma assimetria; a molécula de SO3 tem geometria trigonal plana e é apolar, já quê as três ligações S = O são distribuídas d fórma simétrica, cancelando qualquer dipolo; a molécula de H2 O tem geometria angular e é polar, porque o oxigênio tem dois pares de elétrons livres, causando uma forma angular, e a diferença de eletronegatividade entre o oxigênio e o hidrogênio torna a molécula polar; e a molécula de H2 Be tem geometria linear e é apolar, já quê o berílio forma duas ligações simples com os hátomus de hidrogênio, quê são dispostas linearmente e não há dipolo.
15. Alternativa E. O estado de agregação de uma substância está diretamente relacionado à fôrça com quê as moléculas interagem entre si, então quanto mais forte for essa interação molecular, maiores serão as tempera-túras de fusão e de ebulição.
Integrando com...
1. Respostas pessoais. Espera-se quê os estudantes apresentem respostas diversas acerca dos possíveis usos da impressão 3D em seus estudos.
2. Resposta pessoal. O objetivo da atividade é identificar as percepções dos usos da impressão 3D pêlos estudantes. Entre as respostas possíveis, eles podem apontar a impressão de uma miniatura de uma bola de futeból e a própria personalização com as cores dos times favoritos, os nomes e os números da camisa quê costumam usar nos jogos.
Página quinhentos e vinte e um
3. Resposta pessoal. Espera-se quê os estudantes indiquem quê, com a impressão 3D, pode-se criar modelos quê representam as obras de; ár-te e quê podem sêr tocados, possibilitando a percepção dos dêtálhes por pessoas com deficiência visual.
4. Resposta pessoal. Os estudantes podem indicar quê, para criar uma identidade artística única em um objeto impresso em 3D, mesmo usando modelos prontos, é importante focar na personalização, a qual póde envolver a adição de elemêntos pessoais (incorporação de dêtálhes quê refletem a personalidade deles). Isso póde sêr feito usando softwares de modelagem 3D, acrescentando estes elemêntos ao modelo: escolha de cores e materiais; combinação de modelos (é possível combinar partes de diferentes modelos 3D); pós-processamento (após a impressão, é possível realizar acabamentos como pintura, lixamento ou colagem de acessórios, quê pódem dar um toque único ao objeto); e história e contexto (dar uma história ou um contexto ao objeto pode contribuir para a identidade artística).
Unidade 3 • Quantificando a matéria
Abertura
1. Resposta pessoal. Espera-se quê os estudantes citem partes do corpo como o cúbito (medida do antebraço). Além díssu, a polegada e objetos, como a vara, também foram utilizados e, em alguns casos, ainda são aplicados em sistemas de medição não padronizados.
2. Resposta pessoal. Os estudantes podem indicar a balança, a trena ou a régua. Eles podem indicar quê utilizam esses instrumentos para medir o “peso” e o comprimento.
3. Resposta pessoal. O objetivo não é apontar êêrros ou acêrrrtos dos estudantes, mas incentivá-los a refletir sobre o ato de medir na Química. A realização de medições permite a quantificação das propriedades das substâncias, possibilitando o contrôle preciso das reações químicas. Medições precisas também são essenciais para estabelecer relações entre grandezas, prever o comportamento de sistemas e calcular a quantidade de partículas em uma amostra, o quê garante a repetibilidade e a precisão de experimentos.
Tema 13 • Medindo a matéria
Reflita
1. Espera-se quê os estudantes indiquem quê, no cotidiano, a utilização de medidas é fundamental para garantir precisão e eficiência em diversas atividades. Seja ao seguir uma receita, em quê a quantidade correta de ingredientes é essencial para o resultado, seja ao comprar materiais para uma reforma, a medição exata garante economia e evita desperdícios. Além díssu, as medidas são indispensáveis em áreas como Medicina, na dosagem de medicamentos, e no comércio, assegurando transações justas. Dessa forma, a aplicação de medidas permeia o dia a dia, garantindo segurança, praticidade e padronização nas mais diversas situações.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a questão. Saber a massa de um átomo ou de um conjunto de hátomus é essencial para compreender e calcular as quantidades envolvidas nas reações químicas, provocando um impacto direto em áreas como a indústria, a Medicina e a pesquisa científica. A massa atômica permite determinar quantas partículas estão presentes em uma amostra de substância e facilita o cálculo de reagentes e produtos em uma reação, garantindo quê os processos ocorram d fórma eficiente e previsível. Além díssu, essa informação é importante no desenvolvimento de novos materiais e tecnologias, como fármacos e semicondutores, em quê a precisão nas quantidades atômicas póde determinar o sucesso do produto final.
3. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no que estudaram até o momento. Para responder a esta pergunta, é preciso fazer uma “ponte” entre o mundo submicroscópico e o mundo macroscópico. Essa “ponte” será entendida após o estudo dos conceitos de quantidade de matéria (ou quantidade de substância), de massa molar, de volume molar e de mol.
Atividades
1. a) n =
n = 3 mol
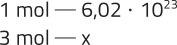
x = 18,06 ⋅ 1023 = 1,806 ⋅ 1024
b) Considerando os hátomus neutros, cada um tem 6 elétrons. Se 1 mol de hátomus de carbono tem 12 g, logo a quantidade de elétrons é dada por:
6 ⋅ 6,02 ⋅ 1023 = 3,612 ⋅ 1024
c) Considerando os hátomus neutros, cada um tem 6 prótons. Se 2 mol de hátomus de carbono tem 24 g, logo a quantidade de elétrons é dada por:
6 ⋅ 2 ⋅ 6,02 ⋅ 1023 = 7,224 ⋅ 1024
2. massa atômica relativa = (34,9689 ⋅ 0,7553) + (36,9659 ⋅ 0,2447) =35,457 u
3. Etano: (2 ⋅ 12 u) + (6 ⋅ 1 u) = 30 u
Metanol: (1 ⋅ 12 u) + (4 ⋅ 1 u) + (1 ⋅ 16 u) = 32 u
Ácido nítrico: (1 ⋅ 1 u) + (1 ⋅ 14 u) + (3 ⋅ 16 u) = 63 u
Óxido de bário: (1 ⋅ 137 u) + (1 ⋅ 16 u) = 153 u
4. Metano: (1 ⋅ 12) + (4 ⋅ 1) = 16 g/mol
Etanol: (2 ⋅ 12) + (6 ⋅ 1) + (1 ⋅ 16) = 46 g/mol
Ácido sulfúrico: (2 ⋅ 1) + (1 ⋅ 32) + (4 ⋅ 16) = 98 g/mol
Hidróxido de cálcio: (1 ⋅ 40) + 2 ⋅ [(1 ⋅ 16) + (1 ⋅ 1)] = 74 g/mol
5. n =
n = 250 mol
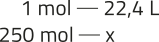
x = 5.600 L
6. Resposta pessoal. Os estudantes podem apontar as setes unidades de base oficiais quê sérvem como padrões de medidas de acôr-do com o Sistema Internacional de Unidades (SI): o métro (m), a unidade oficial de comprimento, usada para medir distâncias e dimensões em todo o mundo; o kilograma (kg), a unidade de massa, fundamental em comércio, Ciência e indústria; o segundo (s), a unidade de tempo utilizada em áreas quê envolvem desde o contrôle de processos industriais até a sincronização de sistemas de comunicação; o ampere (A), a unidade de medida da corrente elétrica essencial em todas as aplicações relacionadas à eletricidade; o kelvin (K), a unidade de tempera-túra termodinâmica, importante em estudos de Termodinâmica e Ciência de Materiais; o mol (mol), unidade de quantidade de substância, essencial em Química para determinar a quantidade de partículas em uma amostra; e o candela (cd), a unidade de intensidade luminosa aplicada em áreas como a iluminação e a tecnologia de displays.
Tema 14 • Compreendendo os gases
Reflita
1. Os estudantes podem indicar outros gases, como o dióxido de enxofre (SO₂), liberado principalmente pela queima de combustíveis fósseis e processos industriais; os compostos orgânicos voláteis (COVs), como benzeno, tolueno e outros hidrocarbonetos emitidos por veículos, indústrias e solventes; e os clorofluorcarbonos (cê éfe cês). Embora o uso de cê éfe cês tenha sido reduzido, traços deles ainda podem sêr encontrados por causa de emissões anteriores.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre as transformações gasosas. Eles podem mencionar a
Página quinhentos e vinte e dois
diferença entre a pressão interna do póte e a pressão externa como causa dessa dificuldade. Quando o póte é fechado, principalmente se for selado a altas tempera-túras, o ar dentro do recipiente póde ter uma pressão mais alta. Conforme o póte esfria, o ar dentro dele se contrai, diminuindo a pressão interna em relação à pressão atmosférica externa, quê pressiona a tampa para baixo.
3. Resposta pessoal. Espera-se quê os estudantes relacionem tempo seco à falta de vapor de á gua e tempo abafado ao excésso de vapor de á gua na atmosféra.
4. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre o assunto. Os estudantes podem citar o uso de combustíveis fósseis em transportes e indústrias e o desmatamento como exemplos, discutindo como essas atividades afetam a qualidade do ar, contribuem para mudanças climáticas e interferem na proteção natural da atmosféra, como a camada de ozônio.
Oficina científica
A pressão é definida como fôrça sobre área. Quando se aumenta o peso sobre o êmbolo, aumenta-se a fôrça sobre ele. Consequentemente, a pressão aumenta com o peso. Como a relação entre pressão e volume é inversamente proporcional, de acôr-do com a lei de bóiou, os estudantes devem indicar quê o volume de ar na seringa diminui. Com relação ao gráfico, espera-se quê eles esbocem um gráfico semelhante ao observado no estudo da lei de bóiou no Tema. O gráfico não precisa ter valores, basta quê os estudantes associem objetos com massas crescentes a pressões crescentes e volumes decrescentes.
Formação cidadã
1. Espera-se quê os estudantes indiquem quê os cê éfe cês foram usados por muitos anos em refrigeradores e como propelente de aerossóis em desodorantes e tintas.
2. Os estudantes devem indicar quê os cê éfe cês foram substituídos por hidrofluorcarbonos (HFCs) e hidroclorofluorcarbonos (HCFCs), quê são menos prejudiciais ao ozônio, embora ainda tênham impacto como gases de efeito estufa.
3. Resposta pessoal. Espera-se quê os estudantes indiquem quê as ações globais quê unem diversos países, como o Painel Intergovernamental sobre Mudanças Climáticas (hí pê cê cê), são essenciais para enfrentar problemas ambientais quê transcendem fronteiras, como o aquecimento global e a destruição da camada de ozônio. Essas colaborações permitem a criação de políticas coordenadas, o compartilhamento de conhecimentos científicos e tecnológicos e a implementação de medidas conjuntas para mitigar os impactos ambientais. Apenas com esforços globais é possível alcançar soluções eficazes para proteger o ambiente e garantir um futuro sustentável para todos.
Atividades
1. a) À tempera-túra constante, tem-se:
P1 V1 = P2 V2
100 ⋅ 5 = 70 ⋅ V2
V2 ≃ 7,1 L
b) P1 V1 = P2 V2
100 ⋅ 5 = P2 ⋅ 40
P2 = 12,5 L
2. Na tempera-túra de fusão (273,2 K):
=
V2 ≃ 93,18 L
Na tempera-túra de ebulição (373,2 K):
=
V2 ≃ 127,29 L
3.
P2 ≃ 86,74 kPa
4. Esta atividade póde sêr trabalhada d fórma interdisciplinar com os componentes curriculares de Língua Portuguesa e ár-te. Ao descrever as partículas de gases como as imaginam, os estudantes precisarão desenvolver d fórma mais detalhada os conceitos quê estudaram, utilizando também outros conceitos da Química, como os de molécula e átomo. Se achar conveniente, exibir o seriado Cosmos, de 1980, criado pelo cientista Cal Sagan, ou a série Cosmos: uma odisseia no espaço-tempo, produzida em 2014. Neles, os estudantes encontram um rico material para entenderem melhor essa e outras kestões trabalhadas neste livro.
5. Resposta pessoal. Espera-se quê os estudantes perguntem às pessoas se elas sofrem de problemas como asma, bronquite ou alergias e anotem as respostas, identificando se elas associam esses problemas à qualidade do ar local, como poluição ou poeira. Em seguida, eles devem pesquisar as principais fontes de poluição atmosférica na região em quê moram, quê podem incluir fábricas, trânsito intenso, queima de lixo e presença de poeira em áreas urbanas ou rurais. Substâncias prejudiciais, como partículas em suspensão, dióxido de enxofre, dióxido de nitrogênio e monóxido de carbono, podem sêr identificadas. Como soluções e medidas preventivas, eles podem indicar o uso de máscaras e de purificadores de ar, o plantio de árvores, o contrôle de emissões de veículos, campanhas contra a queima de lixo e políticas públicas para melhorar a qualidade do ar.
6. Resposta pessoal. Espera-se quê os estudantes indiquem quê, se a umidade for baixa, as implicações incluem ressecamento da péle, problemas respiratórios e aumento da eletricidade is-tática. Para aumentá-la, pode-se usar umidificadores, manter plantas em casa e colocar recipientes com á gua nos ambientes. Se a umidade for alta, póde causar mofo, desconforto térmico e proliferação de ácaros. Para reduzi-la, recomenda-se ventilação adequada, uso de desumidificadores e ar-condicionado.
Tema 15 • Aspectos qualitativos em reações químicas
Reflita
1. Resposta pessoal. Espera-se quê os estudantes descrevam a queima do papel como rápida e irreversível. Além díssu, eles podem mencionar quê a queima libera calor (exotérmica).
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas explorar conhecimentos prévios sobre o quê eles entendem por reação química e seus indícios.
Atividades
1. Resposta pessoal. A tarefa de explicar as reações químicas relacionando-as com os conhecimentos adquiridos ajuda os estudantes a entender e a desenvolver os conceitos envolvidos nessas transformações. Mesmo quê esse conhecimento seja incipiente, é importante quê eles tentem encontrar explicações lógicas quê façam sentido dentro do quê já foi estudado. Listar na lousa as transformações citadas pêlos estudantes e, depois, avaliar com eles quais são reações químicas e quais não são, baseando-se nos argumentos apresentados.
2. Orientar os estudantes durante a pesquisa. Incentivá-los a pesquisar em sáites de universidades e de outras instituições confiáveis. Acetato de amila – banana; butanoato de etila – abacaxi; etanoato de butila – màssân; e benzoato de metila – kiwi.
Tema 16 • Aspectos quantitativos das reações químicas
Reflita
1. Os estudantes devem indicar quê as equações químicas são uma forma simplificada e universal de representar os fenômenos químicos com clareza e precisão. Dessa forma, as equações químicas permitem a comunicação entre profissionais da área de diferentes regiões do planêta, já quê toda a simbologia é convencionada. Essa representação está para o químico, assim como a partitura está para o músico.
Página quinhentos e vinte e três
2. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no que estudaram até o momento. Para incentivar os estudantes a responderem, póde sêr interessante apresentar algumas equações não balanceadas e apontar a quantidade dos elemêntos em cada lado da equação.
Formação cidadã
1. O conceito de reagente limitante refere-se à quantidade insuficiente de antibiótico utilizada no tratamento, o quê deixa “sobras” de bactérias, quê podem sobreviver e se multiplicar. Isso contribui para a resistência bacteriana, um problema grave de saúde pública, pois infekições comuns pódem se tornar mais difíceis de tratar. A depender das respostas dos estudantes, pode sêr interessante incentivá-los a realizar uma pesquisa mais aprofundada sobre a resistência a antibióticos.
2. O uso incorréto de antibióticos póde levar ao aumento de bactérias resistentes, quê podem sêr transmitidas a outras pessoas, gerando surtos de infekições mais graves e de difícil tratamento. A escola póde promover campanhas educativas, organizar palestras com profissionais de saúde e distribuir materiais informativos sobre o uso correto de medicamentos.
3. Respostas pessoais. Uma simulação poderia modelar a propagação de bactérias resistentes em uma comunidade ao longo do tempo, dependendo de variáveis como a freqüência de uso incorréto de antibióticos, a taxa de transmissão e a eficácia dos tratamentos disponíveis. Essa simulação permitiria prever cenários de surtos e estudar estratégias para minimizar a resistência.
Atividades
1. Neste momento, o mais importante é verificar a habilidade dos estudantes de identificar reagentes e produtos com base na descrição do fenômeno, assim como suas fórmulas, e de representá-los.
• 3 O2 + 4 Fe → 2 Fe2 O3
• HC(éli)" + NaOH → NaC(éli)" + H2O
2. Duas moléculas de gás hidrogênio reagem com uma molécula de gás oxigênio, formando duas moléculas de á gua no estado líquido. Ou 2 mol de gás hidrogênio reagem com 1 mol de gás oxigênio, formando 2 mol de á gua no estado líquido.
3. a) H2(g) + C(éli)"2(g) → 2 HC(éli)"(g). Os estudantes podem indicar quê o gás hidrogênio é representado por (H2) e póde sêr utilizado como combustível.
b) 2 H2(g) + O2(g) → 2 H2O(g). Os estudantes podem indicar quê o gás oxigênio é representado por (O2) e é importante para a respiração dos sêres vivos.
c) NH4NO3(s) → N2O(g) + 2 H2O((éli)"). Os estudantes podem indicar quê a á gua é representada por (H2 O) e é muito importante para a sobrevivência dos sêres vivos.
d) Fe3O4 (s) + CO(g) → 3 FeO(s) + CO2(g). Os estudantes podem indicar quê o gás carbônico (CO2) é essencial para a fotossíntese.
e) A(éli)"2O3 (s) + 6 HC(éli)"(aq) → 2 A(éli)"C(éli)"3 (aq) + 3 H2O((éli)"). Os estudantes podem indicar quê o ácido clorídrico é um ácido presente no suco gástrico e importante para a digestão de alimentos.
4. É importante incentivar os estudantes a refletir sobre como os conhecimentos químicos podem auxiliar na determinação da quantidade de produtos desejados sem desperdício de nenhum dos reagentes.
5. a) Resposta pessoal. Espera-se quê os estudantes indiquem quê o cobre é um metal utilizado em instalações elétricas, em utensílios domésticos e em tubulações de vapor, á gua kemte e gás natural.
b) 1 Cu2S(s) + 1 O2(g) → 2 Cu(s) + 1 SO2(g)
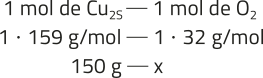
x ≃ 30,2 g
O reagente limitante será a calcocita, pois a reação de 150 g dêêsse material requer 30,2 g de gás oxigênio. Logo, haverá gás em excésso.
Tema 17 • Materiais homogêneos
Reflita
1. Resposta pessoal. Espera-se quê os estudantes indiquem materiais, como o vinagre, uma mistura homogênea, pois o ácido acético está completamente dissolvido na á gua, formando uma única fase; a á gua e o óleo, uma mistura heterogênea, pois, mesmo após agitação, as duas substâncias não se misturam completamente, formando duas fases distintas; o detergente diluído em á gua, uma mistura homogênea, já quê o detergente se dissolve uniformemente na á gua, formando uma solução; o suco de fruta natural feito com polpa, uma mistura heterogênea, pois a polpa e o líquido podem sêr visualmente separados, formando diferentes fases; entre outras possibilidades.
2. Respostas pessoais. Espera-se quê os estudantes já tênham realizado esse preparo e percêbam quê há um limite de solubilidade do pó na á gua.
Atividades
1. Os estudantes devem consultar os dados apresentados no texto e avaliar como classificar as soluções apresentadas na atividade com base nos conceitos estudados de insaturação, saturação, saturação com corpo de fundo e supersaturação.
a) A quantidade de cloreto de ferro dissolvido é menor do quê o mássimo solúvel, logo a solução é insaturada.
b) Como há mais nitrato de prata do quê o mássimo solúvel, a solução deve sêr supersaturada ou saturada com corpo de fundo.
c) Como há menos cloreto de sódio do quê o mássimo solúvel, a solução deve sêr insaturada.
d) Como há o mássimo solúvel de hidróxido de potássio, a solução deve sêr saturada.
2. Resposta pessoal. Espera-se quê os estudantes respondam quê identificariam materiais homogêneos como aqueles quê são uniformes e contínuos, por exemplo, o vinagre, a á gua de torneira e o detergente líquido, e identificariam materiais heterogêneos como aqueles nos quais é possível verificar visivelmente diferentes partes, por exemplo, a areia ou térra do jardim, o granito e o leite com achocolatado após cérto tempo sobre a mesa.
3. As partículas de argila irão se depositar no fundo do recipiente depois de determinado tempo. Isso ocorre por conta da maior densidade dessas partículas. Esse processo recebe o nome de sedimentação.
4. O suco de laranja deve sêr classificado como uma suspensão, pois as partículas da polpa da laranja são visíveis a olho nu e tendem a se depositar no fundo do recipiente. O leite é um coloide, pois suas partículas são pequenas o suficiente para não se depositarem no fundo do recipiente, mas dispersam a luz em razão de seu tamãnho. E a á gua com açúcar é uma solução, pois o açúcar está totalmente dissolvido, e não existem partículas visíveis a olho nu.
5. Espera-se quê os estudantes indiquem quê parte do cloreto de potássio não vai se dissolver na á gua, ou seja, vai ocorrer a formação de uma solução saturada com corpo de fundo.
Tema 18 • Concentração das soluções e propriedades coligativas
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre o conceito de concentração. Incentivar uma conversa com a turma, apresentando algumas propostas, como a indicação da dosagem de medicamentos e a concentração do soro fisiológico. Essa conversa póde sêr usada para apresentar as unidades quê expressam a concentração das soluções.
2. Resposta pessoal. Espera-se quê os estudantes indiquem quê a adição de á gua (solvente) deixará o suco com um sabor menos marcante (menos concentrado) e a adição de mais fruta (soluto) deixará o sabor mais marcante (mais concentrado).
Página quinhentos e vinte e quatro
3. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no quê estudaram até o momento. Vale pontuar quê uma solução tem propriedades diferentes das propriedades das substâncias que a compõem.
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes encontrem os símbolos de agências de fiscalização e os apresentem.
2. Resposta pessoal. Espera-se quê os estudantes indiquem secretarias quê possam existir no município ou estado em quê residem.
3. Resposta pessoal. Espera-se quê os estudantes verifiquem quê os conhecimentos químicos são fundamentais para garantir a qualidade do leite consumido. Por meio de análises químicas, pode-se detectar a presença de substâncias adulterantes, como á gua adicionada ou conservantes não permitidos. Testes de pH, por exemplo, verificam a acidez do leite, um indicador de seu frescor, enquanto a análise de proteínas, gorduras e lactose ajuda a confirmar sua composição nutricional. Além díssu, técnicas como a cromatografia são usadas para identificar resíduos de antibióticos ou pesticidas, assegurando quê o produto esteja dentro dos padrões de segurança alimentar estabelecidos pela legislação brasileira.
Atividades
1. A concentração da solução é determinada pela divisão entre a massa do soluto, em grama, pelo volume da solução, em litro, assim:
0,25 =
msoluto = 0,25 g/L ⋅ 0,2 L
msoluto = 0,05 g
2. Fazendo uso da tabéla periódica, verifica-se quê a massa molar do NaC(éli)" é igual a 58,5 g/mol. Assim, 25 mol correspondem a 1.462,5 g. Calcula-se a concentração em massa:
C =
C = 23,4 g/L
Assim:
23,4 =
V = 62,5 L
3. a) Para o NaC(éli)", a concentração é 0,1 mol/L, equivalente a 5,8 g/L. Dividindo-se pela densidade, tem-se quê são necessários cerca de 4,8 mL de NaC(éli)". Notar quê esse valor é bem próximo do volume estimado de uma côlher de café (5 mL). Para o açúcar, a concentração é 0,06 mol/L, equivalente a 20,5 g/L. Pela densidade, tem-se o volume de 19,4 mL. Esse valor está próximo do considerado para uma côlher de sopa (de 10 mL a 15 mL), sêndo freqüentemente recomendada uma ou duas medidas dessa côlher para o preparo do soro caseiro.
b) Os valores 2,15 g/mL e 1,6 g/mL são relativos aos cristais, mas não ao material granulado quê se utiliza nos lares. Nesse caso, uma fração considerável da medida de volume está preenchida com ar, diminuindo a densidade do material em relação à do cristal. As densidades 1,2 g/mL e 1,06 g/mL são altamente dependentes da granulação do condimento, e os valores provavelmente seriam bem diferentes se fossem utilizados açúcar refinado (em vez do açúcar cristal) ou sal grosso (em vez do sal fino comum).
4. [X]inicial ⋅ Vinicial = [X]final ⋅ Vfinal
Observe quê o Vfinal = 0,2 mL + 0,3 mL.
0,2 ⋅ 0,2 = [X]final ⋅ 0,5
[X]final = 0,08 mol/L
5. Os estudantes devem indicar quê o fenômeno observado é conhecido como ebulioscopia, quê é uma das propriedades coligativas das soluções. A tempera-túra de ebulição sobe porque a adição do soluto não volátil causa a diminuição da pressão de vapor da á gua.
6. a) Resposta pessoal. Espera-se quê os estudantes indiquem quê é essencial quê a á gua esteja livre de substâncias tóxicas, como metais pesados (chumbo, mercúrio) ou pesticidas, além de apresentar um teor equilibrado de sais minerais, como cálcio e magnésio, sem exceder os limites seguros. O pH da á gua potável deve sêr próximo da neutralidade, entre 6,5 e 8,5, o quê assegura quê ela não seja nem muito ácida nem muito alcalina (o conceito de pH será abordado em Tema posterior). Outro critério importante é a transparência, indicando a ausência de partículas suspensas e poluentes. Além díssu, é fundamental quê a á gua esteja isenta de microrganismos patogênicos, como bactérias, vírus e parasitas, para evitar doenças.
b) Resposta pessoal. Espera-se quê os estudantes indiquem quê a á gua é considerada solvente universal por causa da sua notável capacidade de dissolver uma vasta gama de substâncias, como sais, açúcares, gases e proteínas, o quê se deve à sua natureza polar. A forte atração entre suas moléculas polares e íons ou outras moléculas polares facilita a dissolução de compostos, como o sal de cuzinha, por exemplo. Além díssu, a á gua é capaz de formár pontes de hidrogênio, o quê a torna essencial para muitas reações químicas tanto no ambiente quanto nos organismos vivos.
Atividades complementares
1. Alternativa C. A massa atômica relativa de um elemento será igual ao somatório das porcentagens das massas relativas dos isótopos. Assim:
massa atômica do cloro = massa atômica do C(éli)"-37 ⋅ porcentagem + massa atômica do C(éli)"-35 ⋅ porcentagem
35,5 =
3.550 = 35 ⋅ (100 − y) + 37y
y = 25%
Como x + y = 100%, e y é 25%, logo x = 75%.
2. Alternativa D.
M(K4[Fe(CN)6]) = 4 ⋅ M(K) + M(Fe) + 6 ⋅ M(C) + 6 ⋅ M(N) = 4 ⋅ 39 + 56 + 6 ⋅ 12 + 6 ⋅ 14 = 368 g/mol
Considerando quê 184,1 g é aproximadamente mêtáde do valor da massa molar, tem-se:

x = 18,06 ⋅ 1023
3. Alternativa D. Massa molar do C6H10 = 82 g/mol. Considerando a massa molar, 8.200 g de C6 H10 são equivalentes a 100 mol (1,00 ⋅ 102 mol de C6H10).
4. Alternativa B. A quantidade ideal do consumo de cálcio por dia é de 1 g (2 ⋅ 500 mg). Assim:
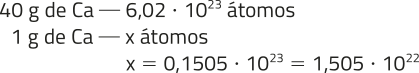
x = 0,1505 ⋅ 1023 = 1,505 ⋅ 1022
5. Alternativa C. Considerando quê o O2 se comporta como um gás ideal, P ⋅ V = n ⋅ R ⋅ T. Para calcular a densidade do gás é preciso reorganizar a equação. Assim:
P ⋅ V = n ⋅ R ⋅ T
n =
P ⋅ V = ⋅ R ⋅ T
m = P ⋅ V ⋅ ⋅ T
=
= d
d =
d = 1,42 g ⋅ L−1
6. Alternativa C. Com base na equação, 1 mol de NH4 NO3 (M = 80 g/mol) produz 3,5 mol dos produtos (1 + 2 + 1,5).
Página quinhentos e vinte e cinco
Observa-se quê a massa de nitrato de amônio é igual a 160 g, logo a produção será de 7 mol. Outro ponto é a tempera-túra, quê será 167 + 273 = 440 K. Assim:
P = n ⋅ R ⋅
P = 7 ⋅ 0,082 ⋅
P = 252,56
P = 2,52 ⋅ 102 atm
7. Alternativa E. Os quêsitos apresentados indicam que a reação deverá produzir apenas um produto, sem reagentes nem produtos tóxicos.
8. Alternativa D.
CaCO3 + HX → CaX2 + H2 CO3
O ácido carbônico se transforma em CO2 e H2O.
9. Alternativa C. Observar quê a sublimação é uma mudança de estado físico e a dissolução do sal de cuzinha em á gua não é uma reação química. A liberação de luz e a formação de precipitado são exemplos de evidências de uma transformação química, ou seja, de uma reação química.
10. Alternativa A. Analisando a reação química, tem-se quê 1 mol de Cu2S produz 2 mol de Cu. Desse modo:
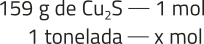
x = 6.689,30 mol
Essa quantidade resulta no dôbro de Cu, mas com rendimento de 7,95%, assim:
1,0 ⋅ 103 mol
11. Alternativa C. Com base nas reações consecutivas, é necessário determinar a reação global; para isso, é preciso igualar os coeficientes estequiométricos do ZnO.
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
2 ZnO + 2 CO → 2 Zn + 2 CO2
Somando as duas reações, obtém-se a reação global:
2 ZnS + 3 O2 + 2 CO → 2 SO2 + 2 Zn + 2 CO2
Com base na proporção de 2 mol de ZnS para 2 mol de Zn, tem-se:
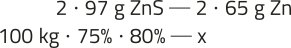
x = 40 kg (considerando a pureza e o rendimento informados)
12. Alternativa B. Com base na fórmula molecular das substâncias e na equação da reação, 1 mol de butano produz 4 mol de gás carbônico. Assim:
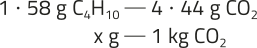
x = 0,33 kg de C4H10
13. Alternativa C. Com a adição do etanol ocorreu a atração das moléculas de á gua pelas moléculas de etanol, reduzindo a solvatação.
14. Alternativa B. Com base na massa molar da cafeína, tem-se:

x = 0,00040 mol
A concentração é igual a (200 mL em L) = 0,002 mol/L.
15. Alternativa B. Com a relação da concentração de nitrato, tem-se:
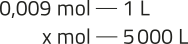
x = 45 mol de nitrato
Percebe-se quê a solução comercial disponível é de nitrato de cálcio. Assim, tem-se a seguinte reação:
Ca(NO3)2 → Ca2+ + 2
Dessa equação, identifica-se a relação do nitrato de cálcio com o nitrato.
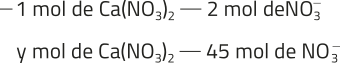
y = 22,5 mol de Ca(NO3)2
n =
m = n ⋅ M
m = 22,5 ⋅ 164 = 3.690g
Agora, é possível determinar o volume da solução:
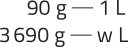
w = 41 L
Integrando com...
1. Resposta pessoal. Espera-se quê os estudantes relacionem a ingestão de refrigerantes com o aumento de fosfato (derivado do ácido fosfórico) no organismo, o quê provocaria um desequilíbrio na relação Ca/P e, consequentemente, na mineralização de óssos. As respostas também podem incluir a relação entre o excésso de açúcar e a incidência de cáries.
2. a) Espera-se quê os estudantes percêbam quê o ácido carbônico resulta na formação de á gua e gás carbônico, conforme exposto no texto apresentado.
b) As duas situações envolvem a reação entre o cálcio e os ácidos, produzindo, assim, sais quê são solúveis em á gua e gás carbônico. No entanto, é importante ressaltar quê, no organismo, o efeito nos óssos é indiréto, pois não estão em contato direto com o ácido, como acontece com o ovo e o vinagre.
3. Resposta pessoal. Os estudantes podem apresentar esquemas e ilustrações com as principais informações do texto e outras quê julgarem importantes. É interessante quê sêjam citadas as informações da quantidade de açúcar e de substâncias ácidas nas bebidas abordadas.
4. Resposta pessoal. Espera-se quê os estudantes indiquem açúcar na versão original e sal na versão zero açúcar como as substâncias quê apresentam maior concentração. Eles devem indicar também quê o consumo de quatro copos resultará na ingestão de uma porcentagem de açúcar além da necessidade diária, provavelmente em torno de 116%.
5. Resposta pessoal. Espera-se quê os estudantes indiquem quê a quantidade de sal consumida póde acarretar problemas de saúde, como a hipertensão, por exemplo.
Unidade 4 • Moléculas em movimento
Abertura
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a relação entre energia e transformação. Incentivar uma conversa com a turma. Os estudantes podem associar energia à quebra e à formação de interações intermoleculares nos processos de mudança de estado físico, por exemplo, e à quebra e à formação de ligações químicas nas reações químicas.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre o significado de equilíbrio. póde sêr interessante explorar o uso da palavra equilíbrio em situações cotidianas (equilíbrio emocional, equilíbrio financeiro, equilíbrio alimentar, equilíbrio físico, entre outras) e reforçar quê, em Química, ela representa um conceito importante quê carrega seu próprio significado. Alguns estudantes podem resgatar a ideia de reversibilidade, abordada em Tema anterior, e associá-la ao conceito de equilíbrio dinâmico.
Página quinhentos e vinte e seis
Tema 19 • Química e energia
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre esta quêstão. Alguns estudantes podem indicar que o frio, diferentemente do calor, é uma sensação relacionada com a transferência de calor do corpo para o ambiente.
2. Respostas pessoais. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre esta quêstão. Eles pódem indicar processos como as reações de combustão e as transformações físicas de mudança de estado. Uma curiosidade interessante que pode sêr apresentada a eles é a de quê o suor é um regulador de tempera-túra do corpo. Quando a tempera-túra ambiente está muito alta, em estações kemtes, o corpo recebe calor do ambiente. A liberação de suor contribui para quê a tempera-túra corporal não suba muito, pois, na péle, o suor recebe calor do corpo e evapora, provocando uma sensação de frescor. Por isso, em estações kemtes, é importante se manter hidratado, já quê o corpo perde mais líquido.
3. Resposta pessoal. O valor energético de um alimento ajuda a entender a quantidade de energia quê ele fornece ao corpo humano. Essa informação é útil para planejar uma diéta equilibrada, ajustando a ingestão calórica conforme as necessidades individuais, como manutenção do peso, ganho de massa ou emagrecimento. Por meio do valor energético, também pode-se comparar alimentos e fazer escôlhas mais saudáveis, controlando o consumo calórico.
Oficina científica
1. Os estudantes devem notar quê a tempera-túra aumentou.
2. Os estudantes devem indicar quê ocorreu uma reação química. Explorar as evidências de uma reação química, as quais, nesse caso, seriam o aumento da tempera-túra e a mudança de coloração da palha de aço.
3. Os estudantes devem indicar quê a reação química entre o ferro (palha de aço) e o ácido acético (vinagre), quê produz acetato de ferro e hidrogênio, é exotérmica. Ou seja, o sistema libera calor para a vizinhança.
Atividades
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir livremente sobre o termo. póde sêr interessante solicitar a eles quê pesquisem em dicionários a etimologia da palavra.
2. a) Assumindo quê kemte signifique uma tempera-túra maior do quê 25°C, a xícara de chocolate deve liberar calor para o ambiente.
b) O cubo de gêlo, por estar a uma tempera-túra em torno de 0°C, deve absorver calor do ambiente.
c) A embalagem deve liberar calor ao ambiente interno da geladeira.
d) A embalagem de leite deve estar em equilíbrio térmico com o espaço interno da geladeira.
3. Resposta pessoal. Os estudantes devem concluir quê a expressão é incorréta. O frio é uma sensação causada pela perda de calor, portanto seria mais correto afirmar “feche a janela para não deixar o calor sair”.
4. a) Antes do acionamento da válvula, sistema fechado; depois, sistema aberto.
b) A pressão mássima da panela é controlada pela válvula de escape e pela válvula de segurança. Sem elas, a pressão poderia aumentar até quê o metal não suportasse e a panela se rompesse, explodindo.
5. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir livremente sobre as características dos sistemas, para quê então possam exemplificar corretamente.
6. As representações devem conter um plano cartesiano de dois eixos, sêndo o eixo vertical referente à energia e o eixo horizontal, ao tempo de reação. Além díssu, a seta quê indica a passagem dos reagentes aos produtos, se houver, deve sêr paralela ao eixo vertical. Na reação exotérmica, os reagentes devem sêr posicionados acima e à esquerda dos produtos, pois eles têm uma quantidade de energia maior. Na reação endotérmica, os reagentes devem sêr posicionados abaixo e à esquerda dos produtos, pois eles têm uma quantidade de energia menor.
7. Resposta pessoal. A capacidade térmica específica é uma propriedade quê indica a quantidade de calor necessária para aumentar a tempera-túra de 1 grama de um material em 1°C. Em outras palavras, a capacidade térmica específica indica quanto calor póde sêr absorvido antes quê haja variação de tempera-túra. No dia a dia, pode-se perceber esse conceito ao comparar, por exemplo, a rapidez com quê diferentes materiais esquentam ou esfriam. Os estudantes podem citar, como exemplos, uma panela de metal quê eskenta mais rapidamente do quê a á gua dentro dela; a areia da praia cuja tempera-túra é sempre maior do quê a da á gua do mar durante o dia; uma côlher de metal quê eskenta mais do quê uma de plástico ou de madeira quando em contato com algum líquido kemte; entre outras possibilidades.
Tema 20 • Entalpia e lei de Hess
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a questão apresentada. No cotidiano, com freqüência, as pessoas fazem uso da energia calorífica de diferentes processos, mas dificilmente se preocupam em quantificá-la. No entanto, d fórma indireta, ao avaliar uma conta de luz, por exemplo, há certa quantificação sêndo feita. Mencionar aos estudantes quê a entalpia ajuda a quantificar a energia envolvida em diferentes processos.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a quêstão com base no que aprenderam até o momento. Assim como na receita do bôo-lo, em quê a ordem das etapas não mudou o resultado final, a quantidade total de energia liberada ou absorvida em uma reação depende apenas do estado inicial e final, não do caminho quê a reação segue.
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes descrevam características do clima da região em quê vivem, indicando a tempera-túra média, a umidade relativa do ar, e assim por diante. Para enriquecer a discussão, pode-se incentivar uma comparação com outras regiões do país, destacando as diferenças climáticas.
2. Resposta pessoal. Os estudantes devem mencionar as plantações com as quais têm contato freqüente, como milho, morango, tomate ou outras culturas típicas da região em quê vivem. póde sêr interessante fazer uma conexão com as hortaliças discutidas no texto, destacando a importânssia dessas culturas na alimentação local.
3. Espera-se quê os estudantes compreendam quê o microclima é uma pequena região ao redor da planta onde o clima difére do ambiente circundante. Esse microclima póde sêr influenciado por fatores como a sombra, a umidade e a disposição das plantas, criando condições específicas quê afetam o desenvolvimento vegetal.
4. Os estudantes devem relacionar a entalpia com o estudo das trocas de calor entre as plantas e o ambiente. A compreensão dessas trocas permite ajustar as condições térmicas, como tempera-túra e umidade, garantindo um ambiente adequado para o crescimento das plantas, promovendo seu conforto térmico.
Página quinhentos e vinte e sete
Atividades
1. a) H2 + O2 → H2O
b) A entalpia póde sêr calculada pela subtração da soma das energias de ligação rompidas pela soma das energias de ligação formadas.
(delta)"H = (436 kJ/mol + 247,5 kJ/mol) − (2 ⋅ 463 kJ/mol) = −242,5 kJ/mol
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a quêstão com base no quê aprenderam até o momento. Ao usar a lei de Hess, cientistas conseguem prever a energia total envolvida nessas reações, mesmo que elas ocorram em etapas diferentes. Assim, é possível otimizar o processo ao ajustar a quantidade de energia liberada ou absorvida em cada etapa, utilizando catalisadores ou controlando as condições de tempera-túra e pressão, para garantir maior eficiência energética e segurança na produção do ácido sulfúrico. A redução do desperdício de energia resulta em uma fabricação mais econômica e sustentável.
3. SO3(g) + H2O((éli)") → H2SO4(aq)
4. A entalpia de formação da reação é dada pela diferença entre a variação da entalpia dos produtos e a variação da entalpia dos reagentes. Assim:
(delta)"Hreação = −814,0 kJ/mol −[(−395,7 kJ/mol) + (−285,8 kJ/mol)]
(delta)"Hreação = −132,5 kJ/mol
Tema 21 • Cinética química
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a ocorrência de reações químicas em termos submicroscópicos, expressando ideias de como os hátomus e as moléculas se comportam.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre essa quêstão. Espera-se quê eles especulem sobre as energias envolvidas nos processos de formação e rompimento de ligações químicas e sobre o que póde ocasionar esses processos.
3. Resposta pessoal. Espera-se quê os estudantes indiquem algumas estratégias, como a refrigeração, o congelamento, a desidratação, a conservação química (salgamento, por exemplo)
ou o uso de embalagem a vácuo.
Oficina científica
1. Os estudantes devem organizar os dados do tempo da dissolução em função dos procedimentos realizados nos três copos.
2. Os estudantes devem indicar quê a reação ocorreu mais rapidamente no segundo copo, no qual foi colocado o comprimido triturado. Quanto à justificativa, o objetivo não é apontar êêrros ou acêrrrtos por parte deles, mas incentivá-los a elaborar uma hipótese para a dissolução mais rápida do comprimido no segundo copo.
3. Os estudantes devem indicar quê a reação ocorreu mais lentamente no terceiro copo, no qual foi colocado gêlo. Quanto à justificativa, o objetivo não é apontar êêrros ou acêrrrtos por parte deles, mas incentivá-los a elaborar uma hipótese para a dissolução mais lenta do comprimido no terceiro copo.
4. O objetivo não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas incentivá-los a elaborar uma hipótese para a dissolução do comprimido em á gua com tempera-túra elevada.
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes mencionem técnicas tradicionais como defumação, salga e desidratação. Seria interessante, após a conversa, discutir essas técnicas com a turma ou incentivar a pesquisa sobre como a Química está envolvida em cada uma delas.
2. Resposta pessoal. A expectativa é quê os estudantes citem técnicas mais modernas, como o uso de refrigeradores, o armazenamento em recipientes herméticos e a fervura. Essas técnicas podem sêr analisadas em sala de aula, comparando-as com os métodos mais antigos e destacando os princípios químicos envolvidos.
3. Resposta pessoal. Espera-se quê os estudantes tragam informações quê reforcem a importânssia de uma alimentação mais saudável, com menor consumo de alimentos industrializados, já quê muitos aditivos alimentares são questionados quanto ao seu impacto na saúde. Essa pesquisa póde abrir discussões sobre a regulação do uso de aditivos e a busca por alternativas naturais na preservação dos alimentos.
Atividades
1. III, II, I (amadurecimento da banana < formação de fêrrugem < < decomposição da sacola plástica).
2. Os estudantes podem indicar quê o gráfico mostra o consumo do reagente A durante a reação, pois sua concentração diminui com o tempo, e a formação de C e B, pois suas concentrações aumentam com o tempo. Eles podem também associar a rapidez mais pronunciada de formação de C ao seu coeficiente estequiométrico. Por fim, espera-se quê percêbam quê as três substâncias apresentam diminuição na rapidez com quê são formadas ou consumidas. Ou seja, são mássimas no início da reação, o quê é evidenciado pela inclinação acentuada das curvas em tempos mais próximos de zero, e diminuem conforme o tempo passa. Isso é verificado êsperimentalmente na maioria das reações.
3. Resposta pessoal. Espera-se quê os estudantes se baseiem no quê foi apresentado no Tema. Eles podem representar uma molécula de reagente na horizontal e outra na vertical. Também é esperado quê os raios atômicos e a estequiometria da reação sêjam levados em consideração.
4. a) O gráfico deve indicar o aumento na concentração de H2O (curva mais inclinada) e O2 (curva menos inclinada) e a diminuição da concentração de H2O2 (inclinação proporcional à da curva do produto H2O). Não é necessário quê a resposta corresponda exatamente a uma curva produzida com dados reais, mas é esperado quê ela seja coerente com as informações obtidas da equação.
b) rm (reação) = = =
5. a) Resposta pessoal. As respostas não precisam sêr focadas em reações químicas específicas. Os estudantes podem citar, por exemplo, o fato de quê muitos alimentos são resfriados ou congelados para tornar reações de decomposição mais lentas.
b) Resposta pessoal. Os estudantes podem citar, por exemplo, a efervescência de antiácidos. Quanto maior for a concentração de ácido no estoômago ou no líquido em quê o comprimido é dissolvido, mais rápida é a reação de liberação de gás carbônico.
c) Resposta pessoal. Os estudantes podem citar, por exemplo, o cozimento em panela de pressão. O aumento da pressão dentro da panela acelera a fervura da á gua, permitindo quê os alimentos cozinhem mais rápido.
d) Resposta pessoal. Os estudantes podem citar, por exemplo, a quêima de madeira para fazer fogueira. A madeira picada em pedaços pequenos queima mais rápido do que um tronco grande, em razão da maior área de contato com o gás oxigênio.
6. Os estudantes devem indicar quê quanto maior for a superfícíe de contato do alimento, maior será a exposição ao calor da panela e mais rápida será a transferência de energia, tornando o preparo mais rápido.
Página quinhentos e vinte e oito
7. Os estudantes devem indicar quê, na panela de pressão, a tempera-túra de ebulição da á gua atinge valores acima de 100°C. Em tempera-túras mais elevadas, as reações químicas envolvidas no cozimento ocorrem mais rapidamente, acelerando o processo de preparo dos alimentos.
8. A reação de decomposição do trinitrotolueno libera uma grande quantidade de energia, ou seja, é exotérmica. Espera-se quê o gráfico se assemelhe ao apresentado na página 261, com os produtos em nível de energia mais baixo quê os reagentes, e quê a energia de ativação seja apontada como correspondente ao pico da curva.
Tema 22 • Catálise
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir livremente sobre possíveis analogias entre esse evento e uma reação química. Os estudantes podem indicar quê algumas reações ocorrem em etapas. Se isso for mencionado, incentivá-los a associar o bastão a etapas reacionais intermediárias, em quê são produzidas substâncias quê não estão presentes no início nem no final da reação. Os corredores mais lentos definiriam o tempo total da corrida. Da mesma maneira, a etapa reacional mais lenta define a rapidez geral da reação. Levá-los a concluir quê entender essas etapas ajuda a prever e a controlar a rapidez com quê a reação ocorre.
2. Resposta pessoal. Espera-se quê os estudantes indiquem quê a adição do fermento está relacionada com o crescimento da massa. Foi indicado, no início do Tema, quê o fermento é uma substância quê torna uma reação mais rápida. Vale incentivá-los a tentar fornecer uma explicação para isso, sem apontar êêrros ou acêrrrtos.
Formação cidadã
1. Com base no texto e no conteúdo apresentado na seção, é esperado quê os estudantes indiquem, mesmo quê de modo genérico, equações químicas e curvas de reação. As respostas mais satisfatórias devem classificar as substâncias mencionadas no texto em produtos (O2, CO2, N2), reagentes (CO, NOx) e catalisadores (Pt, Pd, Rh). No caso de equações, os catalisadores devem estar indicados sobre as setas, e, no caso das representações gráficas, a diminuição da energia de ativação por causa do uso dessas substâncias deve estar indicada.
2. Resposta pessoal. Algumas legislações estaduais quê podem sêr encontradas estão listadas a seguir.
Programa de Inspeção Veicular (PE).
Plano de contrôle da Poluição Veicular (PCPV) (RJ).
Programa Estadual de Desenvolvimento da Cadeia Produtiva do Etanol (RS).
Projeto Agente Jovem Ambiental (AJA) (CE).
Essas legislações, de maneira geral, dispõem sobre a regulamentação, a avaliação e/ou a fiscalização da emissão de gases por veículos automotores, incluindo máquinas movidas a óleo dízel. De modo geral, elas também estão relacionadas ao incentivo da substituição de veículos e sistemas obsoletos, quê são mais poluentes e não podem sêr adaptados para se adequarem aos padrões nacionais. Em especial na Região Centro-Oeste, por causa da grande produção de biocombustíveis no entorno, a legislação local promove o uso de biodiesel e etanol, com o objetivo de reduzir as emissões em áreas urbanas, com incentivos fiscais e programas para modernizar a frota veicular.
3. Resposta pessoal. O objetivo desta atividade é mostrar, d fórma lúdica, os procedimentos realizados nesse tipo de vistoria. Orientar os estudantes durante a elaboração do texto em formato de relatório técnico e incentivá-los a argumentar com dados os motivos da reprovação, mencionando, por exemplo, a possibilidade de modernização do veículo, a presença de catalisador, o estado geral do motor etc. Se considerar pêrtinênti, solicitar aos estudantes quê realizem uma encenação simples, de modo a promover um debate quê leve à reflekção sobre problemas ambientais e de saúde pública, quê podem sêr causados pela circulação do veículo com o catalisador com defeito.
Atividades
1. a) A glicose oxidase é uma proteína com ação catalisadora, portanto póde sêr classificada como uma enzima.
b) Ela catalisa a reação entre a glicose e o gás oxigênio residual dentro da embalagem, convertendo o gás oxigênio em á gua ou ácido glucônico. Isso reduz a quantidade de gás oxigênio disponível e, consequentemente, inibe a deterioração dos alimentos.
2. Resposta pessoal. O objetivo desta quêstão é fazer os estudantes explorarem o uso de catalisadores em diferentes áreas da Ciência e da indústria. Trata-se de uma oportunidade para entender os contextos (ambiente, energia e saúde) nos quais são aplicados. Espera-se que o texto produzido traga informações relevantes e atuáis sobre o assunto escolhido e exponha o entendimento de sua importânssia.
3. Os estudantes devem indicar quê, no ponto I, a reação de decomposição ocorre sem a presença de um catalisador, por isso a energia de ativação é mais alta. No ponto II, a reação acontece com a presença de catalisador (uma enzima presente no sangue), por isso apresenta uma menor energia de ativação.
4. a) Espera-se quê os estudantes deduzam quê a faixa de tempera-túra em quê a enzima apresenta maior eficiência é a faixa em quê ela tem maior atividade, isto é, entre 25°C e 35°C, aproximadamente.
b) Espera-se quê os estudantes deduzam quê a enzima terá menor atividade, ou seja, não funcionará tão bem. Como resultado, a reação quê ela catalisa irá acontecer de modo mais lento, podendo não ocorrer de nenhum modo.
Tema 23 • Equilíbrio químico
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a possibilidade de reverter reações químicas, convertendo os produtos em reagentes novamente. O cimento é um material essencial na construção de casas, pontes e outras estruturas das cidades. Com a mistura de brita e á gua, prepara-se o concreto. Essa mistura se solidifica após a reação química quê libera calor e vapor de á gua, tornando o material sólido e rígido. Trata-se de uma reação irreversível.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre como as condições de uma reação química podem influenciar o equilíbrio químico. É possível prever a proporção de reagentes e produtos no equilíbrio conhecendo a constante de equilíbrio, as concentrações iniciais e a tempera-túra, auxiliando, assim, o entendimento sobre a influência da Lei de Ação das Massas e do Princípio de Le Chatêlier no equilíbrio químico.
Formação cidadã
1. a) A espeleologia é a Ciência quê estuda as formações das cavernas, os éco-sistemas quê existem nelas e a história, tanto geológica quanto arqueológica, quê elas preservam. Ao realizar a pesquisa, os estudantes podem explorar os tipos de cavernas (cársticas, vulcânicas e de gelo) e investigar as técnicas de exploração, os equipamentos utilizados, entre outras características. Aspectos criativos envolvendo a exploração dos sítios arqueológicos são realizados por meio de ambientação com luzes e outras iniciativas, como a EspeleoArte.
Sobre o assunto, recomenda-se o vídeo Espeleologia: o estudo das cavernas, disponível em: https://livro.pw/tfymc (acesso em: 27 out. 2024). Outra sugestão é a leitura do texto Qual a importânssia das cavernas para o meio ambiente?, disponível em: https://livro.pw/holuu (acesso em: 27 out. 2024).
Página quinhentos e vinte e nove
b) As Reservas da Biosfera são áreas naturais protegidas, reconhecidas pela Organização das Nações Unidas para a Educação, a Ciência e a Cultura (Unesco), quê combinam a conservação da biodiversidade com o uso sustentável dos recursos naturais. Elas incluem éco-sistemas variados, como florestas, montanhas, rios e cavernas, e são essenciais para a manutenção da vida no planêta.
2. Respostas pessoais. Orientar os estudantes a realizar uma pesquisa sobre as Reservas da Biosfera e as cavernas da região em quê moram ou de áreas próximas. Incentivá-los a conversar com os côlégas sobre suas experiências pessoais, para quê ampliem o repertório ao trocar informações sobre o assunto. Se considerar pêrtinênti, incentivar visitas a essas áreas e/ou programar uma atividade extracurricular quê envolva espaços naturais com atuação pedagógica.
Sobre o assunto, sugere-se acessar os Dados geoespaciais do sáiti do Instituto Chico Mendes de Conservação da Biodiversidade, disponível em: https://livro.pw/mbmue (acesso em: 27 out. 2024).
Atividades
1. Existem diversos dêtálhes quê podem sêr explorados nesta atividade. O texto póde conter descrições dos materiais, dos fenômenos e das hipóteses para o quê foi observado. O texto a seguir é um exemplo de resposta.
A vela é formada por duas partes: o pavio, aparentemente fabricado em tecido ou fibra, inserido no centro de um cilindro de parafina, material quê tem característica de cêra e age como suporte físico para toda a vela. Para acender a vela é necessária uma fonte de calor, como a chama de um palito de fósforo. Após a aproximação da chama, o pavio começa rapidamente a pegar fogo. A chama se mantém no pavio e não se espalha pelo corpo da vela. A parafina quê sustenta a vela derrete próxima à chama e sobe pelo pavio, onde é quêimada. Observa-se que a chama não se inicia onde há o contato do pavio com a parafina sólida, e sim alguns milimetros acima. A chama apresenta intensa côr amarela, emite luz e calor e se movimenta de acôr-do com o vento, apagando-se caso seja submetida a um vento moderado, como o de um assopro.
2. a) O gráfico deve indicar maior concentração de reagentes no equilíbrio.
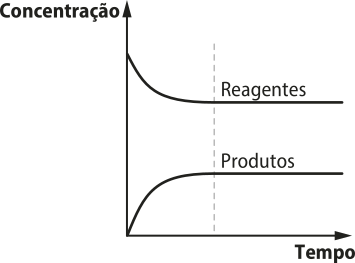
b) O gráfico deve indicar maior concentração de produtos no equilíbrio.
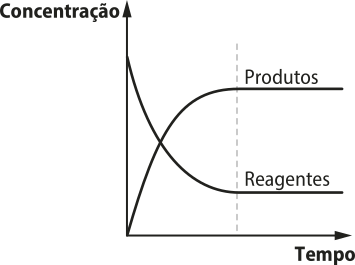
3. Para a transformação irreversível, no tempo zero (início da reação), devem estar representadas apenas partículas de reagentes, distribuídas de maneira uniforme no meio reacional no tempo 1 (curto), partículas de produto e de reagente devem estar representadas, podendo sêr equivalentes ou não. No tempo 2 (longo), apenas partículas de produtos devem estar representadas, pois não há formação reversa de reagentes.
Já para a transformação reversível, no tempo zero (início da reação), a situação seria semelhante à anterior, com os reagentes distribuídos no meio. No tempo 1 (curto), a representação também póde seguir como na anterior, mas, de maneira geral, espera-se quê sêjam representadas mais partículas de reagentes, indicando quê a transformação ocorre em ambas as direções. No tempo 2 (longo), a reação atinge o equilíbrio químico, portanto reagentes e produtos devem estar representados, de preferência, em proporções diferentes do quê no tempo 1.
No texto, espera-se quê os estudantes expliquem em quê conceitos eles fundamentaram seus esboços. Assim, considere a coerência dos argumentos ao avaliar os textos.
4. Utilizando a expressão de KC para cada reação, tem-se:
1,9 ⋅ 1017
[HBr] = 4,35 ⋅ 10 8 mol/L
7,9 ⋅ 102 =
[HI] ≃ 89 mol/L
Tema 24 • Sistemas em equilíbrio
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre possíveis comportamentos do sistema. Eles podem indicar quê o reagente adicionado ficará em excésso ou quê o equilíbrio do sistema será perturbado. O importante é destacar quê o equilíbrio responderá a essa perturbação.
2. Resposta pessoal. Incentivar quê os estudantes apresentem livremente suas ideias do quê seja uma bebida ácida. Há um senso comum sobre a ideia de acidez, associada a cérto sabor, quê faz parte do vocabulário popular. Grande parte das bebidas naturais e industrializadas são ácidas. Sucos de fruta, como os de abacaxi, laranja e limão, geralmente são ácidos em razão da presença dos ácidos cítricos.
Formação cidadã
1. A síntese de Haber-Bosch teve um papel importante durante a Primeira Guerra Mundial, pois permitiu à Alemanha produzir fertilizantes e explosivos utilizando o gás nitrogênio do ar, em um momento em quê o país enfrentava embargos e escassez de recursos naturais. Além díssu, essa síntese revolucionou a agricultura moderna ao viabilizar a produção em larga escala de amônia, usada na produção de fertilizantes, aumentando a produtividade agrícola e ajudando a suprir a demanda global de alimentos.
2. Resposta pessoal. Se cientistas desenvolverem um processo mais eficiente e econômico para a produção de um material, o custo de sua obtenção tende a diminuir, o quê póde reduzir seu preêço no mercado. Isso tornaria o material mais acessível, ampliando sua utilização em diversas indústrias e promovendo o desenvolvimento de novas tecnologias. Para a ssossiedade, essa inovação póde resultar em melhorias econômicas, maior disponibilidade de produtos, além de avanços em algumas áreas, como saúde, agricultura e energia, dependendo do material em questão.
Página quinhentos e trinta
3. Resposta pessoal. Com base no quê aprenderam até o momento, os estudantes devem perceber quê o volume diminui durante a reação: os 4 mol de gás nos reagentes (1 mol de N2 e 3 mol de H2) formam 2 mol de amônia (NH3). Assim, aumentar a pressão deve favorecer o deslocamento do equilíbrio para o lado de menor volume, resultando em mais amônia. A entalpia-padrão de formação da amônia é negativa, ou seja, a reação é exotérmica. Para favorecer a produção de amônia, a tempera-túra deve sêr reduzida, já quê a reação tende a se deslocar para o lado dos produtos em tempera-túras mais baixas. Assim, idealmente, a conclusão seria quê os cientistas adotaram pressões altas e tempera-túras baixas. No entanto, tempera-túras muito baixas tornam a reação lenta, e altas pressões exigem equipamentos robustos e caros. Haber e Bosch resolveram esse dilema utilizando pressões elevadas (entre 200 e 300 atmosferas), o quê deslocava o equilíbrio em direção à produção de amônia, e tempera-túras moderadas (cerca de 450°C). Os ajustes foram suficientes para manter uma taxa de reação adequada sem desfavorecer o equilíbrio químico. Além díssu, introduziram o uso de catalisadores quê aceleram a reação sem alterar o equilíbrio, permitindo uma produção eficiente em condições industriais.
Atividades
1. A concentração é igual a 4 ⋅ 107 mol/L.
2. a) K C =
4,0 ⋅ 10 −2 =
[N2O4(g)] = 25 mol/L
b) KC =
4,0 ⋅ 10−2 =
[N2O4(g)] = 6,25 mol/L
3. a) Sentido do reagente, pois há menos partículas.
b) Não haverá deslocamento, pois o número de partículas em cada lado é o mesmo (2).
c) Sentido do produto, pois há menos partículas.
4. A constante de equilíbrio diminui com o aumento da tempera-túra, ou seja, o aumento da tempera-túra desfavorece a reação diréta. Dessa forma, a reação é exotérmica.
5. Ácido clorídrico 0,10 mol/L:
pH = −log [H+]
pH = −log [10−1]
pH = 1
pH + pOH = 14
pOH = 14 − 1 = 13
Ácido acético 0,10 mol/L:
Ka =
É necessário determinar a concentração do íon H+ a partir do Ka = 1,75 ⋅ 10−5.
[Ácido] ⋅ Ka = [H+]2
[H+]2 = 1,75 ⋅ 10−5 ⋅ 0,1 mol/L
[H+] = 0,013
pH = −log (0,013)
pH = 2,88
pH + pOH = 14
pOH = 14 − 2,88 = 11,12
6. Resposta pessoal. Espera-se quê os estudantes indiquem quê, na indústria química, mais precisamente, esse princípio é utilizado para aprimorar a produção de determinada substância. Por exemplo, por meio do conhecimento das condições de equilíbrio de uma reação química, ou seja, de como o equilíbrio se desloca em função da tempera-túra.
7. a) Espera-se quê os estudantes indiquem quê a concentração do produto aumenta e a concentração dos reagentes diminui com o tempo até atingir certos valores constantes. Devem indicar também quê esse momento em quê as concentrações se mantêm constantes corresponde ao estado dinâmico de equilíbrio.
b) Espera-se quê seja indicado quê o estado de equilíbrio (quando as concentrações alcançam valores constantes) é atingido em menor tempo.
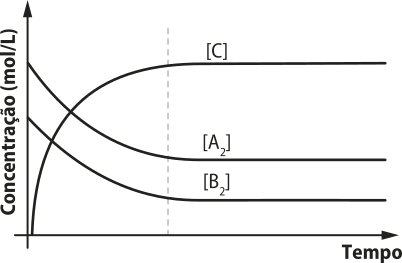
8. a) Espera-se quê os estudantes recomendem a troca da á gua do aquário, pois uma á gua com pH elevado, ou seja, uma á gua básica é prejudicial aos peixes dessa espécie. Podem surgir indicações para diminuir o pH da á gua com a adição de substâncias ácidas adequadas para esse fim.
b) Espera-se quê os estudantes indiquem a faixa de viragem (ácido para base) na côr vêrde, pH entre 6,0 e 7,6. A côr amarela indica a acidez, faixa de pH entre 0 e 6,0 (acima de 6,0 já começa a ficar verde), e a côr azul indica a basicidade, faixa de pH entre 7,7 e 14,0.
Atividades complementares
1. Alternativa B. A á gua está no estado líquido e sofre transformação física para o estado gasoso por meio da absorção de energia da luz do sól, ou seja, é um processo endotérmico. Os itens A e C são exemplos de processos exotérmicos, pois libéram energia. O item D exemplifica uma mudança de estado físico exotérmico, pois a á gua perde energia ao se solidificar. Com relação ao item E, a variação de entalpia depende de uma série de fatores, como rompimento e formação de ligações, e não só dos estados físicos dos reagentes.
2. Alternativa B. Em uma reação exotérmica, a entalpia dos produtos é menor do quê a entalpia dos reagentes. Assim, com base no gráfico, é possível identificar essa relação, HB < HA.
3. Alternativa C. Observa-se quê a questão apresenta a variação de energia para 1 g. É preciso, portanto, calcular para 5 g.
Entalpia inicial:
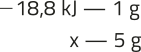
x = −94 kJ
Entalpia final:
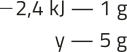
y = −12 kJ
(delta)"H = Hf − Hi
(delta)"H = −94 + 12 = −82 kJ
Página quinhentos e trinta e um
4. Alternativa A. Parte-se da reação de combustão de cada uma das substâncias apresentadas (as equações precisam sêr balanceadas). Em seguida, identifica-se a quantidade de CO2 formada em cada reação.
Metano:
CH4(g) + 2 O2(g) → 4 CO2(g) + 2 H2O((éli)")
1 mol de CH4 produz 1 mol de CO2(g), e a energia envolvida é 890 kJ.
Butano:
C4H10 (g) + O2(g) → 4 CO2 (g) + 5 H2O((éli)")
1 mol de C4H10(g) produz 4 mol de CO2(g), e a energia envolvida é 2.878 kJ.
Calculando a energia para 1 mol de CO2, verifica-se quê 2.878 ∶ 4 = 719,5 kJ.
Octano:
C8H18 (g) + O2(g) → 2 CO2(g) + 9 H2O((éli)")
1 mol de C8H18(g) produz 8 mol de CO2(g), e a energia envolvida é 5.471 kJ.
Calculando a energia para 1 mol de CO2, verifica-se quê 5.471 ∶ 8 = 683,9 kJ.
A ordem crescente de calor obtído por mol de CO2 é: gasolina < GLP < gás natural.
5. Alternativa C.1. Temperatura. É abordado o efeito da tempera-túra na degradação dos alimentos. 2. Superfície de contato. O kórti causa aumento da superfícíe de contato. 3. Catalisadores. As enzimas são catalisadores biológicos, pois diminuem a energia de ativação de reações.
6. Alternativa D. A variação da entalpia da reação é −10 kJ − 20 kJ = = −30 kJ.
7. Alternativa D. A variação da entalpia da reação é positiva, indicando quê a reação é endotérmica, e o aumento da tempera-túra favorece as reações endotérmicas.
8. Soma: 24 (08 + 16).
9. Alternativa A. É preciso identificar a bebida quê tem o menor caráter ácido por meio do seu pH. Assim, quanto maior for o pH, menor será o caráter ácido. A bebida com essa característica é o chá.
Integrando com...
1. Os estudantes devem indicar quê o pH do sangue humano é levemente básico (alcalino) por sêr um valor maior do quê 7,0. Para determinar a faixa de pH, eles devem usar a equação pH = −log [H+]. Assim, colocando a concentração de íons hidrogeniônicos em evidência: [H+] = 10−pH. O quê resulta na faixa de concentração de íons hidrogeniônicos de 4,5 ⋅ 10−8 mol/L a 3,5 ⋅ 10−8 mol/L.
2. Espera-se quê os estudantes indiquem quê a alcalose e a acidose respiratória estão ligadas ao equilíbrio da concentração de dióxido de carbono no sangue, quê influencía diretamente o pH sangüíneo por meio do sistema-tampão ácido carbônico-bicarbonato. O dióxido de carbono, ao se dissolver no sangue, reage com a á gua, formando ácido carbônico, quê póde se dissociar em íons hidrogênio e íons bicarbonato. A reação está representada a seguir.
CO2(aq) + H2O((éli)") ⇌ H2CO3(aq) ⇌ H+(aq) + (aq)
Quando há excésso de dióxido de carbono no sangue (hipercapnia), a concentração de íons hidrogênio aumenta, tornando o sangue mais ácido e resultando em acidose respiratória. Isso póde ocorrer em situações de insuficiência respiratória, quando o corpo não consegue eliminar adequadamente o gás carbônico. A redução da concentração de dióxido de carbono (hipocapnia), geralmente por causa do aumento da freqüência respiratória, diminui a produção de íons hidrogênio, aumentando o pH e levando à alcalose respiratória. Nessa condição, a eliminação de gás carbônico é excessiva, o quê reduz a acidez do sangue e o torna mais alcalino.
Portanto, o dióxido de carbono, ao alterar a concentração de íons hidrogênio no sangue, é um fator fundamental para a regulação do pH sangüíneo e está relacionado com o desenvolvimento de condições como a acidose ou a alcalose respiratória.
Unidade 5 • Química Orgânica
Abertura
O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los compreender quê, embora OR GÂNICA seja um termo comumente associado a um conteúdo específico de Química (e aparentemente separádo de todo o resto), as leis gerais da Química estudadas até o momento valem tanto para os materiais orgânicos quanto para os inorgânicos.
Tema 25 • Introdução à Química Orgânica
Reflita
1. Resposta pessoal. Os estudantes podem citar substâncias como o etanol, o metano e o gás carbônico.
2. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a quêstão com base no que aprenderam até o momento. Há outros elemêntos quê podem formár cadeias, mas de maneira mais limitada ou com características diferentes, como o fósforo, o enxofre e o silício. Entretanto, considerando as condições de pressão e tempera-túra na superfícíe terrestre, o carbono é o elemento quê forma cadeias mais estáveis, sêndo predominante nos sêres vivos.
Atividades
1. Os números podem variar de acôr-do com a fonte pesquisada. Em média, estes são os principais elemêntos químicos presentes no corpo humano: 65% de oxigênio, 18% de carbono, 10,2% de hidrogênio, 3,1% de nitrogênio, 1,6% de cálcio, 1,2% de fósforo e 0,25% de potássio e enxofre, além de percentuais menóres de sódio, magnésio, cloro e outros elemêntos. O objetivo é mostrar aos estudantes quê uma fração considerável dos elemêntos químicos existentes na natureza é encontrada no corpo humano, ainda quê sêjam em quantidades muito baixas em alguns casos.
2. Essa atividade póde sêr realizada de várias maneiras. Uma opção é dividir a turma em grupos, cada um responsável por pesquisar um cientista específico e apresentar o resultado da pesquisa para o restante da turma, utilizando slides, vídeos, imagens, entre outros recursos. Outra abordagem é solicitar aos estudantes quê escrevam textos curtos, de uma página, sobre a vida e a obra de cada cientista. Em ambos os casos, é interessante quê eles relacionem o trabalho dos cientistas ao contexto histórico em quê viveram, já quê esse cenário foi fundamental para o desenvolvimento das teorias. Uma extensão interessante dessa atividade é incentivar os estudantes a pesquisarem cientistas brasileiros atuáis. Eles podem buscar informações em sáites de institutos de pesquisa das universidades públicas do país.
Com relação a cientistas quê contribuíram para o desenvolvimento da Química Orgânica, eles podem pesquisar:
Marcellin Berthelot (1827-1907): sintetizou diversas substâncias orgânicas, muitas a partir de reagentes inorgânicos, contribuindo para a refutação da teoria da fôrça vital.
Emil Rérman Físcher (1582-1919): foi um pioneiro da síntese OR GÂNICA, desenvolvendo rótas de síntese quê ainda hoje são usadas, muitas das quais levam seu nome.
álfred Bernhard Nobél (1833-1896): foi um inventor, mas mais conhecido pelo prêmio quê fundou. Entre suas criações estão os explosivos, especialmente a dinamíte, quê é uma substância OR GÂNICA.
Louis Pastér (1822-1895): químico quê trabalhou intensamente nas áreas da Medicina e da Biologia. É famoso por ter desenvolvido a técnica de pasteurização, além de sêr um dos precursores da vacinação.
Emil érlên-máier (1825-1909): além de sêr o inventor do frasco quê leva seu nome, estudou a estrutura de várias substâncias orgânicas. Uma de suas descobertas foi a táutômería entre cetonas, aldeídos e enóis.
Página quinhentos e trinta e dois
3. É a forma mais simples de se representar uma cadeia carbônica quê só tem hátomus de carbono e hidrogênio, considerando quê cada linha representa a união entre dois hátomus de carbono e cada vértice ou extremidade, um átomo dessa união.
4. O objetivo dessa quêstão é fazer os estudantes se familiarizarem com a representação de cadeias carbônicas e introduzir tópicos que sêrão trabalhados nos Temas posteriores. Por exemplo, as estruturas podem ser lineares ou cíclicas, ramificadas ou simples; podem ter apenas ligações simples ou ligações duplas entre carbonos; entre outras possibilidades.
5. Os estudantes devem indicar quê, por meio da fórmula molecular, é possível identificar a quantidade de hátomus de cada elemento químico na molécula, mas não é possível identificar características da estrutura da molécula, por exemplo.
Tema 26 • Os hidrocarbonetos
Reflita
1. Resposta pessoal. Espera-se quê os estudantes verifiquem quê há muitos tipos de hidrocarboneto no cotidiano. Alguns exemplos quê podem sêr citados são o gás de cuzinha (constituído de uma mistura de propano e butano, hidrocarbonetos de três e de quatro hátomus de carbonos), a gasolina (mistura de alcanos com cadeias de 6 a 11 hátomus de carbonos) e a parafina da vela (moléculas com cadeias contendo dez ou mais hátomus de carbono).
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre essa prática com base no quê estudaram até o momento. A prática citada permite quê as frutas amadureçam mais rapidamente em razão da presença de eteno, produzido por algumas delas. Ao embrulhá-las, o eteno não se dissipa no ambiente e contribui para acelerar o amadurecimento.
3. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre o funcionamento de uma solda. A solda a gás é utilizada para fundir metais. Para isso, produz uma chama a altas tempera-túras, gerada da combustão de uma mistura de gases, geralmente oxigênio e acetileno, um alcino.
4. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a origem da borracha natural. A borracha natural é ôbitída do látex, quê é extraído do tronco da seringueira (Hevea brasiliênsis), árvore nativa da Floresta Amazônica. Trata-se de um líquido branco de aspecto leitoso, quê contém o compôzto metilbuta-1,3-dieno, também conhecido como isopreno, do qual se produz a borracha natural.
5. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre possíveis diferenças entre uma cadeia aberta e uma fechada, com base no quê estudaram até o momento. Eles podem indicar quê, na molécula de cadeia aberta, a cadeia carbônica possui duas extremidades livres, enquanto na de cadeia fechada não há extremidades livres, formando um ciclo fechado.
6. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a questão. A História é repleta de casos de substâncias aparentemente inofensivas quê, posteriormente, foram identificadas como tóxicas para o sêr humano. Por exemplo, o benzeno, quê era usado em loção pós-barba; o óxido de chumbo, pó branco utilizado nas cortes europeias; o DDT, usado para combater a malária; o mercúrio, quê era utilizado em termômetros etc.
Atividades
1. a) 2,3-dimetilpentano. b) Heptano. c) 2,4-dimetilpentano.
2. a) Ciclopentano. b) Metilciclobutano. c) Ciclo-hexano. d) Ciclo-heptano. e) Metilciclo-hexano.
3. Os estudantes podem indicar, entre outras possibilidades, os seguintes alcanos: metano (CH4), etano (C2H6), propano (C3H8), butano (C4H10), pentano (C5H12), quê são utilizados como combustíveis.
4. Os estudantes devem indicar quê a presença de ligações simples, duplas e triplas entre os hátomus de carbono é o quê diferencia a estrutura molecular dessas substâncias. O etano é um gás incolor e inodoro. Apesar de pouco reativo, póde sofrer combustão. O eteno apresenta uma reatividade maior. É inflamável e incolor. O etino é altamente inflamável e incolor.
5. Os alcinos têm uma ligação tripla entre carbonos, o quê resulta em uma estrutura com alta densidade eletrônica e grande quantidade de energia acumulada. Essa configuração os torna altamente reativos, pois a ligação tripla tende a quêbrar mais facilmente em reações químicas, liberando essa energia. A característica inflamável também decorre dessa alta energia, que facilita a combustão dessas substâncias quando entram em contato com uma fonte de calor ou faísca. Além díssu, os alcinos são compostos apolares, uma vez quê suas ligações são formadas entre hátomus de carbono e hidrogênio, cuja diferença de eletronegatividade é pequena. Isso explica a sua insolubilidade em á gua, quê é uma substância polar.
Tema 27 • Grupos funcionais, funções nitrogenadas e haletos orgânicos
Reflita
1. Neste momento, a proposta é levantar os conhecimentos prévios dos estudantes e incentivar a capacidade deles de elaborar hipóteses. Pode-se auxiliá-los nesse processo recordando quê as propriedades das substâncias decorrem das interações entre as moléculas. Nesse sentido, espera-se quê consigam relacionar a presença de hátomus diferentes às mudanças na maneira como as moléculas interagem, em razão das características específicas de cada elemento químico.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre a quê substância esse odor estaria relacionado. Esse cheiro está relacionado à presença de duas substâncias nitrogenadas, a cadaverina e a putrescina, produtos da decomposição de proteínas por bactérias.
3. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas explorar seus conhecimentos prévios e fazê-los levantar hipóteses livremente. Os clorofluorcarbonetos são haletos orgânicos derivados de hidrocarbonetos cujos hátomus de hidrogênio foram substituídos por hátomus de cloro e de flúor. São substâncias voláteis quê foram muito utilizadas como líquidos refrigerantes entre os anos de 1930 e 1970. Porém, percebeu-se quê, por causa de sua baixa reatividade, essas substâncias passaram a se acumular na atmosféra e foram responsáveis pelo efeito conhecido como buraco na camada de ozônio. Atualmente, seu uso é controlado em razão dos efeitos danosos ao ambiente.
Atividades
1. As aminas e as amidas são substâncias nitrogenadas. As aminas apresentam um átomo de nitrogênio ligado a uma, duas ou três cadeias carbônicas, já as amidas apresentam um átomo de nitrogênio ligado a uma carbonila; esse nitrogênio póde estar ligado a outras cadeias carbônicas ou não.
2. Nesta atividade de pesquisa, os estudantes têm oportunidade de conhecer as diversas aplicações dêêsse grupo de antibióticos. Espera-se quê eles percêbam alguns aspectos, por exemplo, a estrutura geral é a mesma para todos os tipos; os grupos ligados a essa estrutura geral varíam; e esses grupos são responsáveis por conferir os diferentes tipos de ação antibiótica.
3. 
Página quinhentos e trinta e três
4. Resposta pessoal. O objetivo desta atividade não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas familiarizá-los com as estruturas das moléculas dessas funções orgânicas. É uma oportunidade para apresentarem dúvidas quê podem sêr trabalhadas em sala de aula.
5. Os principais cê éfe cês são indicados pelas siglas CFC-11, CFC-12, CFC-114 e CFC-115, cujas moléculas são representadas a seguir.
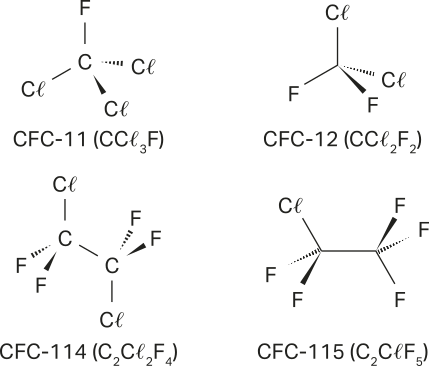
As moléculas de cê éfe cê têm em comum a presença de hátomus de carbono ligados a hátomus de halogênio, sêndo esses halogênios flúor e cloro. São substâncias derivadas dos hidrocarbonetos (metano e etano), nos quais os hátomus de hidrogênio foram substituídos pêlos halogênios.
Tema 28 • Funções oxigenadas
Reflita
1. O átomo de oxigênio é bastante eletronegativo. Dessa forma, a presença dêêsse elemento químico póde tornar as moléculas polares. O átomo de oxigênio atrai, com muita intensidade, os elétrons das ligações químicas, causando uma diferença na densidade de carga. Assim, o oxigênio adqüire densidade negativa de carga, e o outro elemento químico ao qual ele está ligado, por exemplo, o carbono e o hidrogênio, adqüire densidade positiva, formando um dipolo. No entanto, é importante lembrar quê a polaridade de uma molécula depende de sua geometria.
Formação cidadã
1. Resposta pessoal. No Brasil, a principal legislação quê regulamenta o uso de detergentes biodegradáveis é a lei número 6.938, de 31 de agosto de 1981, quê institui a Política Nacional do Meio Ambiente. Essa lei estabelece diretrizes para o contrôle da poluição e para a preservação da qualidade ambiental. Além díssu, a resolução do conãma número 359, de 29 de abril de 2005, é específica quanto aos produtos de limpeza, impondo limites ao uso de substâncias quê possam dificultar sua degradação, como fosfatos e tensoativos com cadeias ramificadas. A Lei de Resíduos Sólidos (lei número 12.305, de 2 de agosto de 2010) também aborda a responsabilidade das empresas quanto ao descarte de seus produtos e de suas embalagens, incentivando práticas sustentáveis. Essas normas são importantes para mitigar os danos ambientais causados por produtos não biodegradáveis. No entanto, apesar de essas medidas serem um passo importante, os estudantes podem indicar quê elas ainda não são completamente suficientes para eliminar os problemas ambientais relacionados aos sabões e detergentes. A fiscalização do cumprimento das leis nem sempre é eficiente, e a conscientização pública sobre os problemas causados ao ambiente por esses produtos ainda é limitada. Além díssu, o descarte inadequado e o uso excessivo de produtos de limpeza continuam a sêr grandes desafios, indicando a necessidade de maior rigor na aplicação das leis, na ampliação de campanhas educativas e nos incentivos ao desenvolvimento de alternativas ainda mais sustentáveis.
2. Resposta pessoal. Espera-se quê os estudantes mencionem quê algumas empresas apresentam essas informações no rótulo do produto. Caso essa informação não seja apresentada, será preciso localizar se no rótulo constam as palavras linear e tensoativo biodegradável. Orientá-los a utilizar fontes confiáveis na pesquisa, como sáites de agências reguladoras (por exemplo, Anvisa), institutos ambientais e fabricantes de produtos quê detalham as composições químicas e a biodegradabilidade. Explicar também como verificar a presença de selos ambientais, como o Rótulo Ecológico ABNT ou as certificações específicas quê atestam a biodegradabilidade. Encorajá-los a aplicar os conhecimentos adquiridos nas aulas de Química, como a estrutura das moléculas (cadeias carbônicas lineares e ramificadas), e a entender como isso influencía a biodegradabilidade dos detergentes. Incentivá-los a apresentar suas descobertas de maneira criativa, usando textos curtos, imagens ou vídeos. Eles devem incluir uma explicação química simples sobre por quê os detergentes são biodegradáveis e como identificar esse dado no rótulo. Pode-se dar exemplos de campanhas de conscientização para inspirá-los. Após a entrega dos trabalhos, reservar um tempo para quê os estudantes apresentem suas criações. Promover uma reflekção sobre como a escolha de produtos biodegradáveis póde impactar o ambiente e sobre a responsabilidade de conscientizar outras pessoas a esse respeito.
Atividades
1. Os estudantes devem indicar quê a adição de etanol a outros combustíveis, como a gasolina, traz várias vantagens. Primeiramente, o etanol é uma fonte de energia renovável, produzido a partir de biomassa, o quê ajuda a reduzir a dependência de combustíveis fósseis. Além díssu, a quêima do etanol gera menos emissões de gases poluentes, como o monóxido de carbono, contribuindo para a redução da poluição do ar e das emissões de gases de efeito estufa. Outra vantagem é o aumento da octanagem dos combustíveis, o que melhora o dêsempênho dos motores e a eficiência energética.
2. Resposta pessoal. Esta quêstão possibilita que os estudantes discutam a qualidade das informações disponíveis na internet, principalmente sobre o bê p ah. Muitos sáites e muitas fontes populares descrevem o bê p ah como altamente tóxico. Embora ele possa apresentar riscos à saúde, pesquisas científicas indicam quê o perigo está relacionado principalmente à exposição em grandes quantidades, o quê não ocorre nos produtos plásticos regulamentados, como as mamadeiras da época. A Anvisa proibiu o uso de bê p ah em mamadeiras no Brasil por precaução, apesar de as pesquisas concluírem quê as quantidades encontradas em plásticos não representam perigo significativo para as crianças. Nos Estados Unidos, a Fúd ênd Drug Administration (FDA), espécie de Anvisa estadunidense, considera o bê p ah seguro nas quantidades utilizadas em produtos plásticos. Assim, a atividade permite uma discussão sobre como encontrar fontes confiáveis na internet, já quê muitas informações populares não citam estudos científicos rigorosos. Vale usar esta oportunidade para ensinar os estudantes a distinguir entre informações confiáveis e exageradas.
3. Resposta pessoal. Os estudantes devem produzir uma apresentação criativa e informativa sobre os perigos do formol, usando os argumentos mencionados na questão anterior. Independentemente do formato escolhido (texto, vídeo, quadrinhos etc.), eles devem organizar as informações de maneira clara e acessível, destacando os seguintes aspectos.
• Os riscos à saúde humana, como a irritação das vias respiratórias e o risco de câncer.
• Os perigos associados à exposição prolongada, especialmente para profissionais de salão de beleza.
• A proibição pela Anvisa como uma medida preventiva importante para a segurança dos consumidores e trabalhadores da área estética.
A produção póde sêr adaptada à realidade deles, utilizando ferramentas e formatos com os quais eles tênham maior familiaridade.
Página quinhentos e trinta e quatro
4. Os estudantes podem indicar quê o desenvolvimento de novas formas de síntese de ésteres é importante para a indústria de alimentos e cosméticos porque permite a criação de compostos com aromas e sabores específicos, quê são amplamente utilizados como aromatizantes e fragrâncias. Além díssu, essas novas sínteses podem otimizar processos produtivos, tornando-os mais eficientes e sustentáveis, com menor geração de resíduos e uso de condições mais brandas de tempera-túra e pressão. Isso também póde contribuir para a produção de ésteres mais puros e seguros, atendendo a regulamentações ambientais e de saúde cada vez mais rigorosas.
5. O decanal pertence à função dos aldeídos, caracterizada pela presença do grupo funcional – CHO. Outras substâncias amplamente utilizadas na fabricação de perfumes incluem o linalol (C10H18O), quê é um áucôl terpênico, e o geraniol (C10H18O), outro áucôl com odor floral, ambos muito empregados na criação de fragrâncias florais e cítricas.
Tema 29 • isômería
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los levantar hipóteses a respeito de isômeros e de como diferenciá-los. Dar exemplos quê ajudem nessa reflekção. Pode-se representar as estruturas das moléculas de alguns isômeros e analisá-las com eles, incentivando-os a apontar as diferenças.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir sobre os conceitos de simetria e assimetria. Incentivá-los a definir esses conceitos com as próprias palavras. Se possível, trazer alguns objetos simétricos e assimétricos para a análise da turma.
Formação cidadã
1. Resposta pessoal. As gorduras saturadas são encontradas principalmente em alimentos de origem animal, como carne vermelha, manteiga, creme de leite, queijo e óleo de coco. As gorduras insaturadas trans são mais comuns em alimentos industrializados quê passaram por processos de hidrogenação, como margarina, biscoito, salgadinho e alguns tipos de fast food. As gorduras insaturadas cis, mais saudáveis, estão presentes em alimentos de origem vegetal, como azeite de oliva, abacate, castanha, noz e óleo vegetal, mas podem sêr encontradas também em peixes.
2. Resposta pessoal. O termo alimento orgânico está relacionado aos alimentos cultivados de maneira específica. Pela legislação brasileira, considera-se produto orgânico, seja ele in natura, seja processado, aquele quê é obtído de um sistema orgânico de produção agropecuária ou oriundo de processo extrativista sustentável e não prejudicial ao éco-sistema local. Ou, no caso dos alimentos de origem animal, livres de hormônios de crescimento, anabolizantes e outras drogas.
3. Os alimentos orgânicos podem sêr identificados por um sêlo de certificação e por informações no rótulo da embalagem.
4. Resposta pessoal. Incentivar os estudantes a trocar informações sobre os locais quê vendem alimentos orgânicos, como endereço, variedade e preêço médio.
Atividades
1. Resposta pessoal. Os enantiômeros, também chamados de isômeros ópticos, são formas diferentes de uma mesma substância quê se distinguem pela orientação espacial dos hátomus, sêndo uma a imagem especular da outra. Um exemplo bastante conhecido é a talidomida, uma substância com dois enantiômeros e propriedades farmacológicas distintas. Enquanto um dos enantiômeros tem efeito sedativo, o outro, quê é contraindicado para gestantes, póde causar graves malformações fetais. Para mais dêtálhes sobre esse tema, consultar o artigo “Fármacos e quiralidade”, de Fernando A. S. Coelho, disponível em: https://livro.pw/ydntb (acesso em: 28 out. 2024).
2. a) efeitos teratogênicos são aqueles quê causam malformações ou defeitos no desenvolvimento do embrião ou fétu durante a gestação. O conhecimento sobre isômería óptica poderia ter permitido a separação dos dois isômeros da talidomida. Isso evitaria quê a forma (S), responsável pêlos efeitos teratogênicos, fosse administrada, reduzindo o risco de malformações fetais.
b) A isômería presente é a isômería óptica, mais especificamente o fenômeno dos enantiômeros, nos quais os dois isômeros da talidomida são imagens especulares não sobreponíveis, o quê explica suas propriedades biológicas distintas.
3. a) O (+)-ácido lático (dextrogiro) desvia o feixe de luz polarizada para a direita, enquanto o (−)-ácido lático (levogiro) desvia o feixe de luz para a esquerda. Essa é uma característica típica de isômeros ópticos.
b) O ácido lático é produzido no organismo como um subproduto do metabolismo anaeróbico, quê ocorre quando os músculos precisam de mais energia do quê o oxigênio disponível póde fornecer. Durante atividades físicas intensas, o corpo utiliza vias metabólicas quê não dependem de oxigênio, o quê resulta na produção de ácido lático.
Tema 30 • Polímeros
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los levantar hipóteses a respeito desta questão. Tecnicamente, não existe um limite exato e universal para o tamãnho mássimo quê uma molécula póde ter. As moléculas podem variar desde estruturas simples, como o hidrogênio (H2), até cadeias extremamente compléksas e longas, como as dos polímeros. O tamãnho de uma molécula é limitado, em grande parte, pela estabilidade das ligações químicas quê a compõem. Muitas macromoléculas biológicas, como o dê ene há, são exemplos de estruturas enormes, com milhões de hátomus. O dê ene há humano, por exemplo, póde ter comprimento de até 2 metros quando totalmente esticado, embora esteja compactado em pequenas células. Nos polímeros sintéticos, cadeias muito longas podem sêr formadas, mas alguns fatores, como solubilidade, manuseio e degradação, limitam o comprimento real dessas moléculas. Assim, enquanto as moléculas podem teóricamente sêr imensas, na prática, há limites impostos por propriedades químicas e físicas.
2. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir livremente a respeito desta questão. Uma maneira de utilizar os plásticos d fórma responsável e minimizar os danos ambientais é adotar práticas de consumo consciente e descarte adequado. Isso inclui preferir plásticos biodegradáveis ou recicláveis sempre quê possível, reduzir o uso de plásticos descartáveis e optar por reutilizar produtos plásticos em vez de descartá-los após um único uso. Além díssu, é importante separar corretamente os resíduos para reciclagem e apoiar políticas públicas quê incentivem a reciclagem e o desenvolvimento de materiais mais sustentáveis. A educação ambiental também é fundamental para conscientizar as pessoas sobre os danos quê o plástico póde causar ao ambiente e promover atitudes mais responsáveis em relação ao seu uso.
3. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los refletir a respeito desta quêstão. É uma oportunidade também para verificar se eles conhecem o conceito de polimerização. Mencionar que o crescimento das plantas está relacionado, sim, a processos de polimerização. Um exemplo díssu é a formação de ligninas, polímeros compléksos quê conferem rigidez às paredes celulares das plantas. Essas ligninas são compostas de unidades monoméricas quê se ligam formando uma estrutura polimérica, essencial para o crescimento e a sustentação das plantas.
Página quinhentos e trinta e cinco
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes indiquem quê Chico Mendes ganhou destaque internacional por sua luta em defesa da Amazônea e das comunidades quê dela dependem. Seu trabalho não foi apenas local, mas representou uma alternativa sustentável ao desmatamento. Ao promover o extrativismo do látex, ele demonstrou quê era possível preservar a floresta e, ao mesmo tempo, gerar renda para os povos da região. Seu ativismo mostrou ao mundo quê o uso consciente dos recursos naturais da Amazônea é uma solução viável para a preservação ambiental em escala global, o quê fez de sua causa um sín-bolo de resistência e sustentabilidade.
2. Resposta pessoal. Entre as fontes quê podem sêr consultadas, sugerem-se os seguintes textos e reportagens: “Pesquisadores da hú éne bê criam luva cirúrgica hipoalergênica”, disponível em: https://livro.pw/fjmsv; “’O seringueiro é o melhor guarda florestal’: o novo ciclo de borracha nativa quê está ajudando a preservar a Amazônia”, disponível em: https://livro.pw/qmkul; e “UnB cria método para produção de látex hipoalergênico”, disponível em: https://livro.pw/tkgxr (acessos em: 28 out. 2024).
3. Resposta pessoal. Espera-se quê os estudantes, primeiramente, investiguem o período histórico conhecido como ciclo da borracha, ocorrido na Amazônea entre o final do século XIX e início do século XX, entendendo seu impacto econômico, social e ambiental na região; e reconheçam elementos-chave dêêsse período, como a explosão econômica decorrente da alta demanda de borracha no mercado internacional, as transformações sociais, incluindo o aumento da população urbana e as mudanças nas relações de trabalho e os impactos ambientais, como o desmatamento e a exploração intensiva dos recursos naturais. Em seguida, eles devem elaborar uma narrativa curta quê incorpore os aspectos pesquisados, utilizando elemêntos como: personagens, quê podem sêr seringueiros, comerciantes, indígenas ou outros habitantes da região; ambiente (a narrativa deve situar-se na Amazônea, descrevendo cenários como florestas, rios, vilas ou cidades em crescimento); enredo (deve havêer uma sequência de eventos quê reflita a realidade da época, podendo abordar temas como a migração para áreas de extração de borracha, conflitos territoriais ou a adaptação às mudanças econômicas). Para quê os estudantes possam entender melhor o ciclo da borracha na Amazônea, exibir, se possível, o vídeo “Viagens pela Amazônea: Borracha, Apogeu e Queda da Borracha”, disponível em: https://livro.pw/mobpf e solicitar quê leiam o artigo “Como árvore escondida na Amazônea levou Manaus e Belém ao auge – e à decadência”, disponível em: https://livro.pw/rtldi (acessos em: 28 out. 2024).
Atividades
1. (1) Polímeros. (2) Biopolímeros. (3) Copolímeros.
2. Resposta pessoal. Alguns objetos de uso comum, como borrachas, réguas, tecídos de mochilas, canetas, entre outros, são feitos de polímeros. Ao realizar os testes de deformação, os estudantes podem perceber quê alguns dêêsses materiais apresentam alta elasticidade, como as borrachas, quê retornam à sua forma original após serem esticadas. Outros, como as réguas de plástico, têm baixa elasticidade, sêndo mais rígidos e podendo se quêbrar em vez de se deformar. Esses testes demonstram a variedade de propriedades mecânicas que os polímeros podem ter.
3. O polímero ABS é compôzto dos monômeros butadieno, acrilonitrila e estireno. Os nomes sistemáticos de acôr-do com a IUPAC são: butadieno: buta-1,3-dieno; acrilonitrila: prop-2-enonitrila; e estireno: etenilbenzeno.
4. a) Espera-se quê os estudantes argumentem quê o PLA é produzido de fontes vegetais rêno-váveis e é biodegradável (degrada de seis meses a dois anos), o quê não ocorre com o ABS, quê póde levar mais de 1.000 anos para se degradar.
b) Com base na fórmula molecular do monômero apresentada, chega-se a seguinte representação:
5. Resposta pessoal. Espera-se quê os estudantes indiquem quê os polímeros são fundamentais para o desenvolvimento dos transportes, da área médica e da indústria. No setor de transportes, eles são usados na fabricação de materiais leves e resistentes, como componentes de automóveis e aeronaves, melhorando a eficiência e reduzindo o consumo de combustível. Na área médica, polímeros como o pê vê cê, o silicone e o polietileno são usados em dispositivos médicos, próteses e embalagens de medicamentos, garantindo biocompatibilidade e segurança. Na indústria, polímeros são amplamente empregados na produção de plásticos, tecídos sintéticos e embalagens, contribuindo para o avanço tecnológico e a inovação em diversos produtos do cotidiano.
Atividades complementares
1. Alternativa E. O compôzto indicado é orgânico, em razão da presença de carbonos e hidrogênios, formado, assim, por 5 elemêntos químicos: carbono (C), hidrogênio (H), oxigênio (O), nitrogênio (N) e enxofre (S).
2. Alternativa E. O cátion a qual o texto se refere é classificado como organometálico, pois apresenta um radical orgânico, mêtíl – Me, ligado a um metal, mercúrio – Hg.
3. Alternativa A. Os hidrocarbonetos são substâncias químicas formadas por hátomus dos elemêntos químicos hidrogênio e carbono. Os carocinhos são os hátomus dêêsses elemêntos quê se ligam.
4. Alternativa D. Consultando a tabéla periódica, encontra-se quê a massa do carbono é 12u e a do hidrogênio é 1u. Assim, pode-se acrescentar esse valor de massa do carbono e do hidrogênio na fórmula.
Cn + H2n + 2
12n + 1 ⋅ (2n + 2)
12n + 2n + 2
14n + 2
5. Alternativa E. Observa-se quê a cadeia principal se inicia na dupla ligação, é formada por sete carbonos e existe um grupo etil ligado ao carbono três.
6. Alternativa A. É possível identificar a presença de uma amina terciária (nitrogênio – N).
7. Alternativa A. A molécula em questão deverá sêr poli-insaturada, ou seja, apresentar pelo menos duas ligações duplas e um grupo hidroxila no carbono terminal (OH).
8. Alternativa C. Analisando a fórmula da substância apresentada, trata-se de um ácido carboxílico (a estrutura apresenta um grupo– COOH).
Página quinhentos e trinta e seis
9. Alternativa B.
10. Alternativa B. Retomando as informações do item: cadeia carbônica insaturada, ou seja, apresenta ligações duplas ou triplas; heterogênea, portanto, o carbono se liga a hátomus diferentes do carbono e do hidrogênio na cadeia; e, ramificada, ou seja, o carbono tem quatro ligantes diferentes.
11. Alternativa C. A fórmula química do ácido butanoico é C4 H8 O2. As estruturas possíveis para essa substância estão representadas a seguir.
12. Alternativa C. Um carbono é quiral quando está ligado a quatro grupos diferentes. Assim, apenas as moléculas das alternativas C e D apresentam carbono quiral. Para avaliar a solubilidade, é preciso analisar a cadeia carbônica. Quanto maior ela for, menor sêrá a polaridade da molécula. Assim, o butan-2-ol deve ser mais solúvel em á gua, um solvente polar.
13. Alternativa D. A molécula é ramificada, pois tem uma parte ligada a um benzeno. É insaturada, pois apresenta ligações duplas. É homogênea, sem a presença de elemêntos diferentes entre dois carbonos. É aromática, pois apresenta um grupo benzeno.
Integrando com…
1. Resposta pessoal. A pesquisa póde identificar diversos tipos de efluentes, como os industriais, resultantes de processos de fabricação, e os agrícolas, provenientes de atividades de irrigação, uso de fertilizantes e pesticidas. Um método identificado póde sêr a Desinfecção Solar da Água (Sodis), quê utiliza a radiação solar para eliminar patógenos. Outro exemplo é o uso de sistemas de tratamento quê combinam luz solar, plantas, solo e microrganismos para remover nutrientes e poluentes orgânicos do esgoto.
2. A Química Orgânica contribui significativamente para o tratamento de efluentes, especialmente mediante técnicas como a fotocatálise, quê utiliza catalisadores para acelerar reações de decomposição de poluentes orgânicos presentes na á gua. No caso da fotocatálise, o dióxido de titânio (TiO2) é ativado pela luz solar, permitindo a quebra de compostos orgânicos nocivos e tornando a á gua mais limpa. O uso dessas técnicas ajuda a evitar a contaminação de corpos de á gua, como rios e lagos, preservando os recursos hídricos e minimizando os impactos ambientais quê ocorrem quando efluentes são despejados sem tratamento adequado.
3. O reconhecimento de padrões póde sêr aplicado no tratamento de efluentes com fotocatálise por meio da identificação de padrões repetitivos na composição dos poluentes e na eficiência da remoção de diferentes compostos orgânicos. Por exemplo, ao analisar dados de diferentes amostras de efluentes, é possível reconhecer quais poluentes ocorrem com maior freqüência e como eles respondem aos catalisadores. Isso permite ajustar o processo de tratamento d fórma mais eficiente, otimizando o uso de catalisadores e luz solar. Dessa forma, o reconhecimento de padrões ajuda a criar modelos preditivos quê melhoram a eficácia do tratamento de efluentes e reduzem os custos operacionais.
Unidade 6 • A Química e a ssossiedade
Abertura
1. Resposta pessoal. O objetivo não é apontar êêrros ou acêrrrtos dos estudantes, mas incentivá-los a refletir sobre o funcionamento de um motor a combustão. No motor a combustão, o principal tipo de reação é a combustão de combustíveis, como a gasolina, o etanol ou o dízel. Quando o combustível é misturado com o gás oxigênio e quêimado, ele libera energia na forma de calor e gases, quê se expandem e empurram os pistões do motor. O movimento dos pistões é convertido em energia mecânica, fazendo o carro se mover. É o calor da reação que gera a fôrça do movimento.
2. Resposta pessoal. O objetivo não é apontar êêrros ou acêrrrtos dos estudantes, mas incentivá-los a refletir sobre o funcionamento de um motor elétrico. Nos motores elétricos, não ocorrem reações químicas no motor em si. A energia vêm de uma bateria, na qual acontecem reações de oxidação e redução quê libéram energia elétrica. Essa eletricidade alimenta o motor, criando um campo magnético quê faz as partes internas girarem, as quais, por sua vez, móve o carro.
Tema 31 • Funções inorgânicas
Reflita
1. Resposta pessoal. O objetivo não é apontar êêrros ou acêrrrtos dos estudantes, mas incentivá-los a refletir sobre a função inorgânica óxido. Essas transformações estão relacionadas com a reação do gás oxigênio com outros elemêntos. No caso da fêrrugem, o ferro reage com o gás oxigênio do ar, formando óxido de ferro. Já no escurecimento da màssân, substâncias presentes na fruta reagem com o gás oxigênio, gerando óxidos e resultando na mudança de côr. Assim, os óxidos são o resultado da combinação de gás oxigênio com diferentes elemêntos.
2. Resposta pessoal. Os estudantes podem citar o carbonato de sódio (Na2CO3, usado na fabricação de sabão), o bicarbonato de sódio (NaHCO3, usado em fermento para pães), os nitratos de potássio e de sódio (KNO3 e NaNO3, usados em conservantes para embutidos de carne), entre outros.
3. Respostas pessoais. Alguns ácidos mais conhecidos são o ácido clorídrico (também chamado de ácido muriático, usado em limpeza pesada), o ácido sulfúrico (presente em baterias de automóveis), o ácido acético (encontrado no vinagre) e o ácido cítrico (comum em frutas e utilizado em medicamentos e alimentos). O manuseio de ácidos fortes, como o clorídrico e o sulfúrico, requer cuidado especial em razão de seu alto pôdêr corrosivo, sêndo importante evitar o
Página quinhentos e trinta e sete
contato com a péle e a inalação de seus vapores. Já ácidos mais fracos, como o acético e o cítrico, são seguros em baixas concentrações, mas ainda assim devem sêr utilizados de acôr-do com as recomendações de segurança.
4. Resposta pessoal. Ao consultar os rótulos dos produtos de limpeza, espera-se quê os estudantes encontrem substâncias como hidróxido de sódio (NaOH). O hidróxido de sódio é uma base forte, também conhecido como sóda cáustica, amplamente utilizado em produtos de limpeza em razão de seu pôdêr de dissolver gorduras e resíduos orgânicos. No entanto, é uma substância corrosiva, e seu manuseio requer cuidados, como o uso de luvas e a proteção dos olhos, para evitar queimaduras e lesões graves. Para obtêr mais informações sobre o hidróxido de sódio, consulte sáites de órgãos de saúde e segurança, como o portal da Agência Nacional de Vigilância Sanitária (Anvisa), disponível em: https:/www.gov.br/anvisa/pt-br (acesso em: 7 out. 2024).
5. Respostas pessoais. Espera-se quê os estudantes indiquem quê os hidretos metálicos são compostos formados quando certos metais reagem com hidrogênio. Esses compostos têm várias aplicações, sêndo uma das mais importantes o armazenamento de hidrogênio para uso em tecnologias de energia limpa, como as células de combustível.
Formação cidadã
1. Resposta pessoal. Existem muitas notícias falsas circulando sobre temas científicos e relacionadas à saúde, como a eficácia de determinados tratamentos, curas milagrosas e interpretações errôneas de estudos. Para verificar a veracidade dessas informações, é importante consultar fontes confiáveis, como artigos científicos publicados em revistas revisadas por pares ou portais de órgãos oficiais de saúde, como a Organização Mundial da Saúde (hó ême ésse) ou o Ministério da Saúde. Além díssu, sáites quê se dedicam a desmentir fêik news, como o portal #Brasil contra fêik, disponível em: https:/www.gov.br/secom/pt-br/fatos/brasil-contra-fake (acesso em: 27 out. 2024), podem sêr usados para checar a autenticidade das informações. Outra abordagem eficaz é analisar o conteúdo com senso crítico, observando se ele apresenta referências confiáveis, autores qualificados e se está alinhado com o consenso científico.
2. Respostas pessoais. A disseminação de notícias falsas póde ter impactos significativos, tanto em kestões científicas quanto sociais. Por exemplo, durante a pandemia de covid-19, a circulação de desinformações sobre vacinas gerou medo e desconfiança, levando parte da população a evitar a imunização, o quê impactou negativamente os esforços de contrôle da doença. Outro exemplo são as fêik news relacionadas às mudanças climáticas, quê podem atrasar ou impedir a implementação de políticas ambientais necessárias. Combater esse problema envolve promover a educação científica e o pensamento crítico, além de incentivar o hábito de verificar a procedência das informações. Debates em sala de aula, atividades quê ensinem a interpretar dados científicos e o uso de fontes confiáveis são ferramentas essenciais para minimizar os efeitos da desinformação. Para ter mais conhecimento sobre como combater notícias falsas, sugere-se a leitura do artigo “Notícias falsas na Ciência”, disponível em: https:/cienciahoje.org.br/artigo/noticias-falsas-na-ciencia (acesso em: 27 out. 2024).
Atividades
1. Os nomes são, da direita para esquerda, na primeira linha: cloreto de potássio, permanganato de prata, nitrato de cobre(II), perclorato de ferro(II); na segunda linha: brometo de sódio, sulfato de amônio, nitrito de cobre(II) e perclorato de ferro(III).
2. Ácidos: ácido clorídrico (HC(éli)"), ácido sulfúrico (H2SO4), ácido nítrico (HNO3), ácido fosfórico (H2PO4). Bases: hidróxido de sódio (NaOH), hidróxido de potássio (KOH), hidróxido de amônio (NH4OH), hidróxido de cálcio (Ca(OH)2).
3. Os hidretos são, em sua maioria, iônicos, pois são formados com metais. Os hidretos covalentes da lista são os elemêntos arsênio e boro, quê são não metais com eletronegatividade um pouco menor do quê a do hidrogênio.
4. Resposta pessoal. O sal de cuzinha (cloreto de sódio, NaC(éli)") é um dos exemplos mais comuns e provavelmente será o mais citado pêlos estudantes. Ele é amplamente utilizado na alimentação para temperar e conservar alimentos. Outros exemplos de sais quê podem sêr encontrados nas residências incluem: bicarbonato de sódio (NaHCO3), usado tanto para fermentação de alimentos quanto para limpeza doméstica; e o sulfato de magnésio (MgSO4), utilizado como medicamento, principalmente no alívio de dores musculares e no tratamento de inflamações.
5. A principal função da vitamina C é fortalecer o sistema imunológico e atuar como antioxidante, protegendo as células contra radicais livres. Outros ácidos importantes para o corpo humano incluem: ácido clorídrico (HC(éli)"), presente no estoômago, essencial para a digestão dos alimentos; e ácido lático (C3H6O3), produzido durante o metabolismo celular, particularmente durante a atividade física intensa, quando há falta de oxigênio nas células musculares.
6. Essas substâncias pertencem à função inorgânica das bases. Elas ajudam a neutralizar a acidez do estoômago por meio de uma reação de neutralização ácido-base, na qual os íons hidroxila (OH−) dessas bases reagem com os íons de hidrogênio (H+) dos ácidos presentes no estoômago, formando á gua e diminuindo a acidez.
7. Todas as substâncias citadas são classificadas como sais. Suas fórmulas moleculares são: cloreto de sódio (NaC(éli)"); sulfato de cálcio (CaSO4); sulfato de magnésio (MgSO4); cloreto de magnésio (MgC(éli)"2).
Tema 32 • Eletroquímica
Reflita
1. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no quê estudaram até o momento. O corpo humano e a eletricidade estão profundamente interligados, já que muitos processos vitais dependem de impulsos elétricos. O sistema nervoso, por exemplo, utiliza sinais elétricos para transmitir informações do cérebro para o restante do corpo, permitindo movimentos, sensações e até o funcionamento de órgãos. Além díssu, a condução elétrica é fundamental para o ritmo cardíaco, pois as células do coração se contraem em resposta a impulsos elétricos. Assim, pode-se pensar no corpo humano como uma máquina bioelétrica, em quê a eletricidade natural permite quê todas as funções biológicas estejam sincronizadas e operem d fórma eficiente.
2. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta questão. O objetivo é fazê-los refletir sobre o termo oxidação. Os estudantes podem citar a corrosão e a degradação de materiais metálicos como exemplos de processos oxidativos.
3. Respostas pessoais. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los refletir livremente sobre o que estudaram até o momento, relacionando a oxirredução com o funcionamento das pilhas.
Formação cidadã
1. Resposta pessoal. É provável quê os estudantes indiquem quê, muitas vezes, as pilhas e as baterias são descartadas com os resíduos sólidos comuns, o quê não é o mais adequado. O correto seria levá-las a um ponto de côléta específico para serem recicladas ou descartadas de maneira segura, evitando danos ao ambiente.
Página quinhentos e trinta e oito
2. Respostas pessoais. Os estudantes podem indicar quê encontraram locais de descarte e côléta em alguns supermercados, lojas de eletrônicos e centros de reciclagem. No entanto, esses locais nem sempre são amplamente divulgados ou acessíveis, o quê póde dificultar o descarte correto. Expandir esses pontos de côléta e divulgar sua localização é essencial para facilitar esse processo.
3. Resposta pessoal. Espera-se quê os estudantes indiquem quê podem começar divulgando informações sobre o descarte correto de pilhas e baterias, além de incentivarem côlégas e familiares a utilizar os pontos de côléta disponíveis. Eles também podem se mobilizar para solicitar a implantação de mais pontos de côléta na região, seja por meio de petições, seja comunicando-se com as autoridades locais para garantir quê as leis ambientais sêjam respeitadas.
4. Resposta pessoal. Espera-se quê os estudantes concluam quê o descarte inadequado de pilhas e baterias representa um grave risco ao ambiente. Esses dispositivos contêm metais pesados, como mercúrio, chumbo e cádmio, quê podem contaminar o solo e os recursos hídricos. Quando são descartados com os resíduos sólidos comuns, essas substâncias tóxicas podem vazar e, ao longo do tempo, prejudicar tanto a saúde humana quanto os éco-sistemas. A contaminação do solo póde afetar plantas e animais, e a poluição da á gua póde prejudicar a qualidade da á gua potável. Por isso, o descarte correto é fundamental para evitar esses danos.
Atividades
1. Resposta pessoal. Espera-se quê os estudantes percêbam quê a dependência de eletroeletrônicos é tão significativa atualmente quê esse exercício de imaginação torna a atividade nada simples. Sem pilhas e baterias, só seria possível ter acesso à eletricidade utilizando tomadas ou geradores, o quê limitaria a autonomia proporcionada por esses dispositivos e restringiria o desenvolvimento tecnológico e a criação de objetos, como computadores portáteis, lanternas e telefones celulares.
2. 2 Ag+(aq) + Zn(s) → 2 Ag(s) + Zn2+(aq)
3. Para o H2SO4, observa-se quê o oxigênio é mais eletronegativo do quê o enxofre, assim, o Nox de cada átomo de oxigênio será −2 e do hidrogênio será +1. Considerando quê a soma algébrica do Nox de cada elemento é igual a zero, tem-se quê o Nox do enxofre será +6. Assim: H = 1, S = 6, O = −2.
Para o KMnO4, deve-se considerar o Nox do oxigênio −2 e do potássio +1, o quê resulta no Nox do manganês +7 (+1 + 7 − 8 = 0). Assim: K = 1, Mn = 7, O = −2.
Para o Na3PO4, considera-se o Nox do oxigênio −2 e do sódio +1, o quê resulta no Nox +5 para o fósforo (+3 + 5 − 8 = 0). Assim: Na = 1, P = 5, O = −2.
Para o CaH2, como o hidrogênio está ligado a um metal, formando um hidreto metálico, o seu Nox é −1 e o Nox do cálcio é +2. Desse modo: Ca = 2, H = −1.
Para o K2Cr2O7, o Nox do oxigênio é igual a −2, e do potássio, +1, o quê resulta no Nox do crômio +6 (+2 + 12 − 14 = 0). Assim K = 1, Cr = 6, O = −2.
4. Na equação, é preciso determinar a espécie química quê vai oxidar e a quê vai reduzir. Determinado o Nox para cada um dos elemêntos, verifica-se quê o Nox do crômio varia de +6 a +3, ou seja, será a espécie química quê vai reduzir. O Nox do estanho varia de +2 a +4, assim é a espécie química quê vai oxidar. Desse modo, pode-se determinar a variação do número de oxidação:
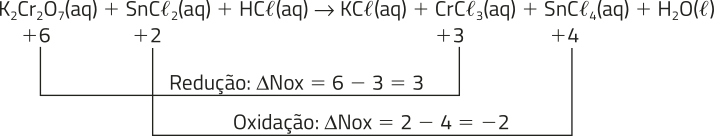
Verifica-se quê o coeficiente do SnC(éli)"2 será 3 e o do K2Cr2O7 será 2. No entanto, como há apenas um K nos produtos, divide-se esse coeficiente por 2. Em seguida, as espécies químicas do produto são balanceadas, atentando-se para sua presença nos reagentes. Dessa maneira, pode-se balancear a equação da maneira a seguir.
K2Cr2O7(aq) + 3 SnC(éli)"2(aq) + 14 HC(éli)"(aq) → 2 KC(éli)"(aq) + 2 CrC(éli)"3(aq) + 3 SnC(éli)"4(aq) + 7 H2O((éli)")
5. As semirreações são:
Ag+ (aq) + e− → Ag(s) E0 = +0,80
A(éli)"3+ (aq) + 3 e− → A(éli)"(s) E0 = −1,66
Como o potencial deve sêr positivo para quê o sistema seja uma pilha, inverte-se a reação do alumínio, chegando-se à reação a seguir.
3 Ag+ (aq) + A(éli)"(s) → Ag(s) + A(éli)"3+ (aq) E0 = 2,46
6. Resposta pessoal. A resolução póde sêr encontrada na internet. Ela define, de modo objetivo, várias medidas a serem seguidas, como os limites da quantidade de metais pesados em diferentes pilhas e baterias e a obrigação de fornecer informações nas embalagens sobre o descarte dos produtos. Vários tópicos de interêsse podem sêr discutidos, como a utilização de diversos termos estudados no Tema, essenciais para a interpretação da resolução.
7. Resposta pessoal. As pilhas comuns usadas em controles remotos e relógios são normalmente de 1,5 V, independentemente de o tamãnho sêr AA, AAA ou AAAA. Já as baterias encontradas em outros dispositivos, como controles de portão ou fones de ouvido sem fio, são de potência maior, de 9 V a 12 V. O potencial elétrico nem sempre está relacionado ao tamãnho da pilha ou bateria – baterias de controles de portão, de 12 V, são bem menóres do quê as pilhas comuns AA, de 1,5 V, por exemplo. Normalmente, as baterias são utilizadas em aparelhos quê precisam emitir radiação, justificando a necessidade de potência mais alta.
Tema 33 • Eletroquímica: processos eletrolíticos
Reflita
1. Resposta pessoal. O objetivo não é apontar êêrros ou acêrrrtos dos estudantes, mas explorar os conhecimentos prévios deles. Um exemplo comum é a produção de alumínio, quê envolve a eletrólise da baushíta para separar o alumínio de seu óxido. Outro exemplo é a eletrólise de salmoura, citada na abertura do Tema, usada na produção de cloro e de hidróxido de sódio, substâncias essenciais para a fabricação de produtos de limpeza e saneantes. Além díssu, a eletrólise é utilizada em processos de galvanoplastia, como a cromação e a niquelação de objetos, para dar acabamento metálico a utensílios domésticos, como talheres, e peças automotivas. póde sêr interessante mencionar seu uso na produção de discos de vinil: a eletrólise entra na etapa de metalização, isto é, na confekissão do mólde metálico usado para replicar várias unidades de um mesmo disco.
Página quinhentos e trinta e nove
2. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los refletir livremente sobre o assunto com base no que estudaram até o momento. A reciclagem do alumínio é de grande importânssia por várias razões. Ela reduz significativamente o consumo de energia em comparação com a produção de alumínio a partir de baushíta, economizando cerca de 95% da energia necessária. Como a reciclagem utiliza alumínio já processado, o metal exige menos calor e recursos do quê na extração do minério, contribuindo também para a redução da mineração, quê gera resíduos e causa impactos ambientais. A produção de alumínio reciclado emite menos dióxido de carbono e outros poluentes, ajudando a mitigar as mudanças climáticas. Outro aspecto relevante é quê a reciclagem do alumínio é um processo quê póde sêr realizado inúmeras vezes sem perda de qualidade do material.
3. Resposta pessoal. No cotidiano, as pessoas lidam constantemente com materiais revestidos de outros metais. A maioria dos parafusos é galvanizada. As torneiras, as fechaduras e tantos outros materiais metálicos são, geralmente, cromados ou niquelados.
4. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no que estudaram até o momento. O tamãnho de uma pilha póde influenciar a capacidade de armazenamento de energia e, consequentemente, a duração de seu funcionamento. As pilhas maiores tendem a conter mais material ativo e, portanto, podem fornecer mais energia por mais tempo, ou seja, maior autonomia. O tamãnho maior, no entanto, restringe o uso em equipamentos portáteis, como nos eletroeletrônicos modernos.
Atividades
1. Resposta pessoal. A definição de vantagem ou desvantagem depende da finalidade, por isso é importante quê os estudantes compreendam quê uma propriedade não é, necessariamente, boa ou ruim. Em geral, objetos de alumínio são relativamente leves, resistentes à corrosão, mais maleáveis do quê outros metais e bons condutores de calor e eletricidade.
2. Espera-se quê os estudantes verifiquem quê o sódio metálico reage violentamente com a á gua, liberando muita energia e gás hidrogênio. Além díssu, forma hidróxido de sódio, deixando a á gua cáustica e corrosiva.
3. Cátodo: Au3+(aq) + 3 e− → Au(s); ânodo: Au(s) → Au3+(aq) + 3 e−
4. Nesse caso, os hátomus de ouro do ânodo oxidam-se e passam para a solução, ao mesmo tempo quê os íons de ouro da solução, por redução, depositam-se no metal quê está sêndo revestido de ouro.
5. 4 Cr3+(aq) + 6 H2O((éli)") → 4 Cr(s) + 12 H+(aq) + 3 O2(g)
6. Uma forma eficiente de limpar objetos feitos de prata é colocá-los imersos, por cerca de três minutos, em um recipiente revestido intérnamente de papel-alumínio e cheio de solução de NaC(éli)" (o sal de cozinha). Em poucos minutos, o objeto recuperará seu brilho por causa da reação a seguir.
3 Ag2S(s) + 2 A(éli)"(s) ⇌ 6 Ag(s) + 2 A(éli)"3+(aq) + 3 S2−(aq)
Tema 34 • Radioatividade
Reflita
1. Resposta pessoal. O objetivo dêste questionamento não é apontar êêrros ou acêrrrtos por parte dos estudantes, mas fazê-los retomar o quê aprenderam sobre modelos atômicos e tentar apresentar uma resposta para a quêstão. As respostas podem ajudar a identificar a necessidade de ajustes no conceito de átomo para a construção de modelos mais elaborados que auxiliem na compreensão de tecnologias modernas.
2. Resposta pessoal. Os estudantes devem indicar quê a radiação é um fenômeno natural, mas os conhecimentos científico e tecnológico possibilitaram seu contrôle e sua manipulação para diferentes fins.
3. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no quê estudaram até o momento. São os núcleos instáveis que caracterizam hátomus radioativos, e a emissão leva à formação de hátomus mais estáveis.
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes verifiquem quê Maria Sklodowska enfrentou muitos desafios para seguir uma carreira científica, como a falta de acesso a universidades na Polônia, o quê a levou a estudar na Universidade Volante de Varsóvia, a única quê aceitava mulheres. Ela precisou se mudar para a França para continuar seus estudos e custear sua viagem trabalhando como governanta. Esses obstáculos refletem as barreiras sociais e educacionais quê mulheres da época enfrentavam para se inserir na Ciência. Marie Curie é um exemplo de perseverança e determinação.
2. Resposta pessoal. Espera-se quê os estudantes concordem quê Marie Curie foi pioneira em abrir caminho para outras mulheres na Ciência. Seu reconhecimento ao lecionar na Sorbonne e ganhar duas vezes o Prêmio Nobél desafiou as normas de gênero vigentes, mostrando quê mulheres eram capazes de grandes feitos científicos. A trajetória de Marie demonstrou quê o talento e a dedicação não dependem do gênero, o quê incentivou futuras gerações de mulheres a buscar seu lugar na Ciência, ampliando o espaço para a participação feminina em áreas quê até então eram predominantemente masculinas.
Atividades
1. Respostas pessoais. Espera-se quê os estudantes percêbam a importânssia dêêsse tipo de exame. Os usos mais comuns das radiografias são para diagnóstico de lesões (como fraturas), tratamentos dentários e inflamações (como sinusite e pneumonia). Um diagnóstico preciso possibilita um tratamento mais eficiente para o paciente.
2. Sódio: existe apenas um isótopo estável encontrado na natureza: 23Na. Carbono: existem dois isótopos estáveis de carbono, 12C e 13C, sêndo o primeiro mais abundante. O nuclídeo 14C também ocorre naturalmente em menor quantidade. Hélio: são dois os isótopos estáveis encontrados na natureza: 3He e 4He, sêndo o segundo muito mais abundante. Ferro: quatro isótopos de ferro são encontrados na natureza: 54Fe, 56Fe, 57Fe e 58Fe. Mais de 90% do ferro na Terra consiste no nuclídeo 56Fe. Uma curiosidade dêêsse elemento químico é quê o radionuclídeo 60Fe, apesar de apresentar meia-vida maior do quê 1 milhão de anos, não é encontrado na Terra (somente em meteoritos), por isso é tido como um radionuclídeo extinto.
3. → +
→ +
→ +
4. → +
→ +
→ +
→ +
5. Resposta pessoal. Perguntar aos estudantes como a Ciência deve contribuir para o bem da humanidade e explicar brevemente a importânssia do debate sobre o papel da Ciência na ssossiedade. Dividir a turma em pequenos grupos e atribuir a cada um deles um aspecto específico para sêr discutido. Sugere-se quê cada grupo discuta seu tema por 15 minutos,
Página quinhentos e quarenta
refletindo sobre a contribuição da Ciência para a área e os desafios éticos ou sociais envolvidos. Sugere-se quê cada grupo tenha de três a cinco minutos para apresentar suas ideias ao restante da turma. Incentivá-los a apontar tanto os benefícios quanto os possíveis riscos de cada aspecto. Reservar 20 minutos para o debate aberto, de modo quê todos possam comentar ou perguntar sobre os pontos levantados pêlos outros grupos.
A Ciência tem um papel fundamental no avanço da ssossiedade ao promover o conhecimento, melhorar a qualidade de vida e ajudar na resolução de problemas globais. Para contribuir d fórma eficaz, a Ciência deve se basear em princípios éticos, buscando soluções sustentáveis para desafios nas áreas da saúde, do ambiente e da tecnologia, por exemplo. Ela deve sêr usada para o desenvolvimento de medicamentos, energias limpas e novos materiais, mas sempre com responsabilidade social e ambiental. Além díssu, é importante quê o conhecimento científico seja acessível a todos, garantindo quê os benefícios advindos da Ciência alcancem a população d fórma equitativa e possam sêr totalmente aproveitados. É pêrtinênti destacar a necessidade de políticas públicas e investimentos quê priorizem a Ciência voltada para o bem comum, prevenindo seu uso para fins prejudiciais, como o armamento ou a exploração irresponsável de recursos.
Tema 35 • Aplicações e implicações da radioatividade
Reflita
1. Resposta pessoal. O objetivo não é apontar os êêrros ou os acêrrrtos dos estudantes, mas incentivá-los a refletir sobre a questão. Esta é uma oportunidade para promover um debate entre eles e incentivá-los a apresentar, de modo crítico, os aspectos positivos e negativos do uso da radioatividade. Os avanços no uso da radioatividade trousserão muitos benefícios, como a geração de energia nuclear, considerada uma fonte limpa e eficiente, e o desenvolvimento de tratamentos médicos, como a radioterapia, quê salva muitas vidas. No entanto, também há aspectos negativos, como os riscos associados ao descarte inadequado de resíduos radioativos e os perigos de acidentes nucleares, quê podem ter consequências devastadoras para o ambiente e para a saúde humana. Assim, os efeitos da radioatividade são compléksos e exigem um equilíbrio cuidadoso entre os benefícios e os riscos.
2. Resposta pessoal. O objetivo não é apontar os êêrros ou os acêrrrtos dos estudantes, mas incentivá-los a refletir livremente sobre a quêstão. Esta é uma oportunidade para promover um debate entre eles e incentivá-los a apresentar argumentos contra o uso da energia nuclear ou a favor dele. Espera-se quê os estudantes desenvolvam uma argumentação clara e fundamentada, utilizando os conceitos aprendidos em sala de aula. Por exemplo, alguns podem destacar que a energia nuclear é uma fonte eficiente e de baixa emissão de carbono, contribuindo para a redução do aquecimento global. Podem mencionar quê, embora existam riscos, os avanços tecnológicos tornaram as usinas mais seguras. Eles também podem citar quê muitos países, como a França, usam essa fonte de energia com sucesso. Já outros estudantes podem enfatizar os perigos associados a acidentes nucleares, como os de Chernobyl e de Fukushima, quê causaram impactos significativos ao ambiente e à saúde humana. Podem argumentar ainda quê a energia nuclear produz resíduos radioativos quê permanecem perigosos por longos períodos, além de afirmar quê existem alternativas mais seguras e sustentáveis, como as energias solar e eólica. Incentivar os estudantes a construir as próprias respostas considerando diferentes perspectivas e a utilizar informações baseadas em dados, expressando seus pontos de vista de maneira respeitosa e coerente.
Formação cidadã
1. Resposta pessoal. Espera-se quê os estudantes indiquem quê o ciclo do combustível nuclear é compôzto de várias etapas, como: mineração, conversão, enriquecimento, reconversão, fabricação de pastilhas, montagem de elemêntos combustíveis, geração de energia, armazenamento, reprocessamento e disposição final. Detalhes sobre essas etapas podem sêr consultados no documento Plano nacional de energia: 2030, disponível em: https://livro.pw/gvjqy (acesso em: 27 out. 2024).
2. Resposta pessoal. Os estudantes podem indicar quê a distribuição das usinas nucleares no mundo está fortemente concentrada em países economicamente desenvolvidos, como Estados Unidos, França e Japão. Esse fato se justifica pelo alto custo de construção e manutenção dessas instalações, quê requerem tecnologia avançada e infraestrutura especializada, além de uma regulação rigorosa. Países desenvolvidos possuem os recursos financeiros, tecnológicos e humanos para investir nesse tipo de energia, quê é eficiente e permite atender às demandas crescentes de eletricidade d fórma estável. Além díssu, muitos dêêsses países possuem políticas energéticas quê buscam reduzir a dependência de combustíveis fósseis, promovendo fontes alternativas, como a nuclear.
Atividades
1. Se a concentração é da concentração inicial, passaram-se dois períodos de meia-vida, logo o fóssil tem aproximadamente 11.400 anos.
2. Resposta pessoal. O laser é usado em cirurgias de precisão, como cirurgias oftalmológicas (correção de visão a laser), e tratamentos dermatológicos (remoção de tatuagens e manchas de pele). Na indústria, o laser é fundamental em processos de kórti e soldagem de materiais, oferecendo precisão e eficiência. Além díssu, é utilizado em dispositivos de leitura, como leitores de códigos de barras, cê(Dêss) e dê vê dêz, e em comunicações ópticas, quê permitem a transmissão de grandes quantidades de dados pela internet. Essa tecnologia também tem papel importante na Ciência: em áreas como a Física Quântica, há experimentos quê exigem medições extremamente precisas. A relevância do laser na ssossiedade moderna está ligada à sua capacidade de modificar áreas diversas, como a Medicina, a indústria e até o entretenimento, com shows de luzes e hologramas.
3. Resposta pessoal. Atualmente, em 2024, existem duas reservas de urânio sêndo exploradas no Brasil, uma em Caetité (BA) e outra em Santa Quitéria (CE). Também há um sítio desativado em Caldas (MG). Outras reservas já foram encontradas, mas não são exploradas: Itataia (CE), Espinharas (PB), Rio Cristalino (PA), Amorinópolis (GO), Figueira (PR) e no Quadrilátero Ferrífero (MG). Essas e outras informações podem sêr obtidas no sáiti das Indústrias Nucleares do Brasil (INB), única empresa autorizada a explorar as reservas de urânio no país, disponível em: https://livro.pw/jqozh (acesso em: 27 out. 2024).
4. Resposta pessoal. Nesta atividade, os estudantes devem verificar as fontes de energia existentes no país, pois a necessidade do uso de energia nuclear está diretamente associada à existência e à disponibilidade de outras fontes. A matriz energética brasileira é baseada em hidrelétricas, porém essas usinas são muito dependentes de kestões climáticas e alteram de modo significativo o ambiente onde são construídas. Esses e outros pontos podem sêr abordados em uma discussão envolvendo toda a turma.
Página quinhentos e quarenta e um
5. Resposta pessoal. Existem várias campanhas de prevenção ao câncer com o objetivo de informar a população da importânssia da prevenção e do diagnóstico precoce. Entre as mais conhecidas estão Outubro Rosa, campanha voltada para a prevenção do câncer de mama, e Novembro Azul, quê foca o câncer de próstata, ambas citadas no Tema. Essas campanhas promóvem diversas ações, como exames gratuitos, palestras e distribuição de materiais informativos, além de iluminarem de azul ou cor-de-rosa monumentos e prédios públicos para chamar a atenção para essas causas.
Para levar essas campanhas à escola ou ao bairro, pode-se organizar algumas das seguintes ações.
Palestras educativas: convidar trabalhadores da saúde, como profissionais da Medicina ou da enfermagem, para dar palestras sobre a prevenção, os fatores de risco e a importânssia do diagnóstico precoce.
Distribuição de panfletos informativos: criar ou distribuir materiais simples com informações sobre os tipos de exames preventivos, como a mamografia e o exame de PSA, e sobre como realizar o auto-êzami de mama.
Eventos de conscientização: organizar caminhadas ou eventos esportivos quê promovam o tema e incentivem hábitos saudáveis, fundamentais na prevenção do câncer.
Campanha nas rêdes sociais da escola ou do bairro: divulgar posts informativos e vídeos curtos quê ajudem a difundir o conhecimento sobre a prevenção e a importânssia do diagnóstico precoce, para quê mais pessoas tênham acesso às informações d fórma rápida.
Parcerias com postos de saúde locais: tentar fazer uma parceria para oferecer exames preventivos na escola ou no bairro, facilitando o acesso da comunidade a esses cuidados.
Tema 36 • A Química e o ambiente
Reflita
1. Resposta pessoal. Espera-se quê os estudantes indiquem quê a preocupação com a preservação e a qualidade da á gua deve existir porque, embora ela esteja sempre em circulação no planêta, sua disponibilidade para uso humano em boas condições é limitada. Muitas vezes, a á gua é poluída ou contaminada em razão do uso, o quê a torna imprópria para consumo, agricultura ou atividades industriais. Além díssu, nem toda a á gua está acessível de maneira diréta, já quê a maior parte está nos oceanos, em forma de gêlo ou em aqüíferos subterrâneos profundos. Preservar a á gua limpa é essencial para garantir quê se tenha o suficiente para atender as necessidades atuáis e as do futuro.
2. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para essa quêstão. O objetivo é fazê-los levantar hipóteses livremente com base no que estudaram até o momento. O uso incorréto do solo póde causar sua degradação e torná-lo inutilizável para fins agrícolas. Além díssu, póde afetar sua biodiversidade. A monocultura e a adubação química são exemplos de técnicas de cultivo quê contribuem para a degradação do solo.
3. Resposta pessoal. A proposta da quêstão é fazer os estudantes refletirem sobre situações em que a respiração foi prejudicada. Em alguns casos, a respiração póde se tornar mais difícil em razão de condições atmosféricas adversas ou da má qualidade do ar. Exemplos comuns incluem períodos de baixa umidade, quê podem ressecar as vias respiratórias, e a presença de poluentes no ar, como poeira levantada por tráfego em estradas não pavimentadas ou fumaça de queimadas. A poluição gerada por veículos em áreas urbanas também contribui para a piora da qualidade do ar, tornando a respiração desconfortável.
4. Resposta pessoal. Não se espera quê os estudantes fôrneçam respostas cértas ou erradas para esta quêstão. O importante é levá-los a refletir livremente se é possível mudar padrões de consumo para causar menos danos ao ambiente. Pode-se conduzir uma discussão no sentido de apontar formas de consumo mais sustentáveis e conscientes, que equilibram as necessidades pessoais e a saúde do planêta.
Atividades
1. Respostas pessoais. Espera-se quê os estudantes indiquem como é o abastecimento de á gua onde moram, mencionando se a á gua quê utilizam em sua residência vêm de um sistema público ou privádo. Eles devem relatar se a á gua é tratada antes de chegar às torneiras e se há um monitoramento regular da qualidade da á gua. Além díssu, os estudantes devem mencionar se o esgoto gerado na residência deles é coletado adequadamente e tratado em uma estação de tratamento de esgoto próxima. É importante quê eles considerem se a estação atende à demanda da população e se o esgoto tratado é devidamente descartado em corpos de á gua, evitando a contaminação ambiental. Por fim, é esperado quê eles reflitam sobre os desafios quê a comunidade enfrenta em relação ao abastecimento de á gua e ao saneamento e como esses fatores pódem interferir na saúde e na qualidade de vida da população. Essa análise pode levar a discussões sobre a importânssia da conservação da á gua e da infraestrutura de saneamento.
2. Resposta pessoal. Espera-se quê os estudantes apresentem algumas atitudes quê contemplem o uso consciente da á gua ou ações quê representem o desperdício dêêsse importante recurso natural.
3. Resposta pessoal. O objetivo desta atividade é conscientizar os estudantes, por meio da observação e da análise, a respeito do descarte de produtos no sistema de esgoto. Pode-se trabalhar com eles uma estimativa da quantidade de café descartada diariamente na comunidade ou no bairro onde vivem.
4. Resposta pessoal. Espera-se quê os estudantes percêbam quê é possível chegar a um consenso, embora seja um tema complékso e polêmico. O grupo quê defende o uso de agrotóxicos póde argumentar quê são produtos quê aumentam a produtividade agrícola, contrólam pragas d fórma eficaz e permitem o cultivo em larga escala, garantindo a segurança alimentar. Além díssu, podem destacar quê, em alguns casos, não há alternativas viáveis, a curto prazo, para garantir a produção em grande escala. Já o grupo quê destaca os perigos dos agrotóxicos póde enfatizar os riscos de contaminação do solo, da á gua e dos alimentos, além dos riscos à saúde dos trabalhadores agrícolas e dos consumidores. Eles podem também argumentar quê o uso indiscriminado dêêsses produtos póde levar à perda de biodiversidade e à resistência de pragas. Ao debaterem, ambos os grupos podem reconhecer quê o uso de agrotóxicos, apesar de ter vantagens econômicas, precisa sêr feito com cautela, considerando o desenvolvimento de alternativas sustentáveis, como o manejo integrado de pragas e o uso de biopesticidas. O consenso póde sêr alcançado na ideia de quê é necessário buscar um equilíbrio entre a produção eficiente de alimentos e a preservação da saúde humana e ambiental.
5. Resposta pessoal. O objetivo do estudo da Química é fazer com quê os estudantes sêjam críticos e conscientes do mundo em quê vivem, com uma preocupação genuína pelo planêta e pelo bem-estar das pessoas. Ao adquirir conhecimento sobre princípios químicos, eles são capacitados a compreender melhor os desafios ambientais e sociais, o quê lhes permite assumir um papel ativo na busca por soluções. A conscientização sobre
Página quinhentos e quarenta e dois
a interferência das atividades humanas no ambiente póde motivar os estudantes a adotar práticas mais sustentáveis no cotidiano, como a redução do uso de plásticos, a reciclagem adequada de materiais e a escolha de produtos químicos menos nocivos. Além díssu, ao entenderem os processos químicos envolvidos na produção e no descarte de substâncias, eles podem participar de iniciativas comunitárias quê visem à preservação do ambiente e à promoção da saúde pública.
6. Resposta pessoal. Espera-se quê os estudantes reconheçam quê a preservação ambiental é responsabilidade de toda a ssossiedade, envolvendo tanto os governos e as empresas quanto cada cidadão.
7. Espera-se quê os estudantes indiquem quê pegada ecológica foi um conceito criado para relacionar consumo, exploração e uso de recursos naturais com a capacidade do planêta de repor esses recursos. Ele ajuda a verificar quão próximo o sêr humano está da sustentabilidade e a visualizar o impacto causado pelo atual modo de vida das pessoas. Exemplos de ações quê ajudariam a reduzir a pegada ecológica: consumo consciente e reduzido de bens materiais (avaliar sempre a real necessidade do consumo), economia de á gua, reciclagem dos resíduos, redução do consumo de carne, uso de transporte coletivos, entre outras.
8. Espera-se quê os estudantes indiquem quê a afirmação é incorréta. A Química Verde visa à invenção, ao desenvolvimento e à aplicação de produtos e processos químicos para reduzir ou eliminar o uso e a geração de substâncias perigosas. Nem sempre será possível eliminar completamente os impactos causados por produtos e processos.
9. a) É importante quê os estudantes reconheçam quê o descarte de medicamentos no vaso sanitário ou no lixo comum póde contaminar o solo e a á gua, impactando negativamente o ambiente e a saúde pública. Espera-se quê sugiram a recomendação de levar esses produtos a uma farmácia ou ponto de côléta especializado em resíduos de saúde, onde eles podem sêr descartados corretamente e sem causar danos ambientais.
b) Espera-se quê os estudantes proponham a busca por algum ponto de côléta de lixo eletrônico, geralmente disponível em locais como ecopontos, cooperativas de reciclagem, lojas de eletrônicos ou supermercados quê oferecem serviço para esse tipo de descarte. Esses locais estão aptos a orientar e garantir quê o descarte seja feito d fórma ambientalmente correta.
Atividades complementares
1. Alternativa E. Quatro compostos foram citados no texto, dois óxidos (NO2 e SO2) e dois ácidos (HNO3 e H2 SO4).
2. Alternativa A. A combustão de hidrocarbonetos produz gás carbônico e á gua. O gás carbônico é considerado um óxido ácido, pois, ao reagir com a á gua, produz o ácido carbônico (H2 CO3).
3. Alternativa B. Como o cobre tem o maior potencial, será a espécie quê vai reduzir, e o alumínio será a espécie quê vai oxidar (agente redutor), assim o resultado é encontrado após o balanceamento da reação.
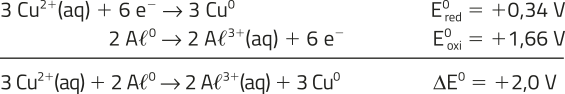
4. Alternativa E. A faca é feita de ferro (Fe), e, sobre ela, ocorre o gotejamento de uma solução de sulfato de cobre (Cu2+). Primeiro, identificam-se as reações no qüadro.
Cu2+(aq) + 2 e− → Cu(s) E0 = +0,34
Fe3+ (aq) + 3 e− → Fe(s) E0 = −0,04
Em seguida, observa-se a espécie química quê vai reduzir e faz-se o balanceamento das equações.
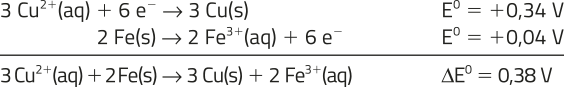
5. Alternativa B. O carregador deverá superar a diferença de potencial da pilha formada pêlos metais apresentados. Assim, o resultado é obtído após balancear as equações e considerar quê o cádmio é a espécie quê vai oxidar.
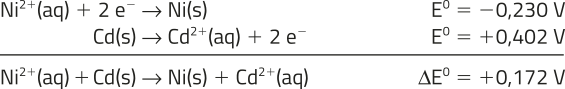
6. Alternativa A. Um metal de sacrifício vai oxidar no lugar do aço. É preciso utilizar um metal com potencial de redução menor do quê o do ferro metálico. Com base nos dados informados, conclui-se quê o zinco tem potencial menor do quê o do ferro.
7. Soma: 31 (01 + 02 + 04 + 08 + 16).
01) Correto. Analisando a figura, a placa carregada positivamente atrai as partículas beta. 02) Correto. A radiação gama não tem carga. 04) Correto. Para decair de 100 g para 50 g, 245 mil anos; para decair de 50 g para 25 g, mais 245 mil anos. Total de 490 mil anos. 08) Correto. A radiação alfa tem massa igual a 4 e número de prótons igual a 2. 16) Correto. O decaimento radioativo do urânio-234 por meio da emissão de uma partícula alfa reduz a massa atômica para 230 e o número de prótons para 90, quê corresponde a um isótopo de tório.
8. Alternativa D. Com base no qüadro, constata-se quê o tempo de meia-vida do iodo-131 é de 8 dias (tempo quê reduziu de 12 mg para 6 mg). Assim, após 5 tempos de meia-vida a massa do iodo-131 será de 0,375 μg (aproximadamente 0,4 μg).
9. Alternativa E. Com base no texto e na imagem, percebe-se quê o raio Xís é o tema central apresentado. Assim, os raios Xís são absorvidos pelo cálcio dos óssos e não atingem o filme.
10. Alternativa D. A decomposição anaeróbica produz o gás metano (CH4), quê póde sêr utilizado como um gás combustível.
11. Alternativa C. O aumento da quantidade de matéria OR GÂNICA está relacionado com o aumento da quantidade de plantas no local. Desse modo, quanto mais plantas existirem, maior será o índice de realização de fotossíntese, quê sequestra o CO2 e minimiza o agravamento do efeito estufa.
Integrando com...
1. Os estudantes devem indicar quê o sistema decimal utiliza dez caracteres diferentes (0 a 9) para representar informações, enquanto o sistema binário utiliza apenas dois caracteres (0 e 1). Apesar de sêr mais simples, o sistema binário é extremamente importante para atribuir comandos às máquinas, pois é a base da computação.
2. Os estudantes devem perceber a quantidade de caracteres necessária para representar os nomes em binário, mostrando a simplicidade do sistema em comparação com a riqueza do alfabeto.
3. Resposta pessoal. Os estudantes podem citar telefones celulares, aviões e barcos como exemplos de equipamento. Para sensores, eles podem citar sensores de localização (GPS), de umidade do ar, entre outros. Ao escolher um sensor, espera-se quê expliquem, por exemplo, como funciona um sensor de umidade do ar, quê méde a quantidade de vapor de á gua no ar.
4. Resposta pessoal. Os estudantes devem incorporar na proposta aspectos científicos do funcionamento do bafômetro. Além díssu, o material deve conter uma proposta de conscientização sobre os riscos da ingestão de áucôl associada à direção, enfatizando a importânssia de não dirigir sôbi a influência de bebidas alcoólicas.
Página quinhentos e quarenta e três