Página XXX
Orientações, sugestões e respostas
Neste tópico das Orientações para o professor, serão apresentados os objetivos das unidades, bem como as habilidades e competências da BNCC trabalhadas em cada tema. Além disso, serão apresentadas orientações, sugestões de atividades e materiais complementares, assim como estratégias de avaliação para os conteúdos abordados em cada capítulo.
Unidade 1 A Química e a matéria do Universo
Nessa unidade, são abordados conteúdos relacionados ao desenvolvimento da Ciência ao longo do tempo, apresentando as explicações místicas dos fenômenos naturais e ressaltando suas diferenças em relação às explicações científicas, baseadas em observações, investigações e formulação de hipóteses. Outro papel significativo dessa unidade é mostrar aos estudantes que a Ciência é uma construção humana contínua, passível de alterações. Eles também vão perceber a importância da mulher no desenvolvimento científico, conhecendo as contribuições de muitas delas.
Objetivos da unidade
- Entender como são realizadas as investigações científicas.
- Identificar os diferentes tipos de conhecimento.
- Reconhecer que o conhecimento científico é uma construção humana contínua, passível de mudanças.
- Valorizar a participação da mulher no desenvolvimento científico.
- Reconhecer a importância da divulgação científica.
- Apontar os principais conceitos envolvidos no estudo da Química.
- Conhecer o modelo atômico e ver que ele é o resultado do trabalho de diversos cientistas.
- Entender a tabela periódica.
- Diferenciar substâncias e misturas.
- Analisar métodos de separação de misturas.
Justificativas
O tema dessa unidade e os conteúdos discutidos em cada capítulo são essenciais para que os estudantes entendam a importância do conhecimento científico. Isso permitirá a eles compreender os fenômenos naturais do cotidiano, resolver problemas de maneira eficaz e adotar uma postura crítica e consciente frente às questões relevantes da sociedade. O estudo de modelos científicos propostos em diferentes épocas permite a discussão da atividade científica como um empreendimento humano, que passa por constantes transformações, favorecendo o trabalho com a habilidade EM13CNT201.
Durante o estudo do desenvolvimento do conhecimento científico, os estudantes conhecerão importantes contribuições femininas, que os incentivarão a derrubar paradigmas e preconceitos que afastam as mulheres da Ciência, favorecendo o trabalho com a habilidade EM13CNT305.
Abertura da unidade - páginas 12 e 13
BNCC em contexto
A abordagem das páginas iniciais dessa unidade incentiva os estudantes a refletir sobre a dimensão investigativa das Ciências da Natureza e suas tecnologias, ressaltando que o desenvolvimento dessa área deve ser inclusivo e não fazer distinção de gênero. Portanto, a abertura da unidade contribui para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 1.
A questão c incentiva os estudantes a refletir ativamente sobre a importância das mulheres nas Ciências, contribuindo para desenvolver a Competência geral 1.
Inicie a abordagem dessas páginas solicitando aos estudantes que observem a fotografia e relatem o que pensam a respeito das informações que a análise de um fragmento de meteorito pode trazer sobre a constituição e a formação da matéria do Universo.
Respostas
a ) Resposta pessoal. Espera-se que os estudantes reconheçam a importância desses estudos, pois permitem compreender como os fenômenos da natureza ocorrem.
b ) Resposta pessoal. Conhecer a estrutura da matéria é importante para explicar propriedades e comportamentos dos materiais. Isso ajuda no desenvolvimento de novas tecnologias e na compreensão das reações químicas.
c ) Resposta pessoal. Reconhecer e valorizar as contribuições das mulheres na ciência é fundamental para promover a igualdade de gênero e garantir que talentos e perspectivas diversas sejam incluídos na pesquisa científica. Isso enriquece a ciência com novas ideias e abordagens, além de inspirar futuras gerações de cientistas.
d ) Resposta pessoal. Os estudantes podem dizer que o estudo de substâncias e misturas é essencial para o desenvolvimento de produtos e o tratamento de resíduos.
Capítulo 1 – A ciência moderna - páginas 14 a 27
Objetivos do capítulo
- Valorizar e utilizar os conhecimentos historicamente construídos.
- Conhecer as diversas funções que um químico pode desempenhar.
Página XXXI
- Relacionar os conhecimentos químicos com os objetivos da Agenda 2030.
- Valorizar a diversidade de saberes, diferenciando as várias formas como ela se apresenta.
- Reconhecer a Ciência como manifestação sociocultural, sujeita a paradigmas referentes ao momento histórico.
- Contextualizar o desenvolvimento científico em diferentes culturas e sem distinção de gênero.
BNCC em contexto
Nas páginas 14 e 15, o estudo das teorias e práticas da alquimia proporciona aos estudantes o contato com saberes do passado e a percepção de que ela é construída gradativamente. Além disso, leva-os a reconhecer que todos os conhecimentos são importantes e que se deve considerar o momento histórico, as condições sociais e a tecnologia vigentes para que seja feita uma análise crítica responsável sobre determinada teoria. Espera-se que se situem no presente, enquanto percebem a base histórica fundamental que os levou a estar onde e como estão atualmente. Desse modo, eles desenvolvem as Competências gerais 1 e 2 e a habilidade EM13CNT201.
Ao refletir sobre as importantes contribuições científicas femininas, espera-se que os estudantes derrubem ou ajudem a eliminar paradigmas e preconceitos que afastam as mulheres da Ciência, favorecendo o desenvolvimento das Competências gerais 1 e 9 e da habilidade EM13CNT305.
Após o trabalho com a página 14, oriente os estudantes para que conversem sobre outras maneiras, além de pesquisas em laboratório, de os saberes científicos serem criados e transmitidos. Para isso, realize a estratégia Think-pair-share. Solicite a cada estudante que pense em quais profissões ou atividades estão relacionadas à criação e à transmissão científica e como ocorrem. Após três minutos, peça a eles que se juntem em duplas e discutam suas conclusões. Solicite às duplas que mostrem os exemplos e exponham seus raciocínios. Anote na lousa os pontos principais. Essa atividade permite desenvolver a Competência geral 6 e o tema contemporâneo transversal Trabalho, pois incentiva os estudantes a refletir sobre diferentes profissões, levando-os a valorizar a diversidade de saberes e se apropriarem de conhecimentos que os permitam entender as relações do mundo do trabalho, bem como fazer escolhas alinhadas ao projeto de vida de cada um.
BNCC em contexto
Ao abordar as páginas 16 e 17, que mostram as diferentes áreas de atuação dos profissionais de Química, infere-se que o desenvolvimento atual dessa área está voltado para os modos de produção mais sustentáveis. Portanto, a discussão promovida contribui para aprimorar a habilidade EM13CNT309.
Compartilhe ideias - página 17
O boxe Compartilhe ideias da página 17 está relacionado ao tema contemporâneo transversal Trabalho ao tratar do alto número de publicações científicas e permitir a discussão a respeito de uma das atribuições dos cientistas. Esse boxe tem o objetivo de fazer os estudantes identificarem as dificuldades e os obstáculos relacionados à pesquisa e à publicação científica no Brasil. Se possível, pergunte a eles como acham que funciona o processo de publicação de artigos científicos e, se julgar interessante, proponha-lhes a elaboração de um artigo, nesses moldes, sobre o tema abordado nessa seção.
Resposta
a ) Espera-se que os estudantes citem que as pesquisas ainda enfrentam muitos obstáculos para seu desenvolvimento, como a falta de investimento e de pesquisadores e o processo burocrático para sua realização. Como medidas para melhorar a produção e a qualidade de trabalhos científicos no Brasil, eles podem citar incentivo e valorização das pesquisas científicas por parte da população em geral e ampliação da divulgação dos estudos científicos.
BNCC em contexto
A abordagem da página 18 contribui para o desenvolvimento da Competência geral 6 ao incentivar a valorização da diversidade de saberes e vivências culturais.
Ligado no tema - página 18
Objetivos
- Diferenciar conhecimento científico, conhecimento tradicional e senso comum.
- Reconhecer a importância da propriedade intelectual.
Orientações
Essa seção favorece o trabalho em conjunto com o professor do componente curricular de Sociologia, ao abordar os diferentes tipos de conhecimento. Questione os estudantes se já ouviram falar sobre esses tipos de conhecimento. Comente que cada um deles possui características específicas, que não podem ser desconsideradas, e que devem ser interpretadas dentro de seus devidos contextos. Explique que alguns conhecimentos populares, como a época adequada de semear e colher determinados tipos de cereais, foram sistematizados e incorporados pela ciência. Entretanto, também existem práticas oriundas do senso comum, transmitidas de geração em geração, que não têm respaldo científico.
Integrando o conhecimento
Na página 21, leia com os estudantes a tirinha quadrinho por quadrinho, questionando o que eles esperam dos quadrinhos seguintes. O uso desse recurso contribui para o trabalho com o componente curricular de Língua Portuguesa, de modo que os estudantes compreendam não apenas as falas dos personagens e o propósito da crítica social apresentada, mas também identifiquem as características do gênero que ajudam nessa interpretação, como os elementos visuais.
Página XXXII
BNCC em contexto
A abordagem da página 26 contribui para o desenvolvimento da habilidade EM13CNT303, pois incentiva os estudantes a elaborar estratégias para selecionar fontes confiáveis de informação ao pesquisar divulgadores científicos em redes sociais.
Ligado no tema - página 26
Objetivos
- Conhecer a divulgação científica.
- Refletir sobre a confiabilidade de fontes de informação.
- Compreender a importância de divulgar o conhecimento científico.
Orientações
Depois que os estudantes lerem o cartaz da página 26, pergunte se já viram cartazes desse tipo e se conhecem outras formas de fazer uma divulgação científica. Caso mencionem outros exemplos, como por meio de redes sociais, incentive-os a compartilhar essas informações com o restante da turma. Enfatize os diversos formatos pelos quais esse conhecimento circula. Informar-se apenas por meio de posts ou vídeos em redes sociais proporciona uma compreensão diferente do conteúdo em comparação com a leitura de revistas sobre ciências, que por sua vez é diferente de participar de seminários e congressos.
O objetivo das questões b, c e d é fomentar nos estudantes um olhar crítico e criterioso para os conteúdos consumidos na internet. Se necessário, auxilie-os analisando as informações obtidas por eles. Verifique se os conteúdos estão relacionados à divulgação da área das ciências e se as fontes das informações são confiáveis.
Acompanhando a aprendizagem
Ao final do capítulo, avalie a compreensão dos estudantes sobre o desenvolvimento da ciência aplicando a estratégia Jogo pedagógico – verdadeiro, falso ou discussão. Para isso, divida a turma em grupos e distribua cartões com perguntas sobre os conteúdos estudados. Confira mais orientações sobre essa estratégia nas páginas XI e XII destas Orientações para o professor.
Respostas - Páginas 19 e 20
1. a ) Porque o novo modelo rompe com os pensamentos aceitos até o momento, propondo uma nova organização para os astros do Sistema Solar. Observa-se, assim, uma quebra de paradigma: a Terra e os seres humanos deixam de ser destaque no centro do Universo para assumir posição semelhante à de outros astros, orbitando ao redor de uma estrela, o Sol.
b ) O objetivo dessa questão é levar os estudantes a entender que o conhecimento científico não é uma verdade absoluta: pode ser reformulado, complementado ou substituído quando se torna insuficiente para explicar fenômenos observados. Espera-se que eles comentem que algumas previsões do modelo geocêntrico não estavam de acordo com o observado, tornando-o incompatível com algumas constatações.
3. b ) Espera-se que os estudantes respondam que a pesquisa aponta como a infecção por esse vírus pode ser prejudicial à saúde, alertando a população. Assim, o cidadão pode e deve adotar medidas que evitem a proliferação do mosquito e a transmissão da doença, como remover água parada dos ambientes, manter caixas-d'água tampadas e não acumular resíduos nas residências.
6. c ) Uma vez reconhecidas as propriedades intelectuais por meio dos conhecimentos tradicionais, pode-se dar o devido crédito aos verdadeiros detentores do saber, e possíveis recursos econômicos provenientes de patentes podem ajudar a garantir a proteção e sobrevivência desses povos.
Respostas - Página 27
1. a ) Resposta pessoal. Espera-se que os estudantes reflitam e reconheçam que os erros que ocorrem quando o oxímetro é utilizado em pacientes negros podem indicar que, na fase de desenvolvimento do dispositivo, os testes foram feitos principalmente com pessoas de pele clara.
b ) Um resultado equivocado pode interferir no diagnóstico, pois indicará que a pessoa está com oxigenação maior do que a real, atrasando a possível hospitalização e o tratamento de um paciente.
c ) Espera-se que os estudantes respondam que novos aparelhos devem ser desenvolvidos e que pessoas negras devem fazer parte dos testes desses aparelhos. Dessa forma, evita-se a criação de produtos que possam apresentar desigualdades em seus usos e garante-se que todos se beneficiem das inovações científicas.
d ) Resposta pessoal. Espera-se que, com base na pesquisa realizada, os estudantes compreendam que o racismo científico surgiu no século XIX, usando a ciência para justificar e perpetuar preconceitos raciais ao tratar características como a cor da pele como forma de fundamentar uma hierarquia racial. Ao relacionar o tema pesquisado com os erros que ocorrem no uso de oxímetros, os estudantes podem identificar como preconceitos históricos ainda afetam a saúde e o acesso a cuidados médicos da população negra.
e ) Espera-se que os estudantes reconheçam que a ciência pode revelar preconceitos e vieses que tendem a ser reproduzidos por cientistas, mesmo sem intenção, em razão de o desenvolvimento científico se basear historicamente em padrões hegemônicos. Portanto, espera-se que eles reflitam e reconheçam que a diversidade no campo científico é essencial para agregar diferentes perspectivas e enriquecer a ciência.
4. Resposta pessoal. Essa atividade tem o objetivo de levar os estudantes a pesquisar a carreira acadêmica de cientistas mulheres, contribuindo para uma análise da diversidade nas áreas científicas. Tal informação pode revelar fragilidades e vieses dos sistemas de divulgação científica e de reconhecimento acadêmico.
Página XXXIII
Capítulo 2 – Conceitos iniciais de Química - páginas 28 a 37
Objetivos do capítulo
- Compreender a importância da padronização na Ciência.
- Utilizar corretamente grandezas e unidades de medida.
- Estimar ordem de grandeza.
BNCC em contexto
O conteúdo das páginas 28 e 29 contribui para o desenvolvimento da Competência geral 2, pois possibilita aos estudantes compreender a necessidade do uso padronizado de grandezas físicas, recorrendo à abordagem própria das Ciências.
Ao trabalhar o quadro com as grandezas e unidades de medida, leia com os estudantes todos os itens listados, enfatizando a diferença entre grandeza e unidade e destacando que as grandezas apresentam diferentes unidades.
Explore as ilustrações das páginas 29 e 30 mostrando aos estudantes como, no dia a dia, eles se deparam constantemente com situações em que grandezas físicas (as mesmas usadas em um laboratório de Química) são utilizadas. Inicie a discussão questionando-os sobre outras situações e contextos em que eles devem identificá-las para realizar alguma tarefa (a preparação de um suco, em que se calcula o volume de água a ser usado, a relação entre a massa e a quantidade de pão a ser comprada na padaria etc.). Assim, os estudantes poderão perceber que, na Química, eles devem usar essas grandezas como o fazem no cotidiano.
Nos tópicos sobre massa, peso, volume e densidade, questione os estudantes sobre a semelhança de alguns desses conceitos e como eles utilizam essas grandezas no dia a dia. É importante eles perceberem que, mesmo que o termo peso seja mais utilizado do que massa (geralmente se fala o peso de uma pessoa em quilogramas, por exemplo), ele não se aplica aos padrões científicos – ainda que seja um modo de pensar em situações do senso comum.
Integrando o conhecimento
Na página 29, ao diferenciar massa (quantidade de matéria) de peso (força), enfatize o conceito de força do componente curricular de Física, já que em Química a utilização da massa dos materiais é mais frequente para a compreensão de suas propriedades. Destaque que o peso, ou seja, a força exercida pelos materiais na superfície da Terra, tem influência da aceleração da gravidade e não é igual em toda a superfície terrestre.
Faça uma relação dessa discussão no momento de abordar o volume e a densidade, pois os conceitos de densidade e peso podem ser confundidos pelos estudantes. É importante destacar que a densidade é uma relação entre o volume e a quantidade de matéria (massa). Faça uma comparação simples com a pergunta: "O que ‘pesa' mais: um 1 quilograma de chumbo ou 1 quilograma de algodão?". Muitos estudantes, intuitivamente, podem responder que o chumbo "pesa" mais, analisando os dois sistemas por meio da natureza do material (no dia a dia, julgamos que chumbo pesa muito mais que algodão). Destaque que a massa (quantidade de matéria) é a mesma (1 quilograma para cada), mas as densidades são diferentes, pois 1 quilograma de algodão ocupa um volume muito maior do que 1 quilograma de chumbo. Dessa forma, mesmo que o chumbo e o algodão tenham a mesma massa, possivelmente, ao jogá-los em um recipiente com água, o chumbo afundará – por ter densidade maior, de 11 gramas por centímetros cúbicos –, enquanto o algodão ficará na superfície da água, pois sua densidade é de 0 vírgula 45 grama por centímetro cúbico, menor do que a densidade da água abre parênteses 1 grama por centímetro cúbico fecha parênteses.
Outro exemplo que pode despertar o interesse dos estudantes é a comparação entre gordura e músculo no corpo humano. A gordura ocupa mais espaço que o músculo, pois meio quilograma de gordura ocupa aproximadamente 18% mais volume do que meio quilo de músculo. Essa diferença ocorre porque a gordura é menos densa que o músculo, resultando em um maior volume para a mesma quantidade de massa.
Por fim, ao apresentar o conceito de pressão, aponte que, em Química, a compreensão desse conceito é importante, acima de tudo nos estudos sobre os gases e o processamento das reações químicas. A pressão pode influenciar significativamente a maneira como as transformações acontecem, afetando a taxa de ocorrência e a eficiência dos processos. Em uma panela de pressão, por exemplo, a elevada pressão acelera o cozimento dos alimentos. Isso demonstra como essa variável pode alterar as condições e o tempo necessário para completar uma transformação.
Ao abordar o barômetro de Torricelli, nas páginas 32 e 33, explique aos estudantes que o mercúrio é um metal pesado que pode causar danos ao organismo, prejudicando os sistemas nervoso, cardiorrespiratório e imunológico. Oriente-os a investigar as normas e regulamentações legais para o uso do mercúrio em produtos do cotidiano, no meio ambiente, na saúde pública e nas indústrias.
Aproveite para explicar aos estudantes a conexão entre altitude e pressão atmosférica, destacando que a pressão atmosférica diminui à medida que a altitude aumenta.
Para desenvolver a expressão que relaciona a pressão com a altura da coluna de mercúrio, na página 33, se necessário, retome o conceito de densidade e desenvolva a expressão na lousa junto com os estudantes.
Ao abordar temperatura e calor, é importante diferenciar esses dois conceitos por meio da discussão sobre sensações térmicas. Explore a ilustração utilizada na página 33, em que duas pessoas se questionam sobre o uso dos termos calor e quente.
Atividade extra
Proponha a seguinte dinâmica: peça aos estudantes que toquem em um material de metal perto deles (pode ser a barra de ferro da carteira/cadeira ou a maçaneta da porta). Depois, solicite que toquem em algum material de madeira ou plástico (pode ser o material da própria carteira/cadeira). Conduza a dinâmica com estes questionamentos:
a ) Qual material está mais frio? Qual material tem mais calor?
Página XXXIV
Possivelmente, os estudantes responderão que o metal é mais frio e a madeira tem mais calor. Porém, apenas com a sensação térmica, não é possível estimar a quantidade de calor (troca de energia entre a mão e o material).
b ) Qual material está com temperatura maior?
Ambos estão aproximadamente com a mesma temperatura.
Peça aos estudantes que levantem hipóteses sobre o motivo de, mesmo com a mesma temperatura, os materiais terem sensações térmicas diferentes. Depois, explique a propriedade do metal em conduzir melhor energia térmica, permitindo sua troca (relacionando o assunto com a discussão apresentada na página 35, sobre condução térmica). Utilizando o exemplo das colheres e panelas da página 35, enfatize como o conhecimento dessa propriedade permite a escolha de materiais isolantes e condutores para aplicações específicas.
Ao trabalhar os conteúdos da página 36, ressalte que a ordem de grandeza serve para estimar quantidades e, por isso, não representa um valor exato.
Acompanhando a aprendizagem
Aplicando a estratégia Aprendendo a perguntar, selecione o conteúdo sobre grandezas físicas desse capítulo e peça aos estudantes que o releiam.
Solicite que formulem uma pergunta acerca desse conteúdo, que a escrevam em um papel e que, depois, o dobrem. As perguntas podem ser do tipo: "Qual é a diferença entre massa e peso?" ou "Qual é a unidade do SI para pressão?".
Recolha todos os papéis, coloque-os em um envelope ou saquinho plástico e solicite a um estudante por vez que sorteie uma pergunta e a leia para a turma. Um estudante escolhido pelo sorteador deverá respondê-la. Com base na resposta, fomente a discussão sobre o questionamento e sobre a resposta para que todos compreendam a questão.
Respostas - Página 37
1. a )1.000 metros barra quilômetro vezes 3 quilômetros é igual a 3.000 metros
b )1 vezes 10 elevado a 6 milímetros barra quilômetro vezes 2 vírgula 5 quilômetros é igual a 2 vírgula 5 vezes 10 elevado a 6 milímetros
c )1 vezes 10 elevado a 5 centímetro barra 1 quilômetro vezes 4 vírgula 5 quilômetros é igual a 4 vírgula 5 vezes 10 elevado a 5 centímetros
d )1.000 centímetros quadrados barra metro elevado ao quadrado vezes 3 vírgula 1416 metros quadrados é igual a 31.146 centímetros quadrados
e )1 vezes 10 elevado a menos 6 metro quadrado barra milímetro elevado ao quadrado vezes 3 vírgula 5 milímetros quadrados é igual a 3 vírgula 5 vezes 10 elevado a menos 6 metro quadrado
f )3 metros cúbicos vezes 1.000 decímetros cúbicos barra metro cúbico é igual a 3.000 decímetros cúbicos
g )1.000 centímetros cúbicos barra decímetro cúbico vezes 450 vírgula 8 decímetros cúbicos é igual a 450.800 centímetros cúbicos
h )200 centímetros cúbicos vezes início de fração, numerador: 1 decímetro cúbico, denominador: 1.000 centímetros cúbicos, fim de fração é igual a 0 vírgula 2 decímetro cúbico
i )T subscrito K é igual a 100 mais 273 é igual a 373 portanto T subscrito K é igual a 373 Kelvin
j )350 é igual a T subscrito C menos 273 portanto T subscrito C é igual a 77 graus Celsius
k )50 minutos vezes início de fração, numerador: 60 segundos, denominador: 1 minuto, fim de fração é igual a 3.000 segundos
l )início de fração, numerador: 1 minuto, denominador: 60 segundos, fim de fração vezes 1.200 segundos é igual a 20 minutos
m )60 minutos barra 1 hora vezes 2 horas é igual a 120 minutos
n )início de fração, numerador: 1 hora, denominador: 3.600 segundos, fim de fração vezes 14.400 segundos é igual a 4 horas
3. A urina humana tem densidade maior do que a da água em razão da presença de compostos dissolvidos, como sais, ureia e proteínas. Esses materiais aumentam a massa da urina para um determinado volume, resultando em uma densidade maior.
4. Para determinar a massa da solução, primeiro, deve-se determinar a massa da água por meio da equação da densidade: d é igual a 'm' barra V implica em 'm' é igual a 1 vezes 380 é igual a 380 portanto 'm' é igual a 380 gramas. A massa de hidróxido de sódio fornecida no enunciado é de 80 gramas, portanto a massa da solução será: 'm' é igual a 80 gramas mais 380 gramas é igual a 460 gramas. Já o volume da solução deve ser determinado por meio da equação da densidade utilizando a densidade da solução fornecida no enunciado: d é igual a 'm' barra V implica em V é igual a 460 barra 575 é igual a 0 vírgula 8 portanto V é igual a 800 mililitros.
6. a ) A massa de um objeto é uma propriedade intrínseca que não depende da localização. Portanto, a massa da amostra é a mesma tanto na Terra quanto na Lua, 500 gramas.
b ) O peso de um objeto é a força com que ele é atraído pela gravidade e depende tanto da massa do objeto quanto da aceleração da gravidade do local onde ele se encontra. Calculando-se, portanto, temos que o peso da amostra na Terra é 0 vírgula 5 quilograma vezes 9 vírgula 8 metros por segundo elevado ao quadrado é igual a 4 vírgula 9 newtons e na Lua 0 vírgula 5 quilograma vezes 1 vírgula 6 metro por segundo elevado ao quadrado é igual a 0 vírgula 8 newton.
7. a ) O calor é transferido do chá quente para o ar ao seu redor principalmente por convecção. O ar próximo à superfície do chá aquece, torna-se menos denso e sobe, enquanto o ar mais frio desce para ocupar seu lugar, criando correntes de convecção que distribuem o calor.
b ) O aquecedor elétrico aquece o ambiente por meio de condução, convecção e irradiação. O resistor elétrico dentro do aquecedor converte energia elétrica em calor (condução). O ar ao redor do aquecedor aquece e circula pela sala (convecção). Além disso, o aquecedor emite radiação infravermelha, que aquece diretamente os objetos e as pessoas no ambiente (irradiação).
c ) O calor é sentido ao tocar a xícara de chá em razão da condução. O calor é transferido diretamente da superfície quente da xícara para a mão de uma pessoa por causa do contato direto entre os dois corpos.
Capítulo 3 – A matéria - páginas 38 a 56
Objetivos do capítulo
- Compreender o que é matéria e a sua constituição.
- Associar a evolução estelar à distribuição dos elementos químicos no Universo.
- Compreender a elaboração, os limites e as potencialidades dos modelos atômicos.
- Relacionar conhecimentos filosóficos e químicos.
- Descrever a estrutura de um átomo com base nos modelos atômicos atuais.
BNCC em contexto
A abordagem da página 38 contribui para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 1, pois aprofunda o conceito de matéria e sua composição, fornecendo subsídios para os estudantes analisarem fenômenos naturais e processos tecnológicos com base nas relações entre matéria e energia. Nessa página, é possível ainda trabalhar a habilidade EM13CNT201 ao questionar a turma e promover a reflexão, a análise e a discussão a respeito de um modelo atômico.
Página XXXV
O trabalho com as páginas 39 a 42 contribui para o desenvolvimento da habilidade EM13CNT209, já que possibilita aos estudantes analisar a evolução estelar associando-a aos modelos de origem e distribuição dos elementos químicos no Universo, estabelecendo relações com as condições necessárias ao surgimento de sistemas solares e planetários, suas estruturas e suas composições. Além disso, fornece subsídios que os auxiliam na análise de interpretações sobre a dinâmica do Cosmo e na elaboração de argumentos sobre a formação, a composição e a evolução do Universo, o que contribui para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 2.
Para levantar os conhecimentos prévios dos estudantes a respeito do que a matéria é constituída, discuta com eles as questões propostas na página. Conduza a discussão de modo a introduzir o assunto dizendo que entender a constituição da matéria foi algo que sempre intrigou a humanidade, e mostre a representação de um modelo atômico na ilustração da página 38. Mostre-lhes também a estrutura dos átomos, indicando as partículas e as regiões que os constituem.
Incentive os estudantes a responder à questão inicial do texto, na página 39, sobre como surgiram os elementos químicos. Conduza a explicação da origem desses elementos relacionando-a à teoria de origem do Universo.
Por questões didáticas, foram suprimidas algumas partículas e antipartículas envolvidas na formação dos primeiros átomos. Se julgar conveniente, comente com os estudantes que os cientistas acreditam que os átomos de hélio e de hidrogênio se combinaram, formando a primeira molécula do Universo, conhecida como hidreto de hélio.
Integrando o conhecimento
Na página 39, é citada a teoria do Big Bang. Desenvolva um trabalho interdisciplinar com o professor do componente curricular de Física, que trata com detalhes desse conteúdo. Os estudantes podem reproduzir a ilustração dessa página no formato de uma linha do tempo e, em seguida, criar ilustrações mostrando a formação dos elementos químicos por meio da fusão de átomos. Verifique também a possibilidade de eles gravarem um vídeo ou elaborarem um flipbook explicando a origem dos elementos, filmando as ilustrações produzidas em sequência. Se a turma tiver conhecimentos para a produção desse material em formato digital, incentive-os a fazê-lo para publicá-lo posteriormente no site da escola ou em suas redes sociais. Essa atividade contribui para o desenvolvimento da Competência geral 5 e da Competência específica de Ciências da Natureza e suas Tecnologias 3, pois incentiva os estudantes a disseminar seus conhecimentos e conclusões sobre o assunto a variados públicos por meio de tecnologias digitais de informação. Além disso, possibilita-lhes criar maneiras próprias de divulgar suas opiniões utilizando ferramentas que fazem parte das culturas juvenis.
Atividade extra
Organize a turma em cinco grupos. Em seguida, peça aos estudantes que montem um painel, atribuindo um tema a cada grupo. Um deve fazer um esquema do planeta Terra, mostrando suas camadas internas e a crosta, e os demais grupos vão abordar a presença e as características de cada elemento citado no Livro do Estudante, como ferro abre parênteses F e fecha parênteses, oxigênio abre parênteses O fecha parênteses, silício abre parênteses S i fecha parênteses e magnésio abre parênteses M g fecha parênteses, na composição do planeta.
BNCC em contexto
A abordagem das páginas 44 a 56 contribui para o desenvolvimento da habilidade EM13CNT201, pois possibilita aos estudantes analisar e discutir teorias, leis e modelos propostos em diferentes épocas e culturas para explicar a composição da matéria. Essa abordagem permite-lhes valorizar os conhecimentos historicamente construídos, o que está em consonância com a Competência geral 1.
Acompanhando a aprendizagem
A partir da página 44, serão abordados os principais modelos atômicos. Após trabalhar cada um deles, nos últimos minutos de aula realize a estratégia One minute paper (veja mais orientações nas páginas XI e XII). Para isso, solicite aos estudantes que façam notas sobre aspectos da aula, por exemplo, os principais conceitos apreendidos e as dúvidas que surgiram. Você pode guiá-los perguntando o que aprenderam em cada um dos modelos. Dessa maneira, é possível obter informações que vão orientar o planejamento e a avaliação.
O estudo de modelos nas Ciências é fundamental para compreender a realidade. A Química está baseada em diversos modelos, como os atômicos, os moleculares, os matemáticos etc. Conheça o artigo Dificuldades de ensino e aprendizagem dos modelos atômicos em Química para obter mais informações sobre aprendizagem desses modelos na Química. Disponível em: https://s.livro.pro/gmx8ej. Acesso em: 22 set. 2024.
Para mais informações sobre a importância dos níveis representacionais no ensino da Química, leia o artigo: Os três níveis do conhecimento químico: dificuldades dos alunos na transição entre o macro, o submicro e o representacional. Disponível em: https://s.livro.pro/s8ddyv. Acesso em: 22 set. 2024.
Conexões com… - página 45
Objetivos
- Reconhecer a importância da historicidade nas Ciências.
- Perspectivar a teoria atômica em seu contexto histórico.
Orientações
Ao tratar desse assunto com os estudantes, mostre a eles que a busca pelo conhecimento da estrutura da matéria, dos movimentos dos corpos, da origem e da diversidade da vida, entre tantos outros temas aos quais nos dedicamos atualmente, já estava presente na humanidade desde os primeiros estudos da Filosofia.
Página XXXVI
Para orientar a resposta a essa questão, retome com os estudantes a ideia de Demócrito de que, dividindo a matéria em pedaços cada vez menores, as partículas seriam imperceptíveis ao olho humano, até o ponto que se tornassem indivisíveis. Questione-os sobre a plausibilidade dessa teoria, evidenciando que o atomismo grego buscava não apenas resolver questões sobre os fenômenos da natureza, mas também fornecer explicações para fenômenos específicos, ao passo que a teoria atômica moderna se concentra na relação entre as propriedades dos átomos e o comportamento que estes exibem em diversos fenômenos nos quais estão envolvidos.
Compartilhe ideias - página 50
O boxe Compartilhe ideias da página 50 está relacionado com a educação midiática, além de contribuir para desenvolver a Competência específica de Ciências da Natureza e suas Tecnologias 3, pois incentiva o envolvimento em processos de leitura, comunicação e divulgação do conhecimento científico relacionado à energia nuclear. Isso permite aos estudantes mais autonomia em discussões, analisando, argumentando e posicionando-se criticamente em relação ao tema. Veja mais dicas sobre como orientá-los em um Debate nas páginas XI e XII destas Orientações para o professor.
Oriente os estudantes a obter informações em fontes confiáveis, como livros ou outros recursos digitais. Solicite-lhes que proponham algumas ações e maneiras de levar o aprendizado dessa atividade para o dia a dia – tomar decisões éticas e responsáveis em situações do cotidiano, refletir antes de agir e avaliar os malefícios originados do uso indevido de informações.
As informações obtidas pelos estudantes podem ser apresentadas utilizando recursos digitais, pois eles próprios podem produzir/gravar um vídeo, elaborar um podcast, entre outras possibilidades. Esse tipo de abordagem possibilita-lhes criar maneiras próprias de divulgar suas opiniões e o conhecimento científico por meio de ferramentas que fazem parte das culturas juvenis.
Modelo de camadas nucleares - página 52
Ao ler o boxe complementar, comente com os estudantes que o fato de os núcleos com certo número de nêutrons e prótons serem especialmente estáveis já havia sido notado, mas que a física polonesa Maria Goeppert Mayer (1906 - 1972) foi a cientista que estudou essa estabilidade e propôs um modelo para explicá-la, denominado modelo de camadas nucleares.
Os cálculos para a determinação dos orbitais da teoria atômica atual são complexos e não fazem parte do escopo do Ensino Médio, por isso foram suprimidos. Cite o princípio da incerteza de Heisenberg, enunciado em 1927 pelo físico alemão Werner Heisenberg (1901-1976), que afirma que a posição e a velocidade dos elétrons em um átomo não podem ser conhecidas simultaneamente com total precisão.
Respostas - Página 43
1. a ) Foi a partir do Big Bang que se formaram os primeiros elementos químicos no Universo: o hélio e o hidrogênio. Já a formação das estrelas envolve uma série de eventos que possibilitaram e ainda possibilitam a diversificação dos elementos químicos.
b ) Em determinado momento da história da Terra, a combinação entre átomos de diferentes elementos químicos deu origem a moléculas orgânicas, que, por sua vez, originaram compostos mais complexos e essenciais à vida, como carboidratos, proteínas e ácidos nucleicos.
c ) Espera-se que os estudantes comentem que foi a partir de uma nuvem de gases e poeira, resultante da morte de uma estrela, que se formou a Terra. Os elementos químicos presentes nessa poeira foram incorporados ao planeta, originando moléculas orgânicas, que foram fundamentais para o desenvolvimento da vida terrestre, inclusive dos seres humanos.
Respostas - Páginas 55 e 56
2. a ) Alternativa V. De acordo com o modelo atômico proposto por Bohr, quando o elétron absorve energia suficiente, ele se desloca de um nível de menor energia para um de maior energia. Quando retorna ao nível original, o elétron emite, na forma de fóton, a mesma quantidade de energia antes absorvida.
b ) Espera-se que os estudantes comentem que os elétrons estão distribuídos na eletrosfera e se movimentam em torno do núcleo seguindo órbitas circulares, as chamadas camadas de energia. Eles podem se mover entre essas camadas, absorvendo ou emitindo energia. Sendo assim, a exposição dos adesivos à luz ambiente faz que eles absorvam essa energia, passando para camadas de energia mais afastadas do núcleo. No escuro, os elétrons excitados liberam, sob a forma de fóton, a energia previamente absorvida, resultando no brilho esverdeado característico desses objetos.
c ) Espera-se que os estudantes elaborem uma animação que inclua a representação de um átomo, com seu núcleo, diferentes níveis de energia e um elétron. Eles devem demonstrar que a absorção de energia (luz ambiente, no caso do exemplo) faz o elétron passar para camadas mais afastadas do núcleo, tornando-se excitado. No escuro, a energia que foi previamente absorvida é liberada sob a forma de um fóton, resultando no brilho característico desses objetos. Essa animação pode ser publicada no site da escola ou nas redes sociais.
d ) Espera-se que os estudantes comentem que sim, pois, ao serem mantidos no escuro, os elétrons do sulfeto de zinco não seriam excitados, impossibilitando a liberação de energia sob a forma de luz quando retornassem à camada de energia do estado estacionário.
e ) Resposta pessoal. Os estudantes podem citar interruptores de lâmpadas elétricas e placas de segurança.
Capítulo 4 – Organização dos elementos químicos - páginas 57 a 69
Objetivos do capítulo
- Compreender as informações presentes na tabela periódica.
- Conhecer o desenvolvimento da tabela periódica.
- Diferenciar elementos químicos naturais e sintéticos.
Página XXXVII
BNCC em contexto
A abordagem das páginas 57 a 59 contempla as Competências gerais 1 e 2, pois mostra aos estudantes o desenvolvimento do pensamento científico, especificamente da organização dos elementos químicos, por meio da história.
O trabalho com essas páginas possibilita aos estudantes perceber que diversos modelos de organização foram propostos, cada um com seus prós e contras, mas evoluíram de forma a serem cada vez mais lógicos e de uso prático, até ser formulado o modelo atualmente aceito. Dessa forma, é trabalhada a habilidade EM13CNT201.
Antes de iniciar o trabalho com esse capítulo, se possível, leia o artigo a seguir, que apresenta a análise de diferentes estratégias para o ensino da tabela periódica.
FERREIRA, L. H.; CORREA, K. C. S.; DUTRA, J. L. Análise das estratégias de ensino utilizadas para o ensino da tabela periódica. Química Nova na Escola, v. 38, n. 4, p. 349-359, nov. 2016. Disponível em: https://s.livro.pro/uwgd31. Acesso em: 10 set. 2024.
Se julgar pertinente, faça pausas estratégicas durante a leitura das primeiras tabelas periódicas, desenvolvidas por diferentes cientistas ao longo da história, e pergunte aos estudantes sobre a contribuição dessa classificação para a construção do conhecimento a respeito da organização dos elementos químicos. Peça a cada um que responda a essa questão para o colega mais próximo. Essa atividade permite o trabalho com a metodologia ativa Turn and talk.
Nas páginas 58 e 59, são expostos modelos ultrapassados de organização da tabela periódica, mas que são muito importantes para os estudantes entenderem como foi tecida e aprimorada sua lógica de organização. Ressalte como os cientistas buscavam ordenar os elementos químicos de acordo com seus números atômicos e suas propriedades periódicas. Porém, muitos desses elementos ainda não eram conhecidos, e as propriedades específicas de alguns ainda não haviam sido determinadas, em razão da dificuldade de isolá-los e realizar experimentos.
Integrando o conhecimento
O conteúdo das páginas 57 a 61, em especial dessa última, apresenta modelos diversos de organização dos elementos químicos, culminando na tabela periódica atual. Esse tópico possibilita um trabalho conjunto com os professores da área de Linguagens e suas Tecnologias, pois a tabela periódica é um constructo originado da necessidade de ordenar elementos químicos de forma lógica e prática, utilizando símbolos e posicionamentos espaciais que facilitem sua leitura e interpretação.
BNCC em contexto
A leitura da tabela periódica atual, apresentada na página 61, favorece o desenvolvimento da Competência geral 4, pois incentiva os estudantes a utilizar diferentes linguagens, como a visual, a matemática e a científica, para expressar e partilhar informações. Nessa tabela, os elementos químicos estão agrupados de acordo com diversas propriedades, incluindo as químicas e físicas, representadas matematicamente.
Inicie o trabalho da página 61 solicitando aos estudantes que façam uma leitura da tabela periódica e comentem como os elementos químicos estão dispostos nela. Verifique se eles identificam a disposição em ordem crescente de seus números atômicos, distribuídos em períodos (linhas) e em grupos (colunas).
Oriente os estudantes a elaborar um texto sobre a importância da organização da tabela periódica para a compreensão do conhecimento a respeito dos elementos químicos. Incentive-os a refletir sobre como procedimentos e estratégias de leitura adequados podem favorecer essa compreensão.
Enfatize que os elementos químicos podem tanto ser encontrados na natureza quanto ser produzidos em laboratório e que alguns dos mais pesados são exclusivamente sintéticos. Esses átomos são muito instáveis, durando apenas alguns segundos ou frações de segundo. Mostre à turma como a Química é uma Ciência dinâmica ao comentar que os quatro elementos mais pesados foram inseridos na tabela apenas recentemente, em 2016.
Ao explorar a massa atômica dos elementos químicos, dê exemplos de alguns isótopos e informe como se calcula a massa atômica por intermédio de sua distribuição natural. Mencione o carbono abre parênteses C fecha parênteses, que tem três isótopos naturais: sobrescrito 12, sobrescrito 13 e sobrescrito 14 C. O isótopo sobrescrito 12 tem massa igual a 12 u (6 prótons e 6 nêutrons) e distribuição natural de aproximadamente 99,0%. O isótopo sobrescrito 13 tem massa igual a 13 unidades (6 prótons e 7 nêutrons) e distribuição natural de aproximadamente 1,0%. O isótopo sobrescrito 14 C tem massa igual a 13 unidades (6 prótons e 8 nêutrons) e distribuição natural desprezível. A massa atômica do carbono é calculada fazendo-se a média ponderada: abre parênteses 12 unidades vezes 0 vírgula 99 fecha parênteses mais abre parênteses 13 unidades vezes 0 vírgula 0 1 fecha parênteses é igual a 12 vírgula 0 1 unidades.
Explique que os elementos químicos podem ter isótopos naturais e artificiais (sintetizados em laboratório). Para a determinação da massa atômica, leva-se em consideração apenas a distribuição dos isótopos naturais.
Ressalte que isótopos possuem sempre o mesmo número de prótons, os quais, por sua vez, determinam o número atômico do elemento químico em questão. Desse modo, isótopos sempre são de um mesmo elemento químico.
Ao tratar de grupos, na página 63, será abordado o conceito de distribuição e configuração eletrônica do nível de valência. Mostre aos estudantes que essa configuração é facilmente obtida observando-se a posição do elemento na tabela periódica.
Elementos químicos dos grupos 1 e 2 apresentam apenas a subcamada s na camada de valência. Assim, sua configuração eletrônica será n s elevado a 1 ou n s elevado ao quadrado, sendo n o período do elemento. O elemento berílio, por exemplo, está no 2º período e no 2º grupo da tabela. Assim, sua configuração eletrônica de valência é 2 s elevado ao quadrado.
Elementos químicos dos grupos 13 ao 18 apresentam a subcamada s completa e a subcamada p em processo de preenchimento (ou completamente preenchida para os elementos do grupo 18). Portanto, sua configuração eletrônica será do tipo n s elevado ao quadrado n p elevado a início expoente, 1 menos 6, fim expoente, sendo que o número atribuído à subcamada p será 1 para o grupo 13, 2 para o 14, e assim por diante, até 6 para o grupo 18. O estanho abre parênteses S n fecha parênteses, por exemplo, localiza-se no 5º período e no 14º grupo da tabela. Assim, sua configuração eletrônica de valência é 5 s elevado ao quadrado 5 p elevado ao quadrado.
Página XXXVIII
Elementos dos grupos 3 ao 12, excluindo-se os lantanídios e os actinídios, apresentam as subcamadas s e p da camada de valência completas e a subcamada d em processo de preenchimento (ou completamente preenchida para os elementos do grupo 12). Além disso, a subcamada de valência d se encontra em um nível inferior à camada mais externa no átomo. Portanto, sua configuração eletrônica será do tipo abre parênteses n menos 1 fecha parênteses d elevado a início expoente, 1 menos 10, fim expoente, sendo que o número atribuído à subcamada d será 1 para o grupo 3, 2 para o 4, e assim por diante, até 10 para o grupo 12. O cobalto abre parênteses C o fecha parênteses, por exemplo, localiza-se no 4º período e no 9º grupo da tabela. Assim, sua configuração eletrônica de valência é 3 d elevado a 7.
Os elementos dos períodos 6 e 7, grupo 3, subdividem-se nas séries dos lantanídios e dos actinídios, respectivamente. Esses elementos apresentam as subcamadas n, p e d da camada de valência completas e a subcamada f em processo de preenchimento – ou completamente preenchida para os elementos lutécio abre parênteses L u fecha parênteses e laurêncio abre parênteses L r fecha parênteses. Além disso, a subcamada f se encontra em dois níveis inferiores à camada mais externa do átomo. Portanto, sua configuração eletrônica será do tipo abre parênteses n menos 2 fecha parênteses f elevado a início expoente, 1 menos 14, fim expoente. O urânio abre parênteses U fecha parênteses, por exemplo, localiza-se no 7º período e no 4º grupo da série dos actinídios. Assim, sua configuração de valência é 5 f elevado a 4.
Explicite que o hélio abre parênteses He fecha parênteses é o único gás nobre que apresenta configuração eletrônica n s elevado ao quadrado. Isso porque possui apenas dois elétrons, ambos na subcamada s do primeiro nível.
Cite a ocorrência e a formação de cátions ao explicar os metais e de ânions ao explicar os não metais. Nesse momento, não será necessário abordar a formação de ligações iônicas, mas é interessante trabalhar brevemente a regra do octeto, a fim de que os estudantes entendam por que alguns elementos perdem e outros ganham elétrons.
Ao analisar os grupos de elementos da tabela periódica, ressalte que não é preciso que os estudantes memorizem as posições dos elementos químicos. Sempre que necessário, enfatize que a tabela não deve ser memorizada, pois se trata de uma ferramenta de estudo e consulta. Nesse momento, é importante que associem os grupos às principais características dos elementos que os compõem.
Após abordar todas as classificações da tabela periódica, na página 64, apresente um resumo das principais classificações. Para os metais, destaque que, em sua maioria, são sólidos em condições ambiente e sua reatividade varia, sendo que muitos deles são encontrados na natureza somente formando outros compostos químicos. Para os ametais, mencione que eles estão nos grupos 14 (do carbono), 15 (do nitrogênio), 16 (calcogênios) e 17 (halogênios) e que as propriedades físicas e químicas podem diferir bastante entre os elementos. Sobre os gases nobres (elementos do grupo 18, com exceção do oganessônio), comente que, em geral, são muito estáveis e pouco reativos.
Contribuição de mulheres para a tabela periódica - página 65
Ao trabalhar o boxe Contribuição de mulheres para a tabela periódica, enfatize a importância das cientistas na descoberta de novos elementos químicos ao longo da história. Essa reflexão é importante, pois ainda é comum que as mulheres sejam sub-representadas enquanto produtoras de conhecimento científico. Incentive-os a refletir sobre os fatores que dificultam o acesso das mulheres à educação formal, bem como os motivos pelos quais muitas vezes suas contribuições são apagadas da história.
Conexões com… - páginas 66 e 67
Objetivos
- Compreender o processo de criação de elementos químicos sintéticos.
- Desenvolver o pensamento crítico e analítico sobre a representação da Ciência em filmes e outras mídias.
Orientações
Ao longo da leitura do texto, ressalte que o filme e o personagem mencionados nessa seção são produtos de uma obra ficcional. Ao mencionar os objetivos e resultados do acelerador de partículas desenvolvido pelo personagem e o acelerador de partículas presente no Laboratório Nacional de Luz Síncroton, em Campinas (SP), os estudantes podem perceber os limites da Ciência na história do personagem. Além disso, ao se depararem com alguns resultados comprovados que já foram obtidos por meio desses instrumentos, os estudantes compreendem a importância das pesquisas científicas no estudo da matéria. Destaque que os aceleradores de partículas são instrumentos importantes principalmente na área da Física.
Acompanhando a aprendizagem
Para realizar uma avaliação ao final do capítulo, proponha uma atividade em grupo na qual os estudantes tenham que selecionar três elementos químicos da tabela periódica para apresentar informações e propriedades referentes a eles. Oriente-os a mostrar os resultados por meio de cartazes, pôsteres ou banners.
Respostas - Página 60
1. c ) Para analisar quais elementos formam tríades, é preciso que os estudantes calculem a média aritmética entre a maior e a menor massa e verifiquem se corresponde à massa do elemento central.
I ) Massa prevista de P é igual a início de fração, numerador: 14 mais 75, denominador: 2, fim de fração é igual a 44 vírgula 5. Como 44 vírgula 5 é diferente de 31, não é uma tríade.
II ) Massa prevista de S é igual a início de fração, numerador: 16 mais 79, denominador: 2, fim de fração é igual a 47 vírgula 5. Como 47 vírgula 5 é diferente de 32, não é uma tríade.
III ) Massa prevista de T i é igual a início de fração, numerador: 45 mais 51, denominador: 2, fim de fração é igual a 48. Como a massa prevista corresponde à massa do titânio, trata-se de uma tríade.
IV ) Massa prevista de L i é igual a início de fração, numerador: 7 mais 39, denominador: 2, fim de fração é igual a 23. Como a massa prevista corresponde à massa do lítio, trata-se de uma tríade.
Capítulo 5 – Substâncias e misturas - páginas 70 a 101
Objetivos do capítulo
- Conhecer a definição, a classificação e as propriedades das substâncias e misturas.
- Conhecer os principais métodos de separação de misturas.
- Entender a importância do saneamento básico para a garantia da saúde da população.
Página XXXIX
BNCC em contexto
Nas páginas 70 e 71, durante o estudo de substâncias simples, é mostrada aos estudantes a molécula de gás hidrogênio abre parênteses H subscrito 2 fecha parênteses, que pode ser aplicada na geração de energia limpa e eficiente com uma boa relação custo-benefício. Essa abordagem fornece subsídios para o desenvolvimento da Competência geral 7, da Competência específica de Ciências da Natureza e suas Tecnologias 1 e das habilidades EM13CNT101, EM13CNT104, EM13CNT106 e EM13CNT309.
O trabalho com o trecho de reportagem sobre o surgimento das primeiras moléculas no início do Universo, apresentado na página 70, possibilita o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 2 e da habilidade EM13CNT209, pois favorece a abordagem a respeito de a matéria que constitui todo o cosmos ter surgido do Big Bang e de como essa matéria foi gradativamente se tornando mais complexa com o surgimento de elementos cada vez mais pesados e de substâncias maiores.
Ressalte as vantagens e desvantagens do uso do gás hidrogênio como combustível. Um exemplo de vantagem é o fato de sua combustão liberar apenas água abre parênteses H subscrito 2 O fecha parênteses. Entre as desvantagens está o fato de ser um gás altamente reativo, que pode causar explosão se mal manipulado.
Ao abordar as propriedades das substâncias, comente que a densidade depende da temperatura do sistema. Por exemplo, a 0 grau Celsius, a densidade da água é 0 vírgula 9998410 grama por mililitro, e a 100 graus Celsius, é 0 vírgula 95837 grama por mililitro.
BNCC em contexto
A explicação acerca do processo de produção de tinta a partir de sementes de urucum, apresentada na página 78, comum aos indígenas xavante, é importante para mostrar aos estudantes as culturas e tradições de diferentes povos, que são contemporâneas e fazem parte da identidade do nosso país. Essa abordagem exercita o senso histórico, valoriza as diversas manifestações artísticas e culturais e reforça a responsabilidade na construção de uma sociedade inclusiva, contribuindo para o desenvolvimento das Competências gerais 1, 3, 6 e 9. Essa abordagem também possibilita o trabalho com os temas contemporâneos transversais Diversidade cultural e Educação para valorização do multiculturalismo nas matrizes históricas e culturais brasileiras.
Nessa página, serão apresentadas situações nas quais devemos considerar a composição e a adequação de materiais frente a aplicações diversas, incentivando os estudantes a usar o senso crítico e argumentos científicos, o que contribui para o desenvolvimento da habilidade EM13CNT307.
Integrando o conhecimento
O conteúdo da página 78 apresenta informações sobre hábitos culturais de povos indígenas, possibilitando o trabalho conjunto com os professores da área de Ciências Humanas Sociais e Aplicadas, principalmente os dos componentes curriculares de História, Geografia e Sociologia. Isso pode gerar discussões relevantes acerca do contexto histórico dos povos indígenas, sua luta pelo direito à terra, a criação de reservas indígenas no Brasil, além de suas tradições e modos de vida. Essa abordagem fornece subsídios para o desenvolvimento das habilidades EM13CHS104, EM13CHS204, EM13CHS205 e EM13CHS601. A pintura corporal como forma de manifestação cultural e religiosa também promove o trabalho com os professores da área de Linguagens e suas Tecnologias, contribuindo para o desenvolvimento das Competências específicas de Linguagens e suas Tecnologias 2 e 6. Oriente os estudantes a escrever um texto sobre a importância da preservação dos saberes indígenas, em especial aqueles relacionados aos recursos naturais e à preservação ambiental. Sugira que busquem orientação dos professores dos componentes curriculares citados. Os seguintes links possuem informações adicionais acerca de pinturas corporais indígenas que podem auxiliar o desenvolvimento da atividade.
- CORPOS e objetos decorados com urucum. Instituto do Patrimônio Histórico e Artístico Nacional. Disponível em: https://s.livro.pro/fmaygv. Acesso em: 1 out. 2024.
- ROCHA, Rebeca. Pinturas corporais indígenas são marcas de identidade cultural. Universidade Federal do Pará, 15 jan. 2019. Disponível em: https://s.livro.pro/v1zaxg. Acesso em: 1 out. 2024.
Atividade extra
Organize os estudantes em grupos de quatro integrantes para pesquisarem os corantes artificiais e naturais, listando exemplos de alimentos em que cada tipo de corante é empregado. Oriente-os na pesquisa e na escrita sobre o uso do urucum e outros elementos naturais, como corantes alimentícios. Em seguida, peça-lhes que discutam a importância de incentivar o uso de corantes naturais.
Para formular as hipóteses sobre o fenômeno ilustrado na página 82, é importante que os estudantes articulem o conhecimento sobre os tipos de solução, relacionando a formação dos cristais às soluções supersaturadas.
Aproveite para conversar com a turma sobre como, muitas vezes, as produções midiáticas, principalmente os vídeos curtos, utilizam termos sem rigor científico apenas para chamar a atenção do espectador. É o caso dos vídeos que mostram o "gelo" instantâneo.
BNCC em contexto
Nas páginas 88 a 95 são trabalhados alguns métodos de separação de misturas que foram desenvolvidos com base em propriedades físico-químicas, o que propicia aos estudantes fazer uma análise crítica, contribuindo para o desenvolvimento da Competência geral 2.
O trecho de reportagem utilizado para iniciar o trabalho sobre a separação de mistura, na página 88, contribui para o desenvolvimento das Competências gerais 4 e 7, pois, por meio do uso de uma linguagem diferente, os estudantes obtêm informações confiáveis sobre a importância do consumo responsável da água em âmbito local e regional. Além disso, as questões feitas com base no trecho de reportagem incentivam a turma a refletir sobre atitudes responsáveis, tanto individuais como coletivas, que podem ser tomadas sobre o uso sustentável da água, contemplando, assim, a Competência geral 9, as Competências específicas de Ciências da Natureza e suas Tecnologias 1 e 3 e as habilidades EM13CNT101, EM13CNT104 e EM13CNT301.
Página XL
Nas páginas 94 e 95, são trabalhados alguns métodos de separação de misturas utilizados nas estações de tratamento de água, o que propicia uma reflexão dos estudantes sobre a importância do saneamento básico para a saúde da população, contribuindo para o desenvolvimento da habilidade EM13CNT310.
Incentive os estudantes a pesquisar e refletir sobre os impactos sociais causados pela falta de investimento nos sistemas de tratamento de água e esgoto, além de pensar quais medidas públicas podem contribuir para a mitigação desse problema, articulando a Competência específica de Ciências da Natureza e suas Tecnologias 3.
Debata com os estudantes a importância do tratamento da água, relacionando-o com os conceitos de substância pura e mistura. Pergunte a eles se conhecem a qualidade da água que consomem e solicite uma pesquisa para investigar isso. Nessa etapa inicial, é fundamental que os estudantes reconheçam a relevância dos conhecimentos da Química e como esses conhecimentos podem ajudá-los a agir criticamente na sociedade, promovendo reflexões e mudanças.
Ligado no tema - páginas 96 e 97
Objetivos
- Compreender a importância do tratamento de água e esgoto.
- Analisar as principais informações contidas em uma fatura de água.
Orientações
Para conduzir essa seção, é possível pedir a cada estudante que observe o consumo de água mensal em uma fatura de sua casa (em metros cúbicos) e compartilhe essa informação para que a análise possa ser feita em sala de aula. Em ambos os casos, o foco não deve ser somente a análise individual, mas também a reflexão sobre os aspectos sociais que envolvem o consumo de água. Assim, são trabalhados simultaneamente os temas contemporâneos transversais Educação financeira e Educação ambiental.
Na questão a dessa seção, incentive os estudantes a associar os riscos com as doenças transmitidas por água contaminada estudadas no componente curricular de Biologia. Se necessário, consulte o professor desse componente para discutir possíveis articulações entre os conteúdos. Na questão b, leve os estudantes a refletir sobre o motivo pelo qual alguns cidadãos não têm acesso a direitos como previstos na Constituição. Para responder à questão c, mesmo que os estudantes não conheçam pessoalmente um bairro que vivencie essa situação, eles podem citar locais mencionados em jornais, na internet ou em outros meios de comunicação. Caso o estudante não tenha acesso a uma fatura de água individualizada para responder à questão d, oriente-o a obter a informação na fatura de água de outros familiares. Caso haja dúvidas na questão e, com base na mesma fatura do item anterior, mostre onde está o volume de água total consumido.
Prática científica - páginas 98 e 99
Objetivos
- Realizar a separação de misturas.
- Identificar os materiais separados na prática.
- Representar as etapas de separação em um fluxograma.
Orientações
Ao elaborarem suas hipóteses e conclusões sobre os fenômenos observados no experimento, os estudantes trabalham a habilidade EM13CNT301.
Os materiais usados nessa prática, bem como os processos envolvidos, não são perigosos. As pedras de construção podem ser substituídas por outras pedras, assim como os clipes podem ser substituídos por pequenos pregos ou parafusos. No lugar do papel-filtro, pode ser usado um filtro de pano, como os de coar café. Os materiais que não podem ser reutilizados ao final da prática podem ser descartados no lixo doméstico.
Verifique com antecedência os materiais que serão usados na prática. A serragem de madeira deve ter tamanho suficiente para não passar na peneira, por isso não use serragem de madeira em pó. A areia deve ser a mais fina, então sugerimos que a peneire com antecedência, pois pode ser que contenha outros materiais. Teste se o ímã está atraindo os clipes.
Na etapa H, o tempo varia de acordo com a temperatura, a incidência do sol, a umidade relativa do ar e a concentração do sal.
Respostas
1. Possível resposta:
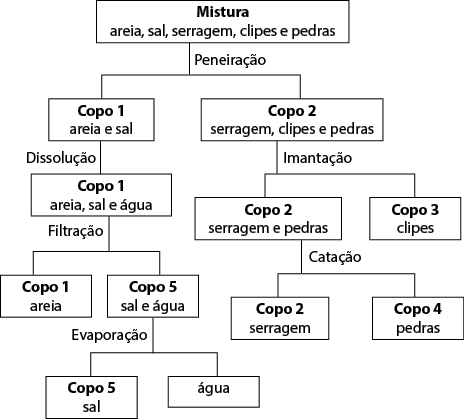
É possível que os estudantes montem o fluxograma de forma diferente, colocando mais informações ou sendo mais sucintos. A representação também pode variar, apresentando as informações dentro ou fora de formas de retângulo e/ou losango com setas ou fios. Se julgar necessário, antes da resolução dessa questão, incentive os estudantes a pesquisar na internet os termos fluxograma de separação de misturas e fluxograma com imagens. Outra opção é pesquisar e selecionar alguns exemplos para mostrar a eles. Com a pesquisa, os estudantes têm mais referência de como elaborar o fluxograma.
Página XLI
2. Copo 1 – areia; copo 2 – serragem de madeira; copo 3 – clipes metálicos; copo 4 – pedras; copo 5 – sal.
3. Espera-se que eles identifiquem que as misturas homogêneas são as que apresentam uma fase, como a mistura de água e sal. As misturas heterogêneas são as misturas que apresentam duas fases ou mais; por exemplo, a mistura de areia, água e sal, que apresenta duas fases.
4. Sim. Possíveis respostas: Imantação, catação, peneiração, dissolução, filtração e evaporação; catação, peneiração, imantação, dissolução, filtração e evaporação.
5. Resposta pessoal. Espera-se que os estudantes citem: substituir a evaporação por destilação simples; substituir peneiração por levigação para separar materiais mais densos, como areia, pedra e clipes; incluir abanação/ventilação para separar a serragem, caso a utilizada seja a do tipo mais leve.
6. Resposta pessoal. Oriente os estudantes sobre o tipo de recurso que eles podem utilizar para produzir as publicações. Reforce as principais informações que eles devem apresentar, como imagens dos procedimentos e explicações, e quais devem evitar compartilhar, como fotografias ou detalhes pessoais dos envolvidos.
Acompanhando a aprendizagem
Peça aos estudantes que escrevam um pequeno texto definindo, com as próprias palavras, o que são substâncias simples e composta e misturas heterogênea e homogênea. Oriente-os a dar um exemplo para cada definição diferente dos apresentados no livro. Em seguida, solicite a quatro ou cinco voluntários que leiam em voz alta suas respostas para os colegas.
A atividade proposta pode ser feita por meio da estratégia One-minute paper; confira mais comentários sobre essa estratégia nas páginas XI e XII destas Orientações para o professor.
Limite o tempo de escrita a apenas um minuto para que os estudantes exercitem sua capacidade de síntese. Verifique se percebem que a dificuldade aumenta, pois os sistemas são gradativamente mais complexos. Essa atividade permite verificar a compreensão deles a respeito dos conteúdos abordados.
Respostas - Página 77
1. Alternativa c. Apenas dois elementos químicos estão representados na imagem: um representado pelas esferas vermelhas e outro pelas esferas pretas.
2. O objeto é feito de alumínio abre parênteses A l fecha parênteses. Considere V subscrito inicial é igual a 7 mililitros e V subscrito final é igual a 21 mililitros.
delta V é igual a V subscrito final menos V subscrito inicial implica em 21 mililitros menos 7 mililitros é igual a 14 mililitros
d é igual a 'm' sobre V implica em d é igual a início de fração, numerador: 37 vírgula 8, denominador: 14, fim de fração portanto d é igual a 2 vírgula 7 gramas vezes mL elevado a menos 1 ou 2 vírgula 7 gramas vezes centímetro elevado a menos 3
4. A atividade também pode ser conduzida em sala de aula. Leve uma caixa de leite para que toda a turma analise e responda às questões, individualmente ou em grupos.
8. As massas molares dos elementos se referem a 1 mol de átomos. Assim, dividindo as massas pelo número de Avogadro abre parênteses 6 vírgula 0 2 vezes 10 elevado a 23 fecha parênteses, obtemos a massa de um único átomo.
'm' subscrito C é igual a início de fração, numerador: 12 gramas barra mol, denominador: 6 vírgula 0 2 vezes 10 elevado a 23 mol elevado a menos 1, fim de fração é igual a 1 vírgula 99 vezes 10 elevado a menos 23 grama
'm' subscrito O é igual a início de fração, numerador: 16 gramas barra mol, denominador: 6 vírgula 0 2 vezes 10 elevado a 23 mol elevado a menos 1, fim de fração é igual a 2 vírgula 66 vezes 10 elevado a menos 23 grama
'm' subscrito H é igual a início de fração, numerador: 1 grama barra mol, denominador: 6 vírgula 0 2 vezes 10 elevado a 23 mol elevado a menos 1, fim de fração é igual a 1 vírgula 66 vezes 10 elevado a menos 24 grama
Portanto, para as moléculas representadas, temos:
'm' início subscrito, C O subscrito 2, fim subscrito é igual a abre colchetes abre parênteses 1 vírgula 99 vezes 10 elevado a menos 23 fecha parênteses mais 2 vezes abre parênteses 2 vírgula 66 vezes 10 elevado a menos 23 fecha parênteses fecha colchetes grama é igual a
é igual a 7 vírgula 31 vezes 10 elevado a menos 23 grama
'm' início subscrito, H subscrito 2, fim subscrito é igual a 2 vezes abre parênteses 1 vírgula 66 vezes 10 elevado a menos 24 fecha parênteses grama é igual a 3 vírgula 32 vezes 10 elevado a menos 24 grama
'm' início subscrito, O subscrito 2, fim subscrito é igual a 2 vezes abre parênteses 2 vírgula 66 vezes 10 elevado a menos 23 fecha parênteses grama é igual a 5 vírgula 32 vezes 10 elevado a menos 23 grama
9. Inicialmente, calcula-se a massa correspondente ao volume do copo:
d é igual a 'm' sobre V implica em 'm' é igual a 1 vírgula 0 grama vezes centímetro elevado a menos 3 vezes 36 centímetros cúbicos é igual a 36 gramas
Sabendo a massa molar da água, calcula-se a quantidade de matéria em mols:
M é igual a 'm' sobre n implica em n é igual a início de fração, numerador: 36 gramas, denominador: 18 gramas vezes mol elevado a menos 1, fim de fração é igual a 2 mol
Considerando o número de Avogadro, tem-se:
Quantidade de moléculas é igual a 2 mol vezes 6 vírgula 0 2 vezes 10 elevado a 23 moléculas vezes mol elevado a menos 1 é igual a 12 vírgula 0 4 vezes 10 elevado a 23 moléculas.
Respostas - Páginas 86 e 87
1. a ) A soda cáustica reage com o óleo, formando produtos solúveis em água e gordura.
b ) Sem a adição da soda cáustica, formaria-se um sistema heterogêneo com duas fases (óleo e água), pois o óleo não se dissolve na água.
c ) Espera-se que os estudantes comentem que o descarte inadequado de óleo de cozinha é altamente prejudicial ao meio ambiente. Ao ser destinado a uma cooperativa, garante-se que o óleo não seja descartado de forma inadequada. Além disso, o próprio processo de reciclagem reduz o descarte de lixo e resíduos. Do ponto de vista econômico e social, evitam-se gastos extras com o tratamento de esgoto e possíveis problemas em razão do entupimento de tubulações. Outro fator positivo é a produção de sabão incentivar a produção e o comércio locais, além de gerar empregos para a comunidade.
3. Espera-se que os estudantes apontem que o soro caseiro é composto de água, açzcar e sal de cozinha, sendo a água o solvente, e os outros componentes, os solutos. No corpo humano, ele evita a desidratação e ajuda na reposição de sais minerais.
4. A torre é construída colocando-se primeiro os líquidos mais densos e depois os menos densos. Entretanto, também é preciso verificar a solubilidade entre os líquidos para que eles não se misturem. Assim, a torre é preparada com a adição das substâncias na ordem: água, óleo, álcool e querosene.
Página XLII
6. a ) A identificação de uma solução coloidal pode ser feita passando um feixe de luz pela solução, pois, caso seja, evidenciará o efeito Tyndall.
b ) Espera-se que os estudantes digam que Venâncio agiu adequadamente, pois desconfiou de uma informação recebida sem fontes confiáveis e decidiu pesquisar, checando o que pesquisadores falam sobre o assunto. Verifique se eles percebem que Fernando agiu inadequadamente, pois confiou em informações que recebeu em um vídeo, sem checar sua veracidade; da mesma forma, Gilmar acreditou em supostas experiências independentes de terceiros, sem buscar informações validadas cientificamente.
Respostas - Páginas 100 e 101
1. f ) Os estudantes podem comentar que os primeiros métodos de tratamento de água, como o relatado no texto, incluíam apenas a filtração em caixas de areia. Em seguida, foi adicionado o tratamento com cloro (desinfecção). Atualmente, a água passa por diferentes etapas em uma estação de tratamento, como floculação, decantação, filtração, desinfecção e fluoração. Além disso, é indicado o tratamento caseiro da água tratada nas ETA antes de ser consumida pelo ser humano.
2. Nesse caso, é possível utilizar o método de separação magnética, uma vez que a agulha metálica seria atraída pelo ímã. Outra possibilidade é utilizar a catação, método no qual se separa um dos componentes sólidos com as mãos. Nessa situação, por ser um objeto perfurante, a catação deve ser feita com equipamento de proteção adequado, como luvas antiperfurantes.
4. Os estudantes devem associar a extração ao fato de alguns componentes do chá serem separados após sua dissolução em água, produzindo o extrato. Como os galhos ou as folhas do chá estão dentro do papel que compõe o sachê, esse objeto funciona como um sistema de filtração, uma vez que os componentes sólidos são retidos.
5. Estações de tratamento de água não utilizam o método de destilação, pois nesse caso seria produzida água destilada (livre de sais minerais), a qual não é própria para consumo humano.
7. Os estudantes podem comentar que, primeiro, é necessário deixar o sistema em repouso. Por decantação, é preciso remover antes o óleo, que, por ser menos denso, ocupará a superfície do sistema na panela. Em seguida, o macarrão no fundo da panela pode ser separado por meio de peneiração ou filtração, com remoção da porção aquosa. Para a separação do sal dissolvido na água, é possível utilizar a vaporização por meio do aquecimento da solução.
8. Se necessário, escreva na lousa as fórmulas moleculares dos componentes de cada fase mencionada ou, ainda, seu peso molecular aproximado para auxiliar os estudantes na identificação.
9. Ao comporem a esquematização, os estudantes devem considerar que no sistema microscópico deve haver uma substância com bolinhas de ao menos duas cores e duas substâncias com bolinhas da mesma cor, diferentes entre si. Por ser uma solução homogênea, a representação macroscópica deve ser de um sistema com somente uma fase contínua.
Retome o que estudou - página 101
Respostas
1. Espera-se que os estudantes comentem a importância de um método para a Ciência, o método científico, algo que não está presente no senso comum, que advém apenas da observação.
2. Espera-se que os estudantes dissertem sobre o nascimento do laboratório como espaço de testes e estudo e a criação de instrumentos de laboratório e desenvolvimento de técnicas.
3. Espera-se que os estudantes comentem que a balança não apresentaria o dado mencionado pelo cliente, pois peso é uma medida de força, e o visor da balança apresenta um valor de massa. Portanto, a utilização do termo massa seria mais adequada na fala do cliente.
4. Espera-se que os estudantes indiquem que a irradiação é o que permite a chegada do calor até o planeta e que parte dessa energia é retida pelos gases na atmosfera, de modo que, quanto maior a concentração de gases do efeito estufa na atmosfera, maior a temperatura do planeta.
5. Espera-se que os estudantes relacionem a frase com o processo de nucleossíntese (fusão nuclear), que ocorreu e ocorre nas estrelas e origina os elementos químicos que compõem a matéria e formam, inclusive, o corpo humano.
6. Espera-se que os estudantes comentem que Rutherford e seus colaboradores, ao bombardearem uma lâmina de ouro com partículas alfa, perceberam que a maioria atravessou a lâmina, mas que algumas sofreram desvios e outras foram repelidas, retornando à fonte, levando-os a entender a existência de um centro positivo e que concentra quase toda a massa do átomo – o núcleo.
7. Espera-se que os estudantes respondam que, em geral, os metais são bons condutores de eletricidade e de calor, sendo dúcteis e maleáveis, e apresentam brilho metálico. Já os ametais são maus condutores de eletricidade e de calor, com tendência à opacidade, e, quando sólidos, fragmentam-se com certa facilidade e apresentam baixa temperatura de fusão. O hidrogênio tem a propriedade de se combinar com metais e ametais, e seu comportamento químico é semelhante ao dos ametais. Por fim, os gases nobres, nas CATP, apresentam-se no estado gasoso, e sua principal característica química é a alta estabilidade.
8. Resposta pessoal. Espera-se que os estudantes reconheçam que a Ciência é uma construção coletiva, baseada em experimentação e em constante alteração, e que possam notar relações do tipo: períodos da tabela e as camadas K, L, M, N, O, P e Q; organização das famílias; e distribuição eletrônica.
9. Resposta pessoal. Espera-se que os estudantes mencionem que a maionese pode ser identificada como uma mistura coloidal porque ela apresenta aspecto homogêneo a olho nu, não sofre nenhum tipo de separação por ação da gravidade e poderia ter partículas observadas sob um microscópio. Tanto a fase dispersa quanto o dispersante são líquidos.
Página XLIII
Unidade 2 A Química e a vida na Terra
Nessa unidade, são abordados conteúdos relacionados às ligações químicas e suas características, com destaque para a compreensão dos diferentes tipos de ligação entre os átomos – iônica, covalente e metálica – e as propriedades dos compostos resultantes de cada ligação interatômica e suas observações na vida cotidiana. Discutem-se a polaridade dos compostos, a geometria das moléculas e as interações que ocorrem entre elas. Analisam-se também as estruturas das diferentes funções orgânicas que contêm o oxigênio abre parênteses O fecha parênteses e o nitrogênio N.
Objetivos da unidade
- Compreender de que maneira os átomos dos elementos químicos se unem para formar as substâncias e suas propriedades.
- Compreender como ocorrem as interações intermoleculares do tipo dipolo induzido-dipolo induzido, dipolo permanente-dipolo permanente, íon-dipolo e as ligações de hidrogênio abre parênteses H fecha parênteses.
- Relacionar algumas propriedades das substâncias às suas interações intermoleculares.
- Classificar as moléculas em polares ou apolares com base no conceito de momento de dipolo.
- Explicar a tensão superficial da água.
- Diferenciar as funções orgânicas oxigenadas e nitrogenadas.
Justificativas
O tema dessa unidade e os conteúdos abordados em cada capítulo são relevantes para o entendimento da formação e aplicação das substâncias, bem como das aplicações de diversos compostos inorgânicos ou orgânicos no cotidiano, contribuindo para desenvolver a habilidade EM13CNT307. A análise das propriedades dos materiais, com base nos tipos de ligações químicas e nas interações intermoleculares, também possibilita o trabalho com essa habilidade.
Abertura da unidade - páginas 106 e 107
BNCC em contexto
A abordagem das páginas de abertura da unidade contribui para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 3, pois insere no contexto dos estudantes uma linguagem própria das Ciências naturais, especificamente da Química, cuja representação de materiais pode acontecer por meio do uso de modelos moleculares, retratando os elementos e as ligações químicas. Também possibilita à turma conhecer a aplicação dos materiais no mundo contemporâneo.
Inicie a abordagem dessas páginas perguntando aos estudantes se já conheciam o modelo representado na imagem. Explique que o modelo representa apenas uma parte pequena de uma molécula de ácido desoxirribonucleico (DNA) e questione o que eles sabem a respeito dela. Pergunte sobre sua composição, quais átomos estão em sua constituição e como sua estrutura consegue se manter no formato representado pelo modelo.
Respostas
a ) Resposta pessoal. Os estudantes podem responder que, por meio do estudo das interações, é possível compreender como as moléculas essenciais à vida são formadas, como a molécula de DNA e as proteínas produzidas por intermediação dela.
b ) Resposta pessoal. Espera-se que os estudantes reflitam sobre as contribuições da Química para a sociedade, pois, além de permitir analisar e descrever as interações presentes nos materiais, esses estudos podem colaborar para o desenvolvimento de novos materiais.
c ) Resposta pessoal. Espera-se que os estudantes mencionem que, por meio dos modelos representacionais, é possível prever e compreender o comportamento da matéria.
Capítulo 6 - A união dos átomos - páginas 108 a 121
Objetivos do capítulo
- Analisar as propriedades e características dos materiais, relacionando-as às ligações químicas entre seus átomos.
- Conhecer a ligação iônica.
- Conhecer a ligação covalente.
- Conhecer a ligação metálica.
- Elencar as condições necessárias para a condução de corrente elétrica.
- Representar as ligações químicas por meio da fórmula de Lewis e as estruturas de linhas.
- Reconhecer as diversas aplicações dos compostos de naturezas distintas no cotidiano.
BNCC em contexto
A abordagem da página 108 contribui para o desenvolvimento da habilidade EM13CNT201, pois possibilita aos estudantes analisar e debater modelos e teorias que discutem a origem da Terra e do Universo. A habilidade EM13CNT307 também é trabalhada, pois o estudo das ligações químicas permite prever as propriedades dos compostos e suas possíveis aplicações.
A reflexão da questão 1 dessa página contribui para o desenvolvimento da Competência geral 2, pois incentiva os estudantes a exercitarem a curiosidade intelectual e recorrer a abordagens próprias da Ciência ao levantar hipóteses sobre como os átomos se unem.
Peça aos estudantes que elaborem, em duplas, hipóteses sobre a questão oral proposta no início da página 108. Proponha, então, um debate coletivo a respeito das hipóteses formuladas, levando-os a perceber que os elementos químicos podem se ligar de diversas formas e em diferentes proporções.
Página XLIV
Ligado no tema - página 109
Objetivos
- Reconhecer ações que incentivam o consumismo.
- Discutir a importância do consumo consciente.
- Conhecer os impactos causados pela produção de materiais e objetos.
Orientações
Essa seção permite o trabalho com o tema contemporâneo transversal Educação ambiental. Ao reconhecer que na sociedade atual há o consumo desnecessário de bens materiais e que essa prática tem sido promovida por pessoas nas mídias, os estudantes são levados a refletir sobre suas práticas de consumo, entendendo que suas ações podem impactar o ambiente de forma negativa.
No momento que eles apresentarem suas respostas para a questão dessa seção, enfatize que o Objetivo 12 da Agenda 2030, ligado ao consumo e à produção responsáveis, deve ser um propósito para todos os cidadãos. Isso envolve mudanças de atitude e o reconhecimento de que todas as pessoas, apesar de serem capazes de prejudicar o ambiente, também são capazes de protegê-lo. Espera-se que, por meio dessa seção, os estudantes reconheçam que não são apenas as pessoas envolvidas diretamente em atividades de extração de materiais que são responsáveis pela degradação do meio ambiente.
Na página 110, retome com os estudantes o modelo atômico de Bohr e a distribuição eletrônica em camadas. Com base nessas informações, eles estarão aptos a reconhecer e identificar a tendência dos elementos de se tornarem cátions ou ânions.
Acompanhando a aprendizagem
Pergunte aos estudantes: "Por que quanto maior é a diferença de eletronegatividade entre dois átomos, maior é a força da ligação iônica entre eles?". Espera-se que eles respondam que, quanto maior é a diferença de eletronegatividade, mais efetivamente se dá a doação de elétrons entre os íons. É importante que eles tenham noção de continuidade de ligações químicas: uma ligação pode ser mais covalente e menos iônica ou menos covalente e mais iônica. Caso os estudantes tenham dificuldade em responder à questão, retome o conceito de eletronegatividade e peça a eles que o discutam em duplas. Ao trazer a discussão para todo o grupo, mostre que a diferença de eletronegatividade entre os elementos pode resultar em ligações iônicas de intensidades diferentes. No entanto, comparada a outros tipos de ligação química, essa ligação será mais forte.
Para reforçar os itens mais importantes a respeito das ligações iônicas, proponha aos estudantes algumas perguntas usando a estratégia de metodologia ativa Quick writing. Confira mais informações sobre essa estratégia nas páginas XI e XII destas Orientações para o professor.
Integrando o conhecimento
Ao abordar a extração do sal-gema na página 112, aproveite para realizar uma integração com o componente curricular de Geografia. Com auxílio do professor desse componente, oriente os estudantes a relembrar as camadas da Terra e indicar em qual delas o sal-gema se encontra e quais são suas características. Eles podem responder que ele está localizado na crosta, tem espessura média de 40 quilômetros e é onde são encontrados diversos elementos químicos.
Ao mencionar o êxodo urbano, explique aos estudantes que ele se refere à saída de pessoas da cidade, que, no caso de Maceió, foi resultado dos problemas causados à infraestrutura urbana pela atividade de extração de sal-gema.
Na página 113, inicie a explicação comentando que a diferença entre os valores da eletronegatividade dos elementos que participam de uma ligação química define se essa ligação será iônica ou covalente. No entanto, para efeitos didáticos, consideramos nessa coleção que a ligação iônica ocorre entre um elemento metálico e um elemento não metálico ou entre um elemento metálico e hidrogênio, enquanto a ligação covalente ocorre entre elementos não metálicos, não metálicos e hidrogênio ou entre hidrogênio e hidrogênio.
Mostre aos estudantes exemplos de ligações covalentes simples, como nas moléculas de hidrogênio abre parênteses H subscrito 2 fecha parênteses e de água abre parênteses H subscrito 2 O fecha parênteses. Lembre-se de ressaltar que o hidrogênio é uma exceção à regra do octeto. Por ter apenas uma camada de elétrons, ele se estabiliza com dois elétrons. Faça na lousa as fórmulas eletrônica e estrutural para os compostos citados.
Ao abordar a ligação metálica, explique como se dá a ligação entre os átomos dos metais. Comente que, de forma diferente do que ocorre nas ligações iônicas e covalentes, na ligação metálica não ocorre transferência ou compartilhamento de elétrons, não sendo necessário, nesse caso, observar a regra do octeto. Explique como funciona o modelo de elétrons deslocalizados na ligação metálica.
Após abordar a ligação metálica, acesse com os estudantes o simulador indicado na página 114. Os simuladores digitais são ferramentas das culturas juvenis que podem auxiliar na compreensão do conhecimento científico.
Materiais inteligentes - página 115
A leitura desse boxe contribui para o desenvolvimento da habilidade EM13CNT307, pois permite analisar as propriedades dos materiais para avaliar a adequação de seu uso em diferentes aplicações. A cada dia, a Ciência dos materiais se mostra cada vez mais promissora. Ela envolve conhecimentos das áreas de Física, Química e Engenharia, necessários para compreender e explicar as propriedades dos materiais e permitir o desenvolvimento de materiais com novas características.
Lembre os estudantes que, embora a classificação das ligações químicas possa ser feita com base nos grupos da tabela periódica aos quais os elementos pertencem – como na ligação iônica, que ocorre, geralmente, entre metais e não metais –, isso não é uma regra definitiva. Explore com a turma o diagrama da página 116, destacando que os compostos no topo do diagrama apresentam maior caráter iônico; aqueles do lado direito, covalente, e do lado esquerdo, metálico.
Com relação à representação das estruturas químicas, enfatize como elas são importantes para entender a organização dos átomos em diferentes tipos de ligação. Se possível, retome as estruturas do capítulo apresentadas até a página 117, destacando o tipo de ligação e a representação utilizada.
Página XLV
Prática científica - páginas 118 e 119
Objetivos
- Avaliar as condições necessárias para a condução de corrente elétrica, relacionando-as às ligações químicas dos compostos.
- Reconhecer e diferenciar materiais condutores e isolantes.
Orientações
Leia com os estudantes a contextualização inicial e pergunte se eles já passaram por uma situação similar à descrita, o que foi dito a eles como justificativa do perigo e se eles julgaram a explicação coerente. Em seguida, peça-lhes que compartilhem com os demais estudantes suas opiniões e a resposta do levantamento de hipóteses inicial.
Prossiga dizendo que eles farão testes de condutividade elétrica de alguns materiais, a fim de classificá-los como condutores ou isolantes. Antes de realizarem os testes e registros, oriente-os a fazer previsões da condução de corrente elétrica para cada material que será testado. Depois, a cada registro dos resultados, solicite a eles que apontem, com base em suas observações, o tipo de ligação presente nos compostos.
Ao final da prática, as soluções preparadas podem ser descartadas na pia, o açúcar e o sal podem ser descartados em lixo comum, e os demais materiais podem ser guardados para experimentos futuros.
Respostas
a ) Essa questão tem o objetivo de levar os estudantes a refletir sobre a química presente na vida de cada um deles e suas vivências. Eles podem comentar que a condução de corrente elétrica ocorre de maneira mais significativa na água do mar, não por causa da água propriamente dita, mas em razão da presença de sais que, em solução aquosa, se dissociam.
1. Os materiais nos quais a lâmpada acendeu: solução salina e placa de cobre. Os materiais em que a lâmpada não acendeu: solução de açúcar, sal, borracha e água destilada.
2. Resposta pessoal. Depende das respostas da questão do início da seção.
3. Água destilada e borracha escolar: ligação covalente; sal: ligação iônica; açúcar: ligação covalente; placa de cobre: ligação metálica. Se possível, escreva na lousa as fórmulas químicas dos compostos que se encontram em cada um dos materiais utilizados e peça aos estudantes que localizem os elementos na tabela periódica e os classifiquem como metal ou não metal.
4. A lâmpada acendeu ao entrar em contato com a solução de N a C l, pois compostos iônicos em solução aquosa formam íons livres, enquanto o sal sólido contém íons imóveis. A placa de cobre conduziu, pois há elétrons livres em sua estrutura, possibilitando a condução de eletricidade.
5. Na etapa I, a lâmpada também acendeu, porém, como havia mais íons livres para conduzir a corrente elétrica, o resultado foi um brilho mais intenso.
6. Resposta pessoal. Espera-se que os estudantes representem os cátions de cobre envoltos por elétrons.
7. Resposta pessoal. Acompanhe a elaboração do podcast pelos estudantes e, caso eles tenham dificuldade em alguma etapa, auxilie-os.
Acompanhando a aprendizagem
Para uma avaliação final, selecione alguns materiais que fazem parte do cotidiano, como sal, açúcar e vinagre. Coloque separadamente uma pequena amostra deles em recipientes tampados, como potes de vidro, e suas fórmulas químicas registradas na parte externa do recipiente. Organize os materiais em mesas e peça aos estudantes que montem uma tabela no caderno, apresentando o nome do material, o estado físico à temperatura ambiente, os elementos químicos de sua composição e o tipo de ligação química presente nele.
Peça-lhes que preencham a tabela em duplas. Dê a eles entre um e dois minutos para que passem em cada mesa e façam o preenchimento da tabela. Ao final dessa dinâmica, analise as anotações deles e faça correções, caso necessário.
Respostas - Páginas 120 e 121
2. a ) O composto A l subscrito 2 O subscrito 3 apresenta ligações iônicas, pois é formado por um metal e um ametal, e o metal alumínio puro abre parênteses A l fecha parênteses apresenta ligações metálicas, pois é formado apenas por um elemento químico metálico.
b ) Apenas o alumínio é bom condutor elétrico, pois apresenta ligação química do tipo metálica.
c ) O alumínio é mais maleável por causa da livre movimentação dos elétrons em sua estrutura.
d ) Ocorre primeiro a fusão do alumínio metálico porque as ligações iônicas são mais fortes do que as ligações metálicas. Se os estudantes ficarem em dúvida, cite as temperaturas de fusão dessas duas substâncias: 2.054 graus Celsius do A l subscrito 2 O subscrito 3 e 660 graus Celsius do A l.
3. Alternativa b.
II ) Falsa. As ligações covalentes ocorrem entre os elementos químicos não metálicos; não metálicos e hidrogênio; e entre átomos de hidrogênio, ocorrendo compartilhamento de elétrons. Os compostos com esse tipo de ligação, em geral, não são bons condutores de eletricidade.
4. Alternativa c. Única alternativa que não apresenta elemento pertencente ao grupo dos gases nobres.
5. a )N H subscrito 3
b ) Apesar de ter ligações do tipo covalente, a amônia pode formar íons em solução e, portanto, ser um bom condutor elétrico.
c )
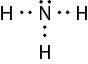
d ) Espera-se que os estudantes citem como prevenção: treinamento dos funcionários, plano de emergência, manutenção e conservação dos equipamentos, entre outras ações. Quanto aos procedimentos após o acidente, podem citar: acionar o corpo de bombeiros e evacuar o frigorífico.
Página XLVI
11. Iônica. Formação: formação de íons por transferência de elétrons. Propriedades: alta temperatura de fusão, solúvel em água e condutor de eletricidade em solução. Exemplos: N a C l, K B r e C a F subscrito 2.
Covalente. Formação: compartilhamento de elétrons. Propriedades: baixa temperatura de ebulição, solubilidade variável e não é condutor de eletricidade. Exemplos: H subscrito 2 O (simples), O subscrito 2 (dupla) e H subscrito 2(simples).
Metálica. Formação: elétrons deslocalizados. Propriedades: alta condutividade elétrica, maleável e dúctil. Exemplos: F e, C u e A l.
Capítulo 7 - As interações entre as moléculas - páginas 122 a 136
Objetivos do capítulo
- Conhecer a tensão superficial.
- Conhecer o modelo de repulsão dos pares de elétrons da camada de valência (VSEPR) e a geometria molecular.
- Conhecer a polaridade e classificar as moléculas em polares ou apolares.
- Analisar como ocorrem as interações intermoleculares.
- Relacionar o tipo de interação intermolecular com algumas propriedades físicas dos materiais.
BNCC em contexto
A abordagem da página 122 contribui para o desenvolvimento da habilidade EM13CNT301, pois possibilita aos estudantes elaborar questões e hipóteses para representar e interpretar modelos explicativos.
A análise das situações envolvendo o inseto sobre a superfície da água e a película que se formou no nadador possibilita aos estudantes exercitar a curiosidade intelectual e recorrer à abordagem da Ciência para investigar, levantar hipóteses e elaborar conclusões com base em conhecimentos científicos, contribuindo para desenvolver a Competência geral 2.
Peça aos estudantes que, individualmente, observem a imagem do inseto sobre a água e reflitam sobre os questionamentos do texto inicial. Em seguida, usando a metodologia Think-pair-share, incentive-os a compartilhar o raciocínio individual com um colega. Depois, oriente-os a socializar com um grupo maior os pensamentos e as conclusões a que a dupla chegou.
Prática científica - página 123
Objetivos
- Observar a tensão superficial da água.
- Analisar o efeito da área de contato da agulha na água.
Orientações
Diga aos estudantes que eles vão analisar na prática os efeitos da tensão superficial da água sobre objetos.
Incentive os estudantes a responder à questão no tópico Por dentro do contexto para identificar outros fatores que afetam o comportamento da água além da densidade. Espera-se que respondam que em alguns casos um material mais denso pode flutuar sobre outro, por conta da tensão superficial do líquido.
É preciso orientá-los a ter cuidado ao manipular a agulha a fim de evitar perfurações; se possível, indique o uso de luvas e óculos de segurança. Um recipiente de plástico também diminui as chances de cortes caso o material caia no chão. Após a prática, a água com detergente pode ser descartada em uma pia.
Para avaliar também a influência da área superficial, questione-os: se a agulha fosse colocada sobre a superfície da água na vertical, o resultado seria diferente? Se possível, peça a um estudante que coloque a agulha na vertical sobre a água sem o detergente no recipiente para que todos observem o resultado. Explique os resultados com base na densidade da agulha – já que afunda, ela tem maior densidade do que a água.
Respostas
1. A água é um líquido que apresenta alta tensão superficial. Logo, objetos pequenos podem flutuar sobre ela, mesmo que sejam mais densos.
2. Após a adição do detergente, a agulha afunda na água. Isso ocorre porque o detergente diminui a tensão superficial da água.
Ao abordar o quadro da página 124, que apresenta diversos exemplos de geometrias moleculares, use o simulador indicado no boxe Dica. Se possível, leve os estudantes à sala de informática ou peça a eles que utilizem o smartphone.
Para auxiliar a compreensão dos estudantes sobre as diferentes geometrias das moléculas, se possível, utilize balões amarrados uns aos outros ou monte um modelo tridimensional com esferas de poliestireno e palitos de madeira, permitindo que os estudantes manipulem os modelos construídos.
Conexões com… - página 125
Objetivos
- Compreender a relação entre alguns conteúdos matemáticos e a geometria molecular.
- Conhecer ângulo de ligação.
Orientações
Leia o texto com os estudantes. Represente as ligações de algumas moléculas reais na lousa por meio das fórmulas estruturais, como o B F subscrito 3. Utilize uma cor de giz para fazer essa representação e outra cor para a figura geométrica, que nesse caso é o triângulo equilátero. Depois, com outra cor, acrescente os valores dos ângulos. Faça isso com ao menos uma molécula para cada geometria representada. Se possível, reproduza todas as estruturas apresentadas utilizando um modelo molecular e auxilie os estudantes a identificar todos os planos que formam as figuras geométricas.
Para responder à questão final, peça aos estudantes que avaliem, primeiramente, as condições necessárias para que a geometria da molécula seja parecida com um triângulo, o que envolveria a presença de 4 átomos. Assim, eles serão capazes de reconhecer que o cloreto de cianogênio abre parênteses C l C N fecha parênteses já não pode ser a resposta. Depois, peça-lhes que representem as estruturas do formaldeído abre parênteses C H subscrito 2 O fecha parênteses e da amônia abre parênteses N H subscrito 3 fecha parênteses considerando os átomos que têm par de elétrons não ligantes e que se posicionem o mais distante possível uns dos outros, bem como dos pares ligantes.
Faça a distinção entre polaridade das ligações e polaridade das moléculas. Mostre que, se uma ligação covalente ocorre entre elementos diferentes, por terem eletronegatividades diferentes, o mais eletronegativo deles irá atrair mais os elétrons que formam a ligação, sendo polarizado negativamente. Quando os átomos presentes na ligação são do mesmo elemento, não ocorre a polarização. Conclua dizendo que a polaridade das ligações é definida usando esse critério.
Página XLVII
Acompanhando a aprendizagem
Aplicando a estratégia Quick writing, faça uma avaliação sobre a compreensão do conceito de polaridade. Além de pedir aos estudantes que expliquem o que define se uma molécula é polar ou apolar, escreva na lousa a fórmula estrutural de algumas moléculas e peça-lhes que as classifiquem como polares ou apolares.
BNCC em contexto
A abordagem das páginas 128 e 129 contribui para o desenvolvimento da habilidade EM13CNT301, pois possibilita aos estudantes que construam questões e elaborem hipóteses para representar e interpretar modelos explicativos.
A análise da situação envolvendo os béqueres com água e com álcool possibilita aos estudantes que exercitem a curiosidade intelectual e recorram à abordagem da Ciência para investigar, levantar hipóteses e elaborar conclusões com base em conhecimentos científicos, contribuindo para desenvolver a Competência geral 2.
Na página 129, comente que os saberes dos povos e comunidades tradicionais foram fundamentais na construção e transformação da sociedade, resultando em experimentações empíricas e conhecimentos que beneficiaram diversas áreas da sociedade. A abordagem sobre a extração de óleo de coco em comunidades quilombolas permite desenvolver o tema Educação para valorização do multiculturalismo nas matrizes históricas culturais brasileiras, pois associa as técnicas de separação de misturas aos conhecimentos tradicionais desses povos.
Comente com os estudantes que não precisam prever as temperaturas de ebulição dos compostos. Eles devem ser capazes de interpretar as informações como a geometria molecular, a polaridade e as interações intermoleculares que ocorrem nas substâncias. Também deverão ser capazes de prever qual substância tem temperatura de fusão ou de ebulição mais alta ou mais baixa quando comparada a outra. É sempre oportuno lembrar os estudantes de que o aprendizado não deve ser baseado em memorização.
Ligado no tema - páginas 132 e 133
Objetivos
- Relacionar o estudo das propriedades das substâncias, como a polaridade, no desenvolvimento de produtos para prevenir acidentes automobilísticos.
- Conscientizar os cuidados no trânsito nos dias de chuva.
Orientações
Leia os textos de forma conjunta e peça aos estudantes que analisem a fotografia do para-brisa, na página 133, para confirmar se ele está repelindo a água. Depois, explique as diferenças entre as ilustrações dessa mesma página, de como é a passagem da luz na superfície com gotas de água e sem elas. O assunto sobre segurança no trânsito está associado ao tema contemporâneo transversal Educação para o trânsito, pois evidencia como os conhecimentos químicos, a exemplo da polaridade, podem ajudar na prevenção de acidentes.
Relembre aos estudantes a polaridade da água (polar) e peça a eles que infiram a polaridade do cristalizador com base no princípio de que substâncias com polaridades iguais tendem a se solubilizar, enquanto as com polaridades distintas não tendem a se misturar.
Respostas - Páginas 134 e 135
4. Espera-se que os estudantes expliquem que o etanol abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses é uma substância com duas partes em sua estrutura: uma polar e outra apolar. Assim, quando está presente na gasolina há interações do tipo dipolo induzido-dipolo induzido entre as substâncias apolares que a constituem e a parte apolar do etanol, formando assim uma mistura homogênea. Ao adicionar água (substância polar) a esse sistema, a parte polar do etanol forma ligações de hidrogênio abre parênteses H fecha parênteses com as moléculas de água. Dessa forma, o sistema passa a ser uma mistura heterogênea, com duas fases. Assim, é possível determinar a quantidade de etanol na gasolina ao comparar seu volume inicial e final. Essa diferença de volume é relativa ao volume de etanol inicialmente presente na gasolina (com etanol), que passa a formar outra fase com a água.
5. a ) Ligações de hidrogênio, por conta da presença de átomos de hidrogênio ligados a átomos muito eletronegativos (F, O e N).
b ) Espera-se haver interações mais fortes no H F, pois o flúor é mais eletronegativo.
6. a ) Todas as substâncias são polares.
b ) Acetona abre parênteses C subscrito 3 H subscrito 6 O fecha parênteses: dipolo permanente-dipolo permanente; água: ligação de hidrogênio; etanol: ligação de hidrogênio.
c ) Porque ela possui um maior número de hidrogênios que podem realizar ligações de hidrogênio quando comparada às outras moléculas (o etanol possui apenas um hidrogênio, e a acetona não possui hidrogênios ligados a átomos bastante eletronegativos).
d ) Acetona e etanol, pois, embora sejam moléculas polares, apresentam regiões apolares, permitindo que sejam solúveis em óleo, um composto apolar.
Capítulo 8 - Funções orgânicas I - páginas 137 a 149
Objetivos do capítulo
- Identificar substâncias orgânicas e relacioná-las a suas estruturas e propriedades.
- Diferenciar substâncias orgânicas e substâncias inorgânicas.
- Diferenciar e classificar cadeias carbônicas.
- Conhecer a nomenclatura das estruturas de hidrocarbonetos de acordo com as regras da União Internacional de Química Pura e Aplicada (IUPAC).
Página XLVIII
- Reconhecer que os combustíveis fósseis como o petróleo e o gás natural são constituídos por hidrocarbonetos.
- Relacionar os problemas ambientais com o uso de combustíveis fósseis.
BNCC em contexto
Nas páginas 137 e 138, é feito um resgate histórico do desenvolvimento da Química orgânica, com foco nas tentativas de isolamento de substâncias presentes em organismos vivos, na teoria da força vital e nos postulados de Kekulé, o que contribui para o trabalho com as Competências gerais 1 e 2 e a habilidade EM13CNT201. Quando consideramos também a possibilidade de a vida se originar de compostos inorgânicos em uma atmosfera primitiva, levando à produção de compostos orgânicos, contempla-se a habilidade EM13CNT202.
Acompanhando a aprendizagem
As questões 1 e 2 propostas na página 137 possibilitam verificar a relação que os estudantes fazem entre os ciclos da vida e as composições química e orgânica dos seres vivos, servindo como avaliação diagnóstica. Provavelmente, eles ainda não terão um conhecimento ampliado acerca do ciclo do carbono, mas já podem saber que grande parte da composição de um organismo vivo se dá pela matéria orgânica. Caso algum estudante cite compostos de carbono, peça a ele que desenvolva o raciocínio.
As equações químicas são uma linguagem própria da Química para representar reações que ocorrem naturalmente e de maneira artificial. Elas são uma representação universal desses processos, podendo ser entendidas em qualquer lugar do mundo sem alteração alguma. Como exemplo, temos uma reação de combustão do metano:
C H subscrito 4 mais 2 O subscrito 2 seta para a direita C O subscrito 2 mais 2 H subscrito 2 O
Nessa equação, os reagentes são o metano e o gás oxigênio, e os produtos são o gás carbônico e a água.
A página 138 discute formulações de hipóteses para o surgimento da vida ao tratar da síntese de aminoácidos pelos químicos estadunidenses Stanley Miller (1930-2007) e Harold Urey (1893-1981). Nessa abordagem, atente para não entrar na discussão sobre quais teorias são certas ou erradas acerca do surgimento da vida e peça aos estudantes que tentem expressar com palavras a importância desse experimento. Incentive-os a perceber que o experimento permitiu constatar que, em condições apropriadas, a matéria orgânica pode ser criada por fenômenos naturais, como descargas elétricas em uma atmosfera rica em substâncias simples e compostas. Esse conteúdo é trabalhado também no componente curricular de Biologia, quando se estuda a origem do Universo, do Sistema Solar e, consequentemente, da vida.
A representação de compostos orgânicos pode ser desafiante para alguns estudantes, visto que omite a maioria dos átomos e exige compreensão sobre geometria molecular. Por conta disso, utilize um tempo maior da aula para se certificar de que todos compreenderam os conceitos dessa representação e reforce os postulados de Kekulé. Para auxiliá-los, construa na lousa uma fórmula estrutural plana que mostre os átomos de carbono e os átomos de hidrogênio abre parênteses H fecha parênteses ligados aos de carbono. Utilize o butan-1-ol como exemplo. Primeiro, desenhe na lousa a fórmula estrutural plana do exemplo; depois, explique aos estudantes que, em compostos orgânicos, os átomos de carbono e de hidrogênio são geralmente ocultados.
Ao lado da fórmula estrutural, escreva na lousa a fórmula estrutural simplificada. Reforce que na cadeia carbônica a ligação entre vários átomos de carbono é representada por traços ligados. Nessa estrutura, cada vértice retrata um átomo de carbono, e todas as ligações demonstradas no desenho se referem a ligações entre átomos de carbono. Aproveite e peça aos estudantes que expressem a fórmula molecular da substância contando todos os átomos presentes: C subscrito 4 H subscrito 10 O ou C subscrito 4 H subscrito 9 O H.

Se julgar conveniente, peça a eles que a façam no sentido inverso também, ou seja, desenhem a fórmula estrutural simplificada e depois a estrutural plana. Use como exemplos: 2-metilpropano, butano, dietilamina, acetato de etila, benzeno, entre outros. No momento, não é preciso nomeá-las, pois a nomenclatura será estudada posteriormente.
BNCC em contexto
A página 139 aborda as propriedades dos compostos orgânicos, apresentando informações importantes que servirão como base para a compreensão dos estudantes sobre Química orgânica, estimulando o exercício da curiosidade intelectual, o que contribui para o desenvolvimento da Competência geral 2.
A abordagem das páginas 139 e 140, sobre a estrutura e a forma de ação de detergentes, incentiva os estudantes a refletir sobre a necessidade da higiene pessoal e da higienização dos objetos com os quais temos contato, principalmente após a eclosão da pandemia de covid-19, o que contempla as Competências gerais 8 e 10 e as habilidades EM13CNT104 e EM13CNT307.
Nas páginas 141 e 142, os estudantes entram em contato com as formas de classificação de cadeias carbônicas. Esse é um assunto bastante técnico e que pode ser assimilado pela prática de exercícios na lousa. Dessa maneira, após terminar a abordagem da página 142, desenhe na lousa diversos exemplos de compostos orgânicos e peça aos estudantes que os classifiquem respondendo em voz alta.
Ao abordar a classificação por disposição dos átomos de carbono na cadeia, reforce que os átomos diferentes do carbono não são levados em consideração, apenas os átomos de carbono. Ou seja, um átomo de carbono ligado a dois átomos de carbono, a um átomo de hidrogênio e a um átomo de oxigênio será secundário, pois está ligado apenas a dois átomos de carbono. Isso pode confundir os estudantes.
Página XLIX
Sobre a representação do anel aromático, comente que a representação das duplas ligações intercaladas não é fixa. Elas também podem ser suprimidas e o círculo pode ser representado dentro da estrutura com forma de hexágono. Ao abordar a estrutura do anel aromático em vários compostos orgânicos, destaque a participação da cientista irlandesa Kathleen Lonsdale (1903-1971) no estudo dessa estrutura. Em 1929, usando métodos de difração de raios X, Lonsdale provou que o anel benzênico era plano. Ela foi a primeira mulher no cargo de professora titular na University College London e a primeira mulher presidente da União Internacional de Cristalografia e da Associação Britânica para o Avanço da Ciência.
Os aplicativos para dispositivos móveis como o sugerido no boxe Dica da página 144 são ferramentas das culturas juvenis que contribuem para aproximar o conhecimento científico do cotidiano dos estudantes.
A discussão sobre os compostos conhecidos como BTEX está vinculada ao tema contemporâneo transversal Trabalho, pois expõe a importância do conhecimento sobre esses compostos orgânicos para o cotidiano dos profissionais envolvidos a fim de garantir a saúde e a segurança deles.
Matriz energética brasileira e consumo de petróleo
O conteúdo da página 148 traz a discussão sobre o uso de petróleo como fonte energética primordial e não renovável e a dependência mundial desse material. Esse conteúdo possibilita o trabalho conjunto com os professores da área de Ciências Humanas Sociais e Aplicadas, principalmente os do componente curricular de Geografia. Coordene com esses professores a explicação sobre a extração e a produção de petróleo e suas consequências geopolíticas, incluindo invasão de territórios, guerras travadas pelo controle do petróleo (guerra Irã-Iraque, guerra do golfo Pérsico, invasão dos Estados Unidos no Iraque) e variações drásticas de preço.
Enfatize que o petróleo é uma importante fonte de energia, usado na produção de diversos combustíveis e como matéria-prima na fabricação de produtos do cotidiano.
Do ponto de vista ambiental, o petróleo é um grande poluidor atmosférico, terrestre e marítimo. Por isso, sugere-se que sejam abordados também os resultados geopolíticos de propostas de mitigação dessas consequências, incluindo a Rio-92, o Protocolo de Kyoto, o Acordo de Paris e a venda de créditos de carbono. Para obter mais informações sobre esses assuntos, são sugeridos os seguintes conteúdos:
- BRASIL. Ministério do Meio Ambiente. Acordo de Paris. Disponível em: https://s.livro.pro/0380xs. Acesso em: 26 set. 2024.
- O QUE é e como funciona o mercado de carbono? Ipam Amazônia. Disponível em: https://s.livro.pro/ua2s9y. Acesso em: 26 set. 2024.
Acompanhando a aprendizagem
As regras de nomenclatura para hidrocarbonetos, exploradas nas páginas 146 e 147, servirão como base para a nomenclatura de outras funções químicas. Por isso, é de fundamental importância que os estudantes dominem o assunto. Para realizar uma avaliação ao final do capítulo, desenhe mais estruturas na lousa e peça para eles nomeá-los.
Respostas - Página 143
2. a ) O tolueno e o xileno.
b )H subscrito 2 O, C subscrito 7 H subscrito 8 e C subscrito 8 H subscrito 10.
c ) Espera-se que os estudantes respondam que a água causa menos impactos ambientais. Comente com eles que solventes como o tolueno e o xileno são considerados compostos orgânicos voláteis (COV), sendo seus vapores poluentes irritantes, tóxicos e potencialmente carcinogênicos.
3. A − III; B − II; C − I. O ácido carboxílico tem ligações de hidrogênio entre suas moléculas e interação forte, o que justifica a elevada temperatura de ebulição. A acetona é levemente polar, assim ocorre interação do tipo dipolo permanente-dipolo permanente, de intensidade mediana. O etano é apolar e, por isso, realiza interações do tipo dipolo induzido-dipolo induzido, considerada a mais fraca, por isso tem temperatura de ebulição baixa.
5. a ) Compostos orgânicos são aqueles que apresentam o átomo de carbono em sua composição, geralmente ligado ao hidrogênio abre parênteses H fecha parênteses. Além de átomos de carbono ligados a átomos de hidrogênio, as moléculas orgânicas podem apresentar outros átomos em sua composição, como oxigênio abre parênteses O fecha parênteses, nitrogênio N, enxofre abre parênteses S fecha parênteses, fósforo abre parênteses P fecha parênteses e halogênios. As ligações entre esses átomos e o carbono são predominantemente covalentes. Por outro lado, os compostos inorgânicos costumam conter metais ou hidrogênio combinado a um átomo do grupo dos ametais. Eles podem ser formados por ligações iônicas, como no caso do cloreto de sódio abre parênteses N a C l fecha parênteses, ou covalentes, como o dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses.
b ) Miller e Urey realizaram um experimento envolvendo um dispositivo fechado com gases que supostamente existiam na atmosfera primitiva. Esses gases foram aquecidos, resfriados e submetidos a descargas elétricas. Ao final desse período, foi possível observar a formação dos aminoácidos que são compostos orgânicos precursores da vida.
c )C H subscrito 4 mais N H subscrito 3 mais H subscrito 2 O expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, energia, fim do detalhe acima C subscrito 2 H subscrito 5 N O subscrito 2 mais C subscrito 3 H subscrito 7 N O subscrito 2
Os reagentes são metano abre parênteses C H subscrito 4 fecha parênteses, amônia abre parênteses N H subscrito 3 fecha parênteses e água abre parênteses H subscrito 2 O fecha parênteses. Os produtos são glicina abre parênteses C subscrito 2 H subscrito 5 N O subscrito 2 fecha parênteses e alanina abre parênteses C subscrito 3 H subscrito 7 N O subscrito 2 fecha parênteses. As moléculas orgânicas são: C H subscrito 4, alanina e glicina. As moléculas inorgânicas são: N H subscrito 3 e H subscrito 2 O.
Respostas - Página 149
1. a )
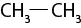
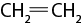
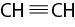
b ) Etano, eteno e etino.
Página L
c ) Espera-se que os estudantes respondam que são cadeias abertas, lineares, homogêneas e insaturadas, com exceção do etano, que tem cadeia saturada.
5. a ) As moléculas de feromônios devem ser voláteis, o que está relacionado com sua estrutura molecular, que deve apresentar massa molecular baixa e forças intermoleculares fracas.
b )
Esse composto é insolúvel em água, pois se trata de uma molécula apolar, o que justifica a capacidade de as formigas andarem pela grama na chuva.
6. a )C subscrito 18 H subscrito 29 O subscrito 3 S N a
b ) A molécula representada pode ser classificada como detergente, pois apresenta em sua estrutura uma parte apolar passível de interação com moléculas de gordura e uma parte polar que interagiria bem com moléculas de água.
Capítulo 9 - Funções orgânicas II - páginas 150 a 171
Objetivos do capítulo
- Analisar as características e propriedades dos compostos orgânicos oxigenados das funções álcool, aldeído, cetona, ácido carboxílico, fenol, enol, éter e éster, bem como suas regras de nomenclatura.
- Identificar a presença de alguns compostos orgânicos oxigenados no cotidiano.
- Analisar as características e propriedades dos compostos orgânicos nitrogenados das funções amina e amida, bem como suas regras de nomenclatura.
- Identificar a presença de alguns compostos orgânicos nitrogenados no cotidiano.
- Conhecer o fenômeno da isomeria entre compostos orgânicos e identificar os tipos de isomeria.
BNCC em contexto
A abordagem da página 151 contribui para o desenvolvimento da habilidade EM13CNT309, pois permite analisar questões socioambientais, políticas e econômicas relativas à dependência do mundo atual em relação aos recursos não renováveis e discutir a necessidade de introduzir alternativas e novas tecnologias energéticas e de materiais, comparando diferentes tipos de motores e processos de produção de novos materiais.
A abordagem sobre colesterol na página 152 possibilita trabalhar a Competência geral 8 e o tema contemporâneo transversal Saúde, pois instiga os estudantes a investigar a importância e os malefícios do acúmulo de colesterol no organismo.
Inicie a aula retomando o conceito de hidrocarboneto, destacando que a principal fonte desses compostos é o petróleo.
Usando a estratégia Quick writing, peça aos estudantes que respondam à seguinte questão: por que não existe um composto de nome butan-3-ol? Em seguida, usando a mesma estratégia, escreva na lousa a fórmula estrutural de um enol e de um álcool cíclico e pergunte se as substâncias representadas pertencem à função álcool.
Ao trabalhar a fermentação alcoólica, questione os estudantes sobre a importância dos fungos para a produção industrial e para os ambientes.
Atividade extra
Se julgar conveniente, apresente aos estudantes um vídeo do programa Pontociência, da UFMG, que descreve um experimento investigativo sobre a fermentação da sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses. Disponível em: https://s.livro.pro/u2u2bc. Acesso em: 3 out. 2024. Nesse vídeo, observa-se a fermentação da sacarose com a formação de gás carbônico abre parênteses C O subscrito 2 fecha parênteses. Organize os estudantes em grupos e oriente-os a fazer a montagem experimental. A observação da saída de gás poderá ser feita apenas no dia seguinte. Após as observações, peça-lhes que analisem as reações da fermentação no Livro do Estudante, pesquisem a fermentação da sacarose para a produção de etanol abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses e respondam às seguintes questões no caderno.
a ) Quais são as semelhanças entre a atividade feita por eles e o processo de produção do etanol por fermentação?
b ) Desenhe um fluxograma do processo de produção do etanol.
c ) O que é a produção de etanol de segunda geração?
Compartilhe ideias - página 152
O primeiro boxe aborda o tema contemporâneo transversal Ciência e tecnologia e contribui para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 1, que envolve analisar processos tecnológicos, a fim de propor ações individuais e coletivas que mitiguem os impactos socioambientais de alguns desses processos.
O segundo boxe está relacionado aos temas contemporâneos transversais Saúde e Vida familiar e social, além de contribuir para o desenvolvimento da habilidade EM13CNT207, que visa desenvolver e divulgar ações de prevenção e promoção da saúde e do bem-estar dos jovens.
Resposta
a ) Resposta pessoal. O objetivo dessa atividade é levar os estudantes a reconhecer que o consumo excessivo de bebidas alcoólicas, além dos problemas de saúde relacionados, causa problemas sociais, como acidentes de trânsito, violência doméstica, vandalismo, acidentes de trabalho, aumento da demanda de atendimentos hospitalares, entre outras situações.
Integrando o conhecimento
A questão 3 da página 152 pode ser usada para retomar conceitos sobre a produção e a função do colesterol no organismo, tema referente ao componente curricular de Biologia. É possível também aproveitar esse momento para mostrar a relação entre esses componentes curriculares comentando a complementaridade entre a Química, que estuda a fórmula, a composição, a estrutura e a propriedade das substâncias, e a Biologia, que trata da presença desse mesmo composto no corpo humano; mencione que essa fusão caracteriza a área da Ciência conhecida como Bioquímica.
Página LI
Atividade extra
O consumo de açúcares como a sacarose, a frutose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses e a glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses está associado a dois problemas de saúde pública: a obesidade e o diabetes. Veja mais informações no artigo "Consumo de frutose e impacto na saúde humana". Disponível em: https://s.livro.pro/4p5mtq. Acesso em: 3 out. 2024. Esse artigo apresenta algumas características dessas substâncias e mostra como a frutose presente nas frutas também pode ser prejudicial sob certas condições. Apresente aos estudantes as principais informações do artigo. Depois, abra uma discussão em sala de aula e proponha que respondam às seguintes questões.
a ) Faça uma lista dos alimentos que você costuma ingerir no dia a dia.
b ) Verifique quais deles são ricos em açúcares.
c ) Proponha formas de substituí-los por opções mais saudáveis.
Antes de iniciar a explicação sobre os fenóis, faça uma revisão de compostos aromáticos. Em seguida, lembre os estudantes de que, para uma substância ser classificada como álcool, deve conter uma hidroxila ligada a um átomo de carbono saturado.
BNCC em contexto
As questões 6 e 7 da página 156 e a análise da tirinha da página 157 incentivam os estudantes a refletir sobre aspectos relacionados à manutenção da saúde, contribuindo para desenvolver a Competência geral 8, além de abordar o tema contemporâneo transversal Saúde.
A análise da tirinha da página 157 também contribui para desenvolver a Competência geral 3, pois incentiva os estudantes a fruir e valorizar expressões artísticas.
A página 157 desenvolve a habilidade EM13CNT309 ao mencionar o biodiesel, pois permite analisar questões socioambientais, políticas e econômicas referentes à dependência que o mundo atual tem dos recursos não renováveis e discutir a necessidade de alternativas e novas tecnologias energéticas e de materiais, comparando diferentes tipos de motores e processos de produção de novos materiais.
Peça aos estudantes que leiam a tirinha e opinem sobre a questão 8 da página 157. Explique que há substâncias artificiais que imitam o aroma de algumas frutas e que essas substâncias pertencem a uma função orgânica chamada éster. Aproveite essa tirinha para incentivá-los a refletir sobre como deve ser o consumo de produtos alimentícios ultraprocessados.
Conexões com… - páginas 158 e 159
Objetivos
- Compreender como o diabetes está relacionado à presença da glicose no sangue.
- Conhecer as causas e os sintomas do diabetes.
- Reconhecer avanços da Ciência que contribuem para o tratamento e a monitoração do diabetes.
Orientações
Ao abordar o diabetes, doença que se estima afligir cerca de 10% da população brasileira, apresentando como ela afeta as pessoas e as contribuições da Ciência para o tratamento e o controle dessa doença, essa seção colabora para o trabalho com os temas contemporâneos transversais Saúde, Educação alimentar e nutricional e Ciência e tecnologia, além de permitir uma abordagem integrada com o componente curricular de Biologia.
Antes de iniciar a leitura da seção, verifique o conhecimento prévio dos estudantes perguntando se já fizeram algum exame de sangue e se eles se recordam dos parâmetros analisados. Caso não mencionem a concentração de glicose, cite-a e questione quais são os possíveis problemas de saúde advindos de alterações nesse parâmetro.
Aproveite o esquema da glicólise e proponha aos estudantes que o analisem com o auxílio do professor de Biologia, destacando que as moléculas de ATP formadas no processo são responsáveis por armazenar e liberar energia.
BNCC em contexto
A questão 12 da página 163 incentiva os estudantes a autoavaliar sua alimentação, principalmente relacionada ao consumo de proteínas, contribuindo para desenvolver a Competência geral 8 e o tema contemporâneo transversal Saúde.
Ao mencionar a erva-mate, comente que, em 2023, a planta foi tombada como o primeiro patrimônio cultural imaterial do Rio Grande do Sul. Essa abordagem permite realizar uma integração com o componente curricular de História ao mencionar que o tombamento é feito levando em consideração a cultura da população local e o uso relevante desse recurso ao longo do desenvolvimento da região.
Para introduzir o conceito de isomeria, forneça modelos moleculares ou bolas de poliestireno expandido e palitos de madeira de forma que os estudantes possam montar as fórmulas apresentadas na página 165, do etanol e do metoximetano abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses.
Inicie a explicação sobre os diastereoisômeros, na página 166, mostrando a impossibilidade de rotação dos átomos de carbono por causa da presença da ligação dupla. Se possível, use modelos moleculares para os estudantes visualizarem de forma concreta.
Compartilhe ideias - página 167
O boxe incentiva os estudantes a refletir sobre os malefícios do consumo excessivo de alimentos processados e ultraprocessados que contêm gorduras trans, levando-os a tomar medidas saudáveis. Esse tema contribui para desenvolver a Competência geral 8 e o tema contemporâneo transversal Saúde.
Página LII
Além disso, contribui para o trabalho com o tema contemporâneo transversal Educação alimentar e nutricional e para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 3, pois envolve investigar situações-problema, propor soluções e comunicar descobertas e conclusões ao público.
BNCC em contexto
A abordagem da página 168 contribui para o desenvolvimento da habilidade EM13CNT104 ao mencionar a talidomida, pois permite avaliar benefícios e riscos à saúde e ao ambiente, considerando a composição, a toxicidade e a reatividade de diferentes materiais e produtos, como também o nível de exposição a eles, posicionando-se criticamente e propondo soluções individuais e/ou coletivas tanto para seu uso quanto para o respectivo descarte responsável.
Acompanhando a aprendizagem
Ao final, para realizar uma avaliação, organize os estudantes em grupos e sorteie as funções orgânicas trabalhadas ao longo do capítulo. Oriente-os a pesquisar dois compostos que fazem parte da função orgânica sorteada e a apresentar a fórmula química dessas substâncias, destacando o grupo funcional e suas aplicações. Se possível, peça-lhes que façam as representações em um cartaz e apresentem as informações oralmente para a turma.
Respostas - Páginas 160 e 161
1. a ) BHA: fenol e éter. BHT: fenol. PG: fenol e éster. TBHQ: fenol.
b ) Fenol.
c ) BHA: butil-hidroxianisol. BHT: butil-hidroxitolueno. PG: galato de propila. TBHQ: terc-butil-hidroquinona.
d ) BHA: 2-terc-butil-4-metoxi-1-hidroxibenzeno; BHT: 2,6-di-terc-butil-4-metil-1-hidroxibenzeno; PG: 3,4,5-trihidroxibenzoato de propila; TBHQ: 2-terc-butil-1,4-dihidroxi-benzeno.
e ) Resposta pessoal. Os estudantes podem citar óleo vegetal, manteiga, ketchup, maionese, entre outros.
6. a )
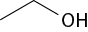
b )
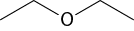
c )
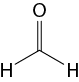
d )
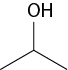
e )
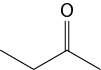
f )
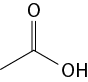
g )
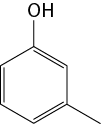
h )
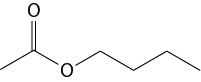
Página 170
6. Nessa atividade, oriente os estudantes a acessar e ler o texto na íntegra. Trata-se de uma oportunidade para agregar mais informações sobre a história dos povos guaranis, que eram nômades. Essa abordagem permite realizar uma integração com o componente curricular de Língua Portuguesa ao trabalhar com lendas.
Retome o que estudou - página 171
Respostas
1. Espera-se que os estudantes respondam que as ligações metálicas são típicas de substâncias formadas por átomos de metais, do mesmo elemento ou de elementos diferentes. Eles podem ainda responder que os metais são bons condutores de eletricidade porque os elétrons de valência do metal conseguem transitar livremente entre os átomos.
2. Espera-se que os estudantes respondam que, na molécula de água abre parênteses H subscrito 2 O fecha parênteses, o átomo de oxigênio abre parênteses O fecha parênteses é mais eletronegativo do que os átomos de hidrogênio abre parênteses H fecha parênteses, por isso ele adquire uma carga parcial negativa, enquanto os átomos de hidrogênio adquirem uma carga parcial positiva. Por conta de sua geometria angular, há um vetor resultante do momento de dipolo, indicado pela seta vermelha para cima, revelando que a molécula toda é polar. Já na molécula de dióxido de carbono, a concentração de elétrons é maior nos átomos de oxigênio (mais eletronegativos do que os átomos de carbono), mas como a molécula tem geometria linear, o vetor resultante do momento de dipolo é nulo, indicando que a substância é apolar.
3. Espera-se que os estudantes respondam que a primeira molécula seria o benzeno abre parênteses C subscrito 6 H subscrito 6 fecha parênteses ou ciclohex-1,3,5-trieno e que a segunda seria o hex-2,4-diino, podendo variar em relação à localização das ligações triplas.
4. Espera-se que os estudantes respondam que, embora tenham a mesma fórmula química, elas apresentam diferentes fórmulas estruturais e são chamadas de isômeros.
Página LIII
Unidade 3 Matéria, energia e as transformações na Terra
Nessa unidade, exploraremos as transformações da matéria e a energia envolvida nos processos. Vamos diferenciar e enfatizar as evidências que emergem de fenômenos físicos e químicos, permitindo uma compreensão mais profunda das dinâmicas que nos cercam.
Além disso, discutiremos o papel da ciência na sociedade, abordando questões culturais e sociais relacionadas à manipulação da matéria e da energia. Essa reflexão crítica é fundamental para entender não apenas os processos científicos, mas também suas implicações éticas e sociais.
Objetivos da unidade
- Diferenciar transformações físicas e transformações químicas da matéria.
- Conhecer as leis ponderais e aplicá-las ao estudo das transformações da matéria.
- Compreender a importância dos ciclos biogeoquímicos para a ciclagem da matéria e como eles ocorrem no ambiente.
- Investigar a proporção de matéria entre os reagentes e os produtos de uma reação química.
- Conceituar entalpia e analisar sua variação em uma reação química.
- Compreender e aplicar a lei de Hess.
Justificativas
Com o intuito de fornecer à turma embasamento teórico para o estudo do ciclo hidrológico e, na próxima unidade, dos ciclos biogeoquímicos, essa unidade aborda as transformações físicas e químicas da matéria, assim como seus estados de agregação, contribuindo para desenvolver a habilidade EM13CNT105.
Abertura da unidade - páginas 176 e 177
BNCC em contexto
A problematização dos fenômenos físicos e químicos observados no lançamento de um foguete se alinha com as competências gerais e específicas da BNCC de Ciências da Natureza para o Ensino Médio, abrangendo o conhecimento científico, o pensamento crítico e a argumentação baseada em evidências. As habilidades EM13CNT101, EM13CNT301 e EM13CNT307 são particularmente relevantes, pois envolvem a análise de transformações e conservações de energia e matéria, a construção de hipóteses e modelos explicativos e a avaliação das propriedades dos materiais em aplicações tecnológicas.
Respostas
a ) Resposta pessoal. O objetivo dessa questão é levantar o conhecimento prévio dos estudantes sobre as transformações químicas. Espera-se que eles mencionem a presença de fumaça e da chama, que são produtos de transformação do combustível do foguete.
b ) Resposta pessoal. O objetivo dessa questão é levantar o conhecimento prévio dos estudantes sobre a quantidade de matéria e a energia envolvida nas transformações químicas. Espera-se que eles respondam que é possível determinar a quantidade de gás consumido e calor gerado.
c ) Resposta pessoal. Os estudantes podem mencionar que essas missões são responsáveis por colocar satélites em órbita para diversos fins, como funcionamento das redes de telecomunicação e monitoramento do planeta Terra.
Capítulo 10 – Transformações da matéria - páginas 178 a 199
Objetivos do capítulo
- Compreender e diferenciar os estados de agregação da matéria.
- Reconhecer a influência da variação de temperatura e pressão nos estados de agregação da matéria.
- Compreender as variações dos estados de agregação.
- Identificar e diferenciar transformações químicas e transformações físicas.
- Compreender as leis ponderais que regem as reações químicas.
- Calcular a quantidade de materiais envolvida em reações químicas com base nas leis ponderais.
BNCC em contexto
Ao trabalhar com as páginas 178 e 179, discuta com os estudantes e incentive-os a pensar em exemplos práticos de como a evaporação acontece em diferentes temperaturas para diferentes substâncias, em alinhamento com a habilidade EM13CNT202. Em seguida, discuta a influência das atividades humanas, como desmatamento e poluição, sobre o ciclo hidrológico. Promova debates que incentivem a reflexão sobre práticas sustentáveis, abordando a habilidade EM13CNT203.
Peça aos estudantes que analisem dados sobre a disponibilidade de água em sua comunidade ou que relembrem crises hídricas que ocorreram e proponham soluções, o que se conecta à habilidade EM13CNT105. Explore também os impactos das mudanças no ciclo hidrológico sobre a biodiversidade, mostrando como isso afeta espécies e hábitats.
Nas páginas 180 e 181, é estudada a estrutura molecular de diversos materiais de acordo com seu estado de agregação, um conteúdo que servirá de base para diversos conteúdos futuros de Química. São também exploradas algumas propriedades relacionadas ao estado de agregação das moléculas. Esse trabalho contempla a Competência geral 2 e as habilidades EM13CNT101 e EM13CNT307.
Página LIV
Atividade extra
Para iniciar a discussão sobre pressão de vapor, na página 185, sugira o seguinte experimento:
Leve para a sala de aula uma pequena quantidade de álcool comercial e água. Depois, adicione cerca de 5 mililitros do álcool em um vidro de relógio. Faça o mesmo procedimento com a água. Por fim, deixe os dois vidros de relógio lado a lado e solicite aos estudantes que os observem por algum tempo, questionando-os se eles sabem o que pode acontecer.
Após a observação de que o álcool vai evaporar mais rápido, faça os seguintes questionamentos:
1. Por que o álcool evaporou mais rápido?
Resposta: O álcool tem uma pressão de vapor maior do que a água.
2. O fato de o álcool ter uma pressão de vapor maior vai influenciar sua temperatura de ebulição?
Resposta: Sim. A temperatura de ebulição do álcool será menor em relação à água, em razão de sua alta pressão de vapor.
Comportamento anômalo da água - página 190
O conteúdo desse boxe apresenta uma discussão sobre o comportamento anômalo da água. Desenhe na lousa o gelo para mostrar aos estudantes que a água no estado líquido e a água no estado sólido têm densidades diferentes e explique que as moléculas de água se estruturam em uma forma hexagonal, em que há grande espaço não preenchido no cristal. No entanto, esse espaço sem matéria é menor quando a água se torna líquida, aumentando seu volume. Porém, o fator mais importante para suas propriedades anômalas são as ligações de hidrogênio que ocorrem por conta de seus átomos de hidrogênio interagindo com átomos de oxigênio de moléculas vizinhas.
Além do exemplo já apresentado de icebergs e de lagos congelados, ressalte que até mesmo o fato de cubos de gelo flutuarem em um copo com água evidencia sua menor densidade.
Ligado no tema - página 192
O estudo da cerâmica das mulheres indígenas da etnia Baniwa oferece uma oportunidade para compreender as transformações químicas e físicas envolvidas na produção desses objetos artísticos, além de fazer uma integração com o componente curricular de Arte. Desde a escolha da argila até a confecção das peças, as mulheres baniwa utilizam processos físicos, como a mistura e a moldagem, que preparam o material para a queima. Essas etapas iniciais são fundamentais para garantir a plasticidade e a homogeneidade da argila, permitindo a criação de formas e designs variados.
Ao abordar pigmentos das cerâmicas, exploram-se a química dos corantes e suas transformações. A interação entre os pigmentos e o calor é crucial para a produção de cores vibrantes e duráveis. Assim, o estudo da cerâmica indígena está vinculado com o tema contemporâneo transversal Educação para valorização do multiculturalismo nas matrizes históricas e culturais brasileiras, pois enriquece o conhecimento sobre transformações químicas e físicas e valoriza as práticas culturais e tradicionais dos povos Baniwa, promovendo uma reflexão que integra ciência, arte e valorização dos povos originários.
Objetivos
- Identificar as transformações químicas e físicas na produção da cerâmica baniwa.
- Valorizar a cerâmica como expressão cultural e artística das mulheres baniwa.
- Explorar a relação entre conhecimentos científicos e saberes tradicionais da etnia Baniwa.
Orientações
Conduza os estudantes a refletir sobre os processos que ocorrem durante a produção da cerâmica. Exercite com eles a capacidade de identificar as evidências ocorridas durante o processo e como a formação de novos materiais é o ponto principal para a diferenciação dos processos físicos e químicos.
Respostas
a ) Sim, o texto descreve o processo de oxidação do pigmento das cerâmicas baniwa, que causa a mudança de cor.
b ) Sim, a transformação física mencionada é a moldagem da argila para formar as peças de cerâmica e depois na secagem, quando ocorre a evaporação da água.
c ) A Ciência, particularmente a Química, está integrada por meio do uso de processos químicos como a oxidação de pigmentos e a moldagem e queima da argila, demonstrando um conhecimento empírico dos materiais e suas transformações.
BNCC em contexto
Nas páginas 195 a 198, a história da Ciência é abordada com base no estudo das leis ponderais. O trabalho com o desenvolvimento da Ciência ao longo do tempo contempla as Competências gerais 1 e 2 e as habilidades EM13CNT101, EM13CNT205 e EM13CNT301.
Acompanhando a aprendizagem
Ao final desse capítulo, solicite aos estudantes que identifiquem e classifiquem cinco fenômenos do cotidiano como transformações físicas ou químicas. Para cada fenômeno, eles devem explicar brevemente por que o classificaram dessa forma, citando as evidências observáveis que os levaram a essa conclusão. Exemplos podem incluir o derretimento do gelo, a ferrugem em um prego, a evaporação da água, a queima de uma vela ou o cozimento de um ovo.
Respostas - Página 182
1. a ) As plantas liberam vapor de água na atmosfera terrestre principalmente por meio da respiração e da transpiração. Além disso, promovem a movimentação da água do subsolo para a atmosfera ao absorvê-la por meio de suas raízes.
b ) O objetivo dessa questão é levar os estudantes a refletir sobre a importância das florestas. Espera-se que eles comentem que as florestas liberam grande quantidade de vapor de água na atmosfera terrestre. Depois, em condições específicas, precipita-se como chuva. O desmatamento prejudica a liberação de vapor de água na atmosfera e, consequentemente, o abastecimento das cidades.
Página LV
c ) O objetivo dessa questão é levar os estudantes a divulgar as informações entre os demais membros da comunidade escolar e familiares.
2. Em A, o picolé, que se encontrava inteiramente no estado sólido, tinha suas moléculas muito próximas, de forma organizada e com pouca mobilidade, mantendo seu formato. Em B, à temperatura ambiente, que é superior à do picolé, partes das moléculas começaram a se agitar e a se afastar umas das outras, aumentando sua mobilidade e tornando parte do picolé líquido. Em C, a agitação e a mobilidade das moléculas atingem a quase totalidade do picolé, levando-o a se transformar quase totalmente em líquido. Esse estado de agregação possibilita às moléculas que escorram na superfície, perdendo sua forma definida.
Respostas - Páginas 193 e 194
1. a ) Espera-se que os estudantes respondam que a energia da matéria, nesse caso, da água, aumentou ao longo do experimento. Isso porque parte da radiação infravermelha foi absorvida pelos átomos constituintes. Como resultado, esses átomos se tornaram cada vez mais agitados, enfraquecendo as interações entre as moléculas e aumentando sua mobilidade. A maior energia e agitação das moléculas levou à alteração da estrutura da matéria, fazendo-a mudar de estado de agregação sólido para o líquido.
b ) Espera-se que os estudantes respondam que a matéria vai continuar absorvendo energia, resultando na agitação crescente de suas moléculas, o que, em determinado momento, levará à evaporação dela.
c ) Espera-se que os estudantes respondam que, uma vez que a temperatura mede o grau de agitação das moléculas que constituem a matéria, à medida que ela recebe energia e seus componentes se tornam mais agitados, a temperatura também aumenta.
d ) À medida que a água sólida se transforma em água líquida e gasosa, ela fica disponível no ambiente, mais especificamente na atmosfera terrestre. Em condições específicas, esse vapor pode retornar ao estado líquido ou gasoso, e assim sucessivamente.
2. Ocorrerá evaporação em A e ebulição em B. Isso porque em A o aquecimento está ocorrendo principalmente na superfície do líquido para que a transformação da matéria ocorra de modo mais lento e gradual, sem a formação de bolhas. Já em B, o aquecimento percorre toda a matéria – a água aquecida no fundo do recipiente se torna menos densa e se move para a parte superior. Além disso, a intensidade da energia fornecida à água em B é maior e ocorre de modo mais rápido, sendo geralmente associada à formação de bolhas.
3. Isso ocorreu porque o ar expirado pela jovem contém vapor de água e está a uma temperatura superior à superfície do espelho. Ao entrar em contato com essa superfície, cuja temperatura é inferior à do ar expirado, a água antes gasosa passou para a fase líquida, formando gotículas que embaçaram a superfície.
4. a ) Espera-se que os estudantes respondam que não, pois em A ocorreu uma transformação física que resultou na mudança da estrutura da casca e do formato do conteúdo do ovo. Já em B, houve alteração na coloração, na textura e no sabor dos ovos, evidenciando uma transformação química.
b ) Na situação A, é o impacto e abertura do ovo. Na situação B, o calor.
5. a ) Mar Morto:
T é igual a 100 menos 3 vírgula 24 vezes 'h' implica em T é igual a 100 menos 3 vírgula 24 vezes abre parênteses menos 0 vírgula 43 fecha parênteses implica em
implica em T é aproximadamente igual a 101 vírgula 39 portanto T é aproximadamente igual a 101 vírgula 39 graus Celsius
Rio de Janeiro: localidades ao nível do mar apresentam temperatura de ebulição de 100 graus Celsius. Também aplicando na equação, obtemos o mesmo resultado:
T é igual a 100 menos 3 vírgula 24 vezes 'h' implica em T é igual a 100 menos 3 vírgula 24 vezes abre parênteses 0 fecha parênteses
portanto T é igual a 100 graus Celsius
Brasília:
T é igual a 100 menos 3 vírgula 24 vezes 'h' implica em T é igual a 100 menos 3 vírgula 24 vezes abre parênteses 1 vírgula 1 fecha parênteses implica em
implica em T é aproximadamente igual a 96 vírgula 44 portanto T é aproximadamente igual a 96 vírgula 44 graus Celsius
La Paz:
T é igual a 100 menos 3 vírgula 24 vezes 'h' implica em T é igual a 100 menos 3 vírgula 24 vezes abre parênteses 3 vírgula 6 fecha parênteses implica em
implica em T é aproximadamente igual a 88 vírgula 34 portanto T é aproximadamente igual a 88 vírgula 34 graus Celsius
Monte Everest:
T é igual a 100 menos 3 vírgula 24 vezes 'h' implica em T é igual a 100 menos 3 vírgula 24 vezes abre parênteses 8 vírgula 85 fecha parênteses implica em
implica em T é aproximadamente igual a 71 vírgula 32 portanto T é aproximadamente igual a 71 vírgula 32 graus Celsius
b ) Resposta pessoal. A resposta depende da altitude do município em questão. Oriente os estudantes a realizar uma pesquisa para identificar a altitude em que se encontra o município.
10. a ) O gelo flutua porque é menos denso do que a água líquida. Isso cria uma camada isolante que permite que a água abaixo mantenha uma temperatura adequada, protegendo os organismos aquáticos durante o inverno.
b ) Sem o comportamento anômalo: se a água não tivesse esse comportamento, o gelo afundaria, o que faria todo o lago congelar. Isso poderia resultar na morte de peixes e outras formas de vida aquática, desestabilizando os ecossistemas e afetando a biodiversidade.
Respostas - Página 199
1. Primeiro, deve-se escrever a equação química balanceada para esta reação:
C mais O subscrito 2 seta para a direita C O subscrito 2
No experimento A, temos: 12 gramas de C mais 32 gramas de O subscrito 2 resultando em X g de C O subscrito 2. Pela lei da conservação da massa, a massa dos reagentes deve ser igual à massa dos produtos. Então:
12 gramas mais 32 gramas é igual a X grama portanto X é igual a 44 gramas de C O subscrito 2
Agora que sabemos as massas de todas as substâncias no experimento A, podemos usar essa informação para encontrar Y e Z no experimento B. No experimento B, temos 88 gramas de C O subscrito 2. Estabelecendo uma proporção com o experimento A:
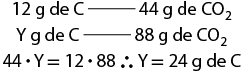
Página LVI
Similarmente para o oxigênio:
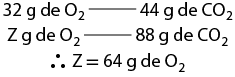
Capítulo 11 − Soluções e propriedades coligativas - páginas 200 a 231
Objetivos do capítulo
- Compreender o conceito de concentração.
- Conhecer as etapas de preparação de uma solução.
- Calcular diferentes tipos de concentração: em massa, porcentagem em massa de soluto, título em massa, partes por milhão e partes por bilhão, em quantidade de matéria, em molalidade e de íons em molaridade.
- Compreender o que é fração em quantidade de matéria.
- Relacionar algumas concentrações de soluções.
- Compreender o conceito de diluição.
- Conhecer as etapas de uma diluição.
- Desenvolver cálculos de concentração de soluções envolvendo diluições.
BNCC em contexto
A abordagem das páginas 200 e 201 contribui para o desenvolvimento da Competência específica de Ciências da Natureza e suas Tecnologias 3 e da habilidade EM13CNT301, pois os estudantes analisam uma situação do cotidiano em que a concentração de substâncias solubilizadas em água pode ser comparada, elaborando hipóteses para explicar as diferenças entre elas. Além disso, eles conhecem como instrumentos são utilizados no preparo de soluções em um ambiente de laboratório.
Explore as fotografias da página 200 para comparar as diferentes concentrações ou mostre essa diluição na sala de aula. Você pode usar uma xícara com metade de sua capacidade com café bem concentrado e pedir aos estudantes que observem os aspectos dessa solução. Em seguida, complete o restante da capacidade da xícara com água morna, para que o referido café se torne mais diluído, e solicite a eles que observem seu aspecto. O café mais concentrado é o que tem uma coloração mais intensa.
Como se deve preparar uma solução com soluto sólido - página 201
Explore as ilustrações do boxe, na página 201, para explicar o processo de preparação de soluções em laboratório. Caso haja à sua disposição os materiais necessários para preparo de uma solução, realize com os estudantes as etapas do procedimento apresentado nas ilustrações, demonstrando detalhadamente cada uma delas. Para exemplificar o processo, não é necessário o uso de uma balança de alta precisão.
A partir da página 201, o texto aborda os tipos de concentração e como calculá-los. É importante que os estudantes compreendam que um cálculo de concentração representa uma relação de quantidade entre soluto e solvente. Por exemplo, na concentração em massa, também conhecida como concentração comum, a relação está entre a massa de soluto e o volume da solução. Essa relação é expressa na unidade. Informe-lhes que, quando afirmamos que determinada solução tem concentração de 2 gramas por mililitro, estamos dizendo que a cada 1 mililitro de solução há 2 gramas de soluto.
BNCC em contexto
Nas páginas 202 e 203, o trabalho com as diferentes formas de apresentar a concentração das soluções e as equações utilizadas em suas determinações colabora para desenvolver a habilidade EM13CNT303, que aborda a análise de dados e a interpretação de informações em contextos científicos, permitindo aos estudantes que explorem como diferentes unidades de medida, como molaridade e porcentagem, influenciam a compreensão das propriedades das soluções. Essa habilidade é importante não só para aplicações práticas em laboratórios, mas também em situações do cotidiano, como na manipulação de produtos químicos em diferentes contextos.
Enfatize aos estudantes que a porcentagem em massa apresentada nas páginas 202 e 203 é uma relação adimensional, pois as unidades de soluto e solução são as mesmas. Explique-lhes que o cancelamento da unidade simplesmente representa uma divisão das unidades: grama dividido por grama é igual a 1.
Assim como se sugere nas páginas 204 e 205, resolva os exemplos de diferentes formas: expressão numérica e por regra de três. É importante demonstrar aos estudantes que não há apenas uma única forma de resolver os problemas e alcançar o resultado.
Integrando o conhecimento
Na página 209, ao abordar fração em quantidade de matéria, é possível estabelecer uma relação com Matemática. A fração em quantidade de matéria, a rigor, é a mesma trabalhada nesse componente curricular, em que se divide uma parte pelo todo. No caso das soluções, pode-se calcular a fração em termos de soluto ou de solvente. De forma análoga, o denominador será sempre o número de mol da solução (representando o todo). Se a concentração for em termos do soluto, o numerador será o número de mol do soluto. Se for em termos do solvente, o numerador será o número de mol do solvente.
Na página 210, explore as demonstrações das relações entre os tipos de concentração, desenvolvendo com os estudantes os cálculos na lousa.
Ao abordar as propriedades coligativas, diga aos estudantes que podemos percebê-las em algumas situações do cotidiano. Usando os exemplos iniciais da página 217 (a água com sal no congelador e a adição de sal na água fervendo), faça um levantamento inicial de concepções prévias, levando-os a refletir sobre esses fenômenos.
Comente com os estudantes que as propriedades coligativas dependem da quantidade de soluto, pois ocorre um impedimento físico na movimentação das moléculas. Isso significa que, por exemplo, quando a água entra em ebulição e adicionamos sal abre parênteses N a C l fecha parênteses, os íons disponíveis (N a sobrescrito mais e C l elevado a início expoente, menos, fim expoente) impedem as moléculas de água de se "desprenderem" umas das outras, havendo uma diminuição da energia cinética delas.
Página LVII
É possível trabalhar o tema osmose de maneira interativa, dialogando com o meio digital e com as culturas juvenis ao acessar com os estudantes o simulador de osmose disponível em: https://s.livro.pro/o8j15r. Acesso em: 27 set. 2024. Explore a hipermídia com eles, para que visualizem uma representação do processo de osmose.
Osmose nos vegetais - página 226
Esse boxe permite fazer uma relação com o componente curricular de Biologia. Comente a respeito da importância da osmose nos organismos vivos. Graças a esse processo, os nutrientes são transportados para as células e os resíduos são removidos. A pressão dentro e fora de cada célula é equilibrada por conta da osmose, que controla a passagem de líquidos do meio interno para o externo.
Propriedades coligativas na alimentação - página 228
Faça uma leitura coletiva desse boxe com os estudantes, especificamente sobre a cocção de alimentos na panela de pressão. Proponha a eles que respondam quais propriedades coligativas estão envolvidas no funcionamento dessa panela e verifique se identificam a tonoscopia e a ebulioscopia.
Acompanhando a aprendizagem
Ao final do estudo desse capítulo, solicite aos estudantes que elaborem um resumo de no máximo 200 palavras sobre os conceitos principais relacionados à concentração de soluções. Essa atividade permitirá a eles consolidar o aprendizado ao destacar palavras-chave como molaridade, molalidade e porcentagem em massa, além de praticar a síntese de informações.
Respostas - Página 208
1. a )'C' é igual a início de fração, numerador: 'm' subscrito 1, denominador: V, fim de fração é igual a início de fração, numerador: 205 gramas, denominador: 500 mililitros, fim de fração é igual a 0 vírgula 41 grama por mililitro
b )'C' é igual a início de fração, numerador: 0 vírgula 41 grama, denominador: mililitro, fim de fração vezes início de fração, numerador: 1.000 mililitros, denominador: litro, fim de fração é igual a 410 gramas por litro
c )d é igual a 'm' sobre V é igual a início de fração, numerador: abre parênteses 205 mais 430 vírgula 5 fecha parênteses grama, denominador: 500 mililitros , fim de fração é igual a 1 vírgula 271 grama por mililitro
d )d é igual a 1 vírgula 271 grama por mililitro vezes 1.000 mililitros por litro é igual a 1.271 gramas por litro
2.'m' subscrito N a O H é igual a início de fração, numerador: 40 gramas, denominador: 1 mol, fim de fração vezes início de fração, numerador: 3 vírgula 2 mol, denominador: 1 litro, fim de fração vezes 0 vírgula 9 litro é igual a 115 vírgula 2 gramas de N a O H
4. a )tau é igual a início de fração, numerador: 'm' subscrito 1, denominador: 'm' subscrito 2 mais 'm' subscrito 1, fim de fração é igual a início de fração, numerador: 50, denominador: 50 mais 950, fim de fração é igual a 0 vírgula 0 5
b )por cento 'm' barra 'm' é igual a 100 vezes início de fração, numerador: 'm' subscrito 1, denominador: 'm' subscrito 2 mais 'm' subscrito 1, fim de fração é igual a 100 vezes 0 vírgula 0 5 é igual a 5 por cento de soluto
c )100 por cento menos 5 por cento é igual a 95 por cento de solvente
6. a )p p m de N a é igual a início de fração, numerador: 1 vírgula 5 grama vezes 10 elevado a 6 grama, denominador: 100 gramas, fim de fração é igual a 15.000 p p m
b )'m' subscrito N a é igual a início de fração, numerador: 1.500 miligramas , denominador: 100 gramas, fim de fração vezes 30 gramas é igual a 450 miligramas
Respostas - Página 216
1.n início subscrito, C a C l subscrito 2, fim subscrito é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração é igual a início de fração, numerador: 36 vírgula 10 gramas, denominador: 111 gramas por mol, fim de fração é igual a 0 vírgula 325 mol
n início subscrito, H subscrito 2 O, fim subscrito é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração é igual a início de fração, numerador: 42 vírgula 75 gramas, denominador: 18 gramas por mol, fim de fração é igual a 2 vírgula 375 mol
n é igual a n subscrito 1 mais n subscrito 2 é igual a abre parênteses 0 vírgula 325 mais 2 vírgula 375 fecha parênteses mol é igual a 2 vírgula 7 mol abre parênteses solução fecha parênteses
A fração do soluto será:
x subscrito 1 é igual a início de fração, numerador: n subscrito 1, denominador: n, fim de fração é igual a início de fração, numerador: 0 vírgula 325, denominador: 2 vírgula 7, fim de fração é igual a 0 vírgula 12
2. Quantidades de matéria das soluções:
'C' é igual a início de fração, numerador: n subscrito 1, denominador: V subscrito 1, fim de fração implica em n subscrito 1 é igual a 0 vírgula 20 mol por litro vezes 0 vírgula 150 litro é igual a 0 vírgula 0 3 mol
'C' é igual a início de fração, numerador: n subscrito 2, denominador: V subscrito 2, fim de fração implica em n subscrito 2 é igual a 0 vírgula 50 mol por litro vezes 0 vírgula 450 litro é igual a 0 vírgula 225 mol
Na solução final, haverá n subscrito 1 mais n subscrito 2 é igual a 0 vírgula 255 mol de soluto, em um volume de 600 mililitros. Logo:
'C' subscrito f é igual a início de fração, numerador: n subscrito 1, denominador: V subscrito 1, fim de fração é igual a início de fração, numerador: 0 vírgula 255 mol, denominador: 0 vírgula 6 litro, fim de fração implica em 'C' subscrito f é igual a 0 vírgula 425 mol por litro
3.'C' subscrito f vezes V subscrito f é igual a 'C' subscrito I vezes V subscrito I mais 'C' subscrito I I vezes V subscrito I I implica em
implica em 'C' subscrito f é igual a início de fração, numerador: 160 vezes 200 mais 40 vezes 100, denominador: 300, fim de fração é igual a 120 portanto 'C' subscrito f é igual a 120 gramas por litro
c subscrito f vezes 0 vírgula 3 é igual a início de fração, numerador: 4 vírgula 0 vezes 0 vírgula 2 mais 1 vírgula 0 vezes 0 vírgula 1, denominador: 0 vírgula 3, fim de fração é igual a 3 portanto c subscrito f é igual a 3 mol por litro
4.x subscrito água é igual a início de fração, numerador: n subscrito 1, denominador: n subscrito 1 mais n subscrito 2, fim de fração é igual a início de fração, numerador: 40, denominador: 40 mais 10, fim de fração é igual a 0 vírgula 8
x subscrito água mais x subscrito álcool é igual a 1 implica em 0 vírgula 8 mais x subscrito álcool é igual a 1 implica em x subscrito álcool é igual a 0 vírgula 2
5. Massa de C a C l subscrito 2 da solução X:
'm' é igual a 60 gramas por litro vezes 0 vírgula 2 litro é igual a 12 gramas
Massa de C a C l subscrito 2 da solução Z:
'm' é igual a 80 gramas por litro vezes 0 vírgula 6 litro é igual a 48 gramas
Portanto, a massa de C a C l subscrito 2 acrescentada pela solução Y é de 48 gramas menos 12 gramas é igual a 36 gramas e sua concentração é 36 gramas por 0 vírgula 4 litro é igual a 90 gramas por litro.
Respostas - Páginas 229 a 231
1. a ) Com o aquecimento nas condições físicas apresentadas, a água do béquer 1 entrará primeiro em ebulição por ter temperatura de ebulição menor que a do líquido em solução (béquer 2). Isso ocorrerá porque no béquer 2 houve a dissolução de um soluto não volátil, assim a sua temperatura de ebulição será maior que a da água do béquer 1.
b ) Com o resfriamento das amostras líquidas contidas nos dois béqueres, submetidas às condições físicas apresentadas, o béquer 1, que tem apenas água, vai congelar primeiro. O líquido do béquer 2 congelará a uma temperatura menor que a do béquer 1.
Página LVIII
c ) As propriedades coligativas relatadas nesses itens são a ebulioscopia e a crioscopia.
2. a ) Quando a salmoura é colocada em contato com o gelo, essa mistura não se solidifica, mas fica mais fria do que o gelo. Assim, a salmoura fica tão fria que consegue congelar rapidamente o sorvete.
b ) Esse experimento evidencia a propriedade coligativa denominada crioscopia.
4. Resposta pessoal. Espera-se que os estudantes pesquisem a respeito da hemodiálise e a relacionem com a osmose, pois esse procedimento utiliza água altamente pura, obtida por meio desse processo.
5. a ) Por meio da indicação "(aq)" no rótulo, é possível concluir que se trata de uma solução de H N O subscrito 3 em água, e não de uma substância pura.
b ) A indicação "(aq)" se refere ao solvente, que é a água, e a fórmula H N O subscrito 3 se refere ao soluto, que é o ácido nítrico.
c ) De acordo com a densidade da solução, em cada 1 centímetro cúbico há 1 vírgula 51 grama de solução. Assim, em 1 vírgula 0 litro abre parênteses 1.000 centímetros cúbicos fecha parênteses há 1.510 gramas de solução, ou seja, 1 vírgula 51 quilograma.
d ) De acordo com a concentração no rótulo, para cada 1 litro de solução há 220 gramas de soluto.
10. Alternativa d.
n subscrito glicose é igual a início de fração, numerador: 6 gramas, denominador: 180 gramas por mol, fim de fração é aproximadamente igual a 3 vírgula 3 vezes 10 elevado a menos 2 mol
'C' subscrito glicose é igual a início de fração, numerador: 3 vírgula 3 vezes 10 elevado a menos 2 mol, denominador: 0 vírgula 5 litro, fim de fração é aproximadamente igual a 6 vírgula 6 vezes 10 elevado a menos 2 mol por L
n subscrito sódio é igual a início de fração, numerador: 0 vírgula 11 grama, denominador: 23 gramas barra mol, fim de fração é aproximadamente igual a 4 vírgula 8 vezes 10 elevado a menos 3 mol
'C' subscrito sódio é igual a início de fração, numerador: 4 vírgula 8 vezes 10 elevado a menos 3 mol, denominador: 0 vírgula 5 litro, fim de fração é aproximadamente igual a 9 vírgula 6 vezes 10 elevado a menos 3 mol por litro
11. Espera-se que os estudantes representem as partículas de glicerina entre as partículas de água, explicando que a adição de glicerina, um soluto não volátil, diminui a pressão de vapor da solução água-glicerina e eleva sua temperatura de ebulição acima de 100 graus Celsius. Enquanto a água pura entra em ebulição a 100 graus Celsius, a mistura água-glicerina e a glicerina pura não atingem a ebulição nessa temperatura, pois a presença das partículas do soluto não volátil dificulta a ebulição do solvente.
12. Espera-se que os estudantes respondam que o cozimento em panela de pressão é mais rápido porque, sob maior pressão, a temperatura de ebulição da água aumenta, cozinhando os alimentos em tempo menor do que o gasto em panelas comuns, que estão submetidas à pressão ambiente.
13. a )V é igual a início de fração, numerador: 630 gramas vezes 1 litro, denominador: 50 gramas, fim de fração é igual a 12 vírgula 6 litros
b )c é igual a início de fração, numerador: início de fração, numerador: 630 gramas, denominador: 58 vírgula 44 gramas por mol, fim de fração, denominador: 12 vírgula 6 litros, fim de fração é aproximadamente igual a 0 vírgula 86 mol por litro
c )'C' é igual a início de fração, numerador: 630 gramas, denominador: 12 vírgula 6 litros, fim de fração é igual a 50 gramas por litro
d )c subscrito i vezes V subscrito i é igual a c subscrito f vezes V subscrito f
0 vírgula 86 mol por litro vezes 12 vírgula 6 litros é igual a 0 vírgula 5 mol por litro vezes V subscrito f implica em V subscrito f é aproximadamente igual a 21 vírgula 67 litros
V subscrito adicionado é igual a V subscrito f menos V subscrito i é igual a 21 vírgula 7 litros menos 12 vírgula 6 litros é aproximadamente igual a 9 vírgula 1 litros
14. a )70 mililitros vezes abre parênteses início de fração, numerador: 30 por cento, denominador: 100 por cento, fim de fração fecha parênteses é igual a 21 mililitros
b )abre parênteses início de fração, numerador: 2 vírgula 6 mililitros , denominador: 50 mililitros , fim de fração fecha parênteses vezes 100 por cento é igual a 5 vírgula 2 por cento. Portanto, o produto é o Eau de Toilette, que está na faixa de 5 a 15%.
15.início de fração, numerador: 19 gramas, denominador: mol, fim de fração vezes início de fração, numerador: 5 vírgula 0 vezes 10 elevado a menos 5 mol, denominador: litro, fim de fração vezes 3 litros é igual a 0 vírgula 0 0 285 grama ou 2 vírgula 85 miligramas
17.início de fração, numerador: 2 gramas de F vezes 1.000 gramas de amostra, denominador: 10 elevado a 6 gramas de amostra, fim de fração é igual a 2 vezes 10 elevado a menos 3 grama de F
início de fração, numerador: 2 vezes 10 elevado a menos 3 grama de F, denominador: 1.000 gramas de amostra, fim de fração vezes início de fração, numerador: 1.000 gramas de amostra, denominador: 1 litro de amostra, fim de fração é igual a início de fração, numerador: 2 vezes 10 elevado a menos 3 grama de F, denominador: litro de amostra, fim de fração
portanto início de fração, numerador: 2 miligramas de F, denominador: L de amostra, fim de fração
18. Espera-se que os estudantes façam representações diferentes das células vegetais em diferentes soluções. Em uma solução hipotônica, a célula vegetal se apresenta túrgida por conta da absorção de água, com o vacúolo expandido. Na solução isotônica, a célula mantém seu tamanho normal, com equilíbrio na entrada e na saída de água. Já na solução hipertônica, perde água, o vacúolo encolhe e a célula murcha. Além disso, os estudantes devem pesquisar como esses processos ocorrem na natureza, discutindo as consequências para a planta, como a importância da turgescência para o suporte estrutural e os efeitos negativos do murchamento em condições de seca.
Capítulo 12 - Quantidade e proporção de matéria - páginas 232 a 246
Objetivos do capítulo
- Compreender e aplicar cálculos estequiométricos, conceitos de mol e massa molar.
- Balancear equações químicas.
- Compreender o conceito de volume molar e realizar cálculos estequiométricos envolvendo substâncias gasosas.
- Compreender os conceitos e calcular a pureza de reagente, rendimento da reação e reagentes em excesso.
BNCC em contexto
A abordagem das páginas 232 e 233 contribui para o desenvolvimento da habilidade EM13CNT101, pois permite aos estudantes analisar e representar as transformações e conservações em sistemas que envolvem quantidade de matéria, relacionando-as com situações do dia a dia.
O balanceamento das equações químicas, iniciado na página 233, contribui para desenvolver o pensamento computacional. Em cada atividade relacionada a esse assunto, incentive os estudantes a decompor os procedimentos em etapas, procurando identificar as semelhanças entre os exemplos.
Página LIX
Compartilhe ideias - página 233
O boxe Compartilhe ideias e a questão da página 233 têm por objetivo incentivar os estudantes a refletir sobre a possibilidade de produzir água a partir da reação representada e propor medidas que contribuam com o uso consciente desse recurso. Organize a turma em duplas e oriente-as a pesquisar em fontes confiáveis e a conversar a respeito disso.
BNCC em contexto
A abordagem das páginas 238 e 239 contribui para o desenvolvimento da habilidade EM13CNT101, pois incentiva os estudantes a analisar e representar as transformações e conservações em sistemas que envolvem quantidade de matéria, relacionando-as com as situações cotidianas. Também contribui para o desenvolvimento da habilidade EM13CNT105, pois possibilita aos estudantes retomar os ciclos biogeoquímicos, nesse caso, o ciclo do nitrogênio, bem como analisar a interferência humana sobre esse ciclo.
Atividade extra
Se julgar interessante, ao iniciar a abordagem sobre o excesso de reagente, na página 239, proponha a questão a seguir para os estudantes.
1. Uma lanchonete prepara cada misto-quente com os seguintes ingredientes: duas fatias de pão de fôrma, uma fatia de presunto e uma fatia de queijo. Antes de iniciar a produção de sanduíches em certo dia, o gerente da lanchonete verificou a quantidade de ingredientes disponíveis: 70 fatias de pão de fôrma, 27 fatias de presunto e 18 fatias de queijo. Utilize a equação a seguir e responda às questões.
2 fatias de pão mais 1 fatia de presunto mais 1 fatia de queijo é igual a 1 misto menos quente
a ) Qual ingrediente limitou a produção dos mistos-quentes?
Resposta: Espera-se que os estudantes percebam que a quantidade de fatias de queijo limita a produção de mistos-quentes.
b ) Quais ingredientes sobraram?
Como serão utilizadas 36 fatias de pão e 18 fatias de presunto, sobraram 34 fatias de pão e 9 fatias de presunto.
Compartilhe ideias - páginas 240 e 241
A abordagem do boxe Compartilhe ideias da página 240 favorece o trabalho com o tema contemporâneo transversal Ciência e tecnologia, pois apresenta aos estudantes a possibilidade do uso de células de hidrogênio para obter energia elétrica, além de permitir o trabalho com a Competência geral 9.
O boxe Compartilhe ideias da página 241 tem como objetivo levar os estudantes a compreender a importância do uso de materiais que apresentam alto grau de pureza para a fabricação de medicamentos. Solicite a eles que formem duplas para realizar a atividade e os oriente a anotar a que conclusão chegaram. Peça a algumas duplas que, voluntariamente, leiam suas respostas para os colegas.
Conexões com… - página 242
Objetivos
- Compreender as interconexões entre Ciência, política e sociedade, utilizando a história de Haber como exemplo.
- Desenvolver uma visão crítica sobre as aplicações da Química na agricultura e na indústria bélica.
Orientações
Para a condução da atividade, leia com os estudantes o texto e fale sobre a trajetória do químico alemão Fritz Haber (1868-1934), enfatizando tanto suas contribuições para a Química quanto as questões éticas relacionadas ao seu trabalho.
Se julgar oportuno, promova uma discussão em grupo, incentivando os estudantes a compartilhar suas impressões sobre as dualidades da Ciência.
O trabalho com esses assuntos desenvolve a Competência geral 1 e a habilidade EM13CNT305, pois conhecer e discutir essas histórias possibilita refletir sobre a responsabilidade dos cientistas em suas descobertas e aplicações. Discutir suas contribuições em sala de aula promove um aprendizado interdisciplinar com o componente curricular de História, permitindo aos estudantes que explorem não apenas os aspectos científicos, mas também as repercussões históricas, sociais e éticas de descobertas e inovações.
Respostas
a ) Espera-se que os estudantes comentem que a Ciência é um produto humano, portanto seu uso está diretamente ligado à intencionalidade das pessoas. Dessa forma, não podemos dizer que ela é intrinsecamente boa ou ruim, pois isso depende da maneira como será usada.
b ) Espera-se que os estudantes comentem que toda descoberta científica ou tecnológica deve ter seu uso respaldado pela ética e o objetivo final de produzir bem-estar aos seres humanos de forma sustentável para o planeta. Do contrário, podemos ver seu uso ligado a guerras, genocídios e destruição do meio ambiente, como foi o caso da história de Haber.
c ) As descobertas científicas e tecnológicas estão diretamente associadas às necessidades da sociedade da época em que foram criadas. Por exemplo, no início do século XX, a necessidade de aumentar a produção agrícola impulsionou a busca por métodos mais eficientes para produzir amônia. No entanto, essa descoberta também impactou profundamente a sociedade na medida em que propiciou o desenvolvimento de armas químicas.
Prática científica - páginas 244 e 245
Objetivos
- Determinar a massa de dióxido de carbono produzida na prática.
- Analisar e compreender a estequiometria das reações e reagentes limitantes durante uma reação química.
Orientações
Incentive os estudantes a discutir as questões iniciais sugeridas em Por dentro do contexto. Verifique se eles compreenderam o conceito de conservação da massa durante uma reação química em um sistema fechado. O objetivo de formular a hipótese proposta é levá-los a refletir sobre a importância do desenvolvimento da Ciência em todos os momentos históricos, ou seja, enxergá-la como um processo, e não como uma resolução que acontece da noite para o dia. Os estudantes podem comentar que em indústrias de cosméticos, por exemplo, a medição das quantidades de reagentes está diretamente relacionada à qualidade dos produtos.
Página LX
O funil, a garrafa e o copo medidor devem ser lavados e depois reutilizados. O balão pode ser descartado no lixo doméstico e os resíduos líquidos na pia.
Respostas
1. Dentro da garrafa, é possível observar o fenômeno da efervescência, isto é, da produção de gás.
2.C H subscrito 3 C O O H abre parênteses a q fecha parênteses mais N a H C O subscrito 3 abre parênteses s fecha parênteses seta para a direita C H subscrito 3 C O O N a abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses
3. Não. Como o sistema se encontra aberto, o gás produzido pela reação escapa para a atmosfera. Por isso, tal valor não é registrado pela balança.
4. O balão se enche de gás.
5. Os valores registrados são os mesmos. Isso acontece porque o gás fica aprisionado pelo balão. Dessa forma, o sistema pode ser considerado fechado, assim as massas se conservam.
6. Considerando a proporção de 1 dois-pontos por 1 de N a H C O subscrito 3 e CO subscrito 2, podemos fazer a seguinte relação:
'm' início subscrito, C O subscrito 2, fim subscrito é igual a início de fração, numerador: 44 gramas, denominador: 84 gramas, fim de fração vezes 5 gramas é aproximadamente igual a 2 vírgula 62 gramas de C O subscrito 2
n início subscrito, C O subscrito 2, fim subscrito é igual a início de fração, numerador: 1 mol, denominador: 44 gramas, fim de fração vezes 2 vírgula 62 gramas é aproximadamente igual a 0 vírgula 0 6 mol de C O subscrito 2
7. Fazendo as considerações do item anterior para 10 gramas.
'm' início subscrito, C O subscrito 2, fim subscrito é igual a início de fração, numerador: 44 gramas, denominador: 84 gramas, fim de fração vezes 10 gramas é aproximadamente igual a 5 vírgula 24 gramas de C O subscrito 2
n início subscrito, C O subscrito 2, fim subscrito é igual a início de fração, numerador: 1 mol, denominador: 44 gramas, fim de fração vezes 5 vírgula 24 gramas é aproximadamente igual a 0 vírgula 12 mol de C O subscrito 2
8. Resposta pessoal. Oriente os estudantes a como produzir e publicar o tipo de recurso a ser desenvolvido. Reforce as principais informações que eles devem apresentar, como imagens dos procedimentos e explicações, e quais devem evitar compartilhar, como fotografias ou detalhes pessoais dos envolvidos.
Acompanhando a aprendizagem
Para finalizar esse capítulo, sugira aos estudantes folhear o próprio livro para escolher uma reação química simples do cotidiano. Depois, peça-lhes que elaborem, em uma folha de papel sulfite, uma questão sobre os assuntos abordados no capítulo, como balanceamento da equação química, relação entre massas etc. Diga a eles que também façam a resposta da questão em outra folha. Em seguida, solicite a todos que troquem as questões com um colega e as resolvam. No final, devolva as questões para quem as elaborou e solicite que sejam corrigidas. Oriente-os a fazer a correção e comparar os resultados obtidos, permitindo-lhes conversar sobre o assunto.
Respostas - Página 236
6. Considere que M início subscrito, C a C O subscrito 3, fim subscrito é igual a 100 gramas por mol, então: n é igual a 1 mol por 100 gramas vezes 450 gramas é igual a 4 vírgula 5 mol. A proporção entre C a C O subscrito 3 e CO subscrito 2 é 1 dois-pontos por 1; logo, 4 vírgula 5 mol de C a C O subscrito 3 produz 4 vírgula 5 mol de CO subscrito 2. O volume molar é 22 vírgula 4 litros. Assim: V é igual a 22 vírgula 4 litros vezes mol elevado a menos 1 vezes 4 vírgula 5 mol é igual a 100 vírgula 8 litros de C O subscrito 2.
Respostas - Página 237
3. a ) Resposta: O vulcanismo é um fenômeno geológico que ocorre quando magma, gases e fumaça são expelidos do interior da Terra para a superfície. Essa é uma oportunidade de integração com o componente curricular de Geografia. Assim, se julgar necessário, peça auxílio ao professor desse componente para que explique aos estudantes diferentes tipos de vulcanismo.
b )S O subscrito 2 é igual a abre parênteses 32 fecha parênteses vezes 1 mais abre parênteses 16 fecha parênteses vezes 2 é igual a 64 unidades
c ) Se a massa molecular do S O subscrito 2 é 64 unidades, sua massa molar é 64 gramas por mol.
d )n é igual a início de fração, numerador: 1 mol, denominador: 64 gramas, fim de fração vezes 256 gramas é igual a 4 mol de S O subscrito 2
e )V é igual a início de fração, numerador: 22 vírgula 4 litros, denominador: 1 mol, fim de fração vezes 4 mol é igual a 89 vírgula 6 litros de S O subscrito 2
6. a ) 2 xícaras de café equivaleriam a 200 miligramas de cafeína; logo, ainda restam 200 miligramas.
'm' subscrito chocolate é igual a início de fração, numerador: 28 gramas de chocolate, denominador: 12 miligramas de cafeína, fim de fração vezes 200 miligramas de cafeína é igual a
é igual a 466 vírgula 66 gramas de chocolate
b )n é igual a início de fração, numerador: 1 mol, denominador: 194 vírgula 19 gramas, fim de fração vezes 0 vírgula 400 grama é igual a 0 vírgula 0 0 2 mol de cafeína
Respostas - Página 246
4.'m' início subscrito, F e subscrito 2 O subscrito 3, fim subscrito é igual a início de fração, numerador: 159 vírgula 7 vezes 10 elevado a menos 6 t F e subscrito 2 O subscrito 3 vezes 280 toneladas F e, denominador: 111 vírgula 7 vezes 10 elevado a menos 6 tonelada F e vezes 0 vírgula 8, fim de fração é igual a 500 toneladas
6. Para 100% de rendimento, a massa seria:
início de fração, numerador: 20 vírgula 27 vezes 10 elevado a 6 g A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 vezes abre parênteses 2 vezes 78 gramas A l abre parênteses O H fecha parênteses subscrito 3 fecha parênteses, denominador: 342 gramas A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3, fim de fração é igual a é igual a 9 vírgula 24 vezes 10 elevado a 6 g A l abre parênteses OH fecha parênteses subscrito 3
Como a massa obtida foi de 4 vírgula 25 toneladas, o rendimento foi de: início de fração, numerador: 4 vírgula 25 vezes 10 elevado a 6 gramas vezes 100 por cento, denominador: 9 vírgula 24 vezes 10 elevado a 6 gramas, fim de fração é aproximadamente igual a 45 por cento.
7. A equação química balanceada é:
C subscrito 2 H subscrito 2 mais 5 barra 2 O subscrito 2 seta para a direita 2 CO subscrito 2 mais H subscrito 2 O
Como a massa molar do etino é 26 gramas por mol, 130 gramas equivalem a 5 mols de etino. De acordo com a equação química balanceada, 1 mol de etino produz 2 mol de CO subscrito 2, assim 5 mol de etino produzem 10 mols de CO subscrito 2, que correspondem a 100%; assim, 80% são 8 mols de CO subscrito 2. Portanto, considerando o volume molar de 22 vírgula 4 litros, o volume de 8 mols é: V é igual a 22 vírgula 4 litros vezes mol elevado a menos 1 vezes 8 mols é igual a 179 vírgula 2 litros de C O subscrito 2.
Capítulo 13 – Termoquímica - páginas 247 a 261
Objetivos do capítulo
- Conceituar entalpia.
- Compreender como a energia está relacionada às reações químicas, diferenciando transformações endotérmicas e transformações exotérmicas.
Página LXI
- Representar variações de energia nas transformações físicas e nas transformações químicas por meio de equações e diagramas.
- Calcular a variação de entalpia de uma reação por meio das entalpias de formação das substâncias envolvidas.
- Calcular a variação de entalpia de uma reação química por meio das energias de ligação dos seus participantes.
- Conhecer a lei de Hess para o cálculo da variação de energia em uma reação química utilizando o método de manipulação algébrica de reações.
BNCC em contexto
A abordagem das páginas 247 e 248 contribui para o desenvolvimento da habilidade EM13CNT105, pois permite relacionar a fotossíntese ao ciclo biogeoquímico do carbono abre parênteses C fecha parênteses e compreender alguns fenômenos naturais.
Ao trabalhar a definição de reação endotérmica na página 247, explique aos estudantes que, nesse tipo de reação, os produtos formados apresentam conteúdo energético maior do que os reagentes. Portanto, para que essa reação ocorra, é necessário obter energia por meio de alguma fonte externa, como o Sol, no caso da fotossíntese.
Compartilhe ideias - página 247
A abordagem proposta no boxe Compartilhe ideias permite trabalhar o tema contemporâneo transversal Educação ambiental, com enfoque nas vantagens e desvantagens do uso da energia solar. A obtenção de energia por meio de fontes renováveis é um tema que será visto ao longo de todo o Ensino Médio. Se achar interessante, organize os estudantes em grupos e peça a eles que elaborem seminários sobre a importância de buscar fontes de energia renovável, visando à redução dos impactos ambientais. Veja mais comentários sobre Seminário nas páginas XI e XII destas Orientações para o professor.
Na página 248, ao abordar a definição de reação exotérmica, explique aos estudantes que, nesse tipo de reação, os produtos formados apresentam conteúdo energético menor do que os reagentes. Portanto, como a ocorrência dessas reações libera energia, a queima de qualquer combustível é uma reação exotérmica.
Organize os estudantes em duplas e peça-lhes que discutam as questões da página 248 usando a metodologia ativa Think-pair-share. Veja mais comentários nas páginas XI e XII destas Orientações para o professor.
Apresente o conceito de entalpia-padrão de formação na página 252, retomando o que são as condições-padrão. Reforce que o valor da entalpia é determinado por meio de um padrão arbitrário, que é considerar que as substâncias puras simples, na forma alotrópica mais estável e nas condições normais de temperatura e pressão, apresentam entalpia igual a zero. O que pode ser medido e calculado com valores não arbitrários são as variações de entalpia abre parênteses delta H fecha parênteses.
Integrando o conhecimento
A abordagem na página 256 sobre a utilização do chert por indígenas no Ártico do Canadá contribui para o trabalho com o tema contemporâneo transversal Diversidade cultural e permite uma integração com os componentes curriculares de História e Geografia. Destaque como as formações rochosas, incluindo o chert, influenciam o uso do solo e a ocupação humana em diversas regiões. Incentive os estudantes a procurar os docentes desses componentes curriculares para desenvolver atividades em que possam pesquisar locais onde o chert é encontrado, relacionando-os às características geográficas da região.
Ao final da explicação sobre a Lei de Hess, na página 257, verifique se os estudantes compreenderam que a Lei de Hess é um método que permite calcular a variação de entalpia de uma reação por meio de reações cujo valor do delta H já é conhecido.
Atividade extra
Calcule a entalpia molar de combustão completa do gás propano abre parênteses C subscrito 3 H subscrito 8 fecha parênteses a 0 grau Celsius e 1 a t m. Para isso, utilize os seguintes dados de entalpia molar: C O subscrito 2 abre parênteses g fecha parênteses abre parênteses menos 394 quilojoules por mol fecha parênteses; H subscrito 2 O abre parênteses l fecha parênteses abre parênteses menos 286 quilojoules por mol fecha parênteses; C subscrito 3 H subscrito 8 abre parênteses g fecha parênteses abre parênteses menos 100 quilojoules barra mol fecha parênteses. Explique aos estudantes que a entalpia molar de uma substância é numericamente igual à sua entalpia de formação.
Resposta
A equação de combustão completa do gás propano é dada por: C subscrito 3 H subscrito 8 abre parênteses grama fecha parênteses mais 5 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 3 C O subscrito 2 abre parênteses g fecha parênteses mais 4 H subscrito 2 O abre parênteses l fecha parênteses.
Com os dados da entalpia de formação dos participantes, pode-se usar a relação:
delta H subscrito reação grau é igual a ∑ n delta H subscrito f grau abre parênteses produtos fecha parênteses menos ∑ n delta H subscrito f grau abre parênteses reagentes fecha parênteses
Assim, considerando a equação da reação, tem-se:
∑ n delta H subscrito f grau abre parênteses reagentes fecha parênteses é igual a 1 vezes abre parênteses menos 100 fecha parênteses mais 5 vezes abre parênteses 0 fecha parênteses é igual a menos 100
∑ n delta H subscrito f grau abre parênteses produtos fecha parênteses é igual a 3 vezes abre parênteses menos 394 fecha parênteses mais 4 vezes abre parênteses menos 286 fecha parênteses é igual a menos 2.326
Aplicando os somatórios na equação:
delta H subscrito reação grau é igual a menos 2.326 menos abre parênteses menos 100 fecha parênteses é igual a menos 2.226
portanto delta H subscrito reação grau é igual a menos 2.226 quilojoules por mol
Ligado no tema - página 258
Objetivos
- Compreender a relação entre o impacto da caça às baleias e a economia do século XIX.
- Identificar conexões entre o contexto histórico e a narrativa Moby Dick, integrando Literatura e Ciência.
- Analisar como a substituição do óleo de baleia pelo petróleo influenciou a preservação das espécies.
- Discutir as implicações ambientais da transição do uso de óleo de baleia para o petróleo.
Orientações
O trabalho com essa seção contribui para o desenvolvimento dos temas contemporâneos transversais Ciência e tecnologia e Educação ambiental ao apresentar como o advento do petróleo, embora motivado por interesses econômicos e industriais, teve um impacto inesperado na conservação de uma espécie marinha. Contudo, esse fato também marca o início de uma nova era de dependência dos combustíveis fósseis, que, embora tenha aliviado temporariamente o ecossistema marinho, trouxe outros desafios ambientais complexos a longo prazo. Ao tratar desses temas por meio da abordagem apresentada em Moby Dick, essa seção também colabora para um trabalho integrado ao componente curricular de Língua Portuguesa.
Página LXII
Durante a leitura, faça perguntas que incentivem a reflexão sobre as conexões entre Literatura e Ciência, auxiliando os estudantes a reconhecer que elementos do livro dialogam com a exploração de recursos naturais e que a obra do escritor estadunidense Herman Melville (1819-1891) pode ser vista como uma crítica às práticas de exploração predatória.
Acompanhando a aprendizagem
Para fazer uma avaliação ao final desse capítulo, sugira uma atividade prática simples para os estudantes investigarem de forma qualitativa a energia envolvida na dissolução de sal ou açúcar em água abre parênteses H subscrito 2 O fecha parênteses. Para isso, divida-os em grupos e peça-lhes que meçam a temperatura do sistema antes e depois do processo utilizando um termômetro e registrando as variações térmicas. Após a atividade, cada grupo apresentará suas conclusões, explicando se o processo estudado foi endotérmico ou exotérmico.
Respostas - Página 248
3. Resposta pessoal. Os estudantes ainda não receberam a informação de que a energia liberada ou absorvida depende apenas das ligações formadas ou rompidas, portanto provavelmente não saberão que o valor da energia será o mesmo. O objetivo dessa questão é incentivar os estudantes a refletir sobre essas semelhanças e diferenças. Por isso, leve-os a perceber que, se uma reação é exatamente o inverso da outra, os valores de energia também são iguais e a energia absorvida na fotossíntese vem de uma fonte solar, enquanto a energia liberada não, e esta pode ser transportada para outros lugares.
Respostas - Páginas 259 a 261
1. a ) A entalpia dos produtos é menor do que a dos reagentes, pois a variação de entalpia é menor do que zero.
b ) Na reação, são produzidos 2 mols de água líquida. Logo, para cada mol tem-se o valor de: menos 571 vírgula 6 quilojoules vezes mol elevado a menos 1 barra 2 é igual a menos 285 vírgula 8 quilojoules vezes mol elevado a menos 1. Como 1 quilocaloria equivale a 4 vírgula 186 quilojoules, a variação de entalpia em calorias será:
início de fração, numerador: menos 285 vírgula 8 quilojoules barra mol vezes 1 quilocaloria , denominador: 4 vírgula 186 quilojoules , fim de fração é igual a menos 68 vírgula 27 quilocalorias barra mol
c ) Como a variação de entalpia é negativa, a reação é exotérmica.
2. a )C H subscrito 4 abre parênteses g fecha parênteses mais 2 O subscrito 2 abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses
delta H é igual a menos 890 quilojoules. Reação exotérmica, pois delta H é menor do que 0.
b )2 H subscrito 2 O subscrito 2 abre parênteses l fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
delta H é igual a menos 196 quilojoules. Reação exotérmica, pois delta H é menor do que 0.
c ) Resposta: C H subscrito 4 O abre parênteses g fecha parênteses seta para a direita C O abre parênteses g fecha parênteses mais 2 H subscrito 2 abre parênteses g fecha parênteses
delta H é igual a menos 90 vírgula 7 quilojoules. Reação exotérmica, pois delta H é menor do que 0.
4. a )3 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 O subscrito 3 abre parênteses g fecha parênteses delta H é igual a mais 285 vírgula 4 quilojoules
b ) A entalpia dos produtos é maior do que a dos reagentes, pois a variação de entalpia é maior do que zero. Trata-se de uma reação endotérmica.
c ) A equação e o gráfico mostram que a produção de 2 mol de ozônio abre parênteses O subscrito 3 fecha parênteses absorve 285 vírgula 4 quilojoules. Assim, a energia absorvida por mol será 285 vírgula 4 quilojoules barra 2 mols é igual a 142 vírgula 7 quilojoules barra mol.
5. Ao entender que a combustão de compostos como o octano abre parênteses C subscrito 8 H subscrito 18 fecha parênteses libera grandes quantidades de energia e dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses, os estudantes podem perceber que escolhas de transporte, como optar por veículos mais eficientes ou alternativas de energia renovável, têm um papel direto na redução da emissão de gases de efeito estufa e, consequentemente, na mitigação do aquecimento global.
7. Rompimento de ligações acompanhado de absorção de energia:
C traço H: 4 vezes abre parênteses mais 412 quilojoules fecha parênteses é igual a mais 1.648 quilojoules
C l traço C l: 3 vezes abre parênteses mais 242 quilojoules fecha parênteses é igual a mais 726 quilojoules
Total: mais 1.648 quilojoules mais 726 quilojoules é igual a mais 2.374 quilojoules.
Formação de novas ligações e liberação de energia:
C traço H: 1 vezes abre parênteses menos 412 quilojoules fecha parênteses é igual a menos 412 quilojoules
C traço C l: 3 vezes abre parênteses menos 338 quilojoules fecha parênteses é igual a menos 1.014 quilojoules
H traço C l: 3 vezes abre parênteses menos 431 quilojoules fecha parênteses é igual a menos 1.293 quilojoules
Total: menos 412 quilojoules mais abre parênteses menos 1.014 quilojoules fecha parênteses mais abre parênteses menos 1.293 quilojoules fecha parênteses é igual a menos 2.719 quilojoules.
Portanto, delta H é igual a abre parênteses menos 2.719 fecha parênteses mais abre parênteses mais 2.374 fecha parênteses é igual a menos 345. Ou seja, a reação é exotérmica, e sua variação de entalpia é delta H é igual a menos 345 quilojoules.
9. a )2 C subscrito 8 H subscrito 18 abre parênteses l fecha parênteses mais 25 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 16 C O subscrito 2 abre parênteses g fecha parênteses mais 18 H subscrito 2 O abre parênteses g fecha parênteses
b )delta H subscrito reação grau é igual a ∑ n delta H subscrito f grau abre parênteses produtos fecha parênteses menos ∑ n delta H subscrito f grau abre parênteses reagentes fecha parênteses
delta H subscrito reação grau é igual a ∑ abre parênteses 16 vezes abre parênteses menos 393 vírgula 5 fecha parênteses mais mais 18 vezes abre parênteses menos 258 vírgula 8 fecha parênteses fecha parênteses menos ∑ abre parênteses 2 vezes abre parênteses menos 250 vírgula 0 1 fecha parênteses mais 16 vezes 0 fecha parênteses
portanto delta H subscrito reação grau é igual a menos 10.940 vírgula 2 quilojoules
Como a equação prevê dois mols de octano, temos, por fim, menos 10.940 vírgula 2 quilojoules barra 2 mol é igual a menos 5.470 vírgula 1 quilojoules barra mol.
c ) Considerando a densidade, em 1 litro de gasolina há 700 gramas de octano, e a quantidade de mols será:
início de fração, numerador: 700 gramas, denominador: 114 gramas barra mol, fim de fração é aproximadamente igual a 6 vírgula 14 mol
Considerando a resposta do item anterior, o calor liberado por 1 litro de octano será:
6 vírgula 14 mol vezes abre parênteses menos 5.470 vírgula 1 quilojoules barra mol fecha parênteses é igual a menos 33.586 vírgula 4 quilojoules
10. Como a pressão atmosférica é menor em regiões de maior altitude e a temperatura de ebulição da água diminui, a entalpia de vaporização também será menor, pois a água precisa de menos energia para passar do estado líquido para o gasoso. O alimento vai levar mais tempo para cozinhar porque parte do calor que seria transferida para ele vai para as moléculas de água no estado gasoso.
11. Deve-se priorizar o desenvolvimento de um combustível com entalpia de combustão maior, pois, a baixas temperaturas, os combustíveis terão baixa pressão de vapor e não apresentarão uma queima homogênea, além de o calor contribuir para a expansão dos gases.
Página LXIII
12. a ) A reação A é exotérmica, e a reação B é endotérmica.
b ) No gráfico da reação A, a curva começa em 300 quilojoules barra mol e diminui até 150 quilojoules barra mol. No gráfico da reação B, a curva começa em 150 quilojoules barra mol e termina em 300 quilojoules barra mol.
13. Devemos multiplicar ambas as equações por 2 e inverter a primeira. Assim, as reações termoquímicas envolvidas são:
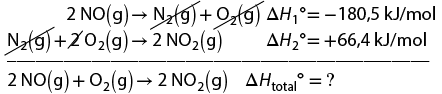
Portanto:
delta H subscrito total grau é igual a delta H subscrito 1 grau mais delta H subscrito 2 grau é igual a menos 180 vírgula 5 mais 66 vírgula 4 é igual a menos 114 vírgula 1
portanto delta H subscrito total grau é igual a menos 114 vírgula 1 quilojoules barra mol
15.delta H é igual a delta H subscrito produtos menos delta H subscrito reagentes
delta H subscrito reação grau é igual a abre colchetes abre parênteses delta H subscrito f grau abre parênteses C a O abre parênteses s fecha parênteses fecha parênteses fecha parênteses mais abre parênteses delta H subscrito f grau abre parênteses C O subscrito 2 abre parênteses g fecha parênteses fecha parênteses fecha parênteses fecha colchetes menos delta H subscrito f grau abre parênteses C a C O subscrito 3 abre parênteses s fecha parênteses fecha parênteses
mais 177 vírgula 5 é igual a abre colchetes abre parênteses menos 635 vírgula 5 fecha parênteses mais abre parênteses menos 393 vírgula 5 fecha parênteses fecha colchetes menos delta H subscrito f grau abre parênteses C a C O subscrito 3 abre parênteses s fecha parênteses fecha parênteses
delta H subscrito f grau abre parênteses C a C O subscrito 3 abre parênteses s fecha parênteses fecha parênteses é igual a menos 1.206 vírgula 5 quilojoules barra mol
16. Devemos primeiro igualar as três reações.
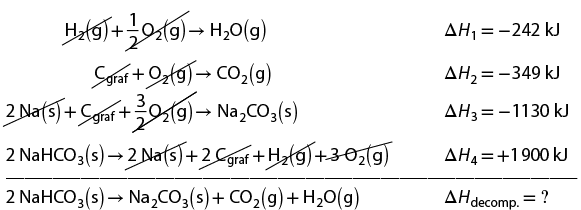
A variação de entalpia de decomposição é calculada pela soma das entalpias das reações anteriores.
delta H início subscrito, decomp., fim subscrito é igual a delta H subscrito 1 mais delta H subscrito 2 mais delta H subscrito 3 mais delta H subscrito 4
delta H início subscrito, decomp., fim subscrito é igual a menos 242 menos 394 menos 1.130 mais 1.900 é igual a mais 134
Portanto, a entalpia de decomposição é 134 quilojoules.
Retome o que estudou - página 261
Respostas
1. Espera-se que os estudantes incluam em seus esquemas informações de que a energia nos sistemas aumenta do estado de agregação sólido para o gasoso, passando pelo líquido. Quanto maior a energia do sistema, mais agitadas serão as moléculas e maior será a temperatura, resultando na transformação dos estados de agregação, como fusão e vaporização. Quando os sistemas perdem energia, reduzindo a mobilidade entre as moléculas, passam de estados de agregação mais energéticos para os menos energéticos, como ocorre na condensação e na solidificação.
2. Espera-se que os estudantes relacionem essa frase à lei de conservação das massas, que diz que, em uma reação química em recipiente fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos. Ela se refere ao fato de que, durante uma reação química, nenhum átomo é criado ou destruído, pois eles se reorganizam formando diferentes substâncias.
3. Espera-se que os estudantes respondam que, na prática, os reagentes de uma reação química não são convertidos totalmente em produtos e que a porcentagem de reagentes convertida em produto é o rendimento da reação.
4. Espera-se que os estudantes respondam que a adição de um soluto não volátil a um solvente resulta no abaixamento da sua temperatura de solidificação, de modo que a água passaria para o estado sólido em temperaturas inferiores a zero grau Celsius. Esse fenômeno é denominado crioscopia e evita o congelamento da água nos sistemas de arrefecimento de carros.
5. O objetivo dessa questão é fazer os estudantes definirem conceitos trabalhados nessa unidade e exemplificá-los. Além disso, incentive-os a trocar informações com os colegas a respeito do conteúdo.
Página LXIV
Unidade 4 Energia e transformações na sociedade
Essa unidade propõe o estudo sobre eletroquímica, eletrólise, radioatividade e suas aplicações. A tecnologia desenvolvida nessas áreas de estudo atualmente não se presta somente a gerar benefícios e comodidade para a população humana, mas alia-se a um desenvolvimento mais sustentável e seguro.
Objetivos da unidade
- Analisar o funcionamento de pilhas e baterias.
- Conhecer os processos de eletrólise e sua importância.
- Entender aspectos gerais da radioatividade.
- Conhecer as principais aplicações da radioatividade e os cuidados envolvidos em sua aplicação.
Justificativas
Abordar o funcionamento de pilhas e baterias remonta a uma construção histórica e compõe uma temática amplamente atual que ainda passa por importantes modificações, as quais objetivam um constante melhoramento desses processos. Esse entendimento possibilita o desenvolvimento da habilidade EM13CNT308.
Além disso, a ampliação do tema sobre radioatividade, considerando as potencialidades e os riscos de sua aplicação, contribui para o trabalho com as habilidades EM13CNT103 e EM13CNT104.
Abertura da unidade - páginas 266 e 267
BNCC em contexto
O estudo dessa unidade permite trabalhar as Competências gerais 1 e 2, que possibilitam a análise de processos tecnológicos que minimizem os impactos socioambientais, bem como as habilidades EM13CNT103 e EM13CNT104, as quais se relacionam diretamente com a temática sobre radioatividade. Contribui ainda para o desenvolvimento da habilidade EM13CNT308, por meio do estudo do funcionamento de pilhas e baterias e do entendimento do processo de eletrólise.
Inicie o trabalho com essas páginas lendo os textos e analisando a fotografia do carro movido a urânio-235 abre parênteses U menos 235 fecha parênteses. Pergunte aos estudantes se já conheciam algo sobre energia nuclear e uso de urânio abre parênteses U fecha parênteses em outros contextos.
Respostas
a ) Resposta pessoal. Espera-se que os estudantes mencionem o uso da tecnologia em diversas áreas, como o tratamento de doenças na Medicina, entre outros.
b ) Resposta pessoal. Espera-se que os estudantes respondam que sim, pois a busca por novas tecnologias possibilita o desenvolvimento de alternativas mais seguras e eficientes.
Capítulo 14 - Eletroquímica - páginas 268 a 288
Objetivos do capítulo
- Conhecer o histórico do desenvolvimento de pilhas e baterias.
- Conhecer o funcionamento e as características de pilhas e baterias.
- Entender a variação no número de oxidação (N O X) e balancear equações químicas de oxirredução.
- Equacionar a reação global de uma pilha e representar um diagrama de barras de uma pilha.
- Conhecer e calcular a diferença de potencial (d d p) de uma pilha.
- Conhecer algumas formas de proteger os metais da corrosão.
BNCC em contexto
A abordagem da página 268 contribui para o desenvolvimento da Competência geral 1, pois incentiva os estudantes a considerar o conhecimento científico como uma construção humana histórica.
Prática científica - página 269
Objetivo
Compreender o funcionamento da pilha de Alessandro Volta.
Orientações
Incentive os estudantes a responder à questão inicial da seção. O objetivo dessa questão é levantar o conhecimento prévio deles, e a resposta é pessoal.
Oriente-os a não deixar os papéis no vinagre por muito tempo, pois eles poderão rasgar. Reforce, contudo, que é preciso umidificá-los suficientemente. Após o experimento, as moedas, as arruelas e o prato devem ser lavados. Esses materiais, bem como o LED, podem ser reutilizados em outros experimentos. Os pedaços de papel podem ser descartados no lixo comum.
Respostas
1. A intensidade da luz do LED aumentaria, pois a voltagem da pilha aumenta.
2. Espera-se que os estudantes respondam que a folha seca não permitiria a passagem de elétrons, que é a condição para que ocorra a condução de corrente elétrica. Outro material que poderia ser utilizado seria uma solução com íons.
BNCC em contexto
O estudo da página 270 contribui para o desenvolvimento da habilidade EM13CNT308, pois permite investigar e analisar o funcionamento de equipamentos elétricos e/ou eletrônicos, compreendendo as tecnologias contemporâneas e avaliando seus impactos sociais, culturais e ambientais.
Página LXV
Na reação de oxirredução, sempre há um elemento químico que é oxidado e outro que é reduzido. Auxilie os estudantes a classificar um participante da reação em agente oxidante ou agente redutor. Eles devem distinguir que aquele que é oxidado é um agente redutor, e, de modo análogo, o que é reduzido é classificado como agente oxidante.
BNCC em contexto
A análise do funcionamento da pilha de Daniell, na página 273, contribui para desenvolver as Competências gerais 1 e 2, pois incentiva os estudantes a recorrer aos conhecimentos científicos construídos historicamente para explicar o funcionamento das pilhas modernas.
A abordagem das páginas 277 e 278 contempla a habilidade EM13CNT307, pois leva os estudantes a analisar as propriedades dos materiais para avaliar como se adéquam em diferentes aplicações (industriais, cotidianas, arquitetônicas ou tecnológicas) e/ou para propor soluções seguras e sustentáveis considerando seu contexto local e cotidiano.
O estudo das páginas 281 a 283 favorece o trabalho com as habilidades EM13CNT106, a qual permite avaliar tecnologias e possíveis soluções para as demandas que envolvem a geração e o consumo de energia elétrica, considerando a disponibilidade de recursos, a eficiência energética, a relação entre custo e benefício, as questões ambientais, a produção de resíduos e os impactos socioambientais e culturais; e EM13CNT107, pois proporciona a realização de previsões qualitativas e quantitativas sobre o funcionamento de pilhas e baterias, com base na análise dos processos de transformação e condução de energia envolvidos, a fim de propor ações que visem à sustentabilidade.
Compartilhe ideias - página 285
Nesse boxe, desenvolve-se a habilidade EM13CNT309, pois permite que os estudantes discutam a introdução de novas tecnologias energéticas, levando em consideração o contexto ambiental atual, que apresenta diversos desafios.
Resposta
a ) Espera-se que os estudantes reconheçam que o desenvolvimento de fontes de energia alternativas reduz a dependência dos combustíveis fósseis. Além disso, o hidrogênio combustível é um tipo de recurso renovável que não emite poluentes atmosféricos, auxiliando a reduzir a poluição do ar.
Prática científica - páginas 286 e 287
Objetivo
Construir uma pilha caseira por meio de um limão.
Orientações
Solicite aos estudantes que formulem hipóteses e as compartilhem com os colegas. A formulação de hipóteses permite trabalhar a habilidade EM13CNT301, considerando uma perspectiva científica e ideias prévias da turma. Comente que, em vídeos nos quais batatas podem "acender" lâmpadas, os equipamentos elétricos são modificados. Na verdade, as lâmpadas estão conectadas a uma fonte de energia elétrica externa e à batata, que possui íons em solução aquosa e permite a movimentação de cargas, ou seja, a batata é um condutor elétrico, mas não produz eletricidade.
Ao desencapar os fios de cobre, acompanhe os estudantes e oriente-os a seguir a ilustração. Se necessário, desencape os fios aos poucos. No momento de fazer cortes no limão, monitore-os para evitar acidentes.
As placas de zinco abre parênteses Z n fecha parênteses e cobre abre parênteses C u fecha parênteses, os fios de cobre e a calculadora/voltímetro devem ser limpos e podem ser usados posteriormente em outros experimentos. Os limões podem ser descartados em lixo comum ou destinados para compostagem de resíduo orgânico.
Respostas
1. Cátodo: placa de cobre. Ânodo: placa de zinco. O zinco tem potencial menor de redução, portanto ele sofrerá oxidação, constituindo o ânodo da pilha. A reação de redução dos íons H sobrescrito mais tem potencial maior de redução, por isso o cobre executará o papel de cátodo.
2. Oxidação: Z n abre parênteses s fecha parênteses seta para a direita Z n elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais início de expressão riscada; 2 e elevado a início expoente, menos, fim expoente; fim de expressão riscada
Redução: 2 H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais início de expressão riscada; 2 e elevado a início expoente, menos, fim expoente; fim de expressão riscada seta para a direita H subscrito 2 abre parênteses g fecha parênteses
Reação global: Z n abre parênteses s fecha parênteses mais 2 H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses seta para a direita Z n elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 abre parênteses g fecha parênteses
3.Z n abre parênteses s fecha parênteses símbolo de uma barra vertical Z n elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses símbolo de uma barra vertical símbolo de uma barra vertical 2 H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses símbolo de uma barra vertical H subscrito 2 abre parênteses g fecha parênteses
4.delta E é igual a E subscrito cátodo menos E subscrito ânodo implica em
implica em delta E é igual a 0 vírgula 0 0 menos abre parênteses menos 0 vírgula 76 fecha parênteses implica em delta E é igual a 0 vírgula 76 V
5. Como a placa de zinco sofre oxidação, haverá um desgaste dela, isto é, diminuição de sua massa. Como na placa de cobre não há formação de íons C u elevado a início expoente, 2 mais, fim expoente, ela não sofrerá desgaste.
6. O sumo do limão funciona como meio eletrolítico, conduzindo corrente elétrica. Isso é possível por causa da presença de íons livres (ionização do ácido cítrico) no sumo dessa fruta.
7. Aumentaria, já que o valor da ddp seria maior. Quaisquer outros metais que tenham tendência igual ou maior para oxidar em relação ao zinco poderiam ser utilizados com sucesso na construção dessa pilha.
8. Resposta pessoal. Oriente os estudantes sobre o tipo de recurso que eles podem utilizar para produzir as publicações. Reforce as principais informações que eles devem apresentar e quais devem evitar compartilhar, como fotografias ou detalhes pessoais dos envolvidos.
Acompanhando a aprendizagem
Para realizar uma avaliação ao final do capítulo, solicite aos estudantes que façam um levantamento da quantidade de itens presentes em suas casas que necessitam de pilhas para funcionar. Peça-lhes também que identifiquem os tipos de pilha e os classifiquem conforme os textos das páginas 281 a 284. Depois, discutam como essas pilhas devem ser descartadas e as implicações ambientais dessas práticas.
Respostas - Página 279
8. Processos de corrosão podem prejudicar a estrutura de objetos e construções. No caso de oleodutos, a corrosão poderá ocasionar vazamento de petróleo, que é composto de diversos materiais tóxicos. Os efeitos desse vazamento no ambiente aquático são diversos; por exemplo, forma-se uma película sobre a água, prejudicando a passagem de luz solar e, consequentemente, a fotossíntese, interferindo na cadeia alimentar local, e as trocas gasosas entre o meio aquático e o ar também são prejudicadas. A impregnação do petróleo nos animais pode causar a morte deles por asfixia, como no caso dos peixes, ou prejudicar o voo e o controle da temperatura corporal das aves marinhas. Além disso, diversos componentes do petróleo são tóxicos e podem provocar a morte direta de muitos outros seres vivos. Do ponto de vista econômico, a corrosão de tubulações de oleodutos representa prejuízo, tendo em vista que haverá perda de material extraído e custos com o reparo ou a substituição das tubulações.
Página LXVI
Capítulo 15 - Eletrólise - páginas 289 a 300
Objetivos do capítulo
- Conhecer aspectos gerais da eletrólise.
- Compreender que a eletrólise não é um processo espontâneo.
- Aplicar a lei de Faraday nos processos de eletrólise.
BNCC em contexto
A abordagem das páginas 289 e 290 contribui para o desenvolvimento da habilidade EM13CNT307, pois permite analisar as propriedades dos materiais para avaliar como seu uso se adapta em diferentes aplicações.
Além disso, ao trabalhar a obtenção do alumínio abre parênteses A l fecha parênteses por meio de processos que envolvem a eletrólise, aprimora-se a Competência geral 1, pois incentiva os estudantes a relacionar a resolução de problemas do dia a dia aos conhecimentos científicos desenvolvidos ao longo do tempo.
Compartilhe ideias - página 290
A abordagem desse boxe permite trabalhar o tema contemporâneo transversal Educação ambiental e a Competência geral 9 ao incentivar os estudantes a discutir um tema e a respeitar as ideias e opiniões uns dos outros; e a Competência geral 7, ao argumentar com base em informações confiáveis para defender ideias que promovam a consciência socioambiental.
Resposta
O objetivo dessa questão é levar os estudantes a refletir sobre as consequências da mineração para o ambiente e a responsabilidade das empresas mineradoras em manter a segurança da atividade por meio de medidas como a manutenção e o monitoramento frequente das estruturas da mineradora, bem como a aplicação de novas tecnologias. Além disso, espera-se que eles comparem as técnicas utilizadas na mineração de diferentes tipos de matéria-prima.
Conexões com… - página 293
Objetivos
- Compreender a importância da coleta e destinação correta do alumínio do ponto de vista econômico e ambiental.
- Reconhecer a importância da reciclagem.
Orientações
Ao iniciar a seção, pergunte aos estudantes se em suas casas há algum tipo de coleta seletiva, como a separação entre lixo seco e úmido. Aproveite para fazer a integração com o componente curricular de Sociologia, vinculando a discussão ao tema contemporâneo transversal Trabalho.
Respostas
a ) O processo de beneficiamento da bauxita para produção de alumínio requer muita energia elétrica na eletrólise. Nesse processo, também é consumida água em grande quantidade nas etapas de lavagem, além de o transporte de grandes quantidades de bauxita para as usinas de beneficiamento ser responsável pela emissão de gases de efeito estufa. À medida que a reciclagem é realizada diretamente com o alumínio em sua forma metálica, esses impactos ambientais são diminuídos.
b ) Na esfera social, medidas como a conscientização sobre a importância desses trabalhadores e sua inclusão em discussões comunitárias pode ajudar a valorizá-los como profissionais essenciais. Na esfera governamental, medidas como a formalização da atividade dos catadores, que garantam acesso a direitos trabalhistas, a implementação de políticas públicas de incentivo à coleta seletiva e programas de capacitação poderiam melhorar as condições de trabalho e renda desses profissionais.
BNCC em contexto
A abordagem da página 298 contribui para o desenvolvimento da habilidade EM13CNT101, pois permite analisar e representar as transformações e conservações em sistemas que envolvam quantidade de matéria e energia, a fim de prever seus comportamentos em situações cotidianas e em processos produtivos.
Ao abordar a lei de Faraday, explique aos estudantes que, ao realizar um processo eletrolítico, uma indústria precisa estimar o uso de energia para atender à demanda de produção. Tais cálculos são possíveis por meio dessa lei.
Resolva na lousa o exemplo numérico apresentado no livro, executando-o passo a passo. Explique-lhes que sempre será necessário fazer o cálculo estequiométrico para descobrir a carga elétrica necessária para obter a massa desejada do produto. Alerte-os para as possíveis conversões de unidades, principalmente para as variáveis massa, tempo e corrente elétrica.
Acompanhando a aprendizagem
Peça aos estudantes que equacionem as reações para a eletrólise ígnea e em solução aquosa do iodeto de potássio abre parênteses K I fecha parênteses. Eles também devem comparar os produtos obtidos para verificar se houve ou não diferença nos dois processos.
Resposta
Eletrólise ígnea: material fundido na ausência de água.
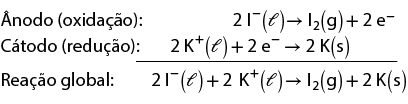
Página LXVII
Eletrólise em solução aquosa: devemos considerar a dissociação do sal, a ionização da água e as semirreações de oxidação e redução.
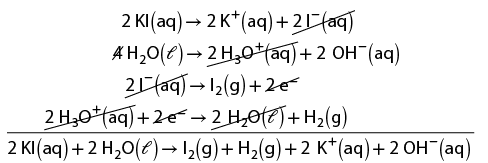
Portanto, há diferença nos processos, pois a eletrólise ígnea tem como produto I subscrito 2 abre parênteses g fecha parênteses e K abre parênteses s fecha parênteses, enquanto a eletrólise em solução aquosa forma I subscrito 2 abre parênteses g fecha parênteses, H subscrito 2 abre parênteses g fecha parênteses e K O H abre parênteses a q fecha parênteses.
Respostas - páginas 299 e 300
1. Eletrólise ígnea: estado líquido. Íons M g elevado a início expoente, 2 mais, fim expoente e C l elevado a início expoente, menos, fim expoente presentes. Produto no cátodo: M g abre parênteses s fecha parênteses. Semirreação anódica: 2 C l elevado a início expoente, menos, fim expoente abre parênteses l fecha parênteses seta para a direita C l subscrito 2 abre parênteses g fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente. Semirreação catódica:
M g elevado a início expoente, 2 mais, fim expoente abre parênteses l fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente seta para a direita M g abre parênteses s fecha parênteses. Eletrólise aquosa: estado aquoso. Íons M g elevado a início expoente, 2 mais, fim expoente, C l elevado a início expoente, menos, fim expoente, H sobrescrito mais e O H elevado a início expoente, menos, fim expoente presentes. Produto no cátodo: H subscrito 2 abre parênteses g fecha parênteses. Semirreação anódica: 2 C l elevado a início expoente, menos, fim expoente abre parênteses l fecha parênteses seta para a direita C l subscrito 2 abre parênteses g fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente. Semirreação catódica: 2 H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente seta para a direita H subscrito 2 abre parênteses s fecha parênteses.
2. a ) O cátodo da eletrólise está conectado ao polo negativo da bateria e o ânodo está conectado ao polo positivo.
b ) Ânodo: A u abre parênteses s fecha parênteses seta para a direita A u elevado a início expoente, 3 mais, fim expoente abre parênteses g fecha parênteses mais 3 e elevado a início expoente, menos, fim expoente; Cátodo: A u elevado a início expoente, 3 mais, fim expoente abre parênteses g fecha parênteses mais 3 e elevado a início expoente, menos, fim expoente seta para a direita A u abre parênteses s fecha parênteses.
c ) Poderia ser observado que no cátodo há a deposição do ouro metálico no anel de alumínio e no ânodo há a oxidação do ouro, em que a barra de ouro pode diminuir de tamanho.
4. a ) Foi descrita a eletrólise do tipo ígnea com as seguintes semirreações:
ânodo: 2 C l elevado a início expoente, menos, fim expoente abre parênteses l fecha parênteses seta para a direita C l subscrito 2 abre parênteses g fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente
cátodo: M g elevado a início expoente, 2 mais, fim expoente abre parênteses l fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente seta para a direita M g abre parênteses s fecha parênteses
b ) Primeiro, as horas são convertidas em segundos, depois aplica-se esse valor para obter o valor de Q:
1 hora vezes 60 minutos barra hora vezes 60 segundos barra minuto é igual a 3.600 segundos
Q é igual a i vezes 't' implica em Q é igual a 48 vírgula 25 vezes 3.600 portanto Q é igual a 173.700 C
Sabemos que 2 mol e elevado a início expoente, menos, fim expoente seta para a direita 1 mol M g, e a massa molar do M g é 24 vírgula 31 gramas barra mol.
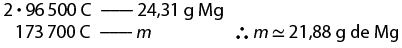
c )

5. Dissociação do sal: C u S O subscrito 4 abre parênteses a q fecha parênteses seta para a direita C u elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses.
Eletrólise: C u elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 e elevado a início expoente, menos, fim expoente seta para a direita C u abre parênteses s fecha parênteses.
Sabemos que 2 mol e elevado a início expoente, menos, fim expoente seta para a direita 1 mol C u, e a massa molar do C u é 63 vírgula 55 gramas barra mol.
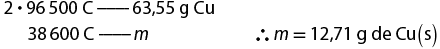
6. a ) Na redução do C u elevado a início expoente, 2 mais, fim expoente, sabemos que 2 mol e elevado a início expoente, menos, fim expoente seta para a direita 1 mol C u, e a massa molar do C u é 63 vírgula 55 gramas barra mol.
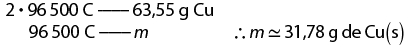
Na redução do C u elevado a início expoente, mais, fim expoente, sabemos que 1 mol de e elevado a início expoente, menos, fim expoente forma 1 mol de C u abre parênteses s fecha parênteses, portanto, 'm' é igual a 63 vírgula 55 gramas.
Na redução do A u elevado a início expoente, 3 mais, fim expoente, sabemos que 3 mol e elevado a início expoente, menos, fim expoente seta para a direita 1 mol A u, e a massa molar do Au é 196 vírgula 97 gramas por mol.
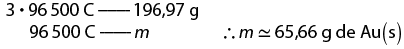
Na redução do A l elevado a início expoente, 3 mais, fim expoente, sabemos que A l elevado a início expoente, 3 mais, fim expoente abre parênteses a q fecha parênteses mais 3 e elevado a início expoente, menos, fim expoente seta para a direita A l abre parênteses s fecha parênteses, e a massa molar do A l é 26 vírgula 98 gramas por mol.

b ) Foi a reação com o ouro, produzindo 65 vírgula 66 gramas.
c ) Sim, ambos afetam. Quanto maior a massa atômica, maior a massa reduzida obtida. Comparando o ouro ao alumínio, cuja carga é a mesma, nota-se que o ouro tem a massa atômica maior do que a do alumínio. Quanto maior a carga, menor é a massa reduzida; pode-se comparar o mesmo elemento (cobre) com diferentes cargas; a que tem a carga mais 2 ficou com massa menor do que a de carga mais 1.
8.Carga total é igual a 0 vírgula 5 mol vezes 96.500 C barra mol é igual a 48.250 C
11. Com base na lei de Faraday abre parênteses Q é igual a i vezes 't' fecha parênteses e nas correlações estequiométricas, é possível calcular a quantidade de cobre metálico depositado usando a fórmula:
'm' é igual a abre parênteses M vezes i vezes 't' fecha parênteses barra abre parênteses n vezes 'F' fecha parênteses, na qual 'm' é a massa depositada, M é a massa molar, i é a corrente elétrica, 't' é o tempo, n é o número de elétrons envolvidos na reação e 'F' é a constante de Faraday. Isso permite prever a quantidade de cobre depositado em função da corrente aplicada e do tempo de eletrólise.
Capítulo 16 - Radioatividade - páginas 301 a 314
Objetivos do capítulo
- Conhecer a cronologia sobre a descoberta e o estudo das propriedades radioativas.
- Compreender radioatividade e termos relacionados, como radioisótopos, radionuclídeos, tempo de meia-vida e radiações ionizantes.
- Conceituar decaimento radioativo e emissão de radiação ionizante e as leis de Soddy.
- Identificar ocorrências naturais de emissão radioativa, compreendendo que não são prejudiciais à saúde humana.
- Desconstruir compreensões limitantes de que a radioatividade é um fenômeno necessariamente danoso ou maléfico à saúde humana, ao ambiente e ao desenvolvimento tecnológico.
Páginas 301 a 308
BNCC em contexto
As páginas 301 e 302 abordam algumas aplicações práticas da radioatividade na área da saúde, incentivando os estudantes a refletir sobre a noção geral de que a radioatividade é necessariamente algo indesejado, levando-os a desmistificar essa concepção. Isso contribui para desenvolver as Competências gerais 2 e 7 e as habilidades EM13CNT103, EM13CNT104 e EM13CNT306.
Página LXVIII
As páginas 301 e 302 abordam o desenvolvimento histórico dos conhecimentos sobre a radioatividade, explorando os trabalhos de cientistas relevantes para a área, o que contempla a Competência geral 1.
Já o trabalho sobre o decaimento radioativo na página 306 contempla as habilidades EM13CNT103 e EM13CNT205.
Ao trabalhar o histórico das descobertas de radioatividade, será destacada a contribuição da física polonesa Marie Curie (1867-1934) e de sua filha, a francesa física e química, Irène Joliot-Curie (1897-1956), que se destacaram no mundo das Ciências, um campo em que mulheres frequentemente enfrentam obstáculos para alcançar reconhecimento. É encorajada uma discussão mais ampla sobre o papel das mulheres na Ciência, o espaço dado a elas e os preconceitos que ainda lhes são atribuídos, trabalhando assim a Competência geral 6 e a habilidade EM13CNT305.
Antes de iniciar o capítulo, conheça algumas possibilidades de literatura para o ensino da radioatividade presentes em revistas científicas. O artigo "O tema radioatividade nas revistas da SBQ e as possíveis contribuições para o ensino de radioatividade na Educação Básica" apresenta diversas sugestões que podem auxiliar no ensino dessa temática em sala de aula. Disponível em: https://s.livro.pro/dq1ub4. Acesso em: 3 out. 2024.
Inicie o conteúdo desse capítulo perguntando aos estudantes se já fraturaram um osso. Caso alguns deles respondam que sim, peça-lhes que citem detalhes sobre os procedimentos médicos que foram realizados para diagnosticar e tratar a fratura. Em seguida, pergunte no que consiste esse procedimento. Possivelmente, alguns deles não associarão os raios X à radioatividade.
Na cronologia da descoberta da radioatividade, explique que Marie Curie e o físico francês Antoine Henri Becquerel (1852-1908) faleceram por conta de complicações advindas de seus trabalhos com radiação. Use esses casos para reforçar a importância de tomar os cuidados necessários ao realizar pesquisas científicas. Na época dos experimentos desses cientistas, pouco se sabia sobre os perigos da radioatividade.
O primeiro elemento radioativo criado artificialmente e um novo prêmio Nobel - mais um fruto da família Curie - página 303
A família Curie deixou, sem dúvida, um legado no âmbito da Ciência. Começando pelos pais, o físico francês Pierre (1859-1906) e Marie Curie, e continuando com Irène e seu esposo, os estudos sobre radioatividade possibilitaram avanços científicos que culminaram em aplicações médicas importantes, como o tratamento de câncer por meio da radioterapia, que pode curar a doença.
Pode-se ainda destacar que os estudos da radioatividade permitiram compreender a transformação de um elemento químico em outro. Por meio dela é possível observar as transmutações de um elemento químico em laboratório, o que pode ocorrer naturalmente ou de maneira artificial.
Na página 306, são citados os radionuclídeos. Explique aos estudantes que eles se referem a núcleos atômicos radioativos, mas que esse termo, em geral, trata do átomo como um todo, não apenas de seu núcleo; ele também é empregado, por vezes, como sinônimo de radioisótopo.
Ao citar isótopos, dê outros exemplos de isótopos relevantes, além dos de urânio abre parênteses U fecha parênteses. Por exemplo: os isótopos do hidrogênio (H traço 2: deutério; e H traço 3: trítio) e os de carbono (C traço 13 e C traço 14).
BNCC em contexto
As páginas 304 e 305 abordam a constituição e as propriedades das partículas radioativas, a ocorrência natural de radioatividade e as leis que regem esse fenômeno, contemplando as habilidades EM13CNT101 e EM13CNT205. Além disso, incentivam os estudantes a recorrer ao conhecimento científico e às abordagens da Ciência para analisar e explicar um experimento demonstrado de radiação com emissão de partículas, contribuindo para desenvolver a Competência geral 2.
Na página 305, é informado que núcleos atômicos instáveis podem emitir partículas e radiações por meio de fenômenos naturais ou artificiais. Converse com os estudantes explicando que as emissões nucleares diferem entre si por carga, massa relativa, poder de penetração, poder de ionização e velocidade de propagação. Para auxiliar na explicação do conteúdo, utilize o esquema do experimento radioativo e o quadro com as principais características de emissões radioativas naturais, ambos apresentados nas páginas 304 e 305, além de discutir as respostas das questões.
Atividade extra
Se julgar conveniente, após a abordagem das leis de Soddy, na página 307, sugira aos estudantes que respondam às seguintes questões, a fim de verificar o aprendizado deles.
1. Na desintegração do rádio-226 abre parênteses sobrescrito 226 R a fecha parênteses, é emitida uma partícula alfa. Esse decaimento seguirá qual lei da radioatividade?
2. O estrôncio-90 abre parênteses sobrescrito 90 S r fecha parênteses sofre decaimento beta. Esse decaimento obedece a qual lei? Justifique sua resposta.
Respostas
1. Seguirá a lei de Soddy, ou primeira lei da radioatividade, a qual afirma que, em um decaimento alfa, o átomo se transforma em outro elemento químico com número atômico e número de massa menores.
2. Esse decaimento segue à lei de Soddy, Fajans e Russel, ou segunda lei da radioatividade, a qual afirma que, quando um átomo radioativo emite uma partícula beta, ele se transforma em outro elemento químico com mesmo número de massa e com número atômico uma unidade maior.
Páginas 310 a 313
Auxilie os estudantes na interpretação dos gráficos apresentados na página 312. O primeiro gráfico, de decaimento geral, mostra na abscissa o número de meias-vidas e, na ordenada, a porcentagem de massa do radioisótopo que ainda resta no material analisado. Destaque que no segundo gráfico, na abscissa, o tempo está em anos.
Página LXIX
Prática científica - página 313
Objetivos
- Compreender que o decaimento de um átomo é um fenômeno probabilístico.
- Simular o decaimento radioativo.
Orientações
Durante a leitura de contextualização e observação da fotografia, explique aos estudantes que o ritual de mumificação era realizado por diversos povos da Antiguidade, com o objetivo de preservar corpos e cumprir obrigações relacionadas às crenças desses povos.
Comente que os métodos de datação permitem estimar com certa precisão a idade de organismos e objetos. Essa prática está relacionada ao desenvolvimento da habilidade EM13CNT205, pois se baseia na probabilidade de núcleos de átomos sofrerem decaimento. Essa seção também contempla as habilidades EM13CNT301 e EM13CNT302, permitindo estimar por meio de modelos o decaimento radioativo e construir gráficos com base nos resultados.
Para a realização da prática, caso não haja moedas suficientes, oriente os estudantes a substituí-las por círculos de papelão de mesmo diâmetro e com marcações em um dos lados.
Respostas
1. Cada moeda representa um átomo instável que não foi desintegrado.
2. A agitação da caixa representa o tempo de meia-vida de determinado radioisótopo.
3. As moedas retiradas representam o produto do decaimento radioativo sofrido pelo suposto radioisótopo a cada meia-vida.
4. Resposta pessoal. Espera-se que os estudantes construam um gráfico em que os dados tenham a tendência logarítmica decrescente, tendendo a zero.
5.
200 gramas com a informação acima: 100 por cento, seta para direita indicando 24 horas, 100 gramas com a informação acima: 50 por cento, seta para direita indicando 24 horas, 50 gramas com a informação acima: 25 por cento, seta para direita indicando 24 horas, 25 gramas com a informação acima: 12,5 por cento, seta para direita indicando 24 horas, 12,5 gramas com a informação acima: 6,25 por cento, seta para direita indicando 24 horas
expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima; fim do detalhe acima expressão com detalhe acima, início da expressão, 6 vírgula 25 gramas, fim da expressão, início do detalhe acima, 3 vírgula 13 por cento, fim do detalhe acima expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 24 horas, fim do detalhe acima expressão com detalhe acima, início da expressão, expressão com detalhe acima, início da expressão, 3 vírgula 125 gramas, fim da expressão, início do detalhe acima, chave para baixo, fim do detalhe acima, fim da expressão, início do detalhe acima, 1 vírgula 56 por cento, fim do detalhe acima
Portanto, após 6 dias, haverá, aproximadamente, 3 gramas de moedas dentro da caixa.
6. Resposta pessoal. Se necessário, na divulgação dos resultados, auxilie os estudantes a reproduzir o gráfico de forma digital por meio de algum programa para construir gráficos e destaque a relação do tema dessa seção com a história, visto que o estudo do decaimento radioativo auxilia na datação de artefatos antigos.
Acompanhando a aprendizagem
Para realizar a avaliação ao final desse capítulo, peça aos estudantes que, em duplas, pesquisem o tempo de meia-vida de dois elementos radioativos. Depois, solicite que elaborem problemas utilizando os dados de massa total da amostra, massa final e tempo de meia-vida. Avalie os problemas propostos fazendo as devidas observações, caso necessário.
Respostas - Página 309
1. O primeiro decaimento é do tipo alfa, pois o número de massa diminuiu quatro unidades, e o número atômico diminuiu duas unidades.
sobrescrito 238, subscrito 92 U seta para direita sobrescrito 234 subscrito 90 T h mais sobrescrito 4 subscrito 2 alfa.
O segundo decaimento é do tipo beta, pois o número atômico aumentou uma unidade e o número da massa permaneceu constante.
sobrescrito 234, subscrito 90 T h seta para a direita sobrescrito 0, subscrito meno 1 beta mais sobrescrito 234, subscrito 91 P a
3. Conservação do total da massa:
232 é igual a 4 vezes x mais 0 vezes y mais 208
232 é igual a 4 vezes x mais 208
x é igual a 6
Conservação do total da carga:
90 é igual a abre parênteses 2 vezes 6 fecha parênteses mais abre parênteses menos 1 vezes y fecha parênteses mais 82
90 é igual a 12 menos y mais 82
y é igual a 4
Portanto, houve emissão de seis partículas alfa e de quatro partículas beta.
7. Conservação do total da massa:
235 mais 1 é igual a 90 mais x mais 3
x é igual a 143
Conservação do total da carga:
92 é igual a 38 mais x
x é igual a 54
Assim, a representação do elemento é sobrescrito 143 subscrito 54 X.
Respostas - Página 314
2. Considerando a atividade do radionuclídeo após cada meia-vida:
100 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 1 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima 50 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 2 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima 25 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 3 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima expressão com detalhe abaixo, início da expressão, 12 vírgula 5 por cento abre parênteses restante fecha parênteses, início do detalhe abaixo, 87 vírgula 5 por cento abre parênteses desintegrado fecha parênteses, fim do detalhe abaixo
't' subscrito total é igual a x vezes 't' início subscrito, 1 barra 2, fim subscrito implica em 60 é igual a 3 vezes 't' início subscrito, 1 barra 2, fim subscrito portanto 't' início subscrito, 1 barra 2, fim subscrito é igual a 20 dias
Assim, a meia-vida do radionuclídeo é de 20 dias.
3. Com 6,25%, temos quatro meias-vidas.
100 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 1 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima 50 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 2 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima 25 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 3 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima 12 vírgula 5 por cento expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, 4 't' início subscrito, 1 barra 2, fim subscrito, fim do detalhe acima
seta para a direita, 6 vírgula 25 por cento
't' subscrito total é igual a x vezes 't' início subscrito, 1 barra 2, fim subscrito implica em 't' subscrito total é igual a 4 vezes 5.730 portanto 't' subscrito total é igual a 22.920 anos
Após a morte do indivíduo, decorreram 22.920 anos.
Capítulo 17 - Usos da radioatividade - páginas 315 a 329
Objetivos do capítulo
- Relacionar as propriedades de materiais radioativos com suas aplicações em áreas como Medicina, agricultura e indústria.
- Identificar os benefícios e cuidados no uso da radioatividade.
BNCC em contexto
As páginas 315 e 316 abordam aplicações práticas da radioatividade no campo da Medicina, elencando diversos exemplos e considerações acerca delas, contribuindo para que os estudantes adquiram conhecimento sobre as potencialidades da radioatividade e a precaução ao trabalhar com processos radioativos, a fim de desenvolver as Competências gerais 1 e 2 e as habilidades EM13CNT101, EM13CNT103, EM13CNT104 e EM13CNT307.
Página LXX
Compartilhe ideias – página 316
Esse boxe incentiva os estudantes a discutir como a radioatividade interfere na saúde humana, contribuindo para desenvolver a Competência geral 9.
Respostas
a ) Resposta pessoal. Espera-se que os estudantes comentem que os raios solares incidem diretamente na pele, situação em que não se controla a intensidade da radiação, o que pode danificar as células cutâneas e causar câncer. Por outro lado, na radioterapia, a intensidade da radiação é controlada para pontos específicos, com o propósito de destruir as células cancerosas.
b ) Resposta pessoal. Espera-se que os estudantes comentem que algumas doenças, como o câncer, são resultado de alterações do material genético das células. Nesse caso, os efeitos demoram a aparecer, a depender de diversos fatores, como o tipo, a intensidade da radiação e o tempo de exposição.
Ligado no tema - página 317
Objetivos
- Compreender a importância dos raios X na Medicina.
- Conhecer a importância do correto descarte das chapas de raio-X e novas tecnologias na área.
Orientações
Essa seção está associada ao tema contemporâneo transversal Ciência e tecnologia, pois explora temas, como os exames de raios-X, que são produtos dos estudos científicos. Também se relaciona ao tema contemporâneo transversal Educação ambiental, ao discutir sobre a destinação correta das chapas de raios-X, que contêm elementos prejudiciais ao meio ambiente.
Respostas
a ) O Sistema Único de Saúde (SUS) garante que todos os brasileiros tenham acesso a serviços de saúde gratuitos, incluindo consultas médicas e exames – como as radiografias.
b ) O descarte correto das chapas de raio-X é importante porque elas contêm substâncias químicas tóxicas, como o metal pesado prata. Se essas chapas forem descartadas de forma inadequada, podem causar contaminação do solo e dos lençóis freáticos, levando à poluição do meio ambiente e podendo afetar negativamente a saúde dos seres vivos.
c ) O uso do raio-X digital elimina a necessidade de chapas físicas, o que reduz o uso de substâncias tóxicas e a contaminação ambiental. Além disso, proporciona exames mais detalhados e facilita o armazenamento e compartilhamento de imagens entre profissionais de saúde.
Atividade extra
Solicite aos estudantes que conversem com os colegas a respeito do uso da radioatividade em processos medicinais, industriais e de produção de alimentos. Em seguida, em grupos de cinco integrantes, peça a eles que elaborem um painel com as principais informações sobre o tema. Oriente-os a respeitar a fala dos colegas e as opiniões divergentes.
Sugira a cada grupo que apresente os painéis aos colegas usando a estratégia de metodologia ativa Gallery walk. Mais orientações sobre essa estratégia nas páginas XI e XII destas Orientações para o professor. Em seguida, organize uma apresentação dos painéis para a comunidade escolar em uma área comum da escola.
BNCC em contexto
O trabalho com radioatividade, meia-vida e radionuclídeos permite exercitar as habilidades EM13CNT205, EM13CNT301 e EM13CNT303 e a Competência geral 2.
Integrando o conhecimento
Aproveite a reportagem da página 321 para pedir aos estudantes que pesquisem outras reportagens sobre a datação por carbono abre parênteses C fecha parênteses ou por outros isótopos radioativos com a finalidade de estabelecer a idade de rochas, animais, plantas e microrganismos do passado. Em seguida, peça a eles que apresentem as reportagens pesquisadas e o que foi descoberto com base no processo de datação.
Questione-os sobre a importância do processo de datação por radioisótopos em fósseis. Essa atividade é uma oportunidade para integrar com os assuntos do processo evolutivo no componente curricular de Biologia, pois está relacionada com a história evolutiva de diversas espécies. Explique que grande parte do que se sabe sobre os ancestrais e seus descendentes biológicos é comprovada por meio da datação por radioisótopos.
Museus - página 324
Aproveite a abordagem desse boxe para desenvolver um diálogo acerca da importância de museus e sítios arqueológicos para entender a história da humanidade. Esse conteúdo possibilita um trabalho conjunto com a área de Ciências Humanas e Sociais Aplicadas, principalmente com o componente curricular História. Se considerar interessante, acesse o cadastro de museus no link a seguir. Disponível em: https://s.livro.pro/5cmjo3. Acesso em: 3 set. 2024. Nele, é possível obter algumas informações sobre museus brasileiros.
Conexões com… - páginas 326 e 327
Objetivos
- Conhecer a aplicação de técnicas de radiação no controle de insetos.
- Reconhecer a importância das pesquisas científicas para a sociedade.
Orientações
A abordagem dessa seção possibilita o trabalho com o tema contemporâneo transversal Ciência e tecnologia. Além disso, favorece o desenvolvimento das habilidades EM13CNT103 e EM13CNT104, pois incentiva os estudantes a utilizar os próprios conhecimentos sobre o assunto para avaliar os benefícios e riscos, ao ambiente e à saúde, quando se aplica a radioatividade.
Página LXXI
Respostas
a ) Espera-se que os estudantes respondam que, durante o verão, as temperaturas médias são mais elevadas e as chuvas, mais frequentes, favorecendo o acúmulo de água no ambiente e, consequentemente, a proliferação do mosquito, pois ele deposita seus ovos na água limpa e parada.
b) Espera-se que os estudantes reconheçam que isso se refere ao acúmulo de água, o que favorece a proliferação do mosquito. Cuidados com a limpeza e evitar acúmulo de lixo e de água, bem como a remoção da água parada, referem-se aos hábitos da sociedade.
c ) Resposta pessoal. O objetivo dessa questão é incentivar os estudantes a atuar como cidadãos ativos, conhecendo a realidade de onde vivem e propondo soluções viáveis, ao mesmo tempo que divulgam informações à comunidade não escolar.
Acompanhando a aprendizagem
No final do capítulo, averigue os conhecimentos dos estudantes e procure identificar possíveis erros conceituais e ideias de senso comum relacionados à temática.
Levante questões como: O que é radiação? A radioatividade é um fenômeno natural ou criado pelo ser humano? A radioatividade é sempre prejudicial? Que partículas são emitidas na radiação? Quanto tempo um átomo permanece radioativo? O que é um radioisótopo?
Peça aos estudantes que anotem as respostas no caderno com base no que conhecem ou estudaram anteriormente.
Respostas - Páginas 328 e 329
1. a ) Esse tipo de equipamento protege o profissional da ação danosa da radiação. Tendo em vista que ele realiza diversos exames que envolvem radiação ao longo de sua profissão, se não utilizasse tais equipamentos ficaria exposto a um nível muito elevado de radiação, o que causaria graves prejuízos à saúde.
b ) Espera-se que os estudantes respondam que o chumbo abre parênteses P b fecha parênteses é um material de alta densidade, portanto com alta capacidade de bloquear a radiação. Nesse caso, quanto maior a densidade de um material, maior sua eficiência para proteger contra as radiações.
c ) Os estudantes podem citar qualquer outro profissional que trabalhe com radioatividade e energia nuclear, como pesquisadores e trabalhadores dessa área, incluindo médicos, engenheiros e funcionários de usinas nucleares.
2. a ) Os estudantes podem citar objetivos como: aumentar a validade do produto e garantir a qualidade do alimento, uma vez que é capaz de eliminar microrganismos; inibir a brotação de tubérculos; controlar a maturação de frutas; impedir a infestação de insetos; descontaminar e desinfeccionar especiarias; e eliminar parasitas em frutos do mar.
b ) Espera-se que os estudantes respondam que, de maneira geral, todos os tipos de alimento podem
ser irradiados. No entanto, para cada tipo é indicada uma intensidade de radiação e um tempo de exposição específicos, a fim de não exceder o limite considerado seguro para a saúde dos consumidores.
c ) Resposta pessoal. O objetivo dessa questão é capacitar os estudantes a se posicionarem em relação ao assunto e expor, mesmo indiretamente, suas opiniões sobre o uso da radiação em alimentos.
d ) Resposta pessoal. O objetivo dessa questão é levar os estudantes a refletir sobre a proximidade do tema com seu dia a dia. Caso encontrem alimentos irradiados no supermercado, oriente-os a listarem-nos.
6. a ) A equipe médica deve evitar a exposição direta à radiação gama emitida por esse material radioativo, mantendo uma distância segura durante o uso. O cobalto-60 deve ser armazenado e transportado em blindagens de chumbo ou outros materiais densos, a fim de absorver a radiação. Protocolos de segurança estritos devem ser seguidos para minimizar riscos de contaminação e exposição acidental. Dosímetros pessoais são utilizados pela equipe para monitorar constantemente a dose de radiação recebida, e todos os profissionais envolvidos devem ser devidamente capacitados sobre os riscos e procedimentos relacionados ao cobalto-60.
b ) Isso significa que a atividade radioativa do radioisótopo vai diminuir pela metade após 5,27 anos. Essa propriedade afeta diretamente o planejamento do tratamento de radioterapia, pois os médicos precisam considerar o decaimento radioativo do cobalto-60 utilizado na fonte de radiação. Isso pode exigir a troca ou recalibração periódica do equipamento, a fim de manter a dose de radiação adequada ao tratamento do paciente.
Retome o que estudou - página 329
Respostas
1.sobrescrito 238 subscrito 92 U seta para a direita sobrescrito 206 subscrito 82 P b mais 8 sobrescrito 4 subscrito 2 alfa mais 6 sobrescrito 0 subscrito menos 1 beta
2. O objetivo dessa questão é verificar a compreensão dos estudantes sobre a definição de radiação, bem como solicitar a eles que expliquem, por meio de um esquema, o que entenderam a respeito do poder de penetração dos três tipos de radiação estudados ao longo do capítulo.
3. Possíveis respostas: Os estudantes podem citar como benefícios o uso da radiação na Medicina, nas indústrias e na produção de alimentos, listando exemplos para cada um deles. Já no caso dos malefícios, podem mencionar os danos aos seres vivos e ao meio ambiente, pontuando alterações mais específicas, como a indução ao câncer.
4. Resposta pessoal. O objetivo dessa questão é levar os estudantes a fazer um resumo sobre os tipos de eletrólise abordados na unidade, bem como sobre as respectivas aplicações principais nas atividades humanas, por exemplo, na indústria. Espera-se que eles expliquem que na eletrólise ígnea ocorre a fusão de um composto iônico. Já na aquosa, que acontece em solução aquosa, há ionização ou dissociação de alguns compostos em água.
5. O objetivo dessa questão é levar os estudantes a organizar as informações sobre o tema de modo esquemático. Eles devem incluir em seus esquemas a obtenção de carbono-14 pelos seres vivos, o decaimento natural, a meia-vida desse radionuclídeo e como tais dados podem ser usados para a datação de fósseis.
Página LXXII
Unidade 5 A dinâmica das transformações e o ser humano
Os equilíbrios químicos estão presentes em diversos processos industriais e naturais, incluindo os que ocorrem no corpo humano. Nessa unidade, serão estudadas reações reversíveis e aspectos qualitativos e quantitativos envolvidos nos equilíbrios homogêneos e heterogêneos. Os exemplos e exercícios apresentados buscam explorar o cálculo de constantes de equilíbrio, os fatores que influenciam sistemas em equilíbrio e as soluções-tampão. São apresentados também conteúdos referentes ao equilíbrio químico e iônico associado à saúde bucal, além de temas relacionados à hidrólise salina e aos produtos de solubilidade.
Objetivos da unidade
- Compreender o que são equilíbrio químico e equilíbrio iônico e relacioná-los à importância da saúde bucal.
- Analisar os aspectos quantitativos envolvidos em equilíbrios químicos, realizando cálculos com constantes de equilíbrio.
- Verificar os fatores que perturbam um equilíbrio químico e os efeitos disso.
- Compreender o processo de hidrólise salina e relacioná-lo a problemas estomacais.
- Relacionar o produto de solubilidade de uma substância com a concentração de eletrólitos na água e a saturação da solução.
Justificativas
Os conteúdos relacionados a equilíbrio químico e iônico favorecem o desenvolvimento da habilidade EM13CNT101, pois fornecem subsídios para os estudantes analisarem e representarem as transformações e conservações em sistemas que envolvam quantidade de matéria, de energia e de movimento para prever seus comportamentos em situações do dia a dia.
Abertura da unidade - páginas 334 e 335
BNCC em contexto
A abertura da unidade propõe aos estudantes que reflitam sobre uma obra de arte contemporânea, articulando ideias sobre o conceito de equilíbrio. Para isso, é importante diferenciar uma condição de equilíbrio estático, como as rochas imóveis umas sobre as outras, de uma condição de equilíbrio dinâmico, como ocorre com os processos reversíveis.
Essa reflexão permite desenvolver a Competência específica de Ciências da Natureza e suas Tecnologias 1, uma vez que o conhecimento sobre as interações da matéria em sistemas em equilíbrio serve como ponto de partida para a análise de fenômenos naturais e processos tecnológicos. Mais adiante, espera-se que os estudantes possam usar esses conhecimentos para propor soluções para situações-problema sob uma perspectiva científica, em consonância com a habilidade EM13CNT301.
Reserve alguns minutos para que os estudantes possam analisar a imagem da obra de arte apresentada, desenvolvendo a Competência geral 3 e, em seguida, identificar os aspectos citados na abertura. Uma sugestão de dinâmica para esse momento é propor a eles que escrevam suas observações sobre a obra em uma nota autoadesiva e, depois, colem-na na lousa ou em outro painel. Por fim, peça a alguns que se levantem e leiam as notas, pedindo aos demais que as comentem, complementando, discordando ou propondo novas ideias.
Respostas
a ) Resposta pessoal. Espera-se que os estudantes relacionem os processos reversíveis às transformações que podem retornar ao seu estado inicial.
b ) Resposta pessoal. Espera-se que os estudantes reconheçam que, apesar de ser corrigido uma vez, ele não se mantém em equilíbrio, visto que as piscinas geralmente ficam expostas a substâncias que podem alterar seu p H.
Capítulo 18 - Equilíbrio químico - páginas 336 a 348
Objetivos do capítulo
- Analisar o processo de formação de cáries de acordo com as reações químicas que ocorrem na boca.
- Diferenciar reações químicas reversíveis de reações químicas irreversíveis.
- Conceituar equilíbrio químico por meio da reação química de desmineralização dentária.
- Expressar a constante de equilíbrio de uma reação em termos de concentração dos componentes e de suas pressões parciais.
- Diferenciar equilíbrio homogêneo de equilíbrio heterogêneo.
- Identificar fatores que afetam o equilíbrio químico.
- Explicar as perturbações em um sistema em equilíbrio com base no princípio de Le Chatelier.
Páginas 336 a 343
BNCC em contexto
A abordagem das páginas 336 e 337 contribui para o desenvolvimento da habilidade EM13CNT208, pois permite estudar a evolução biológica da dentição humana, além de analisar reações químicas relacionadas à composição dentária e à ocorrência da cárie.
A abordagem da estrutura dos dentes e da formação de cáries contribui para desenvolver a Competência geral 8, além do tema contemporâneo transversal Saúde. Além disso, a análise do processo de formação da cárie incentiva os estudantes a recorrer ao conhecimento científico, contribuindo para desenvolver a Competência geral 1.
Página LXXIII
Ao abordar a evolução da dentição humana na página 336, explique aos estudantes que isso favoreceu a sobrevivência de nossa espécie e que as diferenças encontradas em relação às dentições de outros primatas permitem a alimentação onívora. Explique a eles também que, se não tivéssemos desenvolvido determinadas técnicas, como o cozimento, somente a anatomia bucal não possibilitaria, por exemplo, que nos alimentássemos da carne de grandes animais. Sobre a dentição humana, leia o texto a seguir para a turma.
[…] Uma "assinatura" na anatomia de nossa espécie, muito útil na pesquisa paleontológica, são nossos molares com cinco saliências ou coroas, enquanto os molares dos macacos têm só quatro. Nossas mandíbulas são relativamente pequenas. Esta tendência na diminuição da robustez coincide no registro fóssil ao uso de fogo, e portanto a substituição de uma característica física decorrente da aquisição de técnicas culturais que acabaram por assumir algumas das funções biológicas básicas, como mastigar materiais duros para torná-los digestíveis.
[…]
EVOLUÇÃO humana e aspectos socioculturais. Unesp. Disponível em: https://s.livro.pro/7ke9sr. Acesso em: 30 set. 2024.
Relembre os estudantes de que bactérias, principalmente a Streptococcus mutans, são capazes de colonizar a boca. Elas realizam fermentação, utilizando a sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses como nutriente, e nesse processo produzem ácidos, os quais, em contato com o esmalte, causam danos. Essas bactérias são capazes de sintetizar polissacarídios extracelulares aderentes, com base na sacarose, nos polissacarídios intracelulares e em outros carboidratos fermentáveis.
Tais bactérias contêm uma enzima conhecida como glicosil-transferase, capaz de quebrar a sacarose, transformando-a em moléculas de glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses. Após o rearranjo dessas moléculas, são formados os polissacarídios extracelulares, produtos do metabolismo bacteriano. Eles tendem a se aglutinar, formando a placa dental, que mantém o p H da saliva baixo (caráter ácido) por tempo prolongado. Aproveite para retomar o conceito de p H com os estudantes. Explique a eles que, para que as bactérias sejam capazes de causar cárie dental, é necessário que o p H da saliva esteja abaixo de 5,5.
Comente com os estudantes que os ácidos causam perda de íons no esmalte dos dentes. Se houver continuidade da perda, outros tecidos podem ser atingidos, aumentando a desmineralização. Diga à turma que a dentina é a região mais mineralizada do dente e, assim, a mais afetada pelos ácidos, podendo resultar em necrose tecidual. A cárie também pode alcançar a região da raiz, o que é mais comum em pessoas idosas, fumantes ou que não mantêm boa higiene oral.
A saliva tem em sua composição cálcio e fosfato, auxiliando no processo de mineralização dos dentes. Dessa forma, fatores que reduzem a produção de saliva, como o diabetes e o uso de certos medicamentos, contribuem para a formação de cáries.
Ligado no tema - página 338
Objetivos
- Discutir possíveis fatores envolvidos no aumento da expectativa de vida da população.
- Reconhecer a osteoporose como um problema de saúde que pode ser minimizado com hábitos de vida saudáveis.
- Analisar os fatores de risco para desenvolvimento da osteoporose e discutir maneiras de manejá-los.
Orientações
A abordagem dessa seção favorece o trabalho com os temas contemporâneos transversais Saúde e Processo de envelhecimento, respeito e valorização do idoso, pois mostra uma condição que ocorre com frequência em idosos, a osteoporose.
Após a leitura do texto, inicie comentando sobre a questão do aumento da expectativa de vida da população brasileira trazida na manchete. Proponha aos estudantes que reflitam sobre os fatores que levam a esse aumento.
Explique a eles que a vitamina D é produzida pelo próprio corpo humano e contribui para a absorção de cálcio, fundamental à saúde dos ossos. Quando há deficiência dessa substância, os ossos podem se tornar frágeis e desencadear perdas que podem levar à osteoporose. Além disso, a falta dessa vitamina causa perda de força muscular, um dos motivos de quedas em adultos. Em crianças, a deficiência acentuada de vitamina D pode comprometer o crescimento e causar raquitismo, condição que leva a deformidades ósseas.
Antes de abordar o equilíbrio químico, na página 339, leia o artigo "Analogias no ensino do equilíbrio químico". Disponível em: https://s.livro.pro/985l51. Acesso em: 30 set. 2024. Nele, são sugeridas possíveis analogias para abordar o ensino de equilíbrio químico. Essas analogias podem auxiliar no ensino de conceitos de difícil abstração. Como são situações cotidianas, os estudantes podem visualizar e reelaborar ideias. Além disso, o artigo traz recomendações sobre a formação de concepções alternativas. É importante observar a formação dessas concepções para reconstruir o processo de aprendizagem.
Integrando o conhecimento - página 340
A abordagem com o equilíbrio químico permite o estudo conjunto com a área de Linguagens e suas Tecnologias, principalmente com o componente curricular de Arte, pois o trabalho com materiais alternativos permite o desenvolvimento da linguagem artística. Para auxiliar na explicação do que é e como ocorre o equilíbrio químico, é importante buscar estratégias diferenciadas e didáticas. Para isso, acesse o artigo "Modelagem e o ‘fazer ciência'". Disponível em: https://s.livro.pro/gzgnsp. Acesso em: 11 out. 2024. Nesse artigo, é sugerido o uso de materiais alternativos a fim de construir e reconstruir modelos na reação química. Com esse trabalho, os estudantes, reunidos em grupos, são levados a elaborar ideias com base em modelos que eles mesmos devem montar.
Providencie os materiais, como massa de modelar, palitos, esferas de poliestireno expandido, lápis de cor e tintas guache. Divida a turma em grupos e deixe-os livres para escolher que materiais serão utilizados e como farão seus modelos. Caso não consigam completar a atividade corretamente, oriente-os a reorganizar as ideias e reelaborar seus modelos. É importante incentivar o trabalho em grupo e a troca de ideias entre os estudantes.
Página LXXIV
Na página 341, mostre à turma que, para calcular a constante de equilíbrio, não são consideradas as substâncias na fase sólida e solventes. Explique que as concentrações ou as pressões de vapor dos sólidos e solventes não são omitidas do cálculo dessa constante – por serem valores praticamente constantes, estão englobadas no valor de 'K' subscrito c ou 'K' subscrito p.
Páginas 345 a 347
Durante a discussão sobre o princípio de Le Chatelier, na página 345, explique aos estudantes que eles podem se deparar com outra expressão para indicar o efeito de uma ação externa. Em alguns casos, em vez de dizer que o equilíbrio é favorecido no sentido dos reagentes ou produtos, pode-se afirmar que o equilíbrio é deslocado para a esquerda ou para a direita, respectivamente. Esse termo normalmente é utilizado, pois, em uma equação química, os reagentes estão à esquerda da seta de equilíbrio, e os produtos, à direita.
Ao trabalhar a reação de síntese da amônia, na página 347, solicite aos estudantes que interpretem a reação e o valor do delta H, prevendo o comportamento do equilíbrio sob alteração de temperatura. Associe o aumento da temperatura ao sentido endotérmico, e sua diminuição ao sentido exotérmico da reação química. Explique aos estudantes que o delta H dado com a reação refere-se sempre à reação direta.
Acompanhando a aprendizagem
Como atividade avaliativa, pode-se dividir a turma em quatro grupos, cada um responsável por pesquisar exemplos de reações envolvidas em aplicações cotidianas, científicas ou industriais, em que os fatores a seguir alteram o equilíbrio químico. Grupo 1 – Concentração dos reagentes ou produtos; grupo 2 – Volume ou pressão; grupo 3 – Temperatura; grupo 4 – Catalisador.
Oriente os grupos a explicar a influência de cada fator no equilíbrio em nível submicroscópico. Para isso, eles podem pesquisar e usar diferentes modelos de representação. Se possível, oriente-os também a inserir fotografias ou vídeos demonstrativos.
Respostas - Página 336
4. O objetivo dessa questão é aproximar o conteúdo do cotidiano dos estudantes, levando-os a perceber que esse conteúdo pode ajudá-los a compreender um problema que possivelmente ocorreu com eles ou com pessoas próximas. Os estudantes podem comentar que o tratamento da cárie geralmente é realizado por um dentista, que limpa e esteriliza o dano no dente causado pela cárie e preenche o espaço com um material, geralmente resina ou amálgama.
Respostas - Página 344
1. a )2 N H subscrito 3 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 3 H subscrito 2 abre parênteses g fecha parênteses mais N subscrito 2 abre parênteses g fecha parênteses
b ) 50 minutos
c )'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, H subscrito 2, fim subscrito fecha parênteses elevado ao cubo vezes abre parênteses p início subscrito, N subscrito 2, fim subscrito fecha parênteses, denominador: abre parênteses p início subscrito, N H subscrito 3, fim subscrito fecha parênteses elevado ao quadrado, fim de fração
d )'K' subscrito c é igual a início de fração, numerador: abre colchetes H subscrito 2 fecha colchetes elevado ao cubo vezes abre colchetes N subscrito 2 fecha colchetes, denominador: abre colchetes N H subscrito 3 fecha colchetes elevado ao quadrado, fim de fração
e )'K' subscrito c é igual a início de fração, numerador: abre colchetes H subscrito 2 fecha colchetes elevado ao cubo vezes abre colchetes N subscrito 2 fecha colchetes, denominador: abre colchetes N H subscrito 3 fecha colchetes elevado ao quadrado, fim de fração implica em 'K' subscrito c é igual a início de fração, numerador: abre parênteses 1 vírgula 8 fecha parênteses elevado ao cubo vezes abre parênteses 0 vírgula 6 fecha parênteses, denominador: abre parênteses 0 vírgula 4 fecha parênteses elevado ao quadrado, fim de fração implica em
implica em 'K' subscrito c é igual a início de fração, numerador: 5 vírgula 832 vezes 0 vírgula 6, denominador: 0 vírgula 16, fim de fração portanto 'K' subscrito c é igual a 21 vírgula 87
f ) Favorece a formação dos produtos porque o valor da contante de equilíbrio é maior do que 1, e no gráfico observa-se que em equilíbrio a concentração do reagente é menor do que a dos produtos.
2. a ) As constantes de equilíbrio são:
'K' subscrito c é igual a início de fração, numerador: abre colchetes C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 10 vezes abre colchetes H P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 6, denominador: abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 8, fim de fração e
'K' subscrito c é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 5 vezes abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado ao cubo vezes abre colchetes F elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses fecha colchetes
b ) A fluorapatita é um mineral que apresenta menor solubilidade em relação à hidroxiapatita, portanto tem menor suscetibilidade a ataques ácidos. Isso acarreta menor concentração de íons em solução, fazendo sua constante de equilíbrio de desmineralização ser menor do que a constante de equilíbrio de desmineralização da hidroxiapatita.
3. a )'K' subscrito c é igual a início de fração, numerador: abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes elevado a 4, denominador: abre colchetes H subscrito 2 O abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, fim de fração; 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, H subscrito 2, fim subscrito fecha parênteses elevado a 4, denominador: abre parênteses p início subscrito, H subscrito 2 O, fim subscrito fecha parênteses elevado ao quadrado, fim de fração
b )'K' subscrito c é igual a início de fração, numerador: abre colchetes S O subscrito 3 abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes S O subscrito 2 abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado vezes abre colchetes O subscrito 2 abre parênteses g fecha parênteses fecha colchetes, fim de fração; 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, S O subscrito 3, fim subscrito fecha parênteses elevado ao quadrado, denominador: abre parênteses p início subscrito, S O subscrito 2, fim subscrito fecha parênteses elevado ao quadrado vezes abre parênteses p início subscrito, O subscrito 2, fim subscrito fecha parênteses, fim de fração
c )'K' subscrito c é igual a abre colchetes C O subscrito 2 abre parênteses g fecha parênteses fecha colchetes; 'K' subscrito p é igual a p início subscrito, C O subscrito 2, fim subscrito
d )'K' subscrito c é igual a início de fração, numerador: abre colchetes O abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes O subscrito 2 abre parênteses g fecha parênteses fecha colchetes, denominador: abre colchetes O subscrito 3 abre parênteses g fecha parênteses fecha colchetes, fim de fração; 'K' subscrito p é igual a início de fração, numerador: abre parênteses p subscrito O fecha parênteses vezes abre parênteses p início subscrito, O subscrito 2, fim subscrito fecha parênteses, denominador: abre parênteses p início subscrito, O subscrito 3, fim subscrito fecha parênteses, fim de fração
e )'K' subscrito c é igual a início de fração, numerador: abre colchetes P C l subscrito 3 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes C l subscrito 2 abre parênteses g fecha parênteses fecha colchetes, denominador: abre colchetes P C l subscrito 5 abre parênteses g fecha parênteses fecha colchetes, fim de fração; 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, P C l subscrito 3, fim subscrito fecha parênteses vezes abre parênteses p início subscrito, C l subscrito 2, fim subscrito fecha parênteses, denominador: abre parênteses p início subscrito, P C l subscrito 5, fim subscrito fecha parênteses, fim de fração
f )'K' subscrito c é igual a início de fração, numerador: abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes C O abre parênteses g fecha parênteses fecha colchetes, denominador: abre colchetes H subscrito 2 O abre parênteses g fecha parênteses fecha colchetes, fim de fração; 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, H subscrito 2, fim subscrito fecha parênteses vezes abre parênteses p subscrito C O fecha parênteses, denominador: abre parênteses p início subscrito, H subscrito 2 O, fim subscrito fecha parênteses, fim de fração
g )'K' subscrito c é igual a início de fração, numerador: abre colchetes C l F abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes C l subscrito 2 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes F subscrito 2 abre parênteses g fecha parênteses fecha colchetes, fim de fração; 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, C l F, fim subscrito fecha parênteses elevado ao quadrado, denominador: abre parênteses p início subscrito, C l subscrito 2, fim subscrito fecha parênteses vezes abre parênteses p início subscrito, F subscrito 2, fim subscrito fecha parênteses, fim de fração
4.'K' subscrito c é igual a início de fração, numerador: abre colchetes N O subscrito 2 abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes N O abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado vezes abre colchetes O subscrito 2 abre parênteses g fecha parênteses fecha colchetes, fim de fração é igual a início de fração, numerador: abre colchetes 0 vírgula 3 fecha colchetes elevado ao quadrado, denominador: abre colchetes 0 vírgula 3 fecha colchetes elevado ao quadrado vezes abre colchetes 0 vírgula 2 fecha colchetes, fim de fração é igual a 5
Página LXXV
Capítulo 19 - Equilíbrio iônico e p H - páginas 349 a 365
Objetivos do capítulo
- Conceituar ácido e base segundo as definições de Arrhenius e de Brønsted-Lowry.
- Representar as equações químicas de ionização dos ácidos e dissociação iônica das bases.
- Compreender a reação de autoionização da água e identificar as espécies que participam desse equilíbrio químico.
- Conceituar constante de equilíbrio iônico abre parênteses 'K' subscrito i fecha parênteses e relacionar seu valor com a temperatura.
- Determinar o p H e o p O H de uma solução com base nos valores das concentrações de H subscrito 3 O elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente.
- Identificar os valores de p H e de p O H de materiais presentes no cotidiano.
- Escrever as constantes de acidez e basicidade, 'K' subscrito a e 'K' subscrito b, respectivamente.
- Relacionar e interpretar os valores das constantes 'K' subscrito a e 'K' subscrito b com a força dos ácidos e das bases.
- Conceituar grau de ionização e relacioná-lo à força dos ácidos e das bases.
- Compreender a relação da constante de equilíbrio, grau de ionização e concentração estabelecida pela lei da diluição de Ostwald.
- Entender como ocorre o efeito tampão de uma solução em equilíbrio químico.
- Analisar o efeito tampão que controla o p H do sangue.
BNCC em contexto
A abordagem das páginas 349 e 350 contribui para o desenvolvimento da habilidade EM13CNT104, pois permite avaliar os benefícios e os riscos à saúde, considerando a composição e a reatividade de diferentes materiais e produtos e o nível de exposição a eles, posicionando-se criticamente e propondo soluções individuais e/ou coletivas para seus usos.
O conteúdo sobre a relação da acidez da boca com a desmineralização dos dentes contribui para desenvolver a Competência geral 8, pois incentiva os estudantes a avaliar a alimentação a fim de evitar cáries.
A análise do gráfico da página 349 contribui para desenvolver a Competência geral 4, incentivando os estudantes a obter informações científicas com base em linguagens verbo-visuais.
A discussão sugerida na questão 1 da página 349 contribui para desenvolver a Competência geral 9, pois incentiva os estudantes a respeitar as opiniões dos colegas.
Retome o conteúdo do capítulo anterior tratando da relação entre a ingestão de doces e frutas cítricas e a desmineralização dentária.
Peça aos estudantes que discutam em duplas a questão 1 da página 349. Em seguida, solicite-lhes que compartilhem suas opiniões com o restante do grupo.
Volte ao assunto da reação da desmineralização dentária, lembrando que o íon H subscrito 3 O elevado a início expoente, mais, fim expoente, responsável pelo ataque à hidroxiapatita abre parênteses C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2 fecha parênteses, é proveniente dos ácidos formados na boca. Depois, apresente a definição de Arrhenius para os ácidos e as bases, explicando que essa é uma das definições desses conceitos. Comente que ela é válida somente para os componentes dissolvidos em água abre parênteses H subscrito 2 O fecha parênteses, mas é suficiente para embasar e explicar vários conceitos da Química. Esclareça que as outras definições sobre ácidos e bases são mais abrangentes, porém mais complexas.
Ainda na página 349, equacione na lousa as reações de ionização do ácido clorídrico abre parênteses H C l fecha parênteses formando os cátions H sobrescrito mais ou H subscrito 3 O elevado a início expoente, mais, fim expoente. Explique à turma que o H sobrescrito mais é uma forma simplificada de representar H subscrito 3 O elevado a início expoente, mais, fim expoente e que ambas devem ser conhecidas, pois podem ser usadas em textos sobre o assunto. Equacione também a reação de dissociação iônica do hidróxido de sódio abre parênteses N a O H fecha parênteses e aproveite para retomar com os estudantes a diferença entre a ionização e a dissociação iônica.
Na página 350, explique que na definição de Brønsted-Lowry uma substância é classificada como ácido ou como base de acordo com a forma como participa de uma reação química, enfatizando que não é possível classificá-la isoladamente, ou seja, somente como ácido ou como base.
Escreva na lousa as reações dadas como exemplo, mostrando detalhadamente a perda ou a incorporação do H sobrescrito mais para cada espécie química. Comente que, de acordo com Brønsted-Lowry, a definição de ácido e base se expande para além de soluções aquosas.
Retome a equação química de autoionização da água e escreva a expressão da sua constante de equilíbrio. Peça aos estudantes que observem na página 351 a ilustração que representa essa reação e apresente os valores das concentrações dos íons H sobrescrito mais e O H elevado a início expoente, menos, fim expoente na água pura a 25 graus Celsius.
BNCC em contexto
A abordagem da página 353 contribui para o desenvolvimento da habilidade EM13CNT101, pois permite analisar e representar as transformações e conservações em sistemas que envolvam quantidade de matéria, para prever seus comportamentos em situações cotidianas e em processos produtivos que priorizem o desenvolvimento sustentável e o uso consciente dos recursos naturais.
A questão 5 da página 353 auxilia no desenvolvimento das Competências gerais 1 e 9, pois possibilita aos estudantes relacionar o conhecimento científico às situações do cotidiano e trocar ideias com os colegas sobre essa relação.
Na página 353, explique quais foram os objetivos do químico dinamarquês Søren Peter Lauritz Sørensen (1868-1939) ao criar a escala de p H e defina os potenciais hidrogeniônico e hidroxiliônico.
Integrando o conhecimento
A abordagem dos estudos de Søren Peter Lauritz Sørensen sobre p H, na página 353, permite estabelecer uma relação com o componente curricular de Matemática. Converse com o professor desse componente e, juntos, apresentem aos estudantes algumas informações sobre os logaritmos. Durante a exposição, é importante vocês comentarem que os logaritmos são ferramentas matemáticas que surgiram da necessidade de simplificar cálculos complexos. Desenvolvidos pelo matemático escocês John Napier (1550-1617) no século XVII, eles relacionam exponenciação e logaritmos, permitindo resolver equações exponenciais de forma eficiente. Além disso, os logaritmos têm várias aplicações em diversas áreas do conhecimento, como a Física (medida da intensidade sonora), a Geologia (escala Richter) e a Química, conforme visto nesse capítulo. Além de trabalhar os aspectos inerentes à Química, o uso dos logaritmos promove uma articulação com a habilidade EM13MAT305.
Página LXXVI
Por meio de alguns exemplos dados na escala de p H representada no livro, use as fórmulas deduzidas para apresentar como elas devem ser utilizadas para obter os valores de concentração com base no p H e no p O H, e vice-versa. Se considerar necessário, junto ao professor de Matemática, faça uma breve revisão sobre logaritmos de base 10 e suas propriedades. Mas lembre-se de que o foco não é executar muitos cálculos ou cálculos complexos, e sim garantir que os estudantes compreendam como avaliar os valores dados e relacioná-los com as propriedades dos materiais e soluções.
BNCC em contexto
A abordagem da página 354 contribui para o desenvolvimento da habilidade EM13CNT301, pois incentiva os estudantes a elaborar questões, hipóteses, previsões e estimativas, empregar instrumentos de medição e representar e interpretar modelos explicativos, dados e/ou resultados experimentais para construir, avaliar e justificar conclusões no enfrentamento de situações-problema sob uma perspectiva científica.
Atividade extra
Se a escola dispuser de um peagômetro ou papel indicador universal, sugira aos estudantes uma atividade prática para que testem algumas soluções. Podem ser soluções de produtos do dia a dia, como vinagre, suco de limão e detergente diluído. Essa atividade contribui para desenvolver as Competências gerais 1 e 2, incentivando os estudantes a recorrer aos conhecimentos científicos para analisar situações do cotidiano.
Explique o que são indicadores ácido-base e apresente a imagem que mostra a escala de cores do papel indicador universal.
Explique como funciona o papel de tornassol, dizendo que esse indicador consiste apenas em um teste qualitativo, ao contrário do papel indicador universal.
Ao apresentar os demais indicadores, explique como funciona a faixa ou intervalo de viragem de um indicador. Diga que, de acordo com a faixa de viragem de cada um, eles serão adequados em testes específicos.
Acompanhando a aprendizagem
Peça aos estudantes que elaborem um texto de um parágrafo explicando por que, entre os indicadores citados no capítulo, apenas o papel indicador universal é recomendado para testar a água das piscinas. Verifique se eles compreendem que a água da piscina tem uma faixa de tolerância bastante restrita no seu p H. Portanto, não basta definir sua acidez ou basicidade.
BNCC em contexto
A atividade 3 da página 355 contribui para desenvolver a Competência geral 8 e está relacionada ao tema contemporâneo transversal Saúde, pois possibilita aos estudantes analisar aspectos relacionados à manutenção da própria saúde por meio da alimentação.
Na página 357, explique o conceito de grau de ionização. Em seguida, mostre a relação entre o grau de ionização e a força de ácidos e bases. Apresente e explique a lei da diluição de Ostwald. Mostre que ele também deduziu uma equação que permite calcular a constante de equilíbrio por meio do grau de ionização ou de dissociação.
Conexões com… - páginas 358 e 359
Objetivos
- Analisar os processos de produção da farinha de mandioca, identificando os desafios e as soluções encontradas ao longo do tempo por diferentes povos e culturas.
- Estudar os diferentes métodos utilizados para reduzir o teor de ácido cianídrico na mandioca, como a fermentação, a lavagem e a secagem, compreendendo as reações químicas envolvidas em cada processo.
- Refletir sobre a importância da valorização do conhecimento tradicional e da diversidade cultural, a fim de contribuir para a construção de uma sociedade mais justa e equitativa.
Orientações
A relação entre o ácido cianídrico e a farinha de mandioca é um exemplo de como a etnociência, a história cultural e a Ciência se entrelaçam, permitindo ainda uma abordagem interdisciplinar com o componente curricular de História, enfatizando os aspectos históricos e culturais que envolvem o assunto. Além disso, a discussão sobre o ácido cianídrico abre portas para abordar o tema contemporâneo transversal Educação alimentar e nutricional.
Experimentos simples, como a simulação do processo de produção da farinha de mandioca e a análise do p H em diferentes etapas, podem tornar a aula mais dinâmica e significativa. Além disso, a utilização de recursos visuais, como vídeos, imagens e apresentações, pode auxiliar na compreensão do processo.
Ao final da abordagem dessa seção, é possível propor atividades que incentivem a pesquisa e a elaboração de um infográfico sobre o processo de produção da farinha de mandioca ou de um relatório sobre a história da mandioca no Brasil.
Respostas
a ) Resposta pessoal. Incentive os estudantes a comentar se já provaram algum prato feito com mandioca, como o tucupi e a maniçoba. Pergunte a eles como é o sabor desses alimentos e se gostam deles.
b ) O conhecimento tradicional dos povos indígenas inclui métodos eficazes de preparo da mandioca que garantem sua segurança para o consumo. Essas práticas envolvem várias etapas, como a fermentação da raiz em água corrente, a prensagem da raiz ralada e, por fim, a secagem sobre o fogo. Essas etapas garantem que o ácido cianídrico seja removido, tornando a mandioca segura para o consumo.
Página LXXVII
c ) Embora o ácido cianídrico seja um ácido fraco, o cianeto que ele libera é altamente tóxico porque interfere no transporte de oxigênio no corpo humano. O cianeto se liga fortemente à hemoglobina, proteína responsável por transportar oxigênio dos pulmões para as células, impedindo que ela libere o oxigênio necessário para as células do corpo. Isso pode levar à asfixia celular, causando graves danos e, em casos extremos, pode ser fatal. Portanto, a toxicidade do cianeto está relacionada à sua interferência nas funções biológicas essenciais, e não à força ácida do ácido cianídrico.
d ) Espera-se que os estudantes cheguem a resultados que demonstrem como a mandioca é uma fonte de carboidratos e energia, rica em vitaminas e sais minerais. Essa riqueza nutricional, somada às suas diversas possibilidades de consumo e à sua facilidade de plantio, faz esse alimento garantir a rotina alimentar e a subsistência nutricional de milhares de brasileiros. Por ser uma planta adaptável a diferentes tipos de clima, é um alimento plantado em todas as regiões do país, sobretudo por meio da agricultura familiar e das comunidades indígenas. Essa diversidade regional é demonstrada também pelas variações linguísticas em relação ao nome desse alimento, conhecido também como aipim e macaxeira, a depender da região do país.
BNCC em contexto
A abordagem das páginas 360 e 361 contribui para o desenvolvimento da habilidade EM13CNT306, pois permite avaliar os riscos envolvidos em atividades cotidianas aplicando conhecimentos das Ciências da Natureza para justificar o uso de equipamentos e recursos, bem como comportamentos de segurança, visando à integridade física, individual e coletiva.
Peça aos estudantes que discutam em duplas a questão 6 da página 360 e depois compartilhem suas opiniões com o restante da turma. Essa estratégia contribui para desenvolver a Competência geral 9 ao incentivar a empatia.
Solicite a eles que pesquisem reportagens sobre situações em que atletas perceberam alterações no organismo ao realizar suas atividades em locais de altitude elevada. Em seguida, peça-lhes que expliquem como a diminuição da quantidade de ar disponível em altas altitudes pode aumentar o pH sanguíneo. Depois, fale sobre os sintomas e as consequências da alcalose sanguínea.
Peça aos estudantes que prestem atenção aos termos utilizados para fazer referência ao processo de formação de íons para o ácido e para o sal, no início da página 361. Enfatize o motivo da distinção dos termos, explicando que nos sólidos iônicos os íons se separam da estrutura sólida, dispersando-se pela solução, ou seja, eles se dissociam nos íons que os formam. Já quando um composto molecular é dissolvido em água, separando-se em íons, diz-se que a molécula se ioniza.
Explique como o efeito tampão mantém estável o p H do sangue. Depois, mostre como funciona o tamponamento pelo sistema composto de ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses e hidrogenocarbonato de sódio.
Prática científica - páginas 362 e 363
Objetivos
- Preparar uma solução indicadora de ácido-base, utilizando partes de plantas.
- Verificar a acidez e a basicidade de alguns materiais do cotidiano.
- Comprovar a eficácia da solução indicadora produzida.
- Elaborar uma escala de acidez com a solução indicadora.
Orientações
Nessa investigação, será preparada uma solução indicadora de ácido-base a partir de um extrato vegetal e verificada sua eficácia na identificação do caráter ácido ou básico de alguns materiais do cotidiano. A mudança na coloração do extrato vegetal foi um dos critérios utilizados pelo químico irlandês Robert Boyle (1627-1691) na classificação dos materiais como ácidos ou básicos.
O experimento não oferece perigo para execução, exceto no caso de uso da faca, em que é recomendado que seja feito por um adulto/professor, e do sabão em pó e do limão, que não devem entrar em contato com os olhos. Oriente os estudantes a lavar as mãos após extrair o suco do limão.
O descarte dos resíduos poderá ser feito na pia e em lixo comum. Caso não encontre a beterraba para produção do indicador natural, pode-se usar o suco de repolho-roxo, um recurso de fácil acesso e economicamente viável. Os restos de plantas e alimentos podem ser descartados em lixo orgânico ou utilizados como adubo em uma horta. Os copos plásticos, após serem limpos, podem ser descartados em lixo reciclável ou guardados para reutilização em outras atividades práticas. As soluções testadas podem ser diluídas em água e descartadas na pia.
Respostas
1.
| Material | Cor observada | Caráter ácido-base |
|---|---|---|
|
Vinagre |
Rosa |
Ácido |
|
Solução de bicarbonato de sódio |
Verde |
Básico |
|
Solução de sabão em pó |
Verde |
Básico |
|
Suco de limão |
Rosa |
Ácido |
|
Água |
Rosa |
Neutro |
2. Para substituí-los, poderia ser usado suco de laranja, de maracujá ou de acerola, pois todas são frutas ácidas.
3. Para substituí-los, poderia ser usado soda cáustica, leite de magnésia, leite ou água sanitária.
Página LXXVIII
4. Essas substâncias são do grupo das antocianinas, pigmentos que estão presentes em algumas plantas. No caso da beterraba, é a betanina.
5. Repolho-roxo, uva, açaí, amora, jabuticaba, flores de quaresmeira, cúrcuma, entre outros.
6. Poderia ser usado o papel indicador universal, que é acompanhado de um padrão de uma escala colorida que informa com determinada precisão o valor aproximado de p H, ou ainda o peagômetro digital, que pode informar até duas casas depois da vírgula.
7.p H é igual a menos log abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes implica em 4 é igual a menos log abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes implica em
implica em abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a 10 elevado a menos 4 portanto abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a 10 elevado a menos 4 mol por litro
8.p H mais p O H é igual a 14 implica em 8 mais p O H é igual a 14 implica em p O H é igual a 6
9. Resposta pessoal. Espera-se que os estudantes representem no infográfico situações do cotidiano que são influenciadas pelo p H, como a calagem do solo em plantações, a digestão dos alimentos, o alívio de problemas estomacais e os processos industriais na fabricação de alguns produtos. Caso a divulgação seja na sala de aula, oriente os estudantes sobre o momento e como será feito. No pátio da escola, verifique as normas da escola, o local e o momento mais adequado para a divulgação desse cartaz.
BNCC em contexto
A questão 9 da página 363 promove uma integração com a área de Linguagens e suas tecnologias ao trabalhar a habilidade EM13LP34, incentivando os estudantes a se engajarem em processos significativos de socialização e divulgação do conhecimento, além de desenvolver a Competência geral 9 ao incentivar o trabalho em grupo, a troca de ideias e o respeito às opiniões dos colegas.
Respostas - Página 349
2. O objetivo dessa questão é levar os estudantes a perceber que os casos de cáries reduziram ao longo dos anos. Promova uma discussão sobre esses dados e verifique se eles percebem que os casos diminuíram por causa da melhoria nas políticas de prevenção, que envolvem mais acesso a tratamento dentário, campanhas de conscientização sobre a alimentação, aplicação de flúor nos dentes e no tratamento da água, entre outros fatores.
Respostas - Página 355
2. Concentração de íon hidrônio em mol por litro:
10 mi mol por litro é igual a 10 vezes 10 elevado a menos 6 mol por litro é igual a 1 vezes 10 elevado a menos 5 mol por litro
Aplicando esse valor na fórmula do p H, obtemos:
p H é igual a menos log abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é igual a menos log abre parênteses 10 elevado a menos 5 fecha parênteses é igual a 5 portanto p H é igual a 5
3. a ) Espera-se que os estudantes identifiquem que Salmonella spp., Escherichia coli e Clostridium botulinum são microrganismos prejudiciais à saúde humana, podendo causar doenças como salmonelose, infecção intestinal e botulismo, respectivamente. Já a Saccharomyces cerevisiae é benéfica, podendo ser utilizada na fabricação de pães, bolos e bebidas fermentadas.
b ) No gráfico, observamos que são as faixas abaixo de p H é igual a 4 e acima de p H é igual a 9. Mas, por se tratar de alimentos, o mais adequado para manter o sabor é abaixo de 4, pois os de caráter mais básico causam uma sensação desagradável por serem adstringentes.
c ) Para fabricar vegetais em conservas, pode-se adicionar, por exemplo, soluções ácidas como vinagre (ácido etanoico ou acético diluído).
d ) Espera-se que os estudantes respondam que sim, pois, se em uma faixa esses microrganismos não se desenvolvem adequadamente, diminui-se a propagação dos agentes responsáveis pela decomposição dos alimentos.
Respostas - Páginas 364 e 365
1. Considere que C H subscrito 3 C O O H é igual a H A c e C H subscrito 3 C O O elevado a início expoente, menos, fim expoente é igual a A c elevado a início expoente, menos, fim expoente.
Antes da adição do sal, o equilíbrio presente na solução de ácido etanoico é:
H A c abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas A c elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
Como o ácido etanoico é um ácido fraco e a quantidade de matéria de acetato ionizado é a mesma do íon hidrônio, a equação química que demonstra esse equilíbrio é:
'K' subscrito a é igual a início de fração, numerador: abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes A c elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes H A fecha colchetes, fim de fração é igual a início de fração, numerador: abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes elevado ao quadrado, denominador: abre colchetes H A fecha colchetes, fim de fração implica em abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é igual a
é igual a início de raiz quadrada; 'K' subscrito a vezes abre colchetes H A fecha colchetes fim de raiz quadrada implica em
implica em abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é igual a início de raiz quadrada; 1 vírgula 8 vezes 10 elevado a menos 5 vezes 0 vírgula 3 fim de raiz quadrada é igual a início de raiz quadrada; 5 vírgula 4 vezes 10 elevado a menos 6 fim de raiz quadrada é aproximadamente igual a
é aproximadamente igual a 2 vírgula 3 vezes 10 elevado a menos 3 portanto abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é aproximadamente igual a 2 vírgula 3 vezes 10 elevado a menos 3 mol por litro
p H é igual a menos log abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes implica em p H é igual a menos log abre parênteses 2 vírgula 3 vezes 10 elevado a menos 3 fecha parênteses portanto
portanto p H é aproximadamente igual a 2 vírgula 64
O íon comum é o acetato, e o p H da solução é controlado pelo equilíbrio de dissociação do ácido acético, conforme o quadro.
Aplicando esses dados da tabela na expressão de constante de equilíbrio, temos:
'K' subscrito a é igual a início de fração, numerador: abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes A c elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes H A fecha colchetes, fim de fração implica em 1 vírgula 8 vezes 10 elevado a menos 5 é igual a início de fração, numerador: x vezes abre parênteses 0 vírgula 30 mais x fecha parênteses, denominador: abre parênteses 0 vírgula 30 menos x fecha parênteses, fim de fração
| Equação química | Concentração (inicial) | Concentração antes da adição do sal | Concentração com a adição do sal |
|---|---|---|---|
|
H A c |
0 vírgula 30 mol por litro |
menos x mol por litro |
abre parênteses 0 vírgula 30 menos x fecha parênteses mol por litro |
|
seta dupla |
seta dupla |
seta dupla |
seta dupla |
|
H subscrito 3 O elevado a início expoente, mais, fim expoente |
0 |
mais x mol por litro |
mais x mol por litro |
|
mais |
mais |
mais |
mais |
|
A c elevado a início expoente, menos, fim expoente |
0 |
mais x mol por litro |
abre parênteses 0 vírgula 30 mais x fecha parênteses mol por litro |
Página LXXIX
Nessa atividade, podemos considerar que a causa se refere ao valor muito pequeno da constante de equilíbrio. O valor de x em relação aos valores das concentrações iniciais de outros componentes, como o ácido acético e o acetato, também será pequeno. Assim, podemos considerar que a concentração do íon hidrônio seja igual ao valor da constante, conforme a demonstração a seguir.
'K' subscrito a é igual a início de fração, numerador: abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes A c elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes H A fecha colchetes, fim de fração implica em abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é igual a início de fração, numerador: 'K' subscrito a vezes abre colchetes H A fecha colchetes, denominador: abre colchetes A c elevado a início expoente, menos, fim expoente fecha colchetes, fim de fração implica em abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é igual a
é igual a 1 vírgula 8 vezes 10 elevado a menos 5 vezes início de fração, numerador: abre parênteses 0 vírgula 30 mais x fecha parênteses, denominador: abre parênteses 0 vírgula 30 menos x fecha parênteses, fim de fração é igual a
é igual a 1 vírgula 8 vezes 10 elevado a menos 5 vezes início de fração, numerador: início de expressão riscada; 0 vírgula 3; fim de expressão riscada denominador: início de expressão riscada; 0 vírgula 3; fim de expressão riscada fim de fração é igual a 1 vírgula 8 vezes 10 elevado a menos 5
Dessa forma, podemos obter o p H:
p H é igual a menos log abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes é igual a menos log abre parênteses 1 vírgula 8 vezes 10 elevado a menos 5 fecha parênteses portanto p H é aproximadamente igual a 4 vírgula 74
Então, com a adição do íon comum, o pH da solução subiu de 2,64 para 4,74.
2.alfa é igual a 380 sobre 400 portanto alfa é igual a 0 vírgula 95 ou 95 por cento
10. a ) O ponto de viragem do indicador fenolftaleína acontece em p H acima de 8. Para valores abaixo desse p H, a fenolftaleína permanece incolor, e, na produção dessa bebida, as diferentes etapas ocorrem em meios ácidos.
b )abre colchetes H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes é igual a 0 vírgula 0 1 mol por litro é igual a 10 elevado a menos 2
p H é igual a menos log abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes portanto p H é igual a 2
A concentração de íons H elevado a início expoente, mais, fim expoente na bebida produzida indica um p H inferior ao necessário para ela, que, de acordo com a tabela, deve estar entre 4,1 e 4,6. Isso demonstra que o meio está mais ácido do que deveria; portanto, para corrigir a acidez da bebida produzida, é necessária a adição de soda cáustica alimentar, uma base, a fim de que a concentração de H elevado a início expoente, mais, fim expoente diminua e o p H aumente.
11. Resposta pessoal. Espera-se que os estudantes respondam que Pedro deveria redigir uma resposta que explicasse que, apesar de o metabolismo liberar grande quantidade de gás carbônico, a maior parte dela é eliminada na expiração. Parte do gás que seria convertido em ácido carbônico não alteraria op H sanguíneo, já naturalmente básico, pois o sangue tem uma solução tamponante, que mantém o p H do sangue em uma faixa compreendida entre 7,35 e 7,45, resistindo às variações de p H para cima ou para baixo desses valores.
Capítulo 20 - Hidrólise salina e produto de solubilidade - páginas 366 a 377
Objetivos do capítulo
- Analisar o processo de hidrólise salina e relacionar a composição do sal hidrolisado com a acidez ou com a basicidade da solução final.
- Identificar problemas estomacais causados pela ingestão excessiva de alimentos ácidos ou de medicamentos antiácidos.
- Refletir sobre a necessidade de correção de p H do solo para o cultivo de algumas plantas e compreender como ela é feita.
- Compreender como ocorre a formação de cálculos renais.
- Adotar hábitos alimentares saudáveis, incluindo um nível adequado de hidratação, a fim de prevenir a formação de cálculos renais.
- Relacionar o produto de solubilidade de uma substância com a concentração de eletrólitos na água e com a saturação da solução.
BNCC em contexto
As páginas 366 a 368 abordam o conteúdo de hidrólise salina e o teor de acidez de uma solução após a reação de hidrólise, de acordo com a composição do sal inicial. Com base nisso, o estudante será capaz de identificar como se dá a ação de medicamentos antiácidos no estômago. Também poderá entender que há valores ideais de p H para a plantação de determinados cultivos e conseguirá selecionar o melhor método de tratamento de um solo de acordo com o valor de p H desejado. Essa abordagem contempla a Competência geral 2 e as habilidades EM13CNT101, EM13CNT207, EM13CNT301 e EM13CNT307.
A questão 1 da página 366 incentiva os estudantes a analisar hábitos que podem prejudicar a saúde, contribuindo para desenvolver a Competência geral 8.
Na página 366, há a explicação de que a azia é causada pela acidez excessiva do suco gástrico e de que o antiácido, como o nome sugere, reduz esse excesso. Pergunte aos estudantes se sabem por que o suco gástrico é ácido. Verifique se eles relacionam a acidez excessiva do estômago à digestão de muitos alimentos, especialmente os gordurosos.
Destaque que o ideal é que o valor do p H do suco gástrico fique entre 1,5 e 2. Relembre os estudantes de que isso indica um meio ácido, pois o p H é menor do que 7. O valor 7 representa um meio neutro e, acima de 7, considera-se um meio básico.
Um ponto que pode confundir os estudantes é quanto à formação de ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses pela reação do hidrogenocarbonato com água. Afinal, como a acidez diminui se o ácido carbônico é formado? Relembre que a acidez de uma solução é dada pela concentração de íons H sobrescrito mais (ou H subscrito 3 O elevado a início expoente, mais, fim expoente) em solução, e não de substâncias ácidas, como o ácido carbônico ou o ácido etanoico.
Comente também que o ácido carbônico se decompõe facilmente em água e em dióxido de carbono abre parênteses CO subscrito 2 fecha parênteses, segundo a equação química a seguir.
H subscrito 2 CO subscrito 3 abre parênteses a q fecha parênteses duas meias setas que a pontam em direções opostas H subscrito 2 O abre parênteses l fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses
O p H e a produção de alimentos - página 368
No trabalho com o conteúdo desse boxe, é esperado que os estudantes percebam que os conceitos de hidrólise podem ser aplicados na agricultura. Essa é uma aplicação importante, uma vez que a agricultura é parte essencial do processo de produção de alimentos, além de ser uma atividade amplamente desenvolvida no território brasileiro.
Caso a escola fique próxima à zona rural ou a presença de fazendas no município seja comum, pergunte aos estudantes se já viram o processo de tratamento de solo e, caso tenham presenciado isso, solicite a eles que expliquem como ele é feito.
Se julgar conveniente, reproduza na lousa o quadro apresentado ao final da página 369, mas sem os dados, e solicite aos estudantes que o preencham antes de conferir a página 369. Esse quadro mostra um resumo dos tipos de hidrólise, contribuindo para a revisão dos conteúdos estudados no capítulo.
Página LXXX
Sal da alimentação indígena - página 370
O texto apresenta um panorama sobre a produção tradicional de sal de potássio pelos Waujá, evidenciando relações entre cultura, conhecimento ancestral e práticas sustentáveis. A comparação com a produção industrial do sal comum ressalta a singularidade e os benefícios do método desse povo, que valoriza a saúde e o equilíbrio com o meio ambiente. A preocupação com a perda dessa prática ancestral diante da influência de hábitos alimentares externos é pertinente e convida os estudantes a refletir sobre a importância de preservar essas tradições como patrimônio cultural e fonte de conhecimento para toda a sociedade. A valorização do sal de potássio dos Waujá não se limita à sua composição nutricional, mas evidencia a valorização de uma cultura e a busca por alternativas mais saudáveis e sustentáveis na produção de alimentos. Destaque, contudo, que os sais de potássio também não devem ser consumidos em excesso, principalmente se a pessoa que o consome tiver algum problema renal.
BNCC em contexto
As páginas 372 a 374 abordam o coeficiente de solubilidade de substâncias, trazendo, como exemplo e instrumento de reflexão, a formação de pedras renais, uma condição dolorosa e comum agravada pela ingestão de alimentos ricos em sais. Novamente, os estudantes são incentivados a pensar na importância dos hábitos saudáveis de alimentação. Dessa maneira, são trabalhadas as Competências gerais 2 e 8 e as habilidades EM13CNT101, EM13CNT207 e EM13CNT301.
Além disso, esse tópico possibilita trabalhar os temas contemporâneos transversais Educação alimentar e nutricional e Saúde, pois incentiva a turma a analisar hábitos alimentares que contribuem para evitar a formação de cálculos renais.
A página 372 traz informações sobre a formação de pedras nos rins em razão da ingestão de alimentos ricos em sais e outras substâncias. Aborde esse tema incentivando os estudantes a realizar uma avaliação de seus hábitos alimentares, reforçando a importância de uma dieta equilibrada e aconselhada por um nutricionista.
Ressalte a importância de ingerir água em quantidades adequadas a fim de evitar a formação de cálculos renais.
Compartilhe ideias - página 372
O trabalho com o conteúdo desse boxe contribui para desenvolver as Competências gerais 7 e 9, pois incentiva os estudantes a argumentar com base em informações científicas confiáveis e a respeitar as opiniões dos colegas por meio de uma discussão em grupo.
Organize uma pesquisa em artigos científicos, os quais divulguem informações sobre hábitos e alimentos que favorecem a formação de cálculos renais e os que evitam isso. Além disso, solicite uma pesquisa sobre as bebidas energéticas.
Respostas
a) A água no organismo diminui a concentração dos íons que formam os cálculos, como os de cálcio, fosfato e oxalato. Diminuindo essa concentração, o equilíbrio é alterado, favorecendo a solubilização do sólido.
b) A bebida mais recomendada para evitar a formação de cálculos renais é a água potável, preferencialmente com baixa concentração de íons cálcio e fosfato. Os alimentos recomendados são os naturais, como frutas e hortaliças.
c) Após intensa atividade física, ocorre perda de água e de sais minerais do corpo. Os sais são fundamentais para o funcionamento do organismo, por isso é importante que sejam repostos após praticar exercícios de forma intensa. No entanto, quem não pratica exercícios e ingere bebida isotônica fica com excesso de sais minerais, o que pode favorecer a formação de cálculos renais e de outros problemas de saúde no organismo. Devemos sempre lembrar que os compostos essenciais ao nosso corpo devem estar em equilíbrio, ou seja, nem em excesso nem em falta.
Nas páginas 373 e 374, os estudantes são apresentados às equações de cálculo de coeficiente de solubilidade. Eles podem ter bastante dificuldade nesse assunto, especialmente quando há índices. Por conta disso, resolva, com atenção e cuidado, todos os exemplos das páginas, perguntando-lhes se estão acompanhando. Aborde atentamente a atividade resolvida ao final da página 374.
Atividade extra
Ao trabalhar as soluções insaturadas, saturadas e saturadas com corpo de fundo, na página 374, leve para a sala de aula um béquer, água, cloreto de sódio abre parênteses N a C l fecha parênteses e uma balança portátil. Utilizando o valor da solubilidade do N a C l a 25 graus Celsius de 3 vírgula 6 gramas por mililitro, realize com os estudantes a preparação dos três tipos de solução mencionados.
Acompanhando a aprendizagem
Como atividade avaliativa ao final do capítulo, proponha aos estudantes que produzam um esquema explicitando as diferenças das soluções insaturadas, saturadas e saturadas com corpo de fundo para determinado sal. Para isso, oriente-os a pesquisar a constante de solubilidade do sal e calcular as quantidades das espécies presentes nas respectivas soluções.
Respostas - Página 371
1.
01 ) Correta.
02 ) Incorreta. Na hidrólise do N a N O subscrito 3, que é um sal proveniente de um ácido forte e base forte, é um p H da solução que fica próximo de 7.
04 ) Incorreta. O N a N O subscrito 3 é um sal solúvel em água.
08 ) Correta.
32 ) Incorreta. A hidrólise do brometo de amônio é representada por:
N H subscrito 4 B r abre parênteses s fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 O H abre parênteses a q fecha parênteses mais
mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais B r elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
3. O A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 é um sal formado pela reação de base fraca e ácido forte, assim a solução hidrolisada fica com p H é menor do que 7.
Página LXXXI
O N a C N é um sal formado pela reação de base forte e ácido fraco, então a solução hidrolisada fica com p H é maior do que 7. O K C l é um sal formado pela reação de base forte e ácido forte, assim a solução hidrolisada fica com p H é igual a 7.
Respostas - Páginas 375 a 377
1.'K' subscrito s é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes S O subscrito 4 elevado a início expoente, 2 menos, fim expoente fecha colchetes implica em 'K' subscrito s é igual a abre parênteses x fecha parênteses vezes abre parênteses x fecha parênteses implica em
implica em 4 vírgula 9 vezes 10 elevado a menos 5 é igual a x elevado ao quadrado portanto x é igual a 7 vezes 10 elevado a menos 3 mol por litro
2.'K' subscrito s é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes elevado ao quadrado implica em 'K' subscrito s é igual a abre parênteses x fecha parênteses vezes abre parênteses 2 vezes x fecha parênteses elevado ao quadrado implica em
implica em 'K' subscrito s é igual a 4 vezes x elevado ao cubo implica em 'K' subscrito s é igual a 4 vezes abre parênteses 1 vezes 10 elevado a menos 2 fecha parênteses elevado ao cubo portanto 'K' subscrito s é igual a 4 vezes 10 elevado a menos 6
3.'K' subscrito s é igual a abre colchetes C d sobrescrito 2 mais, fecha colchetes vezes abre colchetes S sobrescrito 2 menos, fecha colchetes implica em 'K' subscrito s é igual a abre parênteses x fecha parênteses vezes abre parênteses x fecha parênteses implica em
implica em 4 vezes 10 elevado a menos 30 é igual a x elevado ao quadrado portanto x é igual a 2 vezes 10 elevado a menos 15 mol por litro
Solubilidade é igual a 2 vezes 10 elevado a menos 15 mol por litro vezes 144 vírgula 5 gramas por mol
portanto Solubilidade é igual a 2 vírgula 89 vezes 10 elevado a menos 13 grama por litro
6.'K' subscrito s é igual a abre colchetes P b elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes N subscrito 3 elevado a início expoente, menos, fim expoente fecha colchetes elevado ao quadrado é igual a x vezes abre parênteses 2 vezes x fecha parênteses elevado ao quadrado é igual a 4 vezes x elevado ao cubo
M início subscrito, P b abre parênteses N subscrito 3 fecha parênteses subscrito 2, fim subscrito é igual a 207 mais 14 vezes 6 é igual a 291 gramas por mol
x é igual a início de fração, numerador: 0 vírgula 23, denominador: M início subscrito, P b abre parênteses N subscrito 3 fecha parênteses subscrito 2, fim subscrito, fim de fração implica em x é igual a início de fração, numerador: 0 vírgula 23, denominador: 291, fim de fração portanto x é igual a 7 vírgula 9 vezes 10 elevado a menos 4 mol por litro
'K' subscrito s é igual a abre colchetes P b elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes N subscrito 3 elevado a início expoente, menos, fim expoente fecha colchetes elevado ao quadrado implica em 'K' subscrito s é igual a abre parênteses x fecha parênteses vezes abre parênteses 2 vezes x fecha parênteses elevado ao quadrado implica em
implica em 'K' subscrito s é igual a 4 vezes x elevado ao cubo implica em 'K' subscrito s é igual a 4 vezes abre parênteses 7 vírgula 9 vezes 10 elevado a menos 4 fecha parênteses elevado ao cubo portanto 'K' subscrito s é aproximadamente igual a 2 vezes 10 elevado a menos 9
7. a )'K' subscrito s é igual a abre colchetes P b elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes I elevado a início expoente, menos, fim expoente fecha colchetes elevado ao quadrado implica em 8 vírgula 4 vezes 10 elevado a menos 9 é igual a x vezes abre parênteses 2 vezes x fecha parênteses elevado ao quadrado
8 vírgula 4 vezes 10 elevado a menos 9 é igual a 4 vezes x elevado ao cubo implica em x é igual a início de raiz; início do radicando, início de fração, numerador: 8 vírgula 4 vezes 10 elevado a menos 9, denominador: 4, fim de fração, fim do radicando, índice 3; fim de raiz é igual a 1 vírgula 28 vezes 10 elevado a menos 3
portanto x é aproximadamente igual a 1 vírgula 28 vezes 10 elevado a menos 3 mol por litro
b )'K' subscrito s é igual a abre colchetes M g elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes elevado ao quadrado implica em 4 vezes 10 elevado a menos 12 é igual a y vezes abre parênteses 2 vezes y fecha parênteses elevado ao quadrado
4 vezes 10 elevado a menos 12 é igual a 4 vezes y elevado ao cubo implica em y é igual a início de raiz; início do radicando, início de fração, numerador: 4 vezes 10 elevado a menos 12, denominador: 4, fim de fração, fim do radicando, índice 3; fim de raiz é igual a 1 vezes 10 elevado a menos 4
portanto y é igual a 1 vezes 10 elevado a menos 4 mol por litro
c )P b I subscrito 2
d )abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 2 vezes y portanto abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 2 vezes 10 elevado a menos 4 mol por litro
p O H é igual a menos log abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a menos log abre colchetes 2 vezes 10 elevado a menos 4 fecha colchetes é igual a 3 vírgula 7
p H mais p O H é igual a 14 implica em p H é igual a 14 menos 3 vírgula 7 é igual a 10 vírgula 3
Retome o que estudou - página 377
Respostas
1. Espera-se que os estudantes respondam que as reações químicas reversíveis tendem ao equilíbrio, que é atingido quando a taxa de reação dos produtos formados por reagentes é igual à taxa de reação dos reagentes formados por produtos.
2. Espera-se que os estudantes respondam que, segundo a definição de Arrhenius, os ácidos são substâncias que, em água, têm capacidade de liberar o cátion hidrogênio abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses e formar o cátion hidrônio abre parênteses H subscrito 3 O elevado a início expoente, mais, fim expoente fecha parênteses; já as bases são substâncias que, em água, são capazes de liberar o ânion hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses. Já na definição de Brønsted-Lowry, os ácidos são espécies químicas (molécula ou íon) capazes de ceder prótons abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses em uma reação, enquanto as bases são espécies químicas (molécula ou íon) que podem receber prótons abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses em uma reação.
3. Espera-se que os estudantes expliquem que hidrólise é uma reação química na qual a água possibilita a quebra ou dissociação de uma substância, levando à formação de ácidos, bases e/ou íons.
Unidade 6 As substâncias e o meio ambiente
A abordagem dessa unidade permite aos estudantes avaliar os benefícios e os riscos ambientais, considerando a composição e a reatividade de diferentes materiais e produtos, como também o nível de exposição a eles, posicionando-se criticamente a respeito do uso de determinadas substâncias. A unidade trabalha os conceitos de ácidos, bases, sais e óxidos, com destaque para as principais características dessas funções e suas relações com o ambiente, salientando questões a respeito da poluição. O capítulo 22 trata de fatores que influenciam a rapidez das reações químicas, dando ênfase à relação dos diferentes fatores que influenciam a camada de ozônio.
A unidade também aborda o que é e como são formados os polímeros naturais e artificiais, além da importância deles para o corpo e suas aplicações no cotidiano.
Objetivos da unidade
- Compreender os diferentes modelos para ácido e base.
- Aplicar os conceitos de ácido e base nos diferentes modelos apresentados.
- Analisar as propriedades dos compostos inorgânicos.
- Conceituar óxidos e reconhecer suas aplicações.
- Identificar fatores que influenciam a velocidade de uma reação química.
- Compreender o que são polímeros e sua importância.
Justificativas
O estudo dessa unidade, com foco em meio ambiente, permite aos estudantes entender alguns fenômenos, como a chuva ácida, ao estudar a formação dos ácidos por meio de diferentes modelos. Além disso, eles podem compreender, sob a perspectiva cinética, como ocorre a redução da camada de ozônio. Ao investigar o funcionamento de máquinas que utilizam combustíveis fósseis, os estudantes podem avaliar os impactos das ações humanas e das políticas ambientais para a sustentabilidade do planeta. Esses temas estão relacionados ao desenvolvimento das habilidades EM13CNT102, EM13CNT104, EM13CNT105, EM13CNT203, EM13CNT301 e EM13CNT309. Ao analisar as propriedades de polímeros artificiais e avaliar a adequação do uso deles em diferentes aplicações, são fornecidos aos estudantes subsídios para propor soluções sustentáveis para o uso cotidiano, contribuindo para o desenvolvimento da habilidade EM13CNT307.
Página LXXXII
Abertura da unidade - páginas 382 e 383
Inicie a abordagem das páginas 382 e 383 questionando os estudantes se já viram em seu cotidiano objetos metálicos enferrujados. Em seguida, questione-os sobre o que acham que provoca a ferrugem e como esse processo pode ser evitado.
Depois, promova uma leitura do texto e a discussão das questões em conjunto, incentivando a troca de ideias, a fim de desenvolver a Competência geral 9.
BNCC em contexto
A abordagem das páginas 382 e 383 contribui para o desenvolvimento da habilidade EM13CNT309, pois apresenta aos estudantes a necessidade de analisar as propriedades dos materiais para avaliar a adequação de seu uso em diferentes aplicações.
Respostas
a ) Resposta pessoal. Espera-se que os estudantes relacionem a aplicação do material polimérico no cano a alguma situação similar do cotidiano, como o revestimento de superfícies metálicas com tintas ou plásticos adesivos.
b ) Resposta pessoal. O objetivo dessa questão é levar os estudantes a refletir sobre como o conhecimento desses fatores pode possibilitar que o ser humano controle a rapidez das transformações químicas, aumentando a taxa de desenvolvimento de transformações desejadas e diminuindo a taxa das que não são desejadas.
Capítulo 21 - Ácidos, bases, sais e óxidos - páginas 384 a 403
Objetivos do capítulo
- Compreender a formação da chuva ácida e propor soluções para reduzir esse problema.
- Compreender as definições de ácidos e bases de acordo com as teorias de Arrhenius, Brønsted-Lowry e Lewis, aplicando-as para analisar as propriedades dos compostos inorgânicos.
- Relacionar os processos de ionização e de dissociação iônica com as propriedades dos compostos de Arrhenius.
- Equacionar as reações de neutralização.
- Caracterizar, classificar e nomear ácidos, bases e sais em meio aquoso.
- Conceituar e nomear óxidos.
- Classificar os óxidos quanto ao tipo de ligação que ocorre entre seus átomos e de acordo com suas propriedades químicas.
- Conhecer as aplicações de alguns óxidos no dia a dia.
BNCC em contexto
Os assuntos das páginas 384 e 385 contribuem para desenvolver a habilidade EM13CNT309, incentivando os estudantes a refletir sobre a dependência de recursos não renováveis, discutindo a necessidade de introduzir alternativas; e a habilidade EM13CNT105, pois os encoraja a analisar os efeitos das interferências humanas nos ciclos biogeoquímicos.
Na página 384, a análise das ações da chuva ácida em um monumento e da influência da poluição na ocorrência da chuva ácida incentiva os estudantes a buscar explicações para fenômenos do cotidiano com base nos conhecimentos científicos, contribuindo para desenvolver a Competência geral 1. Além disso, esse assunto está relacionado ao tema contemporâneo transversal Educação ambiental.
A interpretação da reportagem científica apresentada na página 385 contribui para desenvolver a Competência geral 4.
Durante a leitura do texto da página 384, promova uma conversa entre os estudantes sobre a importância do uso de veículos elétricos e híbridos, levantando as vantagens e as desvantagens de cada um deles. É uma oportunidade também para discutir possíveis alternativas à dependência do transporte de produtos por meio de veículos movidos a diesel e a biodiesel.
Verifique se os estudantes percebem que, por causa da presença do gás carbônico abre parênteses C O subscrito 2 fecha parênteses na atmosfera, a chuva é levemente ácida mesmo em ambientes não poluídos.
Comente com os estudantes que os poluentes atmosféricos são carregados pelo vento, levando a chuva ácida a regiões distantes do local onde são gerados.
BNCC em contexto
O boxe Compartilhe ideias da página 385 incentiva os estudantes a respeitar as opiniões dos colegas e desenvolve a empatia, trabalhando a Competência geral 9. Além disso, contribui para desenvolver as Competências gerais 5, 7 e 9, pois os incentiva a argumentar e discutir com base em fatos e informações confiáveis e a utilizar tecnologias digitais para divulgar informações, colaborando também com o trabalho com a habilidade EM13CNT302.
Compartilhe ideias - página 385
Objetivos
- Reconhecer alguns hábitos que contribuem para a redução da chuva ácida.
- Aplicar o conhecimento científico em situações do cotidiano.
Orientações
Solicite aos estudantes que pesquisem medidas que os governantes poderiam tomar para melhorar a qualidade dos combustíveis e reduzir a circulação de veículos movidos a combustíveis fósseis. Você pode ajudá-los sugerindo fontes de pesquisa confiáveis e discutindo em conjunto com a turma aspectos que devem ser abordados no material que será disponibilizado para a comunidade.
Essa atividade aproxima os conteúdos científicos do cotidiano dos jovens, relacionando a aprendizagem de tais conteúdos a aspectos das culturas juvenis, além de fortalecer o letramento digital, ou seja, a construção da fluência necessária para escolher e utilizar ferramentas e dispositivos digitais. Nesse momento também é oportunizada uma reflexão sobre a disseminação e o tratamento de informações em dispositivos midiáticos, tema que se relaciona com a educação midiática.
Atividade extra
O município de Cubatão, no litoral de São Paulo, sofreu por décadas com as dificuldades advindas da poluição gerada pelo seu polo industrial. Além dos problemas respiratórios que grande parte da população enfrentava, ocorria com frequência a chuva ácida. Organize a turma em grupos e peça aos estudantes que pesquisem como a população e o poder público enfrentaram as questões causadas pela poluição e como ela foi reduzida ao longo dos anos.
Página LXXXIII
Em seguida, peça aos grupos que apresentem o resultado de suas pesquisas e promova uma conversa sobre a importância do protagonismo e da participação da população para avaliar aplicações e implicações políticas, socioambientais e culturais da Ciência ao buscar alternativas aos desafios do mundo contemporâneo. Incentive os estudantes a utilizar recursos do universo das culturas juvenis para divulgarem as conclusões desse debate, como podcasts, blogs, vlogs, entre outros.
Na página 386, explique aos estudantes que muitos ácidos que contêm mais de um hidrogênio abre parênteses H fecha parênteses sofrem ionização em etapas. Escreva na lousa as etapas da ionização do ácido sulfúrico. Comente que, no caso do ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 fecha parênteses, a ionização tem três etapas, pois apresenta três átomos de hidrogênio ionizáveis na molécula.
Acompanhando a aprendizagem
Ao iniciar o trabalho com os ácidos, na página 387, peça aos estudantes que citem exemplos de substâncias e materiais que eles entendem ser ou que tenham ácidos em sua composição, incluindo alimentos.
Eles podem mencionar alimentos como laranja (ácido ascórbico, C subscrito 6 H subscrito 8 O subscrito 6), uva (ácido tartárico, C subscrito 4 H subscrito 6 O subscrito 6), maçã (ácido málico, C subscrito 4 H subscrito 6 O subscrito 5), limão (ácido cítrico, C subscrito 6 H subscrito 8 O subscrito 7), vinagre (ácido acético, C subscrito 2 H subscrito 4 O subscrito 2), azeite (ácido oleico,C subscrito 18 H subscrito 34 O subscrito 2), leite (ácido lático, C subscrito 3 H subscrito 6 O subscrito 3), entre outros. Anote na lousa os alimentos e compostos citados pelos estudantes. Caso mencionem exemplos que não sejam ácidos, anote no canto da lousa e, após a leitura da página 387, retome a discussão sobre a classificação desses compostos. Essa atividade ajuda a fazer uma avaliação diagnóstica dos estudantes sobre o conteúdo.
BNCC em contexto
A abordagem das páginas 388 e 390 contribui para o desenvolvimento da habilidade EM13CNT307, pois permite analisar as propriedades de alguns ácidos e algumas bases, respectivamente, para avaliar a adequação de seu uso em diferentes aplicações e de forma segura.
Ao abordar as bases, na página 389, peça aos estudantes que citem exemplos de substâncias ou materiais que eles acham que sejam bases ou que as tenham em sua composição. Eles podem mencionar sabonetes, sabão em barra, detergentes, entre outros. Anote na lousa os alimentos e compostos citados por eles.
Ao iniciar a abordagem da página 392, levante os conhecimentos prévios dos estudantes sobre o termo sal. Certamente eles citarão o cloreto de sódio abre parênteses N a C l fecha parênteses, mas talvez alguns conheçam outros exemplos. Explique-lhes que esse termo designa não apenas uma substância, mas um grupo de substâncias, que inclui o cloreto de sódio. Uma forma de deixar clara essa diferença é nos referirmos ao cloreto de sódio como sal de cozinha.
Integrando o conhecimento
O assunto que engloba a autenticidade de obras de arte, na página 392, permite uma abordagem interdisciplinar com o componente curricular de Arte. Combine com o professor desse componente para que ele trabalhe a importância e os principais métodos utilizados para comprovar a autenticidade de uma obra de arte. Em seguida, comente com os estudantes que pigmentos obtidos do pau-brasil foram usados até o século XIX, quando passaram a ser substituídos por corantes sintéticos. A extração do pigmento é feita de lascas de madeira fervidas em água, e o líquido, depois de filtrado, recebe uma mistura de sulfato de alumínio e carbonato de sódio abre parênteses N a subscrito 2 C O subscrito 2 fecha parênteses até que seu p H se torne neutro, já que a molécula de urolitina tem caráter levemente ácido.
BNCC em contexto
As páginas 395 e 396 contribuem para o desenvolvimento da habilidade EM13CNT104, pois avaliam os benefícios e os riscos ao ambiente, considerando a composição e a reatividade de diferentes materiais.
A abordagem das causas do branqueamento dos corais está relacionada ao tema contemporâneo transversal Educação ambiental, além de contribuir para desenvolver a Competência geral 7, pois incentiva os estudantes a argumentar com base em informações confiáveis para defender ideias que respeitem e promovam a consciência socioambiental.
Na página 396, explique à turma que, nos óxidos, o átomo de oxigênio geralmente tem carga igual a 2 menos. Assim, a fórmula geral de um óxido pode ser dada por:
E elevado a início expoente, x mais, fim expoente O elevado a início expoente, y menos, fim expoente implica em E subscrito y O subscrito x
em que:
- x mais é a carga associada ao elemento químico mais eletropositivo;
- y menos é a carga associada ao elemento químico oxigênio.
Escreva na lousa alguns exemplos de compostos binários que são óxidos:
- L i elevado a início expoente, 1 mais, fim expoente mais O elevado a início expoente, 2 menos, fim expoente implica em L i subscrito 2 O subscrito 1 portanto L i subscrito 2 O
- C a elevado a início expoente, 2 mais, fim expoente mais O elevado a início expoente, 2 menos, fim expoente implica em C a subscrito 2 O subscrito 2 portanto C a O
Integrando o conhecimento
As informações a seguir sugerem uma abordagem interdisciplinar com o componente curricular de Biologia. Apresente-as aos estudantes.
A emissão excessiva de dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses compromete não apenas a integridade dos corais, mas também a de outros seres vivos marinhos, como os dotados de conchas. Esse efeito é causado pela acidificação dos oceanos.
De acordo com dados de pesquisas realizadas no Instituto Oceanográfico da Universidade de São Paulo (IO-USP), o p H dos oceanos caiu 0,2 unidade desde o início da Revolução Industrial, atingindo atualmente 8,1. Explique aos estudantes que, apesar de essa variação parecer pequena, ela corresponde a um aumento da acidez de cerca de 30%. A presença de dióxido de carbono nos oceanos prejudica a formação de conchas e exoesqueletos, que são compostos por carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses.
Página LXXXIV
Prática científica - página 397
Objetivos
- Observar evidências de uma transformação química.
- Reconhecer o caráter ácido e básico de dois óxidos distintos.
- Compreender o que ocorre nos recifes de corais.
Orientações
Esse experimento simples deve ser bem direcionado, explicando-o passo a passo, pois serve como uma maneira de fazer os estudantes compreenderem o que ocorre com os recifes de corais.
Essa reação apresenta a formação de precipitado de carbonato de cálcio e sua consequente dissolução em presença de excesso de gás carbônico abre parênteses C O subscrito 2 fecha parênteses. Desse modo, é necessário ter cautela ao assoprar a solução de cal virgem, para observar, primeiro, a formação do carbonato sólido e sua posterior dissolução.
C O subscrito 2 abre parênteses g fecha parênteses mais C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C a C O subscrito 3 abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
Caso julgue pertinente, na etapa de formação do precipitado, aqueça levemente o copo e verifique que o precipitado deixará de existir, pois a concentração de gás carbônico diminuirá e, consequentemente, o equilíbrio dado pela equação apresentada é deslocado no sentido dos reagentes.
Essa atividade contribui para desenvolver o pensamento computacional.
Ao final da atividade, a solução formada pode ser descartada na pia. O filtro de papel tem de ser descartado em lixeira de resíduos sólidos não recicláveis. Os outros materiais podem ser lavados e utilizados em outras atividades práticas.
Respostas
1. Ao dissolver óxido de cálcio em água, há a formação de hidróxido de cálcio. Ao expelir gás carbônico em água, ocorre a formação de ácido carbônico. A reação entre o hidróxido de cálcio e o ácido carbônico forma água e um sal praticamente insolúvel, culminando em um aspecto turvo.
Equação química:
C a abre parênteses O H fecha parênteses subscrito 2 abre parênteses a q fecha parênteses mais H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses seta para a direita C a C O subscrito 3 abre parênteses s fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses
Conexões com… - páginas 400 e 401
Objetivos
- Identificar os tipos de radiação da luz solar que prejudicam a pele.
- Entender a diferença entre protetores solares físicos e químicos.
- Reconhecer os componentes de cada tipo de protetor em embalagens comerciais.
Orientações
Esse tópico permite relacionar conceitos de Biologia e Física, além de trabalhar o tema contemporâneo transversal Saúde e desenvolver a Competência geral 8.
Auxilie os estudantes na interpretação do esquema, explicando que, quanto menor o comprimento de onda, mais energética é a radiação.
Explique também que o fator de proteção indica por quanto tempo é possível uma pessoa se expor à luz solar antes de apresentar sinais como vermelhidão. Se, naturalmente, a pele tem vermelhidão após 5 minutos de exposição, um FPS 20 fará esse tempo aumentar 20 vezes. Todavia, para ter eficácia, um protetor solar deve ser usado de forma adequada, tanto em quantidade aplicada quanto no tempo de reaplicação.
Enfatize que, mesmo aplicando protetor solar, é necessário seguir a recomendação de não se expor à luz solar entre 10 horas e 16 horas.
Respostas
a ) A radiação UV, particularmente as radiações UVB e UVA, penetra nas camadas da pele e interage diretamente com o DNA das células. Essa interação pode provocar mutações genéticas, alterando a estrutura do DNA e comprometendo sua replicação durante a divisão celular. Com o passar do tempo, essas mutações podem se acumular, resultando no desenvolvimento de células cancerosas e, eventualmente, câncer de pele. Esse processo mostra como fatores físicos podem induzir mudanças biológicas significativas, ressaltando a importância da proteção contra a exposição excessiva à radiação UV.
b ) O protetor solar físico, também conhecido como inorgânico, contém ingredientes como o dióxido de titânio e o óxido de zinco. Esses componentes criam uma barreira na pele que reflete as radiações UVA e UVB. Entre suas vantagens, destacam-se a proteção imediata e a alta resistência ao suor. Em contraste, os filtros orgânicos (químicos) absorvem a radiação UV e a convertem em calor, que é então dissipado pela pele. Ao contrário do protetor solar físico, que apresenta sua forma cosmética com uma textura viscosa branca, a forma cosmética do protetor químico costuma ser mais agradável, sem deixar a pele esbranquiçada.
c ) A radiação UVB é enfatizada nos protetores solares porque é a principal responsável por queimaduras solares e danos diretos ao DNA, que podem levar ao desenvolvimento de câncer de pele. No entanto, a UVB também é importante para a síntese de vitamina D. A proteção contra a UVB, portanto, precisa ser equilibrada: enquanto é necessário proteger a pele contra os danos causados pela exposição excessiva, uma quantidade controlada de UVB é importante para a produção dessa vitamina, essencial para a saúde óssea e imunológica.
Respostas - Página 391
3. Segundo Arrhenius, ácido é o material que, em água, tem capacidade de liberar o cátion hidrogênio abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses e formar o cátion oxônio abre parênteses H subscrito 3 O elevado a início expoente, mais, fim expoente fecha parênteses. Base é o material que, em água, tem capacidade de liberar ânion hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses. Sal é o produto de uma reação de neutralização entre um ácido e uma base.
Capítulo 22 - Cinética química - páginas 404 a 417
Objetivos do capítulo
- Analisar a reação química de formação de ozônio abre parênteses O subscrito 3 fecha parênteses para compreender por que, apesar de o buraco na camada de ozônio ser um processo natural, é agravado por ações antrópicas.
- Interpretar gráficos da variação de concentração de uma substância ao longo do tempo e relacioná-lo com o conceito de taxa ou rapidez de reação.
- Calcular a taxa de uma reação por meio da variação de concentração.
- Identificar quais propriedades e condições reacionais influenciam na taxa de uma reação.
- Construir equações de lei cinética de reações elementares e não elementares.
Página LXXXV
BNCC em contexto
As páginas 404 e 405 abordam o agravamento dos buracos na camada de ozônio em virtude de ações antrópicas, com base em informações científicas e medidas internacionais para o combate a esse agravamento, contribuindo para desenvolver as habilidades EM13CNT101, EM13CNT104, EM13CNT105, EM13CNT203 e EM13CNT206, além das Competências gerais 1, 2 e 7 e do tema contemporâneo transversal Educação ambiental.
Além disso, a abordagem dos conteúdos dessas páginas permite aprofundar o conhecimento a respeito dos processos moleculares, relacionando-os à termodinâmica e à probabilidade, explorando a Competência geral 2 e as habilidades EM13CNT101, EM13CNT205 e EM13CNT301. Já a análise de gráficos e imagens de satélite incentiva os estudantes a interpretar e obter informações científicas com base em recursos visuais, contribuindo para desenvolver a Competência geral 4.
Ao interpretar as imagens da página 404, questione os estudantes sobre o que a mudança nas cores indica, incentivando-os a explicar o que ocorreu ao longo dos anos. Espera-se que notem a diminuição na concentração de ozônio ao comparar o ano de 1979 com os subsequentes e correlacionem a representação com o "buraco na camada de ozônio". Cores mais frias, como azul e violeta, indicam menor concentração de ozônio, enquanto as mais quentes, como amarelo e vermelho, maior concentração.
Integrando o conhecimento
A página 404 aborda o Protocolo de Montreal, um importante acordo internacional cujo maior objetivo é diminuir o agravamento do buraco na camada de ozônio. Esse conteúdo possibilita o trabalho conjunto com os professores de Ciências Humanas e Sociais Aplicadas, principalmente os dos componentes curriculares de Geografia e Sociologia. Solicite aos professores desses componentes a explicação sobre a abrangência e o significado de acordos internacionais como esse e outros, como a Conferência Rio-92, o Protocolo de Kyoto e o Acordo de Paris. A discussão pode ser dividida em três tópicos: efeitos na produção industrial; impacto e interferência na política; e consciência social.
Ao abordar o complexo ativado, na página 407, diga que não é possível isolá-lo experimentalmente. A energia de ativação, ou energia cinética mínima, é aquela necessária para alcançar esse estado.
Ao abordar a energia cinética mínima, comente que a reação entre os gases hidrogênio abre parênteses H subscrito 2 fecha parênteses e oxigênio abre parênteses O subscrito 2 fecha parênteses libera energia, mas se inicia somente em contato com uma faísca. Escreva na lousa a equação química que representa essa reação: 2 H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses g fecha parênteses.
Explique que a faísca fornece a energia de ativação necessária para que ocorra reação química.
Já a reação do fósforo branco abre parênteses P subscrito 4 fecha parênteses com o gás oxigênio molecular se inicia instantaneamente ao contato entre as duas substâncias. Quando a reação é realizada usando outro alótropo do elemento fósforo, o fósforo vermelho abre parênteses P subscrito n fecha parênteses, é necessário iniciar a reação encostando um bastão aquecido em sua superfície.
Acompanhando a aprendizagem
Apresente-lhes as seguintes questões referentes aos exemplos citados anteriormente.
a ) O que é possível inferir sobre a energia de ativação das duas reações?
b ) Que tipo de energia é fornecida pelo bastão aquecido?
Respostas
a ) É possível inferir que a energia de ativação para a reação do fósforo vermelho com o oxigênio molecular é maior em comparação à reação com o fósforo branco.
b ) O bastão aquecido fornece energia térmica ao sistema.
BNCC em contexto
As páginas 409 e 410 aprofundam o estudo dos fatores que influenciam na taxa de uma reação, incluindo diversos exemplos cotidianos importantes, levando os estudantes a se tornarem aptos a tomar decisões mais assertivas, por exemplo, no que diz respeito ao armazenamento ou preparo de alimentos. Dessa forma, são trabalhadas as Competências gerais 1 e 2 e as habilidades EM13CNT101, EM13CNT205 e EM13CNT301.
A abordagem da temperatura como fator que influencia na rapidez de uma reação química permite trabalhar os temas contemporâneos transversais Saúde e Educação alimentar e nutricional e a Competência geral 8, pois leva os estudantes a refletir sobre aspectos que diminuem o tempo de conservação dos alimentos.
Ao abordar a influência da concentração das substâncias na página 409, evidencie que, quanto menor a concentração de reagentes ou quanto maior a concentração de produtos, menor a rapidez da reação.
Ao mencionar a influência da temperatura, o exemplo mais comum e prático é o de armazenamento de alimentos, que vão para a geladeira visando diminuir a rapidez de sua degradação. Muitos deles, como pães, quando não conservados em geladeiras, têm seu tempo de validade reduzido. Outros, que são mais suscetíveis à ação de microrganismos, devem ser guardados em freezers, onde a temperatura é ainda menor.
Quando um alimento é preparado, a temperatura é comumente usada para acelerar a produção. Isso pode ser constatado, por exemplo, no crescimento de um bolo, que é promovido pelo fermento e acelerado pela alta temperatura do forno.
Ao abordar a influência da superfície de contato, dê exemplos cotidianos relacionados também à alimentação. Ao mastigarmos os alimentos, nossos dentes os trituram, aumentando sua superfície de contato, acelerando a digestão pelo suco gástrico.
Acompanhando a aprendizagem
Peça aos estudantes que avaliem as duas etapas que ocorrem na reação de decomposição do ozônio, catalisada pelo cloro abre parênteses C l fecha parênteses, mostrada ao final da página 410. Solicite-lhes que reproduzam no caderno as duas etapas, determinem a equação global e identifiquem o intermediário de reação, o catalisador, o(s) produto(s) e o(s) reagente(s).
I ) C l vezes abre parênteses g fecha parênteses mais O subscrito 3 abre parênteses g fecha parênteses seta para a direita C l O vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
II ) C l O vezes abre parênteses g fecha parênteses mais vezes O vezes abre parênteses g fecha parênteses seta para a direita C l vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
Página LXXXVI
Resposta
Reação global: O subscrito 3 abre parênteses g fecha parênteses mais símbolo em formato de um ponto, O símbolo em formato de um ponto abre parênteses g fecha parênteses seta para a direita 2 O subscrito 2 abre parênteses g fecha parênteses
Intermediário de reação: C l O símbolo em formato de um ponto; catalisador: C l símbolo em formato de um ponto; produto: O subscrito 2; reagentes: O subscrito 3 e símbolo em formato de um ponto O símbolo em formato de um ponto.
Conversor catalítico automotivo - página 411
Ao abordar o boxe complementar Conversor catalítico automotivo, reforce a relevância de diminuir a emissão de substâncias nocivas na natureza, como a de gases poluidores na atmosfera. Veja mais informações sobre os catalisadores automotivos no artigo disponível em: https://s.livro.pro/nzg96h. Acesso em: 9 out. 2024.
BNCC em contexto
As páginas 412 e 413 tratam da lei cinética das reações químicas e englobam todos os outros conceitos explorados no capítulo. São páginas que exigirão maior domínio matemático e lógico. Dessa forma, são trabalhadas as habilidades EM13CNT205 e EM13CNT301, além de incentivar os estudantes a colocar em prática o pensamento computacional.
Acompanhe pausadamente com os estudantes a atividade resolvida da página 413. Esse tipo de atividade é bastante comum em vestibulares do país, além de ser uma boa forma de exercitar o raciocínio lógico e o pensamento computacional.
Na questão 6 da página 413, para determinar o valor de k da reação química, podemos considerar qualquer um dos valores de concentração fornecidos pelo experimento e substituir na lei cinética.
T subscrito i é igual a k vezes abre colchetes B r O subscrito 3 sobrescrito menos fecha colchetes vezes abre colchetes B r sobrescrito menos, fecha colchetes vezes abre colchetes H subscrito 3 O sobrescrito mais fecha colchetes elevado ao quadrado
Para o experimento 1, temos:
k é igual a início de fração, numerador: T subscrito i, denominador: abre colchetes B r O subscrito 3 elevado a início expoente, menos, fim expoente fecha colchetes vezes abre colchetes B r elevado a início expoente, menos, fim expoente fecha colchetes vezes abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes elevado ao quadrado, fim de fração é igual a início de fração, numerador: 0 vírgula 0 0 12, denominador: abre colchetes 0 vírgula 1 fecha colchetes vezes abre colchetes 0 vírgula 1 fecha colchetes vezes abre colchetes 0 vírgula 1 fecha colchetes elevado ao quadrado, fim de fração portanto
portanto k é igual a 12 litros elevado ao cubo barra mol elevado ao cubo vezes s
Prática científica - páginas 414 e 415
Objetivos
- Comparar a rapidez de algumas reações químicas.
- Identificar fatores que influenciam na rapidez das reações químicas.
Orientações
A Contextualização dessa seção envolve as reações que ocorrem no amadurecimento de frutos climatéricos, além de valorizar os conhecimentos populares. Esses frutos não apresentam aumento na produção do eteno abre parênteses C subscrito 2 H subscrito 4 fecha parênteses e não sofrem maturação após sua colheita. Sendo assim, devem ser colhidos apenas quando reunirem as características adequadas ao consumo.
Apresente aos estudantes exemplos de frutos climatéricos e não climatéricos.
- Climatéricos: banana, maçã, mamão, manga, tomate, abacate e pêssego.
- Não climatéricos: limão, laranja, morango e figo.
Durante a execução da atividade, oriente os estudantes a solicitar ajuda de um responsável para a condução de etapas que envolvam objetos cortantes, nocivos ou que necessitem de aquecimento.
Incentive-os a anotar todas as observações e dúvidas que surgirem no decorrer da realização da atividade, para que possam ser pesquisadas e respondidas posteriormente.
As soluções testadas podem ser descartadas na pia. Os materiais utilizados devem ser limpos e guardados para reutilização em outras atividades práticas; caso sejam descartáveis, é preciso limpá-los e colocá-los em lixos recicláveis.
Respostas - página 408
1. a )T início subscrito, m abre parênteses H subscrito 2 O subscrito 2 fecha parênteses, fim subscrito é igual a início de fração, numerador: símbolo de uma barra vertical quantidade de H subscrito 2 O subscrito 2 consumida símbolo de uma barra vertical, denominador: delta 't', fim de fração implica em
implica em T início subscrito, m abre parênteses H subscrito 2 O subscrito 2 fecha parênteses, fim subscrito é igual a início de fração, numerador: símbolo de uma barra vertical abre parênteses 0 vírgula 375 menos 0 vírgula 625 fecha parênteses mol símbolo de uma barra vertical, denominador: abre parênteses 20 menos 10 fecha parênteses minutos, fim de fração é igual a início de fração, numerador: 0 vírgula 25 mol, denominador: 10 minutos, fim de fração portanto
portanto T início subscrito, m abre parênteses H subscrito 2 O subscrito 2 fecha parênteses, fim subscrito é igual a 0 vírgula 0 25 mol barra minuto
b ) Espera-se que os estudantes respondam que a taxa dessa reação não é constante, ou seja, ela diminui com o tempo. Verifique no quadro que, para intervalos iguais abre parênteses 10 minutos fecha parênteses, a variação da concentração molar de água oxigenada diminui com o tempo.
c ) Espera-se que os estudantes respondam que, como a água oxigenada sofre fotólise, ela deve ser armazenada em frasco escuro ou opaco, evitando a passagem de luz, o que impede a taxa ou a rapidez de sua decomposição.
2. Alternativa d. Por meio do gráfico, pode-se observar que a concentração de A aumenta, partindo do zero, e as concentrações de B e C diminuem. Portanto, B e C são reagentes e A é o produto da reação química.
3. d ) A energia de ativação é a energia absorvida pelos reagentes para levá-los até o complexo ativado e, no exemplo, apresenta valor de 55 quilocalorias.
E subscrito a é igual a E subscrito c menos E subscrito r implica em
implica em E subscrito a é igual a 77 menos 22 é igual a 55 portanto E subscrito a é igual a 55 quilocalorias
e )delta E é igual a E subscrito p menos E subscrito r implica em
implica em delta E é igual a abre parênteses menos 15 fecha parênteses menos abre parênteses 22 fecha parênteses é igual a menos 37 portanto delta E é igual a menos 37 quilocalorias
4. a ) Alternativa correta.
b ) Alternativa incorreta. A reação absorve calor.
c ) Alternativa incorreta. O complexo ativado corresponde ao máximo de energia de uma reação química e por isso apresenta alto valor energético – maior do que o dos produtos e o dos reagentes.
d ) Alternativa incorreta. A energia de ativação tem valor superior ao delta H.
Respostas - Páginas 416 e 417
3. a ) Comparando os experimentos, observa-se que ao dobrar a abre colchetes H C l fecha colchetes ocorre a duplicação da rapidez da reação química. Como 2 elevado a 1 é igual a 2, temos uma reação de primeira ordem.
b ) Ao analisar os dados do experimento, conclui-se que a rapidez da reação é diretamente proporcional à concentração de H C l. Assim, tem-se a lei de reação T subscrito i é igual a k vezes abre colchetes H C l fecha colchetes.
c ) Considerando os dados do experimento 1, temos que abre colchetes H C l fecha colchetes é igual a 0 vírgula 10 mol vezes L elevado a menos 1 e T subscrito i é igual a 1 vírgula 0 1 vezes 10 elevado a menos 3 mol vezes L elevado a menos 1 vezes min elevado a menos 1
Substituindo na lei de reação, temos: 1 vírgula 0 1 vezes 10 elevado a menos 3 é igual a k vezes 0 vírgula 10 implica em k é igual a início de fração, numerador: 1 vírgula 0 1 vezes 10 elevado a menos 3, denominador: 0 vírgula 10, fim de fração implica em k é aproximadamente igual a 0 vírgula 0 1. Portanto, a constante k da taxa de desenvolvimento da reação é k é aproximadamente igual a 0 vírgula 0 1 minuto elevado a menos 1.
Página LXXXVII
6. Ao dobrar a concentração de hipoclorito, mantendo constante a concentração de corante nos experimentos 1 e 2, observa-se que a velocidade da reação foi multiplicada por 2, pois início de fração, numerador: T início subscrito, reação 1, fim subscrito, denominador: T início subscrito, reação 2, fim subscrito, fim de fração é igual a início de fração, numerador: 3 vírgula 4 vezes 10 elevado a 4, denominador: 1 vírgula 7 vezes 10 elevado a 4, fim de fração é igual a 2. Dessa forma, se 2 elevado a n é igual a 2 elevado a 1, o expoente corresponde à ordem da reação em relação ao hipoclorito, que é igual a 1. Se compararmos a concentração de corante com a rapidez da reação nos experimentos 1 e 3, pode-se observar que, de forma semelhante, a rapidez da reação vai ser dobrada com a multiplicação da concentração de corante por 2. Assim, a ordem de reação em relação ao corante é igual a 1. Portanto, a lei de velocidade de reação será T subscrito reação é igual a k vezes abre colchetes C l O elevado a início expoente, menos, fim expoente fecha colchetes elevado a 1 vezes abre colchetes corante fecha colchetes elevado a 1. Já a expressão para determinação do valor de k será:
T subscrito reação é igual a k vezes abre colchetes C l O elevado a início expoente, menos, fim expoente fecha colchetes elevado a 1 vezes abre colchetes corante fecha colchetes elevado a 1 implica em
implica em k é igual a início de fração, numerador: T subscrito reação, denominador: abre colchetes C l O elevado a início expoente, menos, fim expoente fecha colchetes elevado a 1 vezes abre colchetes corante fecha colchetes elevado a 1, fim de fração
8. Ao comparar a concentração de X e a rapidez de reação nos experimentos 1 e 2, constata-se que, ao multiplicar a abre colchetes X fecha colchetes por 3, a rapidez da reação é multiplicada por 9, pois início de fração, numerador: T início subscrito, reação 2, fim subscrito, denominador: T início subscrito, reação 1, fim subscrito, fim de fração é igual a início de fração, numerador: 0 vírgula 225, denominador: 0 vírgula 0 25, fim de fração é igual a 9. Logo, como 9 é igual a 3 elevado ao quadrado, o expoente (ordem) do reagente X nessa reação é 2. Se compararmos a concentração de Y e a rapidez da reação nos experimentos 1 e 3, constatamos que ao multiplicarmos a [Y] por 2, a rapidez de reação é multiplicada por 2. Logo, como 2 é igual a 2 elevado a 1, o expoente (ordem) do reagente Y nessa reação é 1. Assim, a lei cinética corresponde a T subscrito reação é igual a k vezes abre colchetes X fecha colchetes elevado ao quadrado vezes abre colchetes Y fecha colchetes elevado a 1.
Capítulo 23 - Polímeros - páginas 418 a 434
Objetivos do capítulo
- Relacionar alimentos comuns do cotidiano aos macronutrientes neles encontrados.
- Relacionar as características estruturais de polímeros com seus efeitos micro e macroscópicos.
- Identificar compostos e produtos poliméricos naturais e sintéticos do cotidiano.
- Compreender a estrutura polimérica de algumas biomoléculas, como peptídios, proteínas, enzimas e sacarídios.
- Problematizar a produção e o consumo de polímeros sintéticos, engajando-se em hábitos de consumo mais adequados.
- Diferenciar mecanismos de produção de polímeros: polímeros de adição e polímeros de condensação.
- Conhecer os polímeros biodegradáveis e sua importância limitada como substitutos aos polímeros tradicionais.
BNCC em contexto
Nas páginas 418 a 422, são propostas aos estudantes discussões sobre alimentação saudável, relacionando-as com alguns macronutrientes e em quais alimentos eles são encontrados, auxiliando-os em suas escolhas. Além disso, aborda-se o conceito de polímeros e onde são encontrados na natureza, possibilitando que os estudantes conheçam melhor o funcionamento de seus corpos. Essas abordagens contribuem para desenvolver as habilidades EM13CNT104, EM13CNT207, EM13CNT302 e EM13CNT306.
As questões 1 e 2 da página 418 incentivam os estudantes a buscar informações científicas para avaliar a alimentação, contribuindo para desenvolver as Competências gerais 1, 7 e 8. Além disso, a abordagem inicial dessa página está relacionada ao tema contemporâneo transversal Saúde.
Ao abordar as questões 1 e 2 da página 418, conduza uma conversa sobre hábitos alimentares reforçando a importância de uma alimentação nutricionalmente saudável, mas evitando classificar um hábito como "correto" ou "incorreto", pois esses hábitos muitas vezes são afetados por vivências e pelas condições sociais de cada pessoa. No entanto, deixe claro à turma que diversas consequências negativas de um mau hábito alimentar são sérias e devem ser evitadas. Ressalte a importância do acompanhamento especializado, como de nutricionistas e endocrinologistas. Trata-se de um tema que aborda aspectos dos temas contemporâneos transversais Educação alimentar e nutricional e Saúde. Além disso, esse é um assunto sensível, que pode levantar comentários sobre massa corporal. É possível que, na turma, haja estudantes que já tenham sofrido bullying relacionados a isso. Procure evitar que a discussão se encaminhe para isso, porém, caso haja comentários inoportunos, reforce que nem sempre a saúde nutricional está ligada à massa corporal. Há pessoas obesas que têm uma alimentação saudável, praticam exercícios e não têm problemas de saúde associados à nutrição, assim como há pessoas de massas corporais consideradas ideais, que são sedentárias, têm alimentação irregular e sofrem com doenças relacionadas à nutrição.
BNCC em contexto
A abordagem da seção Conexões com... na página 424 contribui para desenvolver a Competência geral 6, incentivando os estudantes a conhecer aspectos do trabalho dos seringueiros e a valorizá-lo. Além disso, desenvolve as Competências específicas de Ciências Humanas e Sociais Aplicadas 2 e 3.
Conexões com… - página 424
Objetivos
- Discutir a importância histórica e econômica da extração do látex.
- Identificar figuras históricas importantes para a manutenção e proteção dos povos originários e suas atividades.
Orientações
Essa seção aborda o látex, um importante polímero que serve de matéria-prima para a fabricação da borracha. Esse conteúdo possibilita trabalho conjunto com os professores de Ciências Humanas e Sociais Aplicadas, principalmente dos componentes curriculares Geografia e História. Coordene com esses professores a explicação sobre o ciclo da borracha no Brasil, nome dado ao período de forte entrada de capital no país graças às exportações de borracha, entre o fim do século XIX e o começo do século XX.
Discutam a importância dessa matéria-prima em diferentes setores da indústria, especialmente nas primeiras décadas da Revolução Industrial. A borracha é um importante produto nas indústrias automotiva, petroquímica, de artigos esportivos, de calçados, da construção civil, de saneamento, de utensílios em geral, entre outras.
Complemente o estudo sobre os conhecimentos dos povos indígenas na extração do látex. Para isso, assista ao vídeo indicado a seguir, que apresenta como um indígena da etnia Huni Kuin, do Acre, faz o ritual da extração da seiva de uma seringueira, mostrando seu respeito e o agradecimento à natureza. O vídeo também apresenta como os conhecimentos são transmitidos dos adultos para as crianças da comunidade. Disponível em: https://s.livro.pro/ozf3b2. Acesso em: 29 ago. 2024.
Página LXXXVIII
Ao citar o ambientalista brasileiro Chico Mendes (1944-1988), ressalte que sua liderança foi reconhecida nacional e internacionalmente, chegando a ser premiado pela ONU por seu importante ativismo. Ele também foi reconhecido como um dos Heróis da Pátria e teve seu nome incluso nesse livro. Além disso, em 2013 foi declarado Patrono Nacional do Meio Ambiente. Acesse o link a seguir e mostre aos estudantes um pouco mais da história e do reconhecimento desse seringueiro. Disponível em: https://s.livro.pro/mrkli7. Acesso em: 26 out. 2024.
BNCC em contexto
O trabalho com as páginas 426 e 427 possibilita o desenvolvimento das Competências gerais 2, 7 e 10, das Competências específicas de Ciências da Natureza e suas Tecnologias 1 e 3 e das habilidades EM13CNT104, EM13CNT206, EM13CNT306 e EM13CNT309, fazendo os estudantes refletirem e debaterem sobre a utilização dos polímeros sintéticos no cotidiano, como o uso do plástico, engajando-os em práticas que viabilizam diminuir os impactos negativos que essa classe de materiais traz à natureza.
Ao abordar a reciclagem dos materiais plásticos, na página 427, questione os estudantes sobre a importância desse processo: "O que aconteceria se todo o plástico produzido no mundo não fosse reciclado?"; "Como ocorre o processo de reciclagem?"; "Vocês destinam corretamente os materiais para a reciclagem?".
Para reforçar a importância de reciclar, mencione as inovações e pesquisas em andamento que buscam desenvolver métodos alternativos para reciclar os polímeros, como a utilização de processos químicos para quebrar as ligações cruzadas e recuperar os monômeros. Traga à tona a relevância da sustentabilidade e a necessidade de encontrar soluções para
Atividade extra
Peça aos estudantes que se organizem entre quatro e seis integrantes por grupo para pesquisarem a respeito dos 5 Rs: Repensar, Recusar, Reduzir, Reutilizar e Reciclar. Oriente-os a buscar informações sobre suas aplicações no cotidiano. Questione-os sobre como podem agir no cotidiano para praticá-los e peça aos grupos que escrevam as ações no caderno. Em seguida, promova um debate com todos os grupos.
minimizar o impacto ambiental dos resíduos de polímeros termorrígidos e termoestáveis. Esse assunto está relacionado ao tema contemporâneo transversal Educação ambiental.
Na análise do quadro da página 428, que apresenta diferentes polímeros plásticos, suas aplicações e os usos após a reciclagem, peça aos estudantes que elenquem quais materiais plásticos estão presentes na sala de aula. Anote na lousa os materiais mencionados e, em seguida, solicite-lhes que façam uma estimativa da massa total desses materiais, identificando as maneiras de aplicar os 5 Rs em determinados itens.
Polímeros biodegradáveis - página 432
Inicie a abordagem do boxe perguntando aos estudantes se já ouviram falar em plástico biodegradável e o que entendem por esse termo. Em seguida, sugira a eles que, em grupos, pesquisem as quantidades de plástico descartadas no ambiente e os impactos causados nos seres vivos. Uma das fontes que os estudantes podem utilizar para obter informações é a matéria presente no site da Universidade Federal do Paraná, disponível em: https://s.livro.pro/ihv7z4. Acesso em: 26 out. 2024. Peça a cada grupo que apresente os resultados da pesquisa e, em seguida, leiam o conteúdo do boxe.
Respostas
a ) Essa substituição ajuda a evitar o acúmulo de material plástico no ambiente, tendo em vista que este é lentamente degradado e pouco reciclado. Ao diminuir esse acúmulo, ajuda-se também a reduzir os danos causados por plásticos convencionais no ambiente, como o consumo de petróleo e o prejuízo aos seres vivos em razão da ingestão desses materiais.
b ) Essas pesquisas podem ajudar a desenvolver novas opções de plásticos biodegradáveis, por exemplo, e outros materiais que causem menos danos ao meio ambiente e aos seres vivos. Além disso, novas tecnologias podem ajudar a aperfeiçoar as propriedades dos materiais biodegradáveis, a fim de ampliar suas aplicações, bem como reduzir o custo de sua produção, que atualmente é considerado mais elevado que o da produção dos plásticos convencionais.
c ) O objetivo dessa questão é fazer que os estudantes e seus familiares façam uma autoavaliação a respeito de seus hábitos em relação ao consumo e ao descarte de plástico. Eles podem citar medidas como evitar o descarte de materiais plásticos, reutilizando-os sempre que possível; fazer o descarte adequado para reciclagem desses materiais; e dar preferência a produtos feitos de materiais retornáveis ou que sejam mais facilmente degradados, como o papel.
d ) O objetivo dessa questão é levar os estudantes a atuar como cidadãos ativos no sentido de orientar e informar a população sobre temas relevantes. Essa atividade os incentiva a divulgar conhecimentos científicos utilizando recursos digitais.
Acompanhando a aprendizagem
Finalize a abordagem sobre os polímeros sintéticos e a forma como são sintetizados trabalhando seu uso de forma consciente por meio das questões a seguir.
- Qual é a quantidade de plástico descartada por uma pessoa por dia?
- Quais são os principais usos do plástico ou de outros tipos de polímeros em materiais do cotidiano?
Dê oportunidade para que todos os estudantes exponham suas ideias e seus entendimentos do assunto. O objetivo dessas atividades é avaliar os estudantes, se conhecem a presença de polímeros sintéticos em muitas atividades e em vários objetos do cotidiano deles.
Página LXXXIX
Respostas - Página 425
2. a ) A lactose é um carboidrato (dissacarídio) e a lactase é uma proteína.
b ) O grupo carboxila de um aminoácido se liga ao grupo amino do outro, na chamada ligação peptídica, com a eliminação de uma molécula de água − reação de condensação.
c ) Enzima é um tipo importante de proteína produzida pelas células do organismo. Elas agem como catalisadores dos processos biológicos, possibilitando que uma reação ocorra com menor energia de ativação.
d ) O objetivo dessa atividade é incentivar os estudantes a buscar informações em fontes confiáveis. Eles podem responder que os sintomas estão relacionados com o sistema digestório, como cólicas e diarreia. Esses sintomas, em geral, melhoram com a interrupção do consumo de produtos lácteos ou consumindo alimentos sem lactose.
3. a ) Cada aminoácido tem características químicas específicas, como carga, polaridade e tamanho, que influenciam como a cadeia polipeptídica se dobra e se organiza. A sequência específica de aminoácidos pode levar à formação de estruturas como hélices ou folhas, comuns em proteínas. Além disso, a combinação e a ordem dos aminoácidos afetam as interações intermoleculares, como ligações de hidrogênio e interações hidrofóbicas, que são essenciais para a estabilidade da proteína. Assim, a ordem dos aminoácidos é importante para que a queratina tenha propriedades como resistência e durabilidade, características típicas de polímeros naturais.
b ) As interações intermoleculares que são importantes para a estabilidade da queratina incluem ligações de hidrogênio, interações hidrofóbicas e, principalmente, ligações de dissulfeto formadas entre grupos de cisteína. Essas interações ajudam a manter a estrutura da queratina estável e conferem resistência a diferentes fatores físicos e químicos. Graças à força dessas interações, a queratina tem uma função protetora e estrutural em tecidos como cabelo e unhas.
c ) A insolubilidade da queratina em água é importante para que essa proteína mantenha a integridade e a resistência de estruturas como cabelo e unhas, que precisam suportar estresses mecânicos e ambientais. Essa característica se dá pela natureza hidrofóbica de muitos dos aminoácidos que compõem a queratina, evitando que a proteína se desfaça em ambientes aquosos. A insolubilidade ajuda a proteger essas estruturas contra a degradação e a perda de funcionalidade.
Respostas - Página 433
2. a ) Reações de condensação.
b )
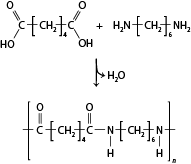
c ) O monômero hexan-1,6-diamina apresenta a função amina. O ácido hexanodioico apresenta a função ácido carboxílico. O ácido benzeno-1,4-dicarboxílico apresenta a função ácido carboxílico. O hidróxibenzeno apresenta a função fenol.
d ) O monômetro que apresenta maior caráter básico é a amina, pois contém átomos de nitrogênio N, que não têm pares de elétrons disponíveis.
3. a )
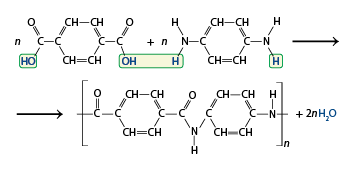
b )
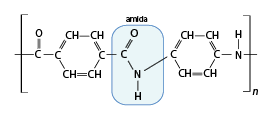
4. a )
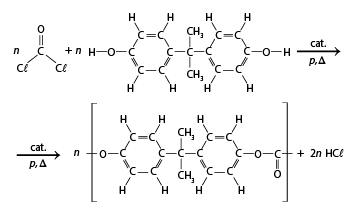
b ) O policarbonato é um plástico transparente, com alta resistência mecânica, usado em janelas de aviões, visores de capacetes e em capas de CDs.
Retome o que estudou - página 434
Respostas
1. O sal cloreto de sódio, quando está em solução aquosa, apresenta íons que não reagem com a água, pois trata-se de um sal formado por ácido e base fortes. Assim, não há hidrólise salina e o p H da solução é igual ao da água, ou seja, neutro. Como não há um meio ácido ou básico, as tiras de papel tornassol vermelho e azul não terão mudança de coloração.
2. Resposta pessoal. Caso os estudantes escolham a concentração como fator que interfere na rapidez, espera-se que digam que esse fator interfere no número de espécies reagentes e na possibilidade de ocorrerem colisões eficazes. A temperatura influencia a energia cinética de um sistema e a probabilidade de a energia de ativação ser atingida. A superfície de contato influencia na área disponível para os reagentes interagirem. Já a presença de catalisadores influencia diminuindo a energia de ativação de uma reação química.
3. Resposta pessoal. O objetivo dessa questão é levar os estudantes a refletir sobre a importância da alimentação variada e equilibrada e a partir dessa reflexão montar um cardápio rico em diferentes tipos de nutrientes. Além disso, é possível verificar a compreensão dos estudantes a respeito do que são polímeros, onde podem ser encontrados e como são formados. Eles podem usar como exemplos os carboidratos e as proteínas.
4. O objetivo dessa questão é fazer os estudantes reconhecerem que a atual relação do ser humano com os materiais, especialmente os polímeros sintéticos, não é sustentável, pois o consumo e o descarte em excesso desses materiais prejudicam o meio ambiente e os seres vivos, inclusive o próprio ser humano. Por outro lado, os polímeros sintéticos são de grande importância na sociedade atual, por sua versatilidade e suas inúmeras aplicações. Os estudantes podem citar: consumo excessivo, descarte incorreto, danos ambientais e usos diversos.