Página 176
UNIDADE 3
MATÉRIA, ENERGIA E AS TRANSFORMAÇÕES NA TERRA
Inúmeros foguetes, com missões espaciais tripuladas, são impulsionados para o espaço por gases expelidos de motores que produzem uma chama controlada. Essa propulsão é capaz de tirar toneladas de matéria do repouso, vencendo o campo gravitacional da Terra até atingir uma altitude predeterminada.
A propulsão de foguetes ocorre por meio de reações entre combustível e oxidante, o que gera grande quantidade de energia e gases. Esses gases se expandem e pressionam as paredes da câmara dos propelentes, provocando o empuxo que faz o foguete se locomover. Geralmente, as temperaturas do local em que ocorrem essas reações variam entre 2.000 e 4.000 graus Celsius, e seus produtos são ejetados por um bocal, o que pode levar o foguete a velocidades de até 15.480 quilômetros por hora.
Esse é um exemplo de transformação da matéria, em que dois materiais interagem entre si para formar uma ou mais substâncias novas. Nesta unidade, serão abordados os diferentes tipos de transformações da matéria, que podem alterar ou não sua composição, a quantidade de matéria envolvida nessas transformações e como a energia está relacionada a elas. Além desses assuntos, também vamos conhecer como a presença de substâncias dissolvidas em líquidos formam soluções e como a presença delas pode influenciar as transformações físicas dessas misturas.
a ) Analisando a fotografia do início do lançamento do foguete, por meio de quais indícios é possível identificar que algum tipo de transformação está ocorrendo na cena?
b ) Você diria que a quantidade de gases formados na queima do combustível e a quantidade de calor gerado podem ser determinados antes do lançamento do foguete?
c ) As missões espaciais são muito importantes para o desenvolvimento científico e tecnológico. Converse com os colegas sobre a importância dessas missões para os seres humanos.
Respostas nas Orientações para o professor.
Nesta unidade, vamos estudar...
- transformações físicas;
- transformações químicas;
- misturas homogêneas (soluções);
- propriedades coligativas;
- estequiometria;
- entalpia.
Página 177

Página 178
CAPÍTULO10
Transformações da matéria
Entre os meses de dezembro e março de cada ano, que marcam o verão no hemisfério Sul, o período do dia é maior do que o da noite e as temperaturas dos dias são mais quentes, além de ser comum ocorrerem chuvas intensas em diferentes regiões do Brasil.

1. Quais são as possíveis razões da inundação retratada na fotografia?
Resposta: Espera-se que os estudantes mencionem que, além das chuvas intensas, o descarte inadequado de resíduos e a impermeabilização do solo em razão da pavimentação, prejudicial à absorção e à drenagem da água das chuvas, podem ter contribuído para a inundação.
O Sol é a estrela do Sistema Solar. Sua luz é composta de radiação ultravioleta, luz visível e radiação infravermelha, chegando aos planetas desse sistema com diferentes intensidades. Ao atingir a superfície terrestre, parte das ondas eletromagnéticas provenientes do Sol, nesse caso a radiação infravermelha, aquece a superfície do planeta e seus componentes bióticos e abióticos, como a água abre parênteses H subscrito 2 O fecha parênteses.
Ao absorver esse tipo de radiação, a água pode mudar seu estado de agregação, ou seja, a disposição de suas moléculas no espaço, passando da fase sólida para a líquida ou da líquida para a gasosa. Essas mudanças podem ser identificadas no ciclo hidrológico e são essenciais para a ciclagem desse composto no ambiente.
O ciclo hidrológico, também conhecido como ciclo da água, é o movimento contínuo da água no ambiente e entre seus componentes e, assim como outros ciclos da natureza, é biogeoquímico. Confira a seguir um esquema do ciclo hidrológico.
Professor, professora: Oriente os estudantes a ler as informações do esquema seguindo a ordem numérica crescente.
Imagem sem proporção e em cores fantasia.
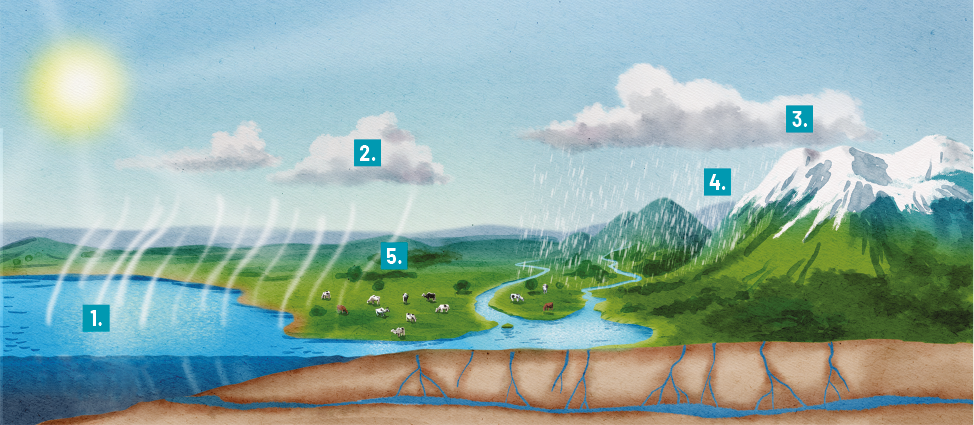
Imagem elaborada com base em: MILLER, G. Tyler; SPOOLMAN, Scott E. Ciência ambiental. 11. ed. São Paulo: Cengage Learning, 2008. p. 56.
Página 179
Imagens desta página sem proporção e em cores fantasia.

1. A radiação infravermelha aquece os corpos de água, resultando na transformação de água líquida em vapor. Os seres vivos também liberam água para a atmosfera por meio da respiração, da transpiração e da liberação de fezes e urina. A água no estado gasoso, por ser menos densa, move-se em direção às camadas superiores da atmosfera.

2. Nas camadas superiores da atmosfera, as baixas temperaturas fazem o vapor de água se condensar em pequenas gotículas de água, que se acumulam nas nuvens.

3. Em condições adequadas, as gotículas de água líquida nas nuvens podem precipitar sob a forma de chuva ou, em casos de temperatura muito baixa, solidificar-se em forma de neve ou granizo.
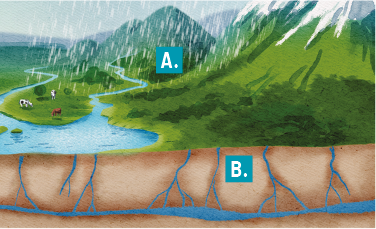
4. A água das chuvas pode escorrer pela superfície (A) ou se infiltrar no solo (B), abastecendo reservatórios de água superficiais e subterrâneos.

5. Os seres vivos absorvem a água do meio e liberam parte dela novamente para o ambiente, enquanto a radiação infravermelha promove a evaporação de parte da água dos corpos de água superficiais, reiniciando o ciclo.
2. Qual é a relação entre umidade do ar e ocorrência de chuvas?
Resposta: A umidade do ar se refere à quantidade de água em determinada área. Sendo assim, de modo geral, quanto maior a umidade do ar, mais vapor de água estará presente na atmosfera e maiores as chances de ocorrência de chuvas.
3. De maneira geral, durante o período do dia, a temperatura nos desertos é elevada, ultrapassando os 40 graus Celsius. Por que as chuvas são pouco frequentes nesses locais?
Resposta: Porque, apesar das temperaturas elevadas, a umidade do ar é muito baixa, em razão da baixa concentração ou ausência de corpos de água e de seres vivos, por exemplo. Dessa maneira, embora a temperatura favoreça a formação de vapor de água, não é suficiente para provocar chuva, tendo em vista os diversos fatores característicos dos desertos.
Página 180
Estudando os estados de agregação da matéria
Professor e professora: Comente com os estudantes que, neste capítulo, será utilizado o termo estado para se referir ao estado de agregação/fase. Enfatize que eles poderão encontrar o termo estado físico sendo utilizado como sinônimo em outros materiais.
No ciclo hidrológico é possível identificar três diferentes estados de agregação da matéria ou fases da matéria: sólido, líquido e gasoso. Esses estados de agregação não são exclusivos da água, podendo também ser encontrados em outros materiais. Na natureza, há outros estados de agregação, no entanto nosso estudo se concentrará apenas nesses três, que são mais comuns no ambiente e em nosso cotidiano.
Imagens desta página sem proporção e em cores fantasia.

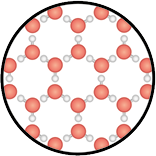
Estado de agregação: sólido.
Nesse estado, que é o de menor energia entre os três estados da matéria citados, os componentes têm mínima mobilidade, mantendo-se unidos. Além disso, as interações entre os componentes são fortes, conferindo resistência física ao material.
- Forma: fixa.
- Volume: fixo.

Professor, professora: Comente com os estudantes que existem outros estados de agregação além dos abordados nesta página, como o plasma e o condensado de bose-einstein. Se julgar conveniente, leia mais informações sobre esses estados de agregação no capítulo 9 do livro digital disponível em: https://s.livro.pro/1c29ro. Acesso: 19 out. 2024.

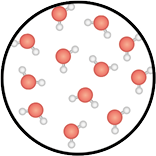
Estado de agregação: líquido.
Esse estado apresenta energia intermediária em relação ao estado de agregação sólido e gasoso. Os componentes de materiais líquidos têm relativa mobilidade e suas interações entre os componentes são mais fracas do que o ocorrido na fase sólida.
- Forma: acomoda-se no recipiente onde se encontra.
- Volume: fixo.
Leão-marinho (Zalophus wollebaeki): pode atingir aproximadamente 2 vírgula 5 metros de comprimento.
Salema (Xenocys jessiae): pode atingir aproximadamente 30 centímetros de comprimento.


Estado de agregação: gasoso.
É o estado de agregação mais energético entre os três citados. Nele, os componentes têm alta mobilidade, portanto as interações entre eles são fracas.
- Forma: tem a forma do recipiente onde se encontra.
- Volume: tem o volume do recipiente onde se encontra.
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 7.
Página 181
4. Por que conseguimos mergulhar em uma piscina com água líquida e não podemos fazer isso se a água estiver congelada?
Resposta: Espera-se que os estudantes respondam que na água líquida as moléculas estão mais espaçadas e têm boa mobilidade, possibilitando que mergulhemos nesse meio. Já no estado sólido, as moléculas que constituem a água estão fortemente unidas, formando uma estrutura rígida que impossibilita o mergulho.
5. Como você estudou anteriormente, as moléculas podem se movimentar. Em sua opinião, essa movimentação interfere na temperatura do material, e vice-versa? Justifique sua resposta.
Espera-se que os estudantes respondam que sim, uma vez que a temperatura mede o grau de agitação das moléculas. Sendo assim, quanto maior a temperatura, maior o grau de agitação de átomos e moléculas, e quanto menor a temperatura, menor o grau de agitação dos componentes do material.
Os átomos e moléculas que compõem os materiais estão em constante movimentação, e a intensidade desse movimento está diretamente relacionada à temperatura do sistema. Quanto maior for a temperatura, maior será a intensidade.
Em baixas temperaturas, a energia cinética das partículas que constituem o material é baixa, por isso elas tendem a se empacotar, mantendo pouca distância umas das outras e adquirindo uma forma rígida e estável.
Por outro lado, quando a temperatura é alta, as partículas se movem intensamente. A energia cinética do sistema torna-se suficientemente forte para romper as interações entre as partículas, aumentando seu livre movimento. É por essa razão que as partículas de um gás ocupam a forma e o volume do recipiente onde se encontram, confinando-se a ele.
Imagens desta página sem proporção e em cores fantasia.
Baixa temperatura

Alta temperatura

Imagens elaboradas com base em: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. F5.
Agora, confira a situação a seguir.


6. Sabendo que as peças apresentadas são as mesmas, em sua opinião, o que ocorreu para que a peça I não pudesse mais passar pela abertura da peça II? Explique sua resposta.
Resposta: Espera-se que os estudantes respondam que pode ter ocorrido contração da peça II e/ou expansão da peça I, impedindo sua passagem pela abertura. Tal condição pode ter ocorrido em decorrência do aumento da temperatura, no caso da expansão, ou da redução da temperatura, no caso da contração.
Um material sólido, quando resfriado ou aquecido, contrai-se e expande-se, respectivamente. Trata-se do mesmo princípio segundo o qual quanto maior for a temperatura, maior será a movimentação das partículas. Na situação apresentada, a peça I foi aquecida, causando afastamento de suas partículas e dilatação da estrutura, embora esse aumento de temperatura não tenha sido suficiente para transformar o metal em líquido. Como resultado, após o aquecimento, a peça I não consegue atravessar a peça II.
Dica
Conheça o simulador de estados da matéria disponível em: https://s.livro.pro/ws5ocv. Acesso em: 30 jul. 2024. Clique em "Estados" para ver o comportamento da matéria nos três principais estados de agregação de acordo com a temperatura do sistema.
Página 182
ATIVIDADES
1. Leia o seguinte trecho de reportagem.
Desmatamento no Matopiba põe em risco o abastecimento de água de mais de 300 cidades
Estudos estimam que vazão dos rios no Cerrado deve cair 34% até 2050 por causa da perda da vegetação nativa
GIRARDI, Giovana. Desmatamento no Matopiba põe em risco o abastecimento de água de mais de 300 cidades. Agência Pública, 22 mar. 2023. Disponível em: https://s.livro.pro/8xnl6a. Acesso em: 30 jul. 2024.
a ) Como as plantas interferem no ciclo hidrológico?
b ) Junte-se a um colega e expliquem como o desmatamento no Matopiba pode interferir no abastecimento de água de algumas cidades. Façam uma pesquisa, se necessário.
Professor, professora: Explique aos estudantes que Matopiba se refere à região que compreende os estados do Maranhão, Tocantins, Piauí e Bahia.
c ) Elaborem um folheto digital com as informações utilizadas para responder a essa atividade, de modo a conscientizar as pessoas sobre a importância da conservação do Cerrado e outros ambientes naturais.
2. Explique, com suas palavras, o que está ocorrendo com o picolé de fruta, entre as imagens A e C, do ponto de vista molecular, ou seja, quanto às suas moléculas constituintes.
A.

B.

C.

Diferentes fases de um picolé de fruta mantido em temperatura ambiente abre parênteses 25 graus Celsius fecha parênteses por certo período.
Respostas das questões 1 e 2 nas Orientações para o professor.
3. Considere um recipiente com capacidade para 5 litros e as situações a seguir.
O recipiente contém 3 litros de água congelada e é fechado hermeticamente, ou seja, impede a entrada e saída de matéria (situação A). Em seguida, o recipiente é aquecido até o gelo se transformar em água líquida (situação B). Por fim, a água é aquecida novamente a ponto de se transformar em água gasosa (situação C).
Qual é o volume que a água ocupa em cada situação?
Resposta: Situação A: 3 litros. Situação B: aproximadamente 3 litros. Situação C: 5 litros.
4. Os perfumes contêm substâncias que se dispersam no ar para que possamos sentir seu cheiro. Essas substâncias estão no estado líquido dentro do frasco e, ao serem aplicadas na pele, passam para o estado gasoso. Explique como a mudança de estado de agregação da matéria ocorre nesse processo, considerando fatores como composição e temperatura.
Resposta: A mudança de estado da matéria nos perfumes, de líquido para gasoso, ocorre em razão da vaporização promovida pela energia térmica presente no ambiente e na própria pele, aliada à composição química das substâncias voláteis do perfume.
5. Leia o texto a seguir e identifique a alternativa em que as palavras correspondam, respectivamente, às letras A, B e C.
Algumas lâmpadas contêm sódio em seu interior. Inicialmente, o sódio está no estado A dentro da lâmpada. Quando a lâmpada é ligada B o metal, levando-o a mudar de estado, passando para o estado C. Nesse processo, as forças de atração envolvendo os átomos de sódio são vencidas, permitindo às partículas que se movimentem emitindo a característica luz amarela.
a ) Gasoso, resfria, líquido.
b ) Sólido, resfria, gasoso.
c ) Líquido, resfria, sólido.
d ) Sólido, aquece, gasoso.
e ) Gasoso, sublima, gasoso.
Resposta: Alternativa d.
Página 183
Transformações físicas
Analise as fotografias a seguir e responda às questões 7 e 8.


7. Em sua opinião, podemos afirmar que a matéria está sofrendo transformação? Em caso afirmativo, essa transformação altera a constituição da matéria?
Resposta: O objetivo desta questão é levantar os conhecimentos prévios dos estudantes a respeito do tema, levando-os a refletir sobre a situação apresentada. Espera-se que eles reconheçam que a situação envolve uma transformação, nesse caso física, e que ela não interfere na constituição da matéria.
8. A situação apresentada envolve ganho ou perda de energia? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que envolve ganho de energia, pois o estado de agregação sólido é menos energético do que o líquido e o gasoso.
A matéria que nos cerca está sujeita a transformações que alteram, em algum nível, a forma como ela se encontra e interage com outros materiais. Essas transformações podem ser físicas ou químicas. As transformações físicas envolvem as mudanças de estado de agregação da matéria ou mudanças de fase. Nesse tipo de transformação, não há mudança na constituição da matéria. Na situação anterior, por exemplo, a água passou por uma transformação física, em que o estado de agregação sólido se alterou para o líquido, porém a matéria permaneceu a mesma: água.
Ou seja, dependendo das condições às quais está sujeita, a matéria pode mudar de fase, passando por uma transformação física. Um dos fatores que interfere nesse tipo de transformação é a temperatura. Assim, as mudanças de fase podem envolver ganho ou perda de energia. Confira o esquema a seguir.
Imagens desta página sem proporção e em cores fantasia.
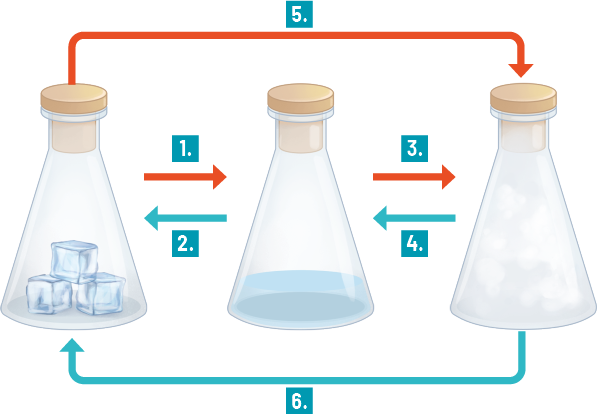
1. Fusão: mudança da fase sólida para a líquida. Nesse processo, os componentes da água sólida, inicialmente agrupados em uma estrutura cristalina, recebem energia suficiente para enfraquecer essa estrutura e ganhar mobilidade, transformando-se em água líquida.

Dica
Os nomes das mudanças de fase são os mesmos para outras substâncias.
Página 184
2. Solidificação: mudança da fase líquida para a sólida. Em baixas temperaturas, a substância líquida perde energia para o meio e interage mais ativamente com moléculas vizinhas, criando a estrutura cristalina do sólido. Esse fenômeno pode ser identificado no orvalho que se forma quando parte da umidade do ar se condensa. Em condições de temperatura igual ou inferior a 0 grau Celsius, o orvalho se solidifica.

3. Vaporização: mudança de estado de agregação líquido para o gasoso. Pode haver três tipos, de acordo com a quantidade de energia recebida: evaporação, ebulição e calefação.
Na evaporação, os componentes da água recebem quantidade de energia suficiente para romper as interações entre eles, garantindo ampla mobilidade. A evaporação é um processo que ocorre a temperaturas relativamente baixas, como a temperatura ambiente, de forma lenta e próximo à superfície do líquido. A água de mares e rios é um exemplo de material que evapora naturalmente. Na ebulição, por outro lado, há ganho superior de energia em toda a extensão do líquido, resultando na formação de bolhas no interior dele, como a água fervida em um fogão. Já a calefação é a passagem repentina da fase líquida à gasosa, quando o material recebe grande quantidade de energia em curto intervalo de tempo. Esse fenômeno pode ser identificado, por exemplo, quando uma gota de água entra em contato com uma frigideira quente.

4. Condensação: mudança do estado de agregação gasoso para o líquido. Nesse processo, as moléculas do material, inicialmente com muita energia e dispersas, perdem energia para o ambiente e se aglomeram na forma líquida.

5. Sublimação: mudança sofrida por uma substância ao passar do estado de agregação sólido para o gasoso.
6. Deposição: mudança sofrida por uma substância ao passar do estado de agregação gasoso para o sólido.
Os fenômenos de sublimação e deposição são menos comuns na natureza.

9. Quais são as mudanças de fase pelas quais a água pode passar durante o ciclo hidrológico?
Resposta: Durante o ciclo hidrológico, a água sofre evaporação, condensação e, em algumas regiões, pode sofrer solidificação e fusão.
Os raios solares são uma importante fonte natural de energia necessária para as transformações físicas da matéria. A radiação infravermelha dos raios solares, ao atingir a matéria presente na superfície terrestre, promove uma vibração mais intensa em suas partículas. O aumento da vibração leva a um afastamento entre os átomos ou as moléculas e aumenta a temperatura do sistema, provocando uma mudança de fase.
Página 185
Substâncias apresentam valores específicos de temperatura, que, em determinadas condições de pressão, possibilitam sua mudança de fase. A temperatura na qual um sólido se transforma em um líquido é chamada de temperatura de fusão abre parênteses T subscrito f fecha parênteses, enquanto a temperatura na qual um líquido se transforma em vapor é chamada de temperatura de ebulição abre parênteses T subscrito e fecha parênteses. Tais temperaturas são determinadas, basicamente, por dois fatores: a pressão sobre o material e a pressão de vapor do material.
A pressão sobre o material se refere à força exercida por fatores externos sobre as partículas da substância. Em condições normais, quando não há mecanismos para controlá-la, a força e a pressão exercidas são a atmosférica. Já a pressão de vapor é exercida pelas moléculas gasosas da própria substância. Quando a pressão de vapor de uma substância líquida se iguala à pressão atmosférica local, o líquido entra em ebulição.
O valor da pressão de gases é normalmente expresso em atmosfera abre parênteses a t m fecha parênteses ou milímetros de mercúrio milímetro de mercúrio. No nível do mar, a pressão atmosférica é igual a 1 a t m ou 760 milímetros Hg. Em altitudes mais elevadas, o ar se torna rarefeito e a pressão atmosférica é menor do que 1 a t m. Assim, nesses locais, menos energia será necessária para que um líquido entre em ebulição e, consequentemente, menor será sua temperatura de ebulição.
Por outro lado, em altitudes menores do que o nível do mar, a coluna de ar é maior e a pressão atmosférica fica acima de 1 a t m. Nesse caso, mais energia é necessária para que um líquido entre em ebulição e, consequentemente, maior será sua temperatura de ebulição.
A pressão no interior de uma panela de pressão, por exemplo, pode ser até duas vezes maior do que a atmosférica, aumentando a temperatura de ebulição da água e, dessa forma, a velocidade de cozimento dos alimentos.

Pressão de vapor
10. Com o passar do tempo, o que ocorre com a água da chuva que forma as poças?
Resposta: Parte da água sofre evaporação. Além disso, em algumas superfícies irregulares em que se formam essas poças, a água pode permear o solo.

A água líquida contida em um recipiente aberto tende a evaporar. Quanto maior a temperatura do ambiente, maior a velocidade de evaporação.
11. Em recipientes fechados pode ocorrer evaporação de um líquido?
Resposta: Sim. O líquido sofre evaporação, porém fica retido no recipiente.
12. O que ocorre ao deixarmos uma garrafa de água quase cheia lacrada por algum tempo recebendo luz solar?
Resposta: Com o passar do tempo, parte da água evapora e se condensa no interior da garrafa.
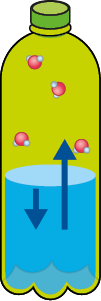
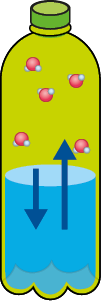
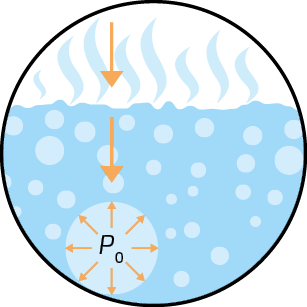
Mesmo se a água estiver em uma garrafa hermeticamente fechada (um sistema que impede a entrada e saída de matéria), algumas moléculas passam do estado líquido para o gasoso (evaporação). O esquema a seguir representa de forma simplificada esse processo de evaporação.
Imagens desta página sem proporção e em cores fantasia.
A.
B.
C.

D.

Representação do processo de evaporação de um líquido, em um sistema fechado, a certa temperatura, até a sua saturação.
A. Início do processo de evaporação.
B. Mais moléculas de água evaporam.
C. O ar está saturado de vapor de água.
D. Para uma molécula de água evaporar, outra se condensa (equilíbrio).
Página 186
Quando há equilíbrio entre as fases líquida e gasosa, ou seja, quando os valores das velocidades de evaporação e condensação se igualam, ocorre o equilíbrio dinâmico, havendo passagem constante de partículas de uma fase para a outra. Enquanto houver esse equilíbrio dinâmico entre as fases, a pressão da fase gasosa sobre a superfície da fase líquida se manterá constante, sendo denominada pressão máxima de vapor do líquido.
A pressão de vapor de uma substância é a pressão da fase gasosa dela quando está em equilíbrio dinâmico com o líquido (ou sólido) correspondente.
Influência da temperatura na pressão de vapor de uma substância
Podemos analisar o comportamento da pressão de vapor da água com a variação de 0 grau Celsius a 100 graus Celsius, por exemplo. Para isso, experimentalmente, é possível organizar os dados em uma tabela e representá-los por meio de um gráfico, como o apresentado a seguir.
| Temperatura abre parênteses grau Celsius fecha parênteses | Pressão milímetro de mercúrio |
|---|---|
|
0 |
4,6 |
|
5 |
6,5 |
|
10 |
9,2 |
|
15 |
12,8 |
|
20 |
17,5 |
|
25 |
23,8 |
|
30 |
31,8 |
|
35 |
42,2 |
|
40 |
55,3 |
|
45 |
71,9 |
|
50 |
92,5 |
|
55 |
118,0 |
|
60 |
149,4 |
|
65 |
187,5 |
|
70 |
233,7 |
|
75 |
289,1 |
|
80 |
355,1 |
|
85 |
433,6 |
|
90 |
525,8 |
|
95 |
633,9 |
|
100 |
760,0 |
Fonte de pesquisa: CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Porto Alegre: AMGH, 2013. p. 199.
Pressão de vapor da água com variação de temperatura
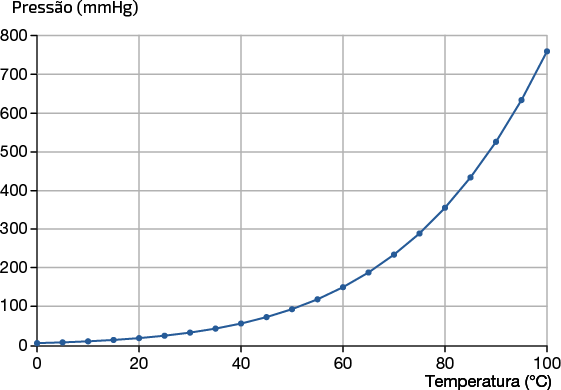
Fonte de pesquisa: CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Porto Alegre: AMGH, 2013. p. 199.
13. O que ocorre com a pressão do vapor da água quando a temperatura aumenta?
Resposta: Com o aumento da temperatura, a pressão do vapor da água também aumenta.
As medidas de pressão de vapor mostram que quanto maior a temperatura de um líquido, maior sua pressão de vapor.
A uma dada temperatura, a pressão de vapor de um líquido não depende do volume desse líquido nem do formato do recipiente que o contém.
14. Em sua opinião, o valor da pressão de vapor de diferentes substâncias à mesma temperatura é o mesmo?
Resposta: Espera-se que os estudantes respondam que, à mesma temperatura, diferentes substâncias apresentam diferentes pressões de vapor, pois elas têm diferentes forças de interações entre as suas partículas.
Na representação gráfica da página a seguir, temos as medidas de pressão de vapor de diferentes substâncias em diferentes temperaturas.
Página 187
Imagens desta página sem proporção.
Variação da pressão de vapor de algumas substâncias em relação à temperatura
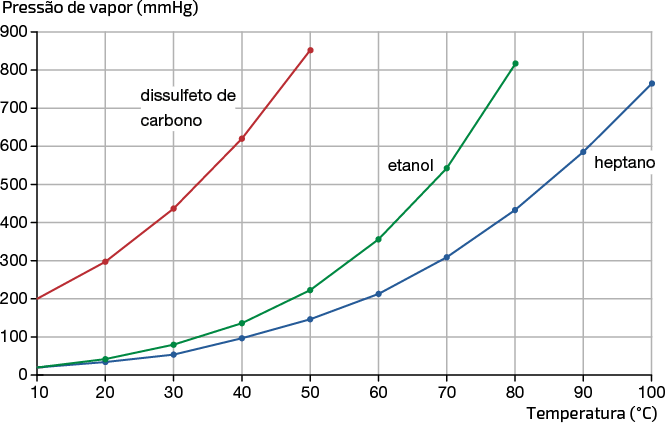
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 529.
Verificando a representação dos dados no gráfico, podemos concluir que:
- a pressão de vapor de um líquido aumenta com o aumento da temperatura;
- à mesma temperatura, líquidos diferentes têm pressões de vapor diferentes.
Dica
Quanto maior a temperatura de uma substância, maior a sua pressão de vapor.
Sublimação e deposição
Alguns sólidos, como o gelo-seco, a naftalina e o iodo molecular, sofrem sublimação e, portanto, também possuem pressão de vapor.
fase sólida expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, equilíbrio dinâmico, fim do detalhe acima fase gasosa
Assim, nesses casos, as velocidades de sublimação e deposição são iguais.


Considere a seguinte situação: despejam-se 10 centímetros cúbicos abre parênteses 10 mililitros fecha parênteses de álcool etílico abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses em um pires, 10 centímetros cúbicos de éter comum (etoxietano, C subscrito 4 H subscrito 10 O) em outro pires e em um terceiro despejam-se 10 centímetros cúbicos de água abre parênteses H subscrito 2 O fecha parênteses.
Em determinado momento, os três pires ficarão vazios, pois, de acordo com o que estudamos, os líquidos sofrem o processo de evaporação. Fazendo uma relação com a pressão de vapor, podemos prever qual dos três pires esvaziará primeiro, ou seja, qual dos três líquidos vai evaporar totalmente antes dos outros dois.
15. Em sua opinião, qual dos três pires ficará vazio primeiro?
Resposta: O pires que continha éter.
16. Qual é a possível relação entre a evaporação e a pressão de vapor de um líquido?
Resposta: Quanto maior a evaporação de um líquido, maior sua pressão de vapor.
Na tabela, apresentamos as pressões de vapor dos três líquidos – álcool etílico, éter comum e água – à temperatura de 20 graus Celsius.
| Substância | Pressão de vapor |
|---|---|
|
Álcool etílico |
45 milímetros Hg |
|
Éter comum |
441 milímetros Hg |
|
Água |
17 vírgula 5 milímetros Hg |
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 518.
Página 188
17. Considerando a relação entre pressão de vapor e interações intermoleculares, o que podemos concluir a respeito da pressão de vapor do éter comum, sendo ela a mais elevada?
Resposta: As interações intermoleculares entre suas moléculas são mais fracas, logo, o éter é o mais volátil.
A ordem decrescente de volatilidade das três substâncias do quadro é éter comum > álcool etílico > água. Por isso, na situação, o éter comum evaporou mais rapidamente. Assim, quanto mais volátil uma substância, maior a sua pressão de vapor. Consequentemente, quanto mais volátil, menores as interações intermoleculares.
A pressão de vapor e a temperatura de ebulição
Num dado momento, ao aquecermos um líquido em um recipiente aberto, ele ferve, ou seja, entra em ebulição. Isso ocorre quando a pressão de vapor do líquido se iguala à pressão atmosférica local. Ao nível do mar, como a pressão atmosférica é igual a 1 a t m, o líquido entrará em ebulição quando a sua pressão de vapor se igualar à pressão atmosférica.
Variação da pressão de vapor de algumas substâncias em relação à temperatura e à temperatura de ebulição
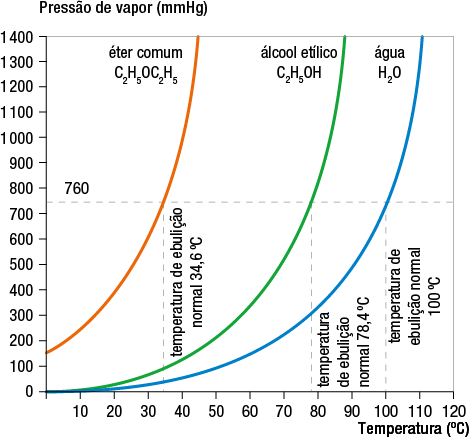
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 518.
Considerando a pressão de vapor da água, do álcool etílico e do éter comum, apresentadas anteriormente, podemos representar por meio de um gráfico a variação de temperatura e indicar a temperatura de ebulição de cada uma das substâncias.
Ao analisarmos a representação gráfica, podemos concluir que, ao nível do mar (pressão atmosférica igual a 760 milímetros Hg), a temperatura de ebulição dessas três substâncias é a seguinte:
- éter comum: 34 vírgula 6 graus Celsius;
- álcool etílico: 78 vírgula 4 graus Celsius;
- água: 100 graus Celsius.
Das três substâncias, o éter é o que apresenta a menor temperatura de ebulição, sendo a substância mais volátil entre elas.
A temperatura de ebulição é aquela em que a pressão de vapor do líquido se iguala à pressão externa exercida sobre o líquido.
Imagens desta página sem proporção e em cores fantasia.
Página 189
Diagrama de fases de uma substância
A determinada pressão, durante a mudança de estado físico de uma substância, há equilíbrio dinâmico entre as fases envolvidas e, nesse caso, a temperatura se mantém constante. Experimentos mostram que, ao variar a pressão, também variam as temperaturas em que há mudanças de estado.
Sob determinadas condições de temperatura e pressão, é possível a coexistência em equilíbrio dinâmico dos três estados físicos dessa substância. Nessa situação, ocorre o ponto triplo da substância.
Assim, pode-se montar o diagrama de fases de uma substância variando a pressão e a temperatura, conforme representado.
Diagrama genérico de fases de uma substância
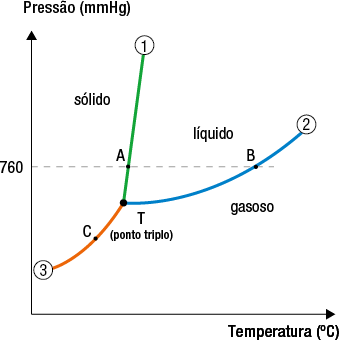
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 489.
Nesse diagrama, a curva 1 é de fusão/solidificação; a curva 2, de ebulição/condensação; e a curva 3; de sublimação/deposição.
| Ponto | Estado físico |
|---|---|
|
A |
sólido duas meias setas que apontam em direções opostas líquido |
|
B |
líquido duas meias setas que apontam em direções opostas gasoso |
|
C |
sólido duas meias setas que apontam em direções opostas gasoso |
|
T |
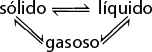
|
O diagrama de fases da água tem, em relação ao diagrama de fases da maioria das substâncias, comportamento anômalo✚ na curva 1 (fusão/solidificação), como representado no Diagrama de fases da água.
Diagrama de fases da água
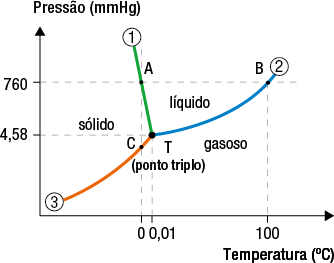
Fonte de pesquisa: CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Porto Alegre: AMGH, 2013. p. 506.
O ponto triplo da água indica a temperatura e a pressão em que há coexistência em equilíbrio dinâmico das três fases. Assim, esquematicamente, tem-se:
sólido duas meias setas que apontam em direções opostas líquido duas meias setas que apontam em direções opostas gasoso
Ponto triplo: T é igual a 0 vírgula 0 1 graus Celsius e P é igual a 4 vírgula 58 milímetros Hg abre parênteses 6 vezes 10 elevado a menos 3 a t m fecha parênteses.
Outro ponto importante é o ponto crítico, que, para a água, ocorre na temperatura de 374 graus Celsius e à pressão de 165.680 milímetros Hg abre parênteses 218 a t m fecha parênteses. Nesse ponto, a água torna-se um fluido supercrítico, comportando-se como gás, mas relativamente densa como um líquido.
No diagrama, é possível verificar que, em temperaturas e pressões superiores às do ponto crítico, a água torna-se um fluido supercrítico.
Diagrama de fases da água com o ponto crítico
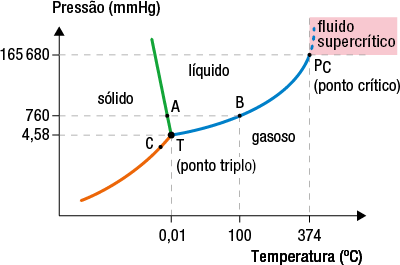
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
- Anômalo:
- algo que apresenta irregularidade ou difere do que é esperado.↰
Página 190
Comportamento anômalo da água
Em algumas regiões do planeta onde o inverno é mais rigoroso, é comum ocorrer o congelamento de lagos, lagoas ou mesmo de pequenos rios. No entanto, se analisarmos atentamente esses corpos de água, veremos que apenas sua superfície está congelada. Abaixo dela, a água permanece líquida e os seres vivos, adaptados a esses ambientes, mantêm-se vivos e ativos.
a ) Em sua opinião, por que isso ocorre?
Resposta pessoal. O objetivo desta questão é incentivar os estudantes a refletir sobre o assunto levando em consideração o próprio conhecimento prévio sobre o comportamento anômalo da água.
A explicação para esse fato está relacionada ao fenômeno conhecido como comportamento anômalo da água. Diferentemente do que ocorre com a maioria das substâncias, quando a água congela há expansão de volume, acarretando diminuição da densidade. Confira a seguir a representação de um lago congelado.
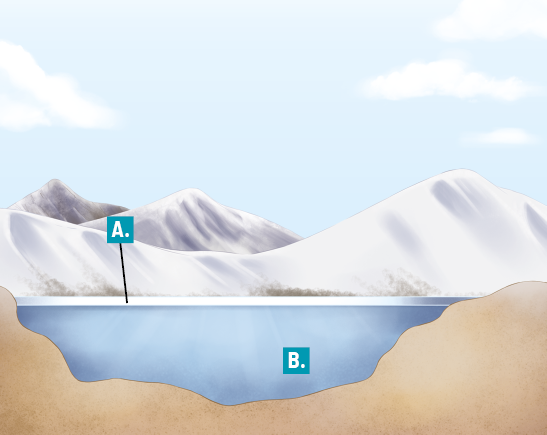
A. Para a maioria das substâncias, a densidade aumenta conforme a temperatura diminui. Isso acontece porque, para uma massa constante, quanto menor for a temperatura, mais unidas estarão as partículas e, consequentemente, menor será o volume ocupado por elas. No caso da água, no entanto, o volume aumenta entre 4 graus Celsius e 0 grau Celsius. Como resultado, ao se solidificar, a densidade da água diminui, fazendo-a flutuar na água líquida.
Nos gráficos a seguir, perceba que o volume da água cresce rapidamente abaixo de 4 graus Celsius e diminui lentamente apenas abaixo de 0 grau Celsius quando já está na forma de gelo. Portanto, a menor densidade da água é obtida a 4 graus Celsius.
Temperatura abre parênteses grau Celsius fecha parênteses vezes volume abre parênteses centímetro elevado ao cubo fecha parênteses para água
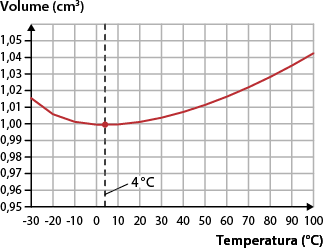
Fonte de pesquisa: HAYNES, William M. (ed.). CRC Handbook of chemistry and physics. 97. ed. Londres: CRC Press, 2017. p. 6-7.
Temperatura abre parênteses grau Celsius fecha parênteses vezes densidade abre parênteses grama barra centímetro cúbico fecha parênteses para água
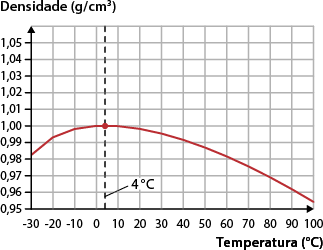
Fonte de pesquisa: HAYNES, William M. (ed.). CRC Handbook of chemistry and physics. 97. ed. Londres: CRC Press, 2017. p. 6-7.
B. Por ser mau condutor de calor, o gelo isola a água líquida das temperaturas negativas da superfície. Desse modo, abaixo da camada de gelo da superfície, a água se mantém líquida e em temperatura mais elevada.
b ) Por que não é recomendável colocar no refrigerador recipientes fechados e cheios de líquidos que tenham água em sua composição?
Resposta pessoal. O objetivo desta questão é que os estudantes reconheçam o comportamento anômalo da água em situações cotidianas. Espera-se que eles respondam que, por apresentar comportamento anômalo, ao ser submetida ao congelamento, a água presente no líquido se expandirá. Caso o recipiente esteja completamente preenchido, o aumento de volume da água causará o rompimento do recipiente com extravasamento de parte do líquido.
Página 191
Transformações químicas
Confira as fotografias a seguir.
A.

B.

18. A matéria que compõe o objeto em questão sofreu mudança em sua composição? Justifique sua resposta.
Resposta: Espera-se que eles respondam que parte da matéria do objeto alterou sua constituição, passando de ferro para ferro enferrujado, ou seja, oxidado.
A matéria pode sofrer transformações químicas, também chamadas de reações químicas. Nesse tipo de transformação, ocorre alteração da composição da matéria. Nesse caso, o balde apresentado na fotografia A, composto de ferro abre parênteses F e fecha parênteses, sofreu oxidação, resultando no exposto na fotografia B. A formação do óxido de ferro(III) abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses se deve à ação do vapor de água e de gás oxigênio abre parênteses O subscrito 2 fecha parênteses presentes na atmosfera.
A oxidação do ferro é constatada pela mudança na coloração do material. Por isso, dizemos que a mudança de cor é uma evidência de transformação química. Confira a seguir outras evidências.
Formação de gás: a formação de bolhas de gás é um indicativo importante de que uma reação química está acontecendo, pois pode representar a formação de uma nova substância na forma gasosa. Um comprimido efervescente, quando em contato com a água, forma novas substâncias, como o gás dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses, liberado em bolhas.

Dica
Nem sempre a formação de bolhas significa que houve uma transformação na matéria. Ao aquecermos água no fogão, as bolhas formadas referem-se ao vapor de água recém-formado por meio de um processo físico.
Formação de precipitado: o precipitado é uma substância sólida imersa em uma mistura líquida ou gasosa. A formação de estalactites é resultado da precipitação de carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses.

Mudança de temperatura: transformações químicas podem envolver trocas energéticas. Assim, quando a transformação libera energia, a temperatura aumenta; quando consome energia, diminui.
Liberação de luz: algumas reações químicas específicas liberam energia na forma de luz visível. As reações que acontecem no Sol, por exemplo, causam tanto o aumento de temperatura, provocando os raios solares que chegam à Terra, quanto a liberação de luz.
Astro (dimensão)
Sol: aproximadamente 1.390.000 quilômetros de diâmetro.

Uma evidência menos usual de transformação química é a liberação de odor, como ocorre em um alimento que apodreceu. Substâncias desconhecidas podem ser prejudiciais ao organismo, portanto não é recomendável inalá-las.
Página 192
LIGADO NO TEMA
A cerâmica das mulheres indígenas da etnia Baniwa
A riqueza cultural do Brasil é moldada por uma diversidade de povos, cada um contribuindo com conhecimentos, práticas e tradições que refletem nossa complexa história. Os Baniwa, habitantes do território indígena do Alto Rio Negro, no Amazonas, exemplificam essa riqueza cultural por meio de sua produção de cerâmicas. Essa prática ancestral é um dos muitos exemplos de como a etnociência — o conhecimento tradicional aplicado de maneira prática e científica — permeia a vida cotidiana e cultural dos povos indígenas.
A produção de cerâmicas pelos Baniwa é um processo que vai além da simples criação de utensílios. Enraizado em um sistema cultural ancestral, é realizado exclusivamente por mulheres, que transmitem esse saber de geração em geração. Essas cerâmicas desempenham um papel crucial em cerimônias e rituais, sendo utilizadas para servir alimentos e bebidas durante esses importantes eventos. A produção não é apenas manual, mas também carregada de significado simbólico e espiritual.
Uma das características marcantes dessas cerâmicas é sua decoração com padrões gráficos em tonalidades vermelho-alaranjadas, muitas vezes inspirados na natureza — representando, por exemplo, a pegada de um pássaro ou o movimento das águas. Esses padrões são desenhados inicialmente com uma coloração amarelada e, após o processo de queima, transformam-se na vibrante cor vermelho-alaranjada que as distingue. Esse processo de mudança de cor é um exemplo de como a Química se manifesta na prática cultural.

O fenômeno por trás dessa mudança de cor está ligado à oxidação dos minerais ferrosos presentes no pigmento utilizado. Durante a queima, a alta temperatura provoca a oxidação do ferro, conferindo à coloração original uma tonalidade avermelhada. Esse processo químico não é apenas uma curiosidade, mas um testemunho do conhecimento empírico acumulado pelos Baniwa ao longo de gerações. Eles compreendem e aplicam esses conhecimentos de forma prática, integrando ciência e cultura em seu cotidiano.
Além da transformação dos pigmentos, o processo de moldagem da argila é outro exemplo de transformação. A argila, em seu estado natural, é moldada e manipulada pelas artesãs baniwas para criar formas específicas, secando-as e queimando-as para promover resistência e durabilidade. Esse processo envolve mudanças na estrutura física da argila, que se torna cerâmica por meio de técnicas tradicionais de queima.
A Química e a Arte se entrelaçam nas ações das artesãs baniwas de maneira profunda e harmoniosa, pois, ao moldar a argila e aplicar padrões gráficos, elas não apenas criam objetos esteticamente belos, mas também manipulam materiais e processos naturais de forma intencional e precisa. Esse entendimento das interações entre materiais e técnicas artísticas pode ser expandido para outros contextos, como o design de produtos, a conservação de obras de arte e o desenvolvimento de novas tecnologias sustentáveis. Nesse sentido, ciência e criatividade colaboram para soluções inovadoras e culturalmente enriquecedoras.
a ) No texto foi descrito algum processo que envolve uma transformação química?
b ) Houve alguma transformação física mencionada no texto?
c ) Como a ciência está integrada às práticas culturais descritas no texto?
Respostas nas Orientações para o professor.
Página 193
ATIVIDADES
1. Alguns cubos de gelo foram retirados da forma em que estavam em um congelador e depositados em um prato, exposto diretamente à luz solar por 5 horas. Analise o antes e depois.
A.

B.

a ) O que você pode dizer a respeito da energia da matéria que sofreu transformação ao longo do experimento e da forma como ela interferiu no resultado obtido? Explique sua resposta.
b ) O que provavelmente ocorrerá após a etapa B se a matéria continuar exposta à luz solar diretamente?
c ) O que você pode afirmar a respeito da temperatura da matéria durante o experimento? Explique sua resposta.
d ) De que maneira essa situação pode ser relacionada à ciclagem da matéria?
2. Se os líquidos apresentados nas situações a seguir continuarem recebendo energia térmica à pressão constante, que tipo de vaporização sofrerão? Justifique sua resposta.
A.

B.

3. Uma jovem expirou próximo à superfície de um espelho. Confira a seguir.

Por que o espelho ficou embaçado?
4. Confira as situações mostradas nas fotografias a seguir.
A.

B.

a ) A transformação da matéria que ocorre na situação A é semelhante à da situação B? Justifique sua resposta.
b ) Qual foi o agente causador da transformação nas situações apresentadas?
5. Uma fórmula simplificada que possibilita calcular a temperatura de ebulição da água em função da altitude do local é dada por: T abre parênteses grau Celsius fecha parênteses é igual a 100 menos 3 vírgula 24 vezes 'h', em que 'h' é a altitude, em quilômetro.
a ) Com base nos dados do quadro a seguir, identifique, aproximadamente, a temperatura de ebulição da água em cada localidade.
| Local | Altitude em relação ao nível do mar | Pressão atmosférica média |
|---|---|---|
|
Mar Morto (Oriente Médio) |
menos 430 metros |
795 milímetros Hg |
|
Rio de Janeiro |
0 metro |
760 milímetros Hg |
|
Brasília |
1.100 metros |
650 milímetros Hg |
|
La Paz (Bolívia) |
3.600 metros |
500 milímetros Hg |
|
Monte Everest (Ásia) |
8.850 metros |
240 milímetros Hg |
b ) Qual é a temperatura de ebulição da água no município onde você vive?
Respostas das questões 1 a 5 nas Orientações para o professor.
6. Ao abrir uma lata de bebida gaseificada, pode acontecer a saída de um jato de líquido efervescente. Explique os principais tipos de transformações que ocorrem na bebida nesse processo, os fatores que influenciam tais transformações, a relação entre as propriedades dos gases dissolvidos e os fenômenos identificados, além dos cuidados necessários ao abrir uma lata de bebida gaseificada.
Resposta: Ao abrir uma lata de refrigerante, a pressão interna diminui, fazendo o gás carbônico dissolvido no líquido escapar em forma de bolhas, causando a efervescência. Isso acontece porque o gás carbônico sai do líquido quando a pressão cai. Entre os cuidados, deve-se aguardar caso a lata tenha sido agitada e abrir lentamente se ela estiver quente.
Página 194
7. O diagrama a seguir se refere a três líquidos.
Diagrama da pressão versus temperatura dos líquidos A, B e C

Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 518.
a ) Qual desses líquidos é o mais volátil? Justifique sua resposta.
Resposta: O mais volátil é o líquido A, pois a uma dada temperatura apresenta a maior pressão de vapor.
b ) Quais seriam suas temperaturas de ebulição no topo de uma montanha onde a pressão externa é 400 milímetros Hg?
Resposta: Líquido A é aproximadamente igual a 41 graus Celsius; Líquido B é aproximadamente igual a 61 graus Celsius; e Líquido C é aproximadamente igual a 85 graus Celsius.
8. Um diagrama de fases representa as regiões de estabilidade das diferentes fases (sólida, líquida e gasosa) de uma substância pura em função de variáveis, como temperatura e pressão. Considere o diagrama de fases do dióxido de carbono CO subscrito 2 mostrado a seguir.
Diagrama de fases do C O subscrito 2

Fonte de pesquisa: ZUMDAHL, Steven S.; ZUMDAHL, Susan S.; DECOSTE, Donald J. Chemistry. 20. ed. Boston: Cengage Learning, 2018. p. 425.
Com base no diagrama, qual das afirmativas a seguir está correta?
a ) O ponto triplo do CO subscrito 2 corresponde às condições em que as fases sólida, líquida e gasosa coexistem em equilíbrio.
b ) Acima da curva de sublimação/deposição, o CO subscrito 2 existe apenas na fase gasosa.
c ) Acima da curva de vaporização, o CO subscrito 2 existe apenas na fase líquida.
d ) Ao longo da curva de fusão, a temperatura do CO subscrito 2 diminui com o aumento da pressão.
Resposta: Alternativa a.
9. Preencha em seu caderno um quadro similar ao representado a seguir, identificando a evidência que indica a ocorrência de uma reação química em cada exemplo apresentado.
| Situação | Evidência |
|---|---|
|
Amadurecimento de frutas |
|
|
Formação de estalactite |
|
|
Queima de papel |
|
|
Mistura de vinagre e bicarbonato de sódio |
Possíveis respostas: Amadurecimento de frutas: mudança de cor, odor e textura. Formação de estalactite: formação de precipitado. Queima de papel: liberação de calor e fumaça. Mistura de vinagre e bicarbonato de sódio: formação de bolhas (liberação de gás).
Atividade(s) adaptada(s) acessível(is)
9. Identifique e escreva no caderno uma evidência que indica a ocorrência de uma reação química nas situações a seguir.
- Amadurecimento de frutas.
- Formação de estalactite.
- Queima de papel.
- Mistura de vinagre e bicarbonato de sódio.
Possíveis respostas: Amadurecimento de frutas: mudança de cor, odor e textura. Formação de estalactite: formação de precipitado. Queima de papel: liberação de calor e fumaça. Mistura de vinagre e bicarbonato de sódio: formação de bolhas (liberação de gás).
10. Durante um inverno rigoroso, o Lago Baikal, na Rússia, tem a superfície congelada, enquanto a água abaixo dela permanece líquida. Essa situação é um exemplo do comportamento anômalo da água. Considerando esse fenômeno, responda às questões a seguir.

a ) Por que o gelo é formado na superfície do Lago Baikal e como isso beneficia a vida aquática durante o inverno?
b ) Se a água não tivesse esse comportamento anômalo, quais seriam as possíveis consequências para os ecossistemas aquáticos? Explique sua resposta.
Respostas nas Orientações para o professor.
Página 195
Leis ponderais
Conservação da matéria
"Na natureza nada se cria, nada se perde, tudo se transforma". Você provavelmente já ouviu essa afirmativa, mas sabe o que ela significa? Antes de explorarmos melhor essas informações, considere o experimento a seguir.
A. Um erlenmeyer contendo uma pequena quantidade de água é acoplado a um balão de borracha, semelhante aos usados em festas. Dentro desse balão, há uma pastilha de hidrogenocarbonato de sódio ou bicarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses, similar ao medicamento utilizado para combater a acidez do estômago. O sistema montado foi colocado sobre uma balança comum, que registra a massa de 208 gramas.

19. O valor de 208 gramas se refere à massa de quais materiais?
Resposta: Esse valor se refere à soma das massas do erlenmeyer, do balão de borracha, da água e da pastilha de hidrogenocarbonato de sódio.
B. A pastilha de hidrogenocarbonato de sódio, no interior do balão de borracha, é despejada na água. Imediatamente, identificam-se a formação de bolhas na água e a liberação de um gás esbranquiçado. Também é possível notar que o balão de borracha começa a inflar.
A formação de bolhas e de gás evidencia uma reação química, que pode ser representada por:
N a H C O subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima N a O H abre parênteses a q fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses

20. O valor de 208 gramas, registrado pela balança após a etapa B, refere-se à massa de quais materiais?
Resposta: Esse valor se refere à soma das massas do erlenmeyer, do balão de borracha, da água, do N a O H abre parênteses a q fecha parênteses e do C O subscrito 2 abre parênteses g fecha parênteses.
Como você pôde notar no experimento, a massa do sistema se manteve, mesmo após a reação química. Isso foi possível porque não houve entrada nem saída de substâncias. Nesse sentido, o gás dióxido de carbono foi impedido, pelo balão de borracha, de escapar do sistema.
21. Você acha que a massa do sistema teria se mantido, após a etapa B, caso não houvesse o balão de borracha? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que não, pois o dióxido de carbono teria sido perdido para o ambiente, reduzindo a massa do sistema.
22. Como os resultados do experimento apresentado podem ser associados à frase inicial "Na natureza nada se cria, nada se perde, tudo se transforma."?
Resposta: Espera-se que os estudantes reconheçam que na etapa B ocorreram transformações da matéria, como do N a H C O subscrito 3 abre parênteses s fecha parênteses sendo transformado em N a O H abre parênteses a q fecha parênteses e C O subscrito 2 abre parênteses g fecha parênteses. Nesse sentido, seus átomos não foram perdidos ou criados, mas rearranjados para se transformar em outros componentes. Como resultado, a massa total do sistema se manteve.
A constatação de que nada pode ser criado ou perdido, e sim transformado, pode parecer óbvia atualmente, mas já foi tema de muitos questionamentos e teorias na Antiguidade, tendo íntima relação com o que se entendia por matéria. A seguir, vamos começar a explorar esse assunto com base na substância água.
Página 196
A água sempre foi assunto de grande interesse para os químicos. Sua abundância na natureza, os diferentes estados de agregação que pode apresentar no ambiente e sua importância para os seres vivos deram à água papel de destaque nos estudos primordiais da Química, mesmo antes de serem desenvolvidos os estudos sobre os elementos químicos, átomos ou substâncias.
O filósofo grego Tales de Mileto (cerca de 624 a.C.-556 a.C.) denominou a água como "elemento primordial". Posteriormente, os também filósofos gregos Empédocles (490 a.C.-430 a.C.) e Aristóteles (384 a.C.-322 a.C.) criaram a teoria dos quatro elementos, segundo a qual toda a matéria era formada por combinações de água, fogo, terra e ar. Com o passar dos séculos, a teoria dos quatro elementos foi se modificando, mas a água sempre tomou posição de destaque sem perder o status de elemento primordial. Acreditava-se, no entanto, que a água é uma entidade indivisível.
Apenas após a metade do século XVIII, com a contribuição de diversos cientistas, em especial do químico francês Henry Cavendish (1731-1810), cientista que fundamentou a descoberta do hidrogênio, foi proposto que a água é formada pelos elementos químicos hidrogênio abre parênteses H fecha parênteses e oxigênio abre parênteses O fecha parênteses. Posteriormente, com os experimentos dos químicos franceses Antoine Laurent Lavoisier (1743-1794) e Joseph Louis Gay-Lussac (1778-1850) e do químico inglês John Dalton (1766-1844), descobriu-se a composição exata da água: dois átomos de hidrogênio e um de oxigênio.

A reação de síntese da água é uma das principais reações químicas envolvidas na formulação da composição dela. Veja a seguir a equação química dessa reação.
expressão com detalhe abaixo, início da expressão, 2 H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses, início do detalhe abaixo, reagentes, fim do detalhe abaixo seta para a direita expressão com detalhe abaixo, início da expressão, 2 H subscrito 2 O abre parênteses g fecha parênteses, início do detalhe abaixo, produto, fim do detalhe abaixo
Segundo essa equação, que representa a síntese da água, duas moléculas de gás hidrogênio abre parênteses H subscrito 2 fecha parênteses e uma molécula de gás oxigênio reagem entre si, formando duas moléculas de água. Perceba que a quantidade de átomos de hidrogênio e de oxigênio é igual entre os reagentes e os produtos. A isso chamamos de lei da conservação das massas, ou primeira lei ponderal, proposta por Lavoisier em 1773. Confira a seguir a equação de síntese da água, agora envolvendo uma quantidade de massa das substâncias.
2 H subscrito 2 abre parênteses g fecha parênteses 4 gramas mais O subscrito 2 abre parênteses g fecha parênteses 32 gramas seta para a direita 2 H subscrito 2 O abre parênteses g fecha parênteses 36 gramas
Nessa equação, 4 gramas de H subscrito 2 abre parênteses g fecha parênteses reagiram com 32 gramas de O subscrito 2 abre parênteses g fecha parênteses, formando 36 gramas de H subscrito 2 O abre parênteses g fecha parênteses. Ou seja, 36 gramas de reagentes se transformaram em 36 gramas de produtos, seguindo a lei de conservação das massas.
Outra característica importante de reações químicas é que sempre há uma proporcionalidade entre as massas de reagentes e de produtos. Confira a seguir.
2 H subscrito 2 abre parênteses g fecha parênteses 4 gramas 8 gramas mais O subscrito 2 abre parênteses g fecha parênteses 32 gramas 64 gramas seta para a direita 2 H subscrito 2 O abre parênteses g fecha parênteses 36 gramas 72 gramas
Quando o dobro de massa de gás hidrogênio e o dobro de massa de gás oxigênio são utilizados, obtemos o dobro de massa de água. A essa característica dá-se o nome de lei das proporções constantes, ou segunda lei ponderal, formulada pelo químico francês Joseph Louis Proust (1754-1826) em 1794.
Vamos estudar as leis ponderais mais detalhadamente a seguir.

Página 197
Primeira lei ponderal: lei da conservação das massas
Os trabalhos de Antoine Lavoisier foram pioneiros para definir a Química como uma ciência quantitativa, ou seja, que trabalha com quantidades numéricas.
Uma característica importante dos trabalhos de Lavoisier diz respeito à sua constituição em sistemas fechados. Nesse tipo de sistema, depois de misturados os reagentes, nenhuma matéria entra e nenhuma matéria sai dele, como é o caso de um balão de vidro hermeticamente fechado e do sistema apresentado na página 195. Assim, Lavoisier tinha a certeza de que qualquer alteração que viesse a acontecer em seus experimentos químicos deveria ser resultante do próprio sistema, incluindo uma possível mudança de massa e liberação de gases.
A atenção especial de Lavoisier no campo da Química se voltou aos seus aspectos ponderais, ou seja, relativos à massa de reagentes e de produtos. Sua constatação mais conhecida é a de que a massa das substâncias dentro de um sistema fechado é a mesma antes e depois de uma reação química. Isso também pode ser identificado na reação de combustão do carbono abre parênteses C fecha parênteses.
C abre parênteses s fecha parênteses 6 gramas mais O subscrito 2 abre parênteses g fecha parênteses 16 gramas seta para a direita C O subscrito 2 abre parênteses g fecha parênteses 22 gramas
23. O resultado do experimento de combustão do carbono teria se mantido caso ele tivesse sido realizado em um sistema aberto? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que não, pois, em um sistema aberto, não seria conhecida a massa do gás oxigênio usada como reagente e o dióxido de carbono formado seria perdido para a atmosfera.
Com base em sua descoberta, Lavoisier enunciou a lei da conservação das massas, posteriormente conhecida como primeira lei ponderal. De acordo com essa lei, em uma reação química em recipiente fechado a soma das massas dos reagentes é igual à soma das massas dos produtos.
Essa lei também ficou conhecida pela afirmação "na natureza nada se cria, nada se perde, tudo se transforma". Do ponto de vista das mudanças físicas e químicas, a lei de Lavoisier é válida, pois durante essas transformações, nenhum átomo é criado ou destruído, uma vez que se reorganizam, formando substâncias diferentes. Essa conclusão, na época, pôs fim às ideias dos alquimistas sobre a transmutação dos metais, por exemplo.
Outra experiência importante realizada por Lavoisier foi o aquecimento do mercúrio abre parênteses H g fecha parênteses em um sistema fechado durante 12 dias, conforme representado a seguir.
Imagens desta página sem proporção e em cores fantasia.
A.
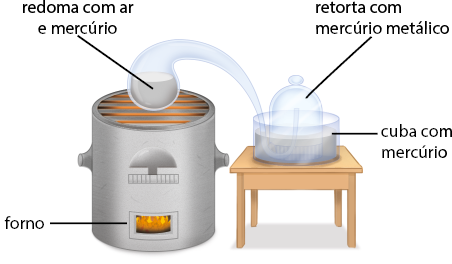
A. Em uma retorta✚ com tubo longo e recurvado foi colocado mercúrio metálico, de maneira que a ponta dela alcançava uma redoma de ar feita sobre uma cuba de vidro, na qual também havia mercúrio. A retorta foi, então, aquecida pelo calor de um forno.
B.
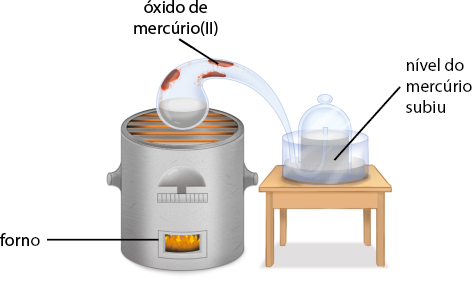
B. Com o passar do tempo, notou-se a formação de um pó vermelho nas paredes da retorta, além da redução do volume de ar contido na redoma em cerca de 20%.
- Retorta:
- vaso de gargalo estreito e curvo.↰
Página 198
A reação ocorrida no interior da retorta correspondeu à oxidação do mercúrio, formando óxido de mercúrio(II) abre parênteses H g O fecha parênteses. Confira a seguir a equação dessa reação.
2 H g abre parênteses l fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 H g O abre parênteses s fecha parênteses
Segunda lei ponderal: lei das proporções constantes
Confira a seguir a equação da reação química que representa a decomposição da água.
2 H subscrito 2 O abre parênteses g fecha parênteses 36 gramas mais 2 H subscrito 2 abre parênteses g fecha parênteses 4 gramas seta para a direita O subscrito 2 abre parênteses g fecha parênteses 32 gramas
Note que essa reação é o inverso da que vimos anteriormente para a síntese da água. Nela, a água é o reagente e os gases hidrogênio e oxigênio são os produtos. Perceba que, de acordo com a primeira lei ponderal, a soma da massa dos reagentes é igual à soma da massa dos produtos. Confira agora o que aconteceria se fossem usadas outras massas de água como reagente.
| 2 H subscrito 2 O abre parênteses g fecha parênteses | seta para a direita | 2 H subscrito 2 abre parênteses g fecha parênteses | mais | O subscrito 2 abre parênteses g fecha parênteses | Proporção |
|---|---|---|---|---|---|
|
Massa de água |
seta para a direita |
Massa de hidrogênio |
mais |
Massa de oxigênio |
início de fração, numerador: massa de oxigênio, denominador: massa de hidrogênio, fim de fração |
|
36 gramas |
seta para a direita |
4 gramas |
mais |
32 gramas |
início de fração, numerador: 32 gramas, denominador: 4 gramas, fim de fração é igual a 8 |
|
9 gramas |
seta para a direita |
1 grama |
mais |
8 gramas |
início de fração, numerador: 8 gramas, denominador: 1 grama, fim de fração é igual a 8 |
|
18 gramas |
seta para a direita |
2 gramas |
mais |
16 gramas |
início de fração, numerador: 16 gramas, denominador: 2 gramas, fim de fração é igual a 8 |
|
900 quilogramas |
seta para a direita |
100 quilogramas |
mais |
800 quilogramas |
início de fração, numerador: 800 quilogramas , denominador: 100 quilogramas , fim de fração é igual a 8 |
Independentemente da massa de água utilizada como reagente da reação química, a proporção de quantidade de massa entre o gás oxigênio e o gás hidrogênio produzidos é a mesma: 8 para 1, respectivamente.
Agora, analise novamente a equação da reação de síntese de água e as massas apresentadas.
2 H subscrito 2 abre parênteses g fecha parênteses 8 gramas mais O subscrito 2 abre parênteses g fecha parênteses 32 gramas seta para a direita 2 H subscrito 2 O abre parênteses g fecha parênteses 36 gramas
Essa reação parece não seguir a lei da conservação das massas. Isso porque a proporção entre gás hidrogênio e gás oxigênio não está correta, pois, em vez de termos oito vezes a massa de oxigênio, temos apenas quatro. Nesse caso, dizemos que o gás hidrogênio está em excesso na reação química ou que o gás oxigênio está em falta. Perceba a seguir o que aconteceria se fossem utilizados 64 gramas de gás oxigênio.
2 H subscrito 2 abre parênteses g fecha parênteses 8 gramas mais O subscrito 2 abre parênteses g fecha parênteses 64 gramas seta para a direita 2 H subscrito 2 O abre parênteses g fecha parênteses 72 gramas
Para a produção de determinado produto, precisamos de uma proporção fixa entre os reagentes, de maneira que o excesso de um ou de outro reagente não altere a quantidade de produto formado, pois o excedente não participa da reação. Essa observação entre a proporção dos reagentes para a formação de produtos foi evidenciada pela primeira vez pelo químico francês Joseph Louis Proust e ficou conhecida como lei das proporções constantes, ou simplesmente lei de Proust.
Após vários experimentos e comparações entre os valores das massas de cada substância participante das reações, Proust constatou que havia proporção constante entre suas massas. Em 1794, formulou essa lei, que posteriormente ficou conhecida como segunda lei ponderal, cujo enunciado pode ser expresso por: determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa.
Página 199
ATIVIDADES
1. Na reação entre carvão e gás oxigênio, ocorre a formação de dióxido de carbono. Os dados experimentais dessa reação estão no quadro a seguir. Considere que em nenhum dos experimentos houve reagente em excesso.
| Experimento | Carvão | Gás oxigênio | Dióxido de carbono |
|---|---|---|---|
|
A |
12 gramas |
32 gramas |
X |
|
B |
Y |
Z |
88 gramas |
Determine os valores de X, Y e Z.
Resposta: X é igual a 44 gramas; Y é igual a 24 gramas; Z é igual a 64 gramas. Resolução nas Orientações para o professor.
2. Em uma indústria química, fabrica-se ácido sulfúrico abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses com um minério chamado pirita, composto de sulfeto de ferro abre parênteses F e S subscrito 2 fecha parênteses, cujo processo tem várias reações químicas envolvidas, como as apresentadas a seguir.
4 F e S subscrito 2 abre parênteses s fecha parênteses mais 11 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 F e subscrito 2 O subscrito 3 abre parênteses s fecha parênteses mais 8 SO subscrito 2 abre parênteses g fecha parênteses
2 S O subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 S O subscrito 3 abre parênteses g fecha parênteses
S O subscrito 3 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 2 S O subscrito 4 abre parênteses l fecha parênteses
Analisando essas reações, identifique a afirmativa correta.
a ) Apenas a conservação de massas deve ser considerada, pois, como há várias reações químicas, não existe mais proporcionalidade.
b ) Apenas a lei de proporções constantes deve ser considerada, pois o dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses da primeira reação é destruído na segunda reação.
c ) Todas as leis ponderais devem ser consideradas nesse processo, até que o ácido sulfúrico produzido seja proporcional à massa de F e S subscrito 2 utilizada no início do processo.
d ) Leis ponderais não se aplicam a essa situação, pois envolvem misturas de duas fases.
e ) Se esse processo fosse realizado em um laboratório em escala menor, não funcionaria da mesma forma, pois não teria mais proporção.
Resposta: Alternativa c.
3. Um experimento envolve a combustão de um pedaço de palha de aço em um recipiente parcialmente fechado, totalizando 5 gramas. Após a combustão, o peso total dos produtos formados é de 5 vírgula 5 gramas. O que isso indica sobre a lei da conservação da massa? Explique sua resposta.
Resposta: O experimento sugere que houve um acréscimo de massa por conta da reação entre o ferro metálico abre parênteses F e abre parênteses s fecha parênteses fecha parênteses e o gás oxigênio abre parênteses O subscrito 2 abre parênteses g fecha parênteses fecha parênteses, que produziu óxido de ferro(II) abre parênteses F e O abre parênteses s fecha parênteses fecha parênteses.
4. Considere a formação do dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses a partir do nitrogênio e do oxigênio. Durante um experimento, foi identificado que 14 gramas de nitrogênio reagem com 32 gramas de oxigênio para formar dióxido de nitrogênio. Com base nessa afirmação, responda às questões a seguir.
a ) Calcule a razão em massa entre o oxigênio e o nitrogênio na formação do dióxido de nitrogênio.
Resposta: Razão 16 dois-pontos por 7.
b ) Se em outro experimento forem utilizados 28 gramas de nitrogênio e 64 gramas de oxigênio, haverá excesso ou falta de algum reagente?
Resposta: Não, pois a massa de ambos os reagentes foi dobrada na proporção em que reagem.
5. Com o intuito de verificar na prática a lei da conservação das massas de Lavoisier, um técnico em química realizou o procedimento a seguir.
I ) Colocou simultaneamente sobre uma balança de precisão dois recipientes abertos, um com solução de ácido clorídrico abre parênteses H C l fecha parênteses e o outro com carbonato de potássio abre parênteses K subscrito 2 C O subscrito 3 fecha parênteses sólido. Nessa etapa, foi registrada a massa total de 200 gramas.
II ) O técnico despejou o carbonato de potássio na solução de ácido clorídrico e manteve os dois recipientes abertos, um com a solução final e o outro vazio, sobre a balança. Nessa etapa, foi registrada a massa total de 190 gramas.
a ) A investigação possibilitou verificar a lei de conservação das massas, de Lavoisier? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que não, pois diferentemente do afirmado por essa lei, a soma da massa dos reagentes não foi igual à massa dos produtos.
b ) Caso sua resposta ao item a tenha sido negativa, o que o técnico poderia alterar em seu experimento para que fosse possível verificar a lei de conservação das massas? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que seria necessário manter os recipientes fechados para que nenhuma matéria fosse perdida para o ambiente.
Página 200
CAPÍTULO11
Soluções e propriedades coligativas
Em praticamente sua totalidade, os sistemas químicos encontrados na natureza são formados por misturas. E parte considerável dos materiais de nosso cotidiano está na forma de soluções.
As proporções estabelecidas entre as quantidades de soluto e de solvente são aspectos quantitativos das soluções, ou seja, envolvem quantificação de grandezas como massa, números de mol e volume.
A presença de soluto em um solvente também forma uma mistura com propriedades diferentes das que ele apresentava quando puro. A água do mar, por exemplo, pode ser considerada uma solução de cloreto de sódio abre parênteses N a C l fecha parênteses dissolvido em água, e a presença do sal altera a temperatura de ebulição da água, aumentando-a.
Neste capítulo, vamos estudar como as concentrações das soluções podem ser expressas e quais são as diferenças de propriedades entre uma solução e a substância pura.
Concentrações de soluções
As duas fotografias a seguir mostram xícaras de café que têm diferentes quantidades de solvente (também chamado de dispersante, é a substância em maior quantidade a compor a solução) e de concentrações, mas ambas as bebidas foram preparadas inicialmente com a mesma quantidade de solvente, o mesmo tipo de pó de café (disperso) e a mesma temperatura.


1. Qual dos dois cafés é o mais concentrado? Justifique sua resposta.
Resposta: O café mais concentrado é o mais escuro (B), pois ele tem mais quantidade de soluto no solvente.
2. O que pode ser feito para igualar as concentrações desses dois cafés?
Resposta: É possível acrescentar água ao café mais concentrado para diluí-lo até atingir a concentração do outro café. Também é possível aquecer o café A a fim de fazê-lo perder solvente para aumentar sua concentração e atingir a concentração do café B. Outra possibilidade é misturar os dois em um recipiente e depois recolocá-los nas xícaras.
Em laboratório, a preparação de uma solução é feita pela dissolução de determinada massa de uma substância em certo volume de solvente apropriado. A massa da substância a ser usada depende da concentração e do volume da solução que se deseja preparar.
Como a solução é preparada com base em dados previamente calculados (quantidades de soluto/solvente/solução), significa que já conhecemos a sua concentração. Em Química, o termo concentração se refere às quantidades de soluto na solução, ou seja, às relações entre soluto e solvente.
Com uma solução concentrada, pode-se preparar outra solução adicionando solvente. Nesse caso, faz-se uma diluição de solução. Também é possível misturar soluções de mesmo soluto e mesmo solvente, porém com concentrações diferentes, a fim de obter uma solução com concentração (intermediária) desejada.
Dica
Para fazer referência a qualquer aspecto do soluto de uma solução, usaremos, em subscrito, o índice 1; para o solvente, colocaremos, em subscrito, o índice 2; e para a solução não será usado índice subscrito.
Página 201
Como se deve preparar uma solução com soluto sólido
Imagens desta página sem proporção e em cores fantasia.
O esquema a seguir apresenta o preparo de soluções líquidas a partir de dispersos sólidos.



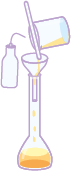


1º. Meça a massa do soluto em uma balança, usando um béquer.
2º. Coloque água no béquer com o soluto e, utilizando um bastão de vidro, misture-o até a sua dissolução total. Se durante o processo de dissolução ocorrer variação na temperatura da mistura, espere atingir a temperatura ambiente antes de passar para o balão, pois a temperatura afeta a precisão da medida.
3º. Passe o conteúdo da mistura do béquer para um balão volumétrico de capacidade adequada. Para isso, acople um funil de vidro (conforme ilustração) para verter a mistura.
4º. Usando uma pisseta, adicione água aos poucos e coloque a mistura no balão até retirar todo o resquício da mistura do béquer.
5º. Adicione mais água ao balão volumétrico até a medida de aferição, que é o traço ou menisco presente no balão.
6º. Feche o balão volumétrico e agite.
Vamos agora estabelecer algumas correlações envolvendo as quantidades de soluto, de solvente e de solução.
Concentração em massa abre parênteses C fecha parênteses
Para preparar um café instantâneo mais concentrado, é preciso aumentar a proporção de pó de café em relação à água utilizada. Nesse caso, a concentração pode ser facilmente determinada em massa.

A concentração em massa (ou concentração comum) expressa a relação entre a massa do soluto 'm' subscrito 1 e o volume da solução V. Essa concentração de solução pode ser expressa da seguinte forma:
'C' é igual a início de fração, numerador: 'm' subscrito 1, denominador: V, fim de fração (pode ser expressa em: grama por decímetro cúbico, grama por litro, grama por mililitro etc.)
em que:
- 'm' subscrito 1 é a massa do soluto;
- V é o volume da solução.
3. Na preparação do café, qual é o soluto e qual é o solvente?
Resposta: O soluto é o pó de café, pois será disperso no dispersante; e o solvente é a água, pois está em maior quantidade.
Página 202
Por exemplo, em uma solução foram dissolvidos 5 gramas de permanganato de potássio em 200 centímetros cúbicos de água. É possível determinar a concentração comum dessa solução em grama por litro usando as seguintes relações de volume:
1 centímetro cúbico é igual a 1 mililitro, e 1 mililitro é igual a 0 vírgula 1 litro.
Logo, 200 centímetros cúbicos (volume) equivalem a 200 mililitros, então 0 vírgula 2 litro., tem-se:
'C' é igual a início de fração, numerador: 'm' subscrito 1, denominador: V, fim de fração implica em 'C' é igual a início de fração, numerador: 5 gramas, denominador: 0 vírgula 2 litro, fim de fração portanto 'C' é igual a 25 gramas por litro de K M n O subscrito 4
Portanto, a concentração comum, ou concentração em massa, da solução de K M n O subscrito 4 é 'C' é igual a 25 gramas por litro. Isso significa que em cada litro dessa solução há 25 gramas do sal dissolvidos.
Analise como resolver usando regra de três se há 5 gramas de soluto em 0 vírgula 2 litro de solução.
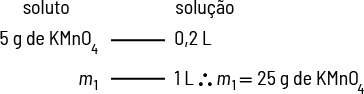
Logo, a concentração comum dessa solução é 25 gramas por litro.
Densidade
Você já viu o equipamento apresentado na fotografia nas bombas de postos de combustíveis?
Esse equipamento é um densímetro, que nesse caso serve para medir a densidade da mistura que forma o combustível.
Como visto anteriormente, a densidade d de uma substância ou material expressa a relação entre massa 'm' e volume V da substância do material e pode ser expressa em: grama por metro cúbico, grama por mililitro, grama por litro etc. Contudo, não se deve confundir concentração em massa com densidade da solução.
Toda matéria, seja ela uma substância simples, seja uma mistura, tem densidade, pois apresenta massa e volume independentemente de seu estado físico.

Porcentagem em massa de soluto abre parênteses por cento m barra m fecha parênteses
Na embalagem do soro fisiológico, há uma informação em porcentagem do cloreto de sódio, que é a porcentagem em massa de soluto.

Essa porcentagem expressa a massa de soluto 'm' subscrito 1 em 100 gramas de solução. Esse tipo de concentração de solução é muito utilizado em indústrias químicas e farmacêuticas. No caso do soro fisiológico, em 100 gramas da solução há 0 vírgula 9 grama de cloreto de sódio.
A porcentagem em massa de soluto pode ser expressa da seguinte forma:
por cento 'm' barra 'm' é igual a 100 vezes início de fração, numerador: 'm' subscrito 1, denominador: 'm' subscrito 1 mais 'm' subscrito 2, fim de fração portanto por cento 'm' barra 'm' é igual a 100 vezes início de fração, numerador: 'm' subscrito 1, denominador: 'm', fim de fração abre parênteses por cento fecha parênteses
em que:
- 'm' subscrito 1 é a massa do soluto;
- 'm' subscrito 2 é a massa do solvente;
- 'm' é a massa da solução abre parênteses 'm' é igual a 'm' subscrito 1 mais 'm' subscrito 2 fecha parênteses.
Página 203
A concentração de solução expressa em por cento 'm' barra 'm' é adimensional, ou seja, sem unidades de grandezas.
Dica
O valor da porcentagem em massa de soluto é maior do que zero e inferior a 100%. Assim, o intervalo a ser considerado é: 0 por cento é menor do que por cento 'm' barra 'm' é menor do que 100 por cento.
Podemos calcular a porcentagem em massa de soluto de uma solução. Por exemplo, uma solução é preparada pela dissolução de 5 gramas de hidróxido de sódio abre parênteses N a O H fecha parênteses em 20 gramas de água. Qual é a porcentagem em massa de soluto nessa solução?
Imagem sem proporção e em cores fantasia.
Sabemos que:
- soluto é o hidróxido de sódio em quantidade de 5 gramas, assim 'm' subscrito 1 é igual a 5 gramas;
- solvente é a água, assim 'm' subscrito 2 é igual a 20 gramas;
- logo, 'm' é igual a 25 gramas.
Portanto, substituindo os valores conhecidos na expressão da porcentagem em massa de soluto, tem-se:
por cento 'm' barra 'm' é igual a 100 vezes início de fração, numerador: 'm' subscrito 1, denominador: 'm' subscrito 1 mais 'm' subscrito 2, fim de fração implica em por cento 'm' barra 'm' é igual a 100 vezes início de fração, numerador: 5 gramas, denominador: 5 gramas mais 20 gramas, fim de fração portanto por cento 'm' barra 'm' é igual a 20 por cento
Assim, a porcentagem em massa de soluto nessa solução é por cento 'm' barra 'm' é igual a 20 por cento. Isso significa que em cada 100 gramas de solução há 20 gramas de soluto.
Confira este exemplo resolvido utilizando a regra de três:

'm' subscrito 1 é igual a 20 gramas de N a O H
por cento 'm' barra 'm' é igual a 20 por cento
Título em massa abre parênteses tau fecha parênteses
A relação entre a massa do soluto e a massa da solução, conforme abordado na porcentagem em massa do soluto, é o título tau em massa da solução. Essa relação expressa a massa de soluto 'm' subscrito 1 em 1 grama de solução, que pode ser dada por:
tau é igual a início de fração, numerador: 'm' subscrito 1, denominador: 'm' subscrito 1 mais 'm' subscrito 2, fim de fração portanto tau é igual a início de fração, numerador: 'm' subscrito 1, denominador: 'm', fim de fração
em que:
- 'm' subscrito 1 é a massa do soluto;
- 'm' subscrito 2 é a massa do solvente;
- 'm' é a massa da solução abre parênteses 'm' é igual a 'm' subscrito 1 mais 'm' subscrito 2 fecha parênteses.
Dica
Como a massa do soluto é menor que a massa da solução, então 0 é menor do que tau é menor do que 1. O título da solução é adimensional.
No soro fisiológico, o título é igual a 0,009. Isso significa que para cada unidade de massa da solução há 0,009 unidade de massa de cloreto de sódio e 0,991 unidade de massa de solvente.
4. Considerando o exemplo anterior, em que há uma solução com 5 gramas de hidróxido de sódio dissolvidos em 20 gramas de água, calcule o título em massa dessa solução.
Resposta: tau é igual a 5 sobre 25 é igual a 0 vírgula 2 portanto tau é igual a 0 vírgula 2 de hidróxido de sódio.
Concentração em partes por milhão abre parênteses p p m fecha parênteses e em partes por bilhão abre parênteses p p b fecha parênteses
Já vimos que para determinar a concentração de soluções, em termos de massa do soluto por massa da solução 'm' subscrito 1 barra 'm', utilizamos o título em massa.
Página 204
Existem casos em que a quantidade de soluto é muito pequena. A concentração em p p m indica quantas partes de soluto (em massa ou em volume) há em 1 milhão abre parênteses 10 elevado a 6 fecha parênteses de partes da solução. Essa forma de expressar concentrações é utilizada, por exemplo, para avaliar poluentes ambientais. Portanto:
1 p p m é igual a início de fração, numerador: 1 parte de soluto, denominador: 10 elevado a 6 partes de solução, fim de fração
Para exemplificar isso, podemos citar uma norma estabelecida pelo Conselho Nacional do Meio Ambiente (Conama). Ela estabelece que a quantidade máxima aceitável de enxofre abre parênteses S fecha parênteses no óleo diesel deve ser de 10 p p m, ou seja, 10 partes de enxofre (soluto) para 10 elevado a 6 partes de óleo diesel (mistura). Essa ação busca melhorar a qualidade do ar, principalmente nas grandes cidades brasileiras, beneficiando o meio ambiente e a saúde humana.

Já a concentração em p p b indica quantas partes de soluto (em massa ou em volume) há em 1 bilhão abre parênteses 10 elevado a 9 fecha parênteses de partes da mistura (solução). Assim, matematicamente podemos expressar:
1 p p b é igual a início de fração, numerador: 1 parte de soluto, denominador: 10 elevado a 9 partes de solução, fim de fração
Como exemplo, citamos a portaria nº 2.914/2011 do Conama, que estabelece o limite de 0 vírgula 0 1 miligrama por litro de chumbo abre parênteses P b fecha parênteses na água para considerá-la potável. Como a densidade é é aproximadamente igual a 1 grama por mililitro, esse valor equivale a 0 vírgula 0 1 p p m de chumbo na água potável. Em partes por bilhão, isso equivale a 10 vírgula 0 p p b e significa que a quantidade máxima permitida de chumbo nas águas de abastecimento público é de 10 gramas de chumbo para 10 elevado a 9 grama de água potável.
Concentração em quantidade de matéria abre parênteses c fecha parênteses
A concentração em quantidade de matéria é a relação entre a quantidade de matéria do soluto n subscrito 1 e o volume da solução V em decímetro cúbico ou litro. A concentração de solução em quantidade de matéria depende da massa do soluto e é considerada uma das mais importantes expressões de concentração.
A concentração em quantidade de matéria ou concentração em mol por litro é a expressão recomendada pela IUPAC e pelo SI. Ela pode ser expressa por:
c é igual a início de fração, numerador: n subscrito 1, denominador: V, fim de fração (expressa em mol por decímetro cúbico ou mol por litro)
Professor, professora: Enfatize aos estudantes que utiliza-se 'C' (cê maiúsculo e em itálico) para representar a concentração em massa e c (cê minúsculo e em itálico) para concentração em quantidade de matéria.
em que:
- n subscrito 1 é a quantidade de matéria do soluto;
- V é o volume da solução.
Imagem sem proporção e em cores fantasia.
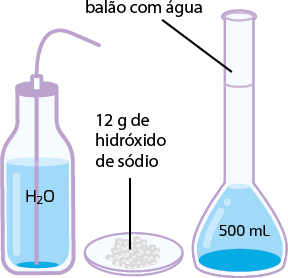
Por exemplo, podemos determinar a concentração em quantidade de matéria da solução preparada pela dissolução de 12 gramas de hidróxido de sódio em água suficiente para obter 0 vírgula 5 litro de solução. Para isso:
1º. Deve-se determinar a quantidade de matéria do soluto, conhecida por número de mol do soluto, n subscrito 1, por meio do cálculo da massa molar do soluto.
M subscrito N a O H é igual a abre parênteses 23 mais 16 mais 1 fecha parênteses grama barra mol implica em M subscrito N a O H é igual a 40 gramas barra mol
Página 205
Em seguida, determina-se a quantidade de matéria de soluto n subscrito 1, que pode ser calculada pela expressão n subscrito 1 é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração, em que 'm' subscrito 1 é a massa do soluto e M subscrito 1 é a massa molar dele.
n subscrito 1 é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração implica em n subscrito 1 é igual a início de fração, numerador: 12 gramas, denominador: 40 gramas barra mol, fim de fração implica em n subscrito 1 é igual a 0 vírgula 3 mol de soluto abre parênteses N a O H fecha parênteses
2º. Depois, calcula-se a concentração em quantidade de matéria substituindo os valores na expressão:
c é igual a início de fração, numerador: n subscrito 1, denominador: V, fim de fração implica em c é igual a início de fração, numerador: 0 vírgula 3 mol, denominador: 0 vírgula 5 litro, fim de fração implica em c é igual a 0 vírgula 6 mol barra litro
A concentração em mol por litro dessa solução é 0 vírgula 6 mol por litro. Isso significa que para cada litro dessa solução há 0 vírgula 6 mol de soluto.
Resolvendo pela regra de três.
Inicialmente, determina-se a quantidade de matéria de soluto n subscrito 1.
Depois, calcula-se a concentração em quantidade de matéria da solução.

Concentração em mol por quilograma abre parênteses Ⱳ fecha parênteses
Em geral, a concentração em mol por quilograma é usada quando há variação da temperatura do sistema, pois o volume da solução pode variar.
A concentração em mol por quilograma expressa a quantidade do soluto n subscrito 1 e a massa do solvente 'm' subscrito 2, em quilogramas, e pode ser representada por:
Ⱳ é igual a início de fração, numerador: n subscrito 1, denominador: 'm' subscrito 2, fim de fração (expressa em mol por quilograma)
em que:
- n subscrito 1 é a quantidade do soluto;
- 'm' subscrito 2 é a massa do solvente.
Por exemplo, tem-se uma solução de ácido sulfúrico abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses em que 24 vírgula 5 gramas de ácido sulfúrico estão dissolvidos em 500 gramas de água. Qual é a concentração em mol por quilograma dessa solução?
1º. Inicialmente, calcula-se a massa molar do soluto.
M início subscrito, H subscrito 2 S O subscrito 4, fim subscrito é igual a abre parênteses 1 vezes 2 mais 32 vezes 1 mais 16 vezes 4 fecha parênteses grama por mol implica em M início subscrito, H subscrito 2 S O subscrito 4, fim subscrito é igual a 98 gramas barra mol
2º. Em seguida, calcula-se a quantidade de matéria de soluto n subscrito 1.
n subscrito 1 é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração implica em n subscrito 1 é igual a início de fração, numerador: 24 vírgula 5 gramas, denominador: 98 gramas barra mol, fim de fração implica em n subscrito 1 é igual a 0 vírgula 25 mol de soluto abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses
3º. Depois, é possível determinar a concentração em mol por quilograma, substituindo os valores na expressão:
Ⱳ é igual a início de fração, numerador: n subscrito 1, denominador: 'm' subscrito 2, fim de fração implica em Ⱳ é igual a início de fração, numerador: 0 vírgula 25 mol, denominador: 0 vírgula 50 quilograma, fim de fração implica em Ⱳ é igual a 0 vírgula 50 mol barra quilograma
A concentração em mol por quilograma dessa solução é 0 vírgula 50 mol por quilograma. Isso significa que para cada quilograma de solvente há 0 vírgula 50 mol de soluto.
O ácido sulfúrico é material corrosivo, portanto deve-se evitar seu contato direto com a pele. Ele pode ser usado na fabricação de fertilizantes, no tratamento de água, como desidratante industrial, entre outras aplicações.

Página 206
Concentração de íons em mol por litro
Nas soluções que apresentam íons, é possível determinar a concentração em mol por litro do soluto e a dos íons provenientes de sua ionização✚ ou dissociação✚. Essa concentração de íons em mol por litro é proporcional aos coeficientes estequiométricos de suas equações químicas e ao seu grau de ionização✚ ou dissociação abre parênteses alfa fecha parênteses.
Por exemplo, sabendo que uma solução aquosa de sulfato de alumínio abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses foi preparada de maneira que, a cada 400 centímetros cúbicos de solução, haja 68 vírgula 4 gramas desse sal, dissolvido à temperatura de 20 graus Celsius, podemos determinar a concentração em quantidade de matéria do sal e dos íons A l elevado a início expoente, 3 mais, fim expoente abre parênteses aq fecha parênteses e S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses nessa solução, sabendo que o seu grau de dissociação é de 60%.
1º. Inicialmente, determina-se a massa molar do soluto:
M início subscrito, A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3, fim subscrito é igual a 27 vezes 2 mais 32 vezes 3 mais 16 vezes 12 implica em M início subscrito, A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3, fim subscrito é igual a 342 gramas barra mol
2º. Em seguida, determina-se a quantidade de matéria do soluto, que é o número de mol do soluto n subscrito 1.
n subscrito 1 é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração implica em n subscrito 1 é igual a início de fração, numerador: 68 vírgula 4 gramas, denominador: 342 gramas barra mol, fim de fração implica em n subscrito 1 é igual a 0 vírgula 2 mol de soluto abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses
3º. Depois, pode-se determinar a concentração em quantidade de matéria do soluto abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses, substituindo os valores na expressão.
c é igual a início de fração, numerador: n subscrito 1, denominador: V, fim de fração implica em c é igual a início de fração, numerador: 0 vírgula 2 mol, denominador: 0 vírgula 4 litro, fim de fração implica em c é igual a 0 vírgula 5 mol barra L de A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses a q fecha parênteses
Logo, a concentração em quantidade de matéria do sal é 0 vírgula 5 mol por litro de A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses a q fecha parênteses. Isso significa que em cada 1 litro dessa solução há 0 vírgula 5 mol de soluto dissolvido.
Por meio da regra de três, calcula-se a massa molar do sal abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses:
M início subscrito, A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3, fim subscrito é igual a 27 vezes 2 mais 32 vezes 3 mais 16 vezes 12 implica em M início subscrito, A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3, fim subscrito é igual a 342 gramas barra mol
Em seguida, calcula-se a quantidade de matéria do sal.

Considerando que 400 centímetros cúbicos equivalem a 400 mililitros, tem-se então 0 vírgula 4 litro de solução. Agora, vamos fazer o cálculo da determinação da concentração em quantidade de matéria do sal.

4º. Para determinar a concentração em quantidade de matéria dos íons A l elevado a início expoente, 3 mais, fim expoente abre parênteses aq fecha parênteses e S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses nessa solução, é necessário considerar a proporção de seus coeficientes estequiométricos e o grau de dissociação.

Assim, as concentrações em quantidade de matéria dos íons são 0 vírgula 6 mol por litro de íons Al elevado a início expoente, 3 mais, fim expoente abre parênteses a q fecha parênteses e 0 vírgula 9 mol por litro de íons S O subscrito 4 elevado a início expoente, 2 menos, fim expoente.
Página 207
ATIVIDADES RESOLVIDAS
R1. Em um laboratório, é preparada uma solução com 72 gramas de glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses dissolvidos em água suficiente para 250 centímetros cúbicos de solução. Determine:
a ) a concentração em massa, em grama por litro.
b ) a concentração em quantidade de matéria da solução.
Resolução
a )
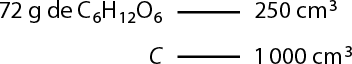
portanto 'C' é igual a 288 gramas por 1.000 centímetros cúbicos ou 288 gramas por litro
b ) Determinando a massa molar do soluto:
M início subscrito, C subscrito 6 H subscrito 12 O subscrito 6, fim subscrito é igual a 12 vezes 6 mais 1 vezes 12 mais 16 vezes 6 é igual a 180
portanto M início subscrito, C subscrito 6 H subscrito 12 O subscrito 6, fim subscrito é igual a 180 gramas por mol
O cálculo da quantidade de matéria do soluto é:
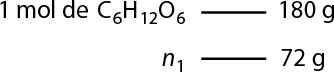
portanto n subscrito 1 é igual a 0 vírgula 4 mol de C subscrito 6 H subscrito 12 O subscrito 6
O cálculo da concentração em quantidade de matéria dessa solução é:
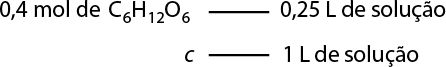
portanto c é igual a 1 vírgula 6 mol por litro de C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses
Assim, a concentração em mol por litro dessa solução é 1 vírgula 6 mol por litro.
R2. O líquido das baterias de chumbo pode ser uma solução aquosa de H subscrito 2 S O subscrito 4, cuja densidade é 1 vírgula 29 grama por centímetro cúbico e o título em massa é igual a 0,38. Qual é a concentração em mol por litro dessa solução?
Resolução
M início subscrito, H subscrito 2 S O subscrito 4, fim subscrito é igual a 1 vezes 2 mais 32 vezes 1 mais 16 vezes 4 é igual a 98
portanto M início subscrito, H subscrito 2 S O subscrito 4, fim subscrito é igual a 98 gramas por mol
Como a densidade da solução é 1 vírgula 29 grama por centímetro cúbico, a massa de um litro abre parênteses 1.000 centímetros cúbicos fecha parênteses dessa solução será 1.290 gramas.
O título em massa igual a 0,38 indica que em cada 1 grama de solução há 0 vírgula 38 grama de soluto. Assim, em 1.290 gramas de solução, a massa de soluto pode ser calculada por:
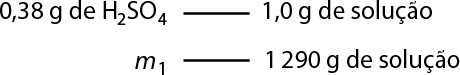
portanto 'm' subscrito 1 é igual a 490 gramas de H subscrito 2 S O subscrito 4
Sabendo qual é a massa do soluto dissolvida em 1 litro de solução, pode-se calcular a quantidade de matéria do soluto, determinando, em seguida, a concentração em quantidade de matéria abre parênteses mol por litro fecha parênteses.
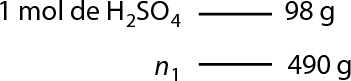
portanto n subscrito 1 é igual a 5 mol por litro de H subscrito 2 S O subscrito 4 abre parênteses a q fecha parênteses
Logo, a concentração em quantidade de matéria abre parênteses mol por litro fecha parênteses será 5 mol por litro de H subscrito 2 S O subscrito 4 abre parênteses a q fecha parênteses.
Isso significa que em 1 litro dessa solução há 5 mol de soluto.
Página 208
ATIVIDADES
1. Um técnico de laboratório preparou 500 mililitros de uma solução aquosa de iodeto de potássio abre parênteses K I fecha parênteses. Para isso, ele misturou 205 gramas desse sal em 430 vírgula 5 gramas de água. Determine:
a ) a concentração da solução expressa em grama por mililitro.
b ) a concentração da solução em grama por litro.
c ) a densidade da solução em grama por mililitro.
d ) a densidade da solução em grama por litro.
2. Determinado produto desengraxante, destinado à remoção de gordura de motores de carros, consiste em uma solução aquosa de concentração 3 vírgula 2 mol por litro de soda cáustica (hidróxido de sódio, N a O H). O rótulo indica que há 900 mililitros desse produto. Nessa concentração, qual é a massa de hidróxido de sódio dissolvida?
3. Observe a fotografia e leia o trecho da matéria a seguir.

Rejeitos da barragem de Brumadinho chegam ao São Francisco, diz ONG
Relatório do SOS Mata Atlântica aponta que lama de rejeitos já atingiu o rio. Agência Nacional de Águas discorda.
Rejeitos de mineração mais finos, carregados de metais pesados provenientes da barragem que se rompeu em Brumadinho, têm afluído no rio São Francisco. Essa foi a principal constatação da segunda expedição da SOS Mata Atlântica pelo rio Paraopeba, realizada de 8 a 14 de março.
[…]
DAMASIO, Kevin. Rejeitos da barragem de Brumadinho chegam ao São Francisco, diz ONG. National Geographic, 22 mar. 2019. Disponível em: https://s.livro.pro/pvhku9. Acesso em: 27 ago. 2024.
a ) Faça uma pesquisa sobre o ocorrido em Brumadinho e, em seguida, responda: quais metais podem estar presentes nos rejeitos desse desastre ambiental?
Resposta: No rejeito pode haver ferro abre parênteses F e fecha parênteses, manganês abre parênteses M n fecha parênteses, alumínio abre parênteses A l fecha parênteses, cromo abre parênteses C r fecha parênteses chumbo abre parênteses P b fecha parênteses, mercúrio abre parênteses H g fecha parênteses, cádmio abre parênteses C d fecha parênteses e arsênio abre parênteses A s fecha parênteses.
b ) Entre os metais pesados há o chumbo, um elemento relativamente abundante na crosta terrestre e que apresenta concentração próxima de 20 p p m (partes por milhão). Determine a massa de chumbo, em gramas, presente em uma amostra de 50 gramas de matéria da crosta terrestre.
Resposta: 'm' subscrito P b é igual a início de fração, numerador: 20 gramas vezes 50 gramas, denominador: 10 elevado a 6 gramas, fim de fração é igual a 1 vezes 10 elevado a menos 3 grama
4. Um farmacêutico prepara 1 quilograma de uma solução aquosa com glicose. Para isso, ele dissolve 50 gramas de glicose. Com base nos dados fornecidos, determine o que se pede nos itens a seguir.
a ) Calcule o título em massa da solução.
b ) Calcule a porcentagem em massa do soluto.
c ) Calcule a porcentagem em massa do solvente.
5. O nitrato de amônio abre parênteses N H subscrito 4 N O subscrito 3 fecha parênteses é um fertilizante muito potente no que diz respeito ao fornecimento de nitrogênio ao solo. Um agricultor que precisa aplicar essa solução tem um frasco com concentração de 0 vírgula 5 mol por litro. Ele deve adicionar ao solo uma quantidade que forneça 0 vírgula 25 mol de nitrato de amônio por metro quadrado de plantação. Com base nessas informações, responda:
a ) Quantos litros da solução o agricultor deve aplicar para fornecer a quantidade necessária de nitrato de amônio a 10 metros quadrados de plantação?
Resposta: Cada litro do produto deve ser adicionado em 2 metros quadrados, portanto em 10 metros quadrados são necessários 5 litros da solução.
b ) Quantos mols há em uma embalagem de 2 litros?
Resposta: c é igual a n sobre V implica em n é igual a c vezes V implica em n é igual a 0 vírgula 5 vezes 2 é igual a 1 portanto 1 mol.
6. O sódio é essencial para o funcionamento adequado do corpo humano, pois participa da regulação do equilíbrio hídrico, da transmissão de impulsos nervosos e da contração muscular. No entanto, o consumo excessivo pode levar a problemas de saúde, como hipertensão arterial, doenças cardiovasculares e problemas renais. Uma análise do teor de sódio em uma amostra de salgadinho revelou que contém 1.500 miligramas de sódio a cada 100 gramas de produto. Com base nessa informação, resolva os itens apresentados.
a ) Calcule a concentração de sódio em ppm na amostra.
b ) Caso uma pessoa consuma uma porção de 30 gramas, quantos miligramas de sódio terá essa porção?
Respostas e resoluções das questões 1, 2, 4 e 6 nas Orientações para o professor.
Página 209
Fração em quantidade de matéria
5. O que significa a palavra fração?
Resposta: De forma geral, a palavra fração representa a razão de uma parte pelo todo.
A palavra fração, em nosso estudo, tem o mesmo significado que você estudou em Matemática. Neste caso, a razão é entre números de mol dos componentes presentes na solução.
Sendo assim, a fração em quantidade de matéria ou fração molar corresponde à razão entre a quantidade de matéria em mol do soluto (ou do solvente) e a soma das quantidades de matéria em mol de todos os componentes da solução.
Logo, temos que:
a fração em quantidade de matéria do soluto abre parênteses x subscrito 1 fecha parênteses indica a razão entre as quantidades de matéria do soluto n subscrito 1 e da solução n, que pode ser representada por:
x subscrito 1 é igual a início de fração, numerador: n subscrito 1, denominador: n, fim de fração (adimensional) 0 é menor do que x subscrito 1 é menor do que 1
a fração em quantidade de matéria do solvente abre parênteses x subscrito 2 fecha parênteses indica a razão entre as quantidades de matéria do solvente n subscrito 2 e da solução n, que pode ser representada por:
Lembrando que n é igual a n subscrito 1 mais n subscrito 2.
x subscrito 2 é igual a início de fração, numerador: n subscrito 2, denominador: n, fim de fração (adimensional) 0 é menor do que x subscrito 2 é menor do que 1
Então, a soma das frações em quantidades de matéria do soluto e do solvente é sempre 1, ou seja, x subscrito 1 mais x subscrito 2 é igual a 1.
Considere que um soro glicosado com 5% de massa (soluto/solvente) utilizado em hospitais é uma solução formada por 5 gramas de glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses dissolvidos em 100 gramas de água abre parênteses H subscrito 2 O fecha parênteses. Com esses dados, podemos determinar as frações em quantidade de matéria do soluto (glicose) e do solvente (água).

1º. Inicialmente, calculam-se as massas molares de cada um dos componentes da solução.
M início subscrito, C subscrito 6 H subscrito 12 O subscrito 6, fim subscrito é igual a abre parênteses 12 vezes 6 mais 1 vezes 12 mais 16 vezes 6 fecha parênteses grama barra mol implica em M início subscrito, C subscrito 6 H subscrito 12 O subscrito 6, fim subscrito é igual a 180 gramas barra mol
M início subscrito, H subscrito 2 O, fim subscrito é igual a abre parênteses 1 vezes 2 mais 16 vezes 1 fecha parênteses grama barra mol implica em M início subscrito, H subscrito 2 O, fim subscrito é igual a 18 gramas barra mol
2º. Em seguida, determinam-se n subscrito 1, n subscrito 2 e n.
n subscrito 1 é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração implica em n subscrito 1 é igual a início de fração, numerador: 5 gramas, denominador: 180 gramas barra mol, fim de fração implica em n subscrito 1 é aproximadamente igual a 0 vírgula 0 28 mol de soluto abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses
n subscrito 2 é igual a início de fração, numerador: 'm' subscrito 2, denominador: M subscrito 2, fim de fração implica em n subscrito 2 é igual a início de fração, numerador: 100 gramas, denominador: 18 gramas barra mol, fim de fração implica em n subscrito 2 é aproximadamente igual a 5 vírgula 556 mol de solvente abre parênteses H subscrito 2 O fecha parênteses
n é igual a n subscrito 1 mais n subscrito 2 implica em n é igual a abre parênteses 0 vírgula 0 28 mais 5 vírgula 556 fecha parênteses mol implica em n é aproximadamente igual a 5 vírgula 584 mol abre parênteses solução fecha parênteses
3º. Assim, a fração em quantidade de matéria de soluto x subscrito 1 é dada por:
x subscrito 1 é igual a início de fração, numerador: n subscrito 1, denominador: n, fim de fração implica em x subscrito 1 é igual a início de fração, numerador: 0 vírgula 0 28 mol, denominador: 5 vírgula 584 mol, fim de fração implica em x subscrito 1 é aproximadamente igual a 0 vírgula 0 0 5
Isso significa que em cada 1 mol de solução há aproximadamente 0 vírgula 0 0 5 mol de soluto.
Já a fração em quantidade de matéria de solvente x subscrito 2 é dada por:
x subscrito 2 é igual a início de fração, numerador: n subscrito 2, denominador: n, fim de fração implica em x subscrito 2 é igual a início de fração, numerador: 5 vírgula 556 mol, denominador: 5 vírgula 584 mol, fim de fração implica em x subscrito 2 é aproximadamente igual a 0 vírgula 995
Esse valor também pode ser obtido pelo uso da relação:
x subscrito 1 mais x subscrito 2 é igual a 1 implica em 0 vírgula 0 0 5 mais x subscrito 2 é igual a 1 implica em x subscrito 2 é igual a 0 vírgula 995
Isso significa que em cada 1 mol de solução há 0 vírgula 995 mol de solvente.
Página 210
Pela regra de três, é possível calcular a fração em quantidade de matéria de soluto x subscrito 1 e de solvente x subscrito 2.
O cálculo da quantidade de matéria da solução abre parênteses n fecha parênteses é:
n é igual a n subscrito 1 mais n subscrito 2 implica em n é igual a abre parênteses 0 vírgula 0 28 mais 5 vírgula 556 fecha parênteses mol implica em n é aproximadamente igual a 5 vírgula 584 mol abre parênteses solução fecha parênteses
Assim, a fração em quantidade de matéria de soluto x subscrito 1 é dada por:
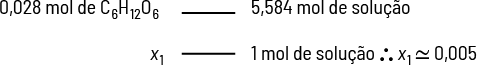
Isso significa que em cada 1 mol de solução há aproximadamente 0 vírgula 0 0 5 mol de soluto.
Já a fração em quantidade de matéria de solvente x subscrito 2 é dada por:
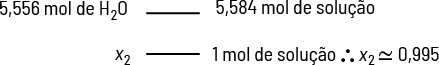
Essa relação é pouco utilizada em soluções líquidas, pois geralmente a quantidade de matéria do soluto é bem menor que a quantidade de matéria da solução.
Relações entre algumas concentrações de soluções
As concentrações em massa 'C' e em quantidade de matéria c podem ser relacionadas da seguinte forma:
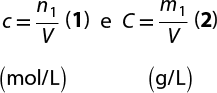
em que: n subscrito 1 é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1, fim de fração (3)
Substituindo (3) em (1), obtém-se:
c é igual a início de fração, numerador: 'm' subscrito 1, denominador: M subscrito 1 vezes V, fim de fração implica em c é igual a início de fração, numerador: 'C', denominador: M subscrito 1, fim de fração
Isolando 'C', a relação obtida é:
'C' é igual a c vezes M subscrito 1
Outras relações envolvendo concentrações de soluções e densidade de solução
| Concentração em massa | Título em massa | Densidade da solução | Concentração em mol por litro |
|---|---|---|---|
|
'C' é igual a início de fração, numerador: 'm' subscrito 1, denominador: V, fim de fração |
tau é igual a início de fração, numerador: 'm' subscrito 1, denominador: 'm', fim de fração |
d é igual a 'm' sobre V |
c é igual a início de fração, numerador: n subscrito 1, denominador: V, fim de fração |
|
seta para baixo |
seta para baixo |
seta para baixo |
seta para baixo |
|
grama por litro |
adimensional |
grama por litro |
mol por litro |
Relações entre as concentrações e a densidade
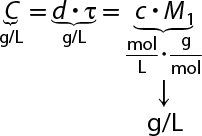
6. Em sua opinião, ao dissolver soluto em determinada quantidade de solvente, está sendo feita uma diluição? Explique sua resposta.
Resposta pessoal. Espera-se que os estudantes respondam que não. O termo diluição é usado quando já se tem uma solução, que, por adição de solvente, forma uma nova solução de concentração menor que a solução inicial. Nesse caso, tem-se uma dissolução, e não uma diluição.
Diluição de soluções
É muito comum que rótulos de embalagens de sucos concentrados orientem os consumidores a acrescentar determinada porção de água durante o preparo. A fotografia na próxima página mostra exatamente esse procedimento. Nesse caso, a água adicionada desempenhou função de solvente, diluindo assim a solução (suco concentrado). Dessa forma, a concentração da solução diminuiu.
Página 211
Imagens desta página sem proporção e em cores fantasia.

7. Você ou alguma pessoa em sua casa já comprou suco concentrado?
Resposta pessoal. Espera-se que os estudantes digam que eles ou as pessoas com quem vivem já compraram suco concentrado.
8. Explique por que o suco é comercializado na forma concentrada em vez de ser vendido pronto para o consumo.
Resposta: Espera-se que os estudantes respondam que, por não ser um produto de consumo imediato, ele ocupa menos espaço e menos gasto com transporte ao estar concentrado.
9. Você conhece outros produtos que são vendidos na forma concentrada?
Resposta pessoal. Os estudantes podem mencionar produtos de limpeza, tinta etc.
Em Química, o termo diluir indica acréscimo de solvente a uma solução, o que diminui a sua concentração. Nesse caso, a quantidade de soluto permanece constante. Em laboratório, utiliza-se uma pipeta (com pera) para transferir uma alíquota✚ de volume conhecido da solução concentrada (solução inicial) para um balão volumétrico e, em seguida, adiciona-se água até o volume final desejado, obtendo a solução diluída (solução final). Analise a representação desse processo a seguir.
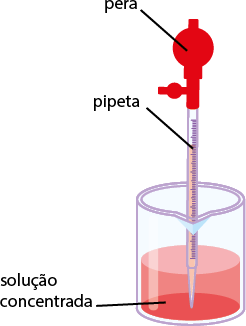
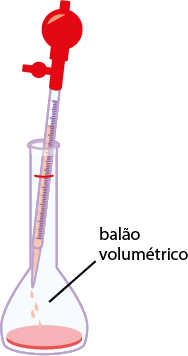
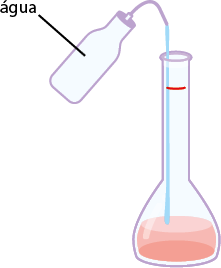

Em geral, o termo concentrar, em Química, indica diminuição da quantidade de solvente da solução, o que aumenta a sua concentração. Nesse caso, se o soluto não for volátil✚ e o solvente não for inflamável✚, ao aquecer a solução para provocar a evaporação do solvente, aumenta-se a concentração da solução.
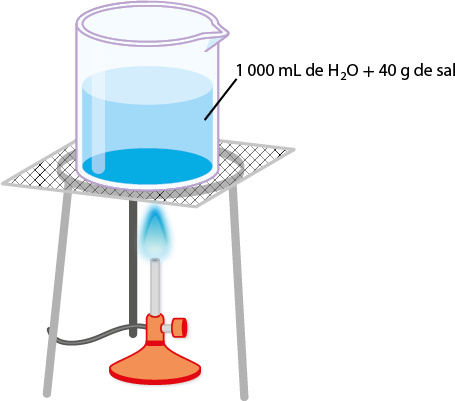
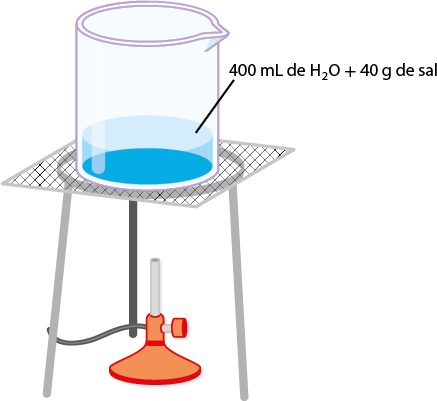
Página 212
Não podemos confundir diluição com dissolução. Na dissolução, adicionamos soluto ao solvente, preparando assim uma solução. Ao acrescentarmos mais solvente, teremos uma diluição.
Perceba que a quantidade de soluto permaneceu constante nas duas situações apresentadas (diluição e concentração de soluções), mas a concentração da solução variou. Assim, temos:
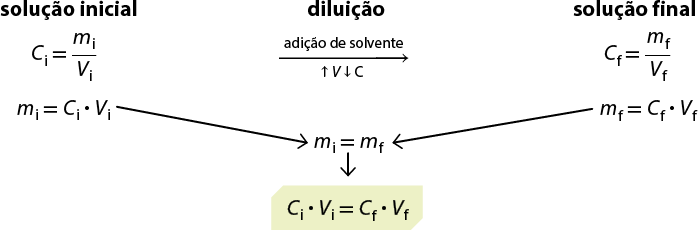
Se a massa do soluto presente na solução se mantiver constante durante a diluição ou a concentração da solução, conclui-se que a quantidade de matéria do soluto permanecerá constante n subscrito i é igual a n subscrito f. Assim, para a concentração em quantidade de matéria abre parênteses mol por litro fecha parênteses, obtém-se a seguinte relação:
c subscrito i vezes V subscrito i é igual a c subscrito f vezes V subscrito f
Esquematicamente, para uma diluição, tem-se:
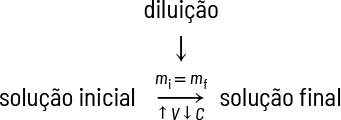
em que V e 'C' são grandezas inversamente proporcionais.
ATIVIDADES RESOLVIDAS
R3. Foram pipetados 25 centímetros cúbicos de uma solução aquosa inicial de ácido nítrico abre parênteses H N O subscrito 3 fecha parênteses, de concentração 16 mol por litro, em 200 centímetros cúbicos de água. Em seguida, adicionou-se água suficiente para atingir o volume final de 500 centímetros cúbicos. Determine a concentração da solução final, em mol por litro.

Resolução
- V subscrito i é igual a 25 centímetros cúbicos, ou seja, 25 mililitros
- c subscrito i é igual a 16 mol por litro
- V subscrito f é igual a 500 centímetros cúbicos
- c subscrito f é igual a ponto de interrogação
Como houve adição de solvente a uma solução inicial (concentrada), o volume aumentou e a concentração diminuiu. Trata-se, portanto, de um procedimento de diluição. Assim, com base na expressão matemática usada em diluição de soluções, se isolarmos a concentração em quantidade de matéria final c subscrito f e, em seguida, substituirmos os valores das demais grandezas, teremos:
c subscrito i vezes V subscrito i é igual a c subscrito f vezes V subscrito f implica em c subscrito f é igual a início de fração, numerador: c subscrito i vezes V subscrito i, denominador: V subscrito f, fim de fração
c subscrito f é igual a início de fração, numerador: 16 mol barra L vezes 25 centímetros cúbicos, denominador: 500 centímetros cúbicos, fim de fração implica em c subscrito f é igual a 0 vírgula 8 mol por litro
Logo, a concentração em quantidade de matéria final para essa solução é 0 vírgula 8 mol por litro. Isso significa que em cada 1 litro dessa solução (final) há 0 vírgula 8 mol de soluto dissolvido.
Pelos dados contidos no texto, vê-se que o volume aumentou 20 vezes abre parênteses de 25 centímetros cúbicos para 500 centímetros cúbicos fecha parênteses. Como concentração de solução e volume são grandezas inversamente proporcionais, a concentração final dessa solução deve ser 20 vezes menor.
Página 213
Mistura de soluções
10. Em sua opinião, o que significa misturar duas soluções?
Resposta pessoal. Espera-se que os estudantes respondam que misturar duas soluções significa colocá-las em um mesmo recipiente.
De acordo com o que já estudamos, é comum prepararmos soluções, que podem ser muito ou pouco concentradas.
Há situações em que podemos misturar duas soluções, como acrescentar adoçante ao café ou juntar um café mais concentrado a outro menos concentrado. Em ambos os casos, estamos colocando duas soluções em um mesmo recipiente, ou seja, misturando soluções.
Imagens desta página sem proporção e em cores fantasia.

11. Cite uma situação em que se misturam duas soluções.
Resposta pessoal. Analise as respostas dos estudantes para verificar se, de fato, consideraram a mistura de duas soluções.
Há casos em que, após misturar soluções, é necessário determinar a concentração de cada componente da mistura final. Para isso, é preciso saber se as soluções misturadas reagem ou não entre si.
Mistura de soluções que não reagem entre si
Na mistura de café com adoçante ou do café concentrado com outro menos concentrado não há reação química. As misturas de soluções que não reagem entre si podem ser tanto de soluções de mesmo soluto como de solutos diferentes.
Ao misturar soluções de mesmo soluto, mas com concentrações diferentes, obtemos uma solução final cujo valor da concentração final fica entre os valores das soluções mais e menos concentradas.
Se considerarmos uma mistura de duas soluções aquosas de sulfato de cobre(II) abre parênteses C u S O subscrito 4 abre parênteses a q fecha parênteses fecha parênteses de concentrações diferentes, seria possível notar o resultado da mistura em relação à cor das concentrações. Uma mistura da solução 1 com a solução 2, ambas apresentadas nas imagens, resultaria em uma solução com tonalidade intermediária entre elas.


Consideremos um experimento em que duas soluções de hidróxido de sódio foram preparadas. A solução A foi preparada dissolvendo 40 gramas em 250 centímetros cúbicos de solvente e a solução B dissolvendo 60 gramas em 250 centímetros cúbicos. A concentração final obtida ao misturar as soluções é apresentada a seguir.
'm' início subscrito, 1 subscrito A, fim subscrito é igual a 40 gramas
V subscrito A é igual a 250 centímetros cúbicos
'C' subscrito A é igual a início de fração, numerador: 40 gramas, denominador: 250 centímetros cúbicos, fim de fração implica em 'C' subscrito A é igual a 0 vírgula 16 grama por centímetro cúbico
'm' início subscrito, 1 subscrito B, fim subscrito é igual a 60 gramas
V subscrito B é igual a 250 centímetros cúbicos
'C' subscrito B é igual a início de fração, numerador: 60 gramas, denominador: 250 centímetros cúbicos, fim de fração implica em 'C' subscrito B é igual a 0 vírgula 24 grama por centímetro cúbico
'm' início subscrito, 1 subscrito f, fim subscrito é igual a 100 gramas
V subscrito f é igual a 500 centímetros cúbicos

'C' subscrito f é igual a início de fração, numerador: 100 gramas, denominador: 500 centímetros cúbicos, fim de fração implica em 'C' subscrito f é igual a 0 vírgula 20 grama por centímetro cúbico
Página 214
Imagens desta página sem proporção e em cores fantasia.
De acordo com esses dados, podemos estabelecer as seguintes relações:
'm' subscrito f é igual a 'm' subscrito A mais 'm' subscrito B (1)
V subscrito f é igual a V subscrito A mais V subscrito B (2)
'C' subscrito A é igual a início de fração, numerador: 'm' subscrito A, denominador: V subscrito A, fim de fração implica em 'm' subscrito A é igual a 'C' subscrito A vezes V subscrito A (3)
'C' subscrito B é igual a início de fração, numerador: 'm' subscrito B, denominador: V subscrito B, fim de fração implica em 'm' subscrito B é igual a 'C' subscrito B vezes V subscrito B (4)
'C' subscrito f é igual a início de fração, numerador: 'm' subscrito f, denominador: V subscrito f, fim de fração implica em 'm' subscrito f é igual a 'C' subscrito f vezes V subscrito f (5)
Se substituirmos (3), (4) e (5) em (1), teremos:
expressão com detalhe abaixo, início da expressão, 'm' subscrito f, início do detalhe abaixo, 'C' subscrito f vezes V subscrito f, fim do detalhe abaixo é igual a expressão com detalhe abaixo, início da expressão, 'm' subscrito A, início do detalhe abaixo, 'C' subscrito A vezes V subscrito A, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, 'm' subscrito B, início do detalhe abaixo, 'C' subscrito B vezes V subscrito B, fim do detalhe abaixo
Logo: 'C' subscrito f vezes V subscrito f é igual a 'C' subscrito A vezes V subscrito A mais 'C' subscrito B vezes V subscrito B
Dessa forma, se misturarmos várias soluções de mesmo soluto, por analogia obteremos, genericamente, as seguintes expressões:
'C' subscrito f vezes V subscrito f é igual a 'C' subscrito A vezes V subscrito A mais 'C' subscrito B vezes V subscrito B mais reticências
c subscrito f vezes V subscrito f é igual a c subscrito A vezes V subscrito A mais c subscrito B vezes V subscrito B mais reticências
Dessa forma, voltando ao experimento anterior, podemos calcular a concentração final da solução da seguinte maneira:
1º. partindo da expressão 'C' subscrito f vezes V subscrito f é igual a 'C' subscrito A vezes V subscrito A mais 'C' subscrito B vezes V subscrito B e isolando 'C' subscrito f, temos:
'C' subscrito f é igual a início de fração, numerador: 'C' subscrito A vezes V subscrito A mais 'C' subscrito B vezes V subscrito B, denominador: V subscrito f, fim de fração
2º. substituindo os valores numéricos, obtemos o valor da concentração final da mistura:
'C' subscrito f é igual a início de fração, numerador: 0 vírgula 16 vezes 250 mais 0 vírgula 24 vezes 250, denominador: 500, fim de fração implica em 'C' subscrito f é igual a 0 vírgula 20 grama por centímetro cúbico
Ao misturar soluções de solutos diferentes sem ter reação química, ocorre a diluição de cada um dos solutos. Nessa situação, como o volume da mistura final é maior e as quantidades de soluto permanecem constantes, as concentrações finais de cada um dos solutos serão menores do que as iniciais.
Considere uma mistura de soluções aquosas de cloreto de sódio (sal de cozinha, N a C l) e de sacarose (açúcar comum, C subscrito 12 H subscrito 22 O subscrito 11), com volumes diferentes.
V subscrito A é igual a 200 centímetros cúbicos
0 vírgula 4 mol de N a C l
V subscrito B é igual a 300 centímetros cúbicos
0 vírgula 9 mol de C subscrito 12 H subscrito 22 O subscrito 11
V subscrito f é igual a 500 centímetros cúbicos
0 vírgula 4 mol de N a C l
0 vírgula 9 mol de C subscrito 12 H subscrito 22 O subscrito 11

No experimento, as concentrações em quantidade de matéria das soluções iniciais e finais podem ser calculadas conforme segue.
1º. Cálculos das concentrações em quantidades de matéria das soluções iniciais A e B.
Solução inicial A: c início subscrito, A subscrito i, fim subscrito é igual a início de fração, numerador: n subscrito A, denominador: V início subscrito, A subscrito i, fim subscrito, fim de fração implica em c início subscrito, A subscrito i, fim subscrito é igual a início de fração, numerador: 0 vírgula 4 mol, denominador: 0 vírgula 2 litro, fim de fração implica em c início subscrito, A subscrito i, fim subscrito é igual a 2 mol por litro de N a C l abre parênteses a q fecha parênteses
Solução inicial B: c início subscrito, B subscrito i, fim subscrito é igual a início de fração, numerador: n subscrito B, denominador: V início subscrito, B subscrito i, fim subscrito, fim de fração implica em c início subscrito, B subscrito i, fim subscrito é igual a início de fração, numerador: 0 vírgula 9 mol, denominador: 0 vírgula 3 litro, fim de fração implica em c início subscrito, B subscrito i, fim subscrito é igual a 3 mol por litro de C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses a q fecha parênteses
Página 215
2º. Cálculos das concentrações em quantidades de matérias da mistura (solução final) para os solutos A e B presentes na solução.
Mistura (solução final): o volume final da solução obtida após a mistura das soluções A e B é igual à soma dos volumes das soluções iniciais abre parênteses 200 centímetros cúbicos mais 300 centímetros cúbicos fecha parênteses. Assim, o volume final da solução após a mistura é igual a 500 centímetros cúbicos.
Utilizando a relação da diluição para cada um dos solutos presentes na mistura, temos:
Solução final A: c início subscrito, A subscrito i, fim subscrito vezes V subscrito A é igual a c início subscrito, A subscrito f, fim subscrito vezes V subscrito f implica em 2 vezes 0 vírgula 2 é igual a c início subscrito, A subscrito f, fim subscrito vezes 0 vírgula 5 implica em c início subscrito, A subscrito f, fim subscrito é igual a 0 vírgula 8
portanto c início subscrito, A subscrito f, fim subscrito é igual a 0 vírgula 8 mol por litro de N a C l abre parênteses a q fecha parênteses
Solução final B: c início subscrito, B subscrito i, fim subscrito vezes V subscrito B é igual a c início subscrito, B subscrito f, fim subscrito vezes V subscrito f implica em 3 vezes 0 vírgula 3 é igual a c início subscrito, B subscrito f, fim subscrito vezes 0 vírgula 5 implica em c início subscrito, B subscrito f, fim subscrito é igual a 1 vírgula 8
portanto c início subscrito, B subscrito f, fim subscrito é igual a 1 vírgula 8 mol por litro de C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses a q fecha parênteses
Imagens desta página sem proporção e em cores fantasia.
O que podemos concluir:
| Solução | Concentração inicial | Concentração na mistura |
|---|---|---|
|
A |
2 mol por litro |
0 vírgula 8 mol por litro |
|
B |
3 mol por litro |
1 vírgula 8 mol por litro |
V subscrito A é igual a 200 centímetros cúbicos
0 vírgula 4 mol de N a C l

V subscrito B é igual a 300 centímetros cúbicos
0 vírgula 9 mol de C subscrito 12 H subscrito 22 O subscrito 11
V subscrito f é igual a 500 centímetros cúbicos
0 vírgula 8 mol por litro de N a C l
1 vírgula 8 mol por litro de C subscrito 12 H subscrito 22 O subscrito 11

Para o cálculo das concentrações das soluções iniciais e finais, em quantidade de matéria, podemos fazer uso da regra de três simples.
Solução inicial A:
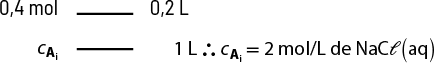
Solução inicial B:
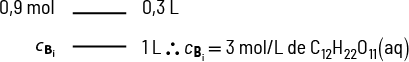
Mistura de soluções (soluções finais A e B):
c início subscrito, A subscrito f, fim subscrito é igual a início de fração, numerador: n subscrito A, denominador: V subscrito f, fim de fração implica em c início subscrito, A subscrito f, fim subscrito é igual a início de fração, numerador: 0 vírgula 4 mol, denominador: 0 vírgula 5 litro, fim de fração implica em c início subscrito, A subscrito f, fim subscrito é igual a 0 vírgula 8 mol por litro de N a C l abre parênteses a q fecha parênteses
c subscrito B subscrito f é igual a início de fração, numerador: n subscrito B, denominador: V subscrito f, fim de fração implica em c subscrito B subscrito f é igual a início de fração, numerador: 0 vírgula 9 mol, denominador: 0 vírgula 5 litro, fim de fração implica em c subscrito B subscrito f é igual a 1 vírgula 8 mol por litro de C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses a q fecha parênteses
Página 216
ATIVIDADES
Imagens desta página sem proporção e em cores fantasia.
1. O cloreto de cálcio abre parênteses C a C l subscrito 2 fecha parênteses é um dos ingredientes utilizados na fabricação de queijos. Sua função é aumentar o rendimento e a eficiência da etapa de coagulação. Com esse objetivo, João, um técnico de laboratório, resolveu preparar uma solução aquosa de cloreto de cálcio dissolvendo 36 vírgula 10 gramas desse soluto em 42 vírgula 75 gramas de água. Qual é a fração em mol de soluto presente na solução preparada por João?
Dados – massas molares abre parênteses grama barra mol fecha parênteses:
C a é igual a 40 ponto-e-vírgula C l é igual a 35 vírgula 5 ponto-e-vírgula H é igual a 1 ponto-e-vírgula O é igual a 16.
2. Em um laboratório, um professor de Química misturou 150 mililitros de solução aquosa a 0 vírgula 20 mol por litro de cloreto de sódio abre parênteses N a C l fecha parênteses com 450 mililitros de uma solução aquosa a 0 vírgula 50 mol por litro também de cloreto de sódio. Qual é a concentração final dessa mistura?
3. Duas soluções aquosas de hidróxido de sódio abre parênteses N a O H fecha parênteses contidas nos balões I e II de concentrações e quantidades de matéria conhecidas são misturadas no balão III, conforme o esquema a seguir.

Considerando os seguintes dados relativos aos balões I, II e III:
Balão volumétrico I:
N a O H abre parênteses a q fecha parênteses implica em 'C' subscrito I é igual a 160 gramas por litro;
c subscrito I é igual a 4 vírgula 0 mol por litro; V subscrito I é igual a 200 mililitros.
Balão volumétrico II:
N a O H abre parênteses aq fecha parênteses implica em 'C' subscrito II é igual a 40 gramas por litro;
c subscrito II é igual a 1 vírgula 0 mol por litro; V subscrito II é igual a 100 mililitros.
Balão volumétrico III:
N a O H abre parênteses a q fecha parênteses implica em 'C' subscrito III é igual a ponto de interrogação; c subscrito III é igual a ponto de interrogação; V subscrito III é igual a 300 mililitros.
Determine a concentração final do balão III em grama por litro e mol por litro.
Respostas e resoluções das questões 1, 2 e 3 nas Orientações para o professor.
4. Em um laboratório, um professor de Química misturou 40 mol de água destilada a 10 mol de álcool comum. Quais são os valores das frações molares do solvente (água destilada) e do soluto (álcool comum)?
a ) 0,4 e 0,1
b ) 20 e 80
c ) 0,8 e 0,2
d ) 0,4 e 0,8
e ) 0,6 e 0,4
Resposta: Alternativa c. Resolução nas Orientações para o professor.
5. Um laboratorista misturou duas soluções abre parênteses X mais Y fecha parênteses formando uma nova solução Z, conforme a ilustração a seguir.

A mistura foi feita com uma solução X de 200 mililitros de cloreto de cálcio abre parênteses C a C l subscrito 2 fecha parênteses, com concentração em massa igual a 60 gramas por litro, e 400 mililitros de outra solução Y de cloreto de cálcio e obteve uma solução Z resultante, de concentração em massa igual a 80 gramas por litro. Calcule a concentração em grama por litro da solução Y.
a ) 150 gramas por litro
b ) 100 gramas por litro
c ) 90 gramas por litro
d ) 65 gramas por litro
e ) 30 gramas por litro
Resposta: Alternativa c. Resolução nas Orientações para o professor.
Página 217
As propriedades coligativas
Até o momento, vimos neste capítulo como as soluções são preparadas em laboratório, como a concentração delas pode ser expressa e alterada pelos processos de diluição e concentração e como esses materiais e procedimentos estão presentes em nosso cotidiano. A partir de agora, vamos estudar como a presença de um soluto interfere nas propriedades do solvente de uma solução.
12. Você já colocou solução de água e sal no congelador? A água congelou?
Resposta pessoal. Caso os estudantes já tenham realizado esse procedimento, espera-se que eles respondam que a água não congelou. Caso contrário, peça-lhes que façam o experimento em casa e verifiquem o que acontece.
Essa questão pode ser respondida com base nos conhecimentos de propriedades coligativas. Vamos analisar uma situação comum do cotidiano em que se ferve água para preparar uma macarronada, por exemplo. A fotografia A mostra um recipiente com água, em processo de ebulição, a 100 graus Celsius, e a fotografia B mostra o mesmo recipiente, logo após a adição de duas colheres de sal. Analise o que aconteceu.
A.

B.

Os líquidos puros, assim como qualquer outra substância, têm valores característicos de pressão de vapor, temperatura de ebulição e temperatura de solidificação/fusão. Esses valores podem levar à identificação de determinada substância. A água, ao nível do mar e à pressão de 1 a t m, entra em ebulição a 100 graus Celsius. Ao dissolver um soluto não volátil nesse líquido (solvente), as propriedades características do solvente se alteram, como no caso da adição do sal (cloreto de sódio) à água.
As propriedades coligativas são as alterações das propriedades do solvente com soluto não volátil, que dependem do número de partículas do soluto, e não de sua identidade química. Portanto, após estudos e experimentos, os químicos concluíram que as propriedades físicas e químicas dos materiais dependem das concentrações das substâncias que o compõem. Logo, as propriedades coligativas são propriedades quantitativas, porque dependem da concentração de soluto não volátil; e não qualitativas, uma vez que não dependem da natureza do soluto.
Por exemplo, no preparo de duas soluções, uma iônica e outra molecular, com volumes iguais e mesma quantidade de matéria em mol, verificamos, ao final, que a solução iônica terá um número de partículas dissolvidas maior que o da solução molecular. Quanto a isso, considere os casos a seguir.
A. Sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses: substância molecular cuja solubilidade em água a 20 graus Celsius é igual a 1.970 gramas por litro.
B. Cloreto de sódio abre parênteses N a C l fecha parênteses: substância iônica cuja solubilidade em água a 20 graus Celsius é igual a 368 gramas por litro.
C. Ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 fecha parênteses: substância molecular que a 20 graus Celsius apresenta grau de ionização igual a 27%.
D. Sulfato de alumínio abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses: composto iônico que a 20 graus Celsius apresenta grau de dissociação igual a 60%.
Página 218
Assim, a 20 graus Celsius são separados 4 recipientes iguais e com capacidade de 1 vírgula 5 litro. Em cada um desses recipientes coloca-se 1 litro de água e adiciona-se, de forma isolada, somente 1 mol das quatro substâncias citadas (C subscrito 12 H subscrito 22 O subscrito 11, N a C l, H subscrito 3 PO subscrito 4 ou A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3). Assim, podemos determinar a ordem crescente de intensidade do efeito coligativo das quatro soluções preparadas.
Se a quantidade de solvente presente em cada solução é de 1 litro e a cada uma foi adicionada uma quantidade de soluto equivalente à massa molar deste, temos:
A. Para a solução de sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses a q fecha parênteses fecha parênteses em 1 litro de solvente a 20 graus Celsius, é possível dissolver até 1.970 gramas do soluto (solubilidade da sacarose). Logo, ao adicionar 342 gramas dessa substância (correspondente à massa de 1 mol) e mexer adequadamente, haverá dissolução total desse açúcar e formação de uma solução insaturada de sacarose.
expressão com detalhe abaixo, início da expressão, C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses s fecha parênteses, início do detalhe abaixo, 1 mol, fim do detalhe abaixo expressão com detalhe acima, início da expressão, expressão com detalhe abaixo, início da expressão, seta para a direita, fim da expressão, início do detalhe abaixo, dissolução, fim do detalhe abaixo, fim da expressão, início do detalhe acima, água, fim do detalhe acima expressão com detalhe abaixo, início da expressão, C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses a q fecha parênteses, início do detalhe abaixo, 1 mol, fim do detalhe abaixo
expressão com detalhe abaixo, início da expressão, 6 vírgula 0 2 vezes 10 elevado a 23 moléculas, início do detalhe abaixo, abre parênteses retículo cristalino fecha parênteses, fim do detalhe abaixo expressão com detalhe abaixo, início da expressão, 6 vírgula 0 2 vezes 10 elevado a 23 moléculas, início do detalhe abaixo, número total de partículas em solução é igual a 6 vírgula 0 2 vezes 10 elevado a 23 partículas, fim do detalhe abaixo
B. Para a solução de cloreto de sódio abre parênteses N a C l abre parênteses a q fecha parênteses fecha parênteses em 1 litro de solvente a 20 graus Celsius, é possível dissolver até 368 gramas de cloreto de sódio (solubilidade do cloreto de sódio). Logo, ao adicionar 58 vírgula 5 gramas dessa substância (correspondente à massa de 1 mol) e mexer adequadamente, haverá dissolução total desse sal e formação de uma solução insaturada de cloreto de sódio.
expressão com detalhe abaixo, início da expressão, N a C l abre parênteses s fecha parênteses, início do detalhe abaixo, 1 mol, fim do detalhe abaixo expressão com detalhe acima, início da expressão, expressão com detalhe abaixo, início da expressão, seta para a direita, fim da expressão, início do detalhe abaixo, dissociação abre parênteses alfa é igual a 100 por cento fecha parênteses, fim do detalhe abaixo, fim da expressão, início do detalhe acima, água, fim do detalhe acima expressão com detalhe abaixo, início da expressão, N a elevado a início expoente, 1 mais, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, 1 mol de cátions, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, C l elevado a início expoente, 1 menos, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, 1 mol de ânions, fim do detalhe abaixo
expressão com detalhe abaixo, início da expressão, 6 vírgula 0 2 vezes 10 elevado a 23 fórmulas unitárias de N a C l, início do detalhe abaixo, abre parênteses retículo cristalino fecha parênteses, fim do detalhe abaixo expressão com detalhe abaixo, início da expressão, 6 vírgula 0 2 vezes 10 elevado a 23 cátions e 6 vírgula 0 2 vezes 10 elevado a 23 ânions, início do detalhe abaixo, íons presentes em solução número total de partículas em solução é igual a 12 vírgula 0 4 vezes 10 elevado a 23 partículas, fim do detalhe abaixo
C. Para a solução de ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 abre parênteses a q fecha parênteses fecha parênteses em 1 litro de solvente a 20 graus Celsius, o grau de ionização é igual a 27%. Assim, ao adicionar 1 mol de moléculas dessa substância, haverá ionização de 0 vírgula 27 mol de moléculas.
| Equação de ionização | Quantidade inicial | Fração reagente (27% de ionização) | Reação | Quantidade final |
|---|---|---|---|---|
| H subscrito 3 P O subscrito 4 |
1 mol |
0 vírgula 27 mol |
0 |
0 vírgula 73 mol (moléculas) |
| água seta para baixo ionização |
água seta para baixo ionização |
água seta para baixo ionização |
água seta para baixo ionização |
água seta para baixo ionização |
| 3 H elevado a início expoente, 1 mais, fim expoente abre parênteses a q fecha parênteses |
0 |
0 |
3 vezes 0 vírgula 27 mol |
0 vírgula 81 mol de cátions |
| mais |
mais |
mais |
mais |
mais |
| P O subscrito 4 elevado a início expoente, 3 menos, fim expoente abre parênteses a q fecha parênteses |
0 |
0 |
0 vírgula 27 mol |
0 vírgula 27 mol de ânions |
Somam-se os valores da última linha do quadro:
0 vírgula 73 mol mais 0 vírgula 81 mol mais 0 vírgula 27 mol é igual a 1 vírgula 81 mol de partículas
Total de partículas em solução: início de fração, numerador: 6 vírgula 0 2 vezes 10 elevado a 23 partículas, denominador: mol, fim de fração vezes 1 vírgula 81 mol é aproximadamente igual a 1 vírgula 0 9 vezes 10 elevado a 24 partículas.
Página 219
D. Para a solução aquosa de sulfato de alumínio abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses a q fecha parênteses fecha parênteses, ao adicionar 1 mol dessa substância em 1 litro de solvente a 20 graus Celsius o grau de dissociação é 60%, então haverá dissociação de 0 vírgula 60 mol desse sal.
| Equação de dissociação | Quantidade inicial | Fração reagente (60% de dissociação) | Reação | Quantidade final |
|---|---|---|---|---|
| A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses s fecha parênteses |
1 mol |
0 vírgula 60 mol |
0 |
0 vírgula 40 mol |
| água seta para baixo ionização |
água seta para baixo ionização |
água seta para baixo ionização |
água seta para baixo ionização |
água seta para baixo ionização |
| 2 A l elevado a início expoente, 3 mais, fim expoente abre parênteses a q fecha parênteses |
0 |
0 |
2 vezes 0 vírgula 60 mol |
1 vírgula 20 mol de cátions |
| mais |
mais |
mais |
mais |
mais |
| 3 S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses |
0 |
0 |
3 vezes 0 vírgula 60 mol |
1 vírgula 80 mol de ânions |
0 vírgula 40 mol mais 1 vírgula 20 mol mais 1 vírgula 80 mol é igual a 3 vírgula 40 mol de partículas
Total de partículas em solução: início de fração, numerador: 6 vírgula 0 2 vezes 10 elevado a 23 partículas, denominador: mol, fim de fração vezes 3 vírgula 40 mol é aproximadamente igual a 2 vírgula 0 5 vezes 10 elevado a 24 partículas. Assim, resumidamente, tem-se:
| Solução | Número total de partículas em 1 litro de solução |
|---|---|
|
C subscrito 12 H subscrito 22 O subscrito 11 abre parênteses a q fecha parênteses |
6 vírgula 0 2 vezes 10 elevado a 23 partículas ou 0 vírgula 602 vezes 10 elevado a 24 partículas |
|
N a C l abre parênteses a q fecha parênteses |
12 vírgula 0 4 vezes 10 elevado a 23 partículas ou 1 vírgula 204 vezes 10 elevado a 24 partículas |
|
H subscrito 3 P O subscrito 4 abre parênteses a q fecha parênteses |
1 vírgula 0 9 vezes 10 elevado a 24 partículas |
|
A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses a q fecha parênteses |
2 vírgula 0 5 vezes 10 elevado a 24 partículas |
Como o efeito coligativo é diretamente proporcional ao número de partículas dispersas em solução, tem-se a seguinte relação em ordem crescente de intensidade do efeito coligativo:
C subscrito 12 H subscrito 22 O subscrito 11 é menor do que H subscrito 3 P O subscrito 4 é menor do que N a C l é menor do que A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3
Neste capítulo, vamos estudar as propriedades coligativas de abaixamento da pressão de vapor do solvente (tonoscopia), o aumento da temperatura de ebulição do solvente (ebulioscopia), o abaixamento do ponto de congelamento do solvente (crioscopia) e o aumento da pressão osmótica (osmoscopia). Para esse estudo, vamos começar com duas propriedades dos solventes que foram vistas no capítulo anterior, a pressão de vapor e a temperatura de ebulição.
Diminuição da pressão de vapor (tonoscopia)
No preparo de uma macarronada, se acrescentarmos sal à água em ebulição, ela pode diminuir ou parar de ferver. Portanto, podemos notar que, ao adicionar a um solvente puro ou a uma solução um soluto não volátil, como o sal de cozinha, ocorre a diminuição na pressão de vapor do solvente. O estudo dessa variação da pressão de vapor do solvente em solução é denominado tonoscopia.
Podemos analisar o comportamento da pressão de vapor da água e da solução de água e sal em função da temperatura. Para isso, aquecendo uma amostra de água e uma amostra da solução de água e sal, podemos representar em um gráfico a variação da pressão de vapor em função da temperatura, como é possível verificar na próxima página.
Página 220
Variação da pressão de vapor delta P em função da temperatura
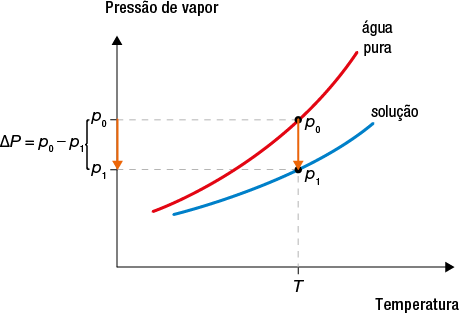
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 590.
13. Analisando os dados representados no gráfico, o que é possível concluir a respeito da variação da pressão de vapor ao acrescentar soluto (sal) ao solvente (água)?
Resposta: Há diminuição do valor absoluto da variação da pressão de vapor. Isso pode ser verificado nas curvas representadas no gráfico. Considerando quaisquer pontos da curva que representa a variação de pressão de vapor da solução, eles estarão abaixo da curva da variação de pressão de vapor da água pura.
De forma geral, a adição de soluto não volátil a um solvente provoca a diminuição da pressão de vapor. A variação da pressão de vapor do solvente delta P é denominada abaixamento absoluto da pressão de vapor do solvente.
A presença das partículas do soluto não volátil dificulta a vaporização das moléculas do solvente. Dessa forma, ocorre a redução da pressão de vapor do líquido, tornando-o menos volátil, o que se refere a um fenômeno conhecido como efeito tonoscópico.
Imagem sem proporção e em cores fantasia.

Imagem elaborada com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 576.
Quanto maior o número de partículas do soluto não volátil em solução, maior será o delta P e, consequentemente, menor será a pressão de vapor do solvente em solução.
A água pura, a 25 graus Celsius, apresenta pressão de vapor de 23 vírgula 80 milímetros Hg. Analise o efeito tonoscópico em duas soluções identificadas como A e B.
A solução A foi elaborada com 1 mol de glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses completamente dissolvido em 1.000 gramas de água pura, com uma pressão de vapor de 23 vírgula 38 milímetros Hg a 25 graus Celsius.
1 mol C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, dissolução, fim do detalhe acima expressão com detalhe abaixo, início da expressão, 1 mol C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses, início do detalhe abaixo, 6 vírgula 0 2 vezes 10 elevado a 23 partículas dissolvidas, fim do detalhe abaixo
A solução B foi elaborada com 0 vírgula 5 mol de cloreto de sódio abre parênteses N a C l fecha parênteses em 1.000 gramas de água pura, com uma pressão de vapor de 23 vírgula 38 milímetros Hg a 25 graus Celsius.
expressão com detalhe abaixo, início da expressão, N a C l abre parênteses s fecha parênteses, início do detalhe abaixo, 0 vírgula 5 mol, fim do detalhe abaixo expressão com detalhe acima, início da expressão, expressão com detalhe abaixo, início da expressão, seta para a direita, fim da expressão, início do detalhe abaixo, dissolução total, fim do detalhe abaixo, fim da expressão, início do detalhe acima, água, fim do detalhe acima expressão com detalhe abaixo, início da expressão, expressão com detalhe abaixo, início da expressão, expressão com detalhe abaixo, início da expressão, N a elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, 0 vírgula 5 mol de partículas dissolvidas, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, 0 vírgula 5 mol de partículas dissolvidas, fim do detalhe abaixo, fim da expressão, início do detalhe abaixo, chave para cima, fim do detalhe abaixo, fim da expressão, início do detalhe abaixo, 1 mol de partículas é igual a 6 vírgula 0 2 vezes 10 elevado a 23 partículas dissolvidas, fim do detalhe abaixo
Página 221
Imagens desta página sem proporção e em cores fantasia.
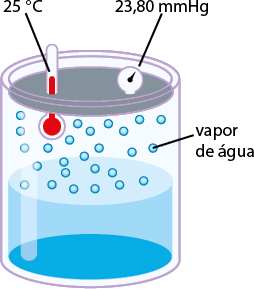
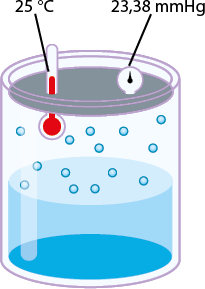
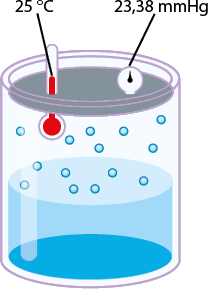
As soluções A e B têm o mesmo número de partículas dissolvidas em um mesmo volume de solvente.
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 576.
Com o experimento, é possível verificar que quantidades iguais de partículas dissolvidas (de diferentes solutos) na mesma quantidade de solvente, à mesma temperatura, causam o mesmo abaixamento na pressão de vapor do solvente na solução. Ou seja, o solvente puro tem maior pressão de vapor que as soluções.
Elevação da temperatura de ebulição (ebulioscopia)
14. Por que a água em ebulição em um recipiente para de ferver quando a ela é adicionada uma quantidade de açúcar ou de sal?
Resposta: Porque ocorre aumento da sua temperatura de ebulição, parando de ferver até que atinja a nova temperatura de ebulição.
15. Qual queimadura seria mais dolorida: a causada por água fervente ou a mistura de água fervente com açúcar? Por quê?
Resposta: A queimadura causada por água fervente com açúcar é mais dolorida, pois sua temperatura de fervura é maior.
Ao adicionar um soluto não volátil a um solvente puro ou a uma solução, ocorre uma diminuição na pressão de vapor do solvente. Assim, para que ocorra a ebulição do solvente dessa solução, é necessário aumentar a temperatura até a pressão de vapor do solvente se igualar à pressão externa (na maioria dos casos, pressão atmosférica). O estudo dessa variação da temperatura de ebulição é denominado ebulioscopia.
As soluções A e B têm o mesmo número de partículas dissolvidas em um mesmo volume de solvente.
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 591.
Com o experimento, pode-se verificar que a adição de um soluto não volátil à água pura causa aumento na temperatura de ebulição do solvente. Nesse caso, a temperatura de ebulição de 100 graus Celsius, na água pura, passou para 100 vírgula 52 graus Celsius, na água com soluto.
Página 222
Essa variação na temperatura de ebulição abre parênteses delta T subscrito e fecha parênteses do solvente é denominada efeito ebulioscópico. Nas soluções A e B, o efeito ebulioscópico foi de 0 vírgula 52 graus Celsius.
Em nível molecular, temos:
Imagens desta página sem proporção e em cores fantasia.
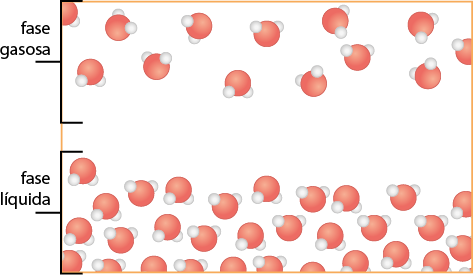

A presença das partículas do soluto não volátil dificulta a ebulição do solvente, aumentando sua temperatura de ebulição.
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 576.
Quanto maior o número de partículas do soluto não volátil dissolvidas em solução, menor será a pressão de vapor do solvente e maior a temperatura de ebulição dele.
Podemos comparar a temperatura de ebulição de um solvente e de duas soluções que tenham o mesmo soluto e solvente, em diferentes quantidades (concentrações), por meio da análise da representação gráfica da variação de pressão em função da temperatura.
Para um mesmo volume, vamos considerar que a solução 2 apresenta maior quantidade de partículas dissolvidas que a solução 1.
Analise a representação a seguir.
Variação da pressão de vapor em relação à temperatura de solvente e soluções
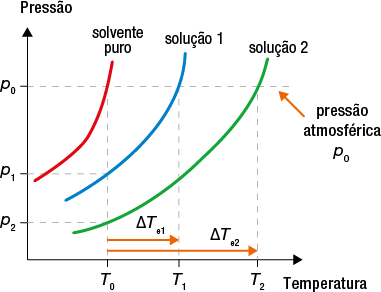
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 579.
Pela análise gráfica, é possível concluir que:
- na temperatura T subscrito 0, a relação entre as pressões de vapor do solvente puro e as soluções 1 e 2 é p subscrito 0 é maior do que p subscrito 1 é maior do que p subscrito 2;
- na temperatura T subscrito 0, o solvente puro tem pressão de vapor igual à pressão atmosférica p subscrito 0. Assim, T subscrito 0 é a temperatura de ebulição do solvente puro;
- a temperatura de ebulição do solvente na solução 1 é T subscrito 1;
- a temperatura de ebulição do solvente na solução 2 é T subscrito 2.
Mais uma vez, evidencia-se que essa propriedade depende exclusivamente da quantidade de matéria do soluto dissolvido, e não da natureza dele.
Esse aumento da temperatura de ebulição do solvente pode ser verificado no preparo do café. Ao adicionar açúcar à água, aumenta-se a temperatura de ebulição do solvente (água). Dessa forma, mantendo as demais condições físicas, a água com açúcar demorará mais para ferver. Quanto maior a quantidade de açúcar (soluto não volátil), maior será o efeito ebulioscópico.
Página 223
Diminuição da temperatura de congelamento (crioscopia)
Imagens desta página sem proporção e em cores fantasia.
Ao adicionar um soluto a um solvente puro, ocorre a diminuição na temperatura de congelamento do solvente. Assim, para que ocorra a solidificação do solvente dessa solução, é necessário diminuir a temperatura dessa solução. Chamamos isso de crioscopia.
Professor, professora: Destaque que o abaixamento da temperatura de congelamento também ocorre com solutos voláteis.
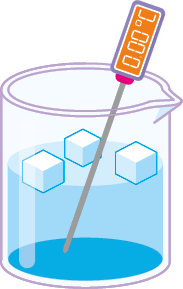
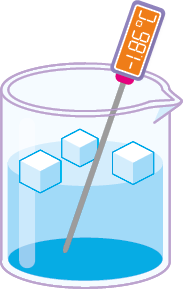
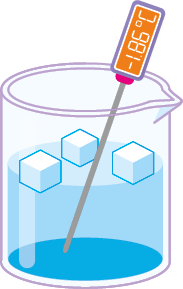
As soluções A e B têm o mesmo número de partículas dissolvidas em um mesmo volume de solvente.
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. 9. ed. São Paulo: Cengage Learning, 2015. v. 1. p. 591.
Com o experimento, pode-se verificar que a adição de um soluto à água pura causa diminuição na temperatura de solidificação do solvente, que passou de 0 grau Celsius para menos 1 vírgula 86 graus Celsius.
Essa variação na temperatura de solidificação abre parênteses delta T subscrito c fecha parênteses do solvente é denominada efeito crioscópico. Nas soluções A e B, o efeito crioscópico foi de 1 vírgula 86 graus Celsius.
Em nível molecular, temos:
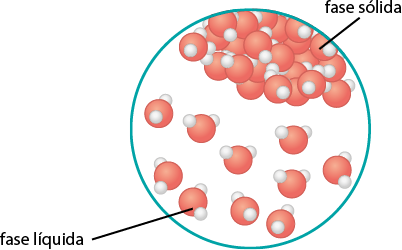
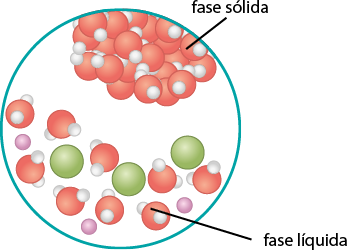
A presença das partículas do soluto dificulta a solidificação do solvente, diminuindo sua temperatura de solidificação.
Imagens elaboradas com base em: ZUMDAHL, Steven S.; ZUMDAHL, Susan A.; DECOSTE, Donald J. Chemistry. 10. ed. Boston: Cengage Learning, 2017. p. 453.
Quanto maior o número de partículas do soluto dissolvidas em solução, menor será a pressão de vapor do solvente e menor será a temperatura de solidificação do solvente nessa solução.
Podemos comparar a temperatura de solidificação de um solvente e de duas soluções que tenham o mesmo soluto e solvente, em diferentes quantidades, por meio da análise da representação gráfica da variação de pressão em função da temperatura.
Vamos considerar que, em um mesmo volume, a solução 2 tem maior quantidade de partículas dissolvidas que a solução 1.
Analise, na representação gráfica da próxima página, as três curvas: solvente puro (água), solução 1 (solução aquosa de N a C l a 0 vírgula 5 mol por litro) e solução 2 (solução aquosa de N a C l a 1 vírgula 0 mol por litro). Quanto maior o número de partículas do soluto em solução, maior será o abaixamento da temperatura de solidificação do solvente e, consequentemente, menor será a temperatura de solidificação do solvente nessa solução.
Página 224
Imagens desta página sem proporção e em cores fantasia.
Variação da pressão de vapor em relação à temperatura de solvente e de soluções
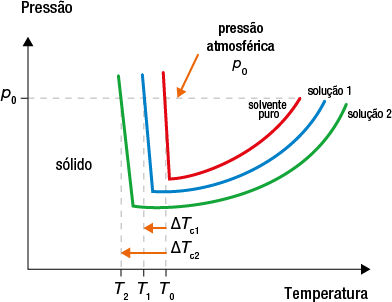
Fonte de pesquisa: CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Porto Alegre: AMGH, 2013. p. 538.
Sendo assim, a diminuição da temperatura de solidificação do solvente depende exclusivamente da quantidade de matéria do soluto dissolvido em solução, e não da natureza dele.
A utilização de etilenoglicol abre parênteses C subscrito 2 H subscrito 6 O subscrito 2 fecha parênteses no fluído de arrefecimento de radiadores de automóveis é um exemplo da aplicação do efeito ebulioscópico e crioscópico, pois ele evita o congelamento fluído em regiões onde as temperaturas chegam a 0 grau Celsius e evita a fervura quando o carro está quente.
Osmose e pressão osmótica
16. Ao colocarmos uvas-passas na água, percebemos que seu volume aumenta. Em sua opinião, por que isso ocorre?
Resposta pessoal. Espera-se que os estudantes respondam que as uvas-passas ficam com volume maior porque a água desloca-se para o seu interior através das membranas celulares.
17. Explique os possíveis motivos que fazem uma folha de alface murchar ao ficar muito tempo em contato com os condimentos da salada.
Resposta: Isso ocorre porque o meio apresenta maior concentração de sais e a água passa através das membranas celulares da alface para o meio.

Você já deve ter percebido que, após temperar uma salada de folhas cruas, elas murcham. Isso ocorre porque a água se difunde do meio menos concentrado (o interior das células das folhas) para o meio mais concentrado (sal do tempero).


A difusão de substâncias (íons sódio, potássio etc.) através de membranas e o controle adequado de suas concentrações são imprescindíveis para os seres vivos.
Imagens elaboradas com base em: JUNQUEIRA, Luiz C.; CARNEIRO, José. Biologia celular e molecular. 9. ed. Rio de Janeiro: Guanabara Koogan, 2012. p. 83.
Página 225
Imagens desta página sem proporção e em cores fantasia.
Antes de serem temperadas, as células vegetais das folhas de acelga estavam normais, mas a adição de porções de sal sobre as folhas fez a água do interior das células migrar para o exterior através da parede celular (membrana semipermeável), realizando o processo conhecido como osmose.
Ao perder água, a célula vegetal tem seu citoplasma retraído, deslocando a membrana plasmática da parede celular e diminuindo seu volume, fazendo que a folha de alface murche. Esse fenômeno é conhecido como plasmólise. Por sua vez, osmose se refere à passagem de líquidos (fluxo de solvente), através de membrana semipermeável, de soluções diluídas (ou de solventes puros) para soluções mais concentradas. Quanto à passagem de solvente através de membrana semipermeável, isso ocorre por causa da diferença de pressão de vapor do solvente puro ou do solvente em solução.
A osmoscopia estuda a passagem espontânea de solvente através de membranas semipermeáveis. Dessa forma, para evitar a osmose, é necessário exercer uma pressão sobre o sistema (no sentido inverso ao da osmose). Essa pressão, responsável por interromper o fluxo osmótico, é denominada pressão osmótica pi e tem intensidade mínima igual à pressão do solvente ao atravessar a membrana semipermeável.
Quanto maior a pressão de vapor do solvente, maior é sua capacidade para atravessar membranas semipermeáveis. Portanto, quanto maior a concentração de uma solução, menor a sua pressão de vapor de solvente, e logo será maior a pressão osmótica pi para impedir que a osmose espontânea ocorra.
A movimentação das espécies químicas através de membranas depende de várias propriedades; entre elas, destacam-se o tamanho, a polaridade e a carga.
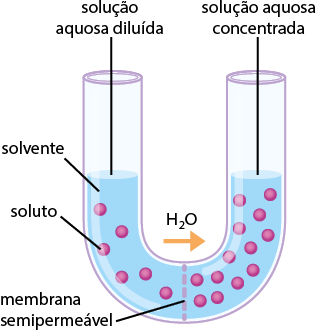
Pressão osmótica: a altura 'h' gera uma pressão hidrostática sobre a membrana, impedindo o fluxo osmótico.
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 582.
De acordo com os seus valores de pressão osmótica, as soluções podem ser comparadas entre si e classificadas em hipotônica, hipertônica ou isotônica.
Vamos considerar duas soluções aquosas de glicose, X e Y, de concentrações em quantidade de matéria respectivamente iguais a 1 vírgula 0 mol por litro e 2 vírgula 0 mol por litro, a uma mesma temperatura. A solução Y é mais concentrada que a solução X; assim, a relação entre suas pressões osmóticas é:
pi subscrito Y é maior do que pi subscrito X
A solução Y é hipertônica em relação à solução X, ou a solução X é hipotônica em relação à solução Y.
Um exemplo prático: o soro fisiológico intravenoso deve ser isotônico em relação às células sanguíneas, ou seja, deve ter a mesma pressão osmótica que a pressão osmótica normal do sangue. Para isso, ele deve apresentar concentração em quantidade de matéria igual a 0 vírgula 15 mol por litro de cloreto de sódio, o que equivale a 0 vírgula 9 por cento m barra m. Isso significa que em cada 100 gramas dessa solução há 0 vírgula 9 grama de cloreto de sódio. Assim, ao usar o soro fisiológico intravenoso (injetável), o solvente (água) pode, com a mesma facilidade, entrar e sair dos glóbulos vermelhos.
Página 226
Analise a representação do que ocorre com uma hemácia ao ser colocada em um recipiente com água pura e em um recipiente com soro fisiológico.
Imagens desta página sem proporção e em cores fantasia.






Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 583.
Osmose nos vegetais
A ascensão da seiva bruta nas plantas ocorre por osmose. A mistura no interior das raízes das plantas tem concentração maior que a do solo e, assim, a água e os sais minerais sobem pelos vasos lenhosos. Entretanto, em árvores muito altas, isso não é suficiente. Segundo a teoria da transpiração-tensão-coesão, desenvolvida pelo botânico irlandês Henry Horatio Dixon (1869-1953), o fator mais importante na ascensão da seiva bruta é a transpiração.
Ocorre transpiração ao ocorrer também a fotossíntese. Nesse caso, os estômatos das folhas se abrem e, com isso, aumenta a concentração no interior das células das folhas. Assim, a água é "puxada" para cima por osmose.
ATIVIDADES RESOLVIDAS
R4. Considere as seguintes soluções aquosas.
| Solubilidade em água | Soluto | Concentração | Solução |
|---|---|---|---|
|
solúvel |
molecular e não volátil |
1 mol por litro |
glicose C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses |
|
solúvel abre parênteses alfa é igual a 100 por cento fecha parênteses |
iônico |
1 mol por litro |
cloreto de sódio N a C l abre parênteses a q fecha parênteses |
|
solúvel |
molecular e não volátil |
1 mol por litro |
ureia C O abre parênteses N H subscrito 2 fecha parênteses subscrito 2 abre parênteses a q fecha parênteses |
|
solúvel abre parênteses alfa é igual a 100 por cento fecha parênteses |
iônico |
1 mol por litro |
sulfato de sódio N a subscrito 2 S O subscrito 4 abre parênteses a q fecha parênteses |
Determine a ordem crescente de:
a ) pressão de vapor.
b ) pressão osmótica.
c ) temperatura de ebulição.
d ) temperatura de congelamento.
Página 227
Resolução
As propriedades coligativas são propriedades quantitativas. Assim, para estabelecer relações entre as soluções citadas, devemos determinar o número de partículas de soluto (não volátil) dispersas no solvente da solução.
Solução aquosa de glicose abre parênteses 1 mol por litro fecha parênteses:

Solução aquosa de cloreto de sódio abre parênteses 1 mol por litro fecha parênteses:
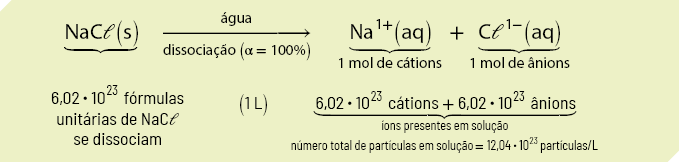
Solução aquosa de ureia abre parênteses 1 mol por litro fecha parênteses:
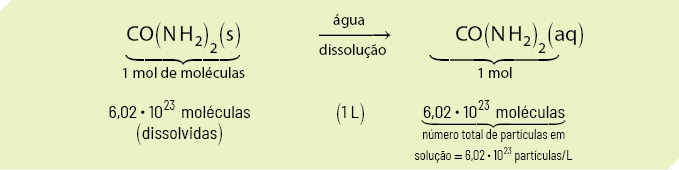
Solução aquosa de sulfato de sódio abre parênteses 1 mol por litro fecha parênteses:

Assim, o número de partículas dispersas por litro de cada uma das soluções pode ser verificado no quadro a seguir.
| Solução | Número de partículas dispersas em 1 litro de solução |
|---|---|
|
Glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses, 1 mol por litro |
6 vírgula 0 2 vezes 10 elevado a 23 partículas |
|
Cloreto de sódio abre parênteses N a C l abre parênteses a q fecha parênteses fecha parênteses, 1 mol por litro |
12 vírgula 0 4 vezes 10 elevado a 23 partículas |
|
Ureia abre parênteses C O abre parênteses N H subscrito 2 fecha parênteses subscrito 2 abre parênteses a q fecha parênteses fecha parênteses, 1 mol por litro |
6 vírgula 0 2 vezes 10 elevado a 23 partículas |
|
Sulfato de sódio abre parênteses N a subscrito 2 S O subscrito 4 abre parênteses a q fecha parênteses fecha parênteses, 1 mol por litro |
18 vírgula 0 6 vezes 10 elevado a 23 partículas |
A ordem crescente do número de partículas dispersas por litro das soluções é:
glicose é igual a ureia é menor do que cloreto de sódio é menor do que sulfato de sódio
Página 228
Já vimos que o efeito coligativo é proporcional ao número de partículas dispersas no solvente da solução, logo:
Quanto maior o número de partículas de soluto dispersas
Maior o efeito coligativo abre chaves. linha 1: tonoscópico dois-pontos diminuição da pressão de vapor do solvente seta para cima delta P. linha 2: ebulioscópico ois-pontos por aumento da temperatura de ebulição do solvente seta para cima delta T subscrito e. linha 3: crioscópico dois-pontos por diminuição da temperatura de solidificação do solvente seta para cima delta T subscrito c. linha 4: osmótico dois-pontos pressão osmótica seta para cima pi.
a ) A ordem crescente da pressão de vapor do solvente em solução é:
sulfato de sódio é menor do que cloreto de sódio é menor do que glicose é igual a ureia
b ) A ordem crescente da pressão osmótica é:
glicose é igual a ureia é menor do que cloreto de sódio é menor do que sulfato de sódio
c ) A ordem crescente da temperatura de ebulição do solvente em solução é:
glicose é igual a ureia é menor do que cloreto de sódio é menor do que sulfato de sódio
d ) A ordem crescente da temperatura de solidificação (congelamento) do solvente em solução é:
sulfato de sódio é menor do que cloreto de sódio é menor do que glicose é igual a ureia
Propriedades coligativas na alimentação
O profissional da indústria do sorvete deve compreender o conceito de crioscopia, pois após o preparo da mistura para sorvete é necessário congelá-la rapidamente. O procedimento consiste em colocar o recipiente contendo o sorvete em uma solução aquosa de propilenoglicol abre parênteses C subscrito 3 H subscrito 8 O subscrito 2 fecha parênteses, um tipo de álcool que, ao ser adicionado à água e dependendo de sua concentração, reduz a temperatura de congelamento da água para valores entre menos 12 graus Celsius e menos 33 graus Celsius.
Antigamente, usava-se salmoura, uma mistura de água e sal. Atualmente, a salmoura não é mais utilizada, pois é corrosiva e pode causar danos aos equipamentos.

A panela de pressão permite fazer a cocção (cozimento) dos alimentos em temperaturas maiores que 100 graus Celsius por causa do aumento de sua pressão interna. Em geral, durante o cozimento, a temperatura interna média pode chegar a aproximadamente 120 graus Celsius, cozinhando os alimentos em menos tempo. Essa pressão interna aumenta até um limite, a partir do qual o pino (válvula) da tampa é empurrado, liberando o vapor e evitando a explosão da panela.

Página 229
ATIVIDADES
Imagens desta página sem proporção e em cores fantasia.
1. Considere um béquer com água (1) e um béquer com solução de água e sal dissolvidos (2), de mesmo volume, e responda às perguntas.
a ) Sob a mesma fonte de calor, se aquecermos os dois béqueres, inicialmente com as mesmas temperaturas e pressão externa, em qual recipiente o líquido entrará primeiro em ebulição em menor temperatura? Por quê?
b ) Se resfriarmos os dois béqueres com as amostras líquidas descritas, submetidas à mesma pressão e ao mesmo trocador de calor, em qual recipiente o líquido se solidificará primeiro? Por quê?
c ) Quais são as propriedades coligativas relatadas nos itens anteriores?
2. Durante uma aula no laboratório de Química, a professora preparou uma mistura para sorvete em uma forma e depois a mergulhou, quase totalmente, em outro recipiente contendo salmoura (mistura de água e sal dissolvido) e gelo. Com isso, em um pequeno intervalo de tempo o sorvete estava pronto.
a ) Explique como a salmoura influencia no congelamento do sorvete.
b ) Qual propriedade coligativa esse experimento evidencia?
3. Em regiões muito quentes, costuma-se adicionar etilenoglicol à água que passa pelo sistema de arrefecimentos dos veículos. Isso evita que a água entre em ebulição com facilidade, pois há aumento da sua temperatura de ebulição. Essa técnica de adição de etilenoglicol está relacionada a qual das propriedades coligativas citadas a seguir? Justifique sua resposta.
a ) Crioscopia.
b ) Tonoscopia.
c ) Ebulioscopia.
d ) Osmometria.
Resposta: Alternativa c.
4. Pesquise e explique o processo da hemodiálise considerando a propriedade coligativa relacionada à osmose. Disserte sobre a importância desse processo e como ele se relaciona com os conhecimentos estudados neste capítulo.
5. Leia o rótulo do frasco de laboratório a seguir. Depois, responda às perguntas.
a ) Esse frasco contém uma solução ou uma substância pura? Justifique sua resposta.
b ) Nessa mistura, o que se refere ao solvente e ao soluto?
c ) Qual é a massa de 1 vírgula 0 litro dessa solução?
d ) Qual é a massa de soluto (ácido nítrico) presente em 1 vírgula 0 litro dessa solução?
Resolução nas Orientações para o professor.
Respostas das questões 1, 2, 4 e 5 nas Orientações para o professor.
6. Ao ajudar sua tia no preparo de alimentos, Renato fez as seguintes anotações:
I ) Ao adicionar açúcar na salada de frutas, ocorreu um aumento no volume de líquido após certo tempo.
II ) Ao adicionar sal em uma panela com água fervente, a fervura cessou por certo tempo.
III ) Alguns minutos após temperar a salada de alface com sal, as folhas de alface murcharam.
Quais propriedades coligativas justificam os itens I, II e III, respectivamente?
a ) Tonoscopia, ebulioscopia e osmose.
b ) Osmose, crioscopia e tonoscopia.
c ) Crioscopia, tonoscopia e osmose.
d ) Osmose, ebulioscopia e crioscopia.
e ) Osmose, ebulioscopia e osmose.
Resposta: Alternativa e.
7. A dissociação total do cloreto de cálcio abre parênteses C a C l subscrito 2 fecha parênteses é representada pela seguinte equação:
C a C l subscrito 2 abre parênteses a q fecha parênteses seta para a direita C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 Cl elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Calcule a concentração em quantidade de matéria dos íons C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses e C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses em uma solução de 2 vírgula 0 mol por litro de C a C l subscrito 2 abre parênteses a q fecha parênteses.
Resposta: Com base na equação química conclui-se que a proporção estequiométrica dos participantes da reação é 1 dois-pontos 1 dois-pontos por 2. Ou seja, em uma solução de 2 vírgula 0 mol por litro formam-se 2 vírgula 0 mol por litro de C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses e 4 vírgula 0 mol por litro de C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses.
Página 230
8. Em um laboratório de controle de qualidade de uma fábrica de açúcar, foram coletadas amostras em diferentes etapas da fabricação. Elas continham água e açúcar com concentrações diferentes e foram separadas em três béqueres. Os três recipientes foram submetidos a análises para obtenção das curvas de aquecimento de cada mistura, que são apresentadas no gráfico a seguir.
Temperatura e pressão de vapor das soluções
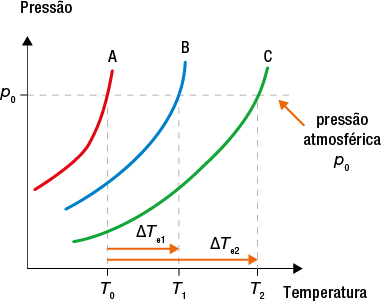
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 579.
De acordo com as informações, escolha a alternativa correta.
a ) A curva A se refere à solução mais concentrada em açúcar.
b ) A curva B é referente a um sistema que apresenta apenas água.
c ) A curva C se refere à solução mais concentrada em açúcar.
d ) A curva A se refere à solução com maior temperatura de ebulição.
e ) A curva C está relacionada à água sem açúcar.
Resposta: Alternativa c.
9. Para conservar alimentos, é comum salgá-los ou colocá-los em soluções concentradas de sal e vinagre, como no caso de conservas de vegetais de pepino e cebola em vinagre e temperos. Esse processo impede a proliferação de microrganismos, pois:
a ) a solução ao redor do alimento se torna hipotônica, fazendo que os microrganismos absorvam água e se desidratem.
b ) a solução ao redor do alimento se torna hipertônica, causando a saída de água das células dos microrganismos por osmose, levando à desidratação e à inativação deles.
c ) a solução ao redor do alimento se torna isotônica, impedindo a troca de água entre os microrganismos e o ambiente.
d ) a solução ao redor do alimento se torna hipertônica, impedindo que os microrganismos absorvam nutrientes essenciais do alimento.
Resposta: Alternativa b.
10. Carlos está analisando o quadro nutricional de um isotônico que costuma consumir após os treinos e anotou as seguintes informações.
| Informação nutricional | Quantidade por porção de 500 mililitros |
|---|---|
|
Valor energético |
100 quilocalorias |
|
Carboidratos totais |
25 gramas |
|
Açúcares (glicose) |
6 gramas |
|
Sódio |
110 miligramas |
Com base nessas informações, qual é a concentração aproximada em mol por litro de glicose e sódio no isotônico, respectivamente?
Dados: massa molar do sódio é igual a 23 gramas por mol e glicose é igual a 180 gramas por mol.
a ) 6 vírgula 6 vezes 10 elevado ao cubo mol por litro e 9 vírgula 6 vezes 10 elevado ao quadrado mol por litro.
b ) 9 vírgula 6 vezes 10 elevado ao quadrado mol por litro e 6 vírgula 5 vezes 10 elevado ao cubo mol por litro.
c ) 3 vírgula 3 vezes 10 elevado a menos 2 mol por litro e 9 vírgula 6 vezes 10 elevado a menos 3 mol por litro.
d ) 6 vírgula 6 vezes 10 elevado a menos 2 mol por litro e 9 vírgula 6 vezes 10 elevado a menos 3 mol por litro.
11. Para analisar o comportamento de algumas substâncias em aquecimento, um técnico em Química colocou para aquecer três béqueres. O primeiro contendo água, o segundo contendo uma mistura de quantidades iguais de água e glicerina abre parênteses C subscrito 3 H subscrito 8 O subscrito 3 fecha parênteses e o terceiro apenas com glicerina. Ao chegar à temperatura de aproximadamente 100 graus Celsius, apenas o líquido do primeiro béquer entrou em processo de ebulição. Represente as partículas dos três béqueres no início e quando o primeiro béquer atingiu 100 graus Celsius.
12. Ao ajudar seu pai a preparar o almoço, Fernando observou que ele havia colocado feijão para cozinhar dentro de uma panela de pressão, enquanto o arroz e a carne estavam sendo cozidos em panelas comuns. Fernando, então, perguntou a seu pai por que o feijão estava em uma panela de pressão.
Apresente uma resposta que o pai de Fernando poderia dar ao filho, explicando as diferenças entre cozinhar um alimento em uma panela de pressão e em uma panela comum.
Respostas das questões 11 e 12 nas Orientações para o professor.
Página 231
13. Para preparar uma salmoura e temperar uma carne, um cozinheiro utilizou o padrão sugerido de 50 gramas de sal para 1 litro de água. A quantidade de carne que era preciso para ser temperada era grande e ele dispunha em sua cozinha de aproximadamente 630 gramas de sal. Levando em consideração esses dados, calcule:
a ) o volume de água necessário para dissolver 630 gramas de sal.
b ) a concentração molar da salmoura, considerando que M subscrito N a C l é igual a 58 vírgula 44 gramas por mol.
c ) a concentração comum da salmoura final.
d ) a quantidade de água que seria necessária para diluir a salmoura até 0 vírgula 5 mol por litro.
Resoluções nas Orientações para o professor.
14. O quadro a seguir mostra a faixa de dosagem de essências em diferentes tipos de produtos em uma perfumaria.
| Produto | Faixa de dosagem em por cento abre parênteses v barra v fecha parênteses |
|---|---|
|
Perfume |
20 a 30 |
|
Eau de Parfum |
15 a 20 |
|
Eau de Toilette |
5 a 15 |
|
Desodorante Colônia |
3 a 5 |
|
Água Colônia |
Até 3 |
a ) Em um frasco contendo 70 mililitros de perfume, qual a quantidade máxima de essência presente?
b ) Qual produto contém 2 vírgula 6 mililitros de essência em um frasco de 50 mililitros da mistura?
Resoluções nas Orientações para o professor.
15. A adição de fluoreto às águas de abastecimento público é uma prática obrigatória para a promoção da saúde bucal, especialmente em crianças. Na estação de tratamento de um município, a água tratada fica com a concentração de fluoreto em 5 vírgula 0 vezes 10 elevado a menos 5 mol por litro. Um morador dessa cidade consome em média 3 litros de água por dia. Ao fim de um dia, qual será a quantidade de massa ingerida de fluoreto?
Massa molar do flúor: 19 gramas por mol.
a ) 1 vírgula 0 85 grama
b ) 1 vírgula 95 miligrama
c ) 2 vírgula 55 gramas por litro
d ) 2 vírgula 85 miligramas
e ) 0 vírgula 285 grama
Resposta: Alternativa d. Resolução nas Orientações para o professor.
16. Aproveitar as propriedades coligativas que ocorrem a partir de adição de solutos a solventes pode ser uma prática muito comum no cotidiano de algumas pessoas. Leia a seguir algumas aplicações desses fenômenos:
I ) Para cozinhar alguns alimentos de forma mais rápida, porém, sem utilizar uma panela de pressão, pode-se adicionar cloreto de sódio à água que será utilizada para o cozimento.
II ) Em lugares de clima frio, é comum adicionar cloreto de sódio ou cloreto de magnésio nas estradas para evitar a formação de gelo.
III ) Por meio da utilização de soluções em diferentes concentrações e membranas semipermeáveis, é possível controlar o fluxo de entrada e saída de moléculas e íons de determinados sistemas.
Todos os fenômenos apresentados são explicados pelas propriedades coligativas. Identifique qual item a seguir contém essas propriedades na ordem apresentada.
a ) Ebulioscopia, tonoscopia e ebulioscopia.
b ) Ebulioscopia, crioscopia e osmose.
c ) Crioscopia, tonoscopia e osmose.
d ) Crioscopia, ebulioscopia e osmose.
e ) Tonoscopia, osmose e crioscopia.
Resposta: Alternativa b.
17. Uma estação de tratamento de água analisou uma amostra de água potável e encontrou uma concentração de 2 p p m de flúor abre parênteses F fecha parênteses. Sendo a densidade da amostra 1 grama por mililitro, isso significa que:
a ) há 2 gramas de flúor em 1 litro de água potável.
b ) há 2 miligramas de flúor em 1 litro de água potável.
c ) há 2 gramas de flúor em 1 mililitro de água potável.
d ) há 2 miligramas de flúor em 1 mililitro de água potável.
Resposta: Alternativa b. Resolução nas Orientações para o professor.
18. As células vegetais têm uma estrutura chamada vacúolo central, responsável por armazenar água, nutrientes e outras substâncias. Quando essas células estão em ambientes com diferentes concentrações de água, podem ocorrer processos de osmose, em que a água se move através da membrana celular para equilibrar as concentrações dentro e fora da célula. Esse movimento pode causar alterações na forma e no funcionamento das células vegetais.
Imagine que você está analisando ao microscópio células vegetais em diferentes soluções: uma solução hipotônica, uma isotônica e uma hipertônica. Represente como pode ser essa visualização através do microscópio. Além disso, faça uma pesquisa para explicar como isso acontece na natureza e quais são as consequências desses processos para a planta, sejam negativas ou positivas.
Respostas das questões 13, 14 e 18 nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
18. As células vegetais têm uma estrutura chamada vacúolo central, responsável por armazenar água, nutrientes e outras substâncias. Quando essas células estão em ambientes com diferentes concentrações de água, podem ocorrer processos de osmose, em que a água se move através da membrana celular para equilibrar as concentrações dentro e fora da célula. Esse movimento pode alterar a forma e o funcionamento das células vegetais.
Imagine que você está analisando pelo microscópio células vegetais em diferentes soluções: uma solução hipotônica, uma isotônica e uma hipertônica. Descreva como pode ser essa visualização através do microscópio. Além disso, faça uma pesquisa para explicar como isso acontece na natureza e quais são as consequências desses processos para a planta, sejam elas negativas ou positivas.
Resposta: Espera-se que os estudantes descrevam as características das células vegetais em diferentes soluções. Em uma solução hipotônica, a célula vegetal se apresenta túrgida por conta da absorção de água, com o vacúolo expandido. Na solução isotônica, a célula mantém seu tamanho normal, com equilíbrio na entrada e na saída de água. Já na solução hipertônica, a célula perde água, o vacúolo encolhe e ela murcha. Além disso, os estudantes devem pesquisar como esses processos ocorrem na natureza, discutindo as consequências para a planta, como a importância da turgescência para o suporte estrutural e os efeitos negativos do murchamento em condições de seca.
Página 232
CAPÍTULO12
Quantidade e proporção de matéria
Cálculo estequiométrico
Quando preparamos algum alimento, como um bolo, geralmente seguimos uma receita que apresenta as quantidades necessárias dos ingredientes para preparar determinada quantidade de porções.

1. O que aconteceria se dobrássemos as quantidades de ingredientes?
Resposta: Espera-se que os estudantes respondam que dobraríamos a quantidade de porções de bolo pronto.
2. O que aconteceria se fizéssemos o bolo apenas com a metade da quantidade de farinha indicada na receita?
Resposta: Espera-se que os estudantes respondam que o resultado não corresponderia à receita.
Nas reações químicas ocorre algo semelhante, pois as substâncias reagem e dão origem a produtos seguindo determinadas proporções. Para investigar como isso ocorre, vamos tomar como exemplo a fotossíntese, um dos processos relacionados ao ciclo do carbono. É por meio dessa reação que o carbono abre parênteses C fecha parênteses, presente na atmosfera na forma de dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses, é absorvido novamente para participar da constituição dos seres vivos.
Vamos retomar a reação geral da fotossíntese:
6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, luz, fim do detalhe acima C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses
Analisando a equação química, notamos que, para produzir uma molécula de glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses por meio da fotossíntese, são necessárias seis moléculas de dióxido de carbono e seis moléculas de água abre parênteses H subscrito 2 O fecha parênteses. Nessa reação ainda são produzidas seis moléculas de gás oxigênio abre parênteses O subscrito 2 fecha parênteses.
Além de obter energia dos açúcares, as plantas usam esse carbono absorvido para produzir outras moléculas, como carboidratos mais complexos (sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses e celulose abre parênteses C subscrito 6 H subscrito 10 O subscrito 5 fecha parênteses subscrito n, por exemplo), aminoácidos e proteínas.
3. A celulose é usada para fabricar um produto muito comum. Qual é esse produto? Comente com os colegas.
Resposta: Espera-se que os estudantes citem, entre outros exemplos, o papel.
A sacarose é um carboidrato formado pela união de dois açúcares simples (monossacarídeos), a glicose e a frutose (que têm a mesma fórmula molecular C subscrito 6 H subscrito 12 O subscrito 6).
Mas quantas moléculas de dióxido de carbono absorvidas durante a fotossíntese são necessárias para produzir uma molécula de sacarose?
Como cada molécula de sacarose é composta de duas moléculas de monossacarídeo (glicose e frutose), temos:

Essa proporção vale para qualquer quantidade de moléculas de sacarose. Basta multiplicar o número de moléculas de sacarose por 12 para obter a quantidade necessária de moléculas de dióxido de carbono.
Em Química, os cálculos proporcionais entre os reagentes e os produtos de uma reação química são chamados cálculos estequiométricos.
Página 233
A quantidade de componentes cuja massa pode ser medida com uma balança está associada ao conceito de mol.
Dica
Ao realizar os cálculos estequiométricos, considera-se que a proporção entre reagentes e produtos em uma reação química é dada em mol.
Mol é a quantidade de matéria de um sistema que apresenta número de unidades elementares igual ao número de átomos contidos em 12 gramas de carbono-12 (C 12) . No Sistema Internacional de Unidades (SI), a unidade de medida da grandeza denominada quantidade de matéria é o mol.
Balanceamento das equações químicas
Nas reações químicas, novas substâncias são formadas (produtos) por meio do rearranjo dos átomos dos reagentes. Dessa forma, antes e depois da reação química, a quantidade de átomos de cada elemento químico permanece constante.
As equações químicas, que representam as transformações que ocorrem nas reações químicas, devem mostrar que houve a conservação dos átomos de todos os elementos químicos, assim como a conservação das massas, como estudamos no capítulo 10.
Vamos considerar, novamente, a formação da água com os gases hidrogênio abre parênteses H subscrito 2 fecha parênteses e oxigênio.
H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses l fecha parênteses
Do lado dos reagentes, existem dois átomos de hidrogênio abre parênteses H fecha parênteses e dois de oxigênio abre parênteses O fecha parênteses. Do lado dos produtos, também existem dois átomos de hidrogênio, mas há apenas um de oxigênio. Dessa forma, não ocorre a conservação do número de átomos e, portanto, das massas.
Para que a massa de oxigênio seja conservada, são necessários dois átomos de oxigênio do lado dos produtos. Para fazer esse acerto, consideraremos a formação de duas moléculas de água na reação.
H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses
No entanto, surge agora um novo problema. A massa de hidrogênio não se conserva mais, pois há dois átomos de hidrogênio no reagente e quatro átomos de hidrogênio no produto. Faremos um acerto semelhante ao que fizemos com o oxigênio, acrescentando o número dois na frente da fórmula do gás hidrogênio:
2 H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses
Dessa vez, as massas e as quantidades de átomos se conservam. Dizemos que essa equação química está balanceada. Os números que inserimos na frente das fórmulas para balancear a equação são chamados coeficientes estequiométricos.
Compartilhe ideias
Embora a água seja um recurso abundante na Terra, a maior parte dela (cerca de 97%) é salgada, inadequada ao consumo humano. Além disso, dos 3% de água doce, cerca de 2,34% encontram-se em geleiras, e o restante precisa passar por tratamento para ser utilizado. Ou seja, a água adequada para consumo é escassa.

a ) Pesquise e converse com um colega a respeito da possibilidade e viabilidade de produzir água por meio da reação apresentada. Dialoguem também sobre o que podemos fazer em nosso cotidiano para utilizar a água de forma consciente, evitando o desperdício.
Resposta pessoal. O objetivo desta questão é que os estudantes realizem pesquisas em fontes confiáveis e façam uma síntese das informações que obtiveram a respeito da possibilidade da produção de água a partir da reação apresentada a eles. Essa atividade incentiva-os a refletir sobre as atitudes que contribuem com o uso consciente da água, como desligar o chuveiro enquanto ensaboa o corpo, fechar a torneira enquanto escova os dentes etc.
Página 234
Esse processo para balancear as equações químicas é conhecido como método das tentativas. Ele pode ser usado para muitas reações, algumas delas bastante complexas.
Dica
Ao usar esse método, inicie o balanceamento escolhendo o elemento químico que apareça menos vezes nos reagentes e nos produtos.
4. Agora, com a ajuda do professor, aplique-o para balancear a equação química global da fotossíntese.
C O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, luz, fim do detalhe acima C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
Resposta: Pode-se iniciar pelo C ou H, pois cada um deles está presente em apenas uma fórmula nos reagentes e produtos. Usando o C, deve-se colocar o número 6 na frente do C O subscrito 2, pois cada glicose tem 6 carbonos. Em seguida, para o H, são necessárias 6 moléculas de H subscrito 2 O para que se tenha 12 átomos de H nos reagentes. Para o oxigênio, como há 18 átomos nos reagentes e cada molécula de O subscrito 2 nos produtos tem 2 átomos, são necessárias 6 moléculas de O subscrito 2 para obter os 12 átomos que faltam.
Relação entre massas
Os cálculos estequiométricos são muito utilizados para resolver problemas reais nas indústrias químicas.
Como vimos, uma equação química balanceada nos fornece a proporção, em mol, entre os reagentes e os produtos. Mas como podemos obter essas proporções em unidades de massa? Afinal, não existem balanças que nos mostrem quantidades em mol. Para responder a essa pergunta, vamos relembrar o conceito de massa molar, visto no capítulo 5 da unidade 1.
Massa molar
Para compreender a massa molar, é necessário retomar os conceitos de massa atômica e de massa molecular. A massa atômica é a massa de um átomo medida em unidades (unidade). Cada unidade equivale a 1 barra 12 da massa de um átomo de carbono-12. As massas atômicas podem ser obtidas consultando a tabela periódica e, para obter a massa molecular de um composto, basta somar a massa dos átomos constituintes.
ATIVIDADES RESOLVIDAS
R1. Calcule a massa molecular do dióxido de carbono.
Resolução
Consultando a tabela periódica, obtemos a massa do carbono, 12 unidades, e a massa do oxigênio, 16 unidades. Para o C O subscrito 2, a massa molecular pode ser obtida por: abre parênteses 1 vezes 12 unidades fecha parênteses mais abre parênteses 2 vezes 16 unidades fecha parênteses é igual a 44 unidades. Portanto, a massa molecular do C O subscrito 2 é de 44 unidades.
Por definição, 1 mol de moléculas de CO subscrito 2 equivale a 6 vírgula 0 2 vezes 10 elevado a 23 moléculas de C O subscrito 2. A massa contida em 1 mol de unidades elementares de uma substância é chamada massa molar abre parênteses M fecha parênteses. A unidade de medida da massa molar é grama por mol, no entanto, para calcular a massa molar, são usados os valores de massa atômica obtidos na tabela periódica, em unidade.
Portanto, a massa molar do CO subscrito 2 será 44 gramas por mol.
Cálculo das massas em uma reação química
Na equação química global da fotossíntese, temos a seguinte proporção em massas.
expressão com detalhe abaixo, início da expressão, 6 C O subscrito 2 abre parênteses g fecha parênteses, fim da expressão, início do detalhe abaixo, 264 gramas, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, 6 H subscrito 2 O abre parênteses l fecha parênteses, fim da expressão, início do detalhe abaixo, 108 gramas, fim do detalhe abaixo expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, luz, fim do detalhe acima expressão com detalhe abaixo, início da expressão, C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses, fim da expressão, início do detalhe abaixo, 180 gramas, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, 6 O subscrito 2 abre parênteses g fecha parênteses, fim da expressão, início do detalhe abaixo, 192 gramas, fim do detalhe abaixo
Dica
A ausência de coeficiente equivale ao coeficiente 1.
Para determinar a massa em gramas de uma substância que participa de uma reação química, utilizando a equação balanceada, a massa molar da substância deve ser multiplicada pelo seu coeficiente. Portanto, as massas molares do C O subscrito 2, H subscrito 2 O e O subscrito 2 foram multiplicadas por seis.
Essa proporção das massas, que obedece à lei de Proust, não se altera. Utilizando esses valores podemos obter, por meio de cálculos proporcionais, as massas de reagentes e de produtos para qualquer situação desejada.
Página 235
ATIVIDADES RESOLVIDAS
R2. Leia o trecho do texto de divulgação científica a seguir.
Pesquisa mostra que cultura do trigo absorve mais C O subscrito 2 do que emite
Pesquisa, conduzida pela Embrapa Trigo (RS) e a Universidade Federal de Santa Maria (UFSM), comprovou que o trigo é capaz de sequestrar mais carbono do que emite para a atmosfera. Os cientistas observaram que durante o ciclo produtivo o trigo absorveu um total de 7.540 quilogramas de dióxido de carbono abre parênteses CO subscrito 2 fecha parênteses por hectare da atmosfera, neutralizando as emissões dos períodos de pousio (sem plantas de cobertura do solo ou cultura geradora de renda sob a forma de forragem ou produção de grãos) e garantindo a oferta líquida de 1.850 quilogramas de CO subscrito 2 por hectare. […]
ANTUNES, Joseani M. Pesquisa mostra que cultura do trigo absorve mais CO subscrito 2 do que emite. Empresa Brasileira de Pesquisa Agropecuária, 6 jun. 2023. Disponível em: https://s.livro.pro/ey8bvn. Acesso em: 30 ago. 2024.
Considerando as informações do texto, qual é a quantidade de gás oxigênio formada pelo total de dióxido de carbono absorvido por hectare de uma plantação de trigo?
Resolução
Vamos utilizar a proporção entre as massas de CO subscrito 2 e O subscrito 2 na equação global da fotossíntese:
6 C O subscrito 2 abre parênteses g fecha parênteses 264 gramas mais 6 H subscrito 2 O abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, luz, fim do detalhe acima C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses 192 gramas
Realizando o cálculo proporcional para a quantidade de 7.540 quilogramas de C O subscrito 2, temos:
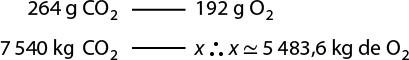
Assim, são liberados aproximadamente 5 vírgula 48 toneladas de gás oxigênio para a atmosfera.
5. Converse com um colega sobre a importância da conservação da vegetação nos ambientes.
Resposta: Espera-se que os estudantes comentem que a vegetação contribui nos ciclos biogeoquímicos, nos regimes de chuvas, além de fornecer abrigo e alimento a muitos animais e proteger o solo.
Relação entre matéria e volume
Para compreender a relação entre matéria e volume, devemos conhecer a seguinte constatação de Amedeo Avogadro: volumes iguais de diferentes gases, na mesma temperatura e pressão, apresentam mesma quantidade de partículas abre parênteses 6 vírgula 0 2 vezes 10 elevado a 23 fecha parênteses. Essa consideração deu origem ao conceito de volume molar.
Volume molar
O volume molar é o volume ocupado por 1 mol de partículas de um gás, ou seja, 6 vírgula 0 2 vezes 10 elevado a 23 partículas desse material, em uma dada temperatura abre parênteses T fecha parênteses e pressão abre parênteses P fecha parênteses.
Os volumes das substâncias gasosas variam de acordo com a pressão e a temperatura em que se encontram. Em experimentos químicos, é comum trabalharmos em Condições Normais de Temperatura e Pressão (CNTP). Isto é, a temperatura normal é de 0 grau Celsius (ou 273 vírgula 15 Kelvin), e a pressão normal equivale a 1 a t m ou 101.325 pascals, equivalente à pressão ao nível do mar. O volume molar de um gás qualquer, nas CNTP, é aproximadamente igual a 22 vírgula 4 litros.
Da mesma forma que os cálculos estequiométricos são utilizados para calcular a massa das substâncias, eles também podem ser utilizados para determinar os volumes para substâncias gasosas. Confira o exemplo na próxima página.
Página 236
ATIVIDADES RESOLVIDAS
R3. Sabendo que 1 hectare de uma plantação de trigo absorveu 7.540 quilogramas de gás carbônico da atmosfera, qual é o volume de gás oxigênio nas CNTP, em litros, liberado por hectare na atmosfera?
Resolução
Vamos utilizar a proporção entre a massa de CO subscrito 2 e o volume de O subscrito 2 nas CNTP:
6 C O subscrito 2 abre parênteses g fecha parênteses expressão com detalhe abaixo, início da expressão, 264 gramas, fim da expressão, início do detalhe abaixo; fim do detalhe abaixo mais 6 H subscrito 2 O abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, luz, fim do detalhe acima C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses expressão com detalhe abaixo, início da expressão, 6 vezes 22 vírgula 4 litros é igual a 134 vírgula 4 litros, fim da expressão, início do detalhe abaixo; fim do detalhe abaixo
Agora, montaremos o cálculo proporcional para a quantidade de 7.540 quilogramas de C O subscrito 2:
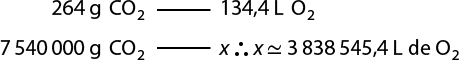
Assim, são liberados aproximadamente 3.838.545 vírgula 4 litros de gás oxigênio para a atmosfera. Note que as massas de CO subscrito 2 devem ser expressas na mesma unidade.
6. A reação de pirólise do carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses produz óxido de cálcio abre parênteses C a O fecha parênteses e dióxido de carbono. Essa reação já era conhecida na Roma antiga, de modo que a cal foi utilizada na construção dos limes, pequenas fronteiras do Império Romano. Atualmente, esse processo, conhecido como calcinação, pode ser utilizado em escala industrial para a produção de cal. De acordo com essa reação química, determine o volume de dióxido de carbono, nas CNTP, produzido com a decomposição de 450 gramas de carbonato de cálcio.
C a C O subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, delta, fim do detalhe acima C a O abre parênteses s fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses

Resposta nas Orientações para o professor.
Fórmulas químicas
As fórmulas que utilizamos para representar as substâncias nas equações químicas, como C O subscrito 2, H subscrito 2 O, C subscrito 6 H subscrito 12 O subscrito 6, são chamadas fórmulas moleculares. Nelas estão indicadas as quantidades de átomos de cada elemento químico que constitui cada substância.
A fórmula mínima ou fórmula empírica fornece a proporção mínima, em números inteiros, dos átomos de cada elemento químico que constitui a substância. A fórmula mínima da glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses é C H subscrito 2 O, e é obtida dividindo todos os índices da fórmula por 6. As fórmulas CO subscrito 2 e H subscrito 2 O também são fórmulas mínimas, pois não é possível simplificar seus índices.
A fórmula percentual ou centesimal fornece a porcentagem (%), em massa, de cada elemento químico da substância. Confira como é obtida a fórmula percentual da glicose.
Primeiramente, a massa molar da glicose é calculada da seguinte forma:
Carbono: 6 vezes 12 gramas por mol é igual a 72 gramas por mol
Hidrogênio: 12 vezes 1 grama por mol é igual a 12 gramas por mol
Oxigênio: 6 vezes 16 gramas por mol é igual a 96 gramas por mol
Massa molar abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses é igual a 6 vezes 12 gramas barra mol mais 12 vezes 1 grama barra mol mais 6 vezes 16 gramas barra mol é igual a 180 gramas barra mol
A porcentagem de cada elemento químico pode ser obtida por meio dos seguintes cálculos.
C: 72 sobre 180 vezes 100 por cento é igual a 40 vírgula 0 por cento
H: 12 sobre 180 vezes 100 por cento é aproximadamente igual a 6 vírgula 7 por cento
O: 96 sobre 180 vezes 100 por cento é aproximadamente igual a 53 vírgula 3 por cento
Portanto, a fórmula percentual da glicose é C início subscrito, 40 vírgula 0 por cento, fim subscrito H início subscrito, 6 vírgula 7 por cento, fim subscrito O início subscrito, 53 vírgula 3 por cento, fim subscrito.
Página 237
ATIVIDADES
1. Faça o balanceamento das equações químicas a seguir.
a ) F e subscrito 2 O subscrito 3 abre parênteses s fecha parênteses mais C abre parênteses s fecha parênteses seta para a direita F e abre parênteses s fecha parênteses mais C O abre parênteses g fecha parênteses.
Resposta: F e subscrito 2 O subscrito 3 abre parênteses s fecha parênteses mais 3 C abre parênteses s fecha parênteses seta para a direita 2 F e abre parênteses s fecha parênteses mais 3 C O abre parênteses g fecha parênteses
b ) A l abre parênteses s fecha parênteses mais C l subscrito 2 abre parênteses g fecha parênteses seta para a direita A l C l subscrito 3 abre parênteses s fecha parênteses.
Resposta: 2 A l abre parênteses s fecha parênteses mais 3 C l subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 A l C l subscrito 3 abre parênteses s fecha parênteses
c ) S O subscrito 2 abre parênteses g fecha parênteses mais N a O H abre parênteses a q fecha parênteses seta para a direita N a subscrito 2 S O subscrito 3 abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses.
Resposta: S O subscrito 2 abre parênteses g fecha parênteses mais 2 N a O H abre parênteses a q fecha parênteses seta para a direita N a subscrito 2 S O subscrito 3 abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
2. O clorato de potássio abre parênteses K C l O subscrito 3 fecha parênteses vírgula por decomposição térmica, forma o cloreto de potássio abre parênteses K C l fecha parênteses e o gás oxigênio. Qual é a massa máxima de cloreto de potássio formada com a decomposição de 5 mol de clorato de potássio? Consulte os dados necessários na tabela periódica.
Resposta: Como a equação balanceada é 2 K C l O subscrito 3 abre parênteses s fecha parênteses seta para a direita 2 K C l abre parênteses s fecha parênteses mais 3 O subscrito 2 abre parênteses g fecha parênteses, a massa molar do K C l deve ser multiplicada por cinco: 74 vírgula 55 gramas vezes mol elevado a menos 1 vezes 5 mol é igual a 372 vírgula 75 gramas.
3. Em 2024, o vulcão Ruang entrou em erupção, espalhando cinzas e gases na atmosfera. Além disso, com a erupção, mais de 12 mil pessoas que viviam próximo ao vulcão tiveram que ser evacuadas da região.

O vulcão pode ser uma fonte natural de dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses, um gás tóxico. Sobre as informações apresentadas, responda os itens a seguir.
a ) Explique o que é o vulcanismo. Se necessário, realize uma pesquisa.
b ) Determine a massa molecular do S O subscrito 2.
c ) Determine a massa molar do S O subscrito 2.
d ) Considere uma amostra contendo 256 gramas de dióxido de enxofre a 0 grau Celsius e 1 a t m. Qual é a quantidade de matéria, em mols, da amostra?
e ) Com os dados e as mesmas condições do item anterior, qual é o volume, em litros, dessa amostra?
4. A hidrazina é um combustível de foguetes e apresenta a seguinte composição percentual, em massa, de cada elemento químico.
- Nitrogênio abre parênteses N fecha parênteses: 87,5%.
- Hidrogênio abre parênteses H fecha parênteses: 12,5%.
Sobre essa substância, é correto afirmar que:
a ) em 10 gramas de hidrazina, há 87 vírgula 5 gramas de nitrogênio e 12 vírgula 5 gramas de hidrogênio.
b ) na hidrazina, a relação entre as quantidades de matéria de nitrogênio e de hidrogênio é de 2 dois-pontos 1.
c ) na hidrazina, a relação entre as quantidades de matéria de nitrogênio e de hidrogênio é de 6 vírgula 25 dois-pontos 12 vírgula 5.
Resposta: Alternativa c. N dois-pontos início de fração, numerador: 87 vírgula 5, denominador: 14 vírgula 0, fim de fração é igual a 6 vírgula 25. H dois-pontos início de fração, numerador: 12 vírgula 5, denominador: 1 vírgula 0, fim de fração é igual a 12 vírgula 5.
5. Hidrocarbonetos são compostos que, ao sofrerem combustão completa (reação com gás oxigênio), formam CO subscrito 2 e H subscrito 2 O.
Analise a seguir a equação incompleta da combustão de um hidrocarboneto linear saturado e responda ao que se pede.
C subscrito lacuna H subscrito lacuna mais lacuna O subscrito 2 seta para a direita 6 C O subscrito 2 mais 7 H subscrito 2 O
Complete a equação química e escreva o nome do hidrocarboneto.
Resposta: C subscrito 6 H subscrito 14 mais 19 sobre 2 O subscrito 2 seta para a direita 6 C O subscrito 2 mais 7 H subscrito 2 O. O nome do hidrocarboneto é hexano.
6. A cafeína (C subscrito 8 H subscrito 10 N subscrito 4 O subscrito 2) é componente de diversos tipos de alimentos e bebidas, como chocolate quente, chá mate ou chá preto, além do próprio café. Entretanto, segundo a Agência Nacional de Vigilância Sanitária (Anvisa), um adulto não deve consumir mais do que 400 miligramas de cafeína diariamente (o equivalente a quatro xícaras de café).
a ) Sabendo que uma porção de 28 gramas de chocolate contém 12 miligramas de cafeína, quantos gramas desse chocolate um adulto pode ingerir para não ultrapassar o limite máximo de cafeína, caso ele já tenha consumido duas xícaras de café?
b ) Qual número de mols equivale à quantidade máxima de cafeína que pode ser ingerida?
Respostas e resoluções das questões 3 e 6 nas Orientações para o professor.
Página 238
Rendimento das reações químicas
O nitrogênio gasoso abre parênteses N subscrito 2 fecha parênteses é o gás mais abundante da atmosfera. Cerca de 78% do ar é composto desse gás. Além disso, o nitrogênio é um elemento químico essencial para os seres vivos, pois participa da composição dos aminoácidos e das proteínas. No entanto, a maioria dos seres vivos não consegue absorvê-lo diretamente do ar. Um dos processos que possibilita a entrada do nitrogênio na cadeia alimentar é a sua transformação em amônia abre parênteses N H subscrito 3 fecha parênteses, que ocorre pela ação de microrganismos presentes no solo, na água ou em raízes que contenham a enzima nitrogenase. No solo, a amônia pode formar íons amônio abre parênteses N H subscrito 4 elevado a início expoente, mais, fim expoente fecha parênteses, em razão da presença de íons hidrônio abre parênteses H subscrito 3 O sobrescrito mais fecha parênteses e íons nitrato abre parênteses N O subscrito 3 elevado a início expoente, menos, fim expoente fecha parênteses, pela ação de outros microrganismos. Essas duas formas do nitrogênio podem ser absorvidas pelas plantas e transferidas aos animais por meio da cadeia alimentar.
A amônia tem diversas aplicações industriais, como a fabricação de fertilizantes, plásticos e detergentes.
O aumento no uso de fertilizantes, no início do século XX, provocou insuficiência da produção natural de amônia à demanda. Em 1909, o químico alemão Fritz Haber (1868-1934) propôs um processo de obtenção da amônia com o nitrogênio atmosférico, por meio da seguinte reação:
N subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N H subscrito 3 abre parênteses g fecha parênteses

Nos anos posteriores, esse processo foi aperfeiçoado por outro químico alemão, chamado Carl Bosch (1874-1940). Por essa razão, esse processo é conhecido como síntese de Haber-Bosch e até hoje é o meio mais usado para a produção industrial da amônia. Por essas descobertas, Fritz Haber ganhou o prêmio Nobel de Química em 1918 e Carl Bosch, em 1931.
Entre outros fatores, Bosch modificou as condições da reação, como pressão e temperatura, para aumentar seu rendimento. Na prática, os reagentes de uma reação química não são totalmente convertidos em produtos. A porcentagem de reagentes convertida em produtos é o rendimento da reação.
Nos cálculos estequiométricos, pode-se calcular tanto as quantidades de produtos levando em conta o rendimento da reação quanto o rendimento da reação com base na quantidade de produto obtido.
Vamos considerar que, no processo de produção da amônia, o rendimento da reação seja de 60%. Qual será a quantidade de amônia obtida ao reagirmos 280 quilogramas de gás nitrogênio?
Inicialmente, precisamos escrever a equação química balanceada e, por meio das massas molares, determinar a massa dos componentes em questão.
N subscrito 2 abre parênteses g fecha parênteses 28 gramas mais 3 H subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N H subscrito 3 abre parênteses g fecha parênteses 34 gramas
Em seguida, calculamos a quantidade obtida de amônia considerando que todo o gás nitrogênio será convertido. Isso equivale a uma reação cujo rendimento é de 100%.
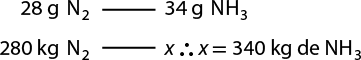
Se o rendimento for de 60%, significa que serão obtidos 60% da massa calculada.
60 centésimos vezes 340 quilogramas é igual a 204 quilogramas de N H subscrito 3
Assim, com 280 quilogramas de N subscrito 2 são obtidos 204 quilogramas de N H subscrito 3.
Página 239
Agora, vamos considerar que, em diferentes condições de operação dos equipamentos, ainda não seja conhecido o rendimento da reação de produção industrial da amônia. Uma análise em laboratório revelou que, para cada 5 gramas de gás nitrogênio utilizados, foram obtidos 4 gramas de amônia. Qual é o rendimento da reação nessas condições?
Precisamos calcular, novamente, a quantidade de amônia obtida para a situação em que o rendimento seja de 100%.
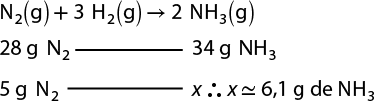
Podemos calcular o rendimento da seguinte maneira.
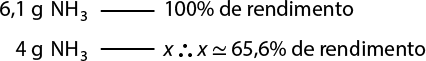
Assim, nessas condições de operação, o rendimento da reação é de aproximadamente 65,6%.
A amônia é matéria-prima para a produção de fertilizantes. No entanto, para produzi-la, usa-se hidrogênio oriundo do gás natural, que resulta na emissão de grande quantidade de dióxido de carbono. Uma alternativa sustentável é a produção e utilização da amônia verde, que consiste em usar o gás hidrogênio obtido pela eletrólise da água, utilizando fontes de energia renováveis. A produção da amônia verde pode contribuir com alguns Objetivos de Desenvolvimento Sustentável (ODS) da Agenda 2030:



Reagente limitante e em excesso
O gás nitrogênio utilizado no processo de produção da amônia é proveniente do ar atmosférico, portanto, ele tem um custo baixo, pois basta filtrar o ar atmosférico e comprimi-lo para usá-lo. Já o gás hidrogênio é adquirido por processos industriais e tem um custo associado a esse fator, por isso deve ser utilizado com a menor perda possível.
Em uma reação química, quando o intuito é forçar a reação de todos os reagentes para formar o produto, um dos reagentes é adicionado em excesso, isto é, em quantidade acima daquela necessária, seguindo a proporção estequiométrica.
Na produção da amônia, por exemplo, o gás nitrogênio é adicionado em excesso, provocando a reação de maior quantidade de gás hidrogênio possível e, consequentemente, a conversão em produto de uma maior quantidade de reagentes.
O reagente totalmente consumido na reação é chamado reagente limitante, pois, como será totalmente consumido, seu esgotamento limita a continuidade da reação.
O reagente colocado em quantidade acima da proporção estequiométrica é chamado reagente em excesso.
Imagine que em uma fábrica de amônia pretende-se produzir duas toneladas desse material e que as condições utilizadas permitem a ocorrência da reação com 100% de rendimento. Para determinar a quantidade do reagente limitante e a quantidade mínima do reagente em excesso, devemos, inicialmente, calcular a quantidade de reagentes necessária como se não houvesse excesso de reagentes.
Para obter duas toneladas de amônia, temos os seguintes cálculos.
Página 240
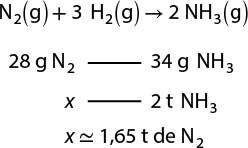
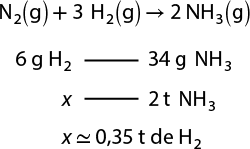
Assim, o reagente limitante será o gás hidrogênio, utilizando 0 vírgula 35 tonelada, e o reagente em excesso será o gás nitrogênio, sendo necessário usar uma quantidade maior ou igual a 1 vírgula 65 tonelada para garantir que as duas toneladas de amônia sejam formadas.
Outra situação envolvendo reagentes em excesso ocorre em combinações de quantidades aleatórias de reagentes, fora da proporção estequiométrica, com o intuito de obter determinada quantidade de produto.
Por exemplo, na reação de formação da água com gases hidrogênio e oxigênio, foram misturados 20 quilogramas de H subscrito 2 e 100 quilogramas de O subscrito 2. Qual dos reagentes foi adicionado em excesso e qual foi a quantidade de água obtida?
Nesse caso, o primeiro passo é descobrir qual dos reagentes está em excesso. Não podemos usar o reagente em excesso para calcular a quantidade de produto, pois nem toda a massa dessa substância reagirá.
Para a reação de formação da água, temos:
2 H subscrito 2 abre parênteses g fecha parênteses 4 gramas mais O subscrito 2 abre parênteses g fecha parênteses 32 gramas seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses 36 gramas
Podemos identificar, pela proporção estequiométrica, que a quantidade em massa de gás oxigênio deve ser equivalente a oito vezes a quantidade de gás hidrogênio. Portanto, para 20 quilogramas de H subscrito 2 seriam necessários 160 quilogramas de O subscrito 2. Como foram misturados 100 quilogramas de O subscrito 2, este é o reagente limitante, pois está abaixo da quantidade necessária para reagir com todo o H subscrito 2. Logo, o gás hidrogênio está em excesso.
Vamos calcular o excesso de gás hidrogênio. Para isso, calcularemos qual seria a quantidade desse gás na proporção estequiométrica para reagir com 100 quilogramas de O subscrito 2.
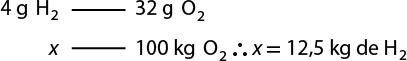
Assim, o excesso de H subscrito 2 será: 20 quilogramas menos 12 vírgula 5 quilogramas é igual a 7 vírgula 5 quilogramas.
Para calcular a quantidade de água obtida, pode-se usar a quantidade dada de O subscrito 2 ou a quantidade de H subscrito 2, desde que seja descontado o excesso. Vamos fazer o cálculo utilizando a quantidade estequiométrica de H subscrito 2:
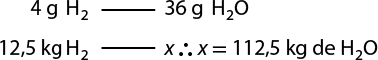
Logo, a quantidade de água obtida é de 112 vírgula 5 quilogramas.
Compartilhe ideias
Ao contrário do petróleo, o combustível hidrogênio não é encontrado diretamente na natureza, pois esse elemento químico está, geralmente, associado a outros. Dessa forma, são necessários alguns processos para obtê-lo.
Uma vantagem do combustível hidrogênio é a possibilidade de obter energia elétrica por meio de células de hidrogênio, nas quais ocorrem reações químicas contendo somente água como produto.

a ) Converse com um colega a respeito das possibilidades de uso das células de hidrogênio e das principais dificuldades enfrentadas ao usá-las em larga escala. Se necessário, façam uma pesquisa.
Resposta: Espera-se que os estudantes citem o uso em veículos como carros, caminhões e ônibus, maquinários como empilhadeiras, pequenos geradores elétricos que podem atender a indústrias e residências, entre outras aplicações. Entre as principais dificuldades para uso em larga escala estão a obtenção do hidrogênio de forma eficaz, o transporte e a distribuição desse combustível.
Página 241
Em muitos processos industriais emprega-se o mesmo artifício usado na produção da amônia e, mesmo que um reagente tenha baixo custo, após a reação ele é separado do produto, purificado e reutilizado.
Pureza dos reagentes
7. Você já ouviu o termo quilate? Para você, o que ele significa?
Resposta: O objetivo desta questão é aproximar o conteúdo do cotidiano dos estudantes. Incentive a troca de informações entre eles acerca do termo quilate e verifique se o relacionam à pureza de metais, como o ouro. Geralmente, esse termo é utilizado no mercado de joias.
No ramo das joias, o termo quilate é uma grandeza que informa a pureza do metal usado na fabricação delas. Convencionou-se que um objeto feito com ouro abre parênteses A u fecha parênteses puro apresenta 24 quilates.

Professor, professora: Explique aos estudantes que não é possível obter ouro completamente puro. Dessa forma, o ouro 24 quilates corresponde ao ouro com 99,9% de pureza.
Em muitos processos industriais, o material de partida não é totalmente puro. Esse tipo de problema é frequente na obtenção de metais oriundos de seus minérios. Para calcular corretamente as quantidades estequiométricas dos reagentes, as amostras do minério são analisadas no laboratório a fim de conhecer a porcentagem de impurezas contida na matéria-prima.
Confira a seguir como fazer cálculos envolvendo reagentes que não são puros.
ATIVIDADES RESOLVIDAS
R4. Um dos processos para obter ferro abre parênteses Fe fecha parênteses é feito por meio da hematita, um minério que apresenta 80% de óxido de ferro(III) abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses. A equação química da reação desse processo é:
F e subscrito 2 O subscrito 3 abre parênteses s fecha parênteses mais 3 C abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, delta, fim do detalhe acima 2 F e abre parênteses s fecha parênteses mais 3 C O abre parênteses g fecha parênteses
Qual será a massa de ferro metálico obtida no processamento de 1 tonelada desse minério?

Resolução
Como o minério contém 80% de F e subscrito 2 O subscrito 3, apenas essa parcela sofrerá reação.
80 centésimos vezes 1 tonelada é igual a 0 vírgula 8 tonelada
Agora, devemos fazer o cálculo estequiométrico usando as massas molares das substâncias envolvidas.
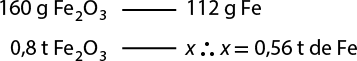
Assim, será obtida 0 vírgula 56 tonelada de F e, que equivale a 560 quilogramas de ferro metálico.
Compartilhe ideias
Na indústria farmacêutica é comumente necessário que os reagentes utilizados nos processos de fabricação de medicamentos tenham alto grau de pureza.

a ) Converse com um colega sobre a importância desses cuidados.
Resposta: Espera-se que, durante a conversa, os estudantes comentem que a presença de impurezas nos materiais usados na fabricação dos medicamentos pode resultar na atuação ineficaz dos princípios ativos do medicamento ou, até mesmo, trazer riscos à saúde do paciente que as ingeriu.
Página 242
CONEXÕES com ... HISTÓRIA
Fritz Haber, entre o Nobel e a guerra
O século XX foi um período de grandes descobertas científicas e inovações tecnológicas na área da Química. Ainda nas primeiras décadas, a radioatividade foi descoberta e novos modelos atômicos foram propostos. A indústria de materiais se revolucionou com o processo de síntese de polímeros e, com o desenvolvimento de novos medicamentos, ocorreram grandes avanços na área da Medicina.
Contudo, essa época foi profundamente marcada pela destruição causada pela Primeira Guerra Mundial (1914-1918), que afetou as estruturas produtivas e sociais da Europa pelos anos seguintes. Nesse contexto, o uso de armas químicas se difundiu, chocando o mundo com seu poder de destruição em larga escala. Para a produção dessas armas, um composto químico era fundamental: a amônia. Como visto anteriormente, os químicos Fritz Haber e Carl Bosch desenvolveram um método para síntese industrial da amônia com alto rendimento.
Essa descoberta foi considerada revolucionária na medida em que permitiria um aumento da produção de fertilizantes nitrogenados em larga escala, aumentando os cultivos agrícolas e podendo combater a fome no mundo. Por ela, Haber recebeu o Prêmio Nobel de Química em 1918. No entanto, essa premiação gerou protestos na época e ainda gera discussão, pois, além de contribuir com as atividades agrícolas, a amônia sintética potencializou a indústria armamentista.
Apesar de grande cientista, Haber era uma pessoa controversa. Ele participou ativamente do exército alemão ao longo da Primeira Guerra Mundial e coordenou o primeiro ataque com gás de cloro aos soldados das tropas aliadas em 1915, na Bélgica. Devido a essas ações, foi acusado de crime internacional de guerra. Ao final desse período, Haber voltou a trabalhar com pesquisas em laboratório até ser exilado pelo governo nazista, em 1933. De ascendência judaica, ele foi poupado da morte pelas suas contribuições ao governo alemão durante a Primeira Guerra, mas foi obrigado a deixar o país e morreu em 1934. Ironicamente, outro produto desenvolvido por Haber para combater piolhos e outras pragas foi utilizado, após sua morte, nas câmaras de gás de Auschwitz, em um dos maiores genocídios já cometidos pela humanidade.

Apesar do uso de armas químicas de guerra ser proibido pelo Protocolo de Genebra em 1925, somente em 1992 foi adotada a Convenção sobre a Proibição de Armas Químicas (CPAQ) da Organização das Nações Unidas (ONU). Por meio da CPAQ, os países signatários têm seu cumprimento do Protocolo verificado.
A história de Fritz Haber revela a Ciência como um produto humano, não sendo, pois, imparcial. Logo, as consequências do seu uso podem ser tanto positivas quanto negativas, a depender da intencionalidade de quem a utiliza ou desenvolve. A descoberta da síntese da amônia demonstra o potencial da Química para transformar o mundo, mas também alerta para a importância de usar esse conhecimento de forma responsável.
a ) Como podemos afirmar que uma descoberta científica é boa ou ruim? Argumente.
b ) O que a história de Fritz Haber evidencia sobre a importância da ética na Ciência?
c ) Como as descobertas científicas refletem o período histórico em que foram produzidas e como seu uso impacta a sociedade desse período?
Respostas nas Orientações para o professor.
Página 243
Química Verde
Projetar reações com os melhores rendimentos e quantidades adequadas de reagentes para evitar desperdício é essencial para os processos industriais. Isso garante um desenvolvimento sustentável e minimiza os impactos ambientais associados à indústria química.
O ramo da Química que se encarrega de analisar e planejar o processo com redução de impactos ambientais e economia de materiais é a Química Verde. Ela surgiu no contexto de uma crescente atenção aos problemas de poluição química e esgotamento de recursos, no começo dos anos 1990, nos Estados Unidos. A Química Verde tem como principais objetivos as reduções de resíduos, do consumo de energia e do consumo de recursos, bem como o uso de fontes renováveis de maneira ideal. Para tanto, a Química Verde segue 12 princípios.
1º. Prevenção: melhor prevenir do que tratar ou remediar a formação de resíduo.
2º. Economia atômica: foco em metodologias sintéticas que maximizem o uso de todos os materiais e em todas as etapas.
3º. Redução de toxicidade: priorizar metodologias que usam e produzem substâncias que não apresentem toxicidade, seja para seres humanos, seja para o meio ambiente.
4º. Desenvolvimento de produtos seguros e eficientes: as funções de produtos devem ser mantidas, mas com toxicidade reduzida.
5º. Solventes seguros: eliminar ou tornar seguros solventes e outros auxiliares de reação.
6º. Otimização do uso de energia: identificar a relação das necessidades energéticas nos processos químicos com os impactos ambientais e econômicos, reduzindo-os. Os processos devem ser feitos em temperatura e pressão ambientes para minimizar o consumo de energia.
7º. Uso de matérias-primas de fontes renováveis: priorizar matérias que não se esgotem e que sejam renováveis, sempre que praticável técnica e economicamente.
8º. Evitar derivações desnecessárias: esses produtos devem ser evitados nos processos químicos e físicos, pois essas etapas vão usar mais reagentes e podem gerar mais resíduos.
9º. Desenvolvimento e uso de catalisadores: são substâncias que aumentam a velocidade das reações, o que é favorável para uma reação consumir menos energia.
10º. Desenvolvimento de produtos degradáveis após o término de vida útil: elaboração de produtos que se decomponham sem danos ao meio ambiente.
11º. Monitoramento/controle de processos em tempo real: análises químicas devem ser feitas favorecendo a identificação prévia da formação de subprodutos perigosos.
12º. Química segura para prevenção de acidentes: a escolha das substâncias e de como são usadas nos processos químicos deve considerar a redução da possibilidade de acidentes químicos, como explosões, incêndios e vazamentos.
A Química Verde promove o desenvolvimento de processos que visam reduzir o impacto ambiental e melhoram a eficiência dos recursos. Com isso, as empresas adotam um caráter competitivo, contribuindo para um crescimento econômico mais sólido e inclusivo. Essas ações estão de acordo com o Objetivo de Desenvolvimento Sustentável 8 da Agenda 2030 da ONU: Trabalho decente e crescimento econômico.

A Química Verde também incentiva a pesquisa e o desenvolvimento de novos materiais e processos ambientalmente amigáveis, impulsionando a criação de novas tecnologias e processos, o que se alinha ao Objetivo 9: Indústria, inovação e infraestrutura.

Página 244
PRÁTICA CIENTÍFICA
Quantidade de matéria
Por dentro do contexto
"Na natureza, nada se cria, nada se perde, tudo se transforma". Essa frase é atribuída ao francês Lavoisier, que viveu no século XVIII e foi responsável por descobertas importantes no estudo da Química, como a composição da água. Mas, afinal, o que essa frase quer dizer?
Tal frase corresponde ao resumo de um pequeno trecho do livro Tratado elementar de Química, publicado por Lavoisier em 1789. O autor queria dizer que as substâncias não podem simplesmente, sumir ou aparecer dentro de reações químicas. Isto é, em sistemas fechados, as massas se conservam. Ele pôde provar suas teorias usando as balanças mais precisas disponíveis em sua época.
Formule uma hipótese indicando a atual importância das ideias de Lavoisier – as quais envolvem a quantificação de reagentes e produtos – para os processos químicos desenvolvidos por algumas indústrias, como a de cosméticos.
Resposta nas Orientações para o professor.

Materiais
- 5 gramas de bicarbonato de sódio
- 180 mililitros de vinagre
- 2 garrafas PET de 600 mililitros transparentes
- balão de festa
- balança
- papel-manteiga para pesagem
- colher de chá
- funil
- copo medidor
Como proceder
Procedimento 1
A. Meça 90 mililitros de vinagre usando o copo medidor.
B. Usando a balança, verifique e anote a massa da garrafa PET.
C. Transfira o vinagre do copo medidor para a garrafa PET.
Imagem sem proporção e em cores fantasia.
D. Coloque a garrafa com o vinagre sobre a balança e anote o valor registrado.
E. Subtraia o valor encontrado na balança no procedimento anterior pelo valor da massa da garrafa PET, do procedimento B. Anote o resultado.
F. Usando a balança, meça 5 gramas de bicarbonato de sódio sobre o papel manteiga.
G. Acrescente o bicarbonato ao vinagre e verifique o que acontece. Em seguida, pese o sistema na balança, subtraia a massa da garrafa e registre o resultado.
Página 245
Procedimento 2
H. Usando o copo medidor, meça 90 mililitros de vinagre novamente.
I. Coloque os seguintes elementos, um de cada vez, na balança e anote suas massas: garrafa PET, 5 gramas de bicarbonato de sódio e balão.
J. Transfira o vinagre para a garrafa PET usada na etapa anterior.
K. Com o auxílio do funil, transfira cuidadosamente com a colher o bicarbonato de sódio para o balão de festa. Certifique-se de ter encaixado bem o balão para que ele não se solte do funil ao acrescentar o bicarbonato de sódio.
Imagens desta página sem proporção e em cores fantasia.
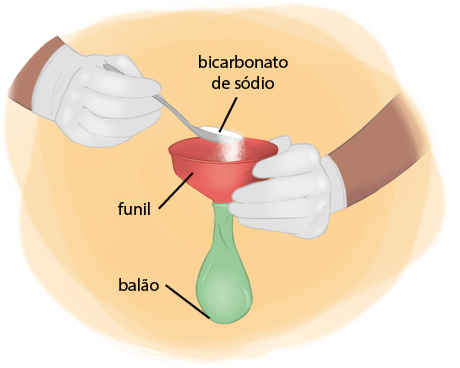
L. Acople o balão no gargalo da garrafa PET de modo que o material sólido não entre na garrafa.
M. Coloque a montagem sobre a balança e anote sua massa. Desse valor, subtraia a massa da garrafa PET e a massa do balão identificadas no procedimento I, anotando o resultado.

N. Despeje o conteúdo do balão no interior da garrafa e observe o que acontece com o conteúdo da garrafa e o balão.
O. Após alguns segundos, confira o valor indicado no visor da balança. Desse valor, subtraia a massa da garrafa PET e a massa do balão identificadas no procedimento I.
Análise e divulgação
1. Qual evidência permite afirmar que ocorreu uma reação química durante o procedimento G?
2. Qual é a equação química da reação que ocorre no experimento?
3. A somatória dos valores encontrados nos procedimentos E e F é igual ao valor encontrado em G ao final da reação? Formule uma hipótese para explicar os valores.
4. Qual alteração pode ser verificada no balão ao final do procedimento N?
5. Há diferenças entre os valores registrados pela balança nos procedimentos M e O? Justifique sua resposta.
6. Quais são a massa e a quantidade de matéria em mol de dióxido de carbono produzidos com 5 gramas de hidrogenocarbonato de sódio?
7. Quais seriam a massa e a quantidade de matéria em mol de dióxido de carbono produzidos caso utilizássemos 10 gramas de hidrogenocarbonato de sódio?
8. Registre cada etapa do experimento por meio de desenhos, fotografias ou vídeos curtos e elabore uma legenda para cada uma delas, explicitando o passo a passo. Divulgue o material criado em uma rede social. Não se esqueça de indicar na legenda geral do post o objetivo dessa prática: aplicar os conhecimentos apreendidos em estequiometria.
Respostas e resoluções nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
8. Com um colega, registrem cada etapa do experimento por meio de desenhos, fotografias ou vídeos curtos e elaborem uma legenda para cada uma delas, explicando o passo a passo. Divulguem o material em uma rede social. Não se esqueçam de indicar na legenda geral do post o objetivo dessa prática: aplicar os conhecimentos apreendidos em estequiometria.
Resposta pessoal. Auxilie os estudantes na produção e na publicação do tipo de recurso a ser desenvolvido. Reforce as principais informações que eles devem apresentar, como imagens dos procedimentos e explicações, e quais devem evitar compartilhar, como fotografias ou detalhes pessoais dos envolvidos.
Orientação para acessibilidade
Professor, professora: Organize as duplas de modo que o estudante não vidente esteja acompanhado de um estudante vidente. É possível organizar diferentes tarefas para cada um dos estudantes.
Página 246
ATIVIDADES
1. Observe a reação da síntese da amônia.
3 H subscrito 2 abre parênteses g fecha parênteses mais N subscrito 2 abre parênteses g fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, catalisador, fim do detalhe acima 2 N H subscrito 3 abre parênteses g fecha parênteses
Nas condições normais de temperatura e pressão (CNTP), para produzir 44 vírgula 8 litros de amônia, necessitam-se de 67 vírgula 2 litros de gás hidrogênio e 22 vírgula 4 litros de gás nitrogênio. Considere que uma indústria química disponha de 50 vírgula 0 metros cúbicos de gás hidrogênio e 11 vírgula 2 metros cúbicos de gás nitrogênio. Qual será o volume máximo de amônia produzido nas CNTP?
Resposta: O reagente limitante é o nitrogênio, pois 11 vírgula 2 metros cúbicos de N subscrito 2 disponíveis requerem 33 vírgula 6 metros cúbicos de H subscrito 2, que está em excesso. Pela estequiometria, 1 volume de N subscrito 2 produz 2 volumes de amônia. Assim, com 11 vírgula 2 metros cúbicos de N subscrito 2, serão produzidos 22 vírgula 4 metros cúbicos de amônia nas CNTP.
2. Sobre o quilate, responda às seguintes questões.
a ) Qual seria a proporção de pureza do ouro se o material tivesse 18 quilates?
Resposta: Como o ouro 24 quilates tem 100% de pureza, o ouro 18 quilates tem 75%.
b ) Considere um anel de ouro de 18 quilates com massa de 1 vírgula 5 grama. Determine os valores de massa e a quantidade de matéria em mol do ouro nesse anel.
Resposta: 'm' subscrito A u é igual a 1 vírgula 5 grama vezes 75 sobre 10 é igual a 1 vírgula 125 grama n subscrito A u é igual a início de fração, numerador: 1 vírgula 125 grama, denominador: 197 gramas vezes mol elevado a menos 1, fim de fração é igual a 5 vírgula 71 vezes 10 elevado a menos 3 mol
3. Um dos processos na indústria metalúrgica para obter ferro pode ser descrito da seguinte forma:
F e O abre parênteses s fecha parênteses mais C O abre parênteses g fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, delta, fim do detalhe acima F e abre parênteses s fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses
Se o rendimento dessa reação for de 75%, qual será a massa de ferro, em quilograma, obtida com 576 toneladas de óxido de ferro(II) abre parênteses F e O fecha parênteses?
Resposta: 'm' subscrito F e é igual a início de fração, numerador: 576 vezes 10 elevado a 6 g F e O vezes 55 vírgula 85 gramas F e, denominador: 71 vírgula 85 gramas F e O, fim de fração vezes 75 centésimos é igual a 336 vezes 10 elevado a 6 grama F e
4. Existe outro processo de obtenção de ferro diferente do citado no exercício anterior, o qual é feito com a hematita, um minério de ferro que apresenta 80% de óxido de ferro(III) abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses. A equação química da reação desse processo pode ser representada por:
F e subscrito 2 O subscrito 3 abre parênteses s fecha parênteses mais 3 C abre parênteses s fecha parênteses seta para a direita 2 F e abre parênteses s fecha parênteses mais 3 C O abre parênteses g fecha parênteses
Qual é a massa mínima de hematita, em tonelada, necessária para produzir 280 toneladas de ferro?
Resposta e resolução nas Orientações para o professor.
5. Um armário no laboratório está com mofo por causa da alta umidade. A assistente testou dois produtos com 100 gramas contendo substâncias químicas capazes de absorver a umidade do ambiente.
Para conferir qual dos produtos é mais eficiente, ao longo de uma semana, no final de cada dia, a assistente verificou na balança a massa dos dois produtos expostos à umidade do armário e anotou os dados no seguinte quadro.
| Dias | Produto A grama | Produto B grama |
|---|---|---|
|
1 |
101,50 |
101,30 |
|
2 |
102,25 |
101,69 |
|
3 |
103,38 |
102,20 |
|
4 |
105,06 |
102,86 |
|
5 |
107,60 |
103,71 |
|
6 |
110,40 |
104,83 |
|
7 |
117,09 |
106,27 |
Analise os dados do quadro e responda às questões.
a ) Qual dos produtos foi mais eficaz para retirar a umidade desse armário? Justifique sua resposta.
Resposta: Foi o produto A, pois teve maior aumento de massa, o que significa que mais umidade foi retirada.
b ) A pureza dos materiais que compõem os produtos A e B pode afetar suas eficácias?
Resposta: Sim, pois no produto de menor pureza há menos reagentes que retiram a umidade.
6. Nas estações de tratamento de água (ETA), uma das etapas é a coagulação, cuja finalidade é transformar as impurezas em suspensão nos aglutinados de partículas de dimensões maiores. Nessa etapa são adicionados sulfato de alumínio abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses e hidróxido de cálcio abre parênteses C a abre parênteses O H fecha parênteses subscrito 2 fecha parênteses, produzindo hidróxido de alumínio abre parênteses A l abre parênteses O H fecha parênteses subscrito 3 fecha parênteses e sulfato de cálcioabre parênteses C a S O subscrito 4 fecha parênteses. O hidróxido de alumínio é responsável pela aglutinação das partículas.
A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses a q fecha parênteses mais 3 C a abre parênteses O H fecha parênteses subscrito 2 abre parênteses a q fecha parênteses seta para a direita
seta para a direita 2 A l abre parênteses O H fecha parênteses subscrito 3 abre parênteses a q fecha parênteses mais 3 C a S O subscrito 4 abre parênteses a q fecha parênteses
Para tratar 1 vírgula 2 vezes 10 elevado a 6 metros cúbicos de água, foram adicionadas 20 vírgula 72 toneladas de A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3. Sabendo que a massa de A l abre parênteses O H fecha parênteses subscrito 3obtida foi de 4 vírgula 25 toneladas, o rendimento do processo foi de aproximadamente:
a ) 70%
b ) 55%
c ) 45%
d ) 100%
Resposta: Alternativa c. Resolução nas Orientações para o professor.
7. Balanceie a equação química para a combustão completa do gás etino abre parênteses C subscrito 2 H subscrito 2 fecha parênteses. Em seguida, determine o volume de dióxido de carbono produzido pela queima de 130 gramas de etino, considerando que o rendimento do processo é de 80% em condições normais de temperatura e pressão (CNTP).
C subscrito 2 H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses
Resposta nas Orientações para o professor.
Página 247
CAPÍTULO13
Termoquímica
Entalpia
1. Qual é a importância da fotossíntese para o desenvolvimento da vida como conhecemos hoje?
Resposta: A fotossíntese possibilita a fixação da energia proveniente do Sol e a produção do gás oxigênio.
O Sol é a fonte de energia primordial para o planeta Terra e para os seres vivos que nela habitam. Por meio do processo de fotossíntese, seres vivos autotróficos✚ absorvem energia solar e a transformam em energia química. Essa energia química é transmitida aos animais herbívoros e onívoros, e destes, aos carnívoros. Sem a fotossíntese, a vida como conhecemos não seria possível.
Relembre a seguir a equação química simplificada do processo de fotossíntese:
6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses mais energia solar seta para a direita C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses
Perceba que a energia solar está localizada do lado esquerdo da equação, ou seja, é um reagente da reação. Isso significa que foi necessária a absorção de energia para formar os produtos. As reações que absorvem energia, como a da fotossíntese, são chamadas de reações endotérmicas.
Dica
O consumo ou a absorção de energia geralmente é indicado em cima da seta das equações químicas, por não se tratar de um reagente químico participante da reação. No entanto, nesta página será representado dessa forma para facilitar a visualização dos processos endotérmicos e exotérmicos.
Além disso, muitas vezes, as palavras energia e calor nas equações químicas são representadas por símbolos, como o delta.
Durante a fotossíntese, a energia solar é responsável por romper as ligações químicas das moléculas de dióxido de carbono abre parênteses CO subscrito 2 fecha parênteses e de água abre parênteses H subscrito 2 O fecha parênteses e por formar as ligações químicas da glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses e do gás oxigênio abre parênteses O subscrito 2 fecha parênteses. A glicose é um carboidrato que armazena grande quantidade de energia em suas ligações.

Compartilhe ideias
A energia solar é proveniente da luz e do calor do Sol, sendo uma energia sustentável que possibilita, por exemplo, gerar energia elétrica.
a ) Junte-se a um colega e pesquisem outras aplicações da energia solar, bem como as vantagens e desvantagens dessa energia em relação às não renováveis.
Resposta: Como aplicações da energia solar, os estudantes podem citar aquecedores de água, iluminação de ambientes durante o dia, geração de energia elétrica por meio de células fotovoltaicas e fogões e fornos solares para o preparo de alimentos. Como vantagens, os estudantes podem citar que se trata de uma energia limpa, que não libera gases poluentes na atmosfera durante sua operação, não exige extração de recursos da natureza, além de ser uma fonte inesgotável. No entanto, as placas para coletar a energia solar ainda têm custo elevado e, para geração de energia elétrica em grande escala, são necessárias grandes áreas para a instalação das usinas.
- Seres vivos autotróficos:
- aqueles que produzem o próprio alimento. São exemplos as plantas, as algas e algumas bactérias.↰
Página 248
A energia armazenada nas ligações químicas da glicose é eventualmente usada pelos próprios seres autotróficos ou por outros seres da cadeia alimentar, por meio do rompimento das ligações químicas. Como exemplo, observe a equação química da reação de combustão da glicose a seguir.
C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses mais energia
Nessa reação, inversa à da fotossíntese, ocorre a liberação de energia. As reações em que a energia é liberada na forma de calor após formar os produtos são chamadas de reações exotérmicas.
A queima (combustão) da glicose, formando dióxido de carbono e água e liberando energia, é a reação simplificada do processo que acontece no organismo quando ele necessita de energia.
2. Imagine uma macieira que, por meio da fotossíntese, deu origem a maçãs que, posteriormente, serviram de alimento a um atleta. Esse atleta, pouco tempo depois de ingerir a maçã, realizou uma atividade física intensa. Descreva como a energia solar foi transportada até ser gasta no exercício do atleta.
Resposta: A energia solar é utilizada na fotossíntese da macieira, gerando gás oxigênio e uma molécula de glicose, que possui alta energia em suas ligações químicas. Ao ingerir a maçã, essas moléculas ficam armazenadas no corpo até serem quebradas, liberando a energia contida nas ligações.
3. Em sua opinião, quais são as semelhanças e as diferenças entre a energia absorvida na reação de fotossíntese e a liberada na combustão da glicose?
Resposta nas Orientações para o professor.
Assim como as reações químicas, os processos físicos também podem ser classificados como endotérmicos ou exotérmicos. A evaporação da água, por exemplo, é um processo endotérmico. É por isso que, para evaporar água, é necessário fornecer calor.
H subscrito 2 O abre parênteses l fecha parênteses mais energia seta para a direita H subscrito 2 O abre parênteses g fecha parênteses
Do mesmo modo, ao segurarmos cubos de gelo, estamos transferindo a eles o calor das mãos, que aos poucos se transforma em água líquida. A fusão também é um processo endotérmico.
H subscrito 2 O abre parênteses s fecha parênteses mais energia seta para a direita H subscrito 2 O abre parênteses l fecha parênteses
A solidificação, processo inverso da fusão, é um processo exotérmico. Por isso, para produzir gelo, colocamos água líquida no congelador. A temperatura baixa do aparelho promove a perda de calor da água, formando o gelo.
H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 2 O abre parênteses s fecha parênteses mais energia
Outro exemplo é a luz projetada no abdome do vaga-lume, principalmente na fase de acasalamento. Esse inseto se alimenta de vegetais e de outros insetos menores e, nesse processo, ingere carboidratos que servem como reserva energética.
A luz projetada no abdome dos vaga-lumes resulta de uma reação exotérmica entre o oxigênio e uma substância chamada luciferina. Note que o reagente não é a glicose, o que significa que a energia contida no carboidrato foi transportada para outros componentes até ser eventualmente liberada pela decomposição da luciferina.
Vaga-lume (Photuris pennsylvanica): pode atingir de 8,0 a 10 vírgula 0 milímetros de comprimento.

Todo material tem um valor de calor próprio, que pode ser entendido como uma energia inerente ao material. Esse calor, à pressão constante, em termos químicos, é denominado entalpia abre parênteses H fecha parênteses. Essa é uma definição simplificada da entalpia, que, além da energia interna, leva em consideração as condições de volume e pressão do sistema. A entalpia é uma propriedade termodinâmica que reflete as características térmicas de um material. Quando um sistema troca energia térmica com o ambiente, essa energia em trânsito é chamada de troca de calor ou troca de entalpia.
Página 249
Variação de entalpia
No tópico anterior, estudamos que as reações químicas podem absorver ou liberar energia. Dessa maneira, existe uma diferença na quantidade de energia entre os reagentes e os produtos de uma reação, a qual, à pressão constante, é denominada variação de entalpia abre parênteses delta H fecha parênteses. Essa variação é determinada pela diferença entre a soma da entalpia dos produtos abre parênteses H subscrito P fecha parênteses e a soma da entalpia dos reagentes abre parênteses H subscrito R fecha parênteses, sendo expressa pela seguinte fórmula:
delta H é igual a somatório H subscrito P menos somatório H subscrito R
Em geral, o valor da variação de entalpia de uma reação é disposto à direita da equação química da reação. Observe novamente a equação da reação de fotossíntese, com seu respectivo valor de delta H.
6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses seta para a direita C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses delta H grau é igual a 2.803 quilojoules por mol
Perceba que não é mais necessário constar o termo energia ou calor na equação, já que isso é informado pelo valor de delta H.
Note que o valor de variação de entalpia informado não é simplesmente delta H, e sim delta H grau. Esse valor é chamado de entalpia padrão e equivale à variação de entalpia nas condições padronizadas do sistema. Nessas condições, a temperatura é 25 graus Celsius, a pressão é 1 a t m, e a substância está na sua forma mais estável. Caso as condições fossem diferentes, o valor de delta H também seria e ele não teria o símbolo de grau. Para manter uma padronização, a entalpia padrão é usada na maioria dos casos.
A unidade usada para a variação de entalpia é o quilojoule quilojoule, referente a 1.000 joules. O joule é a medida de calor do Sistema Internacional de Unidades (SI) e a medida geralmente usada em termoquímica. No entanto, a medida caloria abre parênteses caloria fecha parênteses ou, mais usualmente, quilocaloria quilocaloria, também pode ser usada.
Dica
A relação entre joule e caloria é dada por:
1 caloria é igual a 4 vírgula 18 joules
Assim, o valor da variação de entalpia da fotossíntese, em quilocaloria por mol, é igual a:
início de fração, numerador: 2.803 quilojoules por mol, denominador: 4 vírgula 18 calorias, fim de fração é aproximadamente igual a 671 quilocalorias por mol
O valor da variação de entalpia é dado, geralmente, em relação à quantidade de matéria envolvida na reação. Para a reação de fotossíntese, por exemplo, são absorvidos 2.803 quilojoules por mol de glicose produzida ou por 6 mol de gás carbônico consumido, ou por 6 mol de água consumida ou por 6 mol de gás oxigênio produzido.
4. Com base nas informações a respeito da quantidade de matéria envolvida na reação da fotossíntese, descrita anteriormente, qual é a energia necessária para que essa reação ocorra, considerando o consumo de 0 vírgula 0 6 mol de CO subscrito 2 e 0 vírgula 0 6 mol de H subscrito 2 O, nas condições normais de temperatura e pressão?
Resposta: Como os valores de quantidade de matéria, em mol, são 100 vezes menores do que os indicados na equação estudada anteriormente, o valor da variação de entalpia será também 100 vezes menor: 28 vírgula 0 3 quilojoules ou 6 vírgula 71 quilocalorias.
Embora este modo de representação seja menos utilizado, a equação química da fotossíntese mostrada anteriormente também pode ser representada com a variação da entalpia embutida na própria equação da reação. Observe a equação a seguir.
6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses mais 2.803 quilojoules seta para a direita C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses
A variação da entalpia pode ser positiva, negativa ou, raramente, igual a zero. Por meio do valor de variação da entalpia é possível saber se a reação é endotérmica ou exotérmica. Por exemplo, quando a energia na forma de calor precisa ser providenciada ao sistema, o valor de delta H é positivo e a reação é endotérmica. Porém, quando há liberação de energia, o valor de delta H é negativo e a reação é exotérmica.
As variações da entalpia podem ser representadas graficamente. Vamos estudar na página a seguir o diagrama de variação de entalpia para reações endotérmicas e exotérmicas.
Página 250
Quando a soma da entalpia dos produtos for maior do que a soma da entalpia dos reagentes abre parênteses H subscrito P é maior do que H subscrito R fecha parênteses, essa diferença de energia precisará ser fornecida aos reagentes para que a reação se complete. Dessa maneira, o valor de delta H será positivo abre parênteses delta H é maior do que 0 fecha parênteses e a reação será endotérmica.
Confira o diagrama de variação de entalpia para um processo endotérmico. A diferença de entalpia pode ser vista graficamente pela seta apontada para cima.
Diagrama de variação de entalpia para um processo endotérmico
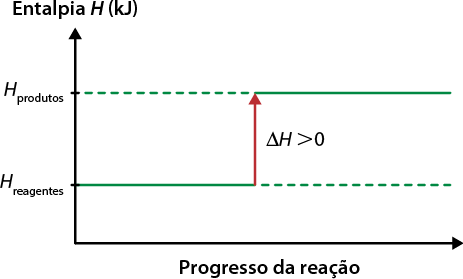
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 175.
Confira o diagrama de variação de entalpia para o processo de fotossíntese.
Diagrama de variação de entalpia para a reação de fotossíntese
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 200.
Note que existe uma diferença de 2.803 quilojoules por mol entre os reagentes e os produtos da reação de fotossíntese. Esse valor de energia deve ser fornecido ao sistema para que a reação se complete e, na natureza, provém dos raios solares.
Perceba que o valor de 2.803 quilojoules é a energia necessária considerando-se a formação de 1 mol de glicose e as condições normais de temperatura e pressão. Por isso, neste diagrama, é necessário indicar que estamos nos referindo à entalpia padrão.
Quando a soma da entalpia dos produtos for menor do que a soma da entalpia dos reagentes abre parênteses H subscrito P é menor do que H subscrito R fecha parênteses, haverá excesso de energia no lado dos reagentes. Essa energia será liberada quando a reação se completar. Dessa maneira, o valor de delta H será negativo abre parênteses delta H é menor do que 0 fecha parênteses e a reação será exotérmica.
Observe o diagrama de variação de entalpia para um processo exotérmico.
Diagrama de variação de entalpia para um processo exotérmico
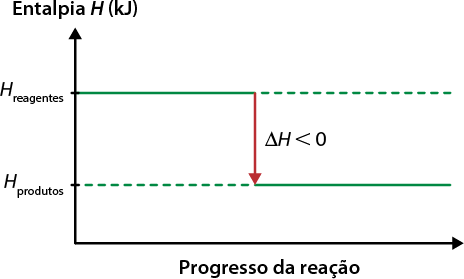
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 175.
Ao contrário do que vimos para reações endotérmicas, no diagrama de uma reação exotérmica, a entalpia total do sistema diminui após o final do processo.
A energia em excesso é, então, liberada para o sistema, o que pode ser verificado pela direção da seta de delta H, apontada para baixo.
Página 251
O valor da variação de entalpia padrão para uma reação de combustão recebe um nome específico: entalpia padrão de combustão, representada por delta H subscrito c grau.
Diagrama de variação de entalpia para a reação de combustão do etanol
Fonte de pesquisa: HAYNES, William M. (ed.). CRC Handbook of Chemistry and Physics. 97. ed. Boca Raton: CRC Press, 2017. p. 5-67.
A entalpia padrão de combustão do etanol é de menos 1.367 quilojoules por mol. Essa energia liberada é utilizada para fazer funcionar o motor de um automóvel movido a álcool.
Todas as reações de combustão são exotérmicas. Nessas reações, um combustível reage com um comburente, geralmente o gás oxigênio, liberando alta quantidade de energia e novos produtos químicos. Observe a seguir a equação química da principal reação de combustão que acontece nos motores de carro movidos a álcool, a combustão do etanol.
C subscrito 2 H subscrito 6 O abre parênteses l fecha parênteses mais 3 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 C O subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 O abre parênteses l fecha parênteses
delta H subscrito c grau é igual a menos 1.367 quilojoules por mol
Para algumas pessoas, abastecer um carro com álcool é mais vantajoso do que abastecer com gasolina. Porém, a entalpia padrão de combustão do octano, o principal combustível da gasolina, é de menos 5.470 quilojoules por mol,quatro vezes maior do que a do etanol. Dessa maneira, tendo-se a mesma massa de ambas as substâncias, o octano será mais eficaz no fornecimento de energia. É importante ressaltar que nem toda a energia liberada faz o motor funcionar, pois grande parte é perdida no processo.
Sabemos que nem todos os processos endotérmicos ou exotérmicos resultam necessariamente em reações químicas endotérmicas ou exotérmicas, pois a troca de calor com o meio (vizinhança) pode provocar mudança no estado de agregação do material sem que haja formação de nova(s) substância(s). Observe os dados e o diagrama a seguir que mostram a variação de energia para as mudanças de estado de agregação da água, à pressão de 1 a t m.
H subscrito 2 O abre parênteses s fecha parênteses seta para a direita H subscrito 2 O abre parênteses l fecha parênteses delta H subscrito fusão é igual a mais 6 vírgula 0 1 quilojoules
H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 2 O abre parênteses s fecha parênteses delta H subscrito solidificação é igual a menos 6 vírgula 0 1 quilojoules
H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 2 O abre parênteses g fecha parênteses delta H subscrito vaporização é igual a mais 40 vírgula 7 quilojoules
H subscrito 2 O abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses l fecha parênteses delta H subscrito condensação é igual a menos 40 vírgula 7 quilojoules
H subscrito 2 O abre parênteses s fecha parênteses seta para a direita H subscrito 2 O abre parênteses g fecha parênteses delta H subscrito sublimação é igual a mais 46 vírgula 71 quilojoules
H subscrito 2 O abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses s fecha parênteses delta H subscrito deposição é igual a menos 46 vírgula 71 quilojoules
Note que a fusão e a vaporização da água são dois processos independentes, cada qual com seu valor de variação de entalpia, mas ambos positivos.
Diagrama de entalpia H com as mudanças de estados de agregação da água
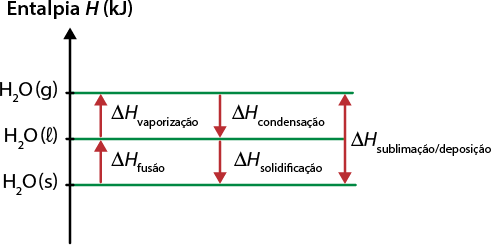
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 268.
A entalpia de fusão é significativamente menor do que a entalpia de vaporização. Isso acontece porque, geralmente, é necessário muito mais energia para separar por completo os componentes de um líquido do que para quebrar a estrutura cristalina de um sólido.

Perceba que os valores de variação de entalpia são os mesmos, mas com sinais trocados.
Página 252
Entalpia de formação
A entalpia padrão de formação, delta H subscrito f grau, é a variação de entalpia relativa à formação de 1 mol de uma substância por meio das substâncias simples mais estáveis dos átomos que a compõem, nas condições normais de temperatura e pressão (25 graus Celsius e 1 a t m).
Observe no exemplo a seguir a entalpia padrão de formação da água líquida, H subscrito 2 O abre parênteses l fecha parênteses.
H subscrito 2 abre parênteses g fecha parênteses mais 1 meio O subscrito 2 abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses l fecha parênteses delta H subscrito f grau é igual a menos 285 vírgula 8 quilojoules barra mol
No lado dos reagentes da equação química, entram as substâncias simples H subscrito 2 e O subscrito 2 em sua forma mais estável, que, no caso, é a gasosa. No lado dos produtos, entra somente a água líquida.
Como, por definição, deseja-se a formação de um mol da substância, logo podem aparecer coeficientes fracionários, como no caso da equação química apresentada, em que o gás oxigênio está com o coeficiente 1 meio.
Por convenção, as substâncias puras simples, na forma alotrópica mais estável e nas condições normais de temperatura e pressão, apresentam entalpia igual a zero. Desse modo, a entalpia padrão de formação da água líquida é de menos 285 vírgula 8 quilojoules por mol.
Perceba que a equação termoquímica da entalpia padrão de formação da água, nas condições padronizadas, também corresponde à entalpia padrão de combustão do gás hidrogênio abre parênteses H subscrito 2 fecha parênteses:
Professor, professora: Reforce aos estudantes que o valor da entalpia de uma substância não é calculado, apenas o da variação da entalpia. Por isso, é uma convenção dizer que a entalpia de substâncias simples e estáveis é igual a zero. A entalpia padrão de formação só pode ser calculada experimentalmente ou por meio da Lei de Hess, que será abordada adiante.
H subscrito 2 abre parênteses g fecha parênteses mais 1 meio O subscrito 2 abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses l fecha parênteses delta H subscrito c grau é igual a menos 285 vírgula 8 quilojoules barra mol
A tabela a seguir apresenta a entalpia padrão de formação de algumas substâncias. Ela será bastante útil posteriormente, portanto retome-a sempre que for necessário.
| Substância | Entalpia de formação delta H subscrito f grau abre parênteses quilojoules por mol fecha parênteses | Substância | Entalpia de formação delta H subscrito f grau abre parênteses quilojoules por mol fecha parênteses |
|---|---|---|---|
|
O subscrito 3 abre parênteses g fecha parênteses |
mais 142 vírgula 7 |
H C l abre parênteses g fecha parênteses |
menos 92 vírgula 3 |
|
O subscrito 2 abre parênteses g fecha parênteses |
0 vírgula 0 |
H subscrito 2 S O subscrito 4 abre parênteses l fecha parênteses |
menos 814 vírgula 0 |
|
H subscrito 2 O abre parênteses l fecha parênteses |
menos 285 vírgula 8 |
N O abre parênteses g fecha parênteses |
mais 90 vírgula 3 |
|
H subscrito 2 O abre parênteses g fecha parênteses |
menos 241 vírgula 8 |
N O subscrito 2 abre parênteses g fecha parênteses |
mais 33 vírgula 2 |
|
C a abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses |
menos 986 vírgula 1 |
N subscrito 2 O abre parênteses g fecha parênteses |
mais 82 vírgula 1 |
|
N a C l abre parênteses s fecha parênteses |
menos 411 vírgula 2 |
S O subscrito 2 abre parênteses g fecha parênteses |
menos 296 vírgula 8 |
|
S i O subscrito 2 abre parênteses g fecha parênteses |
menos 910 vírgula 9 |
S O subscrito 3 abre parênteses g fecha parênteses |
menos 395 vírgula 7 |
|
C subscrito diamante |
mais 1 vírgula 9 |
N H subscrito 3 abre parênteses g fecha parênteses |
menos 46 vírgula 1 |
|
C subscrito grafite |
0 vírgula 0 |
N H subscrito 4 N O subscrito 3 abre parênteses s fecha parênteses |
menos 365 vírgula 6 |
|
C O subscrito 2 abre parênteses g fecha parênteses |
menos 393 vírgula 5 |
N H subscrito 4 C l O subscrito 4 abre parênteses s fecha parênteses |
menos 295 vírgula 3 |
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. A10-A15.
Dica
O mesmo elemento químico pode apresentar mais do que uma forma, como as substâncias simples. O carbono abre parênteses C fecha parênteses, por exemplo, pode se apresentar na forma de grafite abre parênteses C subscrito grafite fecha parênteses, de diamante abre parênteses C subscrito diamante fecha parênteses, de fulereno abre parênteses C subscrito fulereno fecha parênteses etc. Quando isso acontece, dizemos que o elemento químico apresenta diversas formas alotrópicas, que são alótropas entre si.
Como o grafite é a forma alotrópica mais estável do carbono e a forma com menor conteúdo energético, é também a forma considerada para o cálculo da entalpia padrão de formação.
Professor, professora: Comente com os estudantes que, como pode ser observado, a entalpia padrão de formação pode ser positiva (endotérmica) ou negativa (exotérmica).
Página 253
ATIVIDADES RESOLVIDAS
R1. Nas competições de balonismo tripulado são utilizados queimadores de gás propano abre parênteses C subscrito 3 H subscrito 8 fecha parênteses para o aquecimento do ar no interior do balão. Monte a equação termoquímica de combustão completa de 1 mol do gás propano e indique os estados físicos de cada substância à temperatura de 25 graus Celsius e pressão de 1 a t m, sabendo que a entalpia padrão de combustão do gás propano é menos 2.220 quilojoules por mol.

Resolução
A combustão completa do gás propano produz dióxido de carbono gasoso e água no estado líquido abre parênteses 25 graus Celsius e 1 a t m fecha parênteses. Assim, a sua equação termoquímica será:
C subscrito 3 H subscrito 8 abre parênteses g fecha parênteses mais 5 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 3 C O subscrito 2 abre parênteses g fecha parênteses mais 4 H subscrito 2 O abre parênteses l fecha parênteses
delta H subscrito c grau é igual a menos 2.220 quilojoules por mol
Para as substâncias nas mesmas condições padrão de temperatura e pressão, a variação de entalpia de uma reação delta H subscrito reação grau será a diferença entre o somatório das entalpias de formação dos produtos somatório n delta H subscrito f grau abre parênteses produtos fecha parênteses e o somatório das entalpias de formação dos reagentes somatório n delta H subscrito f grau abre parênteses reagentes fecha parênteses, em que n são os valores dos coeficientes estequiométricos. Isso pode ser representado da seguinte maneira:
delta H subscrito reação grau é igual a somatório n delta H subscrito f grau abre parênteses produtos fecha parênteses menos somatório n delta H subscrito f grau abre parênteses reagentes fecha parênteses
Observe, por exemplo, a equação química da reação de combustão do monóxido de carbono abre parênteses C O fecha parênteses.
C O abre parênteses g fecha parênteses mais 1 meio O subscrito 2 abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses delta H subscrito reação grau é igual a ?
Para calcular o valor de delta H subscrito reação grau, devemos usar a fórmula anterior:
delta H subscrito reação grau é igual a somatório abre parênteses 1 vezes delta H subscrito f grau abre parênteses C O subscrito 2 abre parênteses g fecha parênteses fecha parênteses menos somatório abre parênteses 1 vezes delta H subscrito f grau abre parênteses C O abre parênteses g fecha parênteses fecha parênteses mais 1 meio vezes delta H subscrito f grau abre parênteses O subscrito 2 abre parênteses g fecha parênteses fecha parênteses fecha parênteses
Sabendo que a entalpia padrão de formação do C O subscrito 2 abre parênteses g fecha parênteses é menos 393 vírgula 5 quilojoules por mol vírgula a do C O abre parênteses g fecha parênteses é menos 110 vírgula 5 quilojoules por mol, e a do O subscrito 2 abre parênteses g fecha parênteses é 0 quilojoule barra mol, substituímos esses valores na fórmula, obtendo:
delta H subscrito reação grau é igual a menos 393 vírgula 5 menos abre parênteses menos 110 vírgula 5 mais 0 fecha parênteses
delta H subscrito reação grau é igual a menos 283 vírgula 0 quilojoules barra mol
ATIVIDADES RESOLVIDAS
R2. Voltando uma vez mais para a equação da reação de fotossíntese, temos:
6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses seta para a direita C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses delta H grau é igual a mais 2.803 quilojoules barra mol
a ) Obtenha o valor da entalpia padrão de formação da glicose em meio aquoso. Consulte a tabela da página anterior para obter os valores de energia-padrão de formação das demais moléculas envolvidas.
b ) Qual é a equação termoquímica da reação de formação da glicose?
c ) Qual é a energia liberada na formação de 540 gramas de glicose com as substâncias mais simples e estáveis possíveis, sabendo que a massa molar da glicose é 180 gramas barra mol?
Resolução
a ) Consultando a tabela da página anterior, verificamos que a entalpia padrão de formação do dióxido de carbono é menos 393 vírgula 5 quilojoules barra mol, a da água líquida é menos 285 vírgula 8 quilojoules barra mol e a do gás oxigênio é 0 quilojoule barra mol, uma vez que se trata de uma substância simples no estado alotrópico mais estável.
Página 254
A equação que relaciona a variação de entalpia de uma reação com as entalpias padrão de formação de seus constituintes é:
delta H subscrito reação grau é igual a somatório n delta H subscrito f grau abre parênteses produtos fecha parênteses menos somatório n delta H subscrito f grau abre parênteses reagentes fecha parênteses
Ou, para este caso:
delta H subscrito reação grau é igual a somatório abre parênteses delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses mais 6 vezes delta H subscrito f grau abre parênteses O subscrito 2 abre parênteses g fecha parênteses fecha parênteses fecha parênteses menos somatório abre parênteses 6 vezes delta H subscrito f grau abre parênteses C O subscrito 2 abre parênteses g fecha parênteses fecha parênteses mais 6 vezes delta H subscrito f grau abre parênteses H subscrito 2 O abre parênteses l fecha parênteses fecha parênteses fecha parênteses
Substituindo os valores, temos:
2.803 vírgula 0 é igual a abre parênteses delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses mais 6 vezes abre parênteses 0 fecha parênteses fecha parênteses menos abre parênteses 6 vezes abre parênteses menos 393 vírgula 5 fecha parênteses mais 6 vezes abre parênteses menos 285 vírgula 8 fecha parênteses fecha parênteses
2.803 vírgula 0 é igual a delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses menos abre parênteses menos 2.361 menos 1.714 vírgula 8 fecha parênteses
2.803 vírgula 0 é igual a delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses menos abre parênteses menos 4.075 vírgula 8 fecha parênteses
2.803 vírgula 0 é igual a delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses mais 4.075 vírgula 8
delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses é igual a 2.803 vírgula 0 menos 4.075 vírgula 8
delta H subscrito f grau abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses fecha parênteses é igual a menos 1.272 vírgula 8 quilojoules barra mol
b ) C subscrito grafite mais 6 H subscrito 2 abre parênteses g fecha parênteses mais 3 O subscrito 2 abre parênteses g fecha parênteses seta para a direita C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses
portanto delta H subscrito f grau é igual a menos 1.272 vírgula 8 quilojoules barra mol
c ) A massa molar da glicose é igual a 180 gramas barra mol. Portanto, em 540 gramas de glicose, temos:
n é igual a início de fração, numerador: 540 gramas, denominador: 180 gramas barra mol, fim de fração é igual a 3 mol de glicose.
Como a entalpia padrão de formação da glicose é igual a menos 1.272 vírgula 8 quilojoules barra mol, cada mol da substância libera 1.272 vírgula 8 quilojoules quando a glicose é formada com substâncias o mais simples possível, como vimos na resolução do item b. Portanto, para 3 mol de glicose, há a liberação de 3 vezes 1.272 vírgula 8 quilojoules é igual a 3.818 vírgula 4 quilojoules.
Energia de ligação
Para romper uma ligação química, é necessário fornecer energia ao sistema com intensidade suficiente para separar completamente os átomos ligados. Dessa maneira, o rompimento de ligações é um processo endotérmico. Por outro lado, a formação de uma ligação química libera energia ao sistema, que anteriormente estava armazenada na ligação, sendo, portanto, um processo exotérmico.
Imagem sem proporção e em cores fantasia.
Energia envolvida na formação e rompimento da ligação entre os átomos de hidrogênio abre parênteses H fecha parênteses e cloro abre parênteses C l fecha parênteses na molécula de cloreto de hidrogênio abre parênteses H C l fecha parênteses. A formação da ligação é um processo exotérmico que libera 431 quilojoules por mol. O rompimento da ligação é um processo endotérmico que consome os mesmos 431 quilojoules por mol.
Como estudamos, uma parte considerável da energia contida em uma substância química está nas ligações químicas que possui. Como a estrutura interna dos átomos permanece a mesma durante uma reação – exceto em casos específicos, como reações nucleares –, a variação de entalpia de uma reação pode ser calculada apenas pela troca energética da formação e do rompimento das ligações entre os átomos participantes.
Página 255
Assim, a variação de entalpia de uma reação é dada por:
delta H subscrito reação é igual a somatório delta H início subscrito, ligações rompidas abre parênteses reagentes fecha parênteses, fim subscrito mais somatório delta H início subscrito, ligações formadas abre parênteses produtos fecha parênteses, fim subscrito
Por definição, a energia de ligação indica a variação de entalpia média delta H envolvida na formação ou no rompimento de um mol de ligações covalentes simples, duplas ou triplas entre dois átomos de uma substância simples ou composta, obtendo-se átomos isolados no estado gasoso.
Nos diagramas a seguir são representadas as energias envolvidas na ruptura e na formação de 1 mol de ligações entre os átomos de hidrogênio.
Energia absorvida para romper 1 mol de ligações entre átomos de hidrogênio ligados, ou seja, moléculas de H subscrito 2 abre parênteses g fecha parênteses, de modo a obter esses átomos isolados no estado gasoso. A variação de entalpia envolvida nesse processo é delta H grau é igual a mais 436 quilojoules barra mol.
Diagrama de variação de entalpia para o rompimento de uma ligação H traço H, a 25 graus Celsius e 1 a t m
Energia liberada na formação de 1 mol de ligações entre átomos de hidrogênio isolados no estado gasoso, de modo a obter átomos ligados no estado gasoso, ou seja, moléculas de H subscrito 2 abre parênteses g fecha parênteses. A variação de entalpia envolvida nesse processo é delta H grau é igual a menos 436 quilojoules barra mol.
Diagrama de variação de entalpia para a formação de uma ligação H traço H, a 25 graus Celsius e 1 a t m
Fonte de pesquisa: HAYNES, William M. (ed.). CRC Handbook of Chemistry and Physics. 97. ed. Boca Raton: CRC Press, 2017. p. 9-76.
A tabela a seguir apresenta os valores de energia de algumas ligações covalentes entre dois átomos.
| Ligação | Entalpia de ligação média delta H grau abre parênteses k J barra mol fecha parênteses | Ligação | Entalpia de ligação média delta H grau abre parênteses k J barra mol fecha parênteses |
|---|---|---|---|
|
H traço H |
436 |
C é igual a O |
743 |
|
H traço C |
412 |
C traço N |
305 |
|
H traço O |
463 |
O traço O |
157 |
|
H traço Cl |
431 |
O é igual a O |
496 |
|
H traço N |
388 |
N traço N |
163 |
|
C traço C |
348 |
N é igual a N |
409 |
|
C é igual a C |
612 |
N três traços N |
944 |
|
C três traços C |
837 |
N é igual a O |
630 |
|
C traço O |
360 |
Cl traço Cl |
242 |
|
C traço Cl |
338 |
C l traço O |
268 |
Fontes de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 292-293.
HAYNES, William M. (ed.). CRC Handbook of Chemistry and Physics. 97. ed. Boca Raton: CRC Press, 2017. p. 9-74.
5. Por que a energia de ligação C três traços C é maior do que C é igual a C, e esta, maior do que C traço C?
Resposta: A energia de ligação está diretamente relacionada com a força da ligação covalente. Quanto mais forte for a ligação, mais energia será necessária para rompê-la, e quanto mais pares de elétrons estiverem envolvidos na ligação, mais forte será essa ligação. Uma ligação simples envolve o compartilhamento de apenas um par de elétrons, uma ligação dupla, de dois pares, e, por fim, uma tripla, de três pares, tornando-a mais forte do que as demais.
6. Por que a ligação entre dois átomos diferentes tende a ser mais energética do que a ligação entre dois átomos iguais?
Resposta: A ligação química entre dois átomos iguais é apolar, baseada totalmente no compartilhamento de elétrons. Mas quando os dois átomos são diferentes, a ligação é polar, criando um caráter de ligação eletrostática iônica, mais forte do que a covalente.
Página 256
Podemos evidenciar de maneira concreta as implicações da entalpia de ligação analisando a chert, uma rocha sedimentar composta predominantemente de dióxido de silício abre parênteses S i O subscrito 2 fecha parênteses. Sua origem está relacionada à acumulação de restos de organismos marinhos silicosos, como radiolários e diatomáceas, ou à precipitação direta de sílica em ambientes marinhos ou lacustres. Com o passar do tempo, esses sedimentos sofrem processos de compactação e são transformados em rochas sedimentares.
A alta dureza da rocha é uma de suas características mais notáveis, resultante das fortes ligações covalentes entre os átomos de silício e oxigênio. Essas ligações têm uma entalpia de 452 quilojoules barra mol, conferindo ao chert sua resistência à fratura e abrasão. Isso fez do material uma ferramenta essencial em tempos pré-históricos, quando era utilizado para a fabricação de lâminas e pontas de flecha. Hoje, o chert é utilizado na construção civil, especialmente como material agregado para concreto, além de ser de interesse geológico para estudos de ambientes antigos.
No Ártico do Canadá, na Baía de Ramah, o chert foi encontrado em depósitos significativos, sendo uma fonte importante para os povos indígenas locais datados de 7.000 anos atrás. Esses depósitos foram explorados por milênios, com o chert de Ramah sendo altamente valorizado e comercializado em vastas regiões da América do Norte em virtude da sua qualidade excepcional. Sua localização remota e as condições extremas do Ártico tornam esses depósitos de chert uma janela única para a compreensão das práticas culturais e comerciais dos antigos habitantes da região.
ATIVIDADES RESOLVIDAS
R3. O gás cloro abre parênteses C subscrito 2 abre parênteses g fecha parênteses fecha parênteses é altamente tóxico. Quando inalado, reage com a água existente nos pulmões, formando gás cloreto de hidrogênio abre parênteses H C abre parênteses g fecha parênteses fecha parênteses, capaz de causar graves lesões internas, conforme a seguinte reação:
C subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses seta para a direita H C abre parênteses g fecha parênteses mais H C O abre parênteses g fecha parênteses
Utilizando os dados do quadro apresentado, calcule a variação de entalpia em quilojoule barra mol da reação entre o gás cloro e a água.
Resolução
Montando a equação química com as fórmulas estruturais de cada um dos participantes, obtém-se:
C l menos C l mais H menos O menos H seta para a direita H menos C l mais H menos O menos C l


Fazendo o somatório das ligações rompidas e formadas, obtemos a variação de entalpia da reação:
delta H subscrito reação é igual a somatório delta H início subscrito, ligações rompidas abre parênteses reagentes fecha parênteses, fim subscrito mais somatório delta H início subscrito, ligações formadas abre parênteses produtos fecha parênteses, fim subscrito
delta H subscrito reação é igual a mais 1.168 quilojoules mais abre parênteses menos 1.162 quilojoules fecha parênteses é igual a mais 6 quilojoules portanto delta H subscrito reação é igual a mais 6 quilojoules
A variação de entalpia da reação é igual a mais 6 quilojoules. A reação é endotérmica.
Página 257
Dica
Ao calcular a variação de entalpia por meio da energia das ligações, não é necessário inserir na conta ligações iguais que sejam rompidas e formadas, pois a variação resultante será igual a zero. Na atividade resolvida anteriormente, por exemplo, são rompidos 2 mol de ligações H traço O e é formado 1 mol dessa mesma ligação. Podemos simplificar as contas considerando que houve apenas o rompimento de 1 mol da ligação. O resultado não se alterará.
Lei de Hess
O químico suíço Germain Henri Hess (1802-1850) postulou que, se a variação de entalpia de formação das substâncias for conhecida, é possível determinar a variação de entalpia das reações em que essas substâncias participam.
De acordo com Hess, a variação de entalpia de uma reação abre parênteses delta H subscrito reação fecha parênteses é uma função de estado, ou seja, não depende do caminho percorrido para chegar aos produtos, e sim apenas dos estados inicial e final da reação, não dependendo da quantidade nem do tipo de etapas da reação.
Quando um processo químico for realizado em várias etapas consecutivas, a equação química final será a soma algébrica das equações das etapas, e a variação de entalpia de uma reação será a soma algébrica das variações de entalpia das etapas.
Durante a soma algébrica das equações, é importante observar que:
- a inversão de uma equação termoquímica de uma reação implica troca de sinal da variação de entalpia;
- se a equação termoquímica de uma dada reação for multiplicada por x (inteiro ou fracionário e diferente de zero), a variação de entalpia dessa reação também deverá ser multiplicada por x.
Vejamos o exemplo da combustão da glicose por meio das equações químicas de formação a seguir:
Equação 16 C abre parênteses s fecha parênteses mais 6 H subscrito 2 abre parênteses g fecha parênteses mais 3 O subscrito 2 abre parênteses g fecha parênteses seta para a direita C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses delta H é igual a menos 1.263 quilojoules barra mol
Equação 2 C abre parênteses s fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses delta H é igual a menos 394 quilojoules barra mol
Equação 3 H subscrito 2 abre parênteses g fecha parênteses mais 1 meio O subscrito 2 abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses l fecha parênteses delta H é igual a menos 286 quilojoules barra mol
Considerando a equação química da queima da glicose como sendo:
C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses a q fecha parênteses mais 6 O subscrito 2 abre parênteses a q fecha parênteses seta para a direita 6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses
Invertemos a primeira equação e multiplicamos as outras duas por 6:
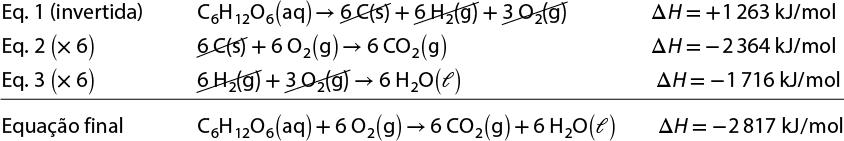
O valor do delta H final pode ser obtido por meio da soma dos valores de entalpia das reações de formação. Portanto:
delta H é igual a mais 1.263 menos 2.364 menos 1.716 é igual a menos 2.817 quilojoules barra mol de glicose
Lembre-se de que, ao fazer qualquer operação com uma equação química, deve-se fazer o mesmo com o delta H (variação de entalpia). Isso porque a variação de entalpia é uma grandeza extensiva, ou seja, depende da quantidade de matéria. Assim, ao aumentar ou diminuir o número de mols de uma equação química, a quantidade de calor liberado ou absorvido será correspondente a essa alteração.
Página 258
LIGADO NO TEMA
Como o petróleo salvou as baleias cachalotes
No período dos séculos XVIII e XIX, o óleo extraído das baleias cachalote, especialmente o espermacete, desempenhou um papel crucial na iluminação e nas indústrias. O espermacete era uma substância altamente valorizada por suas propriedades, sendo utilizado para a fabricação de velas de alta qualidade, lubrificantes de máquinas e até cosméticos.
Um dos registros desse período é o livro Moby Dick, escrito pelo estadunidense Herman Melville (1819-1891) e publicado em 1851. A obra explora a obsessão do capitão Ahab de caçar a baleia cachalote Moby Dick, responsável pela amputação de sua perna. O livro estabelece uma relação entre ser humano e natureza, pois, ao mesmo tempo em que o personagem quer vingar-se da baleia, ele nutre por ela um sentimento de admiração e um desejo intenso de superá-la.
Antes de ser escritor, Melville trabalhou como marinheiro em navios baleeiros. Essa experiência fez com que suas descrições no livro sobre a importância do óleo de baleia e o modo de extraí-lo fossem extremamente realistas e destacassem a busca por essa substância que movia centenas de navios baleeiros pelos oceanos. Confira um trecho do livro.
[…] Trata-se, sem dúvida, do maior habitante do globo; a mais formidável de todas as baleias que se pode encontrar; a de aspecto mais majestoso; e, por último, de longe a mais valiosa comercialmente, sendo ela a única criatura da qual aquela substância valiosa, o espermacete, pode ser obtida. […]
MELVILLE, Herman. Moby Dick. Tradução: Rogerio Galindo. Rio de Janeiro: Antofágica,
2022. E-book.

Durante o auge da caça às baleias, muitos cachalotes foram abatidos anualmente, ameaçando a espécie de extinção. Estima-se que o crânio de uma única baleia cachalote pudesse armazenar até 3 toneladas de espermacete, uma quantidade que incentivava as perigosas expedições dos baleeiros.
No entanto, o desenvolvimento da indústria do petróleo na segunda metade do século XIX trouxe uma mudança significativa. Com a descoberta e a produção em massa de querosene derivado do petróleo, a demanda por óleo de baleia diminuiu drasticamente. O querosene provou ser um substituto eficiente para a iluminação, o que aliviou a demanda de espermacete das baleias cachalote, contribuindo para evitar sua extinção.
Antes da substituição do espermacete pelo querosene, a visão predominante sobre sustentabilidade e recursos naturais era marcada pela exploração desenfreada, sem considerar os impactos em longo prazo. A caça às baleias cachalote, motivada pela alta demanda por espermacete, exemplifica essa mentalidade. A sustentabilidade, como entendemos hoje, não era uma preocupação, pois a prioridade era atender às necessidades da sociedade, muitas vezes à custa do equilíbrio ambiental e da preservação das espécies.
A transição dessa mentalidade para as necessidades sustentáveis que discutimos nos dias de hoje é um exemplo de como o avanço da Ciência e da tecnologia pode alterar significativamente as práticas humanas.
a ) Como Melville utiliza a linguagem literária para refletir a relação entre o ser humano e a natureza?
Resposta: O autor retrata a relação de admiração da natureza e o desejo de superá-la, que são intrínsecos ao ser humano.
b ) Como a substituição de recursos naturais por alternativas pode ser discutida com base na ética e na sustentabilidade nos dias de hoje?
Resposta: A substituição de recursos naturais deve equilibrar desenvolvimento humano e preservação ambiental, considerando o impacto ético e a sustentabilidade e buscando soluções que minimizem danos e protejam futuras gerações.
Página 259
ATIVIDADES
1. Analise a equação química a seguir e responda às perguntas.
2 H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses delta H é igual a menos 571 vírgula 6 quilojoules
a ) A entalpia dos produtos dessa reação é maior ou menor do que a dos reagentes? Justifique sua resposta.
b ) Qual é o valor da variação de entalpia dessa reação em quilojoule barra mol e em quilocaloria barra mol de água líquida produzida?
c ) A síntese da água é exotérmica ou endotérmica?
Resoluções nas Orientações para o professor.
2. Com base nas descrições de alguns fenômenos químicos, escreva suas equações termoquímicas e classifique as reações em exotérmica ou endotérmica.
a ) Combustão de 1 mol de gás metano abre parênteses C H subscrito 4 abre parênteses g fecha parênteses fecha parênteses com 2 mol de gás oxigênio abre parênteses O subscrito 2 abre parênteses g fecha parênteses fecha parênteses, produzindo 1 mol de gás carbônico abre parênteses C O subscrito 2 abre parênteses g fecha parênteses fecha parênteses e 2 mol de água líquida abre parênteses H subscrito 2 O abre parênteses l fecha parênteses fecha parênteses, liberando 890 quilojoules.
b ) Liberação de 196 quilojoules na decomposição de 2 mol de água oxigenada líquida abre parênteses H subscrito 2 O subscrito 2 abre parênteses l fecha parênteses fecha parênteses, produzindo 2 mol de água abre parênteses H subscrito 2 O abre parênteses l fecha parênteses fecha parênteses e 1 mol de gás oxigênio abre parênteses O subscrito 2 abre parênteses g fecha parênteses fecha parênteses.
c ) Liberação de 90 vírgula 7 quilojoules na combustão de 1 mol de metanol abre parênteses C H subscrito 4 O abre parênteses g fecha parênteses fecha parênteses, formando 1 mol de monóxido de carbono abre parênteses C O abre parênteses g fecha parênteses fecha parênteses e 2 mol de gás hidrogênio abre parênteses H subscrito 2 abre parênteses g fecha parênteses fecha parênteses.
Resoluções nas Orientações para o professor.
3. Um jovem estava na piscina com sua família em um domingo ensolarado. No final da tarde, sua mãe o convidou para comer um pedaço de bolo. Quando o jovem saiu da piscina, passou a sentir frio, pois a água que estava em contato com seu corpo começou a evaporar. Qual das alternativas a seguir explica a sensação de frio que o jovem sentiu? Justifique sua resposta.
a ) Sendo um processo endotérmico, a evaporação da água ocorre devido à perda de calor pelo corpo.
b ) Sendo um processo exotérmico, a evaporação da água ocorre devido à perda de calor pelo corpo.
c ) Sendo um processo exotérmico, a evaporação da água ocorre devido à absorção de calor pelo corpo.
d ) Sendo um processo endotérmico, a evaporação da água ocorre devido à absorção de calor pelo corpo.
Resposta: Alternativa a. Para a água evaporar, ela necessita absorver calor, pois, à pressão constante, é um processo endotérmico. Portanto, a água retirou calor do corpo do jovem, fazendo-o sentir frio.
4. Confira a seguir o gráfico de variação de entalpia para a reação de formação do ozônio abre parênteses O subscrito 3 fecha parênteses.
Variação de entalpia para a reação de formação do ozônio
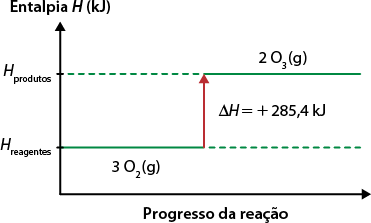
Fonte de pesquisa: HAYNES, William M. (ed.). CRC Handbook of Chemistry and Physics. 97. ed. Boca Raton: CRC Press, 2017. p. 5-30.
Responda aos itens a seguir.
a ) Com as informações do gráfico, escreva a equação termoquímica da reação descrita.
b ) A entalpia dos produtos dessa reação é maior ou menor do que a dos reagentes? Justifique sua resposta.
c ) Qual é o calor absorvido ou liberado por mol de ozônio produzido?
Resoluções nas Orientações para o professor.
5. O aquecimento global é uma das problemáticas mais discutidas atualmente e está diretamente ligado à emissão de gases de efeito estufa, como o dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses. Uma das principais fontes de emissão de C O subscrito 2 é a queima de combustíveis fósseis, como gasolina e carvão. Discuta com seus colegas como a compreensão da entalpia de formação pode influenciar escolhas pessoais com relação ao uso de transportes e à conscientização ambiental.
Respostas das questões 1, 2, 4 e 5 nas Orientações para o professor.
6. Sobre a Lei de Hess, é correto afirmar que:
a ) A determinação da variação da entalpia independe da estequiometria da reação.
b ) A variação de entalpia de uma reação depende do caminho percorrido para chegar aos produtos.
c ) Quando há inversão da equação termoquímica, deve-se manter o sinal da variação da entalpia.
d ) A variação da entalpia depende apenas dos estados inicial e final da reação.
Resposta: Alternativa d.
Página 260
7. O clorofórmio, ou triclorometano, é um composto químico de fórmula C H C l subscrito 3, que, em temperatura ambiente, é um líquido incolor e volátil. Descoberto em 1831, foi muito usado na época como analgésico, porém seu uso foi descontinuado em razão de seu alto poder toxicológico. Atualmente, sua principal aplicação é como solvente, no entanto é amplamente utilizado na indústria como matéria-prima para a produção de outros compostos. Sua reação de obtenção pode ser representada pela seguinte equação química:
C H subscrito 4 abre parênteses g fecha parênteses mais 3 C l subscrito 2 abre parênteses g fecha parênteses seta para a direita C H C l subscrito 3 abre parênteses g fecha parênteses mais 3 H C l abre parênteses g fecha parênteses
Baseando-se nas informações da tabela a seguir e nos conceitos de entalpia das ligações, calcule o valor da entalpia delta H dessa reação.
| Ligação | Entalpia de ligação abre parênteses quilojoules barra mol fecha parênteses |
|---|---|
|
C traço H |
412 |
|
Cl traço Cl |
242 |
|
H traço Cl |
431 |
|
C traço Cl |
338 |
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 292-293.
Resposta: delta H é igual a menos 345 quilojoules. Resolução nas Orientações para o professor.
8. O gráfico a seguir contém as variações de entalpia de duas formas alotrópicas de oxigênio: O subscrito 2 e O subscrito 3. Sabendo que, em substâncias puras, a forma mais estável é a que possui energia igual a zero, qual das duas formas será mais abundante na condição ambiente?
Variações de entalpia

Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. A12.
Resposta: A variação de entalpia da forma O subscrito 2 é a que libera menos energia. Logo, trata-se da forma mais estável e mais abundante.
9. Considere um automóvel popular que consome, em média, 1 litro de gasolina a cada 15 quilômetros rodados. Sabendo que a gasolina tem em sua composição octano abre parênteses C subscrito 8 H subscrito 18 fecha parênteses e que a entalpia de formação do octano é de menos 250 vírgula 1 quilojoules barra mol, a do gás dióxido de carbono é de menos 393 vírgula 5 quilojoules barra mol e a da água líquida é de menos 285 vírgula 8 quilojoules barra mol, responda às questões.
a ) Escreva a equação balanceada de combustão completa do octano.
b ) Calcule a entalpia padrão de combustão do octano.
c ) Determine a quantidade de calor liberada quando o automóvel consome 1 litro de gasolina, considerando que ela seja composta só de octano. (Dado: densidade da gasolina é aproximadamente igual a 0 vírgula 7 quilograma por litro; massa molar do octano é aproximadamente igual a 114 gramas por mol).
Resoluções nas Orientações para o professor.
10. Uma pessoa que gosta muito de fazer trilhas foi acampar em uma região montanhosa onde a altitude é significativamente maior do que o nível do mar. Ela percebeu que, ao cozinhar macarrão, o tempo de cozimento era maior do que o normal. Considerando que a temperatura de ebulição da água diminui com a altitude, explique se a entalpia de vaporização da água permanece constante, aumenta ou diminui na situação descrita e por que o tempo de cozimento do macarrão aumentou.
11. Uma equipe de engenheiros está desenvolvendo um novo tipo de combustível para veículos que operam em locais de clima extremamente frio, onde as temperaturas podem cair abaixo de menos 40 graus Celsius. Considerando que a entalpia de combustão do combustível é fundamental para seu desempenho, quais fatores relacionados à entalpia devem ser considerados no desenvolvimento desse combustível para garantir que ele funcione eficientemente nessas condições?
12. Considere as seguintes informações:
| Reação | Energia dos reagentes | Energia dos produtos |
|---|---|---|
|
A |
300 quilojoules barra mol |
150 quilojoules barra mol |
|
B |
150 quilojoules barra mol |
300 quilojoules barra mol |
a ) Qual das reações é endotérmica e qual é exotérmica?
b ) Esboce um gráfico de energia para cada reação.
Respostas das questões 9, 10, 11 e 12 nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
b ) Descreva o gráfico de energia de cada reação.
Resposta: No gráfico da reação A, espera-se que os estudantes descrevam uma curva que começa em 300 quilojoules barra mol, aumenta até 500 quilojoules barra mol (energia de ativação) e diminui até 150 quilojoules barra mol. No gráfico da reação B, espera-se que eles descrevam uma curva que começa em 150 quilojoules barra mol, sobe até 400 quilojoules barra mol (energia de ativação) e termina em 300 quilojoules barra mol.
Página 261
13. Com as informações a seguir, determine a entalpia da reação de oxidação do monóxido de nitrogênio abre parênteses N O fecha parênteses com a do dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses.
2 N O abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N O subscrito 2 abre parênteses g fecha parênteses
Dados:
N subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N O abre parênteses g fecha parênteses delta H subscrito f grau é igual a mais 90 vírgula 25 quilojoules barra mol
N subscrito 2 abre parênteses g fecha parênteses mais 2 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N O subscrito 2 abre parênteses g fecha parênteses delta H subscrito f grau é igual a mais 33 vírgula 20 quilojoules barra mol
Resposta: A entalpia dessa reação é menos 114 vírgula 1 quilojoules barra mol. Resolução nas Orientações para o professor.
14. Em seu caderno, classifique as afirmações a seguir como verdadeiras ou falsas.
a ) Se delta H é maior do que 0, a reação libera energia.
Resposta: Falsa.
b ) Se delta H é negativa, a reação é do tipo exotérmica.
Resposta: Verdadeira.
c ) O estado de agregação dos reagentes e dos produtos não influencia nos valores de entalpia da reação.
Resposta: Falsa.
d ) O valor de delta H de uma reação é sempre igual, mesmo se a quantidade de matéria for alterada.
Resposta: Falsa.
e ) Em uma reação inversa à outra, o valor de delta H é igual, porém com sinal oposto.
Resposta: Verdadeira.
15. A equação química de decomposição do mármore pode ser representada por:
C a C O subscrito 3 abre parênteses s fecha parênteses seta para a direita C a O abre parênteses s fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses delta H grau é igual a mais 177 vírgula 5 quilojoules barra mol
Considere que os valores das entalpias padrão de formação para C a O abre parênteses s fecha parênteses e C O subscrito 2 abre parênteses g fecha parênteses sejam menos 635 vírgula 5 quilojoules barra mol e menos 393 vírgula 5 quilojoules barra mol, respectivamente. Com base nessas informações, determine o valor da entalpia padrão de formação do mármore, C a C O subscrito 3 abre parênteses s fecha parênteses.
Resposta e resolução nas Orientações para o professor.
16. O hidrogenocarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses pode sofrer decomposição em temperatura relativamente baixa, a partir de 100 graus Celsius, assim pode ser utilizado como fermento químico no preparo de pães e bolos. Como há produção de dióxido de carbono, essa reação também é utilizada na produção de espumas termoplásticas e como pó químico em extintores de incêndio. Veja a reação a seguir.
2 N a H C O subscrito 3 abre parênteses s fecha parênteses seta para a direita N a subscrito 2 C O subscrito 3 abre parênteses s fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses
Calcule a entalpia da reação mostrada considerando a Lei de Hess.
Use as seguintes reações e seus valores de entalpia:
H subscrito 2 abre parênteses g fecha parênteses mais 1 meio O subscrito 2 abre parênteses g fecha parênteses seta para a direita H subscrito 2 O abre parênteses g fecha parênteses delta H subscrito 1 é igual a menos 242 quilojoules
C subscrito grafite mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses delta H subscrito 2 é igual a menos 394 quilojoules
2 N a abre parênteses s fecha parênteses mais C subscrito grafite mais 3 meios O subscrito 2 abre parênteses g fecha parênteses seta para a direita N a subscrito 2 C O subscrito 3 abre parênteses s fecha parênteses delta H subscrito 3 é igual a menos 1.130 quilojoules
2 N a abre parênteses s fecha parênteses mais 2 C subscrito grafite mais H subscrito 2 abre parênteses g fecha parênteses mais 3 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N a H C O subscrito 3 abre parênteses s fecha parênteses delta H subscrito 4 é igual a menos 1.900 quilojoules
Resposta: A entalpia de decomposição é 134 quilojoules. Resolução nas Orientações para o professor.
RETOME O QUE ESTUDOU
Refletindo sobre o que você estudou nesta unidade, responda às questões a seguir.
1. Elabore um esquema, com imagens e textos, explicando os três principais estados de agregação da matéria e suas transformações, com base na energia dos sistemas.
Atividade(s) adaptada(s) acessível(is)
1. Faça uma resenha explicando os três principais estados de agregação da matéria e suas transformações com base na energia dos sistemas.
Resposta: Espera-se que os estudantes incluam em suas descrições informações de que a energia nos sistemas aumenta do estado de agregação sólido para o gasoso, passando pelo líquido. Quanto maior a energia do sistema, mais agitadas serão as moléculas e maior será a temperatura, resultando na transformação dos estados de agregação, como fusão e vaporização. Quando os sistemas perdem energia, reduzindo a mobilidade entre as moléculas, passam de estados de agregação mais energéticos para os menos energéticos, como ocorre na condensação e na solidificação.
2. Como você explicaria a frase "Na natureza nada se cria, nada se perde, tudo se transforma."?
3. Explique o que é rendimento de uma reação química.
4. Explique a importância do etilenoglicol, um soluto não volátil, na água dos radiadores de carros em países cujas temperaturas chegam abaixo de zero grau Celsius.
5. Escreva em seu caderno a definição para os termos entalpia, reação exotérmica e reação endotérmica. Exemplifique cada uma dessas reações. Em seguida, leia suas definições para um colega e anote as definições dele a fim de compará-las com as suas.
Respostas nas Orientações para o professor.
Página 262
MAIS QUESTÕES
1. (Unip-SP) A água possui propriedades macroscópicas que afetam os sistemas biológicos de diversas maneiras, como nos eventos exemplificados a seguir.
1 - No inverno, apenas a camada superficial dos oceanos e lagos se solidifica. Isso faz com que a água permaneça líquida abaixo dessa camada, possibilitando a continuidade da vida nesse ambiente;
2 - Devido a uma espécie de membrana que a água líquida forma e que dificulta a penetração nessa massa líquida, há prejuízo nas trocas gasosas nos alvéolos pulmonares;
3 - A presença de água facilita as trocas hídricas, a circulação sanguínea e os mecanismos hemodinâmicos.
As propriedades da água que se relacionam com os eventos indicados em 1, 2 e 3 são, respectivamente:
a ) elevada temperatura de fusão; elevado calor específico; e baixa condutividade elétrica.
b ) elevada tensão superficial; baixa viscosidade; e elevado calor específico.
c ) baixa densidade do estado sólido em relação ao líquido; baixa tensão superficial; e elevada viscosidade.
d ) elevada tensão superficial; baixa densidade do estado sólido em relação ao líquido; e elevado calor de vaporização.
e ) baixa densidade do estado sólido em relação ao líquido; elevada tensão superficial; e baixa viscosidade.
Resposta: Alternativa e.
2. (Enem/MEC) Antes da geração do céu, teremos que rever a natureza do fogo, do ar, da água e da terra.
Primeiro, em relação àquilo a que chamamos água, quando congela, parece-nos estar a olhar para algo que se tornou pedra ou terra, mas quando derrete e se dispersa, esta torna-se bafo e ar; o ar, quando é queimado, torna-se fogo; e, inversamente, o fogo, quando se contrai e se extingue, regressa à forma do ar; o ar, novamente concentrado e contraído, torna-se nuvem e nevoeiro, mas, a partir destes estados, se for ainda mais comprimido, torna-se água corrente, e de água torna-se novamente terra e pedras; e deste modo, como nos parece, dão geração uns aos outros de forma cíclica.
PLATÃO, Timeu (c. 360 a.C.).
Buscando compreender a diversidade de formas e substâncias que vemos no mundo, diversas culturas da Antiguidade elaboraram a noção de "quatro elementos" fundamentais, que seriam terra, água, ar e fogo. Essa visão de mundo prevaleceu até o início da Era Moderna, quando foi suplantada diante das descobertas da química e da física.
PLATÃO. Timeu-Críticas. Coimbra: CECH, 2011.
Do ponto de vista da ciência moderna, a descrição dos "quatro elementos" feita por Platão corresponde ao conceito de
a ) partícula elementar.
b ) força fundamental.
c ) elemento químico.
d ) fase da matéria.
e ) lei da natureza.
Resposta: Alternativa d.
3. (FMJ-SP) Vapores de iodo abre parênteses I subscrito 2 fecha parênteses formados pelo aquecimento de cristais de iodo sólido podem se dissolver em secreções gordurosas deixadas em certas superfícies, permitindo a revelação de impressões digitais, conforme a figura.
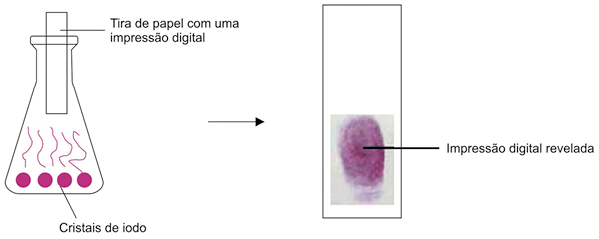
(https://s.livro.pro/hvpeh2. Adaptado.)
a ) Qual o nome da mudança de estado que ocorre com o iodo no processo de revelação de impressões digitais? Que tipo de interação intermolecular é rompida durante essa mudança de estado?
Resposta: Sublimação. É rompida as interações do tipo dipolo induzido-dipolo induzido, pois o iodo no estado sólido é formado por moléculas apolares que sofrem indução umas das outras.
b ) Classifique a molécula de iodo em relação à sua polaridade. Por que o iodo na forma gasosa consegue se dissolver em secreções gordurosas?
Resposta: O iodo é apolar. Como as moléculas da gordura também são apolares, o iodo gasoso consegue se dissolver.
Página 263
4. (Unicamp-SP) Em 15 de abril de 2019, a Catedral de Notre-Dame de Paris ardeu em chamas, atingindo temperaturas de 800 graus Celsius. Estima-se que, na construção da catedral, foram empregadas pelo menos 300 toneladas de chumbo. Material usado à época, o chumbo é um metal pesado com elevado potencial de contaminação em altas temperaturas. Sabendo que o ponto de fusão do chumbo é de 327 vírgula 5 graus Celsius e seu ponto de ebulição é de 1.750 graus Celsius, identifique a curva que pode representar o histórico da temperatura de uma porção de chumbo presente na catedral ao longo do incêndio, bem como o fenômeno corretamente relacionado ao potencial de contaminação.
a )
O potencial de contaminação estaria associado à evaporação do chumbo em alta temperatura.
b )
O potencial de contaminação estaria associado à ebulição do chumbo em alta temperatura.
c )
O potencial de contaminação estaria associado à ebulição do chumbo em alta temperatura.
d )
O potencial de contaminação estaria associado à evaporação do chumbo em alta temperatura.
Resposta: Alternativa d.
5. (Unesp) Todas as soluções aquosas cujos solutos estão indicados nas alternativas são de mesma concentração em mol por litro. A solução que deve apresentar menor temperatura de congelamento é a de
a ) C subscrito 6 H subscrito 12 O subscrito 6
b ) K subscrito 2 S O subscrito 4
c ) N H subscrito 4 C l
d ) C u S O subscrito 4
e ) C H subscrito 3 C O O H
Resposta: Alternativa b.
6. (UERJ) Para análise do teor de ozônio em um meio aquoso, utiliza-se iodeto de potássio e ácido sulfúrico. Esses compostos reagem conforme a seguinte equação:
x K I mais O subscrito 3 mais H subscrito 2 S O subscrito 4 seta para a direita y I subscrito 2 mais H subscrito 2 O mais K subscrito 2 S O subscrito 4
Quando a equação é balanceada, os coeficientes x e y correspondem, respectivamente, aos seguintes valores:
a ) 2 e 1
b ) 4 e 2
c ) 6 e 3
d ) 8 e 4
Resposta: Alternativa c. Resolução nas Orientações para o professor.
7. (UFSC) Diversas substâncias, sob ação de calor, eletricidade ou luz, passam por uma reação química. Várias reações químicas acontecem quando se aquece o açúcar para transformá-lo em caramelo, quando se assa um pão e em inúmeros outros casos.
Sobre transformações da matéria, é correto afirmar que:
01 ) a queima de uma vela é um exemplo de reação de combustão endotérmica.
02 ) a transformação do açúcar em caramelo em uma panela aquecida é uma reação endotérmica.
04 ) a caramelização da gordura da carne do churrasco é um exemplo de fenômeno físico.
08 ) a explosão de dinamite é um exemplo de reação endotérmica.
16 ) na respiração humana não há transformações químicas, já que o processo consiste apenas na liquefação do oxigênio para gerar dióxido de carbono.
32 ) o processo de formação de chuva na atmosfera é um exemplo de fenômeno físico.
Resposta: Soma: 02 mais 32 é igual a 34.
Página 264
8. (Unicamp-SP) É comum encontrarmos, nos supermercados, produtos semelhantes em suas finalidades, porém em quantidades, concentrações de ingredientes e preços bem variados. Imagine três produtos com propriedades desinfetantes, com o mesmo princípio ativo. Os produtos têm as seguintes características:
Produto A: 0,45% (massa/massa) do princípio ativo, conteúdo de 1 litro, valor R$ 11,90;
Produto B: 0,17% (massa/massa) do princípio ativo, conteúdo de 0 vírgula 5 litro, valor R$ 2,49;
Produto C: 0,33% (massa/massa) do princípio ativo, conteúdo de 2 litros, valor R$ 5,19;
Os produtos que oferecem a melhor relação custo/benefício seriam, em ordem crescente,
a ) A, B, C.
b ) C, A, B.
c ) C, B, A.
d ) B, C, A.
Resposta: Alternativa b. Resolução nas Orientações para o professor.
9. (Unesp) Certo spray antisséptico contém como princípio ativo o digliconato de clorexidina, na concentração de 10 miligramas por mililitro. Sabendo que a massa molar desse princípio ativo é, aproximadamente, 5 vírgula 0 vezes 10 elevado ao quadrado grama por mol e que a constante de Avogadro é igual a 6 vírgula 0 vezes 10 elevado a 23 mol elevado a menos 1, o número de moléculas de digliconato de clorexidina presentes em um frasco contendo 50 mililitros desse antisséptico é
a ) 6 vírgula 0 vezes 10 elevado a 20.
b ) 6 vírgula 0 vezes 10 elevado a 17.
c ) 6 vírgula 0 vezes 10 elevado a 14.
d ) 6 vírgula 0 vezes 10 elevado a 23.
e ) 6 vírgula 0 vezes 10 elevado a 26.
Resposta: Alternativa a. Resolução nas Orientações para o professor.
10. (UECE) Sulfato de cobre penta-hidratado tem ação fungicida e é empregado para controle de fungos em frutas e hortaliças. A massa em gramas de sulfato de cobre penta-hidratado necessária para produzir 100 mililitros de uma solução de concentração molar 0 vírgula 2 mol por litro é
a ) 4,99.
b ) 6,99.
c ) 5,99.
d ) 3,99.
Resposta: Alternativa a. Resolução nas Orientações para o professor.
11. (Unicamp-SP) A remoção de sulfeto de hidrogênio presente em amostras de biogás é essencial, já que ele é altamente corrosivo para tubulações metálicas. A queima desse H subscrito 2 S também é muito prejudicial ao meio ambiente, pois leva à formação de dióxido de enxofre. Um estudo de 2014 sugere que a remoção de H subscrito 2 S pode ser realizada pelo uso de esponjas de óxido de ferro, que reage com esse gás, mas pode ser regenerado. Segundo o estudo, no dispositivo utilizado, 1 vírgula 0 0 quilograma de óxido de ferro foi capaz de remover entre 0 vírgula 200 e 0 vírgula 716 quilograma de sulfeto de hidrogênio. Considere que apenas a reação abaixo equacionada esteja ocorrendo nessa remoção.
F e subscrito 2 O subscrito 3 abre parênteses s fecha parênteses mais 3 H subscrito 2 S abre parênteses g fecha parênteses seta para a direita F e subscrito 2 S subscrito 3 abre parênteses s fecha parênteses mais 3 H subscrito 2 O abre parênteses l fecha parênteses
A partir desses dados, pode-se afirmar que, na condição de remoção máxima de sulfeto de hidrogênio relatada no estudo,
a ) restaram cerca de 33% de óxido de ferro para reagir, tomando por base a estequiometria da equação química fornecida.
b ) restaram cerca de 67% de óxido de ferro para reagir, tomando por base a estequiometria da equação química fornecida.
c ) foi removida uma quantidade maior de H subscrito 2 S que a prevista pela estequiometria da equação química fornecida.
d ) as quantidades reagiram na proporção estequiométrica da equação química fornecida.
Massas molares abre parênteses g mol elevado a menos 1 fecha parênteses: F e é igual a 56, H é igual a 1, O é igual a 16 e S é igual a 32.
Resposta: Alternativa c. Resolução nas Orientações para o professor.
12. (UERJ) Em testes de perfuração realizados em plataformas de petróleo, pode ser utilizado o brometo de cálcio. Considere um teste para o qual foi preparada uma solução aquosa desse sal na concentração de 3.000 gramas por litro.
Admitindo a completa dissociação do sal, a concentração de íons brometo, em mol por litro, nessa solução, é igual a:
a ) 15
b ) 30
c ) 45
d ) 60
Resposta: Alternativa b. Resolução nas Orientações para o professor.
13. (UFRGS-RS) Para higienização de superfícies, pode-se utilizar uma solução de hipoclorito de sódio, N a C l O, a 0,5%, deixando-a agir por 1 minuto. Para preparar essa solução, deve-se utilizar 230 mililitros de solução de água sanitária a 2,0% e diluir com água filtrada para preparar 1 litro de solução. Após, colocar em um borrifador e deixar em local sem incidência de luz para evitar a diminuição da concentração de cloro ativo na solução.
O valor aproximado da concentração, em mol vezes litro elevado a menos 1, da solução de água sanitária a 2,0% é de
a ) 2 vírgula 0 vezes 10 elevado a menos 2.
b ) 7 vírgula 0 vezes 10 elevado a menos 2.
c ) 2 vírgula 7 vezes 10 elevado a menos 1.
d ) 5 vírgula 4 vezes 10 elevado a 0.
e ) 3 vírgula 0 vezes 10 elevado ao quadrado.
Resposta: Alternativa c. Resolução nas Orientações para o professor.
Página 265
14. (Enem/MEC) Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O subscrito 2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O subscrito 2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
C subscrito 6 H subscrito 12 O subscrito 6 abre parênteses s fecha parênteses mais 6 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 6 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses delta subscrito c H é igual a menos 2.800 quilojoules
C H subscrito 3 C H abre parênteses O H fecha parênteses C O O H abre parênteses s fecha parênteses mais 3 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 3 C O subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 O abre parênteses l fecha parênteses delta subscrito c H é igual a menos 1.344 quilojoules
O processo anaeróbico é menos vantajoso energeticamente porque
a ) libera 112 quilojoules por mol de glicose.
b ) libera 467 quilojoules por mol de glicose.
c ) libera 2.688 quilojoules por mol de glicose.
d ) absorve 1.344 quilojoules por mol de glicose.
e ) absorve 2.800 quilojoules por mol de glicose.
Resposta: Alternativa a. Resolução nas Orientações para o professor.
15. (Enem/MEC) Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
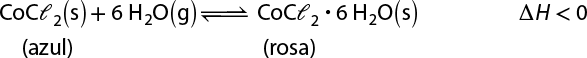
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
a ) Resfriaria no congelador.
b ) Borrifaria com spray de água.
c ) Envolveria com papel alumínio.
d ) Aqueceria com secador de cabelos.
e ) Embrulharia em guardanapo de cabelos.
Resposta: Alternativa d.
16. (Unicamp-SP) A caiação ou pintura com cal hidratada abre parênteses C a abre parênteses O H fecha parênteses subscrito 2 fecha parênteses é uma das formas mais antigas para o revestimento da fachada de edifícios. A cal virgem abre parênteses C a O fecha parênteses – produzida a partir do aquecimento do calcário abre parênteses C a C O subscrito 3 fecha parênteses –, ao ser colocada em água, forma a cal hidratada que, uma vez aplicada à parede e em contato com o CO subscrito 2 do ar atmosférico, vai se transformando em seu precursor, o carbonato de cálcio. Dessa forma, o carbonato de cálcio fica aderido à parede, protegendo-a, conservando-a e embelezando-a.
Considere as equações a seguir:
I ) C a C O subscrito 3 seta para a direita C a O mais C O subscrito 2 ponto-e-vírgula delta H é igual a 178 quilojoules barra mol
II ) C a O mais H subscrito 2 O seta para a direita C a abre parênteses O H fecha parênteses subscrito 2 ponto-e-vírgula delta H é igual a menos 109 quilojoules barra mol
III ) C a abre parênteses O H fecha parênteses subscrito 2 mais C O subscrito 2 seta para a direita C a C O subscrito 3 mais H subscrito 2 O ponto-e-vírgula delta H é igual a ponto de interrogação
Levando em conta apenas as equações do processo de transformação e produção do carbono de cálcio (equações I a III), pode-se afirmar que o processo
a ) pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao aquecimento da parede onde a cal foi aplicada.
b ) pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao resfriamento da parede onde a cal foi aplicada.
c ) não pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao aquecimento da parede onde a cal foi aplicada.
d ) não pode ser considerado carbono neutro e que a última equação representa uma reação que levaria ao resfriamento da parede onde a cal foi aplicada.
Resposta: Alternativa a. Resolução nas Orientações para o professor.