Página 334
UNIDADE 5
A DINÂMICA DAS TRANSFORMAÇÕES E O SER HUMANO
Essas curiosas esculturas feitas de pedaços de rochas em equilíbrio provavelmente chamaram a sua atenção por causa da forma como elas estão dispostas, representando uma condição de equilíbrio estático, ou seja, uma situação em que todas as forças exercidas sobre esses pedaços se equilibram para resultar em zero.
Contudo, se analisarmos bem essa imagem, é possível identificar outros sistemas em equilíbrio. Por exemplo, a água presente no rio retratado na fotografia pode estar em equilíbrio de temperatura, p H e quantidade de sais e minerais solubilizados. Todos esses aspectos compõem outro tipo de equilíbrio: o dinâmico, dependente de vários fatores, entre os quais se destacam a composição química da mistura que forma o corpo de água, o tipo de substrato no fundo dele, a temperatura e a pressão atmosférica no ambiente. As mudanças desses fatores podem alterar a composição física e química da água, sem resultar, no entanto, em alterações permanentes. Esses tipos de transformação são classificados como processos reversíveis.
Esses e outros aspectos dos equilíbrios químicos serão abordados nesta unidade, possibilitando compreender como as espécies químicas se encontram nesses sistemas e como diferentes fatores podem influenciar sua composição.
a ) Em sua opinião, em que consistem os processos reversíveis?
b ) A água de piscinas é tratada regularmente para ser mantida própria para uso, e um dos parâmetros que deve ser conservado em equilíbrio é o p H. Explique a necessidade de tratar regularmente a água e ajustar o p H, mesmo que ele já tenha sido ajustado outras vezes.
Respostas nas Orientações para o professor.
Nesta unidade, vamos estudar...
- reações reversíveis e irreversíveis;
- equilíbrios homogêneos e heterogêneos;
- constantes de equilíbrio;
- fatores que afetam os equilíbrios;
- p H e p O H;
- solução tampão;
- hidrólise salina;
- produto de solubilidade.
Página 335

Página 336
CAPÍTULO18
Equilíbrio químico
Reações reversíveis
Observe as arcadas dentárias a seguir.
Imagens desta página sem proporção e em cores fantasia.
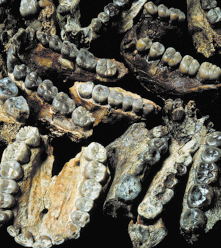
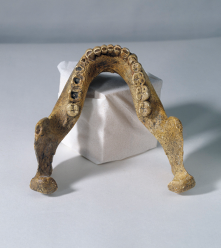
1. Cite uma diferença entre a arcada dentária do ser humano atual e a de seus ancestrais.
Resposta: Os estudantes podem citar tamanho e formato tanto dos dentes quanto da mandíbula.
2. Qual é a importância da dentição para o corpo humano?
Resposta: Os dentes são os responsáveis pela primeira etapa da digestão dos alimentos, a mastigação. Nesse processo, os alimentos são triturados, transformando-se em pedaços pequenos, que, com a saliva, formam o bolo alimentar.
Na Pré-História, os ancestrais dos seres humanos atuais consumiam alimentos mais duros e, na maioria das vezes, crus. Para que os dentes pudessem cortar, rasgar e triturar os alimentos, a arcada dentária dos ancestrais do ser humano seguia um padrão chamado alternação, nisso cada dente inferior relacionava-se diretamente com um superior e o dente ao lado.
Professor, professora: Comente com os estudantes que a mastigação dos alimentos era mais difícil, por isso os dentes eram muito exigidos.
Com as mudanças de hábitos alimentares ao longo do tempo, a arcada dentária dos ancestrais humanos passou por mudanças. No entanto, as funções continuam iguais: triturar os alimentos.
Diante da importância dos dentes para a nutrição do corpo, é essencial cuidarmos deles, a fim de evitar um dos problemas bucais mais comuns, a cárie. Para isso, vamos conhecer a estrutura interna dos dentes de um ser humano adulto.
3. O que são cáries?
Resposta: Cárie é um dano no esmalte do dente causado por ácidos produzidos por algumas bactérias, geralmente encontradas na boca.
4. Você já teve ou conhece alguém que já teve cárie? Como foi o tratamento?
Resposta na Orientações para o professor.
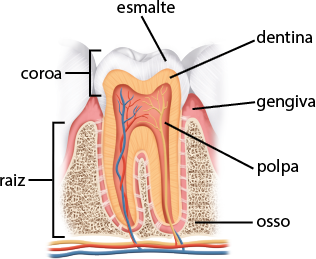
Imagem elaborada com base em: TORTORA, Gerard J.; DERRICKSON, Bryan. Corpo humano: fundamentos de anatomia e fisiologia. 10. ed. Porto Alegre: Artmed, 2017. p. 483.
O esmalte do dente é um dos tecidos mais resistentes do corpo humano. É a parte dos dentes que normalmente é visível. Aproximadamente 97% do esmalte dos dentes é composto de minerais; o restante é água abre parênteses H subscrito 2 O fecha parênteses e compostos orgânicos.
O principal componente do esmalte dos dentes é a hidroxiapatita abre parênteses C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2 fecha parênteses, um mineral sólido pouco solúvel em água, que ajuda a proteger os dentes.
As cáries são cavidades que aparecem nos dentes e são causadas pelo ácido produzido por algumas bactérias presentes na boca, e estas são produzidas ao haver restos de alimentos que ficam na superfície do dente.
Página 337
O aumento da probabilidade do aparecimento de cáries depende de fatores, como o tempo em que os restos de alimento permanecem sobre os dentes, principalmente os ricos em açúcar. No entanto, a quantidade de açúcar ingerida não é o maior fator de risco, mas sim a frequência dessa ingestão.
5. Além de prejudicar a saúde dos dentes, o consumo excessivo de alimentos ricos em açúcar não é um hábito saudável. Por quê?
Resposta: Alimentos ricos em açúcar podem provocar obesidade e aumentar as chances de ter algumas doenças, como o diabetes.
Quando a acidez na boca aumenta por causa da ingestão de açúcares, após cerca de 30 minutos o esmalte pode ser desmineralizado✚. Dessa forma, o hábito de mascar chiclete e ingerir balas várias vezes ao dia é prejudicial à saúde dos dentes.
Quando a desintegração mineral do esmalte é superior à sua formação mineral, inicia-se a ocorrência de cárie.
A desmineralização do esmalte dos dentes é causada pela presença dos íons hidrônio abre parênteses H subscrito 3 O elevado a início expoente, mais, fim expoente fecha parênteses provenientes dos ácidos formados pelas bactérias da boca. Confira a equação química a seguir.
C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses mais 8 H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas 10 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 6 H P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais 10 H subscrito 2 O abre parênteses l fecha parênteses
Nessa equação química, a seta dupla indica que a reação ocorre nos dois sentidos. Esse tipo de reação é chamado de reação reversível. A seta para a direita indica a reação direta, enquanto a seta para a esquerda indica a reação inversa.
Há reações químicas reversíveis e irreversíveis. Por exemplo, as reações de combustão são consideradas processos irreversíveis. Isso porque, após a queima do combustível, os produtos da combustão não podem se combinar de forma espontânea para regenerar o combustível novamente.

6. O que acontece com a fogueira quando toda a madeira for queimada?
Resposta: A reação é finalizada. O objetivo desta questão é fazer os estudantes perceberem que, quando um dos reagentes é totalmente consumido, a reação é finalizada.
Já a reação de mineralização e desmineralização do esmalte dos dentes é reversível. Caso seja mantida uma higiene bucal adequada, a desmineralização natural do esmalte é compensada por outros processos que ocorrem na boca, que favorecem a mineralização. Nas reações reversíveis, chamamos essa situação de equilíbrio químico. Uma reação em equilíbrio apresenta as quantidades de reagentes e de produtos constantes ao longo do tempo.
No entanto, se a higiene bucal não for adequada, o aumento da acidez da boca causará a desmineralização do esmalte em uma proporção que não poderá ser reposta pela mineralização em condições normais. Nesse caso, a reação não estará mais em equilíbrio.
As reações químicas reversíveis tendem ao equilíbrio, que é atingido quando a velocidade direta é igual à velocidade da reação inversa. Quando as quantidades de reagentes e de produtos se mantêm constantes durante a ocorrência da reação química, ocorre o chamado equilíbrio dinâmico.
Professor, professora: Diga aos estudantes que há situações em que se deseja manter uma reação em equilíbrio, como na manutenção do esmalte dos dentes. Há também casos em que se deseja favorecer mais a reação direta ou a reação inversa. Isso pode ser feito alterando algumas condições da reação.
A seguir, estudaremos de forma mais detalhada o processo de equilíbrio nas reações químicas.
- Desmineralizado:
- refere-se ao processo de perda de elementos minerais, ou seja, compostos químicos naturais.↰
Página 338
LIGADO NO TEMA
Osteoporose
Expectativa de vida sobe para 75,5 anos após queda na pandemia
A expectativa de vida ao nascer no Brasil, em 2022, ficou em 75,5 anos, segundo dados das Tábuas da Mortalidade, divulgados nesta quarta-feira (29), no Rio de Janeiro, pelo Instituto Brasileiro de Geografia e Estatística (IBGE). O dado que projeta a longevidade dos brasileiros teve uma recuperação parcial no ano passado após dois anos seguidos de quedas em 2021 e 2020, quando a pandemia de covid-19 fez mais vítimas.
[…]
ABDALA, Vitor. Expectativa de vida sobe para 75,5 anos após queda na pandemia. Agência Brasil, 29 nov. 2023. Disponível em: https://s.livro.pro/r57io3. Acesso em: 6 set. 2024.
Nos últimos anos, a expectativa de vida média no Brasil tem aumentado, embora tenha sofrido uma queda durante o período de pandemia de covid-19. Esse aumento não é uniforme em todas as regiões do Brasil e está relacionado a melhoras em indicadores de qualidade de vida, como acesso ao saneamento básico (água tratada e esgoto), aos serviços de saúde (hospitais, medicamentos, vacinas, atividades físicas etc.), à moradia digna e à alimentação de qualidade.
No entanto, mesmo as pessoas com hábitos de vida saudáveis estão expostas ao risco de desenvolver osteoporose com o passar da idade. Essa doença se caracteriza pela perda acentuada de densidade óssea, principalmente depois dos 50 anos, idade em que há uma queda da produção hormonal (mais acentuada nas mulheres), levando a uma maior perda de massa óssea. A osteoporose causa uma fragilização da estrutura óssea do indivíduo, podendo levar a fraturas grandes, bem como a pequenas fraturas imperceptíveis, mas que geram deformações no corpo.
A prevenção para o surgimento da osteoporose pode se dar pelo gerenciamento dos fatores de risco associados à doença, adotando hábitos de vida saudáveis de forma contínua, com especial atenção na velhice. Entre as práticas recomendadas, destaca-se a prática de atividades físicas de força – como a musculação –, que auxiliam na fixação do cálcio abre parênteses C a fecha parênteses nos ossos, além da ingestão adequada de cálcio e vitamina D por meio de uma alimentação equilibrada e, quando necessário, suplementação orientada por um profissional de saúde.
Além dos desafios relacionados à saúde e à qualidade de vida, a população idosa no Brasil enfrenta outras dificuldades, como preconceitos e estigmas, exclusão do mercado de trabalho e falta de políticas públicas voltadas especialmente às suas necessidades. A discriminação por idade, conhecida como etarismo, deve ser combatida em todas as esferas da sociedade, tanto individuais quanto coletivas. Uma das formas de combater o etarismo é incluir pessoas idosas em diferentes espaços de socialização, garantindo sua representatividade por meio de políticas de acessibilidade.
a ) Explique a relação entre a ingestão adequada de cálcio e a manutenção da saúde óssea.
Resposta: Os ossos, assim como os dentes, passam por reações químicas de desmineralização resultantes da perda de cálcio. Assim, a reposição desse mineral em quantidades adequadas por meio da alimentação pode ajudar a retardar e reverter o processo de desmineralização óssea.
b ) Você já presenciou situações de etarismo com pessoas idosas? Como esse tipo de preconceito afeta a qualidade de vida dessas pessoas?
Resposta pessoal. Os estudantes podem responder que o etarismo afeta a qualidade de vida das pessoas idosas ao gerar exclusão social, preconceito e limitações no acesso a oportunidades e serviços.
c ) Quais medidas, públicas e individuais, podem ser tomadas para reduzir a discriminação com base na idade e melhorar a qualidade de vida das pessoas idosas?
Resposta: Espera-se que os estudantes respondam que para reduzir a discriminação e melhorar a qualidade de vida, medidas públicas incluem a criação de programas de saúde específicos para pessoas idosas, acessibilidade nos locais para práticas de atividade física, criação de centros de convivência, promoção de campanhas de conscientização e inclusão, entre outras. Medidas individuais para combater o etarismo envolvem respeitar e valorizar as pessoas idosas e suas experiências de vida, enquanto ações individuais que as pessoas idosas podem realizar para melhorar a qualidade de vida incluem a prática regular de atividades físicas, manter uma alimentação equilibrada e engajar-se em atividades sociais.
Página 339
O equilíbrio químico e a constante de equilíbrio
Quando uma reação atinge o equilíbrio químico, isso não significa que não são mais formados reagentes e produtos. No estado de equilíbrio, a reação continua a acontecer, mas as concentrações dos componentes não se alteram. Outro ponto importante a destacar é que, no equilíbrio, as concentrações dos reagentes e dos produtos não serão necessariamente iguais. Geralmente, esses valores serão diferentes.
Para um sistema em equilíbrio, podemos avaliar a relação entre as quantidades de reagentes e as de produtos por meio da constante de equilíbrio abre parênteses 'K' subscrito c fecha parênteses. Essa constante é dada pelo quociente entre concentrações dos produtos e dos reagentes após atingirem o equilíbrio. Considere a seguinte reação genérica:
a A mais b B duas meias setas que apontam em direções opostas d D mais e E
em que a, b, d e e são os coeficientes estequiométricos das espécies químicas participantes, isto é, a quantidade de matéria, em mols. A equação geral da constante de equilíbrio em função das concentrações molares é dada por:
'K' subscrito c é igual a início de fração, numerador: abre colchetes D fecha colchetes elevado a d vezes abre colchetes E fecha colchetes elevado a e, denominador: abre colchetes A fecha colchetes elevado a a vezes abre colchetes B fecha colchetes elevado a b, fim de fração
Dica
A constante de equilíbrio é válida apenas para sistemas homogêneos e ideais, como soluções diluídas e gases à baixa pressão. Além disso, o valor de 'K' subscrito c permanece constante apenas quando os participantes da reação estão realmente em equilíbrio, em um recipiente fechado e mantido a uma temperatura constante.
Confira um exemplo a seguir.
C O subscrito 2 abre parênteses g fecha parênteses mais N O abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas C O abre parênteses g fecha parênteses mais N O subscrito 2 abre parênteses g fecha parênteses
'K' subscrito c é igual a início de fração, numerador: abre colchetes C O abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes N O subscrito 2 abre parênteses g fecha parênteses fecha colchetes, denominador: abre colchetes C O subscrito 2 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes N O abre parênteses g fecha parênteses fecha colchetes, fim de fração
Caso algum dos componentes da reação apresente coeficiente estequiométrico maior do que 1, esse coeficiente é colocado no expoente:
H subscrito 2 abre parênteses g fecha parênteses mais I subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H I abre parênteses g fecha parênteses
'K' subscrito c é igual a início de fração, numerador: abre colchetes H I abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes I subscrito 2 abre parênteses g fecha parênteses fecha colchetes, fim de fração
O valor obtido pela constante de equilíbrio permite prever a concentração de produto formado quando a reação atingir o equilíbrio. Essa constante para uma reação não varia com as quantidades iniciais de reagentes, apenas com a temperatura. A reação atingirá, para cada valor de temperatura, uma condição de equilíbrio diferente.
Os equilíbrios químicos podem ser estudados por meio da análise de gráficos da concentração em quantidade de matéria ou da quantidade de matéria pelo tempo.
Confira, por exemplo, a tabela a seguir com os valores de concentração dos reagentes e dos produtos para a reação de formação da amônia abre parênteses N H subscrito 3 fecha parênteses a partir dos gases hidrogênio abre parênteses H subscrito 2 fecha parênteses e nitrogênio abre parênteses N subscrito 2 fecha parênteses.
N subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 newtons H subscrito 3 abre parênteses g fecha parênteses
| Tempo | abre colchetes N subscrito 2 fecha colchetes | abre colchetes H subscrito 2 fecha colchetes | abre colchetes N H subscrito 3 fecha colchetes |
|---|---|---|---|
|
't' subscrito 0 |
1,000 |
1,000 |
0 |
|
't' subscrito 1 |
0,874 |
0,622 |
0,252 |
|
't' subscrito 2 |
0,814 |
0,442 |
0,372 |
|
't' subscrito 3 |
0,786 |
0,358 |
0,428 |
|
't' subscrito 4 |
0,781 |
0,343 |
0,438 |
|
't' subscrito 5 |
0,781 |
0,343 |
0,438 |
Fonte de pesquisa: RUSSEL, John B. Química geral. 2. ed. São Paulo: Makron Books, 2006. p. 690.
Página 340
Com os dados da tabela, é possível construir um gráfico que represente a formação da amônia, como o mostrado a seguir. Por meio dele, podemos analisar a variação (em concentração de quantidade de matéria) das substâncias envolvidas em seu processo de formação.
Concentração molar em função do tempo para a reação de formação da amônia
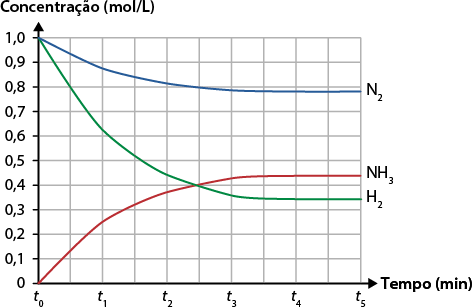
Fonte de pesquisa: RUSSEL, John B. Química geral. 2. ed. São Paulo: Makron Books, 2006. p. 690.
Nesse tipo de gráfico, verificamos que, com o passar do tempo, as concentrações dos reagentes diminuem à medida que são consumidos. Já as concentrações dos produtos partem do zero e aumentam à medida que são formados.
Analisando o gráfico, podemos perceber que a reação de formação da amônia se inicia em 't' subscrito 0, com 1 mol de gás nitrogênio e 1 mol de gás hidrogênio em um balão de 1 litro, a uma temperatura de 350 graus Celsius. No instante 't' subscrito 1, foram consumidos 0 vírgula 126 mol de N subscrito 2 abre parênteses 0 vírgula 874 menos 1 é igual a menos 0 vírgula 126 fecha parênteses e 0 vírgula 378 mol de H subscrito 2 abre parênteses 0 vírgula 622 menos 1 é igual a menos 0 vírgula 378 fecha parênteses, havendo formação de 0 vírgula 252 mol de N H subscrito 3 abre parênteses 0 vírgula 252 menos 0 é igual a 0 vírgula 252 fecha parênteses. Note que essas variações de quantidades das substâncias envolvidas na reação são proporcionais aos coeficientes estequiométricos.
A partir do instante 't' subscrito 4, a reação entra em equilíbrio dinâmico, ou seja, continua ocorrendo com as concentrações de reagentes e de produtos inalteradas.
Para o cálculo da constante de equilíbrio, serão usadas as concentrações molares dos componentes da reação no estado de equilíbrio. Vale lembrar que a concentração molar é o quociente entre a quantidade de matéria (em mols) e o volume (em litros).
abre colchetes N subscrito 2 fecha colchetes é igual a início de fração, numerador: 0 vírgula 781 mol, denominador: 1 litro, fim de fração é igual a 0 vírgula 781 mol por litro
abre colchetes H subscrito 2 fecha colchetes é igual a início de fração, numerador: 0 vírgula 343 mol, denominador: 1 litro, fim de fração é igual a 0 vírgula 343 mol por litro
abre colchetes N H subscrito 3 fecha colchetes é igual a início de fração, numerador: 0 vírgula 438 mol, denominador: 1 litro, fim de fração é igual a 0 vírgula 438 mol por litro
A constante de equilíbrio para essa reação é:
'K' subscrito c é igual a início de fração, numerador: abre colchetes N H subscrito 3 abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes N subscrito 2 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes elevado ao cubo, fim de fração implica em 'K' subscrito c é igual a início de fração, numerador: abre parênteses 0 vírgula 438 fecha parênteses elevado ao quadrado, denominador: abre parênteses 0 vírgula 781 fecha parênteses vezes abre parênteses 0 vírgula 343 fecha parênteses elevado ao cubo, fim de fração implica em 'K' subscrito c é aproximadamente igual a 6 vírgula 0 9
Como o valor da constante é maior que 1, podemos prever que, nessa reação, durante o equilíbrio, a quantidade de produtos é maior do que a quantidade de reagentes.
Podemos observar três situações de equilíbrio químico ao analisar gráficos de concentração molar pelo tempo.
A. Quando a concentração de reagentes abre colchetes R fecha colchetes é igual à concentração de produtos abre colchetes P fecha colchetes em equilíbrio, a constante de equilíbrio é igual a 1. Quando isso ocorre, podemos dizer que a reação não favorece nenhum dos dois sentidos.
Concentração molar em função do tempo
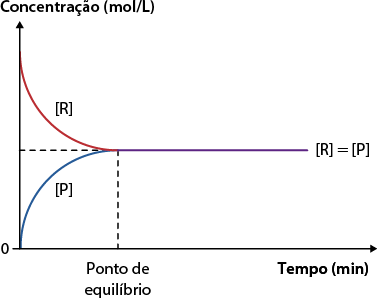
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 665.
Página 341
B. Quando a concentração de reagentes abre colchetes R fecha colchetes é maior que a concentração de produtos abre colchetes P fecha colchetes em equilíbrio. Nesse caso, a constante de equilíbrio é menor que 1. Quando isso ocorre, podemos dizer que a reação favorece a formação dos reagentes.
Concentração molar em função do tempo
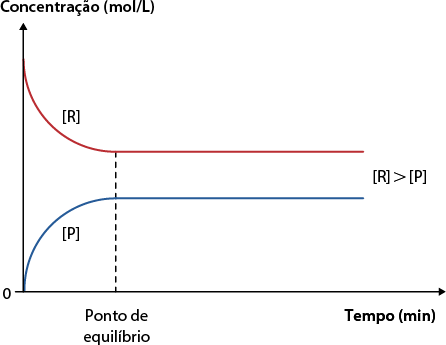
Fonte de pesquisa: CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Porto Alegre: AMGH, 2013. p. 625.
Professor, professora: Auxilie os estudantes na interpretação dos gráficos desta página e da anterior. Explique-lhes que há uma curva representando os reagentes e outra, os produtos. Explique também que a constante de equilíbrio para uma reação varia apenas com a temperatura e independe das quantidades iniciais de reagentes e de produtos. Auxilie a turma com a leitura e a interpretação dos gráficos. Para isso, mostre que a concentração está em mol por litro e varia com o tempo em minutos. Comente que a curva dos reagentes diminui enquanto a dos produtos se eleva, conforme os reagentes são transformados em produtos, até atingir o equilíbrio.
C. Quando a concentração de reagentes abre colchetes R fecha colchetes é menor que a concentração de produtos abre colchetes P fecha colchetes em equilíbrio. Nesse caso, a constante de equilíbrio é maior que 1. Quando isso ocorre, podemos dizer que a reação favorece a formação dos produtos.
Concentração molar em função do tempo
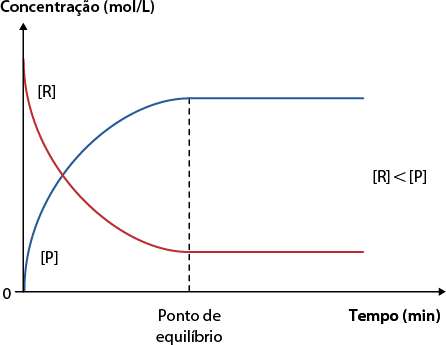
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 665.
Constantes de equilíbrio K subscrito p
Para sistemas gasosos, além da constante de equilíbrio em termos das concentrações molares, podemos calcular a constante de equilíbrio em termos das pressões parciais dos gases participantes da reação. Considerando novamente a reação genérica:
a A mais b B duas meias setas que apontam em direções opostas d D mais e E
em que a, b, d e e são os coeficientes estequiométricos dos participantes da reação química.
A equação geral da constante de equilíbrio em função das pressões parciais é dada por:
'K' subscrito p é igual a início de fração, numerador: abre parênteses p subscrito D fecha parênteses elevado a d vezes abre parênteses p subscrito E fecha parênteses elevado a e, denominador: abre parênteses p subscrito A fecha parênteses elevado a a vezes abre parênteses p subscrito B fecha parênteses elevado a b, fim de fração
Professor, professora: Diga aos estudantes que, para várias reações químicas conhecidas, há valores de constante de equilíbrio em diferentes temperaturas. Diga-lhes que, quando realizamos o cálculo com os valores das concentrações, em mol por litro, de reagentes e produtos presentes no equilíbrio químico, o resultado desse cálculo é igual ao valor da constante de equilíbrio. Se isso não ocorrer, pode-se afirmar que a reação ainda não atingiu o equilíbrio.
Para a reação de decomposição da amônia, a constante 'K' subscrito p é expressa pela seguinte equação:
2 newtons H subscrito 3 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas N subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 abre parênteses g fecha parênteses
'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, N subscrito 2, fim subscrito fecha parênteses vezes abre parênteses p início subscrito, H subscrito 2, fim subscrito fecha parênteses elevado ao cubo, denominador: abre parênteses p início subscrito, N H subscrito 3, fim subscrito fecha parênteses elevado ao quadrado, fim de fração
A seguir, serão apresentados exemplos do cálculo das constantes de equilíbrio 'K' subscrito c e 'K' subscrito p.
Página 342
ATIVIDADES RESOLVIDAS
R1. Calcule a constante de equilíbrio abre parênteses 'K' subscrito p fecha parênteses para a reação representada pela equação química a seguir, sabendo que no recipiente as pressões parciais das substâncias, no equilíbrio, são: p início subscrito, H subscrito 2, fim subscrito é igual a 7 vírgula 38 a t m; p início subscrito, N subscrito 2, fim subscrito é igual a 2 vírgula 46 a t m; p início subscrito, N H subscrito 3, fim subscrito é igual a 0 vírgula 166 a t m.
N subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 newtons H subscrito 3 abre parênteses g fecha parênteses
Resolução
Para essa reação, a constante de equilíbrio é dada por:
'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, N H subscrito 3, fim subscrito fecha parênteses elevado ao quadrado, denominador: abre parênteses p início subscrito, N subscrito 2, fim subscrito fecha parênteses vezes abre parênteses p início subscrito, H subscrito 2, fim subscrito fecha parênteses elevado ao cubo, fim de fração
Substituindo pelos valores numéricos, temos:
'K' subscrito p é igual a início de fração, numerador: abre parênteses 0 vírgula 166 fecha parênteses elevado ao quadrado, denominador: abre parênteses 2 vírgula 46 fecha parênteses vezes abre parênteses 7 vírgula 38 fecha parênteses elevado ao cubo, fim de fração é aproximadamente igual a 2 vírgula 79 vezes 10 elevado a menos 5
R2. Considere que 4 vírgula 0 mol de H subscrito 2 abre parênteses g fecha parênteses e 4 vírgula 0 mol de iodo abre parênteses I subscrito 2 abre parênteses g fecha parênteses fecha parênteses, em um recipiente de 2,0 litros, atingem a condição de equilíbrio a 500 graus Celsius, em que a quantidade de ácido iodídrico abre parênteses H I abre parênteses g fecha parênteses fecha parênteses é igual a 4 vírgula 0 mol. Determine o valor da constante de equilíbrio para a reação a seguir.
H subscrito 2 abre parênteses g fecha parênteses mais I subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H I abre parênteses g fecha parênteses
Professor, professora: Para o cálculo da constante de equilíbrio, é importante orientar os estudantes a montar um quadro com as informações sobre as concentrações em quantidade de matéria das reações químicas. Esse quadro ajuda a visualizar o que ocorre durante uma reação química até que ela atinja o equilíbrio químico.
Resolução
De acordo com as informações dadas e considerando que não havia produto no início da reação, temos:
| Reação | Início | Consumo / produção | Equilíbrio |
|---|---|---|---|
|
1 H subscrito 2 abre parênteses g fecha parênteses mais 1 I subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H I abre parênteses g fecha parênteses |
4 vírgula 0 mol H subscrito 2 mais 4 vírgula 0 mol I subscrito 2 duas meias setas que apontam em direções opostas 0 H I |
4 vírgula 0 mol H I |
4 vírgula 0 mol H I |
Como a proporção entre o H I abre parênteses g fecha parênteses e o H subscrito 2 abre parênteses g fecha parênteses ou I subscrito 2 abre parênteses g fecha parênteses é de 2 dois-pontos 1, foram consumidos 2 vírgula 0 mol de cada um dos reagentes. A quantidade dos reagentes no equilíbrio é igual à quantidade inicial menos o que foi consumido.
| Reação | Início | Consumo/produção | Equilíbrio |
|---|---|---|---|
|
1 H subscrito 2 abre parênteses g fecha parênteses mais 1 I subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H I abre parênteses g fecha parênteses |
4 vírgula 0 mol H subscrito 2 mais 4 vírgula 0 mol I subscrito 2 duas meias setas que apontam em direções opostas 0 H I |
2 vírgula 0 mol H subscrito 2 mais 2 vírgula 0 mol I subscrito 2 duas meias setas que apontam em direções opostas 4 vírgula 0 mol H I |
2 vírgula 0 mol H subscrito 2 mais 2 vírgula 0 mol I subscrito 2 duas meias setas que apontam em direções opostas 4 vírgula 0 mol H I |
Para obter as concentrações molares, devemos dividir as quantidades pelo volume do recipiente:
abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes é igual a início de fração, numerador: 2 vírgula 0 mol, denominador: 2 litros, fim de fração é igual a 1 vírgula 0 mol por litro
abre colchetes I subscrito 2 abre parênteses g fecha parênteses fecha colchetes é igual a início de fração, numerador: 2 vírgula 0 mol, denominador: 2 litros, fim de fração é igual a 1 vírgula 0 mol por litro
abre colchetes H I abre parênteses g fecha parênteses fecha colchetes é igual a início de fração, numerador: 4 vírgula 0 mol, denominador: 2 litros, fim de fração é igual a 2 vírgula 0 mol por litro
Para essa reação, a constante de equilíbrio é:
'K' subscrito c é igual a início de fração, numerador: abre colchetes H I abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes vezes abre colchetes I subscrito 2 abre parênteses g fecha parênteses fecha colchetes, fim de fração
Substituindo pelos valores numéricos, temos:
'K' subscrito c é igual a início de fração, numerador: abre parênteses 2 vírgula 0 fecha parênteses elevado ao quadrado, denominador: abre parênteses 1 vírgula 0 fecha parênteses vezes abre parênteses 1 vírgula 0 fecha parênteses, fim de fração implica em 'K' subscrito c é igual a 4
Página 343
Equilíbrios heterogêneos
Nas reações químicas em equilíbrio, todas as substâncias envolvidas podem se encontrar no mesmo estado de agregação. Isso ocorre nas reações em que todos os componentes estão na fase gasosa ou em solução. Esse tipo de equilíbrio é chamado de equilíbrio homogêneo.
Em outros casos, as substâncias em equilíbrio estão em estados de agregação diferentes, podendo estar em equilíbrio, por exemplo, um sólido com outras substâncias dissolvidas (em fase aquosa). Esse tipo de equilíbrio é chamado de equilíbrio heterogêneo.
Nos equilíbrios heterogêneos, os sólidos e líquidos puros não são incluídos no cálculo da constante de equilíbrio. A fórmula geral para o cálculo da constante permanece, apenas excluindo as substâncias que estejam nesses estados de agregação. Confira a seguir alguns exemplos.
Combustão incompleta do carvão formando monóxido de carbono abre parênteses C O fecha parênteses:
2 C abre parênteses s fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 C O abre parênteses g fecha parênteses
Para a constante de equilíbrio, aplica-se a mesma regra tanto em termos de concentração molar quanto em termos de pressão parcial:
'K' subscrito c é igual a início de fração, numerador: abre colchetes C O abre parênteses g fecha parênteses fecha colchetes elevado ao quadrado, denominador: abre colchetes O subscrito 2 abre parênteses g fecha parênteses fecha colchetes, fim de fração e 'K' subscrito p é igual a início de fração, numerador: abre parênteses p subscrito C O fecha parênteses elevado ao quadrado, denominador: abre parênteses p início subscrito, O subscrito 2, fim subscrito fecha parênteses, fim de fração
Reação de decomposição térmica do carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses sólido para a obtenção da cal virgem abre parênteses C a O fecha parênteses:
C a C O subscrito 3 abre parênteses s fecha parênteses duas meias setas que apontam em direções opostas C a O abre parênteses s fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses

Essa reação química é conhecida como calcinação. Além do uso na construção civil, para a fabricação da argamassa, a cal virgem é utilizada nas indústrias siderúrgicas, de papel e de celulose, de tintas, alimentícia, farmacêutica, açucareira, entre outras. Também é usada no controle ambiental, na agricultura na estabilização de solos e no tratamento de águas potáveis e industriais. Suas constantes de equilíbrio são dadas por:
'K' subscrito c é igual a abre colchetes C O subscrito 2 abre parênteses g fecha parênteses fecha colchetes e 'K' subscrito p é igual a abre parênteses p início subscrito, C O subscrito 2, fim subscrito fecha parênteses
Reação de dissolução da hidroxiapatita:
C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses mais 8 H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas 10 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 6 H P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais 10 H subscrito 2 O abre parênteses l fecha parênteses
A reação de dissolução da hidroxiapatita no processo de desmineralização dos dentes, estudada anteriormente, é um equilíbrio do tipo heterogêneo. Nessa reação, há substâncias nas fases sólida e aquosa. Sua constante de equilíbrio é dada por:
'K' subscrito c é igual a início de fração, numerador: abre colchetes C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 10 vezes abre colchetes H P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 6, denominador: abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes elevado a 8, fim de fração
Note que, na verdade, tanto os sólidos quantos os líquidos não são realmente omitidos no cálculo das constantes. No caso do 'K' subscrito c, as concentrações dos sólidos e dos líquidos são constantes a determinada temperatura. Portanto, seus valores já estão inseridos no próprio valor de 'K' subscrito c. Para o cálculo de 'K' subscrito p, as pressões de vapor dos sólidos e dos líquidos também são constantes a determinada temperatura.
Página 344
ATIVIDADES
1. O gráfico a seguir mostra a quantidade de matéria em função do tempo, para a reação de decomposição da amônia, em um balão de capacidade igual a 10 litros.
Quantidade de matéria em função do tempo
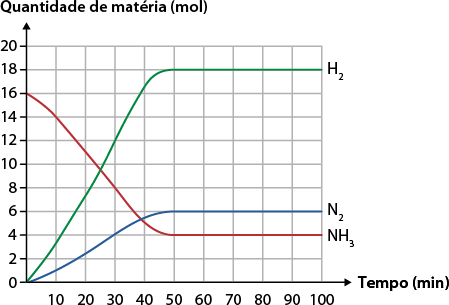
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 397.
De acordo com as informações apresentadas no gráfico, determine os itens a seguir.
a ) A reação química balanceada.
b ) Analise o gráfico e determine o tempo em que a reação atingiu o equilíbrio químico.
c ) A expressão da constante de equilíbrio em termos de pressão parcial.
d ) A expressão da constante de equilíbrio em termos de quantidade de matéria.
e ) O valor da constante de equilíbrio.
f ) Com base na resposta do item anterior e no gráfico, a reação é favorável para a formação do produto ou dos reagentes?
2. O esmalte do dente é constituído de um material pouco solúvel em água e cujo principal componente é a hidroxiapatita menos C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2. Uma quantidade pequena de hidroxiapatita pode se dissolver, em processo descrito pela equação denominado de desmineralização:
C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses mais 8 H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas
duas meias setas que apontam em direções opostas 10 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 6 H P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais 10 H subscrito 2 O abre parênteses l fecha parênteses
Na presença dos íons F elevado a início expoente, menos, fim expoente, outro equilíbrio se estabelece,
C a subscrito 5 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 F abre parênteses s fecha parênteses duas meias setas que apontam em direções opostas 5 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais
mais 3 P O subscrito 4 elevado a início expoente, 3 menos, fim expoente abre parênteses a q fecha parênteses mais F elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Nesse processo, uma nova substância é formada, a fluorapatita menos C a subscrito 5 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 F abre parênteses s fecha parênteses. O esmalte passa a ser, então, um material modificado. Uma pequena incorporação de íons F elevado a início expoente, menos, fim expoente é suficiente para alterar as propriedades do esmalte, tornando-o menos suscetível ao ataque por ácidos.
a ) Escreva a expressão da constante de equilíbrio para as duas reações de desmineralização representadas anteriormente.
b ) Baseado no que foi exposto anteriormente, qual das duas constantes deve apresentar maior valor? Justifique sua resposta.
3. Escreva as expressões para as constantes de equilíbrio em termos das concentrações molares e de pressões parciais dos participantes das seguintes reações químicas reversíveis:
a ) 3 F e abre parênteses s fecha parênteses mais 4 H subscrito 2 O abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas F e subscrito 3 O subscrito 4 abre parênteses s fecha parênteses mais 4 H subscrito 2 abre parênteses g fecha parênteses
b ) 2 S O subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 S O subscrito 3 abre parênteses g fecha parênteses
c ) C a C O subscrito 3 abre parênteses s fecha parênteses duas meias setas que apontam em direções opostas C a O abre parênteses s fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses
d ) O subscrito 3 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas O abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
e ) P C l subscrito 5 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas P C l subscrito 3 abre parênteses g fecha parênteses mais C l subscrito 2 abre parênteses g fecha parênteses
f ) C abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas C O abre parênteses g fecha parênteses mais H subscrito 2 abre parênteses g fecha parênteses
g ) C l subscrito 2 abre parênteses g fecha parênteses mais F subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 C l F abre parênteses g fecha parênteses
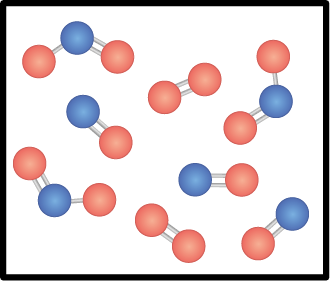
4. O diagrama a seguir representa o estado de equilíbrio da seguinte reação de formação do dióxido de nitrogênio abre parênteses N O subscrito 2 abre parênteses g fecha parênteses fecha parênteses.
2 N O abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 N O subscrito 2 abre parênteses g fecha parênteses
Se o volume do recipiente for um litro e cada molécula representar 0 vírgula 1 mol, qual será o valor da constante de equilíbrio da reação na situação representada no diagrama?
Imagem sem proporção e em cores fantasia.
Respostas das questões 1 a 4 nas Orientações para o professor.
Página 345
Fatores que alteram o equilíbrio químico
Como estudamos anteriormente, quando a desintegração mineral do esmalte dos dentes é superior à sua formação mineral natural, pode ocorrer o desenvolvimento da cárie. O aumento da acidez da saliva, causado pelo aumento da concentração de íons H subscrito 3 O elevado a início expoente, mais, fim expoente, perturba o equilíbrio químico já estabelecido. Confira, na reação a seguir, que esse íon está do lado dos reagentes e reage com a hidroxiapatita, favorecendo, assim, a desmineralização dos dentes.
C a subscrito 10 abre parênteses P O subscrito 4 fecha parênteses subscrito 6 abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses mais 8 H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas 10 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 6 H P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais 10 H subscrito 2 O abre parênteses l fecha parênteses
Em um sistema químico em equilíbrio, a rapidez da reação direta é igual à da reação inversa, mantendo a concentração dos participantes constante. Enquanto não houver a interferência de um agente externo, o sistema permanece em equilíbrio. Se ocorrer a ação de um agente externo, o sistema tende a reagir com o objetivo de minimizar os efeitos dessa ação.
Em 1884, o químico francês Henri-Louis Le Chatelier (1850-1936) enunciou o seguinte princípio:
Quando sobre um sistema em equilíbrio atua um fator externo (variação de concentração, de pressão ou de temperatura), o sistema tende a favorecer a reação no sentido contrário à ação desse fator.
O princípio de Le Chatelier permite prever a influência da ação de um fator externo em um sistema em equilíbrio. Conforme o enunciado do princípio, o equilíbrio pode ser perturbado por diferentes fatores, como temperatura, pressão e concentração.

Variação na concentração de reagentes e de produtos
Ao variar a concentração de um reagente ou de um produto, a reação sai do equilíbrio, mas tende a atingir, espontaneamente, um novo estado de equilíbrio. Confira a seguir o exemplo da reação de formação do cloreto de hidrogênio abre parênteses H C l fecha parênteses.
H subscrito 2 abre parênteses g fecha parênteses mais C l subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H C l abre parênteses g fecha parênteses
Adicionando H subscrito 2 abre parênteses g fecha parênteses ou gás cloro abre parênteses C l subscrito 2 abre parênteses g fecha parênteses fecha parênteses, a reação sai do estado de equilíbrio e, para retornar a esse estado, deve consumir pelo menos uma parte do reagente adicionado. Como o consumo de reagentes ocorre aumentando a velocidade da reação direta, dizemos que o equilíbrio foi favorecido no sentido da formação do produto.
7. Podemos prever, de forma semelhante, como será atingido o novo estado de equilíbrio no caso da diminuição da concentração de um dos reagentes. Explique com suas palavras como isso ocorre.
Resposta: Espera-se que os estudantes respondam que, para retornar ao estado de equilíbrio, é necessário repor o reagente retirado. Para que isso ocorra, a velocidade da reação inversa passa a ser maior do que a velocidade da reação direta. Nesse caso, dizemos que o equilíbrio foi deslocado para a esquerda.
No caso do aumento ou da diminuição da concentração do produto, podemos prever o mesmo efeito observado com os reagentes. Portanto, adicionando qualquer participante, o equilíbrio altera, favorecendo o seu consumo. Já ao retirar algum dos participantes, o equilíbrio se altera favorecendo a sua formação (tendendo a minimizar o efeito da retirada).
Confira no quadro um resumo das mudanças que podem ocorrer na reação estudada.
| Interferência | Sentido favorecido |
|---|---|
|
Aumento da abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes |
Produto |
|
Aumento da abre colchetes C l subscrito 2 abre parênteses g fecha parênteses fecha colchetes |
Produto |
|
Aumento da abre colchetes H C l abre parênteses g fecha parênteses fecha colchetes |
Reagentes |
|
Diminuição da abre colchetes H subscrito 2 abre parênteses g fecha parênteses fecha colchetes |
Reagentes |
|
Diminuição da abre colchetes C l subscrito 2 abre parênteses g fecha parênteses fecha colchetes |
Reagentes |
|
Diminuição da abre colchetes H C l abre parênteses g fecha parênteses fecha colchetes |
Produto |
Página 346
É importante saber que, no novo estado de equilíbrio atingido, os valores de 'K' subscrito c e de 'K' subscrito p permanecem iguais ao do estado de equilíbrio anterior.
Variações no volume e na pressão
Como exemplo, vamos considerar o equilíbrio entre o dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses e o tetróxido de dinitrogênio abre parênteses N subscrito 2 O subscrito 4 fecha parênteses.
N subscrito 2 O subscrito 4 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 N O subscrito 2 abre parênteses g fecha parênteses
O N subscrito 2 O subscrito 4 é um gás incolor e o N O subscrito 2 é um gás de cor castanha. Observa-se, experimentalmente, que, ao diminuir a pressão de um sistema em equilíbrio contendo esses dois gases, a cor castanha se intensificará.
Professor, professora: Comente com os estudantes que, ao entrar novamente em equilíbrio após uma perturbação, o valor da constante de equilíbrio da reação não se altera. Enfatize que a variação de pressão altera o equilíbrio químico apenas de sistemas gasosos.
Imagem sem proporção e em cores fantasia.
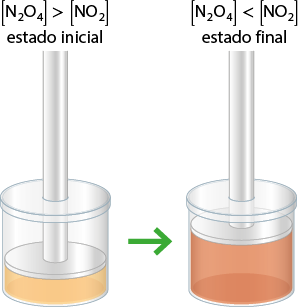
Imagem elaborada com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 448.
Ao subir o êmbolo, a pressão interna do sistema diminui e a coloração se altera.
Nota-se que a diminuição da pressão favorece o sentido da formação do maior número de moléculas de gás N O subscrito 2. Nesse caso, temos 1 mol do lado do reagente e 2 mols do lado do produto.
Essa ideia também está de acordo com o princípio de Le Chatelier, pois o aumento da pressão total altera o equilíbrio, favorecendo a reação no sentido de menor volume (menor número de mols), dado que a redução no volume minimiza o efeito da pressão aplicada. Por outro lado, a redução da pressão total altera o equilíbrio, favorecendo a reação no sentido de maior volume (maior número de mols), pois o aumento de volume minimiza a redução da pressão.
Confira no quadro a seguir um resumo das mudanças que podem ocorrer na reação estudada.
| Interferência | Sentido favorecido |
|---|---|
|
Aumento da pressão total |
Aquele em que há contração volumétrica. |
|
Diminuição da pressão total |
Aquele em que há expansão volumétrica. |
Se uma reação não apresenta variação de volume, a variação da pressão não provoca alterações sobre o seu equilíbrio. Confira um exemplo.
H subscrito 2 abre parênteses g fecha parênteses mais C l subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H C l abre parênteses g fecha parênteses
Nessa reação, há 2 mols de reagentes abre parênteses 1 H subscrito 2 abre parênteses g fecha parênteses mais 1 C l subscrito 2 abre parênteses g fecha parênteses fecha parênteses e 2 mols de produto abre parênteses 2 HC l abre parênteses g fecha parênteses fecha parênteses. Portanto, a variação da pressão não altera o equilíbrio.
Assim como estudamos com as variações das concentrações dos participantes do equilíbrio, a variação da pressão total também não altera os valores de 'K' subscrito c e 'K' subscrito p.
Outro fator importante a considerar é que, em um sistema fechado e em equilíbrio gasoso, o equilíbrio não será afetado se for introduzido um novo gás que não reaja com algum dos participantes desse equilíbrio.
Página 347
Variação da temperatura do sistema
Professor, professora: Comente com os estudantes que, por conta dos efeitos cinéticos, o aquecimento aumenta a rapidez tanto da reação direta como da reação inversa. Contudo, somando-se a isso o efeito da alteração do equilíbrio, a reação endotérmica é afetada de forma mais significativa. Explique que a variação da temperatura provoca alteração no valor da constante de equilíbrio.
Considerando um sistema em equilíbrio, a variação de temperatura tende a produzir um deslocamento de equilíbrio da forma apresentada no quadro a seguir.
| Interferência | Sentido favorecido |
|---|---|
|
Aumento da temperatura |
Aquele em que a reação é endotérmica. |
|
Diminuição da temperatura |
Aquele em que a reação é exotérmica. |
Essa conclusão está de acordo com o princípio de Le Chatelier, pois o aumento da temperatura altera o equilíbrio de modo que a absorção de calor pela reação venha a minimizar a elevação da temperatura (sentido endotérmico). Por outro lado, a diminuição da temperatura altera o equilíbrio de modo que a liberação de calor pela reação venha a minimizar a diminuição da temperatura (no sentido exotérmico). Por exemplo, na reação de síntese da amônia:
N subscrito 2 abre parênteses g fecha parênteses mais 3 H subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 newtons H subscrito 3 abre parênteses g fecha parênteses delta H é igual a menos 109 vírgula 5 quilojoules
O valor do delta H em seguida da reação refere-se à reação direta. Portanto, a reação direta é exotérmica e a reação inversa é endotérmica.
É importante notar que a variação da temperatura provoca alterações nos valores de 'K' subscrito p e 'K' subscrito c. De modo geral, pode-se dizer que nas reações endotérmicas o valor de 'K' subscrito c aumenta com o aumento da temperatura, e nas reações exotérmicas o valor de 'K' subscrito c diminui com o aumento da temperatura.
Influência do catalisador
O catalisador é um agente químico que aumenta a velocidade da reação química, sem ser consumido por ela. Esse aumento da velocidade está relacionado com a diminuição da energia de ativação da reação, a qual refere-se à energia mínima necessária para colocar os reagentes em uma posição que os possibilita reagir com o outro e, assim, iniciar a reação. Analise o gráfico "Energia de ativação de reação catalisada e não catalisada".
Energia de ativação de reação catalisada e não catalisada
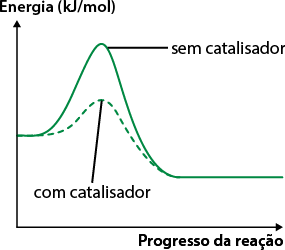
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 689.
Professor, professora: Explique à turma que os catalisadores reduzem o tempo necessário para chegar ao equilíbrio, mas não provocam qualquer deslocamento. Peça aos estudantes que observem o gráfico Energia de ativação de reação catalisada e não catalisada para mostrar a diminuição na energia de ativação provocada pelo uso do catalisador.
Os catalisadores não deslocam os equilíbrios, pois atuam igualmente na rapidez das reações direta e inversa; entretanto diminuem o tempo para que seja estabelecido o estado de equilíbrio do sistema. Confira no gráfico a seguir.
Ação dos catalisadores em reações reversíveis
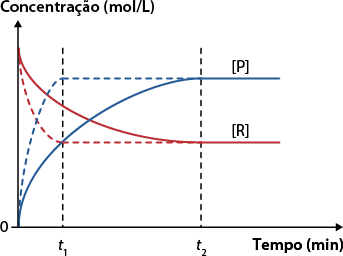
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 689.
Nesse gráfico, 't' subscrito 1 é o tempo gasto para atingir o equilíbrio na presença de catalisador e 't' subscrito 2 é o tempo gasto para atingir o equilíbrio na ausência de catalisador.
No processo, há diminuição do tempo para estabelecer o equilíbrio do sistema. Influenciando apenas o tempo para atingir o estado de equilíbrio, o catalisador não altera o rendimento da reação.
Página 348
ATIVIDADES
1. Considere as seguintes reações químicas.
a ) 2 H subscrito 2 O abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
b ) 2 S O subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 S O subscrito 3 abre parênteses g fecha parênteses
c ) H subscrito 2 abre parênteses g fecha parênteses mais I subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 H I abre parênteses g fecha parênteses
d ) C O abre parênteses g fecha parênteses mais N O subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas C O subscrito 2 abre parênteses g fecha parênteses mais N O abre parênteses g fecha parênteses
Escreva qual dessas reações terá seu equilíbrio alterado favorecendo a formação de mais produto se ocorrer um aumento de pressão.
Resposta: Alternativa b.
2. Em garrafas lacradas contendo água gaseificada, a reação de decomposição do ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses em meio aquoso encontra-se em equilíbrio químico, como mostra a reação a seguir.
H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H subscrito 2 O abre parênteses l fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses

Escreva a alternativa correta sobre o que ocorre quando a garrafa é aberta, de acordo com o princípio de Le Chatelier.
a ) O aumento da pressão em seu interior, favorecendo a formação do ácido carbônico.
b ) A diminuição da pressão em seu interior, favorecendo a formação do ácido carbônico.
c ) O aumento da temperatura em seu interior, favorecendo a decomposição do ácido carbônico.
d ) A diminuição da pressão em seu interior, favorecendo a decomposição do ácido carbônico.
Resposta: Alternativa d.
3. Considere a seguinte reação em equilíbrio químico.
2 H subscrito 2 abre parênteses g fecha parênteses mais 2 N O abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas N subscrito 2 abre parênteses g fecha parênteses mais 2 H subscrito 2 O abre parênteses g fecha parênteses
Escreva a alternativa com o procedimento que levará a um aumento na produção de gás nitrogênio.
a ) Acrescentar vapor de água.
b ) Diminuir a concentração de gás hidrogênio.
c ) Adicionar um catalisador à reação.
d ) Remover o monóxido de nitrogênio.
e ) Aumentar a pressão.
Resposta: Alternativa e.
4. O galo do tempo é um artigo de decoração que muda de cor em função da umidade relativa do ar, passando da cor azul para a cor rosa, e vice-versa. O íon abre colchetes C o C l subscrito 4 fecha colchetes elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses apresenta coloração azul, enquanto o íon abre colchetes C o abre parênteses H subscrito 2 O fecha parênteses subscrito 6 fecha colchetes elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses apresenta a cor rosa. A equação envolvida nesse equilíbrio químico é representada por:
abre colchetes C o C l subscrito 4 fecha colchetes elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais 6 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas
duas meias setas que apontam em direções opostas abre colchetes C o abre parênteses H subscrito 2 O fecha parênteses subscrito 6 fecha colchetes elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 4 C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Responda:
a ) Qual é a cor adquirida pelo galo do tempo em um dia ensolarado?
Resposta: Azul.
b ) Qual é a cor adquirida pelo galo do tempo em um dia chuvoso?
Resposta: Rosa.
c ) O aumento da umidade relativa do ar favorece a formação de quais componentes?
Resposta: abre colchetes C o abre parênteses H subscrito 2 O fecha parênteses subscrito 6 fecha colchetes elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses e C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses.
d ) Qual é a expressão da constante de equilíbrio dessa reação?
Resposta: 'K' subscrito c é igual a início de fração, numerador: abre colchetes abre colchetes C o abre parênteses H subscrito 2 O fecha parênteses subscrito 6 fecha colchetes elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes C l elevado a início expoente, menos, fim expoente fecha colchetes elevado a 4, denominador: abre colchetes abre colchetes C o C l subscrito 4 fecha colchetes elevado a início expoente, 2 menos, fim expoente fecha colchetes, fim de fração
5. O dióxido de nitrogênio, N O subscrito 2, é um gás de cor marrom-avermelhado, que, em determinadas condições, como baixas temperaturas, transforma-se em tetróxido de dinitrogênio, N subscrito 2 O subscrito 4, um gás de coloração incolor. A reação em equilíbrio químico é representada por:
2 N O subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas N subscrito 2 O subscrito 4 abre parênteses g fecha parênteses
a ) Anote quais destas condições reacionais promoveriam o aumento da concentração do tetróxido de dinitrogênio.
- Aumento da temperatura.
- Aumento da pressão.
- Adição de N O subscrito 2.
- Adição de catalisador.
- Diminuição da temperatura.
- Diminuição da pressão.
- Adição de N subscrito 2 O subscrito 4.
- Adição de H subscrito 2 O.
Resposta: Diminuição da temperatura; aumento da pressão; adição de N O subscrito 2.
b ) Escreva a expressão da constante de equilíbrio para essa reação em termos de pressão parcial.
Resposta: 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, N subscrito 2 O subscrito 4, fim subscrito fecha parênteses, denominador: abre parênteses p início subscrito, N O subscrito 2, fim subscrito fecha parênteses elevado ao quadrado, fim de fração
c ) Considere que, no equilíbrio químico, a pressão parcial do dióxido de dinitrogênio é 1 vírgula 5 a t m e a pressão do tetróxido de dinitrogênio é 1 vírgula 2 a t m. Qual é o valor aproximado da constante de equilíbrio em termos de pressão parcial?
Resposta: 'K' subscrito p é igual a início de fração, numerador: abre parênteses p início subscrito, N subscrito 2 O subscrito 4, fim subscrito fecha parênteses, denominador: abre parênteses p início subscrito, N O subscrito 2, fim subscrito fecha parênteses elevado ao quadrado, fim de fração implica em 'K' subscrito p é igual a início de fração, numerador: abre parênteses 1 vírgula 2 fecha parênteses, denominador: abre parênteses 1 vírgula 5 fecha parênteses elevado ao quadrado, fim de fração implica em 'K' subscrito p é igual a início de fração, numerador: 1 vírgula 2, denominador: 2 vírgula 25, fim de fração portanto 'K' subscrito p é aproximadamente igual a 0 vírgula 53
Página 349
CAPÍTULO19
Equilíbrio iônico e p H
Definições ácido-base
Como estudamos no capítulo anterior, a ingestão de alimentos ricos em açúcar associada à higienização bucal inadequada provoca o desgaste do esmalte dentário e a desmineralização dos dentes. No entanto, outros alimentos, além dos doces, podem causar danos aos dentes, como os ácidos.
Os ácidos presentes em alguns alimentos, por exemplo, café, molho de tomate, refrigerante e frutas cítricas (como laranja, limão e tangerina), causam a desmineralização no esmalte dos dentes, que podem ficar amarelados, sensíveis e suscetíveis à formação de cáries.
1. Uma maneira de reduzir os riscos do processo de desmineralização dos dentes em razão do consumo de alimentos ácidos é ingeri-los com alimentos que não sejam ácidos. Em sua opinião, por que é feita essa recomendação?
Resposta: Essa recomendação é feita porque o alimento ácido pode ser neutralizado ou diluído pelo alimento não ácido.
O gráfico a seguir mostra a quantidade média de dentes afetados pela cárie, obturados e extraídos ao longo do tempo em crianças brasileiras.
Índice de cárie, extração e obturação de dente em crianças brasileiras de 12 anos, de 1986 a 2022
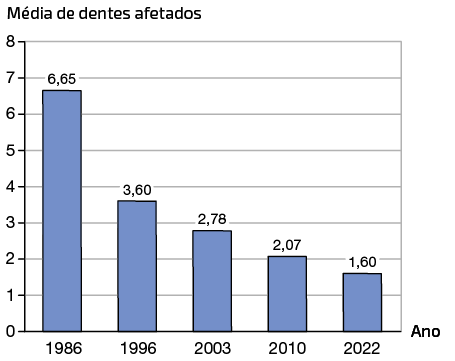
Fontes de pesquisa: BRASIL. Ministério da Saúde. A saúde bucal no Sistema Único de Saúde. Brasília, 2018. Disponível em: https://s.livro.pro/v0hayd.
BRASIL. Ministério da Saúde. Pesquisa Nacional de Saúde Bucal: vigência 2021-2022. Disponível em: https://s.livro.pro/nfxtfz. Acessos em: 5 set. 2024.
Professor, professora: Os dados de 2022 são referentes até o mês de novembro do referido ano.
2. O que você observou ao analisar o gráfico? Em sua opinião, o que justifica os resultados observados?
Resposta nas Orientações para o professor.
3. Você costuma ingerir muitos alimentos ácidos? Em sua opinião, o que define a acidez de uma substância?
Resposta pessoal. Espera-se que os estudantes realizem uma autoavaliação de sua alimentação referente ao consumo de alimentos ácidos e sua relação com o processo de desmineralização dos dentes. Essa questão também os incentiva a expor seus conhecimentos prévios sobre o conceito de ácidos. Muitos podem responder com base no sabor azedo característico de alimentos ácidos, no entanto esclareça que essa é uma característica, mas não pode ser aplicada para identificar esses compostos porque não é seguro provar substâncias desconhecidas. Além disso, há diferentes definições para os ácidos.
A Química, desde sua origem, busca teorias e modelos que expliquem os comportamentos das substâncias.
Entre as teorias mais difundidas para classificar ácidos e bases, tem-se a proposta pelo químico sueco Svante August Arrhenius (1859-1927). Segundo sua definição, temos que:
Ácido é o componente que, em água abre parênteses H subscrito 2 O fecha parênteses, apresenta capacidade de liberar o cátion hidrogênio abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses e formar o cátion oxônio ou hidrônio abre parênteses H subscrito 3 O elevado a início expoente, mais, fim expoente fecha parênteses.
Os ácidos são substâncias que sofrem ionização em solução aquosa. Podemos representar a ionização de um ácido apenas com a liberação do cátion hidrogênio (I) ou com a formação do cátion hidrônio (II):
I. H C l abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
II. H C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Base é o componente que, em água, apresenta capacidade de liberar ânion hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses.
As bases são substâncias iônicas e sofrem dissociação iônica ao serem dissolvidas em água: N a O H abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima N a elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Página 350
A definição de ácido e base de Arrhenius é limitada, pois é restrita à classificação de soluções aquosas.
Para suprir essa limitação, dois físico-químicos, o dinamarquês Johannes Nicolaus Brønsted (1879-1947) e o inglês Thomas Martin Lowry (1874-1936), propuseram uma definição mais geral de ácidos e bases.

Ácido é toda espécie química (molécula ou íon) capaz de ceder prótons H sobrescrito mais em uma reação. Confira a reação a seguir.
H C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
O cloreto de hidrogênio abre parênteses H C l fecha parênteses cede um próton H elevado a início expoente, mais, fim expoente para a água, transformando-se no íon cloreto abre parênteses C l elevado a início expoente, menos, fim expoente fecha parênteses. No exemplo a seguir, o íon amônio abre parênteses N H subscrito 4 elevado a início expoente, mais, fim expoente fecha parênteses é um ácido de Brønsted-Lowry.
N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 3 abre parênteses a q fecha parênteses mais H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
Base é toda espécie química (molécula ou íon) capaz de receber prótons H sobrescrito mais em uma reação. Observe a reação a seguir, em que a amônia abre parênteses N H subscrito 3 fecha parênteses se comporta como uma base.
N H subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Todas as reações apresentadas anteriormente são reversíveis. Analisando a reação a seguir, podemos verificar que, para a reação inversa, o íon H subscrito 3 O elevado a início expoente, mais, fim expoente é um ácido de Brønsted-Lowry, pois cede um próton H sobrescrito mais.
H C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Na reação direta, o H C l cede um próton H sobrescrito mais para a água. Na reação inversa, o H subscrito 3 O elevado a início expoente, mais, fim expoente cede um próton H sobrescrito mais para o C l elevado a início expoente, menos, fim expoente. Portanto, o H subscrito 2 O e o C l elevado a início expoente, menos, fim expoente são bases de Brønsted-Lowry. Considerando as reações direta e inversa, temos:
H C l ácido abre parênteses a q fecha parênteses mais H subscrito 2 O base abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente ácido abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente base abre parênteses a q fecha parênteses
Dizemos que os pares H C l barra C l elevado a início expoente, menos, fim expoente e H subscrito 3 O elevado a início expoente, mais, fim expoente barra H subscrito 2 O são dois pares conjugados ácido-base. Na definição de ácido-base de Brønsted-Lowry, um par conjugado ácido-base é formado por duas espécies químicas que diferem entre si por um H sobrescrito mais.
Professor, professora: Mostre como são formados os pares conjugados ácido-base. Mencione que os produtos formados sempre são mais fracos do que os reagentes.
Quando um ácido tem grande tendência de liberar H elevado a início expoente, mais, fim expoente, ele é considerado forte. Por exemplo, na reação anterior, o H C l apresenta grande tendência para liberar o H elevado a início expoente, mais, fim expoente. Assim, a reação direta tende a ocorrer com mais velocidade até que se atinja o equilíbrio, que resulta em uma concentração maior de produtos do que de reagentes. Então, podemos concluir que o C l elevado a início expoente, menos, fim expoente tem pouca tendência de receber o H elevado a início expoente, mais, fim expoente de volta, o que nos leva a constatar que, se o ácido é forte, sua base conjugada é fraca, e vice-versa.
Essa definição, aliada ao conceito de ácidos e bases conjugados, mostra que a ideia de caráter ácido-base é relativa. Uma substância pode agir como ácido em relação a outra em uma reação, mas funcionar como base em relação a uma terceira substância.
É o caso, por exemplo, da água. Confira as reações a seguir.
I. H C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
II. N H subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Na reação (I), a água recebe um próton H elevado a início expoente, mais, fim expoente do H C l. Portanto, trata-se de uma base.
Na reação (II), ela cede um próton H sobrescrito mais para o N H subscrito 3. Nesse caso, comporta-se como um ácido.
As substâncias que apresentam esse comportamento são chamadas de anfipróticas.
Dica
Podemos dizer que a reação do tipo ácido-base sempre ocorre no sentido de formar outro ácido e outra base, mais fracos que os iniciais.
Página 351
Constante de ionização da água: p H e p O H
4. Você já comeu uma banana nas mesmas condições que as mostradas na fotografia a seguir? Em caso afirmativo, que sensação você teve?
Imagens desta página sem proporção e em cores fantasia.

Resposta pessoal. O objetivo desta questão é incentivar os estudantes a compartilhar suas vivências com relação ao conteúdo a ser trabalhado.
Alguns alimentos, como as bananas e os caquis, quando não estão maduros, têm um sabor adstringente, conhecido como a sensação de "amarrar a boca", diminuindo a salivação. O sabor adstringente, percebido pelo paladar, é uma característica das bases.
Durante um tempo, foi utilizado o teste do sabor para classificar os materiais em ácido ou base, o que possibilitou verificar que as bases são substâncias que tendem a apresentar sabor adstringente, e os ácidos, sabor azedo. Esse critério, no entanto, está em desuso, pois muitos ácidos e bases são tóxicos ou corrosivos e devem ser manipulados em conformidade com normas de segurança.
Medir a acidez ou a basicidade de um meio pode ser de extrema importância. Os exemplos mais próximos do nosso dia a dia são o controle da qualidade da água em piscinas e em tanques destinados à criação de peixes e o controle da acidez do solo, que influi diretamente na produção agrícola. É possível fazer essa verificação com a escala de p H para medir a acidez, a basicidade ou a neutralidade de um meio.
Professor, professora: Explique que, embora o sabor seja um indicativo do caráter ácido ou básico de uma substância, nunca devemos fazer esse teste com substâncias desconhecidas a fim de evitar intoxicação ou danos em tecidos do corpo.
Em qualquer sistema aquoso, parte das moléculas da água se ioniza. Esse sistema em equilíbrio pode ser representado por:
H subscrito 2 O abre parênteses l fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Esse sistema também pode ser descrito, de maneira simplificada, pela seguinte equação química reversível:
H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Para esse sistema em equilíbrio, podemos escrever sua constante de equilíbrio iônico abre parênteses 'K' subscrito i fecha parênteses.
'K' subscrito i é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes H subscrito 2 O fecha colchetes, fim de fração
Sabendo que a concentração da água líquida é constante, o valor de abre colchetes H subscrito 2 O fecha colchetes será englobado pela constante. A constante de equilíbrio iônico da água, ou produto iônico da água, é denominada 'K' subscrito w.
'K' subscrito i vezes abre colchetes H subscrito 2 O fecha colchetes é igual a abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes OH elevado a início expoente, menos, fim expoente fecha colchetes
'K' subscrito w é igual a abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes
Em um copo com água, há um equilíbrio dinâmico em que suas moléculas estão se ionizando e produzindo íons H subscrito 3 O elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente, enquanto outros íons H subscrito 3 O elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente se juntam para formar moléculas de água.

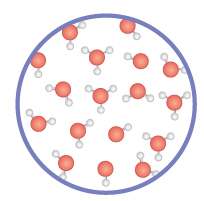
Página 352
Experimentalmente, em 1 litro de água a 25 graus Celsius, 1 vírgula 0 vezes 10 elevado a menos 7 mol de moléculas se ionizam, produzindo íons H sobrescrito mais e O H elevado a início expoente, menos, fim expoente. Considerando que nessas condições físicas a densidade da água líquida seja igual a 1 vírgula 0 grama por mililitro, 1 litro dessa substância apresentará massa igual a 1.000 gramas.
A massa molar da água é igual a 18 gramas por mol. Portanto, para 1.000 gramas de água, temos:
n é igual a 'm' sobre M implica em n é igual a início de fração, numerador: 1.000 gramas, denominador: 18 gramas barra mol, fim de fração é aproximadamente igual a 55 vírgula 6 mol
A concentração de moléculas de água é de aproximadamente 55 vírgula 6 mol por litro. Como apenas 1 vírgula 0 vezes 10 elevado a menos 7 mol de moléculas se ionizam, isso equivale a dizer que, para cada 556 000 000 moléculas de água, apenas uma vai se autoionizar, pois o grau de ionização da água pura é extremamente baixo.
Usando as concentrações dos íons H elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente, podemos calcular o produto iônico da água abre parênteses 'K' subscrito w fecha parênteses para 1.000 gramas abre parênteses 1 quilograma fecha parênteses de água:
'K' subscrito w é igual a abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes
'K' subscrito w é igual a abre parênteses 1 vírgula 0 vezes 10 elevado a menos 7 fecha parênteses vezes abre parênteses 1 vírgula 0 vezes 10 elevado a menos 7 fecha parênteses
'K' subscrito w é igual a 1 vírgula 0 vezes 10 elevado a menos 14
Professor, professora: Ressalte o quanto são pequenas as concentrações dos íons, reproduzindo na lousa os cálculos do início desta página. Calcule o valor do e mostre como ele varia com a temperatura. Explique aos estudantes que todas as situações do livro envolvem o 'K' subscrito w a 25 graus Celsius.
Dica
Note que o valor de 'K' subscrito w foi obtido para a temperatura de 25 graus Celsius. Assim como acontece com todas as constantes de equilíbrio, o 'K' subscrito w varia com a temperatura. Neste capítulo, faremos todos os cálculos relacionados ao produto iônico da água para o seu valor a 25 graus Celsius.
Em determinado meio, as concentrações dos íons H elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente definem se ele é ácido, básico ou neutro de acordo com as relações mostradas no quadro a seguir.
| Caráter | Relação |
|---|---|
|
Ácido |
abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é maior do que abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes |
|
Neutro |
abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes |
|
Básico |
abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é menor do que abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes |
Ao adicionar, por exemplo, H C l à água pura, esse ácido se ioniza:
H C l abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
O aumento na quantidade de íons H sobrescrito mais vai alterar o equilíbrio de ionização da água, favorecendo sua formação, pois uma pequena quantidade de íons H sobrescrito mais vai reagir com os íons O H elevado a início expoente, menos, fim expoente de sua autoionização.
H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses aq fecha parênteses
Isso faz que a concentração de íons O H elevado a início expoente, menos, fim expoente seja reduzida até que o produto da concentração de H subscrito 3 O elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente volte a ser igual a 1 vírgula 0 vezes 10 elevado a menos 14.
Vamos considerar, por exemplo, que foi preparada uma solução de H C l com concentração de 10 elevado a menos 3 mol barra litro. Como o H C l é um ácido forte, podemos admitir que ele foi totalmente ionizado e que a concentração de H sobrescrito mais é igual a 10 elevado a menos 3 mol barra litro.
Substituindo esse valor na fórmula do 'K' subscrito w, temos:
'K' subscrito w é igual a abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes
1 vírgula 0 vezes 10 elevado a menos 14 é igual a 1 vírgula 0 vezes 10 elevado a menos 3 vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes
abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 1 vírgula 0 vezes 10 elevado a menos 11 mol por litro
Dica
Lembre-se de que o valor de 'K' subscrito w é constante. Então, quanto maior for a concentração de H C l na água, menor será a concentração de íons O H elevado a início expoente, menos, fim expoente.
De modo análogo, ao adicionar uma base na água, a concentração dos íons H sobrescrito mais diminuirá e a concentração de íons H sobrescrito mais poderá ser calculada.
Página 353
5. Você já ouviu falar em medir o p H da água de piscinas? Por que isso é importante?
Resposta pessoal. O objetivo desta questão é levantar os conhecimentos prévios dos estudantes em relação às aplicações do p H.
Para que os banhos em piscinas sejam agradáveis e seguros, é preciso ter alguns cuidados com a água, como eliminar os resíduos que podem ser vistos a olho nu e fazer o controle de seu p H, para garantir que ela não irrite os olhos e a pele dos banhistas e não danifique os equipamentos da piscina.
De forma geral, para fazer essa análise, utiliza-se um estojo que, além de possibilitar a leitura da quantidade de cloro abre parênteses C l fecha parênteses na água, indica seu p H.

Quando a água está ácida, é necessário adicionar um material que tem como componente principal o carbonato de sódio abre parênteses N a subscrito 2 C O subscrito 3 fecha parênteses, aumentando o p H dela. Quando ela está alcalina, adiciona-se um material que seja ácido. Nesse caso, usa-se o ácido clorídrico (solução aquosa de cloreto de hidrogênio), diminuindo o p H e evitando que a água se torne turva.
Os estudos sobre p H iniciaram-se com o químico dinamarquês Søren Peter Lauritz Sørensen (1868-1939). Sua ideia era trabalhar apenas com o expoente de base 10 e com valores positivos. Assim, ele definiu que, para expressarmos o potencial hidrogeniônico abre parênteses p H fecha parênteses e o potencial hidroxiliônico abre parênteses p O H fecha parênteses de uma solução, devemos usar:
- p H é igual a menos log abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes
- p O H é igual a menos log abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes
Sabemos que, para um meio neutro, como a água pura à temperatura de 25 graus Celsius, abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 1 vírgula 0 vezes 10 elevado a menos 7 mol por litro. Portanto, temos:
- p H é igual a menos log abre parênteses 10 elevado a menos 7 fecha parênteses portanto p H é igual a 7
- p O H é igual a menos log abre parênteses 10 elevado a menos 7 fecha parênteses portanto p O H é igual a 7
Dica
As soluções ácidas a 25 graus Celsius apresentam abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é maior do que 1 vírgula 0 vezes 10 elevado a menos 7 mol por litro. Portanto, essas soluções têm p H é menor do que 7.
As soluções básicas a 25 graus Celsius apresentam abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é menor do que 1 vírgula 0 vezes 10 elevado a menos 7 mol por litro. Portanto, essas soluções têm p H é maior do que 7.
Para qualquer solução a 25 graus Celsius, também são válidas as relações:
abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 1 vírgula 0 vezes 10 elevado a menos 14
p H mais p O H é igual a 14
A seguir, são apresentados os valores de concentrações, em quantidade de matéria, de íons H sobrescrito mais e de O H elevado a início expoente, menos, fim expoente, com seus respectivos p H e p O H a 25 graus Celsius. Quanto menor o valor do p H, mais ácida é a solução.

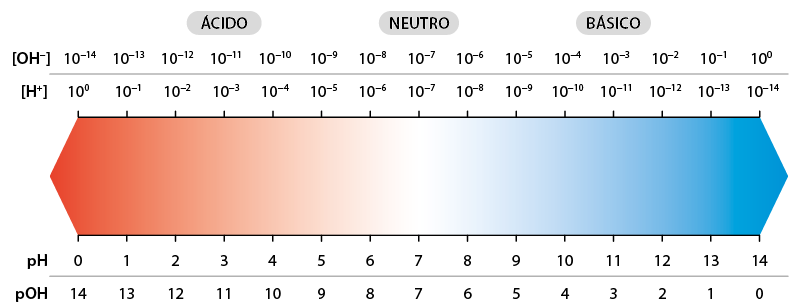
Página 354
Métodos de determinação de p H
A medida do p H de uma solução aquosa pode ser feita com o auxílio de um aparelho chamado peagômetro ou de um indicador ácido-base.
O peagômetro mede a diferença de potencial elétrico existente em uma solução e tem uma escala graduada em valores de p H.
Os indicadores ácido-base são materiais que mudam de cor conforme o p H da solução. Alguns vegetais têm a propriedade de mudar de cor em contato com ácidos ou bases. Um exemplo é o extrato do repolho-roxo.
Os indicadores utilizados em indústrias e laboratórios são compostos orgânicos que apresentam caráter de ácido fraco ou de base fraca. Confira as características e os usos de alguns deles.
Papel indicador universal e papel de tornassol
O papel indicador universal pode adquirir várias cores. Ao mergulhá-lo em uma solução a ser testada, ele adquire uma cor, que é comparada com uma escala colorida de referência, permitindo estimar o p H. O indicador universal é obtido por meio da mistura apropriada de vários indicadores ácido-base.
O papel de tornassol é poroso e impregnado de tornassol, indicador solúvel em água extraído de algumas espécies de liquens. Ele pode ser azul, vermelho ou neutro. E ao contrário do indicador universal, esse papel não permite que seja estimado o valor do p H da solução testada, ele apenas indica se ela é ácida ou básica. Pode-se utilizá-lo colocando-o diretamente na solução ou pingando gotas da solução sobre ele.


O papel de tornassol neutro adquire cor vermelha em contato com soluções ácidas e cor azul em contato com soluções básicas. O papel de tornassol vermelho adquire a cor azul em contato com uma solução básica. E o papel de tornassol azul adquire a cor vermelha em contato com uma solução ácida.
Soluções indicadoras
As soluções indicadoras têm a propriedade de mudar de coloração em função do p H do meio. O intervalo de valores na escala de p H em que ocorre a mudança de cor da solução indicadora é chamada faixa de viragem (ou intervalo de viragem). Confira na tabela Faixa de viragem de algumas soluções.
| Solução indicadora | Faixa de viragem de p H |
|---|---|
|
Fenolftaleína |
8,0 a 10,0 |
|
Tornassol |
5,0 a 8,0 |
|
Alaranjado de metila |
3,2 a 4,4 |
Fonte de pesquisa: BURROWS, Andrew et al. Chemistry3: introducing inorganic, organic and physical chemistry. 3. ed. Inglaterra: Oxford University Press, 2017. p. 328.
Essa faixa de viragem determina o tipo de solução para o qual esse indicador pode ser usado. A fenolftaleína, por exemplo, é incolor para p H abaixo de 8,0 e começa a adquirir coloração rosa a partir desse p H. Portanto, se ela ficar com a cor rosa, temos a garantia de que a solução é básica. No entanto, se ela permanecer incolor, não é possível identificar se a solução é ácida, básica ou neutra. O mesmo pode ser dito dos outros dois indicadores citados, de acordo com as suas faixas de viragem.
Página 355
ATIVIDADES
1. Acidulante é um tipo de aditivo alimentar que ajuda a regular a doçura do açúcar, realçar o paladar e diminuir o p H na faixa de 2,7 a 3,5 de bebidas gaseificadas. Um acidulante bem conhecido é o ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 fecha parênteses, e a ionização de um dos átomos de hidrogênio de sua estrutura ocorre assim:
H subscrito 3 P O subscrito 4 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 2 P O subscrito 4 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
Considerando as definições de ácido e base dadas por Arrhenius e por Brønsted-Lowry, qual das afirmações a seguir está correta?
a ) Na definição de Arrhenius, a ionização do ácido fosfórico produz gás hidrogênio.
b ) Na definição de Arrhenius, a ionização do ácido fosfórico produz íon hidrônio.
c ) Na definição de Brønsted-Lowry, é o ácido fosfórico que recebe próton H sobrescrito mais.
d ) Na definição de Brønsted-Lowry, é a água que doa o próton H sobrescrito mais.
Resposta: Alternativa b.
2. O café tem vários compostos ácidos que podem influenciar no sabor, e o teor desses compostos pode variar de acordo com as condições de cultivos dos grãos até o preparo. Ao analisar determinada amostra de uma mistura aquosa de café, um profissional concluiu que a concentração de íon hidrônio é 10 mi mol por litro. Assim, qual é o valor do p H dessa amostra de café?
3. Analise o gráfico a seguir. Depois, responda às questões propostas.
Faixa aproximada de p H de crescimento de alguns microrganismos encontrados em alimentos
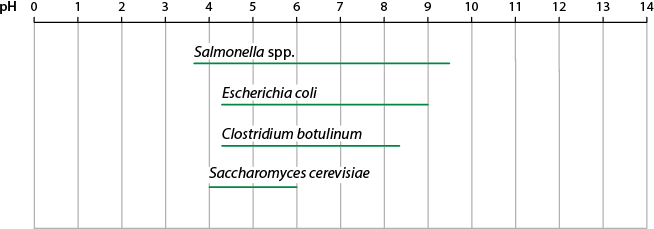
Fonte de pesquisa: NESPOLO, Cássia Regina et al. Práticas em tecnologias de alimentos. Porto Alegre: Artmed, 2015. p. 54.
a ) Os microrganismos mencionados no gráfico são prejudiciais ou benéficos por estarem em nossa alimentação? Caso necessário, faça uma pesquisa.
b ) Qual faixa de acidez é mais indicada em alimentos para que não haja a propagação desses microrganismos prejudiciais?
c ) Como aumentar a acidez de um alimento? Cite exemplos de alimentos para tal situação.
d ) No gráfico, é mostrada a correlação do p H com o crescimento de microrganismos. Existe a correlação de p H com a conservação de alimentos? Justifique sua resposta.
Respostas das questões 2 e 3 nas Orientações para o professor.
4. A tabela a seguir apresenta a faixa de viragem de p H para alguns indicadores.
| Solução indicadora | Faixa de viragem de p H | Mudanças da coloração |
|---|---|---|
|
Fenolftaleína |
8,0 a 10,0 |
Incolor para rosa |
|
Azul de bromotimol |
6,0 a 7,0 |
Amarelo para azul |
|
Alaranjado de metila |
3,2 a 4,4 |
Vermelho para amarelo |
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 719.
a ) Quais são as colorações obtidas por uma solução de concentração de O H elevado a início expoente, menos, fim expoente é igual a 10 elevado a menos 8 se ela for adicionada a cada um dos indicadores indicados na tabela?
Resposta: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 1 vírgula 0 vezes 10 elevado a menos 14 implica em abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes 10 elevado a menos 8 é igual a 1 vírgula 0 vezes 10 elevado a menos 14 implica em abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a 10 elevado a menos 6 p H é igual a menos log abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a menos log abre colchetes 10 elevado a menos 6 fecha colchetes é igual a 6 portanto p H é igual a 6 Nesse p H a solução com fenolftaleína fica incolor; a solução com azul de bromotimol fica amarela; e a solução com alaranjado de metila, amarela.
b ) Qual é o caráter de uma solução que em fenolftaleína apresenta-se incolor; em alaranjado de metila apresenta coloração amarela; e em azul de bromotimol apresenta coloração azul?
Resposta: Trata-se de uma solução com p H entre 7 e 8, portanto o caráter pode ser neutro ou levemente básico.
Página 356
Constantes de ionização e de dissociação
Anteriormente, estudamos que na reação química de ionização ocorre a formação de íons que não existiam no início da reação, como no exemplo A destacado a seguir, com a formação de íons positivos e negativos por meio do cloreto de hidrogênio em solução aquosa.
Imagens desta página sem proporção e em cores fantasia.
Ao adicionar ácido clorídrico em água, ocorre a ionização desse composto molecular, pois há uma atração elétrica entre os polos positivo e negativo do ácido com os da molécula de água, formando cátions H subscrito 3 O elevado a início expoente, mais, fim expoente e ânions C l elevado a início expoente, menos, fim expoente.
Imagens elaboradas com base em: CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Porto Alegre: AMGH, 2013. p. 676.
Já nas reações químicas de dissociação iônica, os íons existentes se separam, como no exemplo B, com o N a elevado a início expoente, mais, fim expoente e o C l elevado a início expoente, menos, fim expoente obtidos a partir do cloreto de sódio abre parênteses N a C l fecha parênteses em água.


Ao solubilizar cloreto de sódio em água, ocorre a dissociação iônica, pois seus íons são separados pela atração elétrica com os polos da água.
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 127.
As soluções que apresentam íons livres, sejam eles produto da ionização ou da dissociação iônica do soluto, têm seus equilíbrios denominados equilíbrios iônicos.
Considere duas soluções aquosas em equilíbrio químico, sendo uma delas um ácido genérico H A abre parênteses a q fecha parênteses que se ioniza, enquanto a outra é uma base genérica B O H abre parênteses a q fecha parênteses que se dissocia. As reações de ionização e dissociação e suas respectivas constantes de equilíbrio são representadas por:
H A abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais A elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
'K' subscrito a é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes A elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes H A fecha colchetes, fim de fração
B O H abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas B elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
'K' subscrito b é igual a início de fração, numerador: abre colchetes B elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes B O H fecha colchetes, fim de fração
Assim como em 'K' subscrito c, os valores de 'K' subscrito a e 'K' subscrito b variam com a temperatura.
Quando os valores numéricos de 'K' subscrito a e 'K' subscrito b são altos, o numerador da fração é muito maior do que o denominador. Podemos concluir, então, que a dissociação ou ionização também é alta. De modo análogo, quando os valores numéricos de 'K' subscrito a e 'K' subscrito b são baixos, o numerador da fração é muito menor do que o denominador, e constatamos que a dissociação ou ionização é baixa.
Página 357
O grau de ionização abre parênteses alfa fecha parênteses de um eletrólito (ácidos e bases, por exemplo) é definido como:
alfa é igual a início de fração, numerador: Quantidade de matéria dissociados ou ionizados, denominador: Quantidade inicial de matéria, fim de fração
A força desses eletrólitos é diretamente proporcional ao seu grau de ionização ou grau de dissociação. Ácidos e bases fortes apresentam alto grau de ionização e de dissociação. Confira os exemplos na tabela a seguir.
| Ácido | K subscrito a | alfa | Força |
|---|---|---|---|
|
H C l |
1 vírgula 0 vezes 10 elevado a 7 |
0,99 |
Forte |
|
H C N |
7 vírgula 9 vezes 10 elevado a menos 10 |
0,00009 |
Fraco |
Fonte de pesquisa: BRUICE, Paula Yurkanis. Organic Chemistry. 8. ed. NJ: Pearson Education, 2015. p. 1.241-1.242.
Em 1909, o filósofo e químico russo Friedrich Wilhelm Ostwald (1853-1932) recebeu o Prêmio Nobel de Química por inúmeros trabalhos sobre catálise e equilíbrios químicos iônicos, entre eles a dedução atualmente conhecida como lei da diluição de Ostwald.
Segundo essa lei, a uma dada temperatura, ao diminuir a concentração em quantidade de matéria de um eletrólito, seu grau de ionização (ou de dissociação) alfa aumenta.
Professor, professora: Explique que as constantes também variam com a temperatura. Em conjunto com os estudantes, interprete o que representam valores altos ou baixos para essas constantes por meio da análise das expressões matemáticas.
Ostwald deduziu a seguinte relação entre a constante e o grau de ionização (ou dissociação) de um monoácido✚ ou uma monobase✚:
'K' subscrito a é igual a início de fração, numerador: M vezes alfa elevado ao quadrado, denominador: 1 menos alfa, fim de fração ou 'K' subscrito b é igual a início de fração, numerador: M vezes alfa elevado ao quadrado, denominador: 1 menos alfa, fim de fração
em que M é a concentração inicial do eletrólito em mol por litro.
Para eletrólitos muito fracos abre parênteses alfa é menor do que 0 vírgula 0 5 fecha parênteses, podemos admitir que o denominador abre parênteses 1 menos alfa fecha parênteses tem valor muito próximo a 1. Dessa forma, a equação pode ser simplificada, obtendo-se:
'K' subscrito a é igual a M vezes alfa elevado ao quadrado ou 'K' subscrito b é igual a M vezes alfa elevado ao quadrado
Considerando que os valores de 'K' subscrito a e 'K' subscrito b variam apenas com a temperatura, concluímos que M e alfa são inversamente proporcionais. Portanto, quanto mais diluída for a solução, maior será seu grau de ionização.
Professor, professora: Apresente o grau de ionização do ácido etanoico em função da concentração da solução. Mostre que a diluição da solução provoca um aumento no grau de ionização. Explique a interpretação da lei da diluição de Ostwald baseada na teoria das colisões, dizendo que um ácido diluído tem mais moléculas de solvente próximas a ele, portanto a interação mais frequente é entre moléculas de ácido com moléculas de solvente.
Confira no quadro a seguir o grau de ionização do ácido etanoico abre parênteses C H subscrito 3 C O O H fecha parênteses no equilíbrio.
C H subscrito 3 C O O H abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C H subscrito 3 C O O elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
| Concentração abre parênteses mol por litro fecha parênteses | alfa abre parênteses 25 graus Celsius fecha parênteses |
|---|---|
|
0,1 |
0,0135 |
|
0,01 |
0,0430 |
|
0,001 |
0,1240 |
|
0,0001 |
0,3350 |
Além da explicação baseada na fórmula simplificada, podemos explicar a lei da diluição de Ostwald por meio da teoria das colisões. Em soluções muito diluídas, a probabilidade de os íons positivos e negativos colidirem para formar a substância inicial é muito pequena. Portanto, a reação inversa é cada vez menos provável, predominando a ocorrência da reação direta.
Página 358
CONEXÕES com ... BIOLOGIA
O ácido cianídrico e a farinha de mandioca
A mandioca, aipim ou macaxera é um alimento de grande valor nutricional e desempenha um papel central na dieta de muitas populações na América do Sul, especialmente nas regiões Norte e Nordeste do Brasil, e povos originários de outros países. Os povos indígenas da América do Sul têm uma longa história de utilização da mandioca como alimento básico em sua dieta. O processamento dessa planta tuberosa desempenha um papel central na cultura e na subsistência desses grupos, sendo cultivada, processada e consumida de diversas formas.
O resultado desse processamento é a farinha de mandioca, um alimento básico e versátil na dieta desses povos. Ela pode ser utilizada para a produção de diversos pratos, como o beiju (uma espécie de pão achatado), o tucupi (um molho) e o mingau.
No entanto, a mandioca é um exemplo clássico de como um alimento pode ser tanto nutritivo quanto potencialmente tóxico, dependendo de como é preparado. Isso ocorre em razão da presença do ácido cianídrico abre parênteses H C N fecha parênteses em algumas espécies de mandioca, particularmente na variedade conhecida como mandioca-brava.

O ácido cianídrico é altamente tóxico, podendo causar sérios danos à saúde se a mandioca não for preparada corretamente. Você acha que a toxicidade desse ácido está relacionada à sua força ácida? Para responder a essa pergunta, é essencial entender o conceito de acidez e força de um ácido, além de compreender as características específicas desse composto.
O ácido cianídrico é considerado um ácido fraco, assim como o ácido acético (presente no vinagre) e o ácido cítrico (encontrado em frutas cítricas). Como visto, a força de um ácido pode ser avaliada pela sua constante de ionização ácida abre parênteses 'K' subscrito a fecha parênteses e pelo grau de ionização. Para o ácido cianídrico, a constante é de aproximadamente 6 vírgula 2 vezes 10 elevado a menos 10, indicando que ele se ioniza muito pouco em solução aquosa. O ácido acético, por sua vez, tem um 'K' subscrito a de 1 vírgula 8 vezes 10 elevado a menos 5 vírgula sendo também um ácido fraco, mas ainda mais forte que o ácido cianídrico. Logo, a toxicidade do ácido cianídrico não ocorre em razão de sua força ácida, mas sim de outro fator.
A toxicidade do ácido cianídrico está relacionada à sua capacidade de liberar cianeto abre parênteses C N elevado a início expoente, menos, fim expoente fecha parênteses no corpo humano. O cianeto é altamente reativo e interfere no transporte de oxigênio pelo sangue. Ele se liga de maneira irreversível ao ferro presente na hemoglobina, resultando em uma rápida asfixia celular, o que pode ser fatal em casos de intoxicação aguda.
O cianeto é encontrado em várias plantas além da mandioca, como sorgo, sementes de maçã, amêndoas amargas, feijão-de-lima e brotos de bambu. Essas plantas contêm glicosídeos cianogênicos, compostos que liberam cianeto quando metabolizados, servindo como mecanismo de defesa contra predadores como animais e insetos que possam querer se alimentar dela. Portanto, é essencial preparar esses alimentos corretamente para evitar intoxicação.
A remoção do ácido cianídrico da mandioca é possível, por exemplo os métodos tradicionais de preparo, utilizados há séculos pelos povos indígenas. Esses métodos envolvem várias etapas que facilitam a eliminação do ácido cianídrico, garantindo que a mandioca possa ser consumida com segurança.
Página 359
A primeira etapa ocorre logo após a colheita da mandioca, quando as raízes são mantidas durante uma noite ou alguns dias em um riacho. Esse processo induz uma fermentação natural, que começa a liberar ácido cianídrico. Durante a fermentação, o meio se torna ácido, deslocando o equilíbrio de ionização do ácido cianídrico em direção à sua forma não ionizada, que é mais volátil e, portanto, mais fácil de remover.
Após essa etapa inicial, as raízes são descascadas e raladas. Durante a remoção das cascas, ainda pode haver liberação de ácido cianídrico, especialmente nas camadas mais externas da raiz. A prensagem da raiz ralada é a próxima etapa crítica, onde o sumo que contém ácido cianídrico é separado e, posteriormente, descartado, eliminando uma parte significativa desse ácido.
Finalmente, a secagem da mandioca completa o processo. Durante a secagem, o calor faz que o ácido cianídrico restante evapore. O resultado é um alimento seguro para consumo, livre da toxicidade original.
Esse processo elaborado de preparo demonstra o conhecimento que os povos indígenas desenvolveram ao longo de gerações, utilizando técnicas precisas para transformar um alimento tóxico em uma fonte segura e nutritiva de energia.

Caso, acidentalmente, alguém consuma uma planta que ainda contém a substância, deve-se ficar atento para os principais sintomas que a intoxicação por cianeto pode causar:
- dor de cabeça;
- vertigem;
- diminuição da coordenação motora;
- arritmia cardíaca (falta de ritmo nos batimentos do coração);
- bradicardia (batimentos cardíacos mais lentos do que o esperado, geralmente abaixo de 60 batimentos por minuto);
- fraqueza.
A procura por atendimento médico rápido é essencial para reverter os efeitos do envenenamento por cianeto.
a ) Você já provou alimentos produzidos com mandioca? Comente com os colegas.
b ) Explique como o conhecimento tradicional dos povos indígenas contribuiu para o uso seguro da mandioca na alimentação. Quais são as etapas do processo de preparo que ajudam a eliminar o ácido cianídrico da mandioca?
c ) O ácido cianídrico presente na mandioca é um ácido fraco. Por que, apesar de ser um ácido fraco, o cianeto liberado é altamente tóxico? Explique o mecanismo pelo qual o cianeto afeta o transporte de oxigênio no corpo humano.
d ) A mandioca é um alimento muito importante para a cultura brasileira. Faça uma pesquisa sobre aspectos nutricionais, culturais e socioeconômicos desse alimento e escreva no caderno o que você descobriu.
Respostas nas Orientações para o professor.
Página 360
Solução-tampão
6. O desempenho de esportistas costuma cair quando precisam competir em altas altitudes. Em sua opinião, por que isso acontece?
Resposta pessoal. O objetivo desta questão é levantar os conhecimentos prévios dos estudantes sobre o assunto.
O funcionamento adequado de nosso organismo depende de diversos fatores, como a temperatura, a quantidade de água, a pressão arterial e o p H. Em nosso corpo, o p H não é o mesmo em todas as partes. No sangue, por exemplo, ele é levemente básico; já no estômago, a acidez é alta por conta da presença do suco gástrico.
No ambiente, à medida que a altitude aumenta, a pressão atmosférica diminui e menos moléculas de gás oxigênio abre parênteses O subscrito 2 fecha parênteses ficam disponíveis no ar, tornando-o mais rarefeito. Essa diminuição afeta o corpo humano de muitas maneiras, por exemplo, aumentando a frequência e a profundidade ao respirar, alterando o equilíbrio entre gases nos pulmões e elevando o p H sanguíneo. Por isso, para evitar queda de desempenho, os atletas se preparam em locais apropriados antes de disputar competições em lugares altos.
O aumento do p H do sangue leva a um distúrbio chamado alcalose. Já a diminuição do p H é conhecida como acidose. Ambas as condições podem ser de ordem respiratória ou metabólica.

A alcalose respiratória pode ser causada pelo ar rarefeito. Nessa situação, a maioria das pessoas se adapta depois de alguns dias. Já a alcalose metabólica surge em razão de um excesso de íons hidrogenocarbonato abre parênteses H C O subscrito 3 elevado a início expoente, menos, fim expoente fecha parênteses na corrente sanguínea, que ocorre quando o corpo perde íons sódio abre parênteses N a elevado a início expoente, mais, fim expoente fecha parênteses ou íons potássio abre parênteses K elevado a início expoente, mais, fim expoente fecha parênteses em demasia, afetando a capacidade renal de controle do equilíbrio ácido-base do sangue.
A acidose respiratória surge quando os pulmões não expelem o dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses de forma adequada. Esse problema pode ocorrer em pacientes com distúrbios que afetam gravemente os pulmões, como pneumonia e asma. Já a acidose metabólica pode ser causada por um metabolismo anormal, por exemplo, em pessoas com o diabetes do tipo 1. Nesse caso, o corpo produz ácido em excesso quando os níveis de açúcar estão fora de controle. Além disso, esse tipo de acidose pode ocorrer quando se perdem íons hidrogenocarbonato em razão de um quadro de diarreia.
Até mesmo a produção de quantidades normais de ácido no organismo pode causar acidose quando os rins não estão funcionando de maneira adequada, e, consequentemente, eles não conseguem excretar uma quantidade suficiente de ácido na urina.
Para manter o p H adequado, o corpo humano tem uma série de mecanismos de controle. Os processos metabólicos atuam para manter o p H do sangue na faixa de 7,35 a 7,45. Para isso, existem substâncias que se encontram em equilíbrio químico, formando um sistema-tampão, isto é, uma solução que resiste a grandes variações de p H.
Em geral, uma solução-tampão é constituída por um ácido fraco e um sal solúvel com mesmo ânion desse ácido ou por uma base fraca e um sal solúvel com mesmo cátion dessa base.
Dica
A solução-tampão não tem seu p H alterado significativamente pela adição de pequenas quantidades de um ácido forte ou de uma base forte.
Página 361
Para entendermos como uma solução-tampão resiste às variações de p H, usaremos como exemplo o tampão formado pelo ácido etanoico, que é um ácido fraco, e o acetato de sódio abre parênteses C H subscrito 3 C O O N a fecha parênteses. Esses compostos têm em comum o ânion acetato abre parênteses C H subscrito 3 C O O elevado a início expoente, menos, fim expoente fecha parênteses.
I. C H subscrito 3 C O O H abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C H subscrito 3 C O O elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
II. C H subscrito 3 C O O N a abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C H subscrito 3 C O O elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais N a elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
O ácido etanoico sofre ionização (I). Por se tratar de um ácido fraco, nessa reação de equilíbrio, a quantidade de reagente é bem maior que a quantidade de produto. Já o acetato de sódio sofre dissociação (II).
Como o acetato de sódio é um sal solúvel, nessa reação de equilíbrio, a quantidade de produtos é muito maior que a de reagente. Portanto, o grande número de íons acetato na solução provoca a alteração do equilíbrio, favorecendo a formação de ácido etanoico na reação (I).
Vamos considerar agora o que acontece com a solução-tampão se for adicionado um ácido forte ou uma base forte.
Efeito da adição de ácido clorídrico (ácido forte)
O ácido clorídrico ioniza quase completamente em água, segundo a reação:
H C l abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
A adição de íons H sobrescrito mais à solução altera o deslocamento do equilíbrio da reação (I), favorecendo a formação de C H subscrito 3 C O O H e consumindo os íons H elevado a início expoente, mais, fim expoente provenientes do H C l e os íons C H subscrito 3 C O O elevado a início expoente, menos, fim expoente liberados na reação (II). O consumo imediato do H sobrescrito mais não provoca grande variação de p H na solução.
A adição sucessiva de pequenas quantidades de H C l alterará continuamente o equilíbrio da reação (I), favorecendo a formação de ácido etanoico e consumindo todo o ânion acetato formado na reação (II), o que cessa o efeito tampão da solução.
Efeito da adição de hidróxido de potássio (base forte)
O hidróxido de potássio abre parênteses K O H fecha parênteses se dissocia quase completamente em água, segundo a reação:
K O H abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Os íons O H elevado a início expoente, menos, fim expoente da base são neutralizados pelos íons H sobrescrito mais provenientes da reação (I):
H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H subscrito 2 O abre parênteses l fecha parênteses
Simultaneamente, a reação (I) terá seu equilíbrio alterado, favorecendo a formação dos produtos, repondo íons H sobrescrito mais e controlando a variação do p H da solução.
A adição sucessiva de pequenas quantidades de K O H alterará continuamente o equilíbrio da reação (I), favorecendo a formação dos produtos até que todo o ácido seja ionizado, cessando o efeito tampão.
Pensando no efeito tampão e no p H sanguíneo, para que as trocas gasosas ocorram normalmente, o sangue atua como um tampão na faixa de p H de 7,35 a 7,45. Um dos sistemas que fazem o tamponamento do sangue é formado pelo ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses e pelo hidrogenocarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses.
Essa reação em equilíbrio é descrita pela equação química simplificada:
C O subscrito 2 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses aq fecha parênteses mais H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Se a respiração se tornar lenta, a eliminação do C O subscrito 2 se torna deficiente, favorecendo a formação dos produtos, o que aumenta a concentração de íons H elevado a início expoente, mais, fim expoente e diminui o p H do sangue. O p H menor do que 7,35 resulta em acidose sanguínea.
Se a respiração se tornar acelerada, ocorre a eliminação de uma quantidade maior de C O subscrito 2, favorecendo a formação dos reagentes, o que diminui a concentração de íons H sobrescrito mais e aumenta o p H sanguíneo. O p H maior do que 7,45 resulta em alcalose sanguínea.
Dica
Em condições normais, o corpo consegue regular o p H sanguíneo com a liberação de íons hidrogenocarbonato feita pelos rins.
Página 362
PRÁTICA CIENTÍFICA
Indicador ácido-base natural
Por dentro do contexto
No nosso corpo, há diversas enzimas que funcionam como catalisadores e têm função de acelerar as reações químicas que mantêm o nosso metabolismo. Mas para que essas enzimas funcionem bem, elas precisam de uma temperatura e de um p H ótimos.
O p H é um parâmetro indispensável em diversas situações, como o desenvolvimento satisfatório de certas plantas. A maioria delas se desenvolve bem em solos de p H alcalino, que, em geral, pode favorecer a disponibilização de nutrientes importantes para seu crescimento, como o cálcio.
Por outro lado, diferenças no p H do solo podem alterar a coloração de determinadas plantas, como é o caso das flores das hortênsias (Hydrangea macrophylla). Em p H mais baixo, suas inflorescências tendem a apresentar uma tonalidade azulada. Em p H mais alto, a cor predominante é rosa.
Hortênsia (H. macrophylla): pode atingir aproximadamente 1 vírgula 83 metro de altura.

Considere que uma pessoa que cultiva hortênsias para venda recebeu uma encomenda de hortênsias na cor rosa. Em sua área cultivada, são encontradas apenas inflorescências azuis.
a ) Indique o que essa pessoa pode fazer para atender à encomenda solicitada.
Resposta: O objetivo desta questão é demonstrar aos estudantes que distinções no p H podem gerar, por vezes, diferenças visíveis e significativas. Espera-se que eles identifiquem, por meio das informações dadas no texto, que as flores azuis aparecem em p H ácido, e as rosas, em p H básico. Isso significa que a mudança de cor deve estar acompanhada da alteração de p H do solo. Nesse caso, a pessoa deve aumentar o pH por meio da adição de alguma substância de caráter básico, como hidróxido de cálcio ou carbonato de cálcio.
Materiais
- 3 beterrabas descascadas e picadas
- água
- liquidificador
- peneira
- 5 copos de 200 mililitros
- vinagre
- bicarbonato de sódio
- sabão em pó
- suco de limão
- caneta permanente
- jarra
- colher de chá
- colher de sopa
- copo medidor
Professor, professora: A fim de ganhar tempo e por segurança, deixe as beterrabas descascadas e picadas antes da prática.
Como proceder
A. Com a caneta, enumere os copos de 1 a 5.
B. Nos copos 1, 4 e 5, acrescente respectivamente o vinagre, o suco de limão e a água.
C. No copo 2, acrescente uma colher de chá de bicarbonato de sódio e 100 mililitros de água e misture até ficar homogêneo. Faça o mesmo preparo de solução para o sabão em pó no copo 3. Deixe os copos organizados sobre uma bancada.
Imagem sem proporção e em cores fantasia.
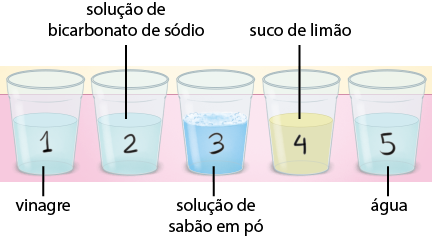
Página 363
D. Para preparar o indicador ácido-base, coloque as beterrabas já picadas no liquidificador e acrescente água até cobri-las. Bata até o líquido ficar homogêneo.
E. Retire o suco do liquidificador, passe-o pela peneira a fim de reter quaisquer partículas maiores e despeje-o na jarra.
Imagens desta página sem proporção e em cores fantasia.

F. Acrescente uma colher de sopa do indicador de beterraba no copo 1 e misture. Observe e anote a cor apresentada.

Cuidado
Ao acrescentar os líquidos nos copos numerados, certifique-se de que um não contamine o outro e limpe a colher depois de terminar a etapa.
G. Repita o procedimento anterior para os outros copos e sempre anote a cor apresentada.
Análise e divulgação
1. Em seu caderno, monte um quadro similar ao modelo a seguir, contendo os materiais testados em uma coluna, a cor registrada em outra coluna e a classificação de cada material.
| Copo | Material | Cor observada | Caráter ácido-base |
|---|---|---|---|
|
1 |
|||
|
2 |
|||
|
3 |
|||
|
4 |
|||
|
5 |
Atividade(s) adaptada(s) acessível(is)
1. Com um colega, anotem quais foram os materiais testados, a cor registrada e a classificação do caráter ácido-base de cada material.
Resposta esperada: Para o vinagre, a cor observada é rosa e ele é classificado como ácido. Para a solução de bicarbonato de sódio, a cor observada é verde e ela é classificada como básica. Para a solução de sabão em pó, a cor observada é verde e ela é classificada como básica. Para o suco de limão, a cor observada é rosa e ele é classificado como ácido. Para a água, a cor observada é rosa e ela é classificada como neutra.
Orientação para acessibilidade
Professor, professora: Organize as duplas de modo que o estudante não vidente esteja acompanhado de um estudante vidente.
2. Cite exemplos de materiais que poderiam substituir o suco de limão e o vinagre nessa prática.
3. Cite exemplos de materiais que poderiam substituir a solução de bicarbonato de sódio e a solução de sabão em pó nessa prática.
4. Quais são as substâncias presentes na solução indicadora responsáveis pelas mudanças de cores observadas no experimento?
5. Cite outras plantas, flores ou frutos que poderiam ser utilizados no preparo de soluções indicadoras naturais de ácido-base.
6. Cite outros recursos que poderiam ser utilizados para medir o p H desses materiais com mais precisão.
7. Considerando que o p H do suco de limão é aproximadamente 4, calcule a concentração de íons H sobrescrito mais presente nesse suco.
8. Considerando que o p H da solução de bicarbonato de sódio é aproximadamente 8, calcule o valor do seu p O H.
9. Produza um infográfico em um cartaz com base nesse experimento. Apresente as mudanças de cores das soluções com indicadores naturais e explique o conceito de p H e sua importância em diversas situações do nosso cotidiano. Insira imagens e textos sucintos de forma organizada. Depois, divulgue esse cartaz no pátio ou na sala de aula conforme as orientações do professor.
Respostas nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
9. Com um colega, produzam um infográfico em um cartaz com base nesse experimento. Apresentem as mudanças de cores das soluções com indicadores naturais e expliquem o conceito de p H e sua importância em diversas situações do cotidiano. Insiram imagens e descrições sucintas de forma organizada. Depois, divulguem esse cartaz no pátio da escola ou na sala de aula.
Resposta pessoal. Espera-se que os estudantes representem no infográfico situações do cotidiano que são influenciadas pelo p H, como a calagem do solo em plantações, a digestão dos alimentos, o alívio de problemas estomacais e os processos industriais na fabricação de alguns produtos. Caso a divulgação seja na sala de aula, oriente a turma sobre o momento e como será feito. Caso seja no pátio, verifique as normas da escola e o local e o momento mais adequados para a divulgação desse cartaz.
Orientação para acessibilidade
Professor, professora: Organize as duplas de modo que o estudante não vidente esteja acompanhado de um estudante vidente. É possível organizar diferentes tarefas para cada um dos estudantes.
Página 364
ATIVIDADES
1. Em um laboratório, estudantes de Farmácia precisavam preparar 1 litro de solução-tampão para utilizar no controle do p H em algumas sínteses de fármacos. Estava disponível no laboratório um frasco de ácido etanoico abre parênteses C H subscrito 3 C O O H fecha parênteses com a concentração de 0 vírgula 3 mol por litro. À solução-tampão foi adicionado também 0 vírgula 3 mol do sal acetato de sódio abre parênteses C H subscrito 3 C O O N a fecha parênteses. Considere a constante de ionização do ácido igual a 1 vírgula 8 vezes 10 elevado a menos 5 a 25 graus Celsius.
Qual é o p H da solução de ácido etanoico antes e depois da adição de acetato de sódio?
2. O número de partículas que se ionizam ou dissociam em relação a uma dada quantidade inicial de partículas dissolvidas é determinado pelo grau de ionização (substâncias moleculares) ou de dissociação (substâncias iônicas). Dissolvendo-se 400 partículas de uma substância em água, verificou-se que 380 partículas se ionizaram. Qual é o grau de ionização abre parênteses alfa fecha parênteses da substância em questão?
Respostas das questões 1 e 2 nas Orientações para o professor.
3. Sobre o sistema tampão existente no sangue, qual das alternativas a seguir é uma afirmação correta?
a ) Se um ácido ou uma base forte for absorvida ou produzida pelo corpo, o sistema tampão é capaz de remover o excesso desses íons, transformando-os em ácido ou base mais fracos.
b ) O sistema tampão mantém o p H do sangue na faixa entre 7,35 e 7,45, que é um pouco ácido.
c ) Esse sistema tampão é formado pelo íon hidrogenocarbonato abre parênteses H C O subscrito 3 elevado a início expoente, menos, fim expoente fecha parênteses e pelo íon sódio abre parênteses N a elevado a início expoente, mais, fim expoente fecha parênteses.
d ) Caso sejam adicionados íons hidrogênio abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses ao tampão do sangue, esses íons vão reagir com o ácido carbônico e formar hidrogenocarbonato.
Resposta: Alternativa a.
4. A reação química a seguir representa o equilíbrio químico da solução de ácido etanoico em água:
C H subscrito 3 C O O H abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C H subscrito 3 C O O elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
Entre as alternativas a seguir, escolha a alternativa que melhor expressa a constante de ionização do ácido etanoico.
a ) 'K' subscrito a é igual a início de fração, numerador: abre colchetes C H subscrito 3 C O O H fecha colchetes, denominador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes C H subscrito 3 C O O elevado a início expoente, menos, fim expoente fecha colchetes, fim de fração
b ) 'K' subscrito a é igual a início de fração, numerador: abre colchetes H subscrito 2 O fecha colchetes vezes abre colchetes C H subscrito 3 C O O elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes C H subscrito 3 C O O H fecha colchetes, fim de fração
c ) 'K' subscrito b é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes C H subscrito 3 C O O elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes C H subscrito 3 C O O H fecha colchetes, fim de fração
d ) 'K' subscrito w é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes, denominador: abre colchetes C H subscrito 3 C O O H fecha colchetes, fim de fração
e ) 'K' subscrito a é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes C H subscrito 3 C O O elevado a início expoente, menos, fim expoente fecha colchetes, denominador: abre colchetes C H subscrito 3 C O O H fecha colchetes, fim de fração
Resposta: Alternativa e.
5. Confira, a seguir, o quadro com os valores das constantes de dissociação de três espécies de características básicas.
| Base | K subscrito b abre parênteses T é igual a 25 graus Celsius fecha parênteses |
|---|---|
|
Hidróxido de amônio abre parênteses N H subscrito 4 O H fecha parênteses |
1 vírgula 8 vezes 10 elevado a menos 5 |
|
Hidróxido de metilamina abre parênteses C H subscrito 3 N H subscrito 3 O H fecha parênteses |
5 vírgula 0 vezes 10 elevado a menos 4 |
|
Hidróxido de anilina abre parênteses C subscrito 6 H subscrito 5 N H subscrito 3 O H fecha parênteses |
4 vírgula 6 vezes 10 elevado a menos 10 |
Qual das bases apresentadas no quadro é considerada a mais forte? Justifique sua resposta.
Resposta: A base mais forte é o hidróxido de metilamina, pois quanto maior for o valor de 'K' subscrito b, maiores serão a dissociação da base e a força desse eletrólito.
6. Ao analisar uma determinada amostra de uma mistura aquosa de café, um profissional determinou que sua concentração hidrogeniônica é de 0 vírgula 0 0 0 0 1 mol por litro. Assim, o p H dessa amostra de café é:
a ) 2
b ) 11
c ) 5
d ) 4
e ) 7
Resposta: Alternativa c. p H é igual a menos log abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a menos log abre colchetes 1 vezes 10 elevado a menos 5 fecha colchetes é igual a 5 portanto p H é igual a 5
7. O ácido tartárico encontrado nas uvas é um ácido orgânico fraco que não ioniza totalmente em solução aquosa. Considere que um professor tenha preparado uma solução aquosa de 0 vírgula 1 mol de ácido tartárico por litro e que a concentração do íon abre colchetes H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses fecha colchetes nessa solução seja de 0 vírgula 0 0 57 mol por litro. Qual é o valor da constante de ionização do ácido tartárico? Justifique sua resposta com os devidos cálculos.
a ) 3 vírgula 1 vezes 10 elevado a menos 3
b ) 3 vírgula 2 vezes 10 elevado a menos 4
c ) 5 vírgula 7 vezes 10 elevado a menos 3
d ) 5 vírgula 7 vezes 10 elevado a menos 2
e ) 3 vírgula 2 vezes 10 elevado a início expoente, mais 4, fim expoente
Resposta: Alternativa b. Utilizando a lei de Ostwald para ácidos fracos, 'K' subscrito a é igual a M vezes alfa elevado ao quadrado, em que M é igual a 0 vírgula 1 mol por litro e o grau de ionização pode ser calculado por: alfa é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes, denominador: M, fim de fração, em que abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes é igual a 0 vírgula 0 0 57 mol por litro, assim alfa é igual a início de fração, numerador: abre colchetes H elevado a início expoente, mais, fim expoente fecha colchetes, denominador: M, fim de fração é igual a início de fração, numerador: 0 vírgula 0 0 57 mol por litro, denominador: 0 vírgula 1, fim de fração é igual a 5 vírgula 7 vezes 10 elevado a menos 2. Substituindo os valores na expressão, temos: 'K' subscrito a é igual a 0 vírgula 1 vezes abre parênteses 5 vírgula 7 vezes 10 elevado a menos 2 fecha parênteses elevado ao quadrado é igual a 3 vírgula 2 vezes 10 elevado a menos 4.
Página 365
8. Sobre uma das bancadas do laboratório de Química da escola, um estudante observou que havia dois lotes, cada um com os seguintes materiais:
I ) água destilada;
II ) suco de limão;
III ) café preparado;
IV ) sangue humano;
V ) creme dental.
Ordene essas amostras de acordo com o que se pede.
a ) No primeiro lote, coloque os materiais em ordem crescente de p H. Escreva a sequência numérica (correspondente aos materiais) obtida.
Resposta: A ordem crescente de p H: II é menor do que III é menor do que I é menor do que IV é menor do que V (quanto maior o p H, menor a acidez e maior a alcalinidade).
b ) No segundo lote, coloque os materiais em ordem crescente de p O H. Escreva a sequência numérica (correspondente aos materiais) obtida.
Resposta: A ordem crescente de p O H: V é menor do que IV é menor do que I é menor do que III é menor do que II (quanto maior o p O H, menor a alcalinidade e maior a acidez).
9. A água é o principal solvente que utilizamos em reações em solução. Entretanto, em reações ácido-base, essa molécula age como um importante reagente em razão de seu caráter anfótero, que significa que ela pode agir tanto como ácido quanto como base, dependendo do reagente em questão.
Analise as seguintes reações e indique em quais delas a água age como ácido ou como base de Brønsted-Lowry.
a ) C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H C N mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Resposta: A água atua como um ácido, doando H elevado a início expoente, mais, fim expoente.
b ) H subscrito 2 C O subscrito 3 mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais H C O subscrito 3 início sobrescrito, menos, fim sobrescrito abre parênteses a q fecha parênteses
Resposta: A água atua como uma base, recebendo H elevado a início expoente, mais, fim expoente.
c ) N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
Resposta: A água atua como uma base, recebendo H elevado a início expoente, mais, fim expoente.
d ) H N O subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais N O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Resposta: A água atua como uma base, recebendo H elevado a início expoente, mais, fim expoente.
10. O p H desempenha um papel ativo em todas as etapas do processo de fabricação de algumas bebidas. Sabendo disso, o químico dinamarquês Sørensen, trabalhando em uma fábrica, desenvolveu a escala de p H para medir a concentração de íons H elevado a início expoente, mais, fim expoente nas diferentes etapas do processo de fabricação de uma bebida.
O quadro a seguir mostra o p H em diferentes etapas da produção.
| Etapa de produção | p H |
|---|---|
|
Água de fermentação |
é menor do que 6 vírgula 0 |
|
Fermentação |
4,0-4,5 |
|
Bebida pronta |
4,1-4,6 |
a ) Por que a fenolftaleína não é um bom indicador a ser usado na determinação do p H no processo de fabricação dessa bebida?
b ) O modo de regular a acidez da bebida é feito pela adição, no preparo, de ácido fosfórico, ácido láctico ou, ainda, soda cáustica alimentícia.
Se a bebida pronta apresentar concentração de íons H sobrescrito mais igual a 0 vírgula 0 1 mol por litro, qual procedimento deve ser realizado para corrigir o p H? Por quê?
11. Um belo dia, Pedro se deparou com uma mensagem de Fernando em um grupo de mensagens de aplicativo entre amigos chamado Vida Longa, e eles começaram uma conversa.
Representação do chat do grupo Vida Longa.
Informações falsas muitas vezes se espalham rapidamente por trazerem conceitos mais complexos e mal-explicados, distorcendo um fato em favor de promover alguma solução mágica.
Redija uma resposta que Pedro poderia dar para explicar o porquê de a água alcalina não ter a validade proposta pelo amigo.
Respostas das questões 10 e 11 nas Orientações para o professor.
Página 366
CAPÍTULO20
Hidrólise salina e produto de solubilidade
Hidrólise salina
Muitas vezes, após uma refeição contendo alimentos ricos em gordura, podemos ter azia, uma sensação incômoda no estômago. A azia é provocada pelo excesso de ácido clorídrico abre parênteses H C l fecha parênteses, produzido pelo estômago para digerir o alimento. Conforme a equação química de ionização do H C l em água abre parênteses H subscrito 2 O fecha parênteses, esse ácido se ioniza formando os íons hidrônio abre parênteses H subscrito 3 O sobrescrito mais fecha parênteses e cloreto abre parênteses C l elevado a início expoente, menos, fim expoente fecha parênteses, diminuindo o p H estomacal e causando dor.
H C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses

Os médicos geralmente orientam o uso de medicamentos chamados antiácidos para combater a acidez estomacal. Eles contêm como princípio ativo o hidrogenocarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses, um sal que, em solução aquosa, sofre dissociação iônica:
N a H C O subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima Na elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Em seguida, o ânion hidrogenocarbonato abre parênteses H C O subscrito 3 elevado a início expoente, menos, fim expoente fecha parênteses formado reage com água, formando ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses e íon hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses:
H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Os íons hidroxila neutralizam parte dos íons hidrônio em excesso no estômago, aumentando o pH do suco gástrico até um valor adequado.
1. O que acontece com o p H do estômago de uma pessoa que toma antiácidos em excesso?
Resposta: O antiácido aumenta o p H do estômago da pessoa. Caso seja tomado em excesso, pode aumentar o p H além do necessário, causando sérias complicações estomacais.
Cuidado
A automedicação pode ser muito prejudicial à saúde. Não tome remédios sem a orientação de um médico.
A reação de dissociação iônica do N a H C O subscrito 3 em água, levando à formação de ácido carbônico e íons hidroxila, é chamada reação de hidrólise salina. É uma reação na qual a água possibilita a quebra ou dissociação de uma substância, levando à formação de ácidos, bases e/ou íons.
Você pode se perguntar por que não ocorre a formação de hidróxido de sódio abre parênteses N a O H fecha parênteses no caso apresentado, visto que são liberados íons N a sobrescrito mais e O H elevado a início expoente, menos, fim expoente no mesmo meio aquoso. Para isso, devemos lembrar que o N a O H é uma base forte. Ou seja, essa substância, em meio aquoso, se dissocia completamente.
Portanto, os íons N a sobrescrito mais e O H elevado a início expoente, menos, fim expoente tendem a ficar separados quando presentes no mesmo meio aquoso. Além disso, a reação entre O H elevado a início expoente, menos, fim expoente e H subscrito 3 O sobrescrito mais consome os íons hidroxila formados:
O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas 2 H subscrito 2 O abre parênteses l fecha parênteses
Por outro lado, o ácido carbônico é ácido fraco, portanto, o íon H C O subscrito 3 elevado a início expoente, menos, fim expoente reage com a água e forma ácido carbônico, conforme representado na equação química anterior.
Assim, é possível notar que, para entender como se dá a hidrólise salina de uma substância, precisamos saber qual é a força dos ácidos e das bases que dão origem a esse sal.
Página 367
Hidrólise de um sal de ácido fraco e base forte
Professor, professora: Explique aos estudantes que a hidrólise se refere ao processo completo de dissociação iônica do sal e reação com água, e não apenas a uma dessas etapas.
O cianeto de potássio abre parênteses K C N fecha parênteses é um composto tóxico. Em soluções aquosas de cianeto de potássio, ocorre a formação de íons hidroxila e de ácido cianídrico abre parênteses H C N fecha parênteses. Isso acontece porque o íon cianeto abre parênteses C N elevado a início expoente, menos, fim expoente fecha parênteses reage com a água durante a reação de hidrólise salina.
Por ser solúvel em água, assim como a maioria dos outros sais de metais alcalinos, o K C N passa pelo seguinte processo de dissociação iônica em meio aquoso:
K C N abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Em seguida, confira a reação que ocorre com a água:
K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais expressão com detalhe abaixo, início da expressão, H C N abre parênteses a q fecha parênteses, início do detalhe abaixo, ácido fraco, fim do detalhe abaixo
O H C N é um ácido fraco, o que leva o íon cianeto a reagir com a água. Dizemos que o K C N é um sal de ácido fraco ( o H C N) e base forte (o K O H). Por outro lado, perceba que o íon K elevado a início expoente, mais, fim expoente está nos dois lados da equação química. Isso acontece porque o hidróxido de potássio abre parênteses K O H fecha parênteses é uma base forte, permanecendo completamente ionizado em K elevado a início expoente, mais, fim expoente e O H elevado a início expoente, menos, fim expoente em meio aquoso. Podemos, então, representar a reação de forma mais simplificada:
início de expressão riscada; K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses; fim de expressão riscada mais C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas início de expressão riscada; K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses; fim de expressão riscada mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H C N abre parênteses a q fecha parênteses
C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H C N abre parênteses a q fecha parênteses
Como resultado, tem-se uma solução aquosa alcalina, com p H é maior do que 7.
A equação química global de hidrólise do K C N pode ser representada por:
K C N abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H C N abre parênteses a q fecha parênteses mais K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses

Para a verificação do p H dessa reação de hidrólise, foram mergulhadas duas fitas de papel tornassol (indicador ácido-base), uma azul e outra vermelha, na solução final. Ambas as fitas apresentaram coloração azul, indicando que a solução apresenta p H básico (alcalino), em virtude da concentração elevada de íons O H elevado a início expoente, menos, fim expoente.
Hidrólise de um sal de ácido forte e base fraca
O cloreto de amônio abre parênteses N H subscrito 4 C l fecha parênteses é um composto que tem diversas aplicações na indústria, como a fabricação de xampus e de produtos de limpeza. Quando dissolvemos cloreto de amônio em água, por ser completamente solúvel, ocorre a dissociação em íons amônio abre parênteses N H subscrito 4 elevado a início expoente, mais, fim expoente fecha parênteses e cloreto:
N H subscrito 4 C l abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Os íons amônio reagem com a água formando o hidróxido de amônio abre parênteses N H subscrito 4 O H fecha parênteses, uma base fraca. No entanto, os íons cloreto não reagem, pois o ácido clorídrico é forte. Portanto, a solução final tem excesso de íons H subscrito 3 O sobrescrito mais, tornando-se ácida.
N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais início de expressão riscada; C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses; fim de expressão riscada mais 2 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais início de expressão riscada; C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses; fim de expressão riscada mais N H subscrito 4 OH abre parênteses a q fecha parênteses
N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais expressão com detalhe abaixo, início da expressão, N H subscrito 4 O H abre parênteses a q fecha parênteses, início do detalhe abaixo, base fraca, fim do detalhe abaixo
Como resultado, tem-se uma solução aquosa ácida, com p H é menor do que 7.
A equação química global de hidrólise do N H subscrito 4 C l pode ser representada por:
N H subscrito 4 C l abre parênteses s fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 O H abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
2. Se mergulharmos duas fitas de papel tornassol, uma azul e outra vermelha, na solução final, qual será a coloração dessas fitas? Por quê?
Resposta: Espera-se que os estudantes respondam que a coloração das duas fitas será vermelha, indicando que a solução apresenta p H ácido, por causa da concentração elevada de íons H subscrito 3 O sobrescrito mais.
Página 368
O p H e a produção de alimentos
Cada planta se desenvolve melhor em determinados intervalos de p H. Dessa forma, os agricultores precisam constantemente medir e corrigir o p H do solo das plantações. Confira na tabela a seguir a faixa de p H mais adequada para o cultivo de algumas frutas.
| Fruta | Faixa de p H |
|---|---|
|
Amora |
4,9 a 6,0 |
|
Abacaxi |
5,0 a 6,0 |
|
Banana |
5,0 a 7,0 |
|
Manga |
5,6 a 6,0 |
|
Maçã |
5,6 a 7,5 |
|
Mamão |
6,0 a 7,0 |
|
Pera |
6,0 a 7,5 |
Fonte de pesquisa: LIU, Guodong et al. Soil p H management for optimum commercial fruit production in Florida. UF/IFAS Extension, 18 mar. 2024. Disponível em: https://s.livro.pro/t0dn24. Acesso em: 27 ago. 2024.
O valor de p H de um solo depende de algumas condições do ambiente em que se encontra, como o tipo e a quantidade de minerais que o compõem, o efeito das chuvas, a presença de vegetação e a ação do tempo e de microrganismos. Os solos alcalinos têm valores de p H mais elevados, e os solos ácidos, valores de p H mais baixos.
Dependendo do tipo de plantação, é necessário que o agricultor corrija o p H do solo, um procedimento essencial para garantir boa produtividade da safra.
Solos muito ácidos precisam ser corrigidos com substâncias que os tornem mais básicos. Uma das maneiras de fazer isso é adicionando carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses, que, em solução aquosa, sofre a seguinte hidrólise salina:
C a C O subscrito 3 abre parênteses s fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses mais 2 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
A liberação de íons O H elevado a início expoente, menos, fim expoente aumenta o p H do solo. Esse processo leva o nome de calagem.

Por outro lado, solos muito básicos precisam ser corrigidos com substâncias que os tornem mais ácidos. Isso pode ser feito com a adição de sulfato de alumínio abre parênteses A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 fecha parênteses, que, em solução aquosa, sofre a seguinte hidrólise salina:
A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3 abre parênteses s fecha parênteses mais 12 H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas 2 A l abre parênteses O H fecha parênteses subscrito 3 abre parênteses a q fecha parênteses mais 3 S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais 6 H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
A liberação de íons H subscrito 3 O sobrescrito mais diminui o p H do solo.
a ) Qual é o tipo de hidrólise salina que acontece na correção da acidez de um solo? E na correção da basicidade?
Resposta: Na correção da acidez do solo, como visto no exemplo do uso de carbonato de cálcio, observa-se a hidrólise salina de um sal de ácido fraco e base forte, liberando no solo íons hidroxila. Já na correção da basicidade, como no exemplo do uso de sulfato de alumínio, a hidrólise salina é de um sal de ácido forte e base fraca, liberando no solo íons hidrônio.
b ) O cloreto de sódio abre parênteses N aC l fecha parênteses é uma substância indicada para corrigir o p H do solo? Por quê?
Resposta: O abre parênteses N aC l fecha parênteses não é efetivo para corrigir o p H do solo, pois é um sal de ácido forte abre parênteses H C fecha parênteses e base forte abre parênteses N a O H fecha parênteses, o que faz com que o p H final não se altere. Além disso, esse sal é prejudicial para as plantas.
c ) Um agricultor que deseja cultivar peras em sua plantação descobriu que o valor do p H de seu solo é 5,0. Para esse agricultor resolver o problema, é mais indicado adicionar carbonato de cálcio ou sulfato de alumínio?
Resposta: A faixa ótima de p H para o cultivo de pera é entre 6,0 e 7,5. Portanto, o p H atual está menor do que o ideal. Para resolver o problema, o agricultor deve corrigir a acidez do solo adicionando carbonato de cálcio, isto é, calcário.
Página 369
Hidrólise de um sal de ácido fraco e base fraca
Estudamos que o ácido cianídrico é um ácido fraco e que o hidróxido de amônio abre parênteses N H subscrito 4 O H fecha parênteses é uma base fraca. O que acontece, então, quando dissolvemos em água o sal originado dessas duas substâncias, ou seja, o cianeto de amônio abre parênteses N H subscrito 4 C N fecha parênteses?
O N H subscrito 4 C N se dissolve completamente em água, dissociando-se nos respectivos íons:
N H subscrito 4 C N abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
No entanto, como o H C N é um ácido fraco e o N H subscrito 4 O H é uma base fraca, ambos os íons reagirão com água, formando estas substâncias:
N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas expressão com detalhe abaixo, início da expressão, N H subscrito 4 O H abre parênteses a q fecha parênteses, início do detalhe abaixo, base fraca, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, H C N abre parênteses a q fecha parênteses, início do detalhe abaixo, ácido fraco, fim do detalhe abaixo
O p H da solução após a hidrólise dependerá de qual substância é mais forte: se o ácido, mesmo fraco, for mais forte do que a base, o p H final será mais baixo, correspondendo a uma solução ácida, pois haverá mais íons H subscrito 3 O sobrescrito mais na solução. Por outro lado, se a base, mesmo fraca, for mais forte do que o ácido, o p H final será alto, correspondendo a uma solução básica, pois haverá mais íons O H elevado a início expoente, menos, fim expoente na solução. No entanto, em qualquer um dos casos, o p H será bastante próximo do valor neutro, ou seja, próximo de 7.
A equação química global de hidrólise do N H subscrito 4 C N pode ser representada por:
N H subscrito 4 C N abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 O H abre parênteses a q fecha parênteses mais H C N abre parênteses a q fecha parênteses
Se verificarmos o p H da solução após a reação de hidrólise, utilizando duas fitas de papel tornassol (uma azul e outra vermelha), podemos notar que a fita de tornassol azul mantém a coloração azul e a fita de tornassol vermelha mantém a coloração vermelha, indicando que o p H dessa solução é neutro.
Hidrólise de um sal de ácido forte e base forte
Vimos que o H C l é um ácido forte e que o K O H é uma base forte. O sal originado por essas substâncias, o cloreto de potássioabre parênteses K C l fecha parênteses, não sofre hidrólise. Ele sofre apenas dissociação iônica e seus íons não reagem com a água:
K C l abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
expressão com detalhe abaixo, início da expressão, K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses, início do detalhe abaixo, não há reação química, fim do detalhe abaixo
Como resultado, o p H da amostra não se altera, permanecendo neutro, ou seja, igual ou muito próximo de 7. O resultado visual do teste do p H da solução final com papel de tornassol é exatamente igual ao verificado na hidrólise de um sal de ácido fraco e base fraca.
O quadro a seguir apresenta um resumo do valor de p H final para cada um dos casos.
| Tipo de sal | Exemplo | Espécies formadas | p H final |
|---|---|---|---|
|
sal de ácido fraco e base forte |
K C N |
ácido fraco H C N, cátion de base forte abre parênteses K sobrescrito mais fecha parênteses e íon hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses |
básico abre parênteses p H é maior do que 7 fecha parênteses |
|
sal de ácido forte e base fraca |
N H subscrito 4 C l |
base fraca abre parênteses N H subscrito 4 O H fecha parênteses, ânion de ácido forte abre parênteses C l elevado a início expoente, menos, fim expoente fecha parênteses e íon hidrônio abre parênteses H subscrito 3 O sobrescrito mais fecha parênteses |
ácido abre parênteses p H é menor do que 7 fecha parênteses |
|
sal de ácido fraco e base fraca |
N H subscrito 4 C N |
ácido fraco abre parênteses H C N fecha parênteses e base fraca abre parênteses N H subscrito 4 O H fecha parênteses |
neutro abre parênteses p H é aproximadamente igual a 7 fecha parênteses |
|
sal de ácido forte e base forte |
K C l |
ânion de ácido forte abre parênteses C l elevado a início expoente, menos, fim expoente fecha parênteses e cátion de base forte abre parênteses K sobrescrito mais fecha parênteses |
neutro abre parênteses p H é aproximadamente igual a 7 fecha parênteses |
Página 370
Sal da alimentação indígena
A etnociência é o campo de estudo interdisciplinar que busca compreender os saberes de diferentes culturas sobre o mundo natural. Um exemplo da rica diversidade de conhecimentos tradicionais é a produção do sal cloreto de potássio por povos indígenas da região do Alto Xingu, no estado do Mato Grosso, como os Waujá.
Diferentemente do sal comum (cloreto de sódio), obtido geralmente por meio da evaporação da água do mar ou de reações de neutralização entre ácido clorídrico e hidróxido de sódio, a origem do sal dos Waujá é peculiar: uma planta aquática chamada aguapé.
A produção desse condimento tradicional envolve um processo meticuloso, que dura cerca de três semanas. Inicialmente, as folhas do aguapé são colhidas e são deixadas expostas ao sol, para secar. Em seguida, elas são queimadas em grandes fogueiras. A cinza resultante, rica em potássio, é então filtrada com água para a obtenção de uma solução. Em seguida, essa solução é aquecida em recipientes de barro, evaporando a água e formando cristais de cloreto de potássio.
Aguapé (Eichhornia crassipes): pode atingir aproximadamente 1 metro de altura.

Uma das características dessa produção é que ela não ocorre o ano todo, respeitando o tempo de regeneração dos aguapés na natureza. Esse método de produção demonstra o conhecimento ancestral sobre as propriedades das plantas e dos processos químicos envolvidos na obtenção desse mineral essencial.
Essa diferença na forma de obter o sal confere a ele características únicas, como a ausência de sódio em sua composição, que é um fator crucial para a saúde dos indivíduos. O sódio é um micronutriente essencial para a dieta humana e, de acordo com a Organização Mundial da Saúde (OMS), seu consumo não deve ultrapassar a quantidade de 2 gramas por dia. O excesso desse nutriente na dieta está diretamente relacionado à hipertensão arterial e a doenças cardiovasculares e renais.
No entanto, a facilidade de acesso ao sal comum nas cidades tem levado à diminuição da produção tradicional de sal de potássio pelos indígenas. Essa mudança nos hábitos alimentares representa um risco para a saúde desses povos.
Além dos aspectos relacionados à saúde, a substituição do sal de potássio representa uma perda significativa para a cultura e a tradição dessas comunidades. Isso porque o conhecimento tradicional da produção desse sal é transmitido de geração em geração, fortalecendo os laços comunitários e preservando a identidade cultural desses povos. Ao abandonar essa prática, os indígenas perdem não apenas um alimento saudável, mas também um importante elemento de sua identidade e herança cultural desses povos.
A preservação das práticas tradicionais de produção de alimentos, como a do sal de cloreto de potássio pelos Waujá, é fundamental para a valorização da diversidade cultural e para a promoção da saúde dos povos indígenas. A valorização desses conhecimentos tradicionais pode contribuir para o desenvolvimento de novas tecnologias e de produtos mais saudáveis e sustentáveis.
a ) Qual característica química do cloreto de potássio permite extraí-lo pelo método utilizado pelos Waujá?
Resposta: O K C l é um sal oriundo da reação entre ácido forte e base forte, portanto não sofre hidrólise. Assim, quando é solubilizado em água, os íons não reagem com ela, permanecendo na forma iônica até que o sal seja recristalizado pela evaporação da água.
b ) Quais medidas você imagina que poderiam ser adotadas como forma de valorizar a cultura tradicional de sal pelos Waujá?
Resposta pessoal. Entre as possibilidades, os estudantes podem mencionar ações de incentivo ao registro e à catalogação das práticas tradicionais e sua divulgação, como forma de valorizá-las.
Página 371
ATIVIDADES
1. Confira as quatro soluções apresentadas a seguir.
- Solução 1: K C l abre parênteses a q fecha parênteses
- Solução 2: N H subscrito 4 B r abre parênteses a q fecha parênteses
- Solução 3: N a N O subscrito 3 abre parênteses a q fecha parênteses
- Solução 4: C a C O subscrito 3 abre parênteses a q fecha parênteses
Faça a soma das afirmações corretas sobre essas soluções.
01 ) O pH da solução 1 é próximo de 7.
02 ) A solução 3 é básica.
04 ) A solução 3 é ácida.
08 ) A solução 2 apresenta p H menor que 7.
16 ) Ao adicionar algumas gotas de fenolftaleína na solução 4, ela adquire coloração rosa.
32 ) N H subscrito 4 B r abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 O H abre parênteses a q fecha parênteses mais H B r abre parênteses a q fecha parênteses representa a hidrólise do brometo de amônio.
Resposta: Soma: 01 mais 0 8 mais 16 é igual a 25. Comentários nas Orientações para o professor.
2. Leia o trecho da reportagem a seguir.
Leite adulterado com soda cáustica
Agentes da Polícia Militar de Minas Gerais prenderam um grupo suspeito de desvio e adulteração de leite com soda cáustica. […]
LEITE adulterado com soda cáustica. O dia, nº 25.585. 18 jul. 2022. p. 10.
De forma criminosa, pessoas adicionavam soda cáustica, que é uma solução de hidróxido de sódio abre parênteses N a O H fecha parênteses, ao leite cru, visando neutralizar sua acidez e ampliar sua validade. O uso de hidróxido de sódio em alguns alimentos como um elemento regulador de acidez é permitido pela Anvisa. No entanto, esse não é o caso do leite, que pode ter sua qualidade comprometida com a adição da substância. Essa adulteração fazia com que a concentração de ácido lático abre parênteses C subscrito 3 H subscrito 6 O subscrito 3 fecha parênteses no leite permanecesse dentro da faixa permitida pela legislação para que pudesse ser comercializado como próprio para o consumo.
A reação entre o hidróxido de sódio e o ácido lático pode ser representada pela equação química:
C subscrito 3 H subscrito 6 O subscrito 3 abre parênteses a q fecha parênteses mais N a O H abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C subscrito 3 H subscrito 5 N a O subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
Qual é o problema causado por essa alteração?
a ) Diluição do leite.
b ) Aumento da concentração de ácido lático.
c ) Diminuição da acidez do leite.
d ) Diminuição do pH do leite.
e ) Produção de sais insolúveis.
Resposta: Alternativa c.
3. Um químico desenvolveu um indicador ácido-base solúvel em água que tem o seguinte comportamento.
| p H | Cor da solução |
|---|---|
|
é menor do que 7 |
vermelha |
|
é igual a 7 |
verde |
|
é maior do que 7 |
azul |
Quais serão as cores das soluções aquosas de A l subscrito 2 abre parênteses S O subscrito 4 fecha parênteses subscrito 3, N a C N e K C l na presença desse indicador, respectivamente?
a ) Vermelha, verde e azul.
b ) Verde, azul e vermelha.
c ) Verde, vermelha e azul.
d ) Azul, verde e vermelha.
e ) Vermelha, azul e verde.
Resposta: Alternativa e. Comentários nas Orientações para o professor.
4. O sal amargo é composto por sulfato de magnésio abre parênteses M g S O subscrito 4 fecha parênteses e conhecido como sal de epsom, é frequentemente utilizado em diversas aplicações, incluindo fertilizantes e processos industriais. Quando dissolvido em água, ele se dissocia em íons magnésio abre parênteses M g elevado a início expoente, 2 mais, fim expoente fecha parênteses e íons sulfato abre parênteses S O subscrito 4 elevado a início expoente, 2 menos, fim expoente fecha parênteses.

a ) Escreva a equação de dissociação do sulfato de magnésio em água.
Resposta: M g S O subscrito 4 abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas M g elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
b ) Analise a hidrólise dos íons formados. Qual é o p H da solução resultante (ácida, básica ou neutra)? Justifique sua resposta com base nas propriedades dos íons envolvidos.
Resposta: A solução de sulfato de magnésio abre parênteses M g S O subscrito 4 fecha parênteses em água será levemente ácida em razão da hidrólise do íon M g elevado a início expoente, 2 mais, fim expoente, que produz íons H sobrescrito mais. Portanto, podemos concluir que a solução resultante tende a ser ácida.
Página 372
Produto de solubilidade
3. Você conhece alguém que já teve cálculo renal, conhecido popularmente como "pedras nos rins"? O que essa pessoa sentiu?
Resposta pessoal. O objetivo desta questão é incentivar os estudantes a expor seus conhecimentos prévios sobre a formação de cálculos renais, aproximando o assunto do cotidiano deles. Eles podem responder que pessoas com esse problema geralmente sentem dor intensa quando os cálculos se movimentam no trato urinário.
O cálculo renal, ou litíase renal, estruturas sólidas formadas no rim, pode se deslocar para outros órgãos do sistema urinário, causando dor intensa e incômodo.
Os rins são órgãos que atuam na filtração de sangue, controlando a concentração das substâncias presentes no organismo. Substâncias muito concentradas, tóxicas ou indesejadas são filtradas, podendo ser parcialmente absorvidas pelos rins e, por fim, eliminadas pela urina.
A urina, produzida nos rins, é conduzida até a bexiga pelos ureteres e eliminada pela uretra. Porém, quando ocorre a formação dessas estruturas sólidas, elas podem se instalar no trato urinário e, ao se movimentarem, provocam dor intensa. Além da dor, a pessoa com cálculo renal pode ter sangue na urina, dificuldade para urinar e até vômito.
Em geral, o nível da dor não está relacionado ao tamanho da "pedra" formada, mas sim ao seu formato, que pode ter estruturas pontiagudas que, ao se moverem, lesionam os canais urinários.
A origem dos cálculos renais pode ser atribuída a alguns fatores, incluindo fatores genéticos, perda excessiva de água, aliada ao seu baixo consumo, ou ingestão excessiva de alimentos ricos em alguns tipos de sais.
Os cálculos renais são constituídos por substâncias altamente insolúveis em água, como o oxalato de cálcio mono-hidratado abre parênteses C a C subscrito 2 O subscrito 4 vezes H subscrito 2 O abre parênteses s fecha parênteses fecha parênteses, ou o fosfato de cálcio abre parênteses C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 fecha parênteses. Confira a equação química simplificada da formação do cálculo renal de fosfato de cálcio no organismo.
Professor, professora: Comente com os estudantes que C a C subscrito 2 O subscrito 4 vezes H subscrito 2 O abre parênteses s fecha parênteses, é um hidrato, um composto que possui moléculas de água em sua estrutura sólida.
(I) 3 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 P O subscrito 4 elevado a início expoente, 3 menos, fim expoente abre parênteses a q fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 abre parênteses s fecha parênteses
Como essa é uma reação de equilíbrio químico, quanto maior for a concentração de íons cálcio abre parênteses C a elevado a início expoente, 2 mais, fim expoente fecha parênteses e fosfato abre parênteses P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha parênteses, mais provável será a formação do fosfato de cálcio. Por esse motivo, a ingestão de alimentos e bebidas ricos em determinados íons favorece a formação de cálculos renais. Muitos refrigerantes, por exemplo, têm em sua composição o ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 fecha parênteses, que, em água, sofre a seguinte ionização:
(II) H subscrito 3 P O subscrito 4 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima 3 H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais P O subscrito 4 elevado a início expoente, 3 menos, fim expoente abre parênteses a q fecha parênteses
O aumento da concentração de P O subscrito 4 elevado a início expoente, 3 menos, fim expoente em (II) altera o equilíbrio da primeira reação (I), favorecendo a formação e a precipitação de C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 na forma de cálculo.
Compartilhe ideias
Muitas atitudes ajudam a evitar a formação de cálculos renais, mas há outras ações de nosso cotidiano que acabam a favorecendo. Reúna-se com dois colegas e discutam as questões a seguir.
a ) Como a ingestão de água em quantidade adequada ajuda a evitar a formação de cálculos renais?
b ) Quais alimentos são bons substitutos de refrigerantes e comidas processadas, a fim de evitar a formação de cálculos renais?
c ) Bebidas isotônicas, ricas em sais minerais, são recomendadas após a prática intensa de exercícios físicos. Expliquem o motivo disso. Em seguida, justifiquem por que esse tipo de bebida não é recomendado quando a pessoa não praticou exercícios físicos.
Respostas nas Orientações para o professor.
Página 373
Agora, confira a equação química da reação de solubilização de fosfato de cálcio em água.
C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima 3 C a elevado a início expoente, 2 mais, fim expoente abre parênteses aq fecha parênteses mais 2 P O subscrito 4 elevado a início expoente, 3 menos, fim expoente abre parênteses a q fecha parênteses
Nessa equação, a reação é inversa à reação de formação do cálculo renal apresentada na página anterior. Analisando a equação, entende-se que o fosfato de cálcio se dissolve em água e se dissocia nos íons cálcio e fosfato. O produto de solubilidade abre parênteses 'K' subscrito s fecha parênteses do fosfato de cálcio é calculado da mesma maneira como são calculadas as constantes de equilíbrio de reações, isto é:
'K' subscrito s é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes elevado ao cubo vezes abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha colchetes elevado ao quadrado
Note que, assim como nos cálculos das constantes de equilíbrio gerais, para obter o produto de solubilidade são consideradas apenas as espécies em meio aquoso, cujas concentrações são elevadas pelo coeficiente estequiométrico.
Para entender melhor o produto de solubilidade, considere um sistema contendo uma solução aquosa saturada de fosfato de cálcio e um precipitado desse mesmo sal a determinada temperatura, como mostra a imagem a seguir.
Imagem sem proporção e em cores fantasia.
Nessas condições, à temperatura constante, mesmo que haja agitação da solução após atingir o equilíbrio, a quantidade de precipitado, ou corpo de fundo, não se altera. Com isso, conclui-se que a velocidade de dissolução abre parênteses v subscrito d fecha parênteses se iguala à velocidade de precipitação abre parênteses v subscrito p fecha parênteses. Portanto, os íons na solução saturada desse sal e os íons do precipitado atingem o equilíbrio.
Esse sistema pode ser representado por:
expressão com detalhe abaixo, início da expressão, C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 abre parênteses s fecha parênteses, início do detalhe abaixo, corpo de fundo, fim do detalhe abaixo v subscrito d duas meias setas que apontam em direções opostas v subscrito p expressão com detalhe abaixo, início da expressão, 3 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, solução aquosa saturada de fosfato de cálcio, fim do detalhe abaixo
Nesse caso, o equilíbrio é heterogêneo, e a constante de equilíbrio é dada pelo produto de solubilidade. Essa constante de equilíbrio é característica para determinada temperatura, isto é, ela assume valores diferentes conforme a temperatura do sistema se altera.
Por exemplo, à temperatura de 25 graus Celsius, o produto de solubilidade do fosfato de cálcio é 'K' subscrito s é igual a 2 vírgula 0 7 vezes 10 elevado a menos 33. Com base nesse valor, podemos calcular a solubilidade desse sal e, consequentemente, a concentração dos íons em solução aquosa:
expressão com detalhe abaixo, início da expressão, C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 abre parênteses s fecha parênteses, início do detalhe abaixo, solubilidade é igual a 1 vezes x abre parênteses moL fecha parênteses, fim do detalhe abaixo v subscrito d duas meias setas que apontam em direções opostas v subscrito p expressão com detalhe abaixo, início da expressão, 3 C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, 3 vezes x abre parênteses mol barra litro fecha parênteses, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, 2 P O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses, início do detalhe abaixo, 2 vezes x abre parênteses mol barra litro fecha parênteses, fim do detalhe abaixo
'K' subscrito s é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes elevado ao cubo vezes abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha colchetes elevado ao quadrado
2 vírgula 0 7 vezes 10 elevado a menos 33 é igual a abre parênteses 3 vezes x fecha parênteses elevado ao cubo vezes abre parênteses 2 vezes x fecha parênteses elevado ao quadrado
2 vírgula 0 7 vezes 10 elevado a menos 33 é igual a 27 vezes x elevado ao cubo vezes 4 vezes x elevado ao quadrado
2 vírgula 0 7 vezes 10 elevado a menos 33 é igual a 108 vezes x elevado a 5
x elevado a 5 é igual a início de fração, numerador: 2 vírgula 0 7 vezes 10 elevado a menos 33, denominador: 108, fim de fração
x é igual a início de raiz; início do radicando, início de fração, numerador: 2 vírgula 0 7 vezes 10 elevado a menos 33, denominador: 108, fim de fração, fim do radicando, índice 5; fim de raiz é aproximadamente igual a 1 vírgula 1 vezes 10 elevado a menos 7
portanto x é aproximadamente igual a 1 vírgula 1 vezes 10 elevado a menos 7 mol barra L
Logo, a solubilidade do fosfato de cálcio, à temperatura de 25 graus Celsius, é aproximadamente 1 vírgula 1 vezes 10 elevado a menos 7 mol por litro. A concentração dos íons cálcio é igual ao triplo desse valor, isto é, 3 vírgula 3 vezes 10 elevado a menos 7 mol por litro. Já a concentração dos íons fosfato é igual ao dobro, ou seja, 2 vírgula 2 vezes 10 elevado a menos 7 mol por litro.
Note que, em comparação com os valores de concentração da maioria dos equilíbrios em meio aquoso, os valores calculados anteriormente são muito baixos. Assim, dizemos que o fosfato de cálcio é insolúvel, isto é, seu produto de solubilidade é muito pequeno.
Página 374
Confira a seguir outros exemplos de cálculos de produto de solubilidade.
Solução saturada de brometo de chumbo(II) abre parênteses P b B r subscrito 2 fecha parênteses:
P b B r subscrito 2 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima P b elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 B r elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
'K' subscrito s é igual a abre colchetes P b elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes B r elevado a início expoente, menos, fim expoente fecha colchetes elevado ao quadrado é igual a 6 vírgula 6 vezes 10 elevado a menos 6
Solução saturada de cianeto de cobre(I) abre parênteses C u C N fecha parênteses:
C u C N abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima C u elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C N elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
'K' subscrito s é igual a abre colchetes C u elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes C N elevado a início expoente, menos, fim expoente fecha colchetes é igual a 3 vírgula 47 vezes 10 elevado a menos 20

Com base nos resultados experimentais obtidos no estudo da solubilidade de um eletrólito, a determinada temperatura, conclui-se que:
- quanto menor é a solubilidade do eletrólito, menor é o valor de 'K' subscrito s;
- o produto de solubilidade de um sal indica se ele é mais ou menos solúvel em água;
- a comparação entre a solubilidade de dois sais diferentes só é possível após todos os cálculos, pois os coeficientes estequiométricos dos íons podem ser diferentes;
- o equilíbrio de dissociação (ou ionização) e a concentração de íons não se alteram ao adicionar determinada quantidade de um eletrólito sólido em uma solução saturada de um mesmo eletrólito, de modo que o produto de solubilidade permanece constante. Portanto, de maneira geral, é possível estabelecer a solubilidade de um eletrólito, a dada temperatura, da seguinte maneira:
Imagens desta página sem proporção e em cores fantasia.

Se abre colchetes A elevado a início expoente, y mais, fim expoente fecha colchetes elevado a x vezes abre colchetes B elevado a início expoente, x menos, fim expoente fecha colchetes elevado a y é menor do que 'K' subscrito s, a solução é insaturada.

Se abre colchetes A elevado a início expoente, y mais, fim expoente fecha colchetes elevado a x vezes abre colchetes B elevado a início expoente, x menos, fim expoente fecha colchetes elevado a y é igual a 'K' subscrito s, a solução é saturada.

Se abre colchetes A elevado a início expoente, y mais, fim expoente fecha colchetes elevado a x vezes abre colchetes B elevado a início expoente, x menos, fim expoente fecha colchetes elevado a y é maior do que 'K' subscrito s, ocorre precipitação desse eletrólito até que o produto seja igual a 'K' subscrito s.
ATIVIDADES RESOLVIDAS
R1. O 'K' subscrito s do fosfato de cálcio é 2 vírgula 0 7 vezes 10 elevado a menos 33 a 25 graus Celsius, sendo praticamente o mesmo à temperatura corporal. Considere que uma pessoa tem uma concentração nos rins de íons cálcio e fosfato igual a 3 vírgula 2 vezes 10 elevado a menos 7 mol por litro e 2 vírgula 1 vezes 10 elevado a menos 7 mol por litro, respectivamente.
a ) Com base nessas informações, haverá a formação de um cálculo de fosfato de cálcio no rim dessa pessoa?
b ) Caso essa pessoa ingerisse grande quantidade de refrigerante, passando a ter uma concentração de íons cálcio e fosfato igual a 3 vírgula 5 vezes 10 elevado a menos 7 mol por litro e 2 vírgula 4 vezes 10 elevado a menos 7 mol por litro, respectivamente, o que aconteceria com ela?
Resolução
a ) Calculando o coeficiente de reação abre parênteses Q fecha parênteses dessa solução, tem-se:
Q é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes elevado ao cubo vezes abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha colchetes elevado ao quadrado é igual a abre parênteses 3 vírgula 2 vezes 10 elevado a menos 7 fecha parênteses elevado ao cubo vezes abre parênteses 2 vírgula 1 vezes 10 elevado a menos 7 fecha parênteses elevado ao quadrado é igual a 1 vírgula 45 vezes 10 elevado a menos 33 portanto Q é igual a 1 vírgula 45 vezes 10 elevado a menos 33
Como o coeficiente de reação é menor do que o produto de solubilidade, os íons estão completamente dissolvidos em água, portanto não há formação de precipitado (cálculo renal).
b ) Calculando o novo coeficiente de reação, tem-se:
Q é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes elevado ao cubo vezes abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha colchetes elevado ao quadrado é igual a abre parênteses 3 vírgula 5 vezes 10 elevado a menos 7 fecha parênteses elevado ao cubo vezes abre parênteses 2 vírgula 4 vezes 10 elevado a menos 7 fecha parênteses elevado ao quadrado é igual a 2 vírgula 47 vezes 10 elevado a menos 33 portanto Q é igual a 2 vírgula 47 vezes 10 elevado a menos 33
Isto é, abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes elevado ao cubo vezes abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha colchetes elevado ao quadrado é maior do que 'K' subscrito s. Portanto, o excesso de íons precipitará na forma de C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 3 até o coeficiente de reação se igualar ao produto de solubilidade.
Página 375
ATIVIDADES
Imagens desta página sem proporção.
1. O sulfato de cálcio abre parênteses C a S O subscrito 4 fecha parênteses é muito utilizado na produção de fertilizantes agrícolas, de dessecantes e do giz escolar. Esse sal está na natureza sob a forma do mineral anidrita.

À temperatura de 25 graus Celsius, o C a S O subscrito 4 tem coeficiente de solubilidade 'K' subscrito s é igual a 4 vírgula 9 vezes 10 elevado a menos 5. Qual é a concentração de íons C a elevado a início expoente, 2 mais, fim expoente em uma solução saturada de sulfato de cálcio?
a ) 3 vezes 10 elevado a menos 3 mol por litro
b ) 4 vezes 10 elevado a menos 3 por litro
c ) 5 vezes 10 elevado a menos 3 mol por litro
d ) 6 vezes 10 elevado a menos 3 mol por litro
e ) 7 vezes 10 elevado a menos 3 mol por litro
Resposta: Alternativa e. Resolução nas Orientações para o professor.
2. O hidróxido de cálcio abre parênteses C a abre parênteses O H fecha parênteses subscrito 2 fecha parênteses, também conhecido como cal hidratada, é o produto da reação entre a cal e a água. Muito utilizado na construção civil, esse composto faz parte da mistura conhecida como argamassa.

Em determinada temperatura, o íon C a elevado a início expoente, 2 mais, fim expoente apresenta solubilidade de 1 vezes 10 elevado a menos 2 mol por litro. Sabendo que uma solução saturada foi produzida utilizando apenas o hidróxido de cálcio, calcule o produto de solubilidade da solução preparada.
a ) 1 vezes 10 elevado a menos 4
b ) 2 vezes 10 elevado a menos 4
c ) 4 vezes 10 elevado a menos 6
d ) 1 vezes 10 elevado a menos 6
e ) 4 vezes 10 elevado a menos 4
Resposta: Alternativa c. Resolução nas Orientações para o professor.
3. O sulfeto de cádmio abre parênteses C d S fecha parênteses é um sólido amarelo utilizado como pigmento em plásticos, com boa estabilidade térmica, resistência química e alta opacidade. Por ter propriedades semicondutoras, esse composto também pode ser utilizado na produção de células fotovoltaicas para painéis solares.

Esse sal tem um produto de solubilidade igual a 4 vezes 10 elevado a menos 30 e massa molar de aproximadamente 144 vírgula 5 gramas barra mol. Com base nessas informações, a solubilidade desse sal será de aproximadamente:
a ) 5 vírgula 78 vezes 10 elevado a menos 28 grama por litro
b ) 2 vírgula 77 vezes 10 elevado a menos 32 grama por litro
c ) 1 vírgula 45 vezes 10 elevado a menos 8 grama por litro
d ) 2 vírgula 89 vezes 10 elevado a menos 28 grama por litro
e ) 2 vírgula 89 vezes 10 elevado a menos 13 grama por litro
Resposta: Alternativa e. Resolução nas Orientações para o professor.
4. A aplicação intravenosa de solução de sacarato de hidróxido de ferro(III) vem sendo uma opção eficaz e segura no tratamento de pacientes adultos com anemia ferropriva (anemia por deficiência de ferro). Essa opção de tratamento tem sido utilizada em pacientes adultos com anemia ferropriva que não obtiveram resposta satisfatória à terapia com medicação via oral.
Considere que, para o preparo de medicamento, é utilizada uma solução de hidróxido de ferro(III) contendo 0 vírgula 0 0 1 mol por litro de íons F e elevado a início expoente, 3 mais, fim expoente e com produto de solubilidade de 'K' subscrito s é igual a 1 vezes 10 elevado a menos 39. Com base nessas informações, responda aos itens a seguir.
a ) Qual é a equação química que representa a dissociação do hidróxido de ferro(III)?
Resposta: F e abre parênteses O H fecha parênteses subscrito 3 abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas F e elevado a início expoente, 3 mais, fim expoente abre parênteses a q fecha parênteses mais 3 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
b ) Qual é a concentração de íons hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses nessa solução?
Resposta: 'K' subscrito s é igual a abre colchetes F e elevado a início expoente, 3 mais, fim expoente fecha colchetes vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes elevado ao cubo implica em 1 vezes 10 elevado a menos 39 é igual a 1 vezes 10 elevado a menos 3 vezes abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes elevado ao cubo implica em abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a início de raiz; início do radicando, 1 vezes 10 elevado a menos 36, fim do radicando, índice 3; fim de raiz é igual a 1 vezes 10 elevado a menos 12 portanto abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a 1 vezes 10 elevado a menos 12 mol por litro
c ) Qual é o pH da solução?
Resposta: p O H é igual a menos log abre colchetes O H elevado a início expoente, menos, fim expoente fecha colchetes é igual a menos log abre colchetes 1 vezes 10 elevado a menos 12 fecha colchetes é igual a 12 p H mais p O H é igual a 14 implica em p H é igual a 14 menos 12 portanto p H é igual a 2
Página 376
5. O produto de solubilidade do brometo de potássio abre parênteses K B r fecha parênteses é de 1 vírgula 7 vezes 10 elevado a menos 10. Considerando que a solução aquosa esteja saturada, qual é a concentração aproximada de íons K elevado a início expoente, mais, fim expoente nessa solução?
a ) 8 vírgula 5 vezes 10 elevado a menos 5 mol por litro
b ) 2 vírgula 6 vezes 10 elevado a menos 5 mol por litro
c ) 1 vírgula 7 vezes 10 elevado a menos 10 mol por litro
d ) 1 vírgula 3 vezes 10 elevado a menos 5 mol por litro
e ) 8 vírgula 5 vezes 10 elevado a menos 3 mol por litro
Resposta: Alternativa
d.
'K' s é igual a abre colchetes K mais fecha colchetes vezes abre colchetes B r menos fecha colchetes implica em 'K' s é igual a abre parênteses x fecha parênteses vezes abre parênteses x fecha parênteses implica em
implica em 1 vírgula 7 vezes 10 menos 10 é igual a x 2
portanto x é aproximadamente igual a 1 vírgula 3 vezes 10 menos 5 mol por litro
6. A azida de chumbo(II) abre parênteses P b abre parênteses N subscrito 3 fecha parênteses subscrito 2 fecha parênteses é um sólido branco muito sensível ao impacto, e é utilizada como explosivo em detonadores. Em solução aquosa a 18 graus Celsius, essa substância tem solubilidade de aproximadamente 0 vírgula 23 grama por litro. Considerando a equação química de dissociação dessa substância, P b abre parênteses N subscrito 3 fecha parênteses subscrito 2 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima P b elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 N subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses, e as massas molares do Pb é igual a 207 gramas por mol e N é igual a 14 gramas por mol, qual é o produto de solubilidade para esse composto, aproximadamente?
a ) 6 vezes 10 elevado a menos 7
b ) 5 vezes 10 elevado a menos 10
c ) 2 vezes 10 elevado a menos 9
d ) 1 vezes 10 elevado a menos 6
e ) 4 vezes 10 elevado a menos 3
Resposta: Alternativa c. Resolução nas Orientações para o professor.
7. As constantes do produto de solubilidade do P b I subscrito 2 e do M g abre parênteses O H fecha parênteses subscrito 2 são, respectivamente, 8 vírgula 4 vezes 10 elevado a menos 9 e 4 vezes 10 elevado a menos 12, ambos a 25 graus Celsius.
a ) Qual é a solubilidade do P b I subscrito 2, a 25 graus Celsius, em mol por litro?
b ) Qual é a solubilidade do M g abre parênteses O H fecha parênteses subscrito 2, a 25 graus Celsius, em mol por litro?
c ) Qual das duas substâncias é a mais solúvel?
d ) Qual é o p H da solução de M g abre parênteses O H fecha parênteses subscrito 2?
Respostas e resoluções nas Orientações para o professor.
8. O sulfato de bário abre parênteses B a S O subscrito 4 fecha parênteses é utilizado principalmente em contraste artificial nos procedimentos radiográficos do sistema digestório. A solubilidade do composto B a S O subscrito 4, em água, é de 9 vírgula 2 vezes 10 elevado a menos 3 grama por litro. Calcule o valor aproximado do produto solubilidade desse composto, considerando a massa molar de 233 gramas por mol.
a ) 8 vírgula 3 vezes 10 elevado a menos 23
b ) 1 vírgula 6 vezes 10 elevado a menos 9
c ) 7 vírgula 1 vezes 10 elevado a menos 23
d ) 2 vírgula 0 vezes 10 elevado a menos 2
e ) 3 vírgula 4 vezes 10 elevado a menos 5
Resposta: Alternativa
b.
x é igual a início de fração, numerador: 9 vírgula 2 vezes 10 elevado a menos 3, denominador: M início subscrito, B a S O subscrito 4, fim subscrito, fim de fração é igual a início de fração, numerador: 9 vírgula 2 vezes 10 elevado a menos 3, denominador: 233, fim de fração underscore é aproximadamente igual a 3 vírgula 95 vezes 10 elevado a menos 5
portanto x é aproximadamente igual a 3 vírgula 95 vezes 10 elevado a menos 5 mol por litro
'K' subscrito s é igual a abre colchetes B a elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes S O subscrito 4 elevado a início expoente, 2 menos, fim expoente fecha colchetes implica em 'K' subscrito s é igual a abre parênteses x fecha parênteses vezes abre parênteses x fecha parênteses implica em
implica em 'K' subscrito s é igual a abre parênteses 3 vírgula 95 vezes 10 elevado a menos 5 fecha parênteses elevado ao quadrado portanto 'K' subscrito s é aproximadamente igual a 1 vírgula 6 vezes 10 elevado a menos 9
9. Em uma indústria farmacêutica, a pureza de um medicamento pode ser garantida pela ausência de íons provenientes de impurezas durante o preparo da solução do medicamento. Explique como o conceito de produto de solubilidade abre parênteses 'K' subscrito s fecha parênteses pode ser utilizado para precipitar impurezas da solução e garantir a pureza do fármaco.
Resposta: Ao manipular as condições da solução e adicionar reagentes apropriados, é possível precipitar impurezas indesejadas, assegurando que o produto final atenda aos padrões de qualidade e segurança exigidos.
10. Durante a preparação de um bolo, o bicarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses é frequentemente utilizado como agente fermentador. No entanto, a eficácia da hidrólise desse composto pode ser influenciada pela composição dos ingredientes da receita. Como diferentes ingredientes da receita (como ácidos, açúcares e gordura) podem afetar a hidrólise do bicarbonato de sódio? Quais fatores podem aumentar ou diminuir a produção de gás carbônico abre parênteses CO subscrito 2 fecha parênteses durante o processo de fermentação?
Resposta: A eficácia do bicarbonato de sódio como agente fermentador em receitas de bolo é fortemente influenciada pela presença de ácidos, pois, ao reagir com eles, forma-se ácido carbônico, que se decompõe formando dióxido de carbono.
11. Sabendo que o produto de solubilidade abre parênteses 'K' subscrito s fecha parênteses do A g C l é 1 vírgula 8 vezes 10 elevado a menos 10, qual das alternativas a seguir apresenta, aproximadamente, a concentração em mol por litro de íons prata abre parênteses A g elevado a início expoente, mais, fim expoente fecha parênteses em uma solução saturada?
a ) 1 vírgula 8 vezes 10 elevado a menos 5
b ) 1 vírgula 3 vezes 10 elevado a menos 5
c ) 1 vírgula 8 vezes 10 elevado a menos 10
d ) 3 vírgula 6 vezes 10 elevado a menos 10
e ) 1 vírgula 8 vezes 10 elevado a menos 55
Resposta: Alternativa
b.
'K' subscrito s é igual a abre colchetes A g elevado a início expoente, mais, fim expoente fecha colchetes vezes abre colchetes C l elevado a início expoente, menos, fim expoente fecha colchetes implica em 'K' subscrito s é igual a abre parênteses x fecha parênteses vezes abre parênteses x fecha parênteses implica em
x é igual a início de raiz quadrada; 1 vírgula 8 vezes 10 elevado a menos 10 fim de raiz quadrada portanto x é aproximadamente igual a 1 vírgula 3 vezes 10 elevado a menos 5 mol por litro
12. Dois compostos muito utilizados para tratar a água de piscinas são o cloreto de cálcio abre parênteses C a C l subscrito 2 fecha parênteses o carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses . Considerando a hidrólise salina, qual desses compostos é responsável por alterar o p H da água?
Resposta: O composto que altera o p H é o carbonato de cálcio, pois ele é um sal proveniente de uma base forte e um ácido fraco, enquanto o cloreto de cálcio é proveniente de ácido e base forte.
13. A constante do produto de solubilidade abre parênteses 'K' subscrito s fecha parênteses de um sal pouco solúvel em água é medida em diferentes temperaturas, com os seguintes resultados:
- 'K' subscrito s a 25 graus Celsius é igual a 1 vírgula 0 vezes 10 elevado a menos 6
- 'K' subscrito s a 50 graus Celsius é igual a 4 vírgula 0 vezes 10 elevado a menos 6
- 'K' subscrito s a 75 graus Celsius é igual a 9 vírgula 0 vezes 10 elevado a menos 6
Considerando os valores de 'K' subscrito s nas diferentes temperaturas, qual das alternativas a seguir melhor descreve o comportamento do sal?
a ) O aumento da temperatura reduz a energia do processo de dissolução, aumentando a solubilidade do sal.
b ) A variação dos valores de 'K' subscrito s sugere que a dissolução do sal é um processo exotérmico.
c ) A solubilidade do sal permanece constante, pois a variação de 'K' subscrito s é compensada pela mudança na entalpia de dissolução.
Página 377
d ) A variação de 'K' subscrito s indica que a dissolução do sal se torna menos espontânea com o aumento da temperatura.
e ) O valor crescente de 'K' subscrito s indica que a dissolução do sal é favorecida pelo aumento da temperatura, sugerindo que o processo é endotérmico.
Resposta: Alternativa e.
14. O carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses é um sal pouco solúvel em água, presente na formação de estalactites e estalagmites em cavernas. A solubilidade do C a C O subscrito 3 em água é descrita pela constante do produto de solubilidade abre parênteses 'K' subscrito s fecha parênteses, cujo valor é 8 vírgula 7 vezes 10 elevado a menos 9 a 25 graus Celsius.

Quando o C a C O subscrito 3 se dissolve, o seguinte equilíbrio se estabelece:
C a C O subscrito 3 abre parênteses s fecha parênteses duas meias setas que apontam em direções opostas C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
Se uma amostra de água em uma caverna contém uma concentração de íons cálcio abre parênteses C a elevado a início expoente, 2 mais, fim expoente fecha parêntesesigual a 2 vírgula 0 vezes 10 elevado a menos 3 mol por litro, qual é a concentração máxima possível de íons carbonato abre parênteses C O subscrito 3 elevado a início expoente, 2 menos, fim expoente fecha parênteses que pode coexistir nessa solução sem que ocorra precipitação de C a C O subscrito 3?
a ) 4 vírgula 35 vezes 10 elevado a menos 6 mol por litro
b ) 1 vírgula 70 vezes 10 elevado a menos 6 mol por litro
c ) 8 vírgula 74 vezes 10 elevado a menos 6 mol por litro
d ) 2 vírgula 0 0 vezes 10 elevado a menos 6 mol por litro
e ) 3 vírgula 56 vezes 10 elevado a menos 6 mol por litro
Resposta: Alternativa
a.
'K' subscrito s é igual a abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes vezes abre colchetes C O subscrito 3 elevado a início expoente, 2 menos, fim expoente fecha colchetes implica em
implica em 8 vírgula 7 vezes 10 elevado a menos 9 é igual a 2 vírgula 0 vezes 10 elevado a menos 3 mol por litro vezes abre colchetes C O subscrito 3 elevado a início expoente, 2 menos, fim expoente fecha colchetes portanto abre colchetes C O subscrito 3 elevado a início expoente, 2 menos, fim expoente fecha colchetes é igual a 4 vírgula 35 vezes 10 elevado a menos 6 mol por litro
15. Um aquarista percebeu que a água de seu aquário estava com um p H mais elevado do que o normal, o que pode ser prejudicial para os peixes. Ele sabe que a alcalinidade da água pode estar relacionada com a dissolução de certos sais presentes no aquário. As equações químicas a seguir apresentam possíveis reações dos sais com a água do aquário:
N H subscrito 4 C l abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas
duas meias setas que apontam em direções opostas N H subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
N a C l abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas N a elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
N a subscrito 2 C O subscrito 3 abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas
duas meias setas que apontam em direções opostas 2 N a elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
K subscrito 2 S O subscrito 4 abre parênteses s fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas 2 K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
Com base nas reações fornecidas, qual das alternativas a seguir melhor explica por que o pH da água do aquário aumentou?
a ) A presença de N H subscrito 4 C l na água está causando um aumento na concentração de íons H sobrescrito mais, o que eleva o p H.
b ) A reação do K subscrito 2 S O subscrito 4 com a água está produzindo íons O H elevado a início expoente, menos, fim expoente, aumentando a alcalinidade da água.
c ) A hidrólise do N a subscrito 2 C O subscrito 3 está produzindo íons O H elevado a início expoente, menos, fim expoente, o que eleva o p H da água do aquário.
d ) O N a C l está neutralizando a água, aumentando o p H em virtude da formação de N a elevado a início expoente, mais, fim expoente e C l elevado a início expoente, menos, fim expoente.
e ) A presença de S O subscrito 4 elevado a início expoente, 2 menos, fim expoente está causando a liberação de H sobrescrito mais, o que reduz o p H da água.
Resposta: Alternativa c.
RETOME O QUE ESTUDOU
Refletindo sobre o que estudou nesta unidade, responda às questões a seguir.
1. Quando uma reação química reversível entra em equilíbrio?
2. Cite as diferenças entre a definição de ácidos e bases segundo a teoria de Arrhenius e a teoria Brønsted-Lowry.
3. Em um minuto, escreva com suas palavras em um pedaço de papel o que é uma hidrólise. Em seguida, entregue esse papel ao professor.
Respostas nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
3. Em um minuto, anote com suas palavras o que é uma hidrólise e compartilhe essa anotação com o professor.
Resposta: Espera-se que os estudantes expliquem que hidrólise é uma reação química na qual a água possibilita a quebra ou a dissociação de uma substância, levando à formação de ácidos, bases e/ou íons.
Página 378
MAISQUESTÕES
1. (UEPG-PR) Dada a seguinte reação em equilíbrio:
C O subscrito 2 abre parênteses 'g' fecha parênteses mais 2 L i O H abre parênteses 's' fecha parênteses duas meias setas que apontam em direções opostas L i subscrito 2 C O subscrito 3 abre parênteses 's' fecha parênteses mais H subscrito 2 O abre parênteses 'g' fecha parênteses
Acerca do deslocamento do equilíbrio dessa reação, segundo o Princípio de Le Chatelier, assinale o que for correto.
01 ) Se adicionarmos mais CO subscrito 2 no meio, o equilíbrio se deslocará no sentido dos produtos.
02 ) A adição do L i O H deslocará o equilíbrio no sentido dos produtos.
04 ) O aumento da pressão deslocará o equilíbrio no sentido dos reagentes.
08 ) Se retiramos CO subscrito 2 do meio, o equilíbrio se deslocará no sentido dos reagentes, de modo a repor a retirada do CO subscrito 2.
Resposta: Soma: 01 mais 0 8 é igual a 9.
2. (UEM-PR) Os rins excretam continuamente substâncias pouco solúveis, como oxalato de cálcio abre parênteses C a C subscrito 2 O subscrito 4 fecha parênteses e fosfato de cálcio abre parênteses C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 fecha parênteses, que apresentam, a 25 graus Celsius, K subscrito p s de 2 vírgula 0 vezes 10 elevado a menos 9 e 1 vírgula 0 vezes 10 elevado a menos 28, respectivamente. Quando a urina se torna saturada dessas substâncias, começam os processos de cristalização e formação de cálculos renais. Sobre essas informações e conceitos do produto de solubilidade, assinale o que for correto.
01 ) Em solução saturada de fosfato de cálcio a relação entre as concentrações dos íons cálcio e fosfato dissolvidos é dada por 2 abre colchetes C a elevado a início expoente, 2 mais, fim expoente fecha colchetes é igual a 3 abre colchetes P O subscrito 4 elevado a início expoente, 3 menos, fim expoente fecha colchetes.
02 ) O oxalato de cálcio é 20 quintilhões de vezes mais solúvel que o fostato de cálcio.
04 ) A 25 graus Celsius, a solubilidade do C a C subscrito 2 O subscrito 4 é dada por início de raiz quadrada; 2 vírgula 0 vezes 10 elevado a menos 9 fim de raiz quadrada .
08 ) Com aumento do consumo de alimentos ricos em cálcio iônico, o princípio de Le Chatelier prevê o aumento da cristalização desses sais através do efeito do íon comum.
16 ) Nos equilíbrios químicos de solubilidade, a velocidade de dissolução é menor que a velocidade de precipitação, por isso há sempre a presença de cristais dessas substâncias de baixa solubilidade.
Resposta: Soma: 01 mais 0 4 mais 0 8 é igual a 13. Resolução nas Orientações para o professor.
3. (UERJ) Considere a reação de equilíbrio químico representada abaixo, que ocorre na atmosfera e envolve dois óxidos de nitrogênio:
N subscrito 2 O subscrito 4 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas 2 N O subscrito 2 abre parênteses g fecha parênteses
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
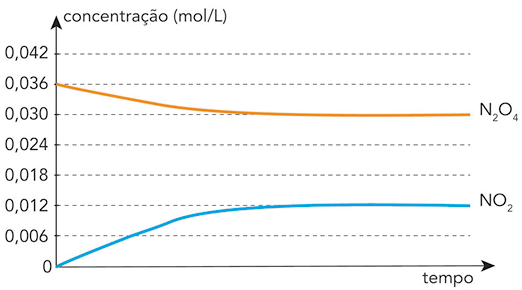
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
a ) 3 vírgula 2 vezes 10 elevado a menos 3
b ) 4 vírgula 8 vezes 10 elevado a menos 3
c ) 3 vírgula 3 vezes 10 elevado a menos 1
d ) 4 vírgula 0 vezes 10 elevado a menos 1
Resposta: Alternativa b. Resolução nas Orientações para o professor.
4. (UEA-AM) Considere a seguinte reação genérica, elementar e reversível, na qual todas as substâncias participantes se encontram em solução aquosa:
a A mais b B duas meias setas que apontam em direções opostas c C mais d D
A constante de equilíbrio abre parênteses K subscrito equilíbrio fecha parênteses dessa reação é dada por:
K subscrito equilíbrio é igual a início de fração, numerador: abre colchetes C fecha colchetes elevado a c vezes abre colchetes D fecha colchetes elevado a d, denominador: abre colchetes A fecha colchetes elevado a a vezes abre colchetes B fecha colchetes elevado a b, fim de fração
No estado de equilíbrio dinâmico, a concentração dos produtos é maior do que a concentração dos reagentes se
a ) K subscrito equilíbrio é maior do que 1
b ) K subscrito equilíbrio é igual a 1
c ) K subscrito equilíbrio é igual a 0
d ) K subscrito equilíbrio é menor do que 0
e ) K subscrito equilíbrio é menor do que 1
Resposta: Alternativa a.
Página 379
5. (Udesc) Para promover a manutenção de diversos tipos de espécies, a água do mar deve ser ligeiramente alcalina, com seu p H entre 7,4 e 8,5. Isto ocorre por conta de diversas reações relacionadas ao gás carbônico e ao carbonato de cálcio, que tendem a manter o pH constante. Essas reações químicas estão representadas a seguir:
(i) CO subscrito 2 abre parênteses g fecha parênteses duas meias setas que apontam em direções opostas C O subscrito 2 abre parênteses a q fecha parênteses
(ii) C O subscrito 2 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses
(iii) H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
(iv) H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
(v) C a C O subscrito 3 abre parênteses s fecha parênteses duas meias setas que apontam em direções opostas C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
Sobre essas reações químicas, analise as proposições.
I ) O H subscrito 2 C O subscrito 3 em solução aquosa dissocia-se formando os íons O H elevado a início expoente, menos, fim expoente e C O subscrito 3 elevado a início expoente, 2 menos, fim expoente.
II ) As reações apresentadas nas cinco equações ocorrem simultaneamente e configuram uma solução tampão.
III ) Segundo os processos acima, infere-se que o p H da água é levemente ácido.
IV ) Caso haja excesso de íons H sobrescrito mais o sistema se deslocará no sentido que produza C O subscrito 3 elevado a início expoente, 2 menos, fim expoente.
V ) Na equação i ocorre o equilíbrio físico entre o gás carbônico dissolvido e o gasoso.
VI ) O aumento de CO subscrito 2 é prejudicial para diversos seres marinhos por provocar a acidificação desse ambiente, com consequente dissolução de sistemas vivos, contendo carbonato de cálcio em sua composição.
Assinale a alternativa correta.
a ) Somente as afirmativas I, II e VI são verdadeiras.
b ) Somente as afirmativas II, V e VI são verdadeiras.
c ) Somente as afirmativas I, III, V e VI são verdadeiras.
d ) Somente as afirmativas III, IV e V são verdadeiras.
e ) Somente as afirmativas III e V são verdadeiras.
Resposta: Alternativa b. Resolução nas Orientações para o professor.
6. (Unifesp-SP) O ácido sulfúrico está entre as principais matérias-primas para a indústria química, e uma das etapas de sua produção envolve a conversão de dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses a trióxido de enxofre abre parênteses S O subscrito 3 fecha parênteses, segundo a reação:
S O subscrito 2 abre parênteses 'g' fecha parênteses mais 1 meio O subscrito 2 abre parênteses 'g' fecha parênteses duas meias setas que apontam em direções opostas S O subscrito 3 abre parênteses 'g' fecha parênteses
O gráfico que se segue mostra a variação do rendimento dessa conversão em função da temperatura.
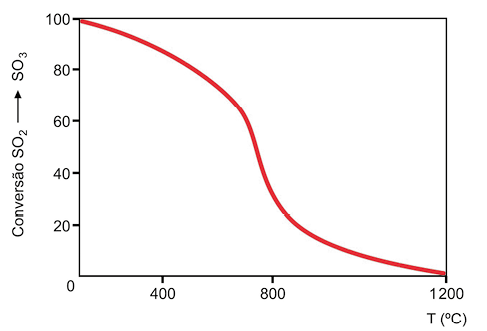
(Mariana de M. V. M. Souza. Processos inorgânicos, 2012.)
a ) Escreva a expressão da constante de equilíbrio K subscrito c da reação entre dióxido de enxofre e oxigênio molecular formando trióxido de enxofre numa dada temperatura. Escreva a equação balanceada da reação que representa a obtenção de ácido sulfúrico a partir da reação entre trióxido de enxofre e água.
b ) Com base no gráfico de rendimento da conversão de S O subscrito 2 em S O subscrito 3 em função da temperatura e no princípio de Le Châtelier, determine se essa reação é exotérmica ou endotérmica. Com base no princípio de Le Châtelier, informe o efeito que um aumento da pressão exercida sobre o sistema químico inicialmente em equilíbrio terá sobre o rendimento de S O subscrito 3 formado quando for estabelecido o novo equilíbrio.
Respostas e resoluções nas Orientações para o professor.
Página 380
7. (UFRGS-RS) Para o ácido nitroso, H N O subscrito 2, a constante de acidez vale 4 vírgula 7 vezes 10 elevado a menos 4.
A respeito desse ácido, considere as seguintes afirmações.
I ) Uma solução aquosa de ácido nitroso tem p H alcalino.
II ) A adição de nitrito de sódio à solução irá diminuir o seu p H.
III ) Uma solução 1 vírgula 0 mol L elevado a menos 1 de ácido nitroso exibirá uma concentração de H elevado a início expoente, mais, fim expoente de cerca de 21 vírgula 6 milimoles.
Quais estão corretas?
a ) Apenas I.
b ) Apenas II.
c ) Apenas III.
d ) Apenas II e III.
e ) I, II e III.
Resposta: Alternativa c. Resolução nas Orientações para o professor.
8. (Fuvest-SP) Um estudante (FV), intrigado com a escala de p H entre 0 e 14, perguntou a um sistema de inteligência artificial (IA) sobre a possibilidade de existirem valores negativos de p H, conforme descrito na figura:

A resposta fornecida pelo sistema de inteligência está
a ) errada, pois p H negativo refere-se à concentração de H sobrescrito mais maior que 1 mol por litro, resultando em um valor de p H menor que zero.
b ) correta, pois p H negativo refere-se à concentração de O H elevado a início expoente, menos, fim expoente maior que 1 mol por litro, resultando em um valor de p H menor que zero.
c ) correta, assim como é possível existir p H maior que 14 em soluções com concentração de H sobrescrito mais maior que 14 mol por litro.
d ) errada, pois a escala de p H é fixa entre 0 e 14, independentemente da concentração de H sobrescrito mais.
e ) correta, pois o p H tende a diminuir e tornar-se negativo em soluções com concentração de íons H sobrescrito mais extremamente baixa.
Resposta: Alternativa a. Resolução nas Orientações para o professor.
9. (Unesp) A "barrilha leve", carbonato de sódio abre parênteses N a subscrito 2 C O subscrito 3 fecha parênteses, é um produto de grande uso industrial, sendo também utilizado no tratamento da água de piscinas. A obtenção da barrilha leve envolve o processo Solvay, no qual dióxido de carbono gasoso abre parênteses CO subscrito 2 fecha parênteses é borbulhado em uma solução aquosa que contém amônia abre parênteses N H subscrito 3 fecha parênteses e cloreto de sódio abre parênteses N a C l fecha parênteses, de acordo com a reação:
C O subscrito 2 abre parênteses 'g' fecha parênteses mais N H subscrito 3 abre parênteses a q fecha parênteses mais N a sobrescrito mais abre parênteses a q fecha parênteses mais C l sobrescrito menos abre parênteses a q fecha parênteses mais
mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita N H subscrito 4 sobrescrito mais abre parênteses a q fecha parênteses mais H C O subscrito 3 sobrescrito menos abre parênteses a q fecha parênteses mais
mais N a sobrescrito mais abre parênteses a q fecha parênteses mais C l esobrescrito menos abre parênteses a q fecha parênteses
A solução iônica resultante desse processo é resfriada de modo que apenas o bicarbonato de sódio, N a H C O subscrito 3 abre parênteses s fecha parênteses, forma um precipitado, e os demais íons permanecem em solução. O N a H C O subscrito 3 abre parênteses s fecha parênteses é separado da mistura por filtração e submetido a aquecimento, decompondo-se e originando o carbonato de sódio, N a subscrito 2 C O subscrito 3 abre parênteses s fecha parênteses.
Em princípio, como resultado do processo Solvay, seria possível obter várias substâncias iônicas por precipitação. Entretanto, nessa etapa, somente o bicarbonato de sódio sólido, N a H C O subscrito 3 abre parênteses s fecha parênteses, se separa como precipitado. Isso ocorre porque, dentre as demais substâncias possíveis de serem formadas no processo Solvay, N a H C O subscrito 3 abre parênteses s fecha parênteses é a substância iônica que apresenta a
a ) menor temperatura de fusão.
b ) menor pressão de vapor.
c ) maior temperatura de ebulição.
d ) menor solubilidade em água.
e ) maior densidade.
Resposta: Alternativa d.
10. (UECE) Se o p H do estômago é igual a 2 e o p H do suco de laranja é igual a 4, considerando a relação das concentrações de seus íons hidrônios, é correto dizer que a concentração
a ) do suco de laranja é 1000 vezes menor que a do estômago.
b ) do estômago é 100 vezes maior que a do suco de laranja.
c ) do suco de laranja é duas vezes maior que a do estômago.
d ) do estômago é 10 vezes maior que a do suco de laranja.
Resposta: Alternativa b. Resolução nas Orientações para o professor.
11. (UFRGS-RS) O ácido nitroso, H N O subscrito 2, é um ácido fraco com K subscrito A é igual a 4 vírgula 3 vezes 10 elevado a menos 4.
A respeito de uma solução aquosa de N a N O subscrito 2, considere as seguintes afirmações.
Página 381
I ) É uma solução de p H menor que 7.
II ) É mais alcalina do que uma solução aquosa de N a C l.
III ) É mais ácida do que uma solução aquosa de N a O H de mesma concentração.
Quais estão corretas?
a ) Apenas I.
b ) Apenas II.
c ) Apenas I e III.
d ) Apenas II e III.
e ) I, II e III.
Resposta: Alternativa d.
12. (Unesp) Água de cal é o nome dado à solução aquosa saturada de cal hidratada [hidróxido de cálcio, C a abre parênteses O H fecha parênteses subscrito 2]. A concentração dessa solução saturada a 20 graus Celsius é de 1 vírgula 7 grama por litro. A partir desse dado, estima-se que o valor da constante do produto de solubilidade em água abre parênteses K subscrito p s fecha parênteses nessa temperatura é próximo de
a ) 8 vezes 10 elevado a menos 6.
b ) 4 vezes 10 elevado a menos 6.
c ) 5 vezes 10 elevado a menos 7.
d ) 8 vezes 10 elevado a menos 4.
e ) 5 vezes 10 elevado a menos 5.
Resposta: Alternativa e. Resolução nas Orientações para o professor.
13. (Fuvest-SP) Cálculos renais, conhecidos popularmente por "pedras nos rins", consistem principalmente em oxalato de cálcio, C a C subscrito 2 O subscrito 4, espécie cuja constante de solubilidade abre parênteses K subscrito p s fecha parênteses é de aproximadamente 2 vezes 10 elevado a menos 9. Os íons oxalato, presentes em muitos vegetais, reagem com os íons cálcio para formar oxalato de cálcio, que pode gradualmente se acumular nos rins. Supondo que a concentração de íons cálcio no plasma sanguíneo seja de cerca de 5 vezes 10 elevado a menos 3 mol por litro, qual seria a concentração mínima, em mol por litro, de íons oxalato para que C a C subscrito 2 O subscrito 4 precipitasse?
a ) 4 vezes 10 elevado a menos 13
b ) 10 vezes 10 elevado a menos 12
c ) 4 vezes 10 elevado a menos 7
d ) 2 vírgula 5 vezes 10 elevado a menos 6
e ) 1 vezes 10 elevado a menos 5
Note e adote:
Desconsidere a presença de quaisquer outros íons e considere que a concentração no plasma é determinante para a precipitação do oxalato.
Resposta: Alternativa c. Resolução nas Orientações para o professor.
14. (UFRGS-RS) Uma suspensão de sulfato de bário pode ser usada como agente de contraste em exames de raios-X. O sulfato de bário é um sal pouco solúvel, com constante do produto de solubilidade 1 vírgula 1 vezes 10 elevado a menos 10.
Em relação a uma solução aquosa saturada desse sal, contendo uma certa quantidade de sal sólido, não dissolvido, são feitas as seguintes afirmações.
I ) A adição de nitrato de bário diminui a quantidade de sólido não dissolvido.
II ) A adição de sulfato de sódio aumenta a quantidade de sódio não dissolvido.
III ) Uma reação reversível, na qual a dissolução do sal é exatamente contrabalançada pela sua precipitação, é estabelecida nessa situação.
Quais estão corretas?
a ) Apenas I.
b ) Apenas II.
c ) Apenas I e III.
d ) Apenas II e III.
e ) I, II e III.
Resposta: Alternativa d.
15. (ITA-SP) Considere 1 litro de solução aquosa preparada por meio da adição de 1 mol de um ácido monoprótico hipotético, 1 mol de sua base conjugada e 0 vírgula 82 mol de uma base forte. Sabendo que a constante de ionização do ácido é igual a 10 elevado a menos 4, assinale a alternativa que melhor representa o p H da solução resultante.
a ) abre parênteses lacuna fecha parênteses 4.
b ) abre parênteses lacuna fecha parênteses 5.
c ) abre parênteses lacuna fecha parênteses 6.
d ) abre parênteses lacuna fecha parênteses 7.
e ) abre parênteses lacuna fecha parênteses 8.
Resposta: Alternativa b. Resolução nas Orientações para o professor.
16. (UECE) As letras p H aparecem quase todos os dias em anúncios de xampus, produtos para a pele e outros bens de consumo. Para entender esses anúncios, é necessário entender a importância do p H que, em termos mais simples, é um número que varia entre 0 e 14 para indicar a acidez de uma solução. Em relação ao p H, assinale a afirmação verdadeira.
a ) Quanto maior a concentração de H sobrescrito mais, maior é o p H.
b ) Uma amostra de chuva com p H 4,0 é dez vezes mais ácida do que chuva com p H 5,0.
c ) Na escala de p H, se a acidez diminui, o número de p H também diminui.
d ) Quando o p H aumenta em uma unidade, a concentração de H sobrescrito mais aumenta em um fator de dez.
Resposta: Alternativa b. Resolução nas Orientações para o professor.
