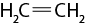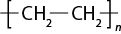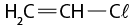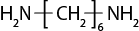Página 382
UNIDADE 6
AS SUBSTÂNCIAS E O MEIO AMBIENTE
Os tubos apresentados na fotografia da próxima página são feitos de material metálico, contudo passaram por um equipamento para receber uma camada de material polimérico em sua superfície. Esse tipo de medida tem o objetivo de proteger o tubo metálico do ambiente em que ficará exposto: ao ar livre, sob o solo ou embaixo da água. Nesses ambientes, é possível que o tubo fique sujeito ao contato com água e oxigênio, o que pode ocasionar o processo de corrosão. Caso ele seja feito de ferro e não tenha uma camada de proteção, esse processo pode ser percebido pelo aparecimento de um material de coloração escura e/ou alaranjada em sua superfície, que consiste na formação de óxido de ferro.
Diversos fatores podem influenciar a taxa de desenvolvimento do processo de corrosão, tais quais a quantidade de água e oxigênio no ambiente, a presença de outras substâncias, como ácidos e bases, além da área superficial do material. Por se tratar de um processo indesejável, uma das soluções para reduzir sua taxa de desenvolvimento, ou mesmo impedi-lo, consiste na diminuição de sua área superficial pela aplicação de uma camada protetora.
Esse fenômeno e a medida utilizada para impedi-lo retratam os temas que serão abordados nesta unidade. Nela, você vai estudar as características e aplicações dos materiais poliméricos, dos ácidos, bases, sais e óxidos, bem como conhecer alguns fatores que influenciam a rapidez das transformações químicas.
a ) Você já identificou, em seu cotidiano, algum método parecido com a da fotografia para impedir ou diminuir o desenvolvimento de alguma reação química? Mencione um exemplo.
b ) Você considera importante conhecer a taxa com que as reações químicas se desenvolvem e os fatores que as influenciam? Explique sua resposta.
Respostas nas Orientações para o professor.
Nesta unidade, vamos estudar...
- ácidos e bases de Arrhenius, Brønsted-Lowry e Lewis;
- sais de Arrhenius;
- óxidos;
- taxa de desenvolvimento das reações químicas;
- fatores que influenciam a rapidez das reações químicas;
- polímeros naturais e sintéticos;
- reação de polimerização.
Página 383

Página 384
CAPÍTULO21
Ácidos, bases, sais e óxidos
Chuva ácida: causa, consequências e possíveis soluções
Confira as fotografias a seguir e responda às questões 1 e 2.


1. Como essas duas fotografias podem estar relacionadas entre si?
Resposta pessoal. Espera-se que os estudantes relacionem as condições climáticas extremas irregulares e a chuva ácida com a poluição atmosférica.
2. Quais são as atitudes do ser humano que colaboram para causar os problemas mostrados nas fotografias?
Resposta pessoal. Os estudantes podem associar a poluição e a chuva ácida com a emissão de gases tóxicos na atmosfera por meio da combustão de combustíveis fósseis, pelo consumo de produtos industrializados etc.
O dióxido de carbono abre parênteses CO subscrito 2 fecha parênteses presente na atmosfera dissolve-se na água abre parênteses H subscrito 2 O fecha parênteses precipitada e, por se tratar de um óxido ácido, leva a chuva, a neblina ou a neve a ficar ácida. Mesmo em ambientes sem poluição, a água da chuva é levemente ácida, com p H por volta de 5,6. Entretanto, a queima de combustíveis fósseis de veículos, indústrias e usinas termelétricas aumenta a quantidade de dióxido de carbono e outros óxidos na atmosfera, causando o aumento da acidez da chuva.
A gasolina e o óleo diesel, por exemplo, contêm enxofre abre parênteses S fecha parênteses, que, por meio de sua combustão, transforma-se em dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses. Na atmosfera, ele pode reagir tanto com a água, formando o ácido sulfuroso abre parênteses H subscrito 2 S O subscrito 3 fecha parênteses, como com o gás oxigênio abre parênteses O subscrito 2 fecha parênteses, originando o trióxido de enxofre abre parênteses S O subscrito 3 fecha parênteses:
S O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 2 S O subscrito 3 abre parênteses a q fecha parênteses
2 S O subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 S O subscrito 3 abre parênteses g fecha parênteses
O S O subscrito 3, por sua vez, pode reagir com água, formando o ácido sulfúrico abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses.
- Intempérie:
- condições climáticas extremas, como vento forte, temporal, seca etc.↰
Página 385
Outras substâncias que também reagem na atmosfera, dando origem à chuva ácida, são os óxidos de nitrogênio. Leia o trecho da matéria a seguir.
O que é chuva ácida e o que ela faz?
O fenômeno tem efeitos na saúde humana e no meio ambiente. Embora possa ter causas naturais, a maior parte é gerada pela atividade humana.
A chuva ácida é um termo amplo que, como o nome sugere, inclui qualquer forma de precipitação com componentes ácidos (como ácido sulfúrico ou ácido nítrico) que cai no solo a partir da atmosfera na forma úmida ou seca. Isto pode incluir chuva, neve, neblina, granizo ou até poeira ácida, segundo define a Agência de Proteção Ambiental dos Estados Unidos (EPA).
O que causa a chuva ácida?
Segundo a agência americana, a chuva ácida ocorre quando dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses e óxidos de nitrogênio abre parênteses N O X fecha parênteses são emitidos para a atmosfera e transportados por correntes de vento e ar.
"O S O subscrito 2 e o N O X reagem com água, oxigênio e outros produtos químicos para formar ácidos sulfúrico e nítrico. Estes, então, se misturam com água e outros materiais antes de cair no chão", explica a organização.
[…]
O QUE é chuva ácida e o que ela faz? National Geographic, 13 dez. 2022. Disponível em: https://s.livro.pro/bqpk9y. Acesso em: 27 ago. 2024.
Professor, professora: Os óxidos de nitrogênios podem ser representados por N O X, N O subscrito X ou N o x. O mais utilizado é o N O subscrito X como adotado nesta obra. Enfatize que não é a mesma coisa que o N O X – números de oxidação, apresentado no capítulo 14, apesar de ter a mesma leitura também.
Os óxidos de nitrogênio abre parênteses N O subscrito X fecha parênteses podem ser formados durante a descarga elétrica em uma tempestade. A energia elétrica provoca a reação entre os gases nitrogênio abre parênteses N subscrito 2 fecha parênteses e oxigênio, formando o monóxido de nitrogênio abre parênteses N O fecha parênteses.
O monóxido de nitrogênio, com o dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses liberado na queima de combustíveis fósseis, reage na atmosfera dando origem a outros ácidos, como o ácido nitroso abre parênteses H N O subscrito 2 fecha parênteses e o ácido nítrico abre parênteses H N O subscrito 3 fecha parênteses, conforme mostram as reações a seguir.
2 N O abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N O subscrito 2 abre parênteses g fecha parênteses
2 N O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H N O subscrito 2 abre parênteses a q fecha parênteses mais H N O subscrito 3 abre parênteses a q fecha parênteses
2 H N O subscrito 2 abre parênteses a q fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 H N O subscrito 3 abre parênteses a q fecha parênteses
Portanto, observa-se maior acidez da chuva nas regiões onde há uma grande quantidade de indústrias e automóveis. Nesses locais, em geral, a água da chuva tem p H por volta de 4,5. No entanto, já houve registro de p H próximo de 2, que pode ser comparado com a acidez do suco de limão, por exemplo.
Além de danificar estátuas e construções, como mostrado na página anterior, a chuva ácida pode aumentar a acidez do solo e dos corpos de água, prejudicando os ecossistemas aquáticos e terrestres. O aumento da acidez do solo pode prejudicar o desenvolvimento das plantas. Já o aumento da acidez dos corpos de água pode aumentar a mortandade de peixes e outros seres vivos aquáticos.
Compartilhe ideias
Evitar a formação da chuva ácida envolve aspectos técnicos, econômicos, políticos e sociais. Uma medida que pode ser tomada é a purificação de combustíveis como o óleo diesel e o carvão mineral, de modo a minimizar a quantidade de enxofre em sua composição.
a ) Reúna-se com seus colegas e listem formas de combater a chuva ácida, incluindo ações individuais que possam ser adotadas em seu dia a dia. Elaborem um folheto digital e divulguem essas informações para a comunidade por meio das redes sociais.
Resposta: Os estudantes podem citar medidas que incentivem o transporte coletivo, o uso de bicicletas e o desestímulo ao transporte individual; a fabricação de veículos que contenham filtros e catalisadores que diminuem a emissão dos gases tóxicos e a implementação de técnicas agrícolas que diminuam o uso de fertilizantes nitrogenados.
Página 386
Algumas definições de ácidos e bases
Professor, professora: Antes de iniciar a discussão sobre ácidos e bases de Arrhenius, revise os conceitos de íons (cátions e ânions), de substâncias iônicas e covalentes. Relembre que íons são espécies químicas com excesso ou déficit de elétrons, ânions e cátions, respectivamente.
Definições de Arrhenius
A Química, desde a sua origem, busca teorias e modelos que expliquem os comportamentos das substâncias. Como visto no capítulo 19, uma das teorias mais difundidas para classificar ácidos e bases é a de Arrhenius, proposta pelo químico sueco Svante August Arrhenius (1859-1927). Confira a seguir com essa teoria define ácido e base.
Ácido é a substância que, em água, apresenta capacidade de produzir o cátion hidrogênio abre parênteses H elevado a início expoente, mais, fim expoente fecha parênteses e formar o cátion oxônio abre parênteses H subscrito 3 O sobrescrito mais fecha parênteses. Os ácidos são substâncias covalentes que, em água, sofrem ionização, isto é:
Professor, professora: Equacione na lousa as reações de ionização do ácido nítrico formando os cátions e os ânions. Explique que elas são equivalentes e que ambas devem ser conhecidas, pois podem ser usadas em diferentes situações.
H N O subscrito 3 abre parênteses a q fecha parênteses seta para a direita H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais N O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
H N O subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais N O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Base é a substância que, em água, apresenta capacidade de liberar ânion hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses. As bases são substâncias iônicas que, em água, sofrem dissociação iônica, isto é:
K O H abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima K elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
A teoria de Arrhenius apresenta limitações, pois é restrita à classificação de soluções aquosas. A teoria ácido-base mais aceita atualmente é a proposta por Brønsted-Lowry, que envolve a liberação ou o recebimento de íons H sobrescrito mais por parte da substância.
Definições de Brønsted-Lowry
Para suprir a limitação da definição proposta por Arrhenius, o químico dinamarquês Johannes Nicolaus Brønsted (1879-1947) e o químico inglês Thomas Martin Lowry (1874-1936) propuseram, de modo independente, uma definição mais geral de ácidos e bases. Acompanhe a seguir como essa teoria define ácido e base.
Ácido é toda espécie química capaz de ceder prótons H sobrescrito mais em uma reação. Por exemplo, o íon H C O subscrito 3 elevado a início expoente, menos, fim expoente é um ácido de Brønsted-Lowry, em que:
H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses
Base é toda espécie química capaz de receber prótons H elevado a início expoente, mais, fim expoente em uma reação, como na reação a seguir, em que o N H subscrito 3 se comporta como uma base:
N H subscrito 3 abre parênteses a q fecha parênteses mais H C l abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais C l elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Definições de Lewis
Explique que na teoria de Brønsted-Lowry uma substância é classificada em ácido ou base de acordo com a forma como ela participa de uma reação química. Na teoria de Brønsted-Lowry não é possível classificar uma substância isoladamente como ácido ou base.
O químico estadunidense Gilbert Newton Lewis (1875-1946) propôs uma teoria para ácidos e bases ainda mais abrangente do que aquelas propostas por Arrhenius e Brønsted-Lowry. De acordo com a teoria de Lewis:
- base é toda espécie química capaz de par de elétrons;
- ácido é toda espécie química capaz de par de elétrons.
Confira o exemplo a seguir.
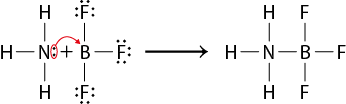
Na reação, a amônia abre parênteses N H subscrito 3 fecha parênteses cede um par de elétrons para o trifluoreto de boro abre parênteses B F subscrito 3 fecha parênteses. Como produto, temos o trifluorborato de amônia abre parênteses B F subscrito 3 H subscrito 3 N fecha parênteses, formado pelo compartilhamento de elétrons. Portanto, o N H subscrito 3 é a base de Lewis, enquanto o B F subscrito 3 é o ácido de Lewis.
Página 387
Ácidos de Arrhenius
De acordo com Arrhenius, os ácidos são compostos moleculares que, ao reagirem com a água, sofrem ionização, formando novas espécies químicas. Nesse processo, há o rompimento de ligações covalentes e formam-se íons: cátions H sobrescrito mais e ânions.
Nessas reações, dizemos que houve a ionização total, quando todos os átomos de hidrogênio presentes na molécula se separaram do ânion, formando cátions H sobrescrito mais. Essa ionização pode ser dividida em etapas (ionização parcial), em que um átomo de hidrogênio é ionizado a cada vez. Confira a reação de ionização do ácido sulfúrico.
Primeira ionização parcial: H subscrito 2 S O subscrito 4 abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais H S O subscrito 4 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Segunda ionização parcial: H S O subscrito 4 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
Classificação e nomenclatura dos ácidos de Arrhenius
Os ácidos podem ou não apresentar oxigênio em sua constituição. Dessa forma, eles podem ser classificados em hidrácidos (que não tem oxigênio) e oxiácidos (que tem oxigênio).
Para os hidrácidos, sua nomenclatura é dada de acordo com a seguinte regra:
ácido + nome do elemento químico + ídrico
Exemplos: ácido iodídrico abre parênteses H I fecha parênteses, ácido bromídrico abre parênteses H B r fecha parênteses e ácido fluorídrico abre parênteses H F fecha parênteses.
Para os oxiácidos, a regra de nomenclatura é dada de acordo com o número de oxiácidos que o elemento químico central forma.
Para elementos químicos que formam apenas um oxiácido, tem-se:
ácido + nome do elemento químico + ico
Exemplos: ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses e ácido bórico abre parênteses H subscrito 3 B O subscrito 3 fecha parênteses.
Para elementos químicos que formam dois oxiácidos, tem-se:
ácido + nome do elemento químico + ico
Ácidos padrões, como o ácido arsênico abre parênteses H subscrito 3 A s O subscrito 4 fecha parênteses, o ácido sulfúrico abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses e o ácido nítrico abre parênteses H N O subscrito 3 fecha parênteses.
ácido + nome do elemento químico + oso
Ácidos que apresentam na fórmula química um oxigênio a menos que o ácido padrão, como o ácido arsênioso abre parênteses H subscrito 3 A s O subscrito 3 fecha parênteses, o ácido sulfuroso abre parênteses H subscrito 2 S O subscrito 3 fecha parênteses e o ácido nitroso abre parênteses H N O subscrito 2 fecha parênteses.
Para elementos químicos que formam quatro oxiácidos, tem-se:
ácido + per + nome do elemento químico + ico
Ácidos que apresentam na fórmula química um oxigênio a mais que o ácido padrão, como o ácido perclórico abre parênteses H C l O subscrito 4 fecha parênteses.
ácido + nome do elemento químico + oso
Ácidos que apresentam na fórmula química um oxigênio a menos que o ácido padrão, como o ácido cloroso abre parênteses H C l O subscrito 2 fecha parênteses.
ácido + nome do elemento químico + ico
Ácidos padrões, como o ácido clórico abre parênteses H C l O subscrito 3 fecha parênteses.
ácido + hipo + nome do elemento químico + oso
Ácidos que apresentam na fórmula química dois oxigênios a menos que o ácido padrão, como o ácido hipocloroso abre parênteses H C l O fecha parênteses.
Página 388
Alguns ácidos e suas aplicações
3. Os ácidos são materiais nocivos à saúde?
Resposta: O objetivo desta questão é levar os estudantes a perceber que os materiais ácidos podem ser nocivos à saúde. Entretanto, a sua ingestão por meio dos alimentos pode trazer benefícios, como facilitar a digestão dos alimentos.
4. Quais alimentos são conhecidos por serem ácidos?
Resposta pessoal. Espera-se que os estudantes mencionem alimentos cujo sabor é azedo, como o abacaxi, a laranja, o limão, a uva e o iogurte.
Geralmente, as pessoas associam a palavra ácido a um material perigoso. De fato, existem ácidos que podem causar queimaduras no ser humano ou danificar muitos materiais, porém alguns ácidos estão presentes em alimentos e podem ser consumidos.
Confira a seguir alguns ácidos e sua aplicabilidade no cotidiano.
1. Ácido sulfúrico abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses: um ácido forte e corrosivo, com ação desidratante, ou seja, ele é capaz de retirar água dos materiais. Esse ácido está envolvido em vários processos industriais, como na fabricação de fertilizantes, no refino do petróleo, na produção de outros ácidos, como o ácido nítrico e o ácido fosfórico, na limpeza de metais e em baterias automotivas.

2. Ácido nítrico abre parênteses H N O subscrito 3 fecha parênteses: usado para produzir fertilizantes, como o nitrato de amônio abre parênteses N H subscrito 4 N O subscrito 3 fecha parênteses. Além disso, participa de reações que formam o nitrato de potássio abre parênteses K N O subscrito 3 fecha parênteses, também chamado de salitre, que é um dos componentes da pólvora. É usado ainda como matéria-prima na fabricação de explosivos como o trinitrotolueno abre parênteses C subscrito 7 H subscrito 5 N subscrito 3 O subscrito 6 fecha parênteses e a nitroglicerina abre parênteses C subscrito 3 H subscrito 5 N subscrito 3 O subscrito 9 fecha parênteses.
3. Ácido clorídrico abre parênteses H C l fecha parênteses: puro, ele é denominado cloreto de hidrogênio. Trata-se de um gás incolor, não inflamável, muito tóxico e corrosivo. Ao ser dissolvido em água, ele forma a solução de ácido clorídrico, a qual é incolor, tóxica e corrosiva. Esse ácido é usado nas indústrias de alimentos, corantes, tintas, couros, entre outros produtos. Vendido comercialmente como ácido muriático, é utilizado na limpeza pesada de pisos. Portanto, ao fazer uso doméstico, é necessário usar equipamentos de proteção individual (EPIs). O ácido clorídrico é um dos componentes do suco gástrico de nosso estômago, cuja ação ajuda a digerir os alimentos.

4. Ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 fecha parênteses: seu principal uso é na indústria alimentícia, como acidulante e conservante de refrigerantes, doces, molhos para saladas e geleias. Esse ácido também é usado na indústria farmacêutica, para obter insulina e produzir antibióticos, e na fabricação de fertilizantes, ração animal, detergentes, entre outros produtos.
5. Ácido etanoico abre parênteses C subscrito 2 H subscrito 4 O subscrito 2 fecha parênteses: usualmente denominado ácido acético, apesar de ser um ácido fraco (pouco ionizável), é corrosivo e produz vapores que causam irritação nos olhos, no nariz e na garganta. É muito utilizado para produzir garrafas PET, perfumes, medicamentos e seda artificial e para obter sais metálicos na fabricação de tintas e inseticidas. O vinagre é uma solução de ácido etanoico em água, tendo entre 4% e 7% de ácido em massa, sendo obtido por meio da fermentação, em que microrganismos transformam o etanol abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses – presente no vinho – em ácido etanoico.
Página 389
Bases de Arrhenius
As bases são compostos com sabor adstringente, algo semelhante ao sabor de uma banana verde, entretanto muitas bases são tóxicas e corrosivas. Esses compostos também são denominados hidróxidos, pois apresentam o ânion hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses, ou álcalis, palavra de origem árabe que significa cinza, pois alguns hidróxidos são encontrados em cinzas de madeira queimada.
As bases são compostos iônicos que, ao se dissolverem em água, liberam ânions hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses e cátions metálicos por dissociação iônica, resultando, portanto, em soluções condutoras de eletricidade. Nesse processo, quando a base entra em contato com a água, não há reação química, e sim a separação de íons preexistentes.
Na dissociação iônica em solução aquosa, formam-se o íon hidroxila abre parênteses O H elevado a início expoente, menos, fim expoente fecha parênteses e um cátion metálico. Confira os exemplos a seguir.
N a O H abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima N a elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
M g abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima M g elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
A l abre parênteses O H fecha parênteses subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima A l elevado a início expoente, 3 mais, fim expoente abre parênteses a q fecha parênteses mais 3 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Dica
Em geral, líquidos podem ser definidos como corrosivos quando apresentam pH inferior a 2,0 ou superior a 11,5.
As bases têm diferentes solubilidades em água. Elas costumam ser classificadas em solúveis, parcialmente solúveis e praticamente insolúveis. De modo geral, a solubilidade desses compostos depende da temperatura a que são submetidos.
A solubilidade das bases em água é determinada experimentalmente. Os resultados obtidos mostram que a solubilidade das bases formadas por metais alcalinos é maior e vai diminuindo até as bases formadas por outros metais, como representado no esquema a seguir.
bases de metais alcalinos e de amônio seta para a direita solúveis
bases de metais alcalinoterrosos seta para a direita parcialmente solúveis
bases de outros metais seta para a direita praticamente insolúveis
Nomenclatura das bases de Arrhenius
A nomenclatura das bases é dada de acordo com as regras a seguir.
Para bases cujos cátions apresentam carga fixa, tem-se:
hidróxido de + nome do elemento químico
Exemplos: hidróxido de sódio abre parênteses N a O H fecha parênteses, hidróxido de cálcio abre parênteses C a abre parênteses O H fecha parênteses subscrito 2 fecha parênteses e hidróxido de alumínio abre parênteses A l abre parênteses O H fecha parênteses subscrito 3 fecha parênteses.
Para bases cujos cátions apresentam carga variável, indica-se ao final do nome entre parênteses o valor da carga do cátion em algarismo romano.
hidróxido de + nome do elemento químico + carga em algarismo romano
Exemplos: hidróxido de cobre(I) abre parênteses C u O H fecha parênteses, hidróxido de cobre(II) abre parênteses C u abre parênteses O H fecha parênteses subscrito 2 fecha parênteses, hidróxido de ferro(II) abre parênteses F e abre parênteses O H fecha parênteses subscrito 2 fecha parênteses e hidróxido de ferro(III) abre parênteses F e abre parênteses O H fecha parênteses subscrito 3 fecha parênteses.
Podem ser escritos também substituindo o valor da carga pelos sufixos ico ou oso.
hidróxido de + nome do elemento químico + ico
Elemento químico com maior carga, como o hidróxido cúprico abre parênteses C u abre parênteses O H fecha parênteses subscrito 2 fecha parênteses e o hidróxido férrico abre parênteses F e abre parênteses O H fecha parênteses subscrito 3 fecha parênteses.
hidróxido de + nome do elemento químico + oso
Elemento químico com menor carga, como o hidróxido cuproso abre parênteses C u O H fecha parênteses e o hidróxido ferroso abre parênteses F e abre parênteses O H fecha parênteses subscrito 2 fecha parênteses.
Página 390
Algumas bases e suas aplicações
Assim como os ácidos, as bases têm importantes aplicações no cotidiano. Por meio dos componentes básicos, também denominados alcalinos, são produzidos vários materiais para diversas finalidades, como sabão, medicamentos e papel. Algumas das principais bases e suas utilizações são listadas a seguir.
1. Hidróxido de sódio abre parênteses N a O H fecha parênteses: recebe o nome comercial de soda cáustica. É um sólido branco, corrosivo, tóxico e solúvel em água. Para manipulá-la, é necessário usar EPIs, pois seu contato com a pele pode causar queimaduras severas. O hidróxido de sódio é muito utilizado na fabricação de sabão, papel, seda artificial, celofane, entre outros produtos, e na purificação de óleos vegetais e derivados do petróleo.

2. Hidróxido de potássio abre parênteses K O H fecha parênteses: também conhecido como potassa cáustica, trata-se de um sólido branco, relativamente translúcido, tóxico e corrosivo. É utilizado na produção de sais de potássio, como o carbonato, o cianeto, o permanganato, os fosfatos e os vários silicatos. Muitas vezes, substitui o hidróxido de sódio na produção de sabões, pois requer menos água para ser liquefeito, resultando em um produto mais concentrado em relação ao agente de limpeza.
3. Hidróxido de cálcio abre parênteses C a abre parênteses O H fecha parênteses subscrito 2 fecha parênteses: conhecido como cal hidratada, cal extinta ou cal apagada. Esses nomes provêm de seu método de preparação, que é por hidratação do óxido de cálcio abre parênteses C a O fecha parênteses, denominado cal viva ou cal virgem. Esse material é usado na construção civil para preparar argamassa e na pintura de paredes (caiação✚). Suas propriedades antibacterianas ajudam a combater o mofo e impedem a infestação por insetos, sendo utilizado para proteger troncos de árvores. Por ter um custo bem mais baixo que as tintas, a caiação acaba sendo usada em guias de calçadas, postes e muros residenciais externos. O hidróxido de cálcio é usado também na agricultura, como inseticida e fungicida, no tratamento (purificação) de águas e esgotos, nas indústrias de couro e alimentos, no refino do açúcar e na odontologia.

4. Hidróxido de amônio abre parênteses N H subscrito 4 O H fecha parênteses: também conhecido como amoníaco, esse hidróxido não existe de forma pura, apenas em solução aquosa de amônia abre parênteses N H subscrito 3 fecha parênteses, isto é:
N H subscrito 3 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita N H subscrito 4 O H abre parênteses a q fecha parênteses
Soluções de hidróxido de amônio são utilizadas na fabricação de produtos têxteis, produtos farmacêuticos, papel, borracha, detergentes, tintas, fertilizantes, couro e outros produtos químicos. É um composto que provoca queimaduras, dano aos olhos e irritação nas vias respiratórias. Portanto, para manuseá-lo, deve-se usar EPIs.
- Caiação:
- solução aquosa de hidróxido de cálcio usada para pintar superfícies.↰
Página 391
ATIVIDADES
1. Associe as fórmulas dos ácidos aos seus respectivos nomes.
I. H subscrito 3 P O subscrito 4
II. H C l O subscrito 4
III. H subscrito 2 S O subscrito 3
IV. H N O subscrito 2
A. ácido perclórico
B. ácido nitroso
C. ácido fosfórico
D. ácido sulfuroso
A sequência das combinações corretas é:
a ) I – A; II – B; III – C; IV – D.
b ) I – A; II – C; III – D; IV – B.
c ) I – C; II – A; III – B; IV – D.
d ) I – B; II – A; III – D; IV – C.
e ) I – C; II – A; III – D; IV – B.
Resposta: Alternativa e.
2. Escreva as equações de ionização total dos ácidos a seguir.
a ) Ácido bromídrico.
Resposta: H B r abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais B r elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
b ) Ácido nítrico.
Resposta: H N O subscrito 3 abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais N O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
c ) Ácido sulfúrico.
Resposta: H subscrito 2 S O subscrito 4 abre parênteses a q fecha parênteses duas meias setas que apontam em direções opostas 2 H elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais S O subscrito 4 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
3. Qual alternativa a seguir apresenta definição de ácido, segundo Arrhenius?
a ) Ácido é a substância que, em água, apresenta capacidade de formar o cátion oxônio e liberar o cátion hidrogênio.
b ) Ácido é a espécie química que recebe pares eletrônicos da base.
c ) Ácido é a substância que, em água, apresenta capacidade de liberar o ânion hidreto e formar o ânion hidroxila.
d ) Ácido é a substância capaz de ceder par de prótons para a base.
Resposta: Alternativa a. Comentário nas Orientações para o professor.
4. Analise as propriedades descritas a seguir e escreva os nomes dos ácidos a que correspondem.
I ) Usado na limpeza de pisos e está presente também no suco gástrico.
II ) Ácido forte e corrosivo, produzido na indústria com enxofre sólido, oxigênio do ar e água.
III ) Usado como acidulante em refrigerantes, balas e goma de mascar e na fabricação de fertilizantes.
IV ) Ácido produzido com amônia, utilizado como matéria-prima na produção de explosivos.
Resposta: I) Ácido clorídrico. II) Ácido sulfúrico. III) Ácido fosfórico. IV) Ácido nítrico.
5. O vinagre tem sabor azedo em razão de um ácido presente em sua composição. Qual alternativa apresenta o nome desse ácido?
a ) Ácido hipocloroso.
b ) Ácido cianídrico.
c ) Ácido sulfídrico.
d ) Ácido etanoico.
e ) Ácido fosforoso.
Resposta: Alternativa d.
6. Equacione a dissociação iônica das bases a seguir.
a ) L i O H
Resposta: L i O H abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima L i elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
b ) C a abre parênteses O H fecha parênteses subscrito 2
Resposta: C a abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
c ) A l abre parênteses O H fecha parênteses subscrito 3
Resposta: A l abre parênteses O H fecha parênteses subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima A l elevado a início expoente, 3 mais, fim expoente abre parênteses a q fecha parênteses mais 3 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
d ) C u abre parênteses O H fecha parênteses subscrito 2
Resposta: C u abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima C u elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
e ) N H subscrito 4 O H
Resposta: N H subscrito 4 O H abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima N H subscrito 4 elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
f ) M g abre parênteses O H fecha parênteses subscrito 2
Resposta: M g abre parênteses O H fecha parênteses subscrito 2 abre parênteses l fecha parênteses expressão com detalhe acima, início da expressão, duas meias setas que apontam em direções opostas, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima M g elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais 2 O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
7. Associe as fórmulas químicas das bases ao seu nome oficial e, em seguida, anote a alternativa com a correspondência correta.
I. C u O H
II. C u abre parênteses O H fecha parênteses subscrito 2
III. K O H
IV. C a abre parênteses O H fecha parênteses subscrito 2
A. Hidróxido de potássio
B. Hidróxido de cobre(II)
C. Hidróxido de cobre(I)
D. Hidróxido de cálcio
a ) I – A; II – B; III – C; IV – D.
b ) I – C; II – B; III – A; IV – D.
c ) I – D; II – C; III – A; IV – B.
d ) I – D; II – C; III – B; IV – A.
e ) I – B; II – A; III – C; IV – D.
Resposta: Alternativa b.
8. Escreva a fórmula das bases de acordo com as suas características.
a ) É denominada cal extinta.
Resposta: C a abre parênteses O H fecha parênteses subscrito 2
b ) É denominada soda cáustica.
Resposta: N a O H
c ) Trata-se de uma solução aquosa de amônia abre parênteses N H subscrito 3 fecha parênteses.
Resposta: N H subscrito 4 O H
d ) É utilizada na fabricação de sabões macios.
Resposta: K O H
9. O ácido clorídrico é um dos compostos químicos frequentemente utilizado em produtos para limpeza de carros, especialmente para a remoção de ferrugem e manchas em superfícies metálicas. Qual das seguintes alternativas descreve corretamente uma propriedade desse ácido que deve ser considerada ao utilizá-lo?
a ) É um ácido fraco, portanto não causa danos a superfícies metálicas.
b ) É um ácido forte que pode reagir rapidamente com metais, liberando gases perigosos.
c ) É um ácido neutro, não apresentando reatividade com outros materiais.
d ) É um ácido sem odor e que pode ser utilizado sem precauções.
e ) É um ácido fraco que, ao ser diluído, se torna seguro para ser usado na limpeza.
Resposta: Alternativa b.
Página 392
Sais de Arrhenius
Um dos principais problemas enfrentados pelos agricultores brasileiros é a acidez do solo. A maioria das terras agricultáveis do país são ácidas, prejudicando o desenvolvimento de algumas culturas. Para não comprometer a produção, um dos processos mais usados para neutralizar a acidez do solo é a adição de carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses nele, um processo denominado calagem. A correção da acidez do solo pela aplicação do C a C O subscrito 3 é possível por causa do caráter básico que essa substância apresenta em meio aquoso, formando íons O H elevado a início expoente, menos, fim expoente:
C a C O subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, H subscrito 2 O, fim do detalhe acima C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses
C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses duas meias setas que apontam em direções opostas H C O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais O H elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses
Sendo o principal componente do calcário, um tipo de rocha sedimentar usada na produção do corretivo agrícola, o carbonato de cálcio pode ser classificado como sal segundo as definições de Arrhenius. Além de diminuir a acidez, o calcário fornece cálcio e magnésio ao solo, nutrientes essenciais para as plantas. O cálcio, por exemplo, estimula o crescimento das raízes, facilitando a absorção da água e dos nutrientes do solo e auxiliando a planta na tolerância à seca.
A formação de um sal, tal como o C a C O subscrito 3, ocorre, em geral, quando uma solução aquosa de uma base reage com uma solução aquosa de um ácido. A reação entre uma base e um ácido, que produz sal e água, é denominada reação de neutralização.
O cloreto de sódio abre parênteses N aC l fecha parênteses, principal constituinte do sal de cozinha, pode ser formado pela reação química de neutralização entre o ácido clorídrico e o hidróxido de sódio:
H C l abre parênteses a q fecha parênteses mais N a O H abre parênteses a q fecha parênteses seta para a direita N a C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
Outro exemplo de reação de neutralização é a aplicada na extração do pigmento utilizado para confirmar a autenticidade de obras de arte. As tintas que os artistas usavam em suas pinturas costumavam ser compostas de substâncias que se deterioram com a ação da luz ao longo do tempo, o que dificulta sua identificação atualmente. Contudo, pesquisadores da National Gallery de Londres, da Escola de Química de Edimburgo, na Escócia, e outras instituições, descobriram que um dos componentes de um pigmento à base de pau-brasil (Paubrasilia echinata) é estável e resistente à luz, podendo ser usado como indicador da autenticidade de obras, uma vez que estava em muitas das tintas usadas por artistas como Rafael, Rembrandt, Pietro de Cortona e Van Gogh.
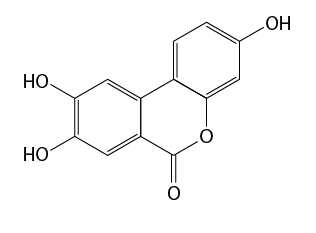
Esse componente, chamado urolitina C, é extraído da tintura de pau-brasil por meio de uma reação de neutralização. Note que na estrutura há a função orgânica fenol, a qual é considerada um ácido orgânico fraco, que possui hidrogênios ionizáveis, e estes reagem com o carbonato de cálcio em solução, pois é um sal básico.
Classificação dos sais de Arrhenius
Como visto no capítulo 20, as soluções aquosas de sais podem ter caráter ácido, neutro ou básico, de acordo com a força do ácido e da base que as formam. Acompanhe a seguir as diferentes formas de classificar os sais.
Sais neutros: têm cátions de bases fortes e ânions de ácidos fortes ou, ainda, cátions de bases fracas e ânions de ácidos fracos. Por exemplo, o nitrato de potássio abre parênteses K N O subscrito 3 fecha parênteses em água forma solução de caráter neutro:
H N O subscrito 3 abre parênteses a q fecha parênteses mais K O H abre parênteses a q fecha parênteses seta para a direita K N O subscrito 3 abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
Sais ácidos: têm cátions de bases fracas e ânions de ácidos fortes, como o cloreto de amônio abre parênteses N H subscrito 4 C l fecha parênteses:
H C l abre parênteses a q fecha parênteses mais N H subscrito 4 O H abre parênteses a q fecha parênteses seta para a direita N H subscrito 4 C l abre parênteses a q fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
Página 393
Sais básicos: têm cátions de bases fortes e ânions de ácidos fracos, como o carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses:
H subscrito 2 C O subscrito 3 abre parênteses a q fecha parênteses mais C a abre parênteses O H fecha parênteses subscrito 2 abre parênteses a q fecha parênteses seta para a direita C a C O subscrito 3 abre parênteses a q fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses
Sais mistos: também denominados de sais duplos, são derivados de dois ácidos ou de duas bases diferentes. Por exemplo, o sulfato duplo de sódio e potássio abre parênteses K N a S O subscrito 4 fecha parênteses é derivado de duas bases e um ácido. No entanto, o cloreto brometo de cálcio abre parênteses C a B r C l fecha parênteses é derivado de uma base e de dois ácidos.

Sais hidratados: cristalizam com uma ou mais moléculas de água em seu retículo cristalino. Por exemplo, o sulfato de cobre(II) penta-hidratado abre parênteses C u S O subscrito 4 vezes 5 H subscrito 2 O fecha parênteses tem cinco moléculas de água em sua estrutura cristalina. A água presente em sais é chamada água de hidratação. O sulfato de cobre(II) penta-hidratado tem a coloração azul. No entanto, ao ser aquecido, ele perde a água de hidratação e transforma-se em sulfato de cobre(II) anidro abre parênteses C u S O subscrito 4 fecha parênteses, que tem cor branca, como mostra a fotografia.

Nomenclatura dos sais de Arrhenius
Como estudamos, os sais podem ser obtidos por reações de neutralização, em que o seu ânion é obtido do ácido. O nome do ânion é proveniente do respectivo ácido, substituindo seu sufixo conforme o quadro a seguir.
| Sufixo do sal | Sufixo do ácido |
|---|---|
|
eto |
ídrico |
|
ato |
ico |
|
ito |
oso |
Confira os nomes de alguns ânions com base nos ácidos que os originam.
| Ácido | Ânion |
|---|---|
|
H C l: ácido clorídrico |
C l elevado a início expoente, menos, fim expoente: cloreto |
|
H N O subscrito 3: ácido nítrico |
N O subscrito 3 sobrescrito menos: nitrato |
|
H subscrito 2 S O subscrito 3: ácido sulfuroso |
S O subscrito 3 elevado a início expoente, 2 menos, fim expoente: sulfito |
Como os sais são formados por cátions (da base) e ânions (do ácido), geralmente os nomes de seus íons formadores compõem sua nomenclatura, em que:
nome do ânion + de + nome do cátion
Por exemplo, o cloreto de potássio abre parênteses K C l fecha parênteses tem o ânion cloreto formado por meio do ácido clorídrico; o nitrato de alumínio abre parênteses A l abre parênteses N O subscrito 3 fecha parênteses subscrito 3 fecha parênteses tem o ânion nitrato formado por meio do ácido nítrico; e o sulfito de cálcio abre parênteses C a S O subscrito 3 fecha parênteses tem o ânion sulfito formado por meio do ácido sulfuroso.
Alguns sais e suas aplicações
1. Cloreto de sódio abre parênteses N aC l fecha parênteses: comumente usado para salgar a comida e conservar alimentos, como carnes e pescados. Está presente no soro fisiológico, com uma concentração de 0,9% em massa. É utilizado também como matéria-prima na indústria para obter gás cloro abre parênteses C l subscrito 2 fecha parênteses, na produção de hidróxido de sódio, na manufatura do papel e na produção de detergentes e sabões.

Página 394
2. Hipoclorito de sódio abre parênteses N a C l O fecha parênteses: é agente alvejante nas indústrias de papel e têxtil. Tem a função de antisséptico no tratamento da água, pois o cloro em sua composição inibe a multiplicação e a proliferação de microrganismos. É um dos componentes da água sanitária destinada à higienização e à desinfecção.

3. Fluoreto de sódio abre parênteses N a F fecha parênteses: utilizado na fabricação de cremes dentais e colutórios (enxaguadores bucais), pois inibe a desmineralização dos dentes, diminuindo a suscetibilidade a cáries. Também é usado na fluoretação de água potável.

4. Carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses: utilizado na correção da acidez do solo e como fertilizante mineral. Também é usado como matéria-prima na indústria de materiais de construção (fabricação de cimento e cal); na indústria do aço; como agente abrasivo e polidor em cremes dentais; e como pigmento na fabricação de tintas, carpetes e vidros.

5. Sulfato de cálcio abre parênteses C a S O subscrito 4 fecha parênteses: utilizado na produção de fertilizantes agrícolas, cimento, giz escolar, vidros e esmaltes. Sua forma hidratada abre parênteses C a S O subscrito 4 vezes 2 H subscrito 2 O fecha parênteses é usada na produção do gesso, aplicado na construção civil, além de atuar como imobilizador na ortopedia graças à sua capacidade de endurecimento rápido.

6. Hidrogenocarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses: utilizado como antiácido estomacal por suas características básicas. Além disso, é um dos componentes do fermento químico culinário, é usado como componente dos talcos desodorantes e está presente em extintores de pó químico seco e de espuma química.

Página 395
7. Sulfato de magnésio abre parênteses M g S O subscrito 4 fecha parênteses: utilizado na fabricação de tintas e sabões; tem ação laxativa, conhecido como sal de Epsom; usado em sais de banho para reduzir dores nas pernas, nas costas e nos pés e para aliviar a tensão muscular; acelera a cicatrização de cortes.

8. Nitrato de amônio abre parênteses N H subscrito 4 N O subscrito 3 fecha parênteses: usado como fertilizante (por causa da alta porcentagem de nitrogênio), na produção de explosivos e na produção de óxido nitroso abre parênteses N subscrito 2 O fecha parênteses por meio da decomposição térmica do nitrato de amônio. O óxido nitroso pode ser utilizado como anestésico.
N H subscrito 4 N O subscrito 3 abre parênteses s fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, delta, fim do detalhe acima N subscrito 2 O abre parênteses g fecha parênteses mais 2 H subscrito 2 O abre parênteses g fecha parênteses

Óxidos
Os corais formam um ecossistema marinho que apresenta grande biodiversidade. Além de proporcionarem abrigo e alimento para a maioria dos seres que nele vivem, os corais filtram a água do mar e, durante esse processo, absorvem os nutrientes de que necessitam para se desenvolverem. De acordo com dados do Ministério do Meio Ambiente, cerca de 65% dos peixes marinhos vivem em recifes de corais, assim como vários moluscos, algas e crustáceos.
No entanto, tem sido observado nas últimas décadas o branqueamento dos corais, um processo que pode causar a morte deles.
Palythoa caribaeorum: pode atingir aproximadamente 15 milímetros de diâmetro.

O aumento da temperatura dos oceanos, resultante, principalmente, da intensificação do efeito estufa, é a principal causa do branqueamento dos corais. O efeito estufa é um processo em que parte do calor proveniente do Sol fica retida na atmosfera, aumentando a temperatura do planeta. Esse processo é necessário para manter a temperatura em uma faixa adequada à manutenção da vida. No entanto, a intensificação desse efeito tem causado o aumento da temperatura média do planeta, trazendo várias consequências prejudiciais aos seres vivos, que incluem o branqueamento dos corais.
Página 396
Imagens desta página sem proporção e em cores fantasia.
1. Os corais têm uma relação simbiótica com algas microscópicas chamadas zooxantelas, que vivem em seus tecidos. Essas algas realizam fotossíntese e fornecem nutrientes aos corais, além de darem a eles sua cor característica.
2. Sob condições adversas do ambiente, como aumento da temperatura e presença de poluentes nas águas dos oceanos, os corais expulsam as algas de seus tecidos.
3. Sem as algas, o coral perde sua principal fonte de alimento e pode ficar mais suscetível a doenças. Além disso, ele fica com uma coloração branca.

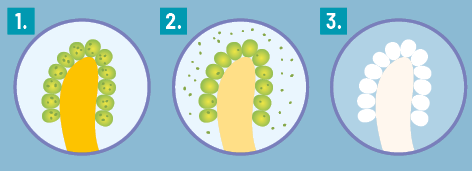
Imagem elaborada com base em: WHAT is coral bleaching? National Ocean Service. Disponível em: https://s.livro.pro/uz7w0u. Acesso em: 29 ago. 2024.
Entre os gases responsáveis tanto pelo efeito estufa natural como pela sua intensificação estão o dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses e o dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses. Esses dois compostos pertencem a um grupo de substâncias denominadas óxidos e são formados principalmente pela queima (oxidação) de matéria orgânica.
Características dos óxidos
Óxido é um composto binário (formado por dois elementos químicos), em que o oxigênio abre parênteses O fecha parênteses é o elemento mais eletronegativo. O único elemento químico mais eletronegativo do que o oxigênio é o flúor abre parênteses F fecha parênteses. Portanto, o difluoreto de oxigênio abre parênteses O F subscrito 2 fecha parênteses e o difluoreto de dioxigênio abre parênteses O subscrito 2 F subscrito 2 fecha parênteses são os únicos compostos binários oxigenados que não são óxidos. Além do C O subscrito 2, o monóxido de carbono abre parênteses C O fecha parênteses, o dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses, o óxido de alumínio abre parênteses A l subscrito 2 O subscrito 3 fecha parênteses e o óxido de cálcio abre parênteses C a O fecha parênteses também são exemplos de óxidos.
As fotografias a seguir apresentam alguns exemplos de minérios que possuem em maior parte óxidos iônicos.




Classificação dos óxidos
Os óxidos podem ser classificados de acordo com suas ligações químicas e suas propriedades. Confira a seguir a classificação quanto ao elemento químico que está ligado ao oxigênio.
Óxidos moleculares: quando o oxigênio forma ligações covalentes com os elementos químicos não metálicos. Exemplos: monóxido de nitrogênio abre parênteses N O fecha parênteses, dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses e trióxido de enxofre abre parênteses S O subscrito 3 fecha parênteses.
Óxidos iônicos: quando o oxigênio forma ligações iônicas com elementos químicos metálicos. Exemplos: óxido de cálcio abre parênteses C a O fecha parênteses, óxido de zinco abre parênteses Z n O fecha parênteses e trióxido de diferro abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses.
Agora, confira a classificação quanto às propriedades.
Óxidos básicos: são óxidos iônicos geralmente formados por elementos químicos de baixa eletronegatividade (metais alcalinos e alcalinoterrosos). Quando são dissolvidos em água, reagem e formam soluções básicas. Exemplos: óxido de sódio abre parênteses N a subscrito 2 O fecha parênteses, óxido de magnésio abre parênteses M g O fecha parênteses e óxido de cálcio abre parênteses C a O fecha parênteses.
Página 397
Óxidos ácidos: também chamados de anidridos, são óxidos moleculares, em geral, formados por elementos químicos de alta eletronegatividade (não metais). Quando são dissolvidos em água, reagem e formam soluções ácidas. Exemplos: dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses, dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses, pentóxido de difósforo abre parênteses P subscrito 2 O subscrito 5 fecha parênteses e trióxido de enxofre abre parênteses S O subscrito 3 fecha parênteses.
Óxidos neutros: são óxidos moleculares formados por não metais que não reagem com água, assim não formam soluções ácidas ou básicas. Exemplos: monóxido de carbono abre parênteses CO fecha parênteses, monóxido de nitrogênio abre parênteses N O fecha parênteses e monóxido de dinitrogênio abre parênteses N subscrito 2 O fecha parênteses.
Óxidos anfóteros: são óxidos com caráter intermediário entre o iônico e o molecular, formados por metais e não metais de eletronegatividade média. Podem se comportar como ácidos ou bases, dependendo do meio. Exemplos: óxido de zinco abre parênteses Z n O fecha parênteses, óxido de alumínio abre parênteses A l subscrito 2 O subscrito 3 fecha parênteses, monóxido de chumbo abre parênteses P b O fecha parênteses, dióxido de chumbo abre parênteses P b O subscrito 2 fecha parênteses, dióxido de estanho abre parênteses S n O subscrito 2 fecha parênteses e trióxido de diarsênio abre parênteses A s subscrito 2 O subscrito 3 fecha parênteses.
Óxidos mistos: também chamados de óxidos duplos, resultam da combinação de dois óxidos distintos de um mesmo elemento químico. Exemplos:
- F e O mais subscrito 2 O subscrito 3 seta para a direita F e subscrito 3 O subscrito 4 (magnetita)
- 2 P b O mais P b O subscrito 2 seta para a direita P b subscrito 3 O subscrito 4 (zarcão)
Peróxidos: são óxidos que têm em sua estrutura o grupo O subscrito 2 elevado a início expoente, 2 menos, fim expoente. Os peróxidos mais comuns são formados de metais alcalinos, alcalinoterrosos e hidrogênio abre parênteses H fecha parênteses. Exemplos: peróxido de sódio abre parênteses N a subscrito 2 O subscrito 2 fecha parênteses, peróxido de cálcio abre parênteses C a O subscrito 2 fecha parênteses e peróxido de hidrogênio abre parênteses H subscrito 2 O subscrito 2 fecha parênteses.
Superóxidos: são óxidos que contêm o íon superóxido, O subscrito 2 elevado a início expoente, menos, fim expoente, no qual o oxigênio tem número de oxidação menos 1 barra 2. Eles são normalmente formados por metais facilmente oxidáveis, como K, R b e C s. Exemplos: superóxido de potássio abre parênteses K O subscrito 2 fecha parênteses e superóxido de césio abre parênteses C s O subscrito 2 fecha parênteses.
PRÁTICA CIENTÍFICA
Caráter básico do óxido de cálcio
Por dentro do contexto
A cal viva ou cal virgem é uma substância que pode ser utilizada para ajustar o p H do solo, aumentando-o. Realize o experimento a seguir, que permite constatar o caráter básico dessa substância.
Materiais
- cal viva
- 2 copos
- água
- colher de sopa
- canudo
- filtro de papel
- funil de plástico
Como proceder
A. Acrescente água no copo até a metade.
B. Adicione 1 colher de sopa cheia de cal viva e misture.
C. Filtre a mistura, obtendo a solução.
D. Coloque o canudo na mistura e sopre vigorosamente.
Análise
1. Explique por que surge um aspecto turvo ao soprar a solução. Escreva a equação química correspondente ao processo descrito.
Resposta nas Orientações para o professor.
Nomenclatura dos óxidos
A nomenclatura dos óxidos é dada por:
prefixo + óxido de + prefixo + nome do elemento químico
Os prefixos referem-se à quantidade de átomos de cada elemento químico, observe o quadro a seguir.
| Prefixo | nº de átomos |
|---|---|
|
Mono |
1 |
|
Di |
2 |
|
Tri |
3 |
|
Tetr |
4 |
|
Pent |
5 |
|
Hex |
6 |
|
Hept |
7 |
|
Oct |
8 |
|
Non |
9 |
|
Dec |
10 |
Página 398
Professor, professora: Explique aos estudantes que o uso do prefixo mono é opcional, por isso o C O e o S O subscrito 3 têm duas possibilidades para seus nomes: monóxido de monocarbono ou monóxido de carbono e trióxido de monoenxofre ou trióxido de enxofre, respectivamente.
Confira alguns exemplos:
- C O: monóxido de monocarbono ou monóxido de carbono
- N subscrito 2 O subscrito 3: trióxido de dinitrogênio
- S O subscrito 3: trióxido de monoenxofre ou trióxido de enxofre
- C l subscrito 2 O subscrito 7: heptóxido de dicloro
- N i subscrito 2 O subscrito 3: trióxido de diníquel
Além da nomenclatura oficial, há outra nomenclatura que costuma ser utilizada em óxidos. Ela se baseia na carga do elemento químico que forma o óxido.
Para elementos químicos com carga fixa, tem-se:
óxido de + nome do elemento químico
Exemplos: óxido de sódio abre parênteses N a subscrito 2 O fecha parênteses e óxido de alumínio abre parênteses A l subscrito 2 O subscrito 3 fecha parênteses.
Para elementos químicos com carga variável, indica-se, ao final do nome e entre parênteses, o valor da carga em algarismo romano.
óxido de + nome do elemento químico + carga em algarismo romano
Exemplos: óxido de ferro(II) abre parênteses F e O fecha parênteses e óxido de ferro(III) abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses.
Podem ser escritos também substituindo o valor da carga pelos sufixos ico ou oso:
óxido de + nome do elemento químico + ico
Elemento químico com maior carga, como o óxido férrico abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses.
óxido de + nome do elemento químico + oso
Elemento químico com menor carga, como o óxido ferroso abre parênteses F e O fecha parênteses.
Principais óxidos e suas aplicações
Imagens desta página sem proporção.
1. Dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses: conhecido também como gás carbônico, é utilizado em águas minerais com gás e em outras bebidas gaseificadas. Abaixo de menos 78 graus Celsius, em pressão ambiente, é um sólido denominado gelo-seco. É utilizado em alguns tipos de extintor de incêndio.

2. Trióxido de dicrômio abre parênteses C r subscrito 2 O subscrito 3 fecha parênteses: o cromo é utilizado na indústria do aço inoxidável para aumentar sua resistência à oxidação e corrosão. Isso se deve à formação de uma película finíssima de óxido de cromo sobre a superfície do aço.

3. Óxido de cálcio abre parênteses C a O fecha parênteses: em geral, é obtido da decomposição (pirólise) do carbonato de cálcio abre parênteses C a C O subscrito 3 fecha parênteses. É utilizado na fabricação da cal hidratada para a construção civil (usada na argamassa e na pintura à base de cal, ou caiação), na agricultura (para tornar o solo menos ácido), na fabricação de tijolos refratários para fornos metalúrgicos, no tratamento de águas e esgotos e como fungicida, por exemplo.
4. Óxido nitroso abre parênteses N subscrito 2 O fecha parênteses: também chamado gás hilariante ou gás do riso, se for inalado em pequena quantidade, provoca euforia. Também pode ser utilizado como anestésico.

Página 399
Imagens desta página sem proporção.
5. Peróxido de hidrogênio abre parênteses H subscrito 2 O subscrito 2 fecha parênteses: esse composto forma uma solução conhecida como água oxigenada. Em soluções aquosas a 3% de peróxido de hidrogênio, é utilizada como antisséptico. Em maior concentração, em torno de 30%, é usada na indústria como alvejante de madeira e de fibras têxteis, pois sua decomposição pode ser feita de forma rápida, liberando o gás oxigênio abre parênteses O subscrito 2 fecha parênteses:
2 H subscrito 2 O subscrito 2 abre parênteses l fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
A concentração de peróxido de hidrogênio na água oxigenada, vendida nas farmácias, é dada em volumes. Um litro de água oxigenada a 10 volumes, por exemplo, produz em sua decomposição 10 litros de gás oxigênio, a 1 a t m e 0 grau Celsius. A decomposição da água oxigenada é acelerada pela ação da luz e do calor. Por essa razão, é comercializada em frascos escuros ou opacos e deve ser guardada em lugares frescos.

6. Dióxido de silício abre parênteses S i O subscrito 2 fecha parênteses: também chamado de sílica, é o principal componente da areia e o óxido mais abundante na crosta terrestre. É utilizado na fabricação do concreto, do vidro e de cerâmicas vitrificadas. Também é utilizado na forma de grãos, chamados sílica-gel, para absorver a umidade em recipientes nos quais são guardados aparelhos eletrônicos, por exemplo.

7. Dióxido de titânio abre parênteses T i O subscrito 2 fecha parênteses: é sólido de cor branca, usado como pigmento na indústria de corantes e tintas. O uso de tintas na cor branca é uma boa alternativa para criar ambientes mais iluminados, já que toda a luz do sol é refletida pela cor branca, reduzindo o gasto de energia elétrica. Além disso, esse óxido é utilizado em plásticos, pois ele dispersa a luz e protege contra radiação UV, preservando o material do desgaste químico e físico natural.

8. Óxido de estanho(IV) abre parênteses S n O subscrito 2 fecha parênteses: utilizado como pó para polimentos, em soldas na fabricação da folha de flandres (folha de ferro recoberta com uma camada desse óxido) e de embalagens para acondicionamento de alimentos.

Página 400
CONEXÕES com ... FÍSICA e BIOLOGIA
Protetor solar
A luz solar desempenha um papel crucial para a saúde humana, sendo fundamental para a síntese de vitamina D, essencial para a absorção de cálcio e, consequentemente, para a saúde óssea. Além disso, a exposição controlada ao sol pode ajudar no tratamento de doenças como a psoríase, uma condição crônica da pele, e na regulação dos ritmos circadianos, promovendo o bem-estar geral. No entanto, a exposição excessiva ou desprotegida pode acarretar sérios riscos à saúde.
O Sol emite uma ampla gama de radiações eletromagnéticas, que podem ser divididas em radiação ultravioleta (UV), visível e infravermelha. A radiação UV é subdividida em três categorias principais: UVC, UVB e UVA. A radiação UVC é a mais energética e perigosa, mas, felizmente, é quase completamente absorvida pela camada de ozônio e não atinge a superfície terrestre. A radiação UVB, que também é parcialmente filtrada pela atmosfera, é responsável pelas queimaduras solares e aumenta o risco de câncer de pele. A radiação UVA, menos energética que a UVB, penetra mais profundamente na pele, contribuindo para o envelhecimento precoce e para o desenvolvimento de câncer de pele. A interação da radiação UV com o DNA das células da pele pode causar mutações genéticas, que, acumuladas ao longo do tempo, aumentam o risco de câncer.
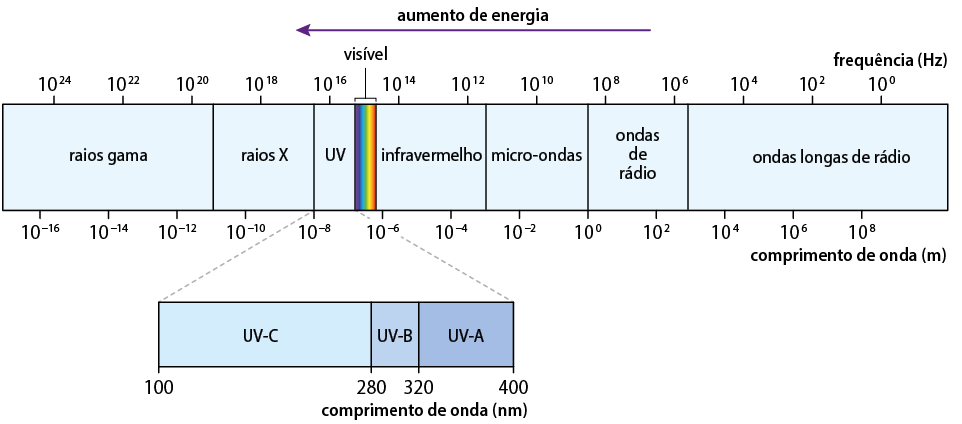
Imagem elaborada com base em: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 225.
Estatísticas mostram que o câncer de pele é um dos tipos de câncer mais comuns no mundo, com incidências crescentes em diversos países. No Brasil, por exemplo, o Instituto Nacional de Câncer (Inca) estima que em 2023 31,3% dos casos são de câncer não melanoma, que se desenvolve em células que não produzem melanina. Essa quantidade evidencia a importância de medidas preventivas adequadas para proteger a pele contra a radiação UV.
O estilo de vida moderno, que inclui profissões ao ar livre, atividades recreacionais e práticas esportivas, aumenta a exposição das pessoas ao sol. A infância é uma fase particularmente vulnerável, pois a pele das crianças é mais sensível à radiação UV, e as queimaduras solares na infância são um fator de risco significativo para o desenvolvimento de câncer de pele na vida adulta. Portanto, medidas preventivas são essenciais para garantir que a exposição à luz solar seja segura. Essas medidas incluem evitar a exposição ao sol entre 10 horas e 16 horas, quando a radiação UV é mais intensa, limitar o tempo de exposição, usar roupas adequadas que cubram a pele e aplicar protetores solares.
Página 401
Os protetores solares são produtos desenvolvidos para proteger a pele dos efeitos nocivos da radiação UV. Existem dois principais tipos de filtro solar: os inorgânicos (físicos) e os orgânicos (químicos). Os filtros inorgânicos, como o óxido de zinco e o dióxido de titânio, agem refletindo e dispersando a radiação UV, funcionando como uma barreira física. Esses compostos, que são óxidos, têm grande importância na química dos protetores solares em razão de sua eficácia e estabilidade. Por outro lado, os filtros orgânicos absorvem a radiação UV e a convertem em calor, sendo dissipado pela pele. Alguns exemplos de filtros orgânicos incluem o avobenzona e a oxibenzona.

A eficácia dos protetores solares é medida pelo Fator de Proteção Solar (FPS), que indica o grau de proteção oferecido contra a radiação UVB. É importante escolher um protetor solar adequado ao tipo de pele e ao nível de exposição esperado, reaplicando-o regularmente, especialmente após nadar ou transpirar.
Nesse sentido, atrelando questões de sustentabilidade e saúde pública, em sintonia com a Agenda 2030 da ONU, especialmente com os Objetivos de Desenvolvimento Sustentável (ODS) 3 e 12, que tratam de saúde e bem-estar e de produção e consumo responsáveis, o desenvolvimento e o uso de protetores solares promovem a saúde global ao prevenir doenças graves como o câncer de pele. Entretanto, é importante que o desenvolvimento desses produtos leve em consideração o impacto ambiental, como a possível contaminação de ecossistemas marinhos, em razão de alguns ingredientes químicos usados em sua composição, e fatores socioeconômicos, prevendo distribuição ou comercialização acessível à população.
O uso de protetores solares, combinados com outras medidas de proteção, é essencial para garantir uma exposição solar segura e saudável. Esses produtos, que têm uma sólida base científica envolvendo aplicações de Química, Física e Biologia, exemplificam a importância da integração entre diferentes conhecimentos para resolver problemas contemporâneos, em harmonia com os objetivos globais de saúde e sustentabilidade.
a ) Como a radiação UV interage com as células da pele e quais são as consequências biológicas dessa interação? Relacione essa interação com o conceito de mutação genética e com o desenvolvimento de câncer de pele.
b ) Explique como os filtros solares inorgânicos, como o óxido de zinco e o dióxido de titânio, aplicam princípios físicos para proteger a pele da radiação UV. Qual é a diferença no modo de ação entre filtros inorgânicos e filtros orgânicos?
c ) Considerando o espectro da radiação solar, por que a proteção contra a radiação UVB é enfatizada nos protetores solares? Como essa radiação específica é importante para a saúde do ser humano?
Respostas nas Orientações para o professor.
Página 402
ATIVIDADES
Imagens desta página sem proporção e em cores fantasia.
1. Os óxidos são classificados de acordo com o comportamento que apresentam ao entrarem em contato com a água. Assim, podem ser classificados como óxidos ácidos (anidridos), óxidos básicos (alcalinos), óxidos anfóteros ou óxidos neutros. Escreva a classificação dos óxidos para cada um dos recipientes (I, II e III) da ilustração a seguir.
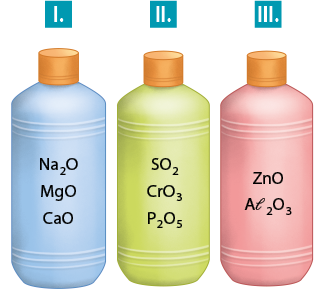
Resposta: Recipiente I: óxidos básicos; recipiente II: óxidos ácidos; recipiente III: óxidos anfóteros.
2. Escreva a fórmula química dos seguintes óxidos:
a ) monóxido de nitrogênio.
b ) monóxido de carbono.
c ) pentóxido de difósforo.
Resposta: a) N O; b) C O; c) P subscrito 2 O subscrito 5.
3. Relacione os óxidos citados à sua aplicação. Para isso, escreva o número romano e a letra correspondente.
I. óxido de cálcio
II. dióxido de carbono
III. dióxido de silício
IV. peróxido de hidrogênio
A. esterilização de ferimentos
B. fabricação de concreto
C. fabricação de vidro
D. apagar fogo em equipamentos elétricos
Resposta: I – B; II – D; III – C; IV – A.
4. Em um laboratório, um técnico derramou uma solução aquosa de ácido clorídrico abre parênteses H C l fecha parênteses sobre uma superfície de mármore abre parênteses C a C O subscrito 3 fecha parênteses. Que gás será liberado durante essa reação?
Resposta: Dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses. Há reação de neutralização: C a C O subscrito 3 abre parênteses s fecha parênteses mais H C 'L' abre parênteses a q fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses
5. O suco de limão contém ácido cítrico abre parênteses C subscrito 6 H subscrito 8 O subscrito 7 fecha parênteses. Em contato com metais, como o alumínio, o ácido cítrico pode causar corrosão. Qual tipo de reação química está envolvido nesse processo?
Resposta: Reação de oxidação.
6. Na ilustração a seguir, percebe-se que a biosfera é composta de litosfera, hidrosfera e atmosfera. Sabe-se também que a litosfera é formada principalmente por minerais pertencentes às funções químicas inorgânicas já estudadas. Quais são essas funções?

Resposta: Composta principalmente de minerais formados por óxidos e sais.
7. Quando o dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses é liberado na atmosfera por indústrias, ele pode reagir com a água presente no ar. Qual(is) ácido(s) é(são) formado(s) com essa reação?
Resposta: Ácido sulfúrico e ácido sulfuroso.
8. O papel sulfite, também conhecido como branco comum no formato A4 abre parênteses 21 centímetros vezes 29 vírgula 7 centímetros fecha parênteses, tem esse nome por causa do uso do sulfito de sódio no processo de descoloramento na manufatura do papel. Qual é a fórmula mínima dessa substância?
Resposta: N a subscrito 2 S O subscrito 3.
9. Confira o quadro a seguir, que mostra algumas soluções químicas e suas características.
| Solução | Características |
|---|---|
|
A – Ácido acético |
Ácido fraco, encontrado em vinagre. |
|
B – Bicarbonato de sódio |
Sal, frequentemente usado em receitas. |
|
C – Amônia |
Base forte, utilizada em produtos de limpeza. |
|
D – Ácido sulfúrico |
Ácido forte, utilizado em baterias. |
|
E – Hidróxido de cálcio |
Base forte, usada na agricultura. |
Página 403
Se um químico precisar neutralizar o ácido sulfúrico (Solução D), qual das seguintes substâncias seria mais apropriada para essa reação?
a ) Solução A (Ácido acético)
b ) Solução B (Bicarbonato de sódio)
c ) Solução C (Amônia)
d ) Solução E (Hidróxido de cálcio)
Resposta: Alternativa d.
10. Considere as seguintes fórmulas químicas de ácidos:
- H C l
- H subscrito 2 S O subscrito 4
- H N O subscrito 3
- H subscrito 2 C O subscrito 3
- H subscrito 3 P O subscrito 4
Com base nas regras de nomenclatura de ácidos de Arrhenius, qual das alternativas a seguir apresenta a nomenclatura correta para os ácidos listados?
a ) H C l – ácido clórico; H subscrito 2 S O subscrito 4 – ácido sulfúrico; H N O subscrito 3 – ácido nítrico; H subscrito 2 C O subscrito 3 – ácido carbônico; H subscrito 3 P O subscrito 4 – ácido fosfórico.
b ) H C l – ácido clorídrico; H subscrito 2 S O subscrito 4 – ácido sulfúrico; H N O subscrito 3 – ácido nítrico; H subscrito 2 C O subscrito 3 – ácido carbônico; H subscrito 3 P O subscrito 4 – ácido fosfórico.
c ) H C l – ácido clorato; H subscrito 2 S O subscrito 4 – ácido sulfúrico; H N O subscrito 3 – ácido nitroso; H subscrito 2 C O subscrito 3 – ácido hidrocarbonato; H subscrito 3 P O subscrito 4 – ácido fosfato.
d ) H C l – ácido clorídrico; H subscrito 2 S O subscrito 4 – ácido sulfuroso; H N O subscrito 3 – ácido nítrico; H subscrito 2 C O subscrito 3 – ácido metanoico; H subscrito 3 P O subscrito 4 – ácido fosfórico.
e ) H C l – ácido clorídrico; H subscrito 2 S O subscrito 4 – ácido sulfúrico; H N O subscrito 3 – ácido nitrato; H subscrito 2 C O subscrito 3 – ácido carbônico; H subscrito 3 P O subscrito 4 – ácido fosfórico.
Resposta: Alternativa b.
11. A formação da ferrugem é um fenômeno comum que afeta objetos de metal, especialmente aqueles feitos de ferro, sendo frequentemente observada em estruturas expostas à umidade, como pontes, carros e ferramentas. O principal composto responsável pela cor marrom-avermelhada da ferrugem é o óxido de ferro(III) abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses. Explique como esse composto é formado e qual reação química acontece.
Resposta: O ferro reage diretamente com a água, formando hidróxido de ferro(II), que, ao ser exposto ao oxigênio, se oxida e forma óxido de ferro(III).
12. A base fraca mais comum encontrada em produtos de limpeza é o hidróxido de amônio abre parênteses N H subscrito 4 O H fecha parênteses. Analise as alternativas a seguir e identifique aquela que apresenta a afirmativa correta sobre bases fortes e bases fracas em termos de dissociação em água.
a ) Essas substâncias apresentam diferença na ligação de hidrogênio formada com a água.
b ) Apenas bases fortes se dissociam em água.
c ) As bases fortes e bases fracas apresentam diferença na capacidade da dissociação em água.
d ) Não há diferença na dissociação dessas substâncias em água.
Resposta: Alternativa c.
13. O ácido fosfórico abre parênteses H subscrito 3 P O subscrito 4 fecha parênteses é amplamente utilizado na indústria alimentícia, especialmente em refrigerantes. Por meio da reação desse ácido com diferentes bases, como N a O H, C a abre parênteses O H fecha parênteses subscrito 2 e N H subscrito 4 O H, forma-se uma série de sais. Analise as reações a seguir e identifique a opção que apresenta o sal formado e uma aplicação sua.
a ) A reação entre H subscrito 3 P O subscrito 4 e N a O H forma fosfato de sódio abre parênteses N a subscrito 3 P O subscrito 4 fecha parênteses, utilizado como conservante em alimentos.
b ) A reação entre H subscrito 3 P O subscrito 4 e C a abre parênteses O H fecha parênteses subscrito 2 forma fosfato de cálcio abre parênteses C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 fecha parênteses, usado para evitar a precipitação de cálcio no refrigerante.
c ) A reação entre H subscrito 3 P O subscrito 4 e N H subscrito 4 O H forma fosfato de amônio abre parênteses abre parênteses N H subscrito 4 fecha parênteses subscrito 3 P O subscrito 4 fecha parênteses, utilizado como acidulante em bebidas.
d ) A reação entre H subscrito 3 P O subscrito 4 e C a abre parênteses O H fecha parênteses subscrito 2 forma fosfato de cálcio abre parênteses C a subscrito 3 abre parênteses P O subscrito 4 fecha parênteses subscrito 2 fecha parênteses, utilizado para fornecer cálcio aos refrigerantes.
Resposta: Alternativa b.
14. Tanto o hipoclorito de sódio abre parênteses N a C l O fecha parênteses quanto o peróxido de hidrogênio abre parênteses H subscrito 2 O subscrito 2 fecha parênteses são amplamente utilizados como agentes desinfetantes e alvejantes em diferentes aplicações. Considerando suas propriedades e reações, qual das alternativas a seguir compara corretamente o comportamento químico desses compostos?
a ) O hipoclorito de sódio é um agente oxidante mais forte que o peróxido de hidrogênio, por isso é indicado para limpar feridas abertas.
b ) Ambos os compostos são igualmente eficazes em soluções ácidas e liberam o mesmo tipo de subproduto durante a decomposição.
c ) O peróxido de hidrogênio se decompõe facilmente em água e oxigênio, enquanto o hipoclorito de sódio libera cloro gasoso quando está em contato com ácidos.
d ) O peróxido de hidrogênio reage com a matéria orgânica, liberando cloro gasoso, enquanto o hipoclorito de sódio libera oxigênio quando está em contato com catalisadores.
Resposta: Alternativa c.
Página 404
CAPÍTULO22
Cinética química
Taxa média de uma reação química
Confira a seguir as imagens obtidas por satélite. Elas mostram o buraco na camada de ozônio abre parênteses O subscrito 3 fecha parênteses na região da Antártida, no hemisfério Sul da Terra, no mês de setembro de diferentes anos. Depois, responda às questões propostas.
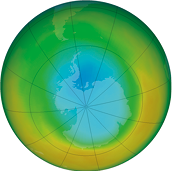
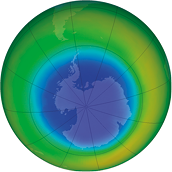
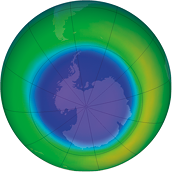
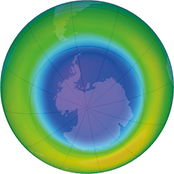
Professor, professora: Informações sobre a relação das cores nas imagens com a unidade Dobson nas Orientações para o professor.
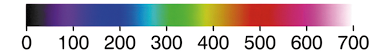
Dica
Cada unidade Dobson corresponde a 2 vírgula 69 vezes 10 elevado a 16 moléculas de ozônio por centímetro quadrado ou 2 vírgula 69 vezes 10 elevado a 20 moléculas por metro quadrado. Esses valores correspondem ao número de moléculas necessárias para formar uma camada de 0 vírgula 0 1 milímetro de espessura de gás ozônio puro, a 0 grau Celsius e pressão de 1 a t m. Assim, quanto maior o número de unidades, maior a concentração desse gás e, consequentemente, maior a espessura da camada de ozônio.
1. Qual é a importância da camada de ozônio para a vida na Terra e como a degradação dela pode prejudicar a biodiversidade?
Resposta: Espera-se que os estudantes respondam que a camada de ozônio atua como uma barreira de proteção, bloqueando parte da radiação ultravioleta proveniente do Sol e que pode prejudicar os seres vivos. Assim, quando degradada, os seres vivos ficam mais expostos a esse tipo de radiação, que pode causar a morte de diversas espécies, prejudicando, assim, a biodiversidade.
2. Analisando as imagens, o que você pode concluir com relação à degradação da camada de ozônio ao longo dos anos?
Resposta: Espera-se que os estudantes respondam que de 1979 a 1999 foi verificado um aumento progressivo do buraco nessa camada. Em 2023, no entanto, ela não continuou aumentando, provavelmente por conta, em parte, da redução de emissão de gases que causam a destruição da camada de ozônio.
Ao refletir sobre as questões anteriores, você deve ter percebido que, apesar de o buraco na camada de ozônio aumentar progressivamente durante alguns anos, em 2023 não houve um aumento expressivo. Essa conservação é resultado, em parte, do Protocolo de Montreal.
3. Qual é a importância do Protocolo de Montreal?
Resposta: Espera-se que os estudantes respondam que esse acordo internacional teve como objetivo reduzir os danos causados à camada de ozônio. Isso foi feito, por exemplo, pela redução até a total eliminação de gases produzidos e usados pelos seres humanos e que degradam o gás ozônio. Entre eles, os clorofluorcarbonos (CFCs), que são proibidos no Brasil desde 2010.
O gás ozônio é um dos componentes da atmosfera terrestre, sendo formado e degradado naturalmente. As reações químicas que descrevem sua formação (A) e sua decomposição (B) estão representadas a seguir de modo simplificado, sendo denominadas como ciclo de Chapman.
A. O subscrito 2 abre parênteses g fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, U V, fim do detalhe acima 2 O vezes abre parênteses g fecha parênteses
O vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, U V, fim do detalhe acima O subscrito 3 abre parênteses g fecha parênteses
B. O subscrito 3 abre parênteses g fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, U V, fim do detalhe acima O vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
Página 405
Repare que, para ocorrerem essas reações químicas, são necessários gás oxigênio abre parênteses O subscrito 2 fecha parênteses e incidência de radiação ultravioleta (UV). Essa radiação tem energia suficiente para romper a ligação entre dois átomos na molécula de oxigênio, gerando radicais✚ oxigênio abre parênteses O vezes fecha parênteses capazes de reagir com outra molécula de gás oxigênio.
Na estratosfera, essas reações são favorecidas por causa da alta incidência de radiação ultravioleta. Já na troposfera, o gás ozônio pode ser produzido por meio de processos de decomposição de poluentes liberados na queima de combustíveis fósseis, como os óxidos de nitrogênio e os hidrocarbonetos. Ao contrário da proteção fornecida pela camada de ozônio, a presença desse gás próximo à superfície da Terra pode causar irritação nas vias aéreas e nos olhos, sendo um risco à saúde humana.
Apesar da sua denominação, o buraco na camada de ozônio não é efetivamente um buraco, mas uma redução na espessura dessa camada. Esse fenômeno ocorre naturalmente todos os anos, durante a primavera no hemisfério Sul, quando as condições atmosféricas são favoráveis à reação de consumo de gás ozônio para formação de oxigênio molecular, o que diminui a concentração de gás ozônio na região da Antártida.
Embora seja um fenômeno natural, as atividades antrópicas, mais especificamente os gases liberados por elas, aceleram esse processo, ou seja, favorecem a reação de decomposição do ozônio, causando um desequilíbrio entre sua formação e decomposição.
Afinal, o que queremos dizer com acelerar o processo de consumo de gás ozônio? Para responder a essa pergunta, precisamos compreender os conceitos relacionados à Cinética química, que estuda as taxas das reações químicas. Confira o gráfico a seguir.
Professor, professora: Oriente os estudantes a generalizar as fórmulas de taxas médias de consumo e de produção de reagentes e a taxa média de reação, e aplicar a generalização à reação de consumo de gás ozônio: 2 O subscrito 3 abre parênteses g fecha parênteses seta para a direita 3 O subscrito 2 abre parênteses g fecha parênteses.
Variação da concentração de amônia abre parênteses N H subscrito 3 fecha parênteses em função do tempo
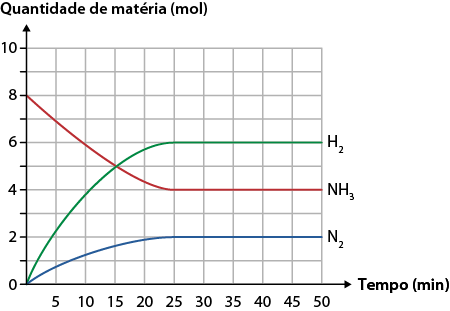
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 397.
Analisando o gráfico, note que a concentração do reagente abre parênteses N H subscrito 3 fecha parênteses diminui ao longo do tempo, enquanto a concentração de produtos (H subscrito 2 e N subscrito 2) aumenta ao longo do tempo. Para acompanhar essa variação, definimos a rapidez ou taxa média abre parênteses T subscrito m fecha parênteses de consumo (ou formação) de uma espécie química, que é definida como a variação da sua quantidade – comumente em quantidade de matéria, massa, concentração ou pressão – ao longo do tempo. No caso do consumo de N H subscrito 3 apresentado no gráfico, temos:
Professor, professora: Uma confusão comum está na diferença entre taxa de consumo de reagente, de formação de produto, e da reação como um todo. Diga aos estudantes que as duas primeiras dizem respeito a substâncias específicas e esta é uma forma prática de determinar o progresso da reação. Já a taxa média da reação diz respeito à reação como um todo e, por isso, cada taxa específica é dividida pelo coeficiente estequiométrico da substância em questão.
T subscrito m abre parênteses N H subscrito 3 fecha parênteses é igual a menos início de fração, numerador: símbolo de uma barra vertical variação na concentração de N H subscrito 3 símbolo de uma barra vertical, denominador: 't' subscrito final menos 't' subscrito inicial, fim de fração
Dica
A variação da concentração é em módulo, símbolo de uma barra vertical delta abre colchetes X fecha colchetes símbolo de uma barra vertical, o que significa que é sempre positiva. O valor negativo é inserido em alguns casos, pois há consumo de reagente.
- Radicais:
- átomos, íons ou moléculas que contêm um número ímpar de elétrons em sua última camada eletrônica, tornando-os altamente reativo.↰
Página 406
Imagens desta página sem proporção e em cores fantasia.
Para a produção de H subscrito 2, temos:
T subscrito m abre parênteses H subscrito 2 fecha parênteses é igual a início de fração, numerador: símbolo de uma barra vertical variação na concentração de H subscrito 2 símbolo de uma barra vertical, denominador: 't' subscrito final menos 't' subscrito inicial, fim de fração
Professor, professora: Se houver a possibilidade, use modelos moleculares ou massinhas de modelar para exemplificar as colisões que levam e que não levam à formação de produtos. Deixe claro que a probabilidade de colisão é um fator muito importante. Por isso, no geral, quanto maior for a temperatura de um sistema, maior será a taxa da reação, uma vez que os componentes se movimentarão mais rapidamente e haverá a possibilidade de se chocarem de modo efetivo.
Para a produção de N subscrito 2, temos:
T subscrito m abre parênteses N subscrito 2 fecha parênteses é igual a início de fração, numerador: símbolo de uma barra vertical variação na concentração de N subscrito 2 símbolo de uma barra vertical, denominador: 't' subscrito final menos 't' subscrito inicial, fim de fração
A rapidez ou taxa média da reação abre parênteses T início subscrito, m abre parênteses reação fecha parênteses, fim subscrito fecha parênteses pode ser calculada por:
T início subscrito, m abre parênteses reação fecha parênteses, fim subscrito é igual a menos início de fração, numerador: T subscrito m abre parênteses N H subscrito 3 fecha parênteses, denominador: a, fim de fração é igual a início de fração, numerador: T subscrito m abre parênteses H subscrito 2 fecha parênteses, denominador: b, fim de fração é igual a início de fração, numerador: T subscrito m abre parênteses N subscrito 2 fecha parênteses, denominador: c, fim de fração
Dica
As variáveis a, b e c são os coeficientes estequiométricos da amônia abre parênteses N H subscrito 3 fecha parênteses, do gás hidrogênio abre parênteses H subscrito 2 fecha parênteses e do gás nitrogênio abre parênteses N subscrito 2 fecha parênteses, respectivamente. Ou seja, a taxa média de reação depende da rapidez de consumo ou de formação das espécies envolvidas, levando em consideração a estequiometria da reação.

Teoria das colisões e formação do complexo ativado
As reações químicas estão presentes em diversas situações de nosso dia a dia. Cada uma dessas reações ocorre em uma taxa específica. Algumas ocorrem imediatamente após o contato dos reagentes, enquanto outras podem demorar milhares de anos para ocorrer. Nesse contexto, podemos nos questionar por que a taxa de reação é diferente para cada sistema. Para responder a essa questão, precisamos avaliar os sistemas na escala dos átomos e das moléculas.
Considere um recipiente fechado contendo gás hidrogênio. Há pouca interação entre as moléculas desse gás. Porém, por elas estarem em movimento constante, com determinada energia cinética, espera-se que eventualmente colidam entre si.
Ao adicionar vapor de iodo abre parênteses I subscrito 2 fecha parênteses a esse recipiente, poderá ocorrer uma reação química. Essa reação só ocorrerá quando houver contato, por meio de uma colisão eficaz, entre as moléculas de ambos reagentes (H subscrito 2 e I subscrito 2). As colisões não eficazes ou elásticas entre algumas moléculas não resultam na formação de produto.

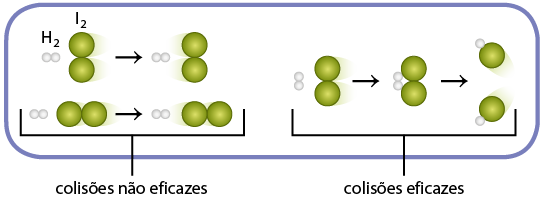
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 625.
Ou seja, em nível molecular, nem toda colisão entre moléculas resulta em reação química. Esses são os princípios do modelo de colisão, que afirma que, para a ocorrência de uma colisão eficaz, é necessário que dois requisitos sejam cumpridos. Conheça-os a seguir.
Página 407
Orientação
Note que, na reação química entre as moléculas de H subscrito 2 e I subscrito 2, as ligações H traço H e I traço I necessitam ser rompidas, de modo a possibilitar a formação da ligação entre os átomos de hidrogênio abre parênteses H fecha parênteses e de iodo abre parênteses I fecha parênteses. O rompimento e a formação de novas ligações ocorrem ao mesmo tempo, resultando em uma estrutura intermediária denominada complexo ativado. A colisão eficaz ocorre apenas quando as partículas (no exemplo, moléculas) de reagente colidem em uma orientação espacial que favoreça a formação do complexo ativado.
Imagens desta página sem proporção e em cores fantasia.

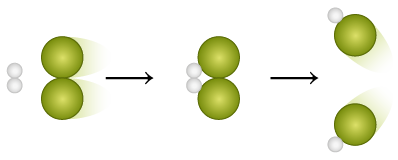
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 625.
Energia cinética mínima
A conversão de reagentes em complexo ativado requer que a colisão entre as partículas de reagente ocorra com uma energia cinética mínima, denominada energia de ativação. Essa energia é necessária, pois, em uma reação química, sempre há o rompimento de algumas ligações, o que demanda energia. Logo, variações de energia de uma reação química podem ser representadas em um gráfico de energia, em função do progresso da reação química.
Note que, nos gráficos a seguir, são representadas as energias de reagentes, produtos e complexo ativado, e que, independentemente de a reação química liberar energia (ser exotérmica) ou absorver energia (ser endotérmica), a formação do complexo ativado sempre envolve a absorção de energia. Assim, a energia de ativação abre parênteses E subscrito a fecha parênteses pode ser calculada subtraindo a energia do complexo ativado abre parênteses E subscrito c fecha parênteses e a energia dos reagentes abre parênteses E subscrito r fecha parênteses, dada por E subscrito a é igual a E subscrito c menos E subscrito r.
Diagrama de energia de uma reação exotérmica
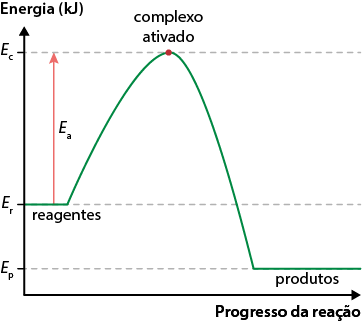
Diagrama de energia de uma reação endotérmica
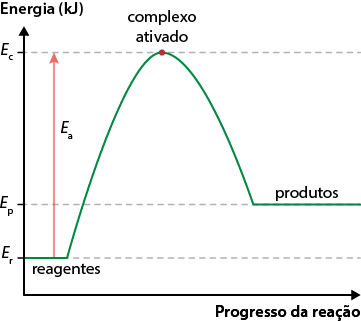
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 626.
Considerando, portanto, que em uma mistura de reagentes ocorrerão colisões eficazes e não eficazes, quanto maior for a probabilidade de uma colisão efetiva, maior será a taxa de uma reação química. Assim, quanto menor é a energia de ativação de uma reação química, maior é a probabilidade de ocorrência de colisões efetivas e maior é a rapidez da reação química. No próximo tópico, discutiremos como é possível controlar a taxa de uma reação química, baseando-se nos princípios do modelo de colisão.
Página 408
ATIVIDADES
1. A fotólise da água oxigenada abre parênteses H subscrito 2 O subscrito 2 fecha parênteses é a reação de decomposição que ocorre pela ação da luz, representada pela equação química:
2 H subscrito 2 O subscrito 2 abre parênteses a q fecha parênteses expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, lambda, fim do detalhe acima 2 H subscrito 2 O abre parênteses l fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
O quadro a seguir apresenta os dados relativos às variações das concentrações de H subscrito 2 O subscrito 2 em função do tempo a uma dada temperatura.
| H subscrito 2 O subscrito 2 abre parênteses mol barra litro fecha parênteses | Tempo minuto |
|---|---|
|
1,000 |
0 |
|
0,625 |
10 |
|
0,375 |
20 |
|
0,200 |
30 |
|
0,120 |
40 |
De acordo com os dados do quadro, responda às questões.
a ) Qual é a taxa média de consumo do reagente H subscrito 2 O subscrito 2 no intervalo de 10 a 20 minutos?
b ) A rapidez dessa reação é constante? Justifique sua resposta.
c ) Como devemos armazenar água oxigenada a fim de evitar sua decomposição?
Respostas nas Orientações para o professor.
2. O gráfico a seguir representa a variação das concentrações das substâncias A, B e C em um intervalo de tempo.
Variação das concentrações durante a reação química
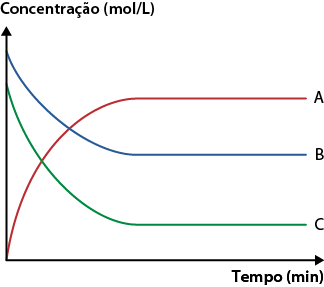
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 397.
Qual é a equação que melhor representa a reação ocorrida em função do tempo?
a ) A seta para a direita B mais C.
b ) B seta para a direita A mais C.
c ) C seta para a direita A mais B.
d ) B mais C seta para a direita A.
Resposta: Alternativa d. Resolução nas Orientações para o professor.
3. Considere a equação química genérica a seguir.
X mais Y seta para a direita Z mais W
Energia de ativação da reação
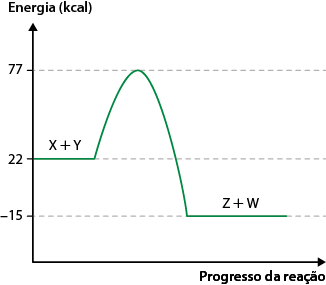
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 626.
De acordo com o diagrama de energia representado, responda às questões.
Resolução nas Orientações para o professor.
a ) Qual é a energia associada aos reagentes da reação química?
Resposta: Os reagentes são X e Y, portanto sua energia é 22 quilocalorias.
b ) Qual é a energia associada aos produtos da reação?
Resposta: Os produtos são Z e W, portanto sua energia é menos 15 quilocalorias.
c ) Qual é a energia do complexo ativado?
Resposta: A energia do complexo ativado é 77 quilocalorias.
d ) Qual é a energia de ativação da reação?
Resposta: E subscrito a é igual a 55 quilocalorias. Resolução nas Orientações para o professor.
e ) Qual é a variação de energia da reação?
Resposta: delta E é igual a menos 37 quilocalorias.
4. Analise o gráfico a seguir e escreva a alternativa correta.
Energia de ativação da reação
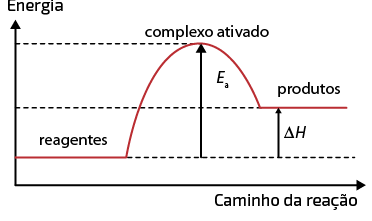
Fonte de pesquisa: ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 626.
a ) A entalpia dos produtos é maior do que a dos reagentes.
b ) A reação libera calor.
c ) O complexo ativado tem menos energia do que os reagentes.
d ) A reação absorve calor.
Resposta: Alternativa a. Comentários nas Orientações para o professor.
Página 409
A rapidez de uma reação química
O conhecimento a respeito da rapidez das reações químicas é de suma importância, por exemplo, para planejar e controlar processos industriais, compreender o tempo que o princípio ativo de um medicamento leva para agir em um organismo e projetar medidas que desacelerem algumas reações indesejadas.
Além disso, esse conhecimento tem grande relevância para explicar fenômenos do nosso cotidiano. Você já se perguntou por que mastigar bem os alimentos pode ajudar no processo de digestão? Ou por que armazenamos alguns alimentos na geladeira? Essas e tantas outras situações cotidianas estão relacionadas aos fatores que influenciam a taxa de uma reação química. Confira alguns deles a seguir.
Professor, professora: Incentive os estudantes a responder às questões propostas no texto.
Concentração
O aumento na concentração de uma espécie de reagente representa um maior número de espécies em um dado volume, o que amplia a possibilidade de ocorrer colisões eficazes. Dessa maneira, quanto maior for a concentração de um reagente, maior será a taxa da reação química.
Além da necessidade de uma fonte de ignição, o ato de abanar a lenha acelera a sua queima. Isso pode ser explicado por meio da equação química que representa a combustão desse material: C abre parênteses s fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses. O ato de abanar a lenha em brasa adiciona gás oxigênio ao sistema, aumentando sua concentração e, consequentemente, a rapidez da reação química.

Temperatura
Em um sistema fechado, a energia total é conservada, pois não há troca de matéria e de energia com o ambiente. Apesar disso, essa energia está distribuída de maneira heterogênea entre as partículas que compõem o sistema, de tal forma que algumas se movem com energia cinética maior do que outras.
Em um sistema que troca energia com o ambiente, o aquecimento fornece energia térmica que será convertida em energia cinética. Assim, a probabilidade de haver partículas colidindo com energia cinética mínima aumenta, ou seja, a probabilidade de a energia de ativação ser atingida e ocorrer a formação do complexo ativado é maior. Desse modo, o aumento da temperatura ocasiona o aumento na rapidez das reações químicas. O raciocínio oposto também é válido, e o resfriamento do sistema ocasiona a diminuição na rapidez das reações químicas.
Superfície de contato
Para que ocorra uma reação química, os reagentes precisam estar em contato. Portanto, a rapidez dessas reações também depende da área superficial que os reagentes apresentam no momento da reação. Nesse caso, quanto maior for a área superficial, maior será a superfície de contato e, portanto, mais rápida será a reação química.
A ferrugem é o produto da oxidação de objetos feitos de ferro abre parênteses Fe fecha parênteses, cuja primeira etapa é descrita por 2 F e abre parênteses s fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses seta para a direita 2 F e abre parênteses O H fecha parênteses subscrito 2 abre parênteses s fecha parênteses. Assim, para que a reação química ocorra, a superfície contendo ferro necessita estar em contato com o ar, que contém gás oxigênio e umidade na forma de vapor de água. Por isso, uma das maneiras de desacelerar a reação de formação da ferrugem é proteger a superfície de objetos de ferro com uma camada de tinta, para evitar o contato do ferro com os demais reagentes.

Página 410
Catalisadores
Professor, professora: Após abordar os catalisadores, comente com os estudantes que também existem substâncias classificadas como inibidores, que aumentam a energia de ativação de uma reação e diminuem sua taxa.
A rapidez de uma reação química também pode ser alterada pela presença de um catalisador, que atua diminuindo a energia de ativação da reação. Ou seja, a função de um catalisador é acelerar uma reação química. Ao final dela, esse catalisador é regenerado e pode continuar participando das mesmas reações químicas.
Vamos analisar, como exemplo, a reação de decomposição do peróxido de hidrogênio abre parênteses H subscrito 2 O subscrito 2 fecha parênteses. Na ausência de catalisador, a reação pode ser representada por 2 H subscrito 2 O subscrito 2 abre parênteses a q fecha parênteses seta para a direita 2 H subscrito 2 O abre parênteses l fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses. Contudo, na presença de um catalisador, como o íon brometo abre parênteses B r elevado a início expoente, menos, fim expoente fecha parênteses, a reação ocorre em duas etapas, mostradas no gráfico. Note que a energia de reagentes e de produtos não se altera, mas a energia de ativação das duas etapas da reação catalisada (E subscrito a 1 e E subscrito a 2) é menor que a da reação não catalisada abre parênteses E subscrito a fecha parênteses.
Diagrama de energia da reação de decomposição do H subscrito 2 O subscrito 2 catalisada e não catalisada
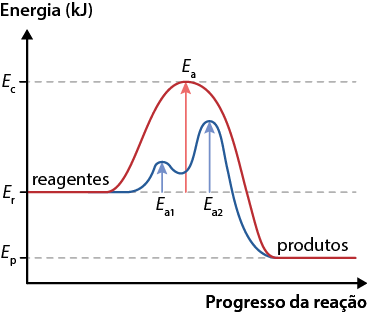
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 638.
No início deste capítulo, citamos que algumas substâncias destroem a camada de ozônio ao acelerar a decomposição do O subscrito 3. Agora que compreendemos o que é um catalisador, podemos entender melhor como a aceleração desse processo ocorre.
Em 1928, foram sintetizados, pela primeira vez, os clorofluorcarbonos (CFCs), compostos que contêm os elementos carbono, cloro abre parênteses C l fecha parênteses e/ou flúor abre parênteses F fecha parênteses. Com uma alta estabilidade química e baixo custo, foram amplamente aplicados como gás refrigerante em eletrodomésticos e propelentes de aerossol. No entanto, ao serem liberados no ambiente, dispersam-se até a estratosfera, onde a radiação ultravioleta é capaz de romper a ligação entre carbono e cloro, gerando radicais capazes de reagir com o ozônio, como mostram de forma simplificada as equações químicas a seguir.
C l vezes abre parênteses g fecha parênteses mais O subscrito 3 abre parênteses g fecha parênteses seta para a direita C l O vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
C l O vezes abre parênteses g fecha parênteses mais vezes O vezes abre parênteses g fecha parênteses seta para a direita C l vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses

Observe que o cloro e o ozônio reagem gerando o óxido de cloro abre parênteses C l O fecha parênteses, um intermediário da reação que, depois, reage com um átomo de oxigênio, regenerando o catalisador na segunda etapa da reação.
Apesar do destaque para os CFCs, eles não são os únicos gases com a capacidade de atingir a camada de ozônio. As altas emissões de óxidos de nitrogênio, provenientes de processos industriais e queima de combustíveis fósseis, também podem afetar a camada de ozônio. Um desses compostos, o óxido de dinitrogênio abre parênteses N subscrito 2 O fecha parênteses, além de ser um dos gases do efeito estufa, é o um dos principais responsáveis pela sua destruição.
4. Considerando as características dos catalisadores, por que um único radical cloro é capaz de reagir com milhares de moléculas de ozônio?
Resposta: Isso ocorre porque o radical cloro é regenerado ao final da reação química, podendo, em seguida, reagir com outras moléculas de ozônio.
Página 411
Conversor catalítico automotivo
O funcionamento da maioria dos veículos no Brasil se baseia na queima de combustíveis, como diesel, gasolina e etanol abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses. Além de energia, ocorre a liberação de produtos de combustão completa, como dióxido de carbono e gás nitrogênio, e de combustão incompleta, como monóxido de carbono abre parênteses C O fecha parênteses, óxido de nitrogênio abre parênteses N O fecha parênteses, dióxido de nitrogênio abre parênteses N O subscrito 2 fecha parênteses e hidrocarbonetos. Esse último grupo de gases, liberados pela combustão incompleta de combustíveis, é altamente tóxico aos seres vivos e prejudicial ao meio ambiente, estando relacionado, por exemplo, à intensificação do efeito estufa e à ocorrência de chuva ácida.

Imagens desta página sem proporção.
Visando reduzir a carga de poluentes potencialmente tóxicos emitidos pela queima de combustíveis no ambiente, foram desenvolvidos os conversores catalíticos veiculares: dispositivos que transformam gases tóxicos em gases menos poluentes ou não poluentes. Confira as reações químicas a seguir.
2 C subscrito 2 H subscrito 6 abre parênteses g fecha parênteses mais 7 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 4 C O subscrito 2 abre parênteses g fecha parênteses mais 6 H subscrito 2 O abre parênteses g fecha parênteses
2 C O abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 C O subscrito 2 abre parênteses g fecha parênteses
2 N O subscrito 2 abre parênteses g fecha parênteses mais 4 C O abre parênteses g fecha parênteses seta para a direita N subscrito 2 abre parênteses g fecha parênteses mais 4 C O subscrito 2 abre parênteses g fecha parênteses
A comercialização de automóveis com dispositivo para redução da emissão de gases poluentes é obrigatória desde 1997 pela lei nº 9.503 (Código de Trânsito Brasileiro), e a sua remoção pode ser considerada crime ambiental ou condução de veículo sem equipamento obrigatório, ficando o condutor sujeito a multa.
O arranjo interno do conversor catalítico é constituído de um material cerâmico ou metálico no formato de uma colmeia. Os canais são os locais por onde os gases passam e sofrem as reações químicas, tornando-se menos poluentes. Essa estrutura é revestida com óxido de alumínio abre parênteses A l subscrito 2 O subscrito 3 fecha parênteses e, sobre ela, fixa-se a substância que atua como catalisador. Para essa função, geralmente é utilizada uma liga de metais nobres, como paládio abre parênteses P d fecha parênteses e ródio abre parênteses R h fecha parênteses ou paládio e molibdênio abre parênteses M o fecha parênteses. Ao redor dessa estrutura, adiciona-se um revestimento de manta expansiva que tem como finalidade atuar como isolante térmico e dar resistência mecânica à colmeia. Por fim, um metal é utilizado como carcaça, conferindo o aspecto final do conversor catalítico.


O conversor catalítico de um veículo, geralmente, tem um tempo de vida médio de 80 mil quilômetros rodados. Após esse período, o conversor precisa ser trocado para que seja mantida a eficiência na transformação dos gases tóxicos.
a ) Com base nos fatores que afetam a rapidez de uma reação química, justifique por que é importante que o catalisador tenha o formato de colmeia.
Resposta: O formato de colmeia aumenta a área superficial do catalisador e, portanto, a área de contato com os gases.
b ) Por que a inalação de monóxido de carbono pode ser prejudicial ao organismo? Se necessário, faça uma pesquisa.
Resposta: Ao ser inalado, o monóxido de carbono atinge a corrente sanguínea. No sangue, ele compete com o gás oxigênio para se ligar à hemoglobina, o primeiro se liga preferencialmente à hemoglobina, pois é mais energético. Como resultado, o transporte de gás oxigênio pelo sangue é comprometido e, consequentemente, a oxigenação dos tecidos.
c ) Converse com seus familiares ou conhecidos que possuam veículo e pergunte se eles costumam fazer a manutenção de itens veiculares, como catalisadores e filtros, e se ficam atentos à qualidade do combustível.
Resposta pessoal. O objetivo dessa questão é incentivar a refletir sobre esse tipo de cuidado na manutenção de veículos.
Página 412
Lei cinética das reações químicas
Ao longo deste capítulo, estudamos que a rapidez de uma reação química depende, entre outros fatores, da concentração de reagente e da temperatura. Mas como podemos expressar isso matematicamente? Considere a equação química a seguir.
N subscrito 2 abre parênteses g fecha parênteses mais 2 O subscrito 2 abre parênteses g fecha parênteses seta para a direita 2 N O subscrito 2 abre parênteses g fecha parênteses
Professor, professora: Diga aos estudantes que a notação abre colchetes A fecha colchetes significa "concentração da espécie química A em mol por litro".
Essa reação química acontece em uma etapa e, portanto, é denominada reação elementar. Em nível molecular, isso significa que, para ela ocorrer, é necessário o choque de uma molécula de N subscrito 2 e duas de O subscrito 2. A lei cinética dessa reação pode ser expressa por:
T subscrito i é igual a menos k vezes abre colchetes N subscrito 2 fecha colchetes elevado a 1 vezes abre colchetes O subscrito 2 fecha colchetes elevado ao quadrado
em que T subscrito i é taxa instantânea de reação, k é a constante de rapidez de reação (dependente da temperatura), e abre colchetes N subscrito 2 fecha colchetes e abre colchetes O subscrito 2 fecha colchetes são as concentrações de nitrogênio e oxigênio, em mol por litro. Repare que a concentração dos reagentes é elevada por um expoente equivalente aos coeficientes estequiométricos correspondentes.
Professor, professora: Enfatize que os coeficientes estequiométricos são utilizados somente na lei de velocidade de reações elementares, pois em outras situações são parâmetros experimentais.
Considere agora a reação química a seguir, que ocorre em duas etapas com taxas distintas.
Etapa 1 (lenta): H subscrito 2 abre parênteses g fecha parênteses mais 2 N O abre parênteses g fecha parênteses seta para a direita N subscrito 2 O abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses
Etapa 2 (rápida): H subscrito 2 abre parênteses g fecha parênteses mais N subscrito 2 O abre parênteses g fecha parênteses seta para a direita N subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses
Reação global: 2 H subscrito 2 abre parênteses g fecha parênteses mais 2 N O abre parênteses g fecha parênteses seta para a direita N subscrito 2 abre parênteses g fecha parênteses mais 2 H subscrito 2 O abre parênteses g fecha parênteses
Nesse caso, temos uma reação não elementar, na qual cada etapa é uma reação elementar e a taxa é determinada pela etapa lenta. Nesse caso, a equação da taxa instantânea da reação é:
T subscrito i é igual a k vezes abre colchetes H subscrito 2 fecha colchetes vezes abre colchetes N O fecha colchetes elevado ao quadrado
Repare que, nesse caso, é necessário saber o caminho que a reação percorre, ou seja, o mecanismo da reação. Os expoentes que elevam as concentrações não correspondem ao coeficiente estequiométrico da reação global e precisam ser determinados experimentalmente. Eles são denominados de ordens de reação.
Os expoentes definem a ordem da reação química, que determina como a rapidez varia em função da concentração dos reagentes. No caso da reação entre N subscrito 2 e O subscrito 2, a ordem em relação a cada reagente é, respectivamente, 1 e 2. Já a ordem global da reação é determinada pela soma desses expoentes, portanto 3.
Dica
Uma reação é de ordem zero em relação a um reagente se a alteração da concentração dele não causar alteração na rapidez de reação; de ordem 1 em relação a um reagente se, ao duplicar a concentração dele, a rapidez de reação também duplicar; de ordem n em relação a um reagente se, ao multiplicar a concentração dele por 2, a rapidez de reação for multiplicada por 2 elevado a n – a base 2 dessa potência refere-se à alteração ocorrida na concentração do reagente.
Os químicos noruegueses Cato Maximilian Guldberg (1836-1902) e Peter Waage (1833-1900) enunciaram a lei de ação das massas. Essa lei afirma que, a dada temperatura, a rapidez de reação é diretamente proporcional ao produto das concentrações em quantidade de matéria dos reagentes elevadas a expoentes que são determinados experimentalmente. A equação resultante é denominada lei cinética das reações químicas ou lei cinética de Guldberg-Waage.
5. Com base nas informações anteriores, apresente a expressão matemática da lei cinética das reações químicas para uma reação genérica entre dois reagentes. Qual é a ordem de reação em relação a cada reagente e a ordem global da reação?
Resposta: Suponha a reação genérica: x A mais y B seta para a direita z C mais w D. A lei cinética é dada por: T subscrito i é igual a k vezes abre colchetes A fecha colchetes elevado a 'm' vezes abre colchetes B fecha colchetes elevado a n. A ordem em relação a A: 'm'; em relação a B: n; global: 'm' mais n. Comente com os estudantes que, como não determinamos se a reação é elementar ou não, a ordem em relação aos reagentes pode ser diferente dos coeficientes estequiométricos da reação.
Página 413
ATIVIDADES RESOLVIDAS
R1. Os íons bromato abre parênteses B r O subscrito 3 elevado a início expoente, menos, fim expoente fecha parênteses reagem com íons brometo abre parênteses B r elevado a início expoente, menos, fim expoente fecha parênteses para formar bromo abre parênteses B r subscrito 2 fecha parênteses, de acordo com a equação química:
B r O subscrito 3 elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais 5 B r elevado a início expoente, menos, fim expoente abre parênteses a q fecha parênteses mais 6 H subscrito 3 O elevado a início expoente, mais, fim expoente abre parênteses a q fecha parênteses seta para a direita 3 B r subscrito 2 abre parênteses a q fecha parênteses mais 9 H subscrito 2 O abre parênteses l fecha parênteses
A concentração de íons bromato foi monitorada a 25 graus Celsius em quatro experimentos, cada um com diferentes concentrações iniciais de reagentes, como apresentado no quadro.
| Experimento | abre colchetes B r O subscrito 3 elevado a início expoente, menos, fim expoente fecha colchetes abre parênteses mol barra litro fecha parênteses | abre colchetes B r elevado a início expoente, menos, fim expoente fecha colchetes abre parênteses mol barra litro fecha parênteses | abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes abre parênteses mol barra litro fecha parênteses | T subscrito i abre parênteses mol barra litro vezes segundo fecha parênteses |
|---|---|---|---|---|
|
1 |
0,10 |
0,10 |
0,10 |
0,0012 |
|
2 |
0,20 |
0,10 |
0,10 |
0,0024 |
|
3 |
0,10 |
0,30 |
0,10 |
0,0036 |
|
4 |
0,20 |
0,10 |
0,20 |
0,0096 |
Qual é a expressão da lei de Guldberg-Waage para essa reação?
Resolução
Primeiro, é necessário determinar a ordem em relação a cada espécie.
B r O subscrito 3 elevado a início expoente, menos, fim expoente: comparando os experimentos 1 e 2, em que apenas a concentração de íons bromato varia, nota-se que abre colchetes B r O subscrito 3 elevado a início expoente, menos, fim expoente fecha colchetes elevado a 1 é diretamente proporcional a T subscrito i. Ou seja, a ordem é igual a 1.
B r elevado a início expoente, menos, fim expoente: comparando os experimentos 1 e 3, em que apenas a concentração de íons brometo varia, nota-se que abre colchetes B r elevado a início expoente, menos, fim expoente fecha colchetes elevado a 1 é diretamente proporcional a T subscrito i. Ou seja, a ordem é igual a 1.
H subscrito 3 O elevado a início expoente, mais, fim expoente: comparando os experimentos 2 e 4, em que apenas a concentração de íons oxônio varia, nota-se que abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes elevado ao quadrado é diretamente proporcional a T subscrito i. Ou seja, a ordem é igual a 2.
A expressão da lei de Guldberg-Waage é, portanto: T subscrito i é igual a k vezes abre colchetes B r O subscrito 3 elevado a início expoente, menos, fim expoente fecha colchetes vezes abre colchetes B r elevado a início expoente, menos, fim expoente fecha colchetes vezes abre colchetes H subscrito 3 O elevado a início expoente, mais, fim expoente fecha colchetes elevado ao quadrado.
Observando a equação global de uma reação química, não é possível determinar se ela é uma reação elementar ou não. Essa informação, que nos possibilita determinar a lei cinética para dada reação, pode ser obtida por meio de experimentos. Nesse caso, um dos principais métodos baseia-se em acompanhar a variação da concentração dos reagentes em função do tempo, no denominado método das taxas iniciais.
Vamos utilizar, como exemplo, a reação química de decomposição do pentóxido de dinitrogênio abre parênteses N subscrito 2 O subscrito 5 fecha parênteses, dada por:
2 N subscrito 2 O subscrito 5 abre parênteses g fecha parênteses seta para a direita 4 N O subscrito 2 abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses
Foram realizados cinco experimentos com concentrações iniciais distintas. Confira o gráfico a seguir.
Concentração de N subscrito 2 O subscrito 5 em função do tempo
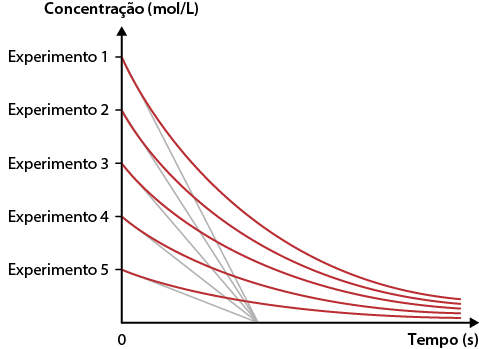
Fonte de pesquisa: BURROWS, Andrew et al. Chemistry3: introducing inorganic, organic and physical chemistry. 3. ed. Inglaterra: Oxford University Press, 2017. p. 409.
Note que a taxa da reação muda e, nos instantes iniciais da reação química, a curva aproxima-se de uma reta. É nessa faixa que a taxa média de consumo do reagente é equivalente à taxa inicial da reação, dada por:
T subscrito 0 é igual a menos início de fração, numerador: delta abre colchetes N subscrito 2 O subscrito 5 fecha colchetes, denominador: delta 't', fim de fração
Para essa reação, correlacionando a concentração inicial de reagente e a taxa de reação, verifica-se que elas são diretamente proporcionais. Ou seja, a ordem da reação é igual a 1.
6. Utilizando a lei cinética para a reação entre os íons B r O subscrito 3 elevado a início expoente, menos, fim expoente e B r elevado a início expoente, menos, fim expoente, determine o valor de k da reação.
Resposta: k é igual a 12 litros elevado ao cubo barra mol elevado ao cubo vezes segundo. Resolução nas Orientações para o professor.
7. Por que devemos manter a temperatura constante durante os experimentos realizados no método das taxas iniciais?
Resposta: A variação da temperatura pode mudar o valor de k e levá-lo às taxas iniciais sem correlação apenas com a concentração de reagente.
Página 414
PRÁTICA CIENTÍFICA
Cinética química
Por dentro do contexto
Você já viu alguém utilizando uma folha de jornal para enrolar um abacate ou uma banana verde, a fim de acelerar o amadurecimento desses frutos? Essa é uma prática que costuma ser disseminada pelo conhecimento popular e que, a princípio, pode parecer estranha para muitos, mas ela de fato contribui para a diminuição do tempo de amadurecimento de certos frutos.
Bananeira (Musa sp.): pode atingir aproximadamente 3 metros de altura.

A colheita dos frutos verdes facilita o manuseio e o transporte, além de ampliar o tempo de conservação desses itens após a colheita.
A banana e o abacate são frutos climatéricos, isto é, que amadurecem após serem colhidos, em razão da produção do gás eteno abre parênteses C subscrito 2 H subscrito 4 fecha parênteses pelo próprio fruto, o qual atua no seu amadurecimento.
Existem diversos fatores que podem alterar a rapidez das reações químicas, seja em processos biológicos ligados ao nosso cotidiano, como no exemplo citado, ou em laboratório.
a ) Considerando as informações apresentadas, formule uma hipótese explicando o motivo de a prática de enrolar os frutos em jornal acelerar o amadurecimento deles.
Resposta pessoal. O objetivo desta questão é levar os estudantes a relacionar práticas do cotidiano com a cinética das reações químicas. Como o eteno é um gás, o jornal usado para envolver o fruto funciona como uma barreira, impedindo sua liberação para o ambiente e mantendo a concentração desse gás próximo ao fruto maior, o que acelera seu amadurecimento.
Materiais
- 8 comprimidos efervescentes
- 7 copos
- água
- vinagre
- gelo
- colher
- caneta permanente
- cronômetro
- ebulidor ou chaleira elétrica
- smartphone
Dica
Filme as reações de cada etapa com o smartphone.
Como proceder
Procedimento 1
A. Com a caneta permanente, identifique dois copos com os números 1 e 2 e adicione água até a metade de cada um deles.
B. No copo 1, acrescente um comprimido efervescente inteiro e cronometre o tempo gasto até o final da reação de dissolução. Anote o valor de tempo marcado no cronômetro.
Imagens desta página sem proporção e em cores fantasia.

C. Com a colher, triture um comprimido efervescente.
D. No copo 2, coloque o comprimido triturado e marque o tempo até o final da reação. Anote o valor marcado no cronômetro.
Página 415
Procedimento 2
E. Com a caneta permanente, identifique três copos da seguinte forma: 3 (água fria); 4 (água em temperatura ambiente); e 5 (água quente).
F. No copo 3, acrescente algumas pedras de gelo e água até metade de seu volume. No copo 4, acrescente água à temperatura ambiente até metade de seu volume. No copo 5, com auxílio de um adulto, aqueça um pouco de água e acrescente até metade de seu volume. A água pode ser aquecida em uma chaleira elétrica ou com um ebulidor.
Imagens desta página sem proporção e em cores fantasia.

G. Em seguida, coloque um comprimido efervescente em cada copo e observe em qual deles a reação ocorre em menor e em maior tempo. Anote os resultados.
Procedimento 3
H. Identifique dois copos com os números 6 e 7 e adicione vinagre até a metade de cada um deles.
I. No copo 6, adicione um comprimido efervescente e cronometre o tempo para que o comprimido se dissolva.

J. No copo 7, coloque 2 comprimidos de maneira simultânea e marque o tempo que a reação leva para ocorrer.

Análise e divulgação
1. Identifique o fator que altera a velocidade das reações em cada um dos procedimentos.
Resposta: Procedimento 1: superfície de contato; Procedimento 2: temperatura; Procedimento 3: concentração dos reagentes.
2. Considerando o Procedimento 1, houve diferença no tempo de dissolução dos comprimidos nos copos 1 e 2? Explique sua resposta.
Resposta: Espera-se que os estudantes respondam que sim, pois a trituração do comprimido efervescente adicionado ao copo 2 aumenta a superfície de contato e, consequentemente, a velocidade da reação.
3. Relacione as observações do Procedimento 1 com a importância da mastigação durante uma refeição.
Resposta: A mastigação faz os alimentos serem cortados em partes menores, permitindo que sejam digeridos mais rapidamente pelo nosso organismo.
4. Registre, em ordem crescente e de maneira qualitativa, o tempo de ocorrência das reações realizadas no Procedimento 2. Justifique sua resposta.
Resposta: Da menor para a maior ordem: copo 3, copo 4 e copo 5. Quanto maior a temperatura, maior a agitação das partículas, o que favorece o encontro delas no meio e a ocorrência das reações químicas. Assim, no copo 5 (água quente) foi necessário um menor tempo para ocorrência da reação. Por outro lado, em baixas temperaturas, a reação ocorre mais lentamente, fazendo que a reação no copo 3 (água fria) fosse a mais demorada.
5. Relacione as observações do Procedimento 2 com a importância do uso da geladeira na conservação de alimentos, em geral.
Resposta: A geladeira proporciona maior tempo de vida útil aos alimentos ao possibilitar seu armazenamento em baixas temperaturas, diminuindo a atividade de microrganismos que causam sua deterioração.
6. Em qual dos copos, 6 ou 7, as reações processam mais rapidamente? Justifique sua resposta.
Resposta: No copo 7, uma vez que o aumento da concentração dos reagentes favorece o aumento das colisões eficazes entre as partículas que reagem.
7. Em todos os procedimentos, há um indício de ocorrência de reações químicas. Cite-o.
Resposta: Liberação de gás, representada pela formação de bolha de dióxido de carbono.
8. Publique em um blog os resultados do seu experimento. Utilize as gravações registradas durante a atividade prática e apresente-as com as análises realizadas, destacando quais foram os fatores que influenciaram a reação química de dissolução do comprimido efervescente e como eles afetaram a rapidez dela.
Resposta pessoal. Oriente os estudantes a como registrar as atividades e quais informações devem ser publicadas.
Atividade(s) adaptada(s) acessível(is)
8. Com um colega, publiquem em um blog os resultados do experimento. Utilizem as gravações registradas durante a atividade prática e as apresentem com as análises realizadas, destacando quais foram os fatores que influenciaram a reação química de dissolução do comprimido efervescente e como eles afetaram a rapidez dela.
Resposta pessoal. Oriente os estudantes a como registrar as atividades e quais informações devem ser publicadas.
Orientação para acessibilidade
Professor, professora: Organize os grupos de modo que o estudante não vidente esteja acompanhado de um estudante vidente. É possível organizar diferentes tarefas para cada um dos estudantes.
Página 416
ATIVIDADES
Imagens desta página sem proporção e em cores fantasia.
1. Alguns fatores podem alterar a rapidez das reações químicas. Para exemplificar essa interferência, um professor colocou um fio de zinco metálico abre parênteses Z n fecha parênteses em uma solução de ácido sulfúrico abre parênteses H subscrito 2 S O subscrito 4 fecha parênteses diluída (tubo A) e outro fio de zinco metálico em uma solução concentrada (tubo B).
A.

B.

Elabore uma explicação para os resultados observados em cada um dos tubos.
Resposta: Espera-se que os estudantes comentem que o fio de zinco, na solução concentrada de ácido sulfúrico (tubo II), libera muitas bolhas, indicando que a reação está ocorrendo mais rapidamente do que no tubo I. Essa reação ocorre com maior rapidez por causa da maior concentração de um dos reagentes, nesse caso o ácido sulfúrico, que é maior no tubo II, aumentando, assim, o número de partículas por unidade de volume e o número de colisões entre as partículas dos reagentes.
2. Considere o gráfico a seguir, que corresponde à variação da pressão de metilcarbilamina abre parênteses C H subscrito 3 N C fecha parênteses em sua reação de conversão em etanonitrila abre parênteses C H subscrito 3 C N fecha parênteses.
Variação da pressão de C H subscrito 3 N C em função do tempo
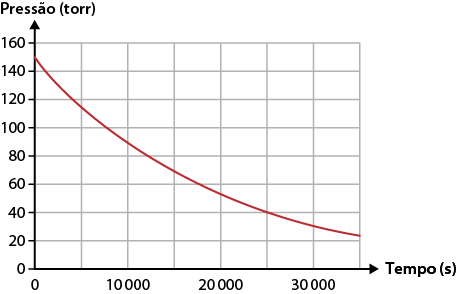
Fonte de pesquisa: BROWN, Theodore L. et al. Química: a ciência central. 13. ed. São Paulo: Pearson, 2016. p. 619.
a ) A taxa média de consumo do reagente é a mesma ao longo de diferentes intervalos de tempo? Calcule os valores correspondentes aos intervalos de tempo entre 0 e 10.000 segundos e 10.000 e 20.000 segundos.
Resposta: Não, pois a taxa média de consumo de reagente diminui
ao longo do tempo.
T subscrito m é igual a menos início de fração, numerador: símbolo de uma barra vertical 90 menos 150 símbolo de uma barra vertical, denominador: abre parênteses 10.000 menos 0 fecha parênteses, fim de fração portanto T subscrito m é igual a menos 0 vírgula 0 0 6 torr barra segundo
T subscrito m é igual a menos início de fração, numerador: símbolo de uma barra vertical 55 menos 90 símbolo de uma barra vertical, denominador: abre parênteses 20.000 menos 10.000 fecha parênteses, fim de fração portanto T subscrito m é igual a menos 0 vírgula 0 0 35 torr por segundo
b ) Como a variação da taxa de uma reação química com a concentração de um reagente pode explicar isso?
Resposta: No decorrer da reação, a concentração ou quantidade de reagente diminui, ocasionando a diminuição na rapidez da reação.
3. Confira o quadro a seguir, que apresenta os valores de rapidez da reação de decomposição do ácido clorídrico abre parênteses H C l fecha parênteses para quatro experimentos que partem de diferentes valores de concentração inicial dessa substância.
| nº do experimento | abre colchetes H C l fecha colchetes abre parênteses mol barra litro fecha parênteses | Rapidez abre parênteses mol barra litro vezes minuto fecha parênteses |
|---|---|---|
|
Experimento 1 |
0,10 |
1 vírgula 0 1 vezes 10 elevado a menos 3 |
|
Experimento 2 |
0,20 |
2 vírgula 0 2 vezes 10 elevado a menos 3 |
|
Experimento 3 |
0,40 |
4 vírgula 0 4 vezes 10 elevado a menos 3 |
|
Experimento 4 |
0,60 |
6 vírgula 0 6 vezes 10 elevado a menos 3 |
Com base nas informações do quadro e na reação química dada por 2 H C l abre parênteses g fecha parênteses seta para a direita H subscrito 2 abre parênteses g fecha parênteses mais C l abre parênteses g fecha parênteses, determine:
a ) a ordem global da reação;
b ) a lei cinética da reação;
c ) a constante k da taxa de desenvolvimento.
Respostas e resoluções nas Orientações para o professor.
Página 417
4. Explique os fenômenos a seguir.
a ) Frutas refrigeradas amadurecem mais devagar.
Resposta: A temperatura é um fator que, no geral, afeta na velocidade das reações químicas. Sendo assim, temperaturas baixas podem retardar o amadurecimento das frutas.
b ) Uma pastilha efervescente triturada em água se decompõe mais rápido do que uma pastilha inteira.
Resposta: Quanto maior a superfície de contato, mais rapidamente as reações acontecem.
c ) Os alimentos cozinham mais rápido em uma panela de pressão.
Resposta: O aumento da pressão dentro da panela faz a temperatura de ebulição da água aumentar. Um aumento na temperatura promove a diminuição do tempo de cozimento.
5. Considere que o processo de decomposição do gás pentóxido de dinitrogênio abre parênteses N subscrito 2 O subscrito 5 fecha parênteses seja uma reação de primeira ordem, conforme a seguinte equação química:
2 N subscrito 2 O subscrito 5 seta para a direita 4 N O subscrito 2 mais O subscrito 2
De acordo com a lei cinética de Guldberg-Waage, escreva a equação de rapidez da reação.
Resposta: T subscrito reação é igual a k vezes abre colchetes N subscrito 2 O subscrito 5 fecha colchetes.
6. A reação do íon hipoclorito, principal componente da água sanitária, com corantes, produz substâncias incolores. Os dados experimentais no quadro apresentam a relação das quantidades e a taxa de desenvolvimento da reação em três experimentos.
| Experimento | 1 | 2 | 3 |
|---|---|---|---|
|
abre colchetes C l O elevado a início expoente, menos, fim expoente fecha colchetes abre parênteses mol por litro fecha parênteses |
1 vírgula 7 vezes 10 elevado a menos 3 |
3 vírgula 4 vezes 10 elevado a menos 3 |
1 vírgula 7 vezes 10 elevado a menos 3 |
|
abre colchetes corante fecha colchetes abre parênteses mol por litro fecha parênteses |
1 vírgula 7 vezes 10 elevado a menos 2 |
1 vírgula 7 vezes 10 elevado a menos 2 |
3 vírgula 4 vezes 10 elevado a menos 2 |
|
Rapidez inicial abre parênteses mol por litro fecha parênteses |
1 vírgula 7 vezes 10 elevado a 4 |
3 vírgula 4 vezes 10 elevado a 4 |
3 vírgula 4 vezes 10 elevado a 4 |
Considerando os dados, determine a lei de reação e a expressão para definir o valor de k.
7. Na reação química hipotética X mais Y seta para a direita Z, verificou-se a alteração da concentração do reagente X em função do tempo, segundo o quadro.
| abre colchetes X fecha colchetes abre parênteses mol por litro fecha parênteses | Tempo segundo |
|---|---|
|
0 vírgula 255 |
0 |
|
0 vírgula 220 |
120 |
|
0 vírgula 200 |
240 |
|
0 vírgula 190 |
360 |
|
0 vírgula 100 |
720 |
De acordo com os dados do quadro, qual é a taxa de desenvolvimento média do reagente X, no intervalo de 4 a 6 minutos?
Resposta: T início subscrito, m abre colchetes X fecha colchetes, fim subscrito é igual a menos início de fração, numerador: símbolo de uma barra vertical quantidade de X consumida símbolo de uma barra vertical, denominador: delta 't', fim de fração é igual a menos início de fração, numerador: símbolo de uma barra vertical 0 vírgula 190 menos 0 vírgula 200 símbolo de uma barra vertical, denominador: 6 menos 4, fim de fração é igual a menos início de fração, numerador: símbolo de uma barra vertical menos 0 vírgula 0 1 símbolo de uma barra vertical, denominador: 2, fim de fração é igual a menos 0 vírgula 0 0 5 mol barra litro vezes minuto.
8. O quadro mostra os dados da análise cinética obtida para a seguinte reação hipotética:
X abre parênteses g fecha parênteses mais 2 Y abre parênteses g fecha parênteses seta para a direita 2 watts abre parênteses g fecha parênteses
| Experimento | abre colchetes X fecha colchetes abre parênteses mol por litro fecha parênteses | abre colchetes Y fecha colchetes abre parênteses mol por litro fecha parênteses | Taxa de desenvolvimento da reação abre parênteses mol barra litro vezes segundo fecha parênteses |
|---|---|---|---|
|
1 |
1,5 |
1,5 |
0,025 |
|
2 |
4,5 |
1,5 |
0,225 |
|
3 |
1,5 |
3,0 |
0,050 |
Qual é a expressão da lei de Guldberg-Waage para essa reação?
Respostas e resoluções das questões 6 e 8 nas Orientações para o professor.
9. O esquema a seguir apresenta as reações químicas envolvidas na destruição da camada de ozônio, iniciada pelos gases CFCs, os clorofluorcarbonos. Analise o esquema e responda aos itens propostos.
Imagem sem proporção e em cores fantasia.
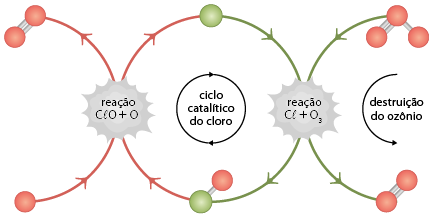
Imagem elaborada com base em: MECANISMOS de destruição do ozônio. Programa Brasileiro de Eliminação dos HCFCs, Brasília, 19 maio 2017. Disponível em: https://s.livro.pro/d9dnrc. Acesso em: 13 set. 2024.
a ) Escreva as equações químicas envolvidas na degradação da molécula de ozônio.
Resposta: Primeira etapa: C l vezes abre parênteses g fecha parênteses mais O subscrito 3 abre parênteses g fecha parênteses seta para a direita C l O vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses. Segunda etapa: C l O vezes abre parênteses g fecha parênteses mais vezes O vezes abre parênteses g fecha parênteses seta para a direita C l vezes abre parênteses g fecha parênteses mais O subscrito 2 abre parênteses g fecha parênteses.
b ) O esquema já considera o radical cloro formado. Contudo, explique como ocorre sua formação.
Resposta: Ao chegarem à estratosfera, as ligações entre o átomo de carbono e o átomo de cloro ou flúor dos CFCs são quebradas pela radiação ultravioleta, formando o radical.
c ) Explique por que o cloro é considerado um catalisador nessa reação química.
Resposta: O cloro é considerado um catalisador porque acelera a decomposição do ozônio e não é consumido ao final do processo, pois ele é regenerado na segunda etapa.
Página 418
CAPÍTULO23
Polímeros
Micronutrientes e macronutrientes
Leia o trecho da reportagem a seguir.
81% dos adolescentes do País têm fatores de risco para doenças crônicas
Estudo da UFMG e da Unifesp aponta ainda que 71,5% fazem pouco exercício e 1 barra 3 come doces em excesso, entre outros dados
CUPANI, Gabriela. 81% dos adolescentes do País têm fatores de risco para doenças crônicas. O Estado de S. Paulo, São Paulo, ano 145, n. 47.803, 3 set. 2024. p. A18.
1. O trecho da reportagem menciona que a ingestão de doces em excesso e pouco exercício são fatores de risco para doenças crônicas. Quais outros aspectos podem ser considerados em uma alimentação inadequada?
Resposta: Espera-se que os estudantes respondam que uma alimentação inadequada está relacionada à ingestão de alimentos pouco variados, que não fornecem todos os nutrientes necessários para o desenvolvimento e o funcionamento do organismo, além do consumo excessivo de alimentos processados e ultraprocessados. A má alimentação também pode estar relacionada à ingestão de alimentos em quantidade insuficiente.
2. Como você avalia sua alimentação?
Resposta pessoal. O objetivo desta questão é levar os estudantes a fazer uma autoavaliação da alimentação deles, verificando se é composta de alimentos variados e em quantidades adequadas, sem excesso nem falta.
É por meio da alimentação que obtemos os nutrientes de que o corpo necessita para se manter vivo e saudável. Os nutrientes são compostos químicos essenciais para o metabolismo do organismo. Eles são responsáveis pelo crescimento, pela manutenção e pelo bom funcionamento dos órgãos, além de fornecer energia para realizar as atividades do dia a dia.
Os principais nutrientes são os carboidratos, os lipídios e as proteínas, chamados macronutrientes, e as vitaminas e os sais minerais, denominados micronutrientes.
Confira a seguir alguns desses nutrientes, entendendo sua importância e em que alimentos eles são encontrados.
Carboidratos: são fontes de energia e responsáveis por diversos papéis no metabolismo do corpo. Estão presentes em pães, macarrão, arroz, cereais e batata.
Sais minerais: auxiliam na produção de hormônios, na formação de dentes e ossos e na regulação da pressão sanguínea. Estão presentes em frutas e hortaliças.
Lipídios: atuam como reservas energéticas, na produção de hormônios e na formação das células. Além disso, agem como isolante térmico. Estão presentes em alimentos como abacate, azeite e oleaginosas.
Vitaminas: atuam em conjunto com algumas enzimas, controlando as atividades das células. Além disso, auxiliam no fortalecimento do sistema imunológico. Estão presentes em frutas e hortaliças.
Proteínas: auxiliam na construção de tecidos, na formação da estrutura do organismo e participam da regulação de processos do metabolismo, bem como do transporte de substâncias entre as células. Estão presentes em ovos, carnes e leguminosas.
Alguns nutrientes, como os carboidratos e as proteínas, fazem parte de um grupo chamado polímeros, que são macroestruturas formadas por moléculas menores denominadas monômeros, os quais se unem entre si pelo processo de polimerização. Os polímeros podem ser naturais ou artificiais. Vamos estudar alguns exemplos deles ao longo deste capítulo.
Página 419
Polímeros naturais
Os polímeros naturais são encontrados na natureza, como o látex, a celulose, o amido, o glicogênio e as proteínas. Muitos deles fazem parte do nosso dia a dia. Por exemplo: alguns são essenciais para o desenvolvimento e a manutenção do corpo; outros são utilizados como alimentos ou utilizados na confecção de produtos pelas indústrias.
Estudaremos a seguir as características e as propriedades de alguns polímeros naturais.
Látex
O látex é um tipo de seiva, extraído da planta Hevea brasiliensis, mais conhecida como seringueira. Ele serve de matéria-prima para a obtenção da borracha natural, que foi a primeira borracha utilizada industrialmente.

O látex da seringueira é uma emulsão com cerca de 35% de poli-isopreno. Esse composto é um polímero formado pela repetição de moléculas de isopreno (2-metilbut-1,3-dieno, C subscrito 5 H subscrito 8), cuja reação de polimerização simplificada é:
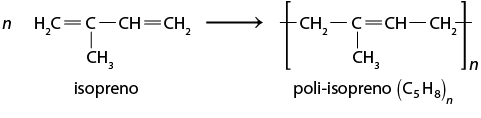
Dica
Na borracha natural, o valor de n, que representa o número de moléculas de isopreno que formam o polímero, é da ordem de 5.000 unidades.
Seda
A seda é um polímero de origem animal. As lagartas de insetos e as aranhas secretam fibras de seda para formar casulos e construir teias, respectivamente.
Essas fibras são compostas de uma proteína com estrutura que possibilita, por exemplo, que a teia de aranha seja elástica, sendo utilizada por esse animal para proteger os ovos e capturar alimentos.
Casulo de lagarta de bicho-da-seda (B. mori): pode atingir aproximadamente 3 centímetros de comprimento.

Proteínas
As proteínas são polímeros naturais formados por unidades monoméricas chamadas aminoácidos.
Existem 20 tipos de aminoácidos e todos os seres vivos são constituídos desse mesmo conjunto de aminoácidos. Esses monômeros têm em sua composição um grupo amino abre parênteses menos N H subscrito 2 fecha parênteses e um grupo carboxila abre parênteses menos C O O H fecha parênteses ligados ao mesmo átomo de carbono abre parênteses C fecha parênteses, e os grupos R, que diferem entre os tipos de aminoácidos existentes.
Página 420
Os aminoácidos podem ser classificados em essenciais, os quais o corpo humano não é capaz de produzir e devem ser ingeridos por meio de alimentos, e em não essenciais, os quais são produzidos pelo corpo humano. O quadro a seguir apresenta as fórmulas estruturais dos 20 aminoácidos que compõem as proteínas.
| Aminoácido | Fórmula estrutural | Aminoácido | Fórmula estrutural |
|---|---|---|---|
|
Ácido aspártico (Asp) Não essencial |
|
Isoleucina (Ile) Essencial |
|
|
Ácido glutâmico (Glu) Não essencial |
|
Leucina (Leu) Essencial |
|
|
Alanina (Ala) Não essencial |
|
Lisina (Lys) Essencial |
|
|
Arginina (Arg) Não essencial |
|
Metionina (Met) Essencial |
|
|
Asparagina (Asn) Não essencial |
|
Prolina (Pro) Não essencial |
|
|
Cisteína (Cys) Não essencial |
|
Serina (Ser) Não essencial |
|
|
Fenilalanina (Phe) Essencial |
|
Tirosina (Tir) Não essencial |
|
Página 421
Imagem sem proporção e em cores fantasia.
| Aminoácido | Fórmula estrutural | Aminoácido | Fórmula estrutural |
|---|---|---|---|
|
Glutamina (Gln) Não essencial |
|
Triptofano (Trp) Essencial |
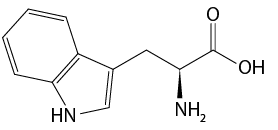
|
|
Glicina (Gly) Não essencial |
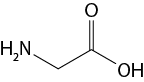
|
Treonina (Tre) Essencial |
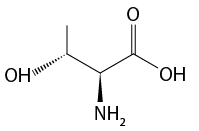
|
|
Histidina (His) Essencial |
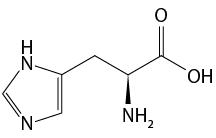
|
Valina (Val) Essencial |
|
Para formar as proteínas, os aminoácidos se ligam covalentemente, por meio das chamadas ligações peptídicas. Essa ligação ocorre entre o grupo carboxila de um aminoácido com o grupo amino do outro aminoácido, formando um dipeptídio.
Dica
A maioria das proteínas é uma sequência de 100 a 10.000 aminoácidos. As combinações entre os 20 aminoácidos possibilitam a formação de muitos tipos de proteínas.
Confira a seguir como ocorre a formação da ligação peptídica entre glicina e alanina, dois aminoácidos não essenciais.
A ligação peptídica é formada pela remoção da hidroxila abre parênteses menos O H fecha parênteses do grupo carboxila de um aminoácido e do hidrogênio abre parênteses H fecha parênteses do grupo amino de outro. Essa reação é chamada reação de condensação, a qual se caracteriza pela eliminação da água abre parênteses H subscrito 2 O fecha parênteses.
As proteínas podem ser representadas por quatro níveis de estruturas moleculares, como mostrado a seguir.
A estrutura primária é a sequência de aminoácidos unidos por ligações peptídicas que compõem sua cadeia polipeptídica.

Imagem elaborada com base em: NELSON, David L.; COX, Michael M. Princípios de bioquímica de Lehninger. Tradução: Ana Beatriz Gorini da Veiga et al. 6. ed. Porto Alegre: Artmed, 2014. p. 96.
Página 422
Imagens desta página sem proporção e em cores fantasia.
A estrutura secundária é representada por dobras na cadeia que são estabilizadas por ligações de hidrogênio.
A estrutura terciária das proteínas corresponde ao maior enrolamento de sua cadeia polipeptídica.

A estrutura quaternária ocorre quando várias cadeias polipeptídicas se associam e se enovelam.

Imagens elaboradas com base em: NELSON, David L.; COX, Michael M. Princípios de bioquímica de Lehninger. Tradução: Ana Beatriz Gorini da Veiga et al. 6. ed. Porto Alegre: Artmed, 2014. p. 96.
Um tipo importante de proteína produzida pelas células do organismo são as enzimas. Elas agem como catalisadores dos processos biológicos, e podem atuar dentro ou fora das células que as produzem. Como acontece com todos os catalisadores, a enzima possibilita que uma reação ocorra com menor energia de ativação.
Professor, professora: Correlacione a necessidade do controle da temperatura corporal e febre com as atividades das enzimas.
Imagem elaborada com base em: ROUSSEL, Alain et. al. Crystal Structure of Human Gastric Lipase and Model of Lysosomal Acid Lipase, Two Lipolytic Enzymes of Medical Interest. Journal of Biological Chemistry, 1999, v. 274. p. 16.995-17.002.
As enzimas têm funções bastante específicas e só agem em condições bem determinadas de temperatura e de p H, por exemplo. Alterando essas condições, a enzima passa por um processo chamado desnaturação e perde sua ação.
Professor, professora: Ao mencionar a desnaturação de proteínas, mencione como exemplo os procedimentos para alisamento de cabelo, que visam alterar as estruturas dos fios de cabelo por meio da desnaturação da proteína queratina presente neles. Advirta-os, contudo, que o alisamento químico utiliza substâncias que, se manipuladas incorretamente, podem causar efeitos colaterais como irritação, queimadura, descamação, queda de cabelo, entre outros efeitos.
Carboidratos
Os carboidratos são compostos formados por átomos de carbono, hidrogênio e oxigênio abre parênteses O fecha parênteses, conhecidos como hidratos de carbono ou glicídios. Eles são a fonte de energia mais facilmente utilizada pelo nosso corpo e apresentam grupos hidroxila abre parênteses menos O H fecha parênteses ligados a carbono saturado (álcool) e aldeído abre parênteses menos C O H fecha parênteses ou carbonila abre parênteses C é igual a O fecha parênteses. São compostos de função mista, poliálcool-aldeído (poli-hidroxialdeído) ou poliálcool-cetona (poli-hidroxicetona). Os carboidratos são genericamente representados pela fórmula C subscrito n abre parênteses H subscrito 2 O fecha parênteses subscrito n e podem ser classificados em monossacarídios, dissacarídios e polissacarídios.
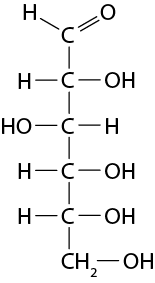
Monossacarídios
Unidades básicas dos carboidratos. Eles não sofrem hidrólise✚ e podem ser poli-hidroxialdeídos (aldoses) ou poli-hidroxicetonas (cetoses).
Exemplos: glicose, frutose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses e galactose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses.
- Hidrólise:
- reação química entre uma substância e a água para formar uma nova ligação entre o oxigênio e outro(s) elemento(s).↰
Página 423
Dissacarídios
Apresentam fórmula molecular C subscrito 12 H subscrito 22 O subscrito 11 e são resultantes da dimerização por condensação de dois monossacarídios, ou seja, são formados pela união de dois monossacarídios com liberação de uma molécula de água.
Exemplos: sacarose, maltose e lactose.
Polissacarídios
São resultantes da polimerização por condensação de monossacarídios.
Exemplos: amido, celulose e glicogênio.
Confira a seguir a reação de formação da celulose pela polimerização das moléculas de glicose. As ligações que ocorrem entre os monossacarídios são do tipo covalente, chamadas ligação glicosídica. Essa reação é chamada reação de condensação, a qual se caracteriza pela eliminação de água.
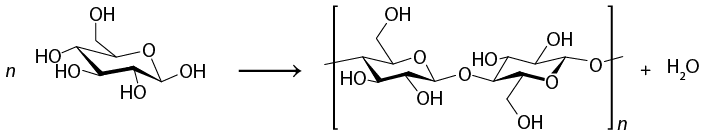
Observe no quadro a seguir os tipos de carboidratos e algumas características gerais.
| Carboidrato | Fonte | Aplicações e importância para o organismo |
|---|---|---|
|
Glicose |
Encontrada em frutas, milho doce, xarope de milho, mel e algumas raízes. |
Principal nutriente para as células obterem energia. |
|
Frutose |
Encontrada com a glicose no mel e nas frutas, é considerada o monossacarídio mais doce. |
Utilizada na produção de adoçantes e algumas bebidas. |
|
Galactose |
É obtida do açúcar do leite (lactose) ao sofrer hidrólise durante a digestão. |
Fornece grande quantidade de energia em uma quantidade pequena de produto. |
|
Sacarose |
Encontrada principalmente na cana-de-açúcar e na beterraba. |
Serve como base para a produção de açúcar, utilizado para adoçar alguns alimentos, e para a produção de etanol abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses. |
|
Maltose |
Encontrada em vegetais e tem função energética. |
É o principal componente do malte, usado na fabricação de pães, por exemplo. |
|
Lactose |
Presente no leite de vaca e em seus derivados. |
Utilizada na indústria de alimentos, como de doces e pães, e na indústria farmacêutica, como excipiente em cápsulas e comprimidos. |
|
Celulose |
Presente em praticamente todos os vegetais. Ela é extraída da madeira. |
Utilizada na fabricação de tecidos e na produção de papel. |
|
Amido |
Encontrado em cereais, como o arroz, o milho e o trigo, e em tubérculos, como a batata e a mandioca. |
No intestino, o amido é hidrolisado, formando moléculas de glicose, as quais são distribuídas a todas as células do corpo pela corrente sanguínea. |
|
Glicogênio |
É produzido no fígado e nos músculos dos animais pela glicose que circula no organismo. |
Funciona como uma reserva de energia que o organismo utiliza quando precisa de glicose. |
Página 424
CONEXÕES com ... GEOGRAFIA e HISTÓRIA
A extração do látex
A extração do látex de árvores seringueiras é historicamente uma das atividades mais representativas na cultura de diversos povos da Região Norte do Brasil. Essa tradição surgiu com os povos indígenas, que inicialmente realizavam a extração da seiva do látex para a produção de diferentes objetos, como bolas que eram usadas em atividades recreativas e culturais das comunidades. Além disso, o material também era utilizado para produzir os encauchados, que são produtos feitos da desidratação do látex e que servem para impermeabilizar objetos, como vestimentas e vasilhas.
Com o tempo, os conhecimentos e as técnicas indígenas passaram a ser utilizados por trabalhadores extrativistas da floresta, os chamados seringueiros, que, por sua vez, aprimoraram novas técnicas e as mantêm ativas até hoje, transmitindo seus conhecimentos por gerações.
Entre os séculos XIX e XX, a extração do látex viveu seu auge e se tornou muito lucrativa com o aumento da produção e da exportação da borracha. Esse período foi essencial para o avanço da economia brasileira e para o desenvolvimento da Região Norte do país. O rápido crescimento de cidades como Manaus, no Amazonas, e Belém, no Pará, foi resultado de um grande processo migratório de trabalhadores seringueiros vindos principalmente da Região Nordeste. Essa fase ficou historicamente conhecida como Ciclo da Borracha.
Importantes acontecimentos marcaram esse período na região amazônica, e um deles foi a anexação do estado do Acre ao território brasileiro em 1903. Foi também no estado do Acre que, décadas mais tarde, outros acontecimentos marcaram a história dos seringueiros e da Floresta Amazônica. No final do século XX, o município de Xapuri, no interior do Acre, se tornou palco de relevantes lutas ambientais lideradas pelo seringueiro brasileiro Francisco Alves Mendes Filho (1944-1988), conhecido como Chico Mendes, um dos mais significativos personagens da luta pela regularização de terras e pelo combate ao desmatamento da Amazônia. Sua liderança contava com o apoio de centenas de famílias de seringueiros que viviam na mesma região.
Área da reserva extrativista Chico Mendes, Acre
Fonte de pesquisa: RESERVA Extrativista Chico Mendes. Unidades de Conservação no Brasil. Disponível em: https://s.livro.pro/lceemo. Acesso em: 17 set. 2024.
As lutas lideradas por Chico Mendes foram fundamentais para a criação de modelos sustentáveis do uso de terras no Brasil. Após sua morte, em 1988, foram criadas reservas extrativistas pelo governo federal, que são áreas florestais protegidas por lei cujos objetivos são assegurar o uso sustentável dos recursos naturais da área protegida, preservando as formas de sustento e a cultura de populações tradicionais. Uma das primeiras reservas extrativistas criadas no país foi na região do município de Xapuri, no Acre, em 1990, que, em homenagem ao líder ambientalista, recebeu o nome de Reserva Extrativista Chico Mendes. Com uma área de aproximadamente 970 mil hectares, a reserva abriga milhares de famílias e garante a elas renda e sobrevivência, além da manutenção das tradições culturais.
a ) Em sua opinião, qual é a importância da manutenção das reservas extrativistas e da criação de reservas?
Resposta pessoal. Espera-se que os estudantes compreendam que a existência das reservas extrativistas garante a sobrevivência de povos tradicionais e a geração de renda para muitas famílias de comunidades florestais, além da conservação da vegetação nativa e o combate à extração predatória.
Página 425
ATIVIDADES
1. Confira a imagem e responda às questões propostas a seguir.
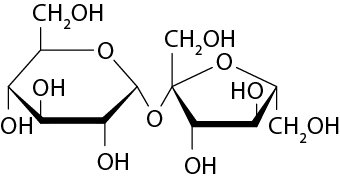
a ) A estrutura anterior representa um monossacarídio, um dissacarídio ou um polissacarídio? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que é um dissacarídio, pois é formado por dois monossacarídios.
b ) Cite um exemplo de monossacarídio, dissacarídio e polissacarídio. Em seguida, explique qual é a fonte desses carboidratos e a importância deles para os seres humanos.
Resposta pessoal. O objetivo desta questão é levar os estudantes a identificar os tipos de carboidratos existentes, sua principal fonte e a importância que têm.
c ) Por que podemos considerar que um polissacarídio como a celulose é um polímero?
Resposta: Porque ele é formado pela repetição de uma molécula, no caso, a glicose, que funciona como um monômero.
2. A intolerância à lactose é uma condição na qual a pessoa é incapaz de digerir o açúcar presente no leite e em seus derivados. Essa condição ocorre quando o organismo não produz quantidade suficiente de uma enzima chamada lactase, a qual é responsável por quebrar a lactose em glicose e galactose.
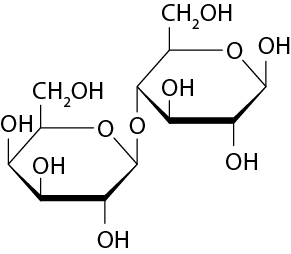
a ) Que tipos de polímeros são a lactose e a lactase?
b ) Como se dá a ligação entre os monômeros para formar o polímero que compõe a enzima lactase?
c ) Explique o que é e qual é o papel de uma enzima.
d ) Faça uma pesquisa sobre os principais sintomas e tratamentos da intolerância à lactose.
3. A queratina é uma proteína formada por 21 aminoácidos, sendo o principal a cisteína, que é um aminoácido sulfurado. Ela é uma proteína fibrosa presente no cabelo, nas unhas e na pele e desempenha um papel importante na proteção e na resistência desses tecidos, por conta de sua estrutura altamente organizada.
a ) A queratina é formada por uma sequência específica de aminoácidos que se unem para formar uma longa cadeia. Como a composição e a ordem dos aminoácidos influenciam a estrutura e as propriedades de um polímero natural?
b ) A força da queratina está relacionada às interações intermoleculares em sua estrutura. Quais tipos de interações são importantes para a estabilidade da queratina e como elas afetam suas propriedades? Se necessário, realize uma pesquisa.
c ) A queratina é considerada insolúvel em água. Por que essa característica é importante para a função da queratina em estruturas como cabelo e unhas? Explique com base nas propriedades dos polímeros naturais.
Respostas das questões 2 e 3 nas Orientações para o professor.
4. A seda é uma fibra natural produzida por organismos como o bicho-da-seda, composta de cadeias de aminoácidos que se repetem, formando uma proteína. Em contraste, o poliéster é um polímero sintético, cuja estrutura é formada por unidades repetitivas de monômeros, resultantes de reações químicas entre ácidos carboxílicos e álcoois. Ambos os materiais têm estruturas poliméricas, mas sua origem e composição são diferentes.
Com base nas informações apresentadas, identifique a alternativa correta.
a ) A seda é formada por unidades repetitivas de aminoácidos, enquanto o poliéster é formado por monômeros que não se repetem.
b ) Tanto a seda quanto o poliéster são compostos de unidades repetitivas, mas a seda utiliza aminoácidos como monômeros, enquanto o poliéster é formado por monômeros de ácido carboxílico e álcool.
c ) A seda não tem uma estrutura repetitiva, enquanto o poliéster é formado por uma sequência contínua de aminoácidos.
d ) O poliéster é um polímero natural que não tem unidades repetitivas, enquanto a seda é um polímero sintético formado por moléculas que se repetem.
Resposta: Alternativa b.
Página 426
Polímeros sintéticos
Imagens desta página sem proporção e em cores fantasia.
Leia o trecho do texto a seguir sobre a invenção da baquelite pelo químico e inventor belga Leo Hendrik Baekeland (1863-1944).
[…]
Usou uma máquina autoclave e obteve uma massa cor de âmbar que podia ser transformada em qualquer objeto. Começava ali a era do plástico. O químico chegou a esse resultado em 1907 e o apresentou formalmente à Sociedade Americana de Química dois anos depois. Por ser resistente ao calor, podendo ser laminada e moldada na fase inicial da produção e ter baixo custo, a baquelite teve muitas aplicações, além de ser utilizada como isolante pela indústria elétrica. Era conhecida como o "material dos mil usos": de rádios a bijuterias, de brinquedos a telefones, de bolas de bilhar a máquinas fotográficas. Como não podia ser refundida, virou até moeda na Indonésia durante a Segunda Guerra Mundial.
[…]
MARCOLIN, Neldson. A era do plástico. Pesquisa Fapesp, mar. 2006. Disponível em: https://s.livro.pro/g6m1ri. Acesso em: 17 set. 2024.
A baquelite foi o primeiro tipo de plástico sintético desenvolvido por Baekeland. Esse material é formado pela combinação por polimerização de fenol abre parênteses C subscrito 6 H subscrito 6 O fecha parênteses e metanal abre parênteses C H subscrito 2 O fecha parênteses na autoclave, em alta temperatura e pressão, e é resistente ao calor. Ela foi um dos primeiros polímeros sintéticos, ou seja, produzidos pelo ser humano. Embora tenha sido amplamente utilizada durante anos, para os mais variados fins, o desenvolvimento de novos polímeros mais leves e resistentes levou à redução do uso da baquelite a partir da década de 1960.

Em geral, os polímeros sintéticos são produzidos por hidrocarbonetos provenientes do petróleo. Esses polímeros são utilizados para a fabricação dos mais diversos materiais do dia a dia, sendo o plástico um dos mais usados na atualidade.
Os polímeros sintéticos, assim como os naturais, podem ser classificados de acordo com suas propriedades. Confira os exemplos a seguir.
3. Cite pelo menos dez objetos que você usa no dia a dia que são feitos de plástico.
Resposta pessoal. O objetivo desta questão é levar os estudantes a refletir sobre as diferentes aplicações do plástico em nosso dia a dia, muitas das quais provavelmente eles nem haviam percebido que usavam esse material.
Os polímeros termoplásticos podem, algumas vezes, ser fundidos por aquecimento e solidificados por resfriamento. Nesses materiais, o aquecimento e o resfriamento não alteram a composição do polímero nem modificam o formato da sua macromolécula. Em geral, esse tipo de polímero apresenta macromoléculas com ou sem ramificações.


Imagens elaboradas com base em: GAUTO, Marcelo Antunes; ROSA, Gilber Ricardo. Processos e operações unitárias da indústria química. Rio de Janeiro: Editora Ciência Moderna, 2011. p. 127.
Página 427
Imagens desta página sem proporção e em cores fantasia.
Os polímeros que não modificam seu formato por aquecimento ou resfriamento, por sua vez, são denominados termorrígidos, termoestáveis ou termofixos. Em geral, esses polímeros são formados por macromoléculas que apresentam estruturas com ligações cruzadas ou em rede.

Imagens elaboradas com base em: GAUTO, Marcelo Antunes; ROSA, Gilber Ricardo. Processos e operações unitárias da indústria química. Rio de Janeiro: Editora Ciência Moderna, 2011. p. 128.
De maneira geral, os polímeros termoplásticos são recicláveis, enquanto os termorrígidos não. Para o caso dos polímeros recicláveis, existe uma classificação que auxilia na separação adequada dos materiais e, consequentemente, no processo de reciclagem. Confira a seguir.

Além disso, cada um desses tipos de plástico apresenta características específicas que interferem em sua aplicação, antes e após a reciclagem. Confira alguns exemplos a seguir.
- O polipropileno (PP) é um termoplástico com uma das mais baixas densidades entre os polímeros, ao mesmo tempo que tem forte resistência química e de impacto em temperatura ambiente. Por isso, é utilizado na fabricação de peças estruturais aplicadas em indústrias de processos em geral. Além disso, o PP é considerado atóxico, tornando sua aplicação ideal em indústrias farmacêuticas e alimentícias.
- O polietileno é dividido em duas categorias: os de baixa densidade (PEBD) e os de alta densidade (PEAD). Além da baixa densidade, os PEBD têm flexibilidade e baixa temperatura de fusão. Já os PEAD têm densidade e temperatura de fusão mais altas do que as do PEBD, além de serem mais rígidas e terem mais flexibilidade. Essas características permitem sua aplicação na produção de itens plásticos mais resistentes.
- O poliestireno expandido é obtido pela polimerização por adição e tem baixa densidade. Ele pode ser utilizado como material isolante. Para isso, é moldado na forma do objeto a ser isolado (que pode ser um copo, por exemplo) e, assim, empregado para conservar o calor ou a baixa temperatura de um produto (como uma bebida ou outro alimento). Esse tipo de material é leve, de baixo custo e atua como isolante térmico, sendo amplamente utilizado em embalagens para conservação da temperatura de alimentos.

Página 428
No quadro a seguir são apresentados alguns exemplos de polímeros e seu uso após a reciclagem.
| Polímero | Exemplos de uso | Exemplos de uso após a reciclagem |
|---|---|---|
|
(1) Politereftalato de etileno (PET) |
Garrafas de bebidas, frascos e embalagens para medicamentos, alimentos, cosméticos e produtos de limpeza, cordões de varal, cerdas de vassoura e fibras têxteis. |
Cerdas de vassoura e fibras têxteis. |
|
(2) Polietileno de alta densidade (PEAD) |
Tubo de caneta esferográfica, baldes, tambores, frascos de produtos de limpeza, potes de sorvete e tampinhas de garrafa. |
Cadeiras e cestos para lixo. |
|
(3) Policloreto de vinila (PVC) |
Canos e conexões de encanamentos, fita isolante, conduítes e filme plástico para cobrir alimentos. |
Canos e mangueiras. |
|
(4) Polietileno de baixa densidade (PEBD) |
Sacos de lixo, sacolas de supermercado, embalagens de alimentos e tampas de potes de sorvete, revestimento para fios e cabos elétricos. |
Sacolas de supermercado. |
|
(5) Polipropileno (PP) |
Painéis e para-choques de veículos, potes de margarina e copos descartáveis. |
Recipientes para tintas. |
|
(6) Poliestireno (PS) |
Isolantes térmicos, copos, pratos e talheres descartáveis e seringas. |
Canos e cestos para lixo. |
|
(7) Outros |
CDs, celulares e partes plásticas de notebooks. |
"Madeira" plástica. |
Professor, professora: Leve os estudantes a perceber que, após a reciclagem, nenhum tipo de plástico pode ser utilizado para embalar alimentos ou produtos de higiene e limpeza.
Os polímeros sintéticos podem ser produzidos por meio de reações químicas de adição ou reações químicas de condensação.
Polímeros de adição
Os polímeros de adição são formados por meio da reação de adição de muitos monômeros iguais entre si, resultando em uma macromolécula.
Imagem sem proporção e em cores fantasia.
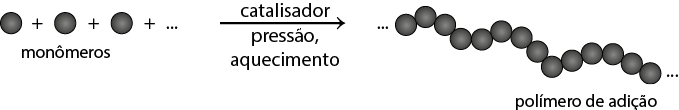
Em geral, a reação de adição ocorre pela ruptura de uma das ligações da dupla ligação e formação de duas ligações simples. A seta curva no esquema a seguir representa a movimentação de um elétron na reação.

Página 429
A equação de polimerização pode ainda ser representada por:
n H subscrito 2 C é igual a C H subscrito 2 expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, polimerização, fim do detalhe acima abre colchetes menos H subscrito 2 C menos C H subscrito 2 menos fecha colchetes subscrito n
Confira no quadro a seguir alguns exemplos de polímeros de adição.
Imagens desta página sem proporção.
| Monômero | Polímero | Exemplos de aplicações |
|---|---|---|
|
|
|
Bacias de plástico, baldes, sacolas de plástico, sacos de lixo, revestimentos de fios, cabos e brinquedos. 
|
|
|
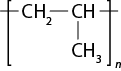
|
Cordas, caixas plásticas, alguns sacos plásticos, lonas plásticas, equipamentos médicos que possam ser esterilizados, alguns tipos de tubos plásticos e para-choques e painéis de veículos. 
|
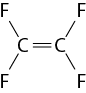
|
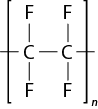
|
Revestimento de panelas, frigideiras e equipamentos químicos, antenas parabólicas, torneiras e algumas próteses. 
|
|
|
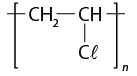
|
Toalhas de mesa, cortinas para chuveiros, roupas e bolsas de couro artificial, alguns brinquedos, revestimento de estofamentos automotivos, canos, tubos e isolantes elétricos. 
|
|
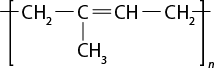
|
Câmaras de ar com baixo teor de enxofre, preservativos, balões de festa, borrachas escolares, bicos de chupetas e luvas cirúrgicas. 
|
Página 430
| Monômero | Polímero | Exemplos de aplicações |
|---|---|---|
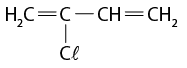
|
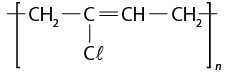
|
Coletes náuticos, cobertura de cabos submarinos, roupas para mergulho, luvas e mangueiras. 
|
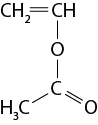
|
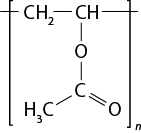
|
Colas, tintas e gomas de mascar. 
|
Alguns polímeros podem ser formados pela reação de adição entre monômeros diferentes. Nesse caso, são chamados copolímeros. O acrilonitrila butadieno estireno (A B S, abre parênteses C subscrito 15 H subscrito 17 N fecha parênteses subscrito n) é um copolímero utilizado na fabricação de revestimento de alguns aparelhos elétricos e de recipientes para embalagens, painéis automotivos e revestimento de peças hidráulicas, por exemplo.
Imagens desta página sem proporção.

O A B S é formado pelos três monômeros que compõem seu nome: acrilonitrila abre parênteses C subscrito 3 H subscrito 3 N fecha parênteses subscrito n, but-1,3-dieno abre parênteses C subscrito 4 H subscrito 6 fecha parênteses e estireno (vinilbenzeno, C subscrito 8 H subscrito 8). Confira sua reação de formação a seguir.
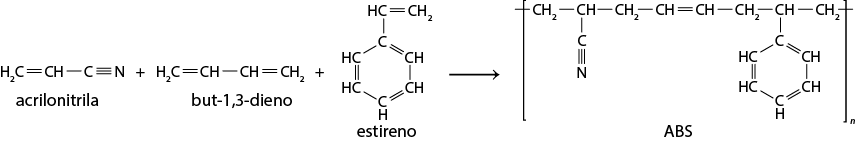
Polímeros de condensação
Em geral, os polímeros de condensação ou de eliminação se formam pela reação entre monômeros diferentes, com a eliminação de pequenas moléculas. O politereftalato de etileno (PET) é um polímero de condensação. Ele é formado pela polimerização do ácido tereftálico abre parênteses C subscrito 8 H subscrito 6 O subscrito 4 fecha parênteses e do etilenoglicol abre parênteses C subscrito 2 H subscrito 6 O subscrito 2 fecha parênteses. Esses compostos reagem eliminando uma molécula de água, conforme a reação a seguir.
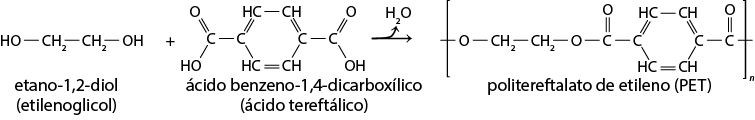
Página 431
Como estudamos anteriormente, o PET é um polímero reciclável bastante conhecido pelo seu uso em garrafas de bebidas gaseificadas. Na reação de polimerização, durante a formação desse polímero, um diácido carboxílico reage com um diálcool, formando um éster. Por essa razão, o PET é classificado como um poliéster.
O PET pode ser usado para produzir guarda-chuvas, embalagens e barracas de camping, por exemplo. Além disso, quando esse polímero é misturado ao algodão, um material de origem vegetal, ele forma uma fibra sintética, usada na produção de tecidos.
A seguir são apresentados outros exemplos de polímeros de condensação e suas respectivas reações de formação.
Poliamida: polímero utilizado na produção de fios de náilon, algumas peças de vestuário, alguns artigos esportivos e cerdas de escovas dentais.

Baquelite: sob a forma de resina termoplástica, esse polímero pode ser usado na composição de colas para madeiras, tintas e vernizes. Já na forma de resina termoestável, ele é utilizado em cabos de panelas, interruptores de luz, tampas, telefones, plugues etc.
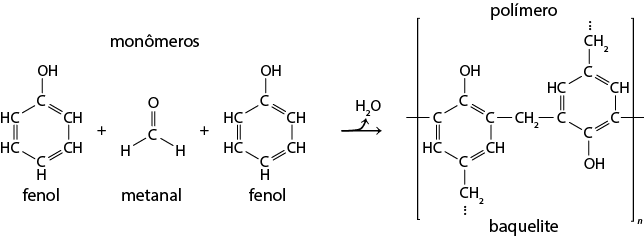
Fibra de aramida: polímero usado em capacetes das forças armadas, coletes à prova de balas, roupas contra incêndio e alguns esquis esportivos. Material de elevada resistência – uma corda de fibra de aramida é mais resistente do que um cabo de aço de mesmo diâmetro.
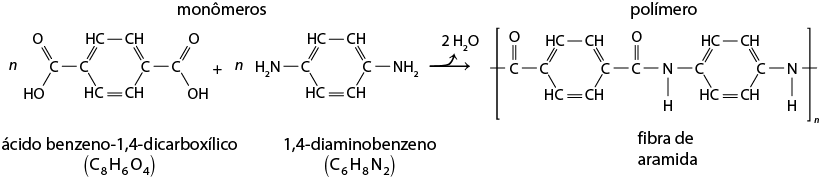
Página 432
Polímeros biodegradáveis
De acordo com uma publicação de 2023 da associação Plastics Europe, a produção mundial de plástico está aumentando gradativamente a cada ano e, em 2022, chegou a 400,3 milhões de toneladas, das quais 362,3 foram produzidas com materiais de origem fóssil, como frações do petróleo ou gás natural, e apenas 32,5, equivalente a menos de 9%, foram produzidas com material reciclado.
A maior parte do plástico produzido atualmente não é biodegradável, ou seja, não é naturalmente decomposta por microrganismos. A degradação dos plásticos convencionais pode levar até milhares de anos, causando um efeito cumulativo no ambiente. Além disso, quando descartados, os plásticos são inicialmente quebrados em pequenos pedaços, conhecidos como microplásticos, que se dispersam no ambiente e podem ser consumidos equivocadamente pelos seres vivos. Ao entrarem na cadeia alimentar, esses microplásticos podem ser transmitidos a outros seres vivos, como os seres humanos.

Nesse cenário, os plásticos biodegradáveis têm se mostrado uma possível alternativa à crise ambiental causada pelo plástico, uma vez que podem ser degradados pela ação de microrganismos, como bactérias, fungos e algas, naturais do ambiente. Esses seres vivos produzem enzimas que provocam a despolimerização do material, degradando-o. Esse processo, contudo, depende de condições ambientais, como temperatura e umidade, e de propriedades do material, como tipo de ligações químicas, ramificações, massa molar e capacidade de absorção de umidade.
Atualmente, existem vários tipos de plásticos biodegradáveis que utilizam diferentes matérias-primas orgânicas em sua produção, como o ácido lático e o amido.
O plástico poli(ácido lático) (PLA) é um polímero termoplástico produzido com base no ácido lático, obtido da fermentação bacteriana de vegetais ricos em amido, como milho e mandioca. Já o plástico de amido tem como matéria-prima principal esse carboidrato, que tem sido utilizado para a produção de plásticos com características distintas e cada vez mais versáteis e semelhantes às dos plásticos convencionais.
Mesmo sendo biodegradável, o consumo desses materiais deve ser consciente. Assim, sempre que possível, dê preferência por materiais duráveis e retornáveis.
a ) Qual é a importância de substituir os plásticos convencionais pelos plásticos biodegradáveis?
b ) Qual é a importância das pesquisas científicas na redução do consumo de plásticos convencionais?
c ) Converse com seus familiares sobre medidas que vocês podem adotar no dia a dia para reduzir o consumo e o descarte de plástico em sua residência.
d ) A informação é uma importante aliada na conscientização da população a respeito dos problemas ambientais, por exemplo. Junte-se a dois colegas e produzam um vídeo sobre o tema abordado nesta seção, visando informar outras pessoas sobre o assunto e incentivar o consumo consciente e a preferência por produtos biodegradáveis.
Respostas nas Orientações para o professor.
Página 433
ATIVIDADES
1. A poliacrilonitrila abre parênteses abre parênteses C subscrito 3 H subscrito 3 N fecha parênteses subscrito n fecha parênteses é muito usada na fabricação de lã artificial, malhas de inverno, alguns cobertores, preenchimento de bichos de pelúcia, entre outros. Já o polimetilmetacrilato abre parênteses abre parênteses C subscrito 5 H subscrito 8 O subscrito 2 fecha parênteses subscrito n fecha parênteses, conhecido comercialmente como acrílico, é um polímero muito resistente utilizado em sistemas de vidros automotivos, janelas, revestimentos de algumas cabines de automóveis, entre outras aplicações. Observe a fórmula estrutural de ambos os polímeros citados.
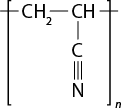
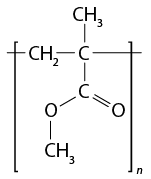
Em relação aos polímeros citados, afirma-se que:
a ) são classificados como polímeros de condensação.
b ) formam macromoléculas pela reação de adição de muitos monômeros iguais entre si.
c ) são formados por macromoléculas que apresentam estruturas com ligações cruzadas.
d ) são exemplos de polímeros naturais.
e ) ambos são considerados termorrígidos.
Resposta: Alternativa b.
2. Nos processos de fabricação de diversos produtos, os polímeros sintéticos conquistam, a cada dia, importantes funções em substituição a materiais tradicionais, como algodão e vidro. Os polímeros são obtidos das reações de adição ou condensação de moléculas relativamente pequenas, os monômeros. Observe alguns monômeros no quadro a seguir.
| Monômero | Polímero | Utilização |
|---|---|---|
|
Náilon |
Fibras têxteis |
|
Fibra de aramida |
Fibras sintéticas |
|
Baquelite |
Isolante térmico |
a ) Os polímeros do quadro são obtidos por polimerização em reações de adição ou de condensação?
b ) Escreva a reação de polimerização do náilon.
Atividade(s) adaptada(s) acessível(is)
b ) No caderno, explique como ocorre a reação de polimerização do náilon.
Resposta: Espera-se que os estudantes descrevam que ocorre a saída do grupo O H do monômero formador do náilon que contém o ácido carboxílico, e um hidrogênio do monômero formador do náilon que contém a função amina, havendo eliminação de H subscrito 2 O e formação de uma ligação entre o carbono e o nitrogênio dos monômeros.
c ) Quais são as funções químicas observadas em cada um dos monômeros?
d ) Dos três monômeros citados, qual apresenta maior caráter básico? Justifique sua resposta.
3. A fibra de aramida é um polímero resistente ao impacto, ao fogo e ao ataque químico, por isso o colete à prova de balas é feito com essa fibra, o que lhe confere menor massa e maior moldagem ao corpo do usuário.
Trata-se de um polímero de condensação obtido dos monômeros ácido benzeno-1,4-dicarboxílico e 1,4-diaminobenzeno, cujas estruturas estão representadas a seguir.
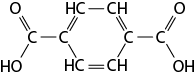
a ) Represente a reação de polimerização de formação da fibra de aramida.
Atividade(s) adaptada(s) acessível(is)
a ) No caderno, explique como ocorre a reação de polimerização de formação da fibra de aramida.
Resposta: Espera-se que os estudantes descrevam que ocorre a saída do grupo O H do ácido benzeno-1,4-dicarboxílico e um hidrogênio do 1,4-diaminobenzeno, havendo eliminação de H subscrito 2 O e formação de uma ligação entre o carbono e o nitrogênio dos monômeros.
b ) A estrutura da fibra de aramida, um polímero de condensação, pertence a qual função química? Justifique sua resposta.
Respostas das questões 2 e 3 nas Orientações para o professor.
Página 434
4. Os policarbonatos são polímeros de condensação dos monômeros fosgênio e p-isopropilenodifenol (bisfenol A). Após a reação, há formação do polímero e liberação de moléculas de H C l. Considere as estruturas dos monômeros a seguir.
a ) Represente a reação de polimerização entre esses dois monômeros.
Atividade(s) adaptada(s) acessível(is)
a ) No caderno, explique como ocorre a reação de polimerização entre esses dois monômeros.
Resposta: Espera-se que os estudantes descrevam que ocorre a saída do átomo de cloro do fosgênio e um hidrogênio do bisfenol A, havendo eliminação de H C l e formação de uma ligação entre o carbono proveniente do fosgênio e o oxigênio do bisfenol A.
b ) Pesquise e registre algumas das aplicações dos policarbonatos.
Respostas nas Orientações para o professor.
5. Os polímeros são essenciais em nossa vida, pois têm inúmeras vantagens. Apesar disso, geram grande quantidade de resíduos que causam diversos problemas ambientais. Assim, é necessária a utilização de polímeros que minimizem esses impactos na sociedade. Nesse contexto, qual é a diferença entre polímero reciclável e polímero biodegradável?
Resposta: Reciclável: é o processo em que todo polímero, após ser utilizado, pode ser reutilizado para fabricação de novos produtos. Biodegradável: é o processo em que o polímero pode ser consumido por microrganismos usuais no meio ambiente, gerando C O subscrito 2, húmus e água (na presença de O subscrito 2 principais produtos, além de metano C H subscrito 4 (na ausência de oxigênio).
6. Plásticos são materiais orgânicos poliméricos sintéticos que têm como propriedade a maleabilidade, por isso são facilmente transformáveis com o calor e a pressão. O plástico serve para fabricar os mais variados objetos, como embalagens, roupas e sapatos. Os tubos utilizados em construções civis são, na maioria das vezes, compostos de policloreto de vinila (PVC), um tipo de plástico resistente e durável.

Escreva a alternativa que apresenta polímeros com halogênios em sua estrutura.
a ) Polietileno e polipropileno.
b ) Amido e proteínas.
c ) Baquelite e borracha.
d ) PVC e politetrafluoretileno.
Resposta: Alternativa d.
7. Associe os itens a seguir, relacionando o tipo de polímero com suas características e seus exemplos.
I. Polímeros de adição.
II. Polímeros de condensação.
III. Polímeros naturais.
Características e exemplos:
A. São formados pela união de monômeros sem a eliminação de subprodutos; um exemplo é o polietileno.
B. São encontrados na natureza e sintetizados por organismos vivos; exemplos incluem a celulose e a borracha natural.
C. São formados pela união de monômeros com a eliminação de pequenas moléculas como água; o poliéster é um exemplo.
Resposta: I – A; II – C; III – B.
RETOME O QUE ESTUDOU
Refletindo sobre o que estudou nesta unidade, responda às questões a seguir.
1. Explique por que o cloreto de sódio abre parênteses N aC l fecha parênteses, quando está em solução aquosa, mantém a cor vermelha de uma tira de papel tornassol vermelho e a cor azul de uma tira de papel tornassol azul, lembrando que o tornassol vermelho fica azul em meio básico, e o tornassol azul, vermelho em meio ácido.
2. Escolha um dos fatores que interferem na rapidez de uma reação química e explique como ele atua nesse parâmetro, citando um exemplo do cotidiano para a situação abordada.
3. Escolha uma refeição diária e monte um cardápio que represente uma alimentação saudável. Em seguida, aponte os nutrientes desses alimentos e sua importância para o corpo. Algum dos alimentos listados em seu cardápio é fonte de polímeros naturais? Descreva como esse polímero é formado.
4. Faça uma análise crítica a respeito da relação do ser humano com os materiais, como os polímeros sintéticos na sociedade atual, definindo-a com uma ou mais palavras. Essa relação é considerada sustentável? Explique sua resposta.
Respostas nas Orientações para o professor.
Página 435
MAIS QUESTÕES
1. (UFPR) Apesar de o N H subscrito 4 N O subscrito 3 ser um composto de grande periculosidade pelo risco de causar explosões catastróficas, ele é empregado em grande escala como fertilizante, pois tem alta proporção de nitrogênio em sua composição. Um dos processos industriais para a sua produção envolve a seguinte reação química:
C a abre parênteses N O subscrito 3 fecha parênteses subscrito 2 abre parênteses a q fecha parênteses mais 2 N H subscrito 3 abre parênteses g fecha parênteses mais C O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses l fecha parênteses seta para a direita 2 N H subscrito 4 N O subscrito 3 abre parênteses a q fecha parênteses mais C a C O subscrito 3 abre parênteses s fecha parênteses
Conforme apresentado pela equação acima, além do produto desejado, forma-se um subproduto insolúvel que pode ser removido posteriormente.
Qual é o nome recomendado pela IUPAC (União Internacional de Química Pura e Aplicada) desse subproduto?
a ) Carbonato de amônio.
b ) Carbonato de cálcio.
c ) Nitrito de amônio.
d ) Nitrato de cálcio.
e ) Nitrito de cálcio.
Resposta: Alternativa b.
2. (UECE) Os compostos: N a H C O subscrito 3, A l abre parênteses O H fecha parênteses subscrito 3 e M g abre parênteses O H fecha parênteses subscrito 2 são chamados de antiácidos, porque normalmente são usados para neutralizar o excesso de ácido no estômago (p H entre 0,4 e 1,3). A equação química correta da atuação do antiácido na neutralização é:
a ) 2 N a H C O subscrito 3 mais H subscrito 3 O elevado a início expoente, mais, fim expoente duas meias setas que apontam em direções opostas N a subscrito 2 C O subscrito 3 mais O H elevado a início expoente, menos, fim expoente mais 2 H subscrito 2 O.
b ) A l abre parênteses O H fecha parênteses subscrito 3 mais 3 H subscrito 3 O elevado a início expoente, mais, fim expoente duas meias setas que apontam em direções opostas A l elevado a início expoente, 3 mais, fim expoente mais 6 H subscrito 2 O.
c ) M g abre parênteses O H fecha parênteses subscrito 2 mais 2 H elevado a início expoente, mais, fim expoente duas meias setas que apontam em direções opostas M g elevado a início expoente, 2 mais, fim expoente mais O H elevado a início expoente, menos, fim expoente mais H subscrito 3 O elevado a início expoente, mais, fim expoente.
d ) N a H C O subscrito 3 mais H C l duas meias setas que apontam em direções opostas N a C l mais 2 H elevado a início expoente, mais, fim expoente mais C O subscrito 2.
Resposta: Alternativa b.
3. (UFRGS-RS) O gesso (do grego: gypsos) é um material inorgânico produzido a partir da gipsita, um mineral abundante na natureza, constituído majoritariamente pelo sulfato de cálcio di-hidratado.
Sobre o sulfato de cálcio di-hidratado, são feitas as seguintes afirmações.
I ) É uma substância composta.
II ) É um oxiácido.
III ) Apresenta ligações iônica e covalente em sua estrutura.
Quais estão corretas?
a ) Apenas I.
b ) Apenas II.
c ) Apenas I e III.
d ) Apenas II e III.
e ) I, II e III.
Resposta: Alternativa c.
4. (UFRGS-RS) O B a O subscrito 2 é um sólido branco acinzentado que é utilizado na pigmentação de fogos de artifício e como agente oxidante e alvejante.
Sobre esse composto, são feitas as seguintes afirmações.
I ) É denominado peróxido de bário.
II ) Reage com ácido sulfúrico, produzindo água oxigenada e sulfato de bário.
III ) Possui, na fórmula molecular, o número de oxidação do oxigênio igual a menos 2.
Quais estão corretas?
a ) Apenas I.
b ) Apenas III.
c ) Apenas I e II.
d ) Apenas II e III.
e ) I, II e III.
Resposta: Alternativa c. Resolução nas Orientações para o professor.
5. (UFRGS-RS) Mariscos possuem uma concha feita de carbonato de cálcio, a qual se forma quando os íons cálcio, secretados a partir das células do marisco, encontram a água do mar, rica em dióxido de carbono dissolvido.
Considere as afirmações sobre esse processo.
I ) Uma das reações que ocorre é C a elevado a início expoente, 2 mais, fim expoente abre parênteses a q fecha parênteses mais C O subscrito 3 elevado a início expoente, 2 menos, fim expoente abre parênteses a q fecha parênteses seta para a direita C a C O subscrito 3 abre parênteses s fecha parênteses.
II ) A reação envolvendo os íons cálcio na formação da concha é uma reação do tipo ácido-base.
III ) O produto formado é classificado como um óxido básico.
Quais estão corretas?
a ) Apenas I.
b ) Apenas II.
c ) Apenas III.
d ) Apenas I e II.
e ) I, II e III.
Resposta: Alternativa a.
Página 436
6. (Enem/MEC) A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que ocorrem em condições de
a ) alta pressão.
b ) alta temperatura.
c ) excesso de reagentes.
d ) maior superfície de contato.
e ) elevada energia de ativação.
Resposta: Alternativa d.
7. (Enem/MEC) A sacarase (ou invertase) é uma enzima que atua no intestino humano hidrolisando o dissacarídeo sacarose nos monossacarídeos glicose e frutose. Em um estudo cinético da reação de hidrólise da sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses, foram dissolvidos 171 gramas de sacarose em 500 mililitros de água. Observou-se que, a cada 100 minutos de reação, a concentração de sacarose foi reduzida à metade, qualquer que fosse o momento escolhido como tempo inicial. As massas molares dos elementos H, C e O são iguais a 1, 12 e 16 gramas mol elevado a menos 1, respectivamente.
Qual é a concentração de sacarose depois de 400 minutos do início da reação de hidrólise?
a ) 2 vírgula 50 vezes 10 elevado a menos 3 mol litro elevado a menos 1
b ) 6 vírgula 25 vezes 10 elevado a menos 2 mol litro elevado a menos 1
c ) 1 vírgula 25 vezes 10 elevado a menos 1 mol litro elevado a menos 1
d ) 2 vírgula 50 vezes 10 elevado a menos 1 mol litro elevado a menos 1
e ) 4 vírgula 27 vezes 10 elevado a menos 1 mol litro elevado a menos 1
Resposta: Alternativa b. Resolução nas Orientações para o professor.
8. (Enem/MEC) A Química Verde é um ramo da química que prega o desenvolvimento de processos eficientes, que transformem a maior parte do reagente em produto, de forma mais rápida e seletiva, que utilizem poucos reagentes, que produzam somente o produto desejado, evitando a formação de coprodutos, e que utilizem solventes não agressivos ao meio ambiente. Assim, as indústrias contornariam problemas relacionados à poluição ambiental e ao desperdício de água e energia.
O perfil de um processo que segue todos os princípios desse ramo da química pode ser representado por:
a ) A mais B mais C seta para a direita D (a reação ocorre a altas pressões).
b ) A mais B seta para a direita C mais D (a reação é fortemente endotérmica).
c ) A mais 3 B seta para a direita C (a reação ocorre com uso de solvente orgânico).
d ) 3 A mais 2 B seta para a direita 2 C seta para a direita 3 D mais 2 E (a reação ocorre sob pressão atmosférica).
e ) A mais 1 meio B seta para a direita C (a reação ocorre com o uso de um catalisador contendo um metal não tóxico).
Resposta: Alternativa e.
9. (Fuvest-SP) O cientista Richard Feynman, prêmio Nobel de Física em 1965, fez comentários sobre o processo de combustão em uma entrevista chamada Fun to Imagine. Segundo ele, à primeira vista, é impressionante pensar que os átomos de carbono de uma árvore não entram em combustão com o oxigênio da atmosfera de forma espontânea, já que existe uma grande afinidade entre essas espécies para a formação de CO subscrito 2. Entretanto, quando a reação tem início, o fogo se espalha facilmente.
Essa aparente contradição pode ser explicada pois
a ) a reação depende de um processo que concentre o carbono para ocorrer.
b ) o fogo torna a reação desfavorável.
c ) o fogo depende da presença de CO subscrito 2 para começar.
d ) o átomo de carbono da árvore é muito mais resistente ao O subscrito 2 do que os átomos de carbono dispersos no fogo.
e ) a reação precisa de uma energia de ativação para começar.
Resposta: Alternativa e.
10. (Fuvest-SP) Apesar de a África ser considerada o berço das civilizações e existirem indícios de conhecimentos elementares de Química no sul do continente cerca de 100.000 anos atrás, os conhecimentos químicos ensinados são eurocentristas. Entretanto, uma das grandes contribuições para o estudo de reatividade química é atribuída ao químico egípcio Ahmed Hassan Zewail, agraciado com o prêmio Nobel em 1999 por seus estudos de reações químicas usando uma técnica conhecida com espectroscopia de femtossegundos. Essa técnica possibilita identificar espécies com tempo de vida curto utilizando pulsos de laser com duração de 10 elevado a menos 15 segundos.
Essa contribuição é relevante para o estudo de reações químicas, pois
a ) todos os processos químicos são extremamente rápidos e não podem ser estudados por técnicas que não sejam em femtossegundos.
b ) as reações químicas podem passar por espécies instáveis e com pouco tempo de vida.
Página 437
c ) o tempo existente para analisar os produtos de uma reação depende apenas da quantidade de produtos formada.
d ) permite entender como reagentes específicos se comportam frente a processos reacionais que são extremamente lentos.
e ) apenas com uma técnica tão rápida é possível analisar o grau de pureza dos reagentes isolados.
Resposta: Alternativa b.
11. (Unicamp-SP) Um dos pilares da nanotecnologia é o fato de as propriedades dos materiais dependerem do seu tamanho e da sua morfologia. Exemplo: a maior parte do H subscrito 2 produzido industrialmente advém da reação de reforma de hidrocarbonetos: C H subscrito 4 abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses seta para a direita 3 H subscrito 2 abre parênteses g fecha parênteses mais C O abre parênteses g fecha parênteses. Uma forma de promover a descontaminação do hidrogênio é reagir o C O com largo excesso de água:
C O abre parênteses g fecha parênteses mais H subscrito 2 O abre parênteses g fecha parênteses seta para a direita C O subscrito 2 abre parênteses g fecha parênteses mais H subscrito 2 abre parênteses g fecha parênteses;
delta H é igual a menos 41 vírgula 6 quilojoules mol elevado a menos 1.
A figura abaixo mostra resultados da velocidade (em unidade arbitrária, unidade astronômica) dessa conversão em função da temperatura, empregando-se um nanocatalisador com duas diferentes morfologias.
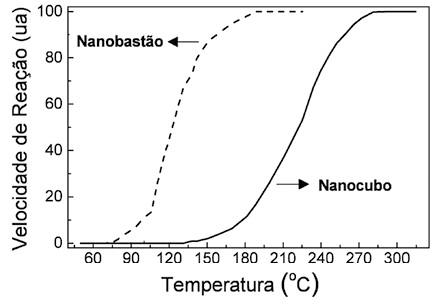
Considerando essas informações, é correto afirmar que, com essa tecnologia, a descontaminação do hidrogênio por C O é mais eficiente na presença do catalisador em forma de
a ) nanobastão, pois a transformação do C O ocorreria em temperaturas mais baixas, o que também favoreceria o equilíbrio da reação no sentido dos produtos, uma vez que a reação é exotérmica.
b ) nanobastão, pois a transformação do C O ocorreria em temperaturas mais baixas, o que também favoreceria o equilíbrio da reação no sentido dos produtos, uma vez que a reação é endotérmica.
c ) nanocubo, pois a transformação do C O ocorreria em temperaturas mais elevadas, o que também favoreceria o equilíbrio da reação no sentido dos produtos, uma vez que a reação é exotérmica.
d ) nanocubo, pois a transformação do C O ocorreria em temperaturas mais elevadas, o que também favoreceria o equilíbrio da reação no sentido dos produtos, uma vez que a reação é endotérmica.
Resposta: Alternativa a.
12. (UFRGS-RS) Uma professora, ao introduzir o conceito de energia de ativação, projetou em sua aula o seguinte modelo teórico.

Adaptado de: MARTORANO, S. A. A. A transição progressiva dos modelos de ensino cinética química a partir do desenvolvimento histórico do tema. 2012. Tese (Doutorado em Ensino de Química) Ensino de Ciências (Física, Química e Biologia), Universidade de São Paulo, São Paulo, 2012.
Disponível em: <https://s.livro.pro/jayfqr>. Acesso em: 16 nov. 2021. p. 295.
As teorias que sustentam esse modelo teórico, para explicar a influência de certos fatores na velocidade de uma reação química, são as
a ) Teoria das colisões e Teoria do complexo ativado.
b ) Teoria do estado de transição e Teoria de repulsão dos pares eletrônicos de valência.
c ) Teoria das colisões e Teoria de repulsão dos pares eletrônicos de valência.
d ) Teoria cinética dos gases e Teoria do complexo ativado.
e ) Teoria cinética dos gases e Teoria do estado de transição.
Resposta: Alternativa a.
Página 438
13. (Enem/MEC) O Prêmio Nobel de Química de 2000 deveu-se à descoberta e ao desenvolvimento de polímeros condutores. Esses materiais têm ampla aplicação em novos dispositivos eletroluminescentes (LEDs), células fotovoltaicas etc. Uma propriedade-chave de um polímero condutor é a presença de ligações duplas conjugadas ao longo da cadeia principal do polímero.
ROCHA FILHO, R. C. Polímeros condutores: descoberta e aplicações. Química Nova na Escola, n. 12, 2000 (adaptado).
Um exemplo desse polímero é representado pela estrutura
a )
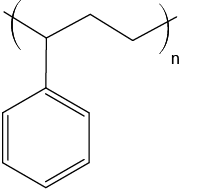
b )
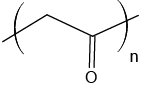
c )
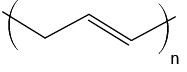
d )
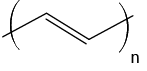
e )
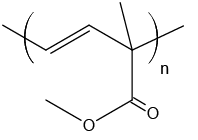
Resposta: Alternativa d.
14. (Unesp) Considere a estrutura do polímero conhecido pela sigla PET (polietilenotereftalato).
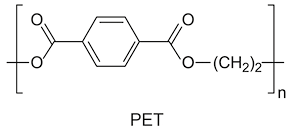
O exame dessa estrutura mostra que o PET é
a ) um poliéster.
b ) um poliálcool.
c ) uma poliamida.
d ) um poliéter.
e ) uma policetona.
Resposta: Alternativa a.
15. (UECE) Plásticos são substâncias formadas por moléculas muito grandes, chamadas de macromoléculas. São conhecidas como polímeros, que são fabricados pela união de muitas moléculas pequenas iguais, denominadas de monômeros. Diante dessa informação, assinale a afirmação verdadeira.
a ) Policloreto de vinila (PVC), usado na fabricação de cano d'água e mangueira, contém somente átomos de C, H, e C l em seu monômero.
b ) Politereftalato de etileno (PET), usado na fabricação de garrafa de refrigerante, não contém o átomo de O em seu monômero.
c ) Poliestireno (PS), usado na fabricação de copo descartável, além dos átomos de C e H, também contém o átomo de N em seu monômero.
d ) Polipropileno (PP), usado na fabricação de seringa, contém o átomo de O em seu monômero.
Resposta: Alternativa a.
16. (UECE) Macromoléculas de cadeias longas caracterizam os polímeros, em que cada cadeia apresenta uma unidade chamada de monômero. Um exemplo de polímero é o poliacrilonitrila, cuja estrutura é a seguinte:
Com relação a esse fato, analise as seguintes proposições:
I ) A fórmula do monômero formador do poliacrilonitrila é C subscrito 3 H subscrito 3 N.
II ) A fórmula estrutural deste monômero é:
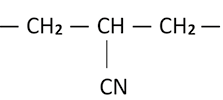
Considerando as proposições acima apresentadas, é correto afirmar que
a ) I é falsa e II é verdadeira.
b ) ambas são falsas.
c ) ambas são verdadeiras.
d ) I é verdadeira e II é falsa.
Resposta: Alternativa d.
17. (FMRP-SP) Analise o primeiro verso do poema "Psicologia de um Vencido", de Augusto dos Anjos, que faz alusão à composição química dos seres humanos restringindo-a ao elemento químico carbono e ao composto de amônia (N H subscrito 3).
Eu, filho do carbono e do amoníaco,
Monstro de escuridão e rutilância,
Sofro, desde a epigênesis da infância,
A influência má dos signos do zodíaco.
Todos os elementos químicos identificados no poema podem ser encontrados nas moléculas de
a ) polissacarídeos.
b ) carboidratos.
c ) lipídeos.
d ) enzimas.
e ) ácidos graxos.
Resposta: Alternativa d.