Página 106
UNIDADE 2
A QUÍMICA E A VIDA NA TERRA
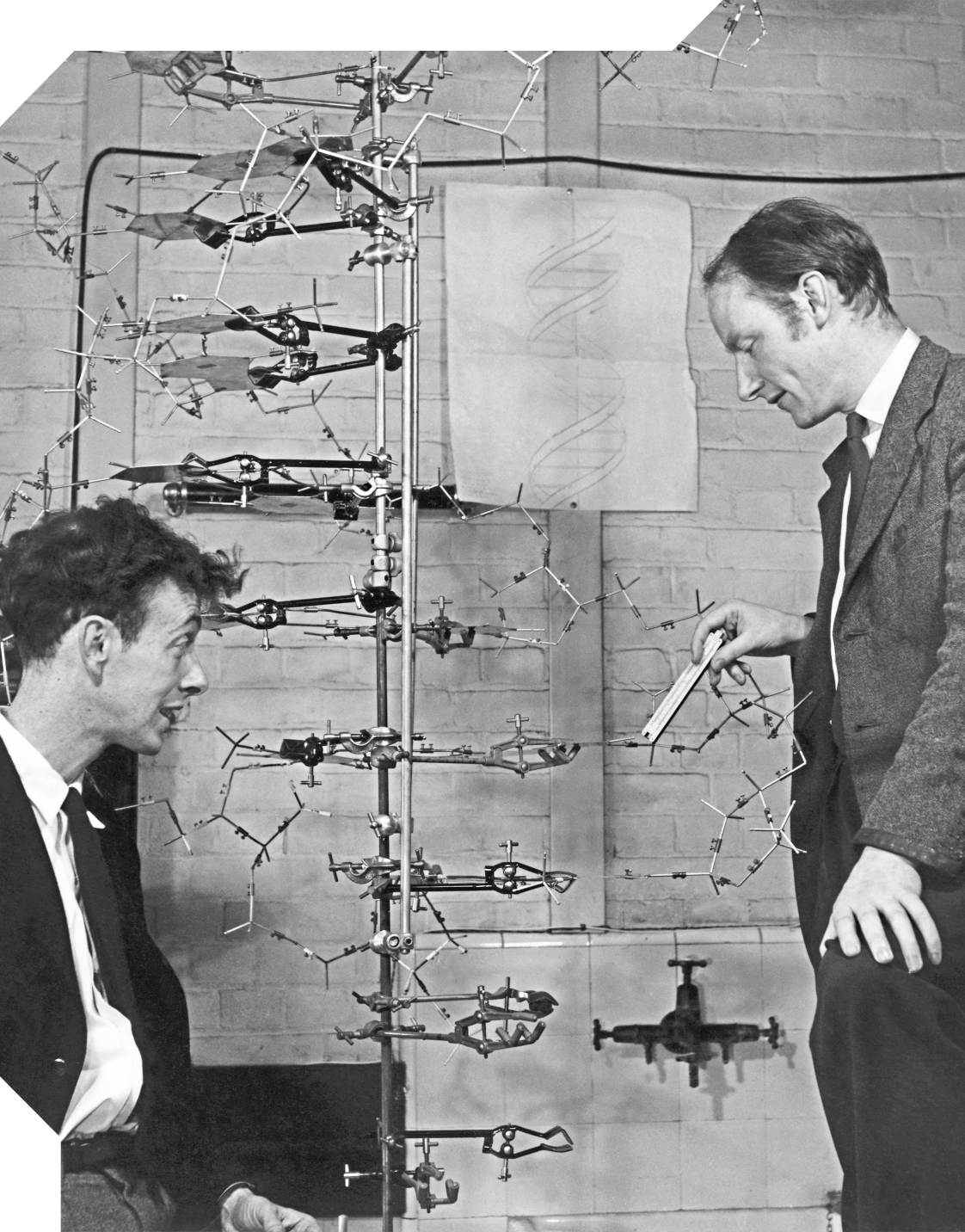
Analisando a imagem do modelo de DNA do geneticista estadunidense James Watson (1928 -) e do biofísico inglês Francis Crick (1916-2004), você consegue imaginar o impacto dessa descoberta na compreensão da vida? Essa estrutura complexa é fundamental para armazenar e transmitir informações genéticas em todos os organismos vivos. O modelo criado pelos cientistas foi elaborado por meio da análise de imagens de difração de raios X, que possibilitaram identificar as posições de diferentes átomos presentes na molécula de DNA.
Os modelos representacionais podem ser utilizados para analisar muitos aspectos da química. Com base no modelo da molécula de DNA, por exemplo, é possível representar a disposição de diversos tipos de átomos presentes nessa molécula e as diferentes porções repetitivas que formam sua estrutura. Além dos tipos e grupos de átomos, essa representação permite distinguir o tipo de interação que ocorre entre eles. Cada haste do modelo representa uma ligação química entre átomos, e as duas "hélices" são mantidas unidas por meio de interação intermolecular entre eles. O conhecimento dessas interações é fundamental para compreender o processo de replicação e transcrição do DNA, que permite que as fitas se separem e recombinem facilmente.
Nesta unidade, vamos estudar os tipos de interações químicas que ocorrem entre átomos e moléculas e as substâncias formadas principalmente por átomos de carbono e hidrogênio.
a ) Como você acha que o estudo das interações químicas contribui para compreender a dinâmica da vida na Terra?
b ) O estudo da Química está presente em diversas áreas. Discuta com seus colegas como os estudos relacionados à interação dos átomos podem refletir na sociedade.
c ) Como as representações utilizadas pelos cientistas podem ajudar no entendimento da matéria e de seu comportamento?
Respostas nas Orientações para o professor.
Nesta unidade, vamos estudar...
- ligações químicas;
- interações intermoleculares;
- compostos orgânicos;
- funções orgânicas.
Página 107
Página 108
CAPÍTULO6
A união dos átomos
Ligações químicas
1. De acordo com seus conhecimentos, como os átomos se unem?
Resposta pessoal. Esta questão tem o objetivo de fazer os estudantes expressarem seus conhecimentos prévios sobre ligações químicas. Eles podem responder que os átomos se unem por meio de ligações químicas estabelecidas entre os elétrons de seus últimos níveis de energia.
Ao longo do processo de evolução do Universo, após o início da expansão, houve a formação de átomos, que se espalharam pelo espaço. Condições específicas de temperatura, pressão e força gravitacional possibilitaram que os átomos de elementos químicos se aglutinassem em amontoados sólidos, dando origem aos planetas, como a Terra.
Com o resfriamento gradual da Terra, os elementos mais pesados, como ferro abre parênteses Fe fecha parênteses e níquel abre parênteses N i fecha parênteses, concentraram-se em seu núcleo, e os elementos mais leves se acumularam no manto e na superfície.
O manto terrestre é composto principalmente de silicatos✚ de magnésio abre parênteses M g fecha parênteses e de ferro; a crosta é mais diversificada, contando com silicatos e óxidos✚ de metais (alumínio abre parênteses A l fecha parênteses, ferro, cálcio abre parênteses C a fecha parênteses, sódio abre parênteses N a fecha parênteses e outros). Muitos minerais, quando devidamente tratados, dão origem a metais de interesse econômico. Confira a seguir alguns dos minerais mais comuns da crosta terrestre.
Imagens desta página sem proporção.



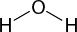
Mais de uma centena de elementos químicos estão previstos na tabela periódica. Os átomos desses elementos não se encontram isolados, mas sim combinados entre si formando diversos compostos. Por exemplo, a água abre parênteses H subscrito 2 O fecha parênteses, um recurso essencial para a vida na Terra, é formada pela união de átomos de oxigênio e de hidrogênio abre parênteses H fecha parênteses.
Um átomo pode se unir a outro ou a outros átomos por meio de ligações químicas. Essas ligações podem ser fortes (primárias) ou fracas (secundárias). Há três tipos principais de ligações químicas fortes: a iônica, a covalente e a metálica. Começaremos estudando a ligação iônica.
Página 109
LIGADO NO TEMA
Consumo consciente
Leia os trechos das reportagens a seguir.
Influenciador digital é o responsável por 40% das compras feitas pelo consumidor brasileiro
[…] Em 2021, o Brasil superou a China e assumiu o posto de país em que o público consumidor é o mais impactado pela influência digital. […]
CAPOMACCIO, Sandra. Influenciador digital é o responsável por 40% das compras feitas pelo consumidor brasileiro. Jornal da USP, 17 ago. 2021. Disponível em: https://s.livro.pro/4ehy21. Acesso em: 12 ago. 2024.
Pesquisa mostra que 44% das compras pela internet são por impulso
[…] Segundo o levantamento, os produtos e serviços mais comprados por impulso são: comidas e bebidas por delivery, moda e vestuário, itens para a casa, eletrônicos e artigos de informática.
COSTA, Kariane. Pesquisa mostra que 44% das compras pela internet são por impulso. Agência Brasil, 2021. Disponível em: https://s.livro.pro/r2cvy9. Acesso em: 12 ago. 2024.
Você costuma consumir por impulso? Já comprou alguma coisa por causa de uma propaganda? Você precisa realmente de tudo o que já comprou ou quer comprar?
O consumo consciente é extremamente relevante na atualidade, pois, além de muitos objetos serem descartados incorretamente – muitas vezes, até antes de perderem sua função –, a quantidade de matéria-prima extraída da natureza para sua construção é muito alta. E o problema vai da produção ao descarte.
Você sabe quantos elementos químicos estão envolvidos na produção de aparelhos eletrônicos? Muitos aparelhos têm ouro abre parênteses A u fecha parênteses, prata abre parênteses A g fecha parênteses, cobre abre parênteses C u fecha parênteses e mais um bocado de outros metais, e nenhum deles é encontrado pronto para uso. O cobre, por exemplo, é extraído da calcopirita e utilizado em materiais que precisam apresentar boa condução de calor e eletricidade.
Imagens desta página sem proporção.


O consumo consciente diminui não apenas a necessidade de extrair matéria-prima do ambiente, mas também a demanda por processos de separação dos compostos. Por isso, essa temática vem sendo discutida e é um dos objetivos da Agenda 2030, que prevê padrões de consumo e de produção sustentáveis.
a ) Junte-se a um colega para pesquisar qual objetivo da Agenda 2030 está relacionado ao consumo responsável e listem quais são as principais atitudes desse objetivo que podem ser adotadas pelos consumidores.
Resposta: Espera-se que os estudantes localizem que se trata do Objetivo 12 – Consumo e produção responsáveis. Entre as principais atitudes que podem ser praticadas pelos consumidores, eles podem mencionar a redução do desperdício de alimentos; a redução da geração de resíduos por meio da prevenção, redução, reciclagem e reúso dos materiais; ajudar a compartilhar informações sobre a conscientização e o estilo de vida em harmonia com a natureza.
Página 110
Ligação iônica
A principal fonte de obtenção de ferro no Brasil é a hematita, mineral encontrado em formações rochosas próximas à água ou em ambientes onde havia água no passado remoto.
A hematita é composta de óxido de ferro(III) abre parênteses F e subscrito 2 O subscrito 3 fecha parênteses, uma substância formada pela união de dois átomos de ferro e três átomos de oxigênio em suas respectivas formas iônicas abre parênteses F e elevado a início expoente, 3 mais, fim expoente fecha parênteses e abre parênteses O elevado a início expoente, 2 menos, fim expoente fecha parênteses.


2. Cite algumas aplicações do ferro em objetos do seu dia a dia.
Resposta pessoal. Os estudantes podem citar que o ferro pode estar presente em janelas, pregos, ferramentas, automóveis e trilhos de trem.
Para atingir a estabilidade, os átomos doam ou recebem elétrons em sua última camada e, dessa forma, passam a ter carga elétrica diferente de zero. Essas espécies são chamadas de íons.
Um átomo que recebe elétrons passa a apresentar mais elétrons do que prótons em sua estrutura, adquirindo carga negativa. Nesse caso, o íon recebe o nome de ânion e é representado pelo símbolo do átomo seguido do número de elétrons que recebeu e o sinal de carga negativa. O ânion O elevado a início expoente, 2 menos, fim expoente da hematita, por exemplo, indica que o átomo de oxigênio recebeu dois elétrons. Já os átomos que doam elétrons adquirem carga positiva, pois passam a ter mais prótons do que elétrons em sua estrutura. Nesse caso, são chamamos de cátions, representados pelo símbolo do átomo seguido do número de elétrons perdidos e o sinal de carga positiva. O cátion F e elevado a início expoente, 3 mais, fim expoente da hematita indica que o átomo perdeu três elétrons e tem carga positiva.
Professor, professora: Diga aos estudantes que a eletronegatividade do ferro (1,83) e a do oxigênio (3,44) resulta em uma diferença de 1,61.
A eletronegatividade está relacionada à capacidade de um átomo de atrair elétrons. Como a diferença de eletronegatividade entre o ferro e o oxigênio – sendo o oxigênio o mais eletronegativo – é elevada, dizemos que a ligação química é do tipo ligação iônica, ou seja, uma interação entre cátions e ânions.
Professor, professora: Diga aos estudantes que o ferro é o metal mais produzido no Brasil e também o mais comercializado, representando em 2021 cerca de 80,1% do valor total da produção de metais por mineração. Por causa do preço baixo, da alta dureza e da capacidade de formar ligas metálicas, é o metal mais utilizado na metalurgia e na construção civil.
Dica
Nas ligações iônicas, os átomos tendem a se combinar de modo a ter oito elétrons na camada de valência, ficando com a mesma configuração eletrônica de um gás nobre. No entanto, há exceções à regra do octeto.
Podemos compreender a ligação iônica como a força de atração entre dois íons, sendo um com carga positiva e outro com carga negativa. Há uma força eletrostática entre os íons que os mantém unidos.
As estruturas de Lewis são uma forma de demonstrar os elementos químicos com os elétrons da camada de valência. Nesse caso, a ligação iônica é a atração eletrostática entre os átomos.
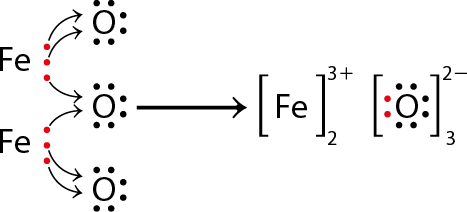
Note que são necessários dois átomos de ferro (que doam três elétrons cada um) e três átomos de oxigênio (que recebem dois elétrons cada um) para que a carga total seja nula.
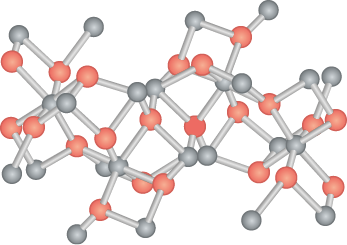
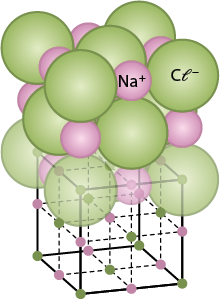
Os compostos iônicos formam retículos cristalinos, nos quais os íons se organizam em estruturas simétricas mantidas pela atração e repulsão de suas cargas. A proporção entre os íons é elucidada por meio da célula unitária. No caso do óxido de ferro(III), sua fórmula unitária é F e subscrito 2 O subscrito 3, indicando que, para cada dois átomos de ferro (esfera vermelha), há três de oxigênio (esfera cinza). Analise sua estrutura cristalina na próxima página.
Página 111
Em uma fórmula unitária, o balanço de cargas positivas e negativas será sempre igual a zero, indicando que a estrutura é eletricamente neutra. Confira como isso acontece no caso do F e subscrito 2 O subscrito 3.
Imagens desta página sem proporção e em cores fantasia.
2 átomos de F e elevado a início expoente, 3 mais, fim expoente é igual a carga 6 mais abre parênteses positiva fecha parênteses
3 átomos de O elevado a início expoente, 2 menos, fim expoente é igual a carga 6 menos abre parênteses negativa fecha parênteses
Total é igual a carga 0 abre parênteses neutra fecha parênteses
Quando há uma grande diferença de eletronegatividade entre os átomos envolvidos, geralmente entre um metal e outro ametal, ou metal e hidrogênio (hidreto metálico), nós os chamamos de compostos iônicos.
Dica
Lembre-se de que podemos consultar a tabela periódica para avaliar as tendências da eletronegatividade dos elementos.
A ligação iônica é considerada forte, o que significa que necessita de muita energia para ser rompida. As energias de atração e repulsão entre os íons no retículo cristalino conferem resistência adicional ao composto químico. Isso faz que os compostos iônicos tenham altas temperaturas de fusão e de ebulição e sejam sólidos à temperatura ambiente, e são maus condutores de eletricidade no estado sólido, pois seus íons não têm mobilidade dentro do retículo cristalino. Porém, quando no estado líquido ou dissolvido em água, tornam-se bons condutores elétricos, já que seus íons passam a ter alta mobilidade.
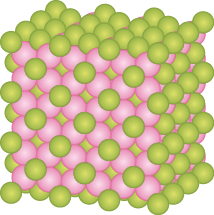
Muitos materiais que usamos diariamente são compostos iônicos. Confira os exemplos do fluoreto de cálcio e cloreto de sódio a seguir.
Fluoreto de cálcio abre parênteses C a F subscrito 2 fecha parênteses: muito usado em cremes dentais e pode ser adicionado à água nas estações de tratamento, auxiliando na prevenção da cárie. Na natureza, o fluoreto de cálcio é encontrado no mineral fluorita.
Verifique como os compostos iônicos podem ter retículos cristalinos diferentes. Na estrutura apresentada, os átomos de cálcio estão representados em rosa e os de flúor abre parênteses F fecha parênteses, em verde.
3. Comente a importância de adicionar o fluoreto de cálcio no tratamento de água.
Resposta: Espera-se que os estudantes comentem que esse composto ajuda na prevenção da cárie dentária.
Cloreto de sódio abre parênteses N a C l fecha parênteses: conhecido popularmente como sal de cozinha, é muito usado para temperar ou realçar o sabor dos alimentos. A principal forma de produzir N a C l é por meio da evaporação da água do mar.

4. Que problemas de saúde associados ao consumo de sal de cozinha você conhece? O que pode ser feito para evitá-los?
Resposta pessoal: O objetivo desta questão é levar os estudantes a refletir sobre os problemas de saúde, como a hipertensão arterial. Espera-se que eles respondam que o consumo deve ser moderado.
Página 112
A extração de sal é uma atividade econômica fundamental em diversas regiões do mundo, inclusive no Nordeste brasileiro, realizada tanto por meio do processo de evaporação da água do mar, resultando no sal marinho, quanto da mineração de depósitos subterrâneos, originando o sal-gema.
O sal-gema, ou halita, é retirado de depósitos subterrâneos formados em tempos geológicos passados. No Brasil, um exemplo é encontrado em Maceió (AL), onde sua extração causou graves problemas ambientais e sociais. Desde os anos 1970, a capital alagoana vem enfrentando tremores de terra e o afundamento de bairros inteiros por conta da intensa exploração de sal-gema. De acordo com imagens de satélites, estima-se que o solo afundou cerca de 2 metros entre 2004 e 2020. Em 2023, foi dado o alerta de risco de acordo pela Defesa Civil do estado, que, depois, foi considerada situação de emergência. Esse fenômeno resultou no êxodo urbano da região.
A extração de sal-gema afeta diretamente a estabilidade geológica da região. O processo de mineração cria cavernas e vazios subterrâneos que podem entrar em colapso com o tempo. A cidade de Maceió está localizada sobre camadas sedimentares, que, ao serem perfuradas e removidas, perdem a capacidade de suportar o peso das construções acima delas, resultando em danos significativos à infraestrutura urbana.
Imagem sem proporção e em cores fantasia.
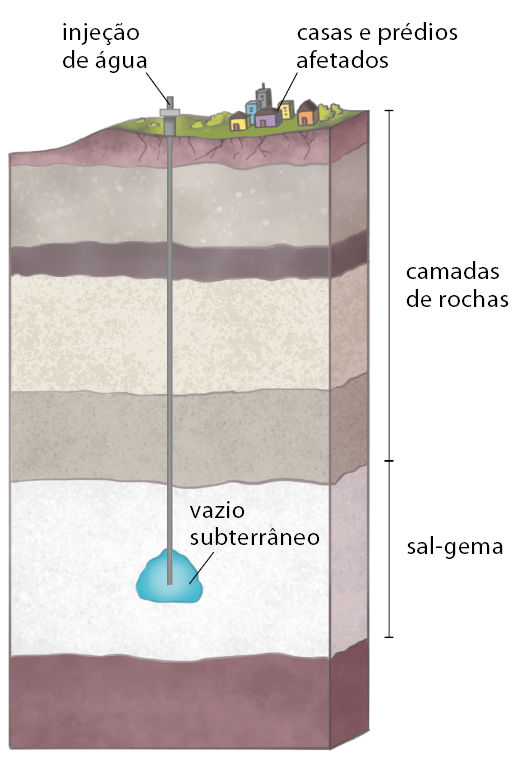
Imagem elaborada com base em: SCHMIDT, Sarah. Vazios que rompem o chão. Pesquisa Fapesp, n. 335, jan. 2024. p. 48.
Para entender o impacto da extração de sal-gema, é essencial considerar a estrutura geológica da Terra. A crosta terrestre é composta de várias camadas sedimentares, cuja perfuração pode ocasionar desastres, como os ocorridos em Maceió. Além disso, a exploração de sal-gema tem uma relevância histórica significativa.
Na África Ocidental, essa foi uma das principais atividades econômicas até o século XVI, particularmente no Império de Mali. Em Tagaza, região desértica ao norte do Mali, havia uma grande mina de sal-gema. Este sal era tão valioso quanto o ouro e sua enorme abundância levava as pessoas a construírem suas casas com placas desse sal.
A extração de sal-gema destaca a importância desse recurso e os desafios associados a ele. Em Maceió, ocorreram sérios problemas ambientais e sociais, enquanto em Tagaza foi crucial para impulsionar sua economia.
Página 113
Ligação covalente
Professor, professora: Em geral, quando a diferença de eletronegatividade entre os dois átomos for maior ou igual a 1,70 e um dos átomos for um metal, a ligação será iônica. Se for menor do que 1,70, será covalente. Mas há exceções, por isso deve-se sempre verificar quais elementos estão envolvidos na ligação.
O quartzo, ou sílica, de fórmula unitária S i O subscrito 2 (dióxido de silício), é um dos minerais mais abundantes na crosta terrestre. Além de ser o principal componente da areia, ele está presente no arenito, um tipo de rocha bastante comum em ambientes marinhos, rios e lagos.
A areia, por sua vez, tem grande importância econômica, pois é a principal matéria-prima na fabricação de vidros e concretos. A sílica corresponde a cerca de 70% da massa final do vidro e é responsável por conferir cor, claridade e resistência ao produto.
A própria fórmula unitária e o próprio nome do dióxido de silício nos mostram que ele é composto de átomos de silício e átomos de oxigênio. Esses dois átomos têm eletronegatividades bastante próximas, portanto, ao contrário do que ocorre em ligações iônicas, não haverá doação de elétrons, mas sim um compartilhamento, o que caracteriza uma ligação covalente.

A seguir, temos as representações da estrutura de Lewis para o S i O subscrito 2, em que o átomo de oxigênio possui 6 elétrons na camada de valência e o de silício, 4. O silício compartilha 4 elétrons, enquanto o oxigênio compartilha 2. Na segunda representação, cada traço simboliza um par de elétrons compartilhados.
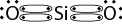
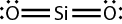
As ligações covalentes podem ser simples, duplas ou triplas, dependendo do número de pares de elétrons compartilhados. No caso do S i O subscrito 2, o átomo de silício faz uma ligação dupla com cada átomo de oxigênio.
A ligação covalente acontece principalmente entre um átomo de ametal e outro ametal, entre um ametal e o hidrogênio ou entre dois átomos de hidrogênio.
Professor, professora: Certifique-se de que os estudantes identifiquem os elementos químicos ametais à direita na tabela periódica.
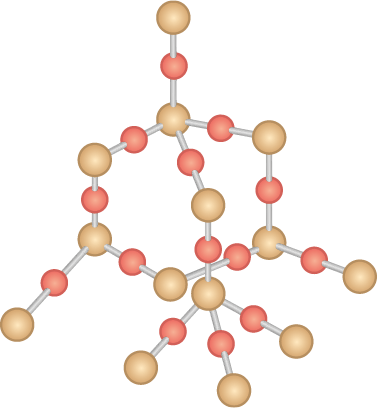
Os compostos formados por ligações covalentes podem se estruturar como retículos cristalinos de longo alcance, chamados sólidos covalentes ou reticulares, ou como moléculas simples, chamadas substâncias moleculares, ou apenas moléculas. Na representação do dióxido de silício a seguir – em que as esferas vermelhas representam átomos de oxigênio e as marrons, átomos de silício –, é apresentada apenas uma parte da sua estrutura.
Imagem sem proporção e em cores fantasia.
5. Considerando que não há formação de íons na ligação covalente, esses compostos são maus ou bons condutores de eletricidade ao serem dissolvidos na água?
Resposta: Espera-se que os estudantes respondam que são maus condutores de eletricidade, pois não apresentam cargas.
A força da ligação covalente depende de diversos fatores, como da quantidade de elétrons compartilhados. A variabilidade da força de ligação afeta as temperaturas de fusão e de ebulição. Assim, esses compostos podem ser gasosos, líquidos ou sólidos à temperatura ambiente abre parênteses 25 graus Celsius fecha parênteses e têm baixa temperatura de fusão se comparados com os compostos iônicos.
Professor, professora: Comente com os estudantes que a ligação covalente forma uma nuvem de elétrons, ou seja, uma região com mais probabilidade de encontrar os elétrons. Isso os ajudará a entender que os elétrons não são estáticos e os preparará para discutir a respeito da polaridade no próximo capítulo.
Página 114
Ligação metálica
Leia o trecho da matéria a seguir.
Pesquisador da Uniso desenvolve liga metálica mais dura do mundo
O material foi chamado de Diamante Metálico e pode conter até nove elementos diferentes em sua formulação.
[…]
Ferro, cromo e nióbio foram alguns dos elementos utilizados no desenvolvimento da nova liga. […]
PROFETA, Guilherme. Pesquisador da Uniso desenvolve liga metálica mais dura do mundo. Uniso Ciência. v. 3, n. 5, jun. 2020. p. 36, 37, 42.
6. Você já ouviu falar em liga metálica? Caso sua resposta seja afirmativa, cite um exemplo de liga metálica em um objeto usado em seu cotidiano.
Resposta pessoal. O objetivo desta questão é levar os estudantes a expressar seus conhecimentos prévios sobre ligas metálicas e identificar esses materiais em seu cotidiano, citando objetos de aço, rodas de liga leve de automóveis, entre outros exemplos.
Dica
Uma liga metálica é um material composto de átomos de dois ou mais elementos químicos diferentes, e ao menos um deles deve ser um metal. O aço, por exemplo, é uma liga entre ferro e carbono abre parênteses C fecha parênteses.
Átomos de metais ligam-se uns aos outros por meio de ligações metálicas, que têm um perfil bem diferente das ligações iônicas e covalentes, pois, como os metais apresentam baixo valor de eletronegatividade, seus elétrons são pouco atraídos pelo núcleo. Logo, a tendência dos metais é doar elétrons. Em um composto formado exclusivamente por metais, não há átomos aceptores de elétrons, e os elétrons de valência conseguem transitar livremente entre os átomos.
Dica
Acesse o simulador "Polaridade da molécula" para investigar como a eletronegatividade interfere no tipo de ligação. Disponível em: https://s.livro.pro/dp3ksm. Acesso em: 12 ago. 2024.
Podemos considerar que as estruturas metálicas são formadas por cátions rodeados por elétrons livres em movimento, e a força de atração entre cátions e elétrons é o que constitui a ligação metálica.
Imagens desta página sem proporção e em cores fantasia.

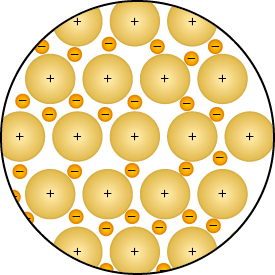
A aplicação de força nos metais também pode fazer os cátions mudarem de posição e, por isso, os metais têm alta maleabilidade, que é a capacidade de serem deformados e transformados em lâminas, e alta ductilidade, que corresponde à capacidade de serem transformados em fios.
7. Como verificamos, a condução elétrica depende da movimentação de elétrons pelo material. Como você explicaria o fato de os metais serem bons condutores de eletricidade?
Resposta: Espera-se que os estudantes respondam que isso ocorre porque os elétrons transitam livremente nos metais e nas ligas metálicas.
Em uma ligação metálica, a intensa força eletrostática entre os cátions e os elétrons confere altas temperaturas de fusão e de ebulição às estruturas, que são sólidas à temperatura ambiente. A única exceção é o mercúrio abre parênteses H g fecha parênteses, metal que é líquido a 25 graus Celsius.
Página 115
Materiais inteligentes
Conhecer as características das ligações químicas e as propriedades físico-química dos materiais formados por elas é fundamental para desenvolver novas tecnologias. Esse conhecimento permite a criação de materiais inteligentes, que por meio de estímulos específicos (como tensão, mudança de temperatura, campo magnético etc.) desempenham funções inovadoras em diversas áreas.
Um exemplo notável é o nitinol, uma liga metálica de níquel e titânio com o efeito memória de forma. Esse material passa por tratamentos sofisticados, que o projetam para ter um formato predeterminado. Assim, o material pode ser deformado em um segundo formato e, ao ser aquecido, o metal retorna à sua forma original. Esse material é amplamente utilizado em dispositivos médicos, como stents e fios ortodônticos.
Outro tipo de material inteligente é o piezoelétrico. Esses materiais geram cargas elétricas quando submetidos à pressão mecânica ou se deformam quando expostos a um campo elétrico. Um exemplo é o cristal de quartzo, que tem ligações covalentes entre silício e oxigênio. Geralmente, são utilizados em sensores, atuadores e dispositivos de captura de energia. Também são usados em plataformas de pesagem de veículos grandes e pesados.

Já os transdutores são usados em microfones e alto-falantes para captar e emitir som, em sensores de pressão e impacto em sistemas de segurança automotivos, em relógios de quartzo para manter a precisão do tempo e em equipamentos médicos de ultrassom para gerar e receber ondas sonoras usadas na formação de imagens internas do corpo.

As aplicações desses materiais inteligentes são muitas e vão da medicina à eletrônica e à engenharia. Eles representam o futuro dos materiais, permitindo a criação de tecnologias mais eficientes e adaptáveis às necessidades humanas.
Página 116
Classificações de ligações químicas
Embora classifiquemos as ligações químicas em três tipos – iônicas, covalentes e metálicas –, essas categorias representam os extremos das interações. Na realidade, em muitos compostos, as ligações apresentam características intermediárias. O grau de caráter iônico, covalente ou metálico de uma ligação pode ser previsto para compostos binários utilizando dois parâmetros fundamentais: a diferença de eletronegatividade e a eletronegatividade média dos átomos envolvidos.
A diferença de eletronegatividade entre dois átomos determina o grau de polaridade da ligação; quanto maior a diferença, mais iônica é a ligação. A eletronegatividade média influencia a natureza geral da ligação, ajudando a identificar se um composto tende mais para o comportamento metálico ou covalente.
O diagrama de Van Arkel-Ketelaar utiliza esses parâmetros para categorizar as ligações em três regiões.
Diagrama de Van Arkel-Ketelaar
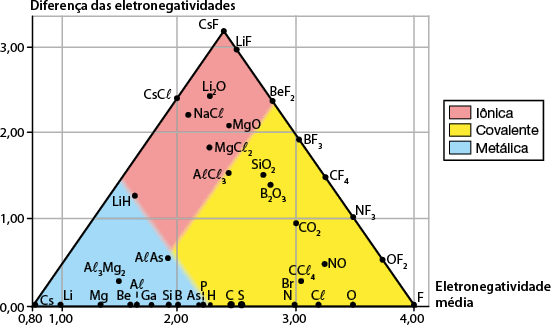
Fonte de pesquisa: KOTZ, John C. et al. Química geral e reações químicas. Tradução: Noveritis do Brasil. 9. ed. São Paulo: Cengage Learning, 2015. v. 2. p. 1022.
Os compostos metálicos são encontrados na região em que tanto a diferença de eletronegatividade quanto a eletronegatividade média são baixas. Os compostos iônicos têm diferença de eletronegatividade alta e eletronegatividade média intermediária. Os compostos covalentes, por sua vez, têm diferença de eletronegatividade baixa e eletronegatividade média maior.
Representação de estruturas químicas
As representações das estruturas químicas são recursos amplamente utilizados no estudo da matéria e suas propriedades. Além de otimizar a comunicação do conhecimento químico, diversos tipos de representações são utilizados para demonstrar, por exemplo, as ligações entre átomos, os ângulos das ligações, a posição espacial dos átomos, entre outras informações.
Nos compostos iônicos, forma-se um arranjo tridimensional, em que um íon não está associado a apenas um contra-íon. A estrutura cristalina do cloreto de sódio abre parênteses N a C l fecha parênteses, por exemplo, pode ser representada de diferentes formas. Uma representação comum mostra as esferas dos íons em contato, destacando a rede cristalina compacta. Outra mostra o centro dos íons como pequenas esferas que não estão em contato direto, mas ainda mantêm a estrutura tridimensional regular. Trata-se de duas formas de representar a mesma estrutura, com objetivos diferentes.
Imagem sem proporção e em cores fantasia.
Página 117
Em relação à ligação covalente, as estruturas moleculares podem ser representadas simplificadamente por estruturas de linhas. Essas estruturas podem omitir os átomos de carbono abre parênteses C fecha parênteses e hidrogênio abre parênteses H fecha parênteses ou não. Por exemplo, o propano abre parênteses C subscrito 3 H subscrito 8 fecha parênteses pode ser representado com todos os átomos explícitos e as ligações entre os carbonos (A) ou apenas com linhas e ângulos representando as ligações entre os carbonos (B).
Imagens desta página sem proporção e em cores fantasia.
A.
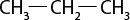
B.

Outra forma de representação das moléculas que fazem ligações covalentes é o modelo de bolas cheias (A), no qual cada átomo é representado por uma esfera cheia, e o modelo de bolas e varetas (B), em que as esferas representam os átomos e as varetas representam as ligações entre eles.
A.

B.

Na ligação metálica, além da representação dos elétrons entre os cátions, o arranjo tridimensional de suas estruturas pode ser representado de forma similar aos sólidos iônicos. Os metais têm estrutura cristalina e algumas dessas estruturas podem ser constituídas de apenas um tipo de átomo. A estrutura de um metal puro, como o alumínio, e de uma liga metálica, como o ouro 14 quilates abre parênteses A u menos A g fecha parênteses, são exemplos de tais representações.
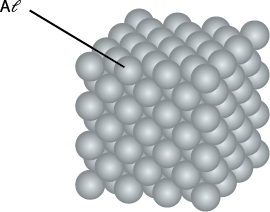
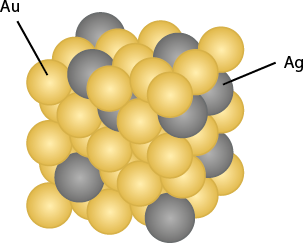
Essas representações são fundamentais para entender o comportamento mecânico dos materiais, como a maleabilidade e a ductilidade dos metais, que permitem que eles sejam moldados sem quebrar.

Quando os cátions de um metal são deslocados por uma martelada, os elétrons móveis conseguem responder imediatamente e seguir os cátions até suas novas posições, o que torna o metal maleável.
As representações químicas são ferramentas importantes para visualizar e compreender as diversas estruturas e os comportamentos dos materiais. Elas permitem uma melhor compreensão das propriedades químicas e físicas ao facilitar a expressão e comunicação dos conhecimentos científicos.
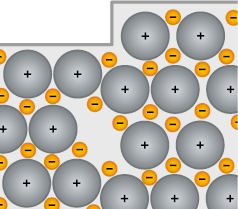
Página 118
PRÁTICA CIENTÍFICA
Conduzindo corrente elétrica
Por dentro do contexto
Como já estudamos, certos elementos químicos dificilmente são encontrados de maneira isolada. O sal de cozinha e o açúcar comum são substâncias compostas presentes no nosso cotidiano, muitas delas são encontradas até na água.
É possível que você já tenha ouvido falar dos perigos de continuar nadando no mar enquanto relâmpagos de uma chuva forte aparecem no céu. O contato de relâmpagos com a água pode ser muito perigoso, mesmo a água não sendo boa condutora de corrente elétrica.

a ) Considerando os tipos de ligação química estudados e suas características, formule hipótese(s) que justifiquem esse perigo.
Resposta nas Orientações para o professor.
Materiais
- bateria de 12 V
- lâmpada LED
- 3 pedaços de fios de cobre
- alicate
- fita isolante
- água destilada
- papel-toalha
- sal de cozinha
- açúcar
- borracha escolar
- copos ou béqueres
- colher de chá
- placa de cobre
Cuidado
Ao inserir os fios para testar a condutividade dos compostos, tome cuidado para não molhar os dedos. Verifique também se todos os fios estão devidamente conectados e envoltos com fita isolante.
Como proceder
A. Desencape cerca de 2 centímetros das extremidades dos fios de cobre com o alicate.
B. Com a fita isolante, conecte uma extremidade de um dos fios na bateria e a outra no fio do LED. Conecte o segundo fio na bateria e deixe uma extremidade solta. Conecte o terceiro fio de cobre com o fio do soquete da lâmpada.
Imagem sem proporção e em cores fantasia.
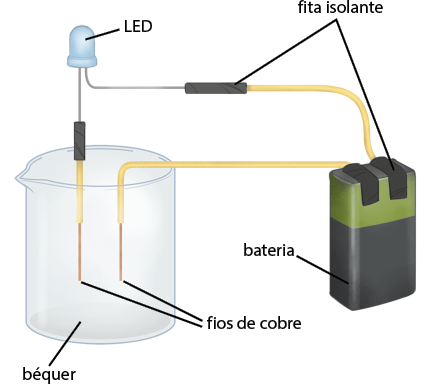
C. Deixe o aparato organizado, como apresentado na imagem.
D. Em um copo ou béquer, coloque água destilada até a metade do recipiente e mergulhe os fios dentro dele. Observe o que ocorre com a lâmpada. Seque os fios com papel-toalha.
E. Adicione 1 colher de chá de sal de cozinha em um outro copo limpo e teste a condução de corrente elétrica nessa substância. Para isso, encoste os dois fios, separadamente, no sal. Limpe as pontas dos fios. Para a limpeza dos fios durante todo o experimento, lave as pontas deles em água destilada e seque-as com o papel-toalha antes de iniciar o próximo passo.
Dica
Lembre-se de lavar a colher cuidadosamente ao mudar de procedimento, para que não haja contaminação.
F. Adicione 1 colher de chá de açúcar em outro copo limpo e teste a condução de corrente elétrica nessa substância. Para isso, encoste os dois fios, separadamente, no açúcar. Limpe as pontas dos fios novamente.
Página 119
G. Coloque água destilada no copo usado na etapa E até a metade e misture, a fim de formar a solução de N a C l e teste novamente. Observe o que ocorre com a lâmpada. Faça a limpeza das pontas dos fios novamente.
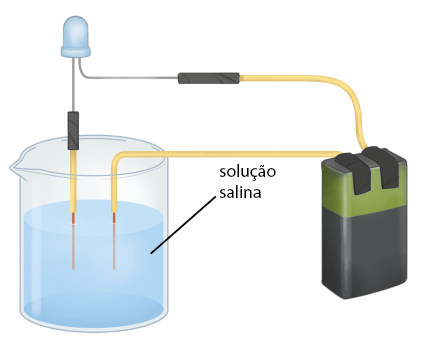
H. Depois, coloque água no copo usado na etapa F até a metade e misture, a fim de formar a solução de açúcar, e teste novamente. Observe o que ocorre com a lâmpada. Limpe as pontas dos fios novamente.
I. No copo da etapa G, acrescente mais 1 colher de chá de sal, a fim de formar uma solução mais concentrada e teste a condutividade mais uma vez. Limpe as pontas dos fios novamente.
J. Encoste as extremidades dos fios na placa de cobre e na borracha e observe a lâmpada.
Imagens desta página sem proporção e em cores fantasia.
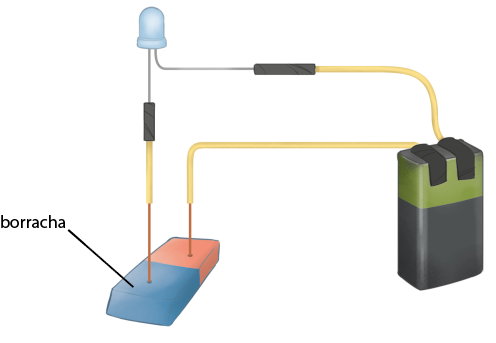
Análise e divulgação
1. Em quais materiais a lâmpada acendeu e em quais não acendeu?
2. Os resultados foram de acordo com a hipótese que você formulou antes da prática?
3. Identifique o tipo de ligação química que ocorre entre os átomos dos materiais testados.
4. Justifique por que alguns materiais conduziram a corrente elétrica e outros não. Se necessário, pesquise em referências confiáveis para auxiliar na sua resposta.
5. O que aconteceu na etapa I? Explique, comparando com o ocorrido na etapa G.
6. Represente, com um desenho, a ligação entre os átomos de cobre dos fios condutores de eletricidade.
Atividade(s) adaptada(s) acessível(is)
6. Descreva a ligação entre os átomos de cobre dos fios condutores de eletricidade.
Resposta pessoal. Espera-se que os estudantes descrevam os cátions de cobre envoltos por elétrons.
7. É hora de divulgar os resultados! Produza um podcast curto relatando o que você descobriu.
- Crie um roteiro organizado e claro.
- Comece o podcast se apresentando, depois apresente o tema que será abordado. Utilize frases e questionamentos que despertam a curiosidade para chamar a atenção do ouvinte.
- Você pode prosseguir citando casos relatados na mídia ou em redes sociais que, erroneamente, em geral, associam a água como ótima condutora de corrente.
- Para concluir, explique o experimento, justificando suas observações e os conceitos teóricos.
Respostas nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
7. É hora de divulgar os resultados! Com um colega, produzam um podcast curto relatando o que vocês descobriram.
- Criem um roteiro organizado e claro.
- Comecem o podcast se apresentando; depois, falem do tema. Usem frases impactantes para chamar a atenção do ouvinte, por exemplo: "A verdade sobre a condução de corrente elétrica da água".
- Vocês podem prosseguir citando casos relatados na mídia ou em redes sociais que, em geral, associam equivocadamente a água como ótima condutora de corrente.
- Para concluir, expliquem o experimento, justificando suas observações e os conceitos teóricos.
Resposta pessoal. Acompanhe a elaboração do podcast pelos estudantes e, caso eles tenham dificuldade em alguma etapa, auxilie-os.
Orientação para acessibilidade
Professor, professora: Organize as duplas de modo que o estudante não vidente esteja acompanhado de um estudante vidente. É possível organizar diferentes tarefas para cada um dos estudantes.
Página 120
ATIVIDADES
1. Escreva a fórmula dos compostos iônicos obtidos em cada uma das situações a seguir.
a ) União entre o sódio, que tem 1 elétron na camada de valência, e os elementos químicos com 7 elétrons na camada de valência, como flúor, cloro abre parênteses C l fecha parênteses, bromo abre parênteses B r fecha parênteses e iodo abre parênteses I fecha parênteses.
Resposta: N a F, N a C l, N a B r e N a I.
b ) União entre o bromo, que tem 7 elétrons na camada de valência, e os elementos com 2 elétrons na camada de valência, como magnésio, cálcio, estrôncio abre parênteses S r fecha parênteses e bário abre parênteses B a fecha parênteses.
Resposta: M g B r subscrito 2, C a B r subscrito 2, S r B r subscrito 2 e B a B r subscrito 2.
2. O alumínio é utilizado em vários tipos de produtos, como embalagem de bebidas, material para construção civil e peças automotivas. Esse metal é obtido do minério bauxita, constituído principalmente de óxido de alumínio abre parênteses A l subscrito 2 O subscrito 3 fecha parênteses e moléculas de água.
Responda às questões a seguir.
a ) No composto A l subscrito 2 O subscrito 3 e no metal A l, qual(is) tipo(s) de ligação química ocorre(m) entre os átomos?
b ) A l subscrito 2 O subscrito 3 e A l são bons condutores elétricos na fase sólida? Justifique sua resposta.
c ) Qual dessas substâncias é a mais maleável: A l subscrito 2 O subscrito 3 ou o A l? Justifique sua resposta.
d ) Se fosse feito o aquecimento gradativo das amostras de A l e de A l subscrito 2 O subscrito 3, qual delas sofreria fusão primeiro?
3. Avalie as afirmações a seguir e verifique qual é a alternativa correta.
I ) Em ligações iônicas, os metais doam seus elétrons de valência para o ametal.
II ) Ligações covalentes ocorrem apenas entre elementos químicos não metálicos, compartilhando os elétrons, sendo esses compostos excelentes condutores de eletricidade.
III ) Ligações metálicas ocorrem em metais puros; os elétrons ficam espalhados pela estrutura metálica.
a ) Todas as afirmativas estão corretas.
b ) Apenas I e III estão corretas.
c ) Apenas II e III estão corretas.
d ) Apenas I e II estão corretas.
e ) Todas as afirmativas estão erradas.
Resposta: Alternativa b. Comentários nas Orientações para o professor.
4. Identifique a alternativa que indica os elementos químicos que podem se ligar ao carbono.
a ) H, N h, O e H e.
b ) L i, F r, K r e P.
c ) N, H, C e O.
d ) H e, F e, C r e K.
Resposta: Alternativa c. Comentários nas Orientações para o professor.
5. Leia a manchete e o texto a seguir.
Vazamento de amônia em frigorífico em Paiçandu leva 14 funcionários para o hospital
Disponível em: https://s.livro.pro/kw3p5l. Acesso em: 12 ago. 2024.
A amônia é um gás, à temperatura ambiente abre parênteses 25 graus Celsius fecha parênteses e incolor. Tem odor característico e pode se depositar nas vias aéreas superiores. Entre as diversas aplicações, é utilizada em refrigeradores, sínteses químicas e agricultura.
Responda aos itens a seguir.
a ) A amônia é constituída dos elementos químicos nitrogênio N e hidrogênio. Sabendo que o nitrogênio tem 5 elétrons de valência e o hidrogênio tem apenas 1, qual é a fórmula molecular da amônia?
b ) A amônia é um bom condutor elétrico quando está na fase líquida? Justifique.
c ) Escreva as fórmulas de Lewis da amônia.
d ) Quais medidas de prevenção poderiam ser feitas nesse frigorífico? Depois do vazamento, que medidas deveriam ser aplicadas? Se necessário, faça uma pesquisa em sites sobre segurança de trabalho.
Respostas das questões 2 e 5 nas Orientações para o professor.
6. Sobre a classificação de ligações químicas é correto afirmar que:
a ) todos os compostos apresentam ligações químicas com características bem definidas, que podem ser classificadas em três tipos.
b ) muitos compostos podem apresentar ligações que apresentam características intermediárias aos três principais tipos de ligação química.
c ) podemos classificar as ligações químicas de acordo com o diagrama de Linus Pauling.
d ) a classificação do tipo de ligação não depende da eletronegatividade dos átomos.
Resposta: Alternativa b.
Página 121
7. A produção de bolos frequentemente envolve o uso de bicarbonato de sódio abre parênteses N a H C O subscrito 3 fecha parênteses, que atua como um agente fermentador. Durante o processo de cozimento, o bicarbonato de sódio se decompõe, liberando dióxido de carbono abre parênteses CO subscrito 2 fecha parênteses e outros compostos que contribuem para o crescimento da massa do bolo.
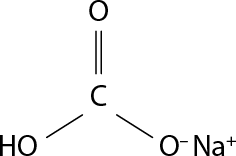
Qual(is) tipo(s) de ligação química ocorre(m) entre os átomos do bicarbonato de sódio?
Resposta: Ligação covalente e iônica.
8. Justifique como a ligação metálica explica a condutividade elétrica das ligas metálicas, utilizando o exemplo da liga de alumínio com cobre, que é amplamente utilizada em diversos aparelhos eletrônicos.
Resposta: A ligação metálica permite alta condutividade elétrica, pois os elétrons livres se movem facilmente.
9. O gás carbônico é crucial para a vida na Terra em razão de seu papel em dois processos fundamentais: o efeito estufa e a fotossíntese. No efeito estufa, o CO subscrito 2 ajuda a reter calor na atmosfera, mantendo a temperatura global em níveis que permitem a vida. Além disso, durante a fotossíntese, as plantas utilizam o CO subscrito 2 para produzir oxigênio e nutrientes, essenciais para a sobrevivência dos seres vivos.
Em relação aos processos citados, responda aos itens a seguir.
a ) Além do gás carbônico, outros gases são cruciais para a vida na Terra. Cite outros três exemplos e diga que ligação está envolvida em seus átomos.
Possíveis respostas: Gás oxigênio abre parênteses O subscrito 2 fecha parênteses, gás nitrogênio abre parênteses N subscrito 2 fecha parênteses, ozônio abre parênteses O subscrito 3 fecha parênteses etc. Todos os compostos citados têm ligação covalente.
b ) Outro gás encontrado na atmosfera e que é essencial é o ozônio abre parênteses O subscrito 3 fecha parênteses. Escreva sua fórmula de Lewis e registre suas observações.
Resposta: Espera-se que os estudantes demonstrem um átomo de oxigênio central realizando uma ligação dupla e uma simples com outros dois. Eles devem demonstrar os pares de elétrons não compartilhados: 1 par no átomo central; 3 pares no átomo com ligação simples; 2 pares no átomo com ligação dupla.
Atividade(s) adaptada(s) acessível(is)
b ) Outro gás encontrado na atmosfera e que é essencial é o ozônio abre parênteses O subscrito 3 fecha parênteses. Descreva a fórmula de Lewis dessa substância e registre suas observações.
Resposta: Espera-se que os estudantes descrevam um átomo de oxigênio central realizando uma ligação dupla e uma simples com outros dois. Eles devem descrever os pares de elétrons não compartilhados: um par no átomo central, três pares no átomo com ligação simples e dois pares no átomo com ligação dupla.
10. Qual das seguintes afirmações melhor descreve a importância das representações de estruturas químicas no estudo da química?
a ) As representações de estruturas químicas são apenas uma forma de melhorar o design dos artigos científicos e não têm impacto no entendimento dos conceitos químicos.
b ) Elas ajudam a entender a disposição dos átomos e as ligações em uma molécula, facilitando a compreensão de suas propriedades e reatividade.
c ) Elas são usadas para substituir a necessidade de realizar experimentos práticos e não contribuem para o conhecimento teórico.
d ) As representações químicas são importantes apenas para profissionais que manipulam compostos químicos e não são necessárias para o estudo básico da Química.
Resposta: Alternativa b.
11. Monte o quadro como o modelo a seguir, sintetizando os seus conhecimentos sobre ligações químicas.
| Tipo de ligação química | Iônica | Covalente | Metálica |
|---|---|---|---|
| Formação | |||
| Propriedades físico-químicas | |||
| Exemplos |
Resposta nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
11. Faça uma síntese sobre as ligações iônicas, covalentes e metálicas, mencionando a formação, as propriedades físico-químicas e exemplos delas.
Resposta: Iônica. Formação: geração de íons por transferência de elétrons. Propriedades: alta temperatura de fusão, solúvel em água e condutor de eletricidade em solução. Exemplos: N a C l, K B r e C a F subscrito 2. Covalente. Formação: compartilhamento de elétrons. Propriedades: baixa temperatura de ebulição, solubilidade variável e não é condutor de eletricidade. Exemplos: H subscrito 2 O (simples), O subscrito 2 (dupla) e H subscrito 2 (simples). Metálica. Formação: elétrons deslocalizados. Propriedades: alta condutividade elétrica, maleável e dúctil. Exemplos: F e, C u e A l.
12. O ácido acetilsalicílico abre parênteses C subscrito 9 H subscrito 8 O subscrito 4 fecha parênteses é um composto amplamente utilizado na medicina para aliviar a dor e reduzir a febre e as inflamações. A estrutura química desse composto inclui ligações entre átomos de carbono, hidrogênio e oxigênio. Essas ligações são responsáveis por diversas propriedades do composto, como sua estabilidade química e interação com outras moléculas no organismo.
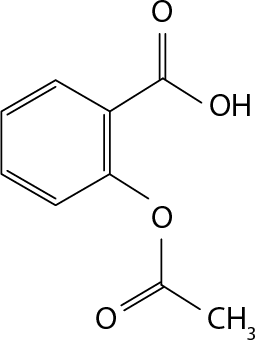
Analisando as informações anteriores, indique o tipo de ligação química que ocorre entre os átomos dessa substância. Justifique.
Resposta: Ligações covalentes, pois há compartilhamento de elétrons entre os ametais carbono, hidrogênio e oxigênio.
Página 122
CAPÍTULO7
As interações entre as moléculas
Você já viu alguma das situações como as apresentadas nas fotografias a seguir? Elas parecem muito estranhas, não é mesmo? Afinal, como pode um inseto caminhar sobre a água? E como a água se molda em torno do nadador?
Imagens desta página sem proporção e em cores fantasia.
Alfaiate (Gerris lacustris): pode atingir aproximadamente 10 milímetros de comprimento.

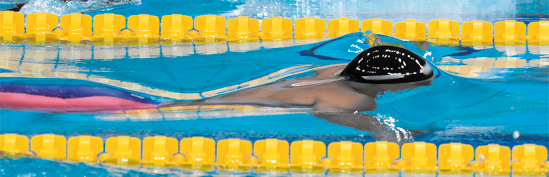
Se prestarmos atenção, vamos perceber que o inseto que toca na água está planando no líquido como se fosse uma cama elástica, pois suas pernas parecem afundar, mas sem romper a superfície.
O mesmo efeito ocorre com o nadador. Antes que a sua cabeça saia da água, conseguimos ver a formação de uma espécie de película.
Esse fenômeno observado na água é chamado de tensão superficial e se deve a interações fortes que acontecem entre as moléculas de H subscrito 2 O. Essas interações são denominadas forças intermoleculares.
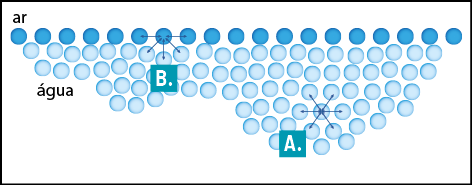
No interior do líquido, as moléculas de água interagem fortemente entre si. Como essas forças de atração ocorrem em todos os sentidos, elas se anulam (situação A). Já na superfície (situação B), como as moléculas não estão na parte exterior, elas sofrem uma maior força de atração no sentido do interior do líquido.
O efeito da força resultante é a redução da área superficial do líquido, que passa a se comportar como se fosse uma membrana elástica, com a tendência de se contrair ocupando a menor área possível.
Os primeiros estudos sobre as interações entre moléculas de líquidos foram registrados pelo cientista estadunidense Benjamin Franklin (1705-1790). Na época, Franklin investigou a repulsão entre água e óleo, mas o fenômeno de tensão superficial ainda não era conhecido, até que uma cientista, a italiana Agnes Pockels (1862-1935), descreveu a manipulação de filmes de óleo e detergentes sobre a superfície da água e mediu a tensão superficial de monocamadas de lipídios, sugerindo que se tratava de um fenômeno molecular. Em 1891, com auxílio do físico britânico Lord Rayleigh (1842-1919), ela publicou seu primeiro artigo na revista Nature.

Página 123
PRÁTICA CIENTÍFICA
A tensão superficial da água
Por dentro do contexto
A densidade é uma propriedade específica da matéria que ajuda a prever se um material vai flutuar ou afundar em relação a outro, quando misturados. No entanto, será que essa propriedade pode explicar todos os fenômenos de flutuação? Vamos realizar um experimento para entender melhor essa questão.
Materiais
- 1 recipiente largo, preferencialmente de plástico atóxico, contendo água potável
- agulha ou alfinetes de alumínio
- detergente de cozinha
Como proceder
A. Encha o recipiente com água e, cuidadosamente, disponha a agulha horizontalmente na água até que flutue.
Cuidado
Ao manipular a agulha, cuidado para não se machucar.
B. Lentamente, adicione gotas de detergente à água em torno da agulha, sem que caia diretamente em cima dela.
C. Verifique o que ocorre após a dissolução completa do detergente.
Análise
1. Sabendo que a densidade da água é inferior à do alumínio, como é possível explicar o fato de a agulha flutuar?
2. O que aconteceu após a dissolução do detergente?
Respostas nas Orientações para o professor.
As interações intermoleculares podem ser mais fracas ou mais fortes, dependendo principalmente de dois fatores: a geometria e a polaridade da molécula. Vamos começar pela geometria molecular.
Geometria molecular
Confira a seguir a estrutura molecular da água abre parênteses H subscrito 2 O fecha parênteses e a do dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses.
Professor, professora: Caso haja estudantes com dificuldade para enxergar, providencie modelos moleculares para utilizar durante o trabalho com a geometria molecular.
Imagens desta página sem proporção e em cores fantasia.

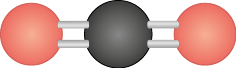
Ambas são compostas de três átomos, porém a organização espacial dos átomos (geometria molecular) é diferente. A molécula de água tem geometria angular, enquanto a do dióxido de carbono tem geometria linear. Essa diferença pode ser explicada pelo modelo de repulsão dos pares de elétrons da camada de valência (VSEPR, na sigla em inglês), desenvolvido pelo químico inglês Ronald James Gillespie (1924-2021) e pelo químico australiano Ronald Sydney Nyholm (1917-1971).
Segundo a teoria, os pares eletrônicos da camada de valência dos átomos repelem os demais pares, uma vez que todos têm cargas negativas. Portanto, os pares eletrônicos (ligantes e não ligantes) ficarão o máximo que puderem afastados uns dos outros.
Os pares de elétrons não ligantes do átomo de oxigênio da molécula de água afastam as ligações covalentes feitas com os átomos de hidrogênio abre parênteses H fecha parênteses, resultando na geometria angular. Na molécula de dióxido de carbono, não há pares eletrônicos não ligantes no átomo central, logo as ligações duplas se repelem, resultando na geometria linear.
Página 124
O quadro a seguir mostra os principais tipos de geometria molecular e alguns exemplos de molécula para cada geometria. A polaridade das moléculas, que será nosso próximo assunto, também é mostrada.
Imagens desta página sem proporção e em cores fantasia.
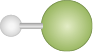
| Número de átomos ligados ao átomo central | Número de pares de elétrons não ligantes | Tipo de geometria | Polaridade | Fórmula química | Modelo molecular |
|---|---|---|---|---|---|
|
1 |
Irrelevante |
Linear |
Átomos iguais: apolar |
O subscrito 2 |
|
|
Átomos diferentes: polar |
H C l |
|
|||
|
2 |
0 |
Linear |
Átomos adjacentes iguais: apolar |
C O subscrito 2 |

|
|
Átomos adjacentes diferentes: polar |
H C N |
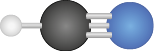
|
|||
|
2 |
2 |
Angular |
Polar |
H subscrito 2 O |
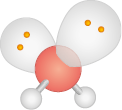
|
|
3 |
0 |
Trigonal |
Átomos adjacentes iguais: apolar |
B F subscrito 3 |
|
|
Átomos adjacentes diferentes: polar |
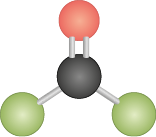
C O C l subscrito 2 |
|
|||
|
3 |
1 |
Piramidal |
Polar |
N H subscrito 3 |

|
|
4 |
0 |
Tetraédrica |
Átomos adjacentes iguais: apolar |
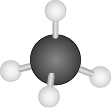
C H subscrito 4 |
|
|
Átomos adjacentes diferentes: polar |
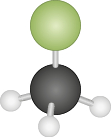
C H subscrito 3 C l |
|
Dica
Acesse o simulador de Geometria molecular, disponível em: https://s.livro.pro/eawr83. Acesso em: 19 ago. 2024.
Esse simulador possibilita que você monte diferentes estruturas moleculares, variando os tipos de ligação química e os pares de elétrons.
Página 125
CONEXÕES com ... MATEMÁTICA
Geometria molecular, figuras geométricas e ângulos
Você provavelmente notou que algumas geometrias assumidas pelas moléculas se assemelham a figuras geométricas. Considere que esses arranjos moleculares sejam simétricos, pois o átomo central não tem pares de elétrons não ligantes, e formados por dois elementos A e B, em que n átomos de B ficam em volta do átomo central A, seguindo a fórmula A B subscrito n vírgula em que n é maior do que 1. Essa associação é possível porque as moléculas, por mais que sejam representadas no plano do papel, são objetos tridimensionais. Compreender essas figuras nos ajuda a determinar o ângulo entre as ligações dos átomos, também chamado de ângulo de ligação.
Imagens desta página sem proporção e em cores fantasia.
As moléculas de fórmula A B subscrito 2 também assumem a geometria linear abre parênteses 180 graus fecha parênteses. Exemplos: dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses e cloreto de berílio abre parênteses B e C l subscrito 2 fecha parênteses.

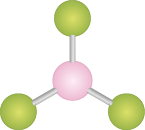
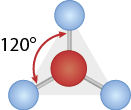
Quando analisamos moléculas de fórmula A B subscrito 3, notamos que seu formato se assemelha ao de um triângulo equilátero, em que o elemento B fica nos vértices e o elemento A fica no centro. Os ângulos internos das ligações são 120 graus. Exemplo: trifluoreto de boro abre parênteses B F subscrito 3 fecha parênteses.
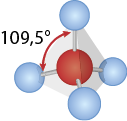
O formato de pirâmide triangular também é observado nas moléculas de fórmula A B subscrito 4 cuja geometria é a tetraédrica. O elemento B fica nos vértices e o elemento A fica no centro da pirâmide. Os ângulos de ligações medem 109 vírgula 5 graus. Exemplo: tetracloreto de carbono abre parênteses C C l subscrito 4 fecha parênteses.
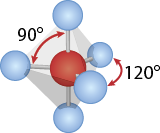
A fórmula A B subscrito 5 gera a geometria bipirâmide trigonal, e este arranjo minimiza a repulsão dos elétrons dos 5 átomos de B. É como dois tetraedros ligados, com uma mesma base triangular. Nesse plano, o ângulo de ligação dos átomos mede 120 graus. E o ângulo de ligação entre os átomos do plano e os que não estão no plano mede 90 graus. O elemento A está no centro do poliedro. Exemplo: pentacloreto de fósforo abre parênteses P C l subscrito 5 fecha parênteses.
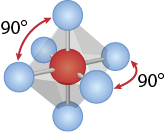
O arranjo mais estável para moléculas de fórmula A B subscrito 6 é a geometria octaédrica. O arranjo octaédrico é como duas pirâmides quadrangulares ligadas como uma base quadrada em comum. Todos os ângulos entre ligações são de 90 graus. Exemplo: hexafluoreto de enxofre abre parênteses S F subscrito 6 fecha parênteses.
Imagens elaboradas com base em: BROWN, Theodore L. et al. Química: a ciência central. Tradução: Eloiza Lopes, Tiago Jonas e Sonia Midori Yamamoto. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 363.
Embora essas sejam as geometrias moleculares mais comuns, há muitas outras se considerarmos os pares de elétrons não ligantes. Em todos os casos, sempre será possível associar a disposição dos átomos e dos pares de elétrons em torno do átomo central com o formato de uma figura tridimensional. Caso tenha pares de elétrons não ligantes, os ângulos de ligações variam, pois dependem da energia de repulsão, do elemento químico etc.
Esses conceitos podem ser extrapolados para a compreensão de fenômenos de outras áreas de estudo: Cristalografia, síntese de fármacos na Farmácia etc.
a ) Qual das seguintes moléculas tem uma geometria molecular que se assemelha a um triângulo: tioformaldeído abre parênteses C H subscrito 2 S fecha parênteses, amônia abre parênteses N H subscrito 3 fecha parênteses ou cloreto de cianogênio abre parênteses C N C l fecha parênteses?
Resposta: C H subscrito 2 S, pois o átomo central é o carbono, que está ligado por uma ligação dupla ao enxofre e por ligações simples aos átomos de hidrogênio.
Página 126
Polaridade
Imagens desta página sem proporção e em cores fantasia.
Professor, professora: Explique aos estudantes que há diferença entre a polaridade de uma ligação química e a da molécula como um todo. É possível que a ligação seja polar e a molécula seja apolar.
O segundo conceito que vamos estudar para entendermos as interações intermoleculares é o de polaridade, que está relacionado à diferença de eletronegatividade dos átomos e à geometria da molécula.
Como mencionado anteriormente, a eletronegatividade é a medida da capacidade que determinado átomo tem de atrair elétrons para seu núcleo. Quanto mais eletronegativo for um átomo, maior será essa capacidade. Em uma ligação covalente, o átomo mais eletronegativo atrairá para si os elétrons da ligação de maneira mais eficaz do que o outro átomo. Dizemos que o primeiro terá maior carga parcial negativa (simbolizada por delta elevado a início expoente, menos, fim expoente) e que o segundo terá maior carga parcial positiva (simbolizada por delta elevado a início expoente, mais, fim expoente).
A ligação covalente pode ser entendida como a formação de uma nuvem eletrônica entre os dois átomos, ou seja, uma região com maior probabilidade de encontrarmos os elétrons, e ela será deslocada para o lado do átomo com carga parcial negativa e estará mais distante do átomo com carga parcial positiva. Por haver essa diferença na distribuição de elétrons, dizemos que a ligação é polar ou que está polarizada.
Observe a molécula de água a seguir. Como o átomo de oxigênio é mais eletronegativo do que os de hidrogênio, ele adquire uma carga parcial negativa. Sabendo que a nuvem eletrônica se concentra nele, indicamos o deslocamento por meio de duas setas pretas, chamadas de momento de dipolo. Como a água tem geometria angular, há um vetor resultante do momento de dipolo, indicado pela seta vermelha para cima, tornando a molécula toda polar.
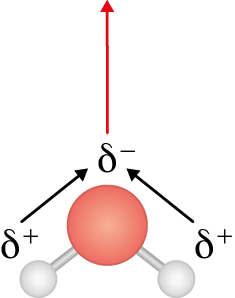
Vamos verificar agora a molécula de dióxido de carbono. Ela também é formada por ligações covalentes polares, em que a concentração de elétrons é maior nos átomos de oxigênio, por serem mais eletronegativos. No entanto, como a molécula tem geometria linear, o vetor resultante do momento de dipolo é nulo, pois os átomos atraem os elétrons em igual intensidade, mas em sentidos opostos. Como resultado, temos uma molécula apolar.
Professor, professora: ao abordar o vetor resultante na molécula de H subscrito 2 O, incentive o estudante a imaginar como o átomo de oxigênio se moveria se cada um entre dois estudantes puxasse este átomo na direção das setas pretas, conduzindo-o a compreender de forma sensorial como o vetor resultante de dipolo se forma. O mesmo vale para o exemplo do C O subscrito 2.
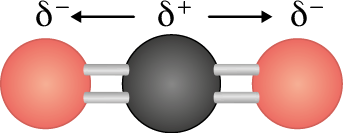
Portanto, para descobrirmos qual é a polaridade de uma molécula, precisamos saber qual é sua geometria. O quadro Exemplos de geometria molecular, da página 124, pode auxiliar nesse processo. Para as geometrias lineares, trigonais e tetraédricas, se os átomos adjacentes ao átomo central forem iguais entre si, os vetores se anularão e a molécula será apolar; caso contrário, será polar. Para as geometrias angular e piramidal, a molécula sempre será polar, pois os momentos de dipolo não se anulam.
1. Qual é a polaridade de uma molécula formada apenas por dois átomos iguais? Justifique sua resposta.
Resposta: A molécula será apolar, pois ambos os átomos têm a mesma eletronegatividade.
2. Como é a polaridade de ligações iônicas e metálicas?
Resposta: Na iônica, há total transferência de elétron de um átomo para o outro. Logo, o momento de dipolo apontará para o átomo que recebeu os elétrons (que está com carga negativa). Na metálica, os elétrons estão distribuídos de forma homogênea entre os núcleos, formando ligações apolares.
Página 127
ATIVIDADES
1. Analise o experimento que foi realizado na sala de aula.
I ) A professora pingou gotas de corante alimentício no leite.

a ) O que aconteceu com as gotas de corante?
Resposta: As gotas de corante ficaram concentradas no centro do recipiente com leite.
b ) Por que isso aconteceu?
II ) Em seguida, a professora adicionou um pouco de detergente sobre as gotas de corante.

Resposta: Isso ocorreu pois o corante aquoso apresenta tensão superficial, impedindo que as moléculas de água se distribuam por todo o leite.
c ) O que aconteceu com as gotas de corante?
Resposta: As gotas de corante espalharam-se.
d ) Por que isso aconteceu?
Resposta: Isso ocorreu pois o detergente rompeu a tensão superficial da água com corante, permitindo que ela se distribuísse por todo o leite.
2. Confira o quadro de substâncias e o de geometrias moleculares a seguir e responda às questões propostas.
QUADRO I
Substância
A. C H subscrito 4
B. S O subscrito 2
C. B F subscrito 3
D. H C l
E. N H subscrito 3
QUADRO II
Geometria molecular
1. Piramidal
2. Linear
3. Trigonal plana
4. Tetraédrica
5. Angular
a ) Associe corretamente as moléculas do quadro I com sua respectiva geometria molecular do quadro II, escrevendo em seu caderno a letra e o número correspondentes.
Resposta: A – 4; B – 5; C – 3; D – 2; E – 1.
b ) Classifique as moléculas do quadro I em polares ou apolares.
Resposta: C H subscrito 4 - apolar; S O subscrito 2 - polar; B F subscrito 3 - apolar; H C l - polar; N H subscrito 3 - polar.
c ) Quais moléculas seriam solúveis em água? Justifique sua resposta.
Resposta: S O subscrito 2, H C l e N H subscrito 3, pois estas moléculas, assim como as de água, são polares.
d ) Quais dessas moléculas têm par de elétrons não ligantes?
Resposta: S O subscrito 2, H C l e N H subscrito 3.
3. Classifique as substâncias a seguir como polar ou apolar.
a ) O subscrito 2
Resposta: Apolar.
b ) H F
Resposta: Polar.
c ) C O subscrito 2
Resposta: Apolar.
d ) N O
Resposta: Polar.
e ) B e C l subscrito 2
Resposta: Apolar.
f ) H subscrito 2 O
Resposta: Polar.
4. Considerando a molécula de amônia abre parênteses N H subscrito 3 fecha parênteses, analise as afirmações a seguir.
I ) Apresenta geometria tetraédrica.
II ) Seu átomo central apresenta um par de elétrons não ligantes e ligações covalentes polares.
III ) A sua geometria molecular é semelhante à geometria da água.
IV ) É uma molécula polar e espera-se que, em condições adequadas, possa se dissolver em solventes polares.
Considerando V como afirmação verdadeira e F como falsa, a sequência correta é:
a ) F – F – F – V.
b ) F – V – V – V.
c ) V – V – F – V.
d ) F – V – F – V.
e ) V – V – V – V.
Resposta: Alternativa d.
5. Identifique a alternativa que apresenta somente substâncias polares.
a ) H subscrito 2 O e C l subscrito 2
b ) C l subscrito 2 e C C l subscrito 4
c ) C C l subscrito 4 e C H subscrito 4
d ) C H subscrito 4 e H subscrito 2 O
e ) H subscrito 2 O e C H C l subscrito 3
Resposta: Alternativa e.
Página 128
Interações ou forças intermoleculares
Na situação a seguir, duas substâncias foram deixadas em repouso durante certo período.
A.

B.

3. O que aconteceu na situação? Como você explicaria o que ocorreu?
Resposta pessoal. O objetivo desta questão é levar os estudantes a comentar que o álcool evaporou mais rapidamente do que a água.
Duas moléculas de substâncias iguais ou diferentes podem interagir de formas distintas envolvendo diversos tipos de interações intermoleculares. Essas interações são muito mais fracas que as ligações químicas. No início do capítulo, vimos que duas moléculas de água interagem entre si por meio de um tipo de interação intermolecular denominada ligação de hidrogênio. A seguir, exploraremos outros tipos de interações intermoleculares.
De acordo com relatos históricos científicos, as interações intermoleculares começaram a ser estudadas em 1873 pelo físico holandês Johannes Diderik van der Waals (1837-1923). Em sua homenagem, elas foram denominadas interações de Van der Waals.
A situação anterior envolvendo a água e o álcool evidencia que, mesmo sendo substâncias polares, as interações intermoleculares do álcool são mais fracas que as da água, por isso ele evaporou mais rápido.
As moléculas também podem interagir com as de outra substância, de polaridade semelhante ou diferente. Essas interações resultam na formação de misturas homogêneas ou heterogêneas.
Por exemplo, o óleo vegetal que pode ser extraído de grãos como soja, canola e milho é uma mistura homogênea de compostos apolares. Se for adicionada água no óleo, haverá separação de fases, formando uma mistura heterogênea. Isso acontece porque a água é polar e o óleo é apolar.
Há diferentes tipos de interações intermoleculares, a depender da polaridade das moléculas. Quanto mais polar for uma molécula, mais forte será essa interação, pois as cargas parciais negativas e positivas da molécula exercerão maior influência nas moléculas vizinhas. Confira a seguir alguns tipos de interações moleculares, em ordem de força crescente.
1º. Dipolo induzido-dipolo induzido.
2º. Dipolo permanente-dipolo permanente.
3º. Ligação de hidrogênio.
4º. Íon-dipolo.
4. Podemos falar sobre interações intermoleculares para compostos formados por ligações metálicas? Justifique sua resposta.
Resposta: Não, pois esses compostos não formam moléculas. As interações predominantes são as interatômicas.
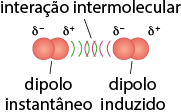
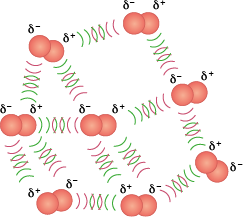
Dipolo induzido-dipolo induzido
Como vimos, uma molécula apolar tem vetor resultante de momento de dipolo igual a zero. No entanto, movimentos aleatórios dos elétrons nas ligações podem deixar a molécula temporariamente polarizada, formando um dipolo instantâneo. Quando isso acontece, o dipolo instantâneo causa um dipolo induzido na molécula que estiver próximo, e o efeito se espalha para todo o sistema.
Página 129
Esse tipo de interação intermolecular é fraco, uma vez que os dipolos das moléculas são apenas temporários. Por esta razão, as temperaturas de ebulição e de fusão de moléculas apolares são em geral muito baixas, e o estado físico da maioria desses compostos é gasoso à temperatura ambiente abre parênteses 25 graus Celsius fecha parênteses, com exceção de moléculas orgânicas muito grandes, que são líquidas e têm maiores temperaturas de fusão e de ebulição. O propano abre parênteses C subscrito 3 H subscrito 8 fecha parênteses, por exemplo, principal componente do gás liquefeito de petróleo (GLP), é gasoso à temperatura ambiente abre parênteses 25 graus Celsius fecha parênteses. Já o octano abre parênteses C subscrito 8 H subscrito 18 fecha parênteses, principal componente da gasolina, é líquido.
Dica
Em geral, quanto maiores o tamanho e a massa molecular de uma molécula, maiores serão suas temperaturas de fusão e de ebulição, pois há uma região maior de contato entre moléculas e mais possibilidade de interações intermoleculares.
Imagens desta página sem proporção e em cores fantasia.
Confira o efeito da interação intermolecular dipolo induzido-dipolo induzido com a molécula de oxigênio no exemplo a seguir.
A.

B.
C.
Antes de serem formalmente estudadas e explicadas pela ciência, as interações intermoleculares já eram exploradas por comunidades tradicionais. Um exemplo disso pode ser percebido na extração do óleo de coco em comunidades quilombolas. Esse e outros conhecimentos dessas comunidades são transmitidos de forma oral por seus membros.
Nas comunidades quilombolas, a preservação dessas práticas é desempenhada pelos griôs, que são os membros da comunidade reconhecidos como guardiões dos saberes tradicionais e das tradições ancestrais. Eles aprendem com os mais velhos e ensinam os mais jovens, funcionando como um elo entre os saberes do passado e do futuro. Graças ao trabalho dos griôs, práticas e técnicas antigas, como a extração do óleo de coco, continuam sendo transmitidas até hoje.
Para extrair o óleo de coco, os quilombolas seguem um processo cuidadoso e artesanal. Primeiro, os cocos são colhidos e triturados para facilitar o acesso à polpa, a qual passa pelo processo de secagem ao sol e depois é cozida em água, um método que permite que o óleo de coco vá para a superfície e seja separado da água com utensílios simples, como colheres ou conchas.
Por muito tempo, práticas como essas e as características da cultura e do modo de vida das comunidades quilombolas não foram amplamente reconhecidas ou documentadas em pesquisas oficiais. Somente no Censo de 2022 realizado pelo Instituto Brasileiro de Geografia e Estatística (IBGE) foi feita uma investigação mais detalhada sobre a população quilombola, revelando que há cerca de 1,3 milhão de pessoas que pertencem a essas comunidades no Brasil.
5. Por que óleo e água não se misturam?
Resposta: Porque o óleo é uma substância apolar, enquanto a água é polar.
6. Qual propriedade explica o fato de o óleo de coco flutuar sobre a água?
Resposta: Densidade.
7. Pesquise outros saberes tradicionais das comunidades quilombolas do Brasil.
Resposta pessoal. Espera-se que os estudantes encontrem, por meio da pesquisa, diversos saberes tradicionais quilombolas, como técnicas agrícolas, práticas de medicina tradicional e práticas de preservação da história oral.
Página 130
Dipolo permanente-dipolo permanente
As interações do tipo dipolo permanente-dipolo permanente ou dipolo-dipolo ocorrem entre moléculas polares, que não apresentam distribuição uniforme de suas cargas. Essa distribuição assimétrica de cargas é responsável pela formação de dipolos elétricos permanentes, o que faz surgir atração eletrostática permanente entre os dipolos elétricos de moléculas polares com outras abre parênteses delta elevado a início expoente, mais, fim expoente seta com duas pontas, uma para a esquerda e outra para a direita delta elevado a início expoente, menos, fim expoente fecha parênteses. Nesse caso, o átomo mais eletronegativo de uma molécula é atraído pelo átomo menos eletronegativo de outra, bem parecido com a interação de tipo dipolo induzido-dipolo induzido. Analise o exemplo do ácido clorídrico abre parênteses H C l fecha parênteses a seguir.
Imagens desta página sem proporção e em cores fantasia.

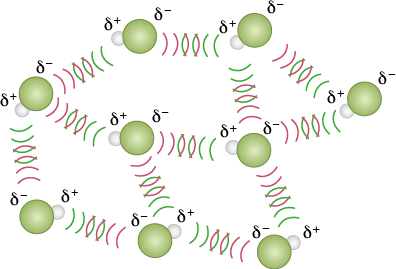
A interação dipolo permanente-dipolo permanente tem intensidade média, com exceção de alguns casos especiais que vamos ver no tópico Ligações de hidrogênio. Por conta disso, as temperaturas de fusão e de ebulição de moléculas que fazem esse tipo de interação são levemente maiores do que as das moléculas apolares, e a maior parte se encontra no estado gasoso em temperatura ambiente abre parênteses 25 graus Celsius fecha parênteses, como é o caso do ácido clorídrico, do dióxido de enxofre abre parênteses S O subscrito 2 fecha parênteses e do monóxido de carbono abre parênteses C O fecha parênteses. Quanto mais polar e/ou maior for o tamanho e a massa molecular da molécula, maiores serão as temperaturas de fusão e de ebulição, como no exemplo a seguir, em que a quantidade de átomos eletronegativos (átomos de cloro) e a massa das moléculas aumentam.
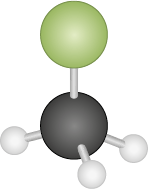
O clorometano abre parênteses C H subscrito 3 C l fecha parênteses tem um átomo de cloro e temperatura de ebulição igual a menos 24 graus Celsius, sendo gasoso à temperatura ambiente.
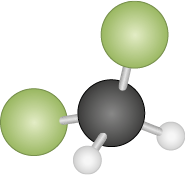
O diclorometano abre parênteses C H subscrito 2 C l subscrito 2 fecha parênteses tem dois átomos de cloro, é mais polar e tem temperatura de ebulição igual a 40 graus Celsius, sendo líquido à temperatura ambiente.
O triclorometano abre parênteses C H C l subscrito 3 fecha parênteses tem três átomos de cloro, é líquido à temperatura ambiente, mas é ainda mais polar e tem temperatura de ebulição igual a 61 graus Celsius.
Íon-dipolo
A interação intermolecular mais forte é aquela que se estabelece entre um íon e uma molécula polar. Os cátions interagem com a extremidade negativa de um dipolo, e os ânions, com a extremidade positiva. A interação pode aumentar com a elevação da carga iônica e/ou magnitude do momento dipolar. E a distância entre o íon e o dipolo também influencia: se estiverem mais próximos, mais forte será a atração.
Página 131
Essa interação explica, por exemplo, a solvatação dos compostos iônicos em água. Confira a seguir os íons do cloreto de sódio abre parênteses N aC l fecha parênteses solvatados pela água.
Imagens desta página sem proporção e em cores fantasia.
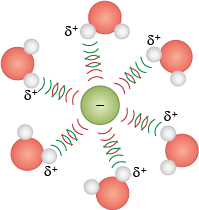
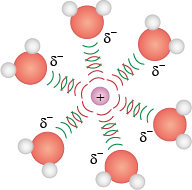
Professor, professora: Explique que todas as interações intermoleculares têm, em maior ou menor grau, semelhança com a força de uma ligação química. Além disso, diga que a ligação de hidrogênio tem esse nome porque se aproxima de uma ligação covalente por meio da interação de um átomo muito eletronegativo com hidrogênios vizinhos (pouco eletronegativos).
Ligações de hidrogênio
As ligações de hidrogênio são interações intermoleculares de alta intensidade e ocorrem entre moléculas que têm átomos de hidrogênio ligado ao flúor abre parênteses F fecha parênteses, ao oxigênio abre parênteses O fecha parênteses, ao nitrogênio N ou a qualquer outro átomo bastante eletronegativo.
As interações intermoleculares entre duas moléculas de água são um exemplo de ligação de hidrogênio. Sua polaridade é tão grande que interage fortemente com as moléculas ao redor.
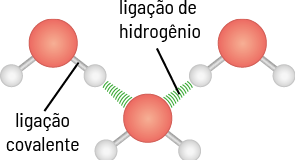
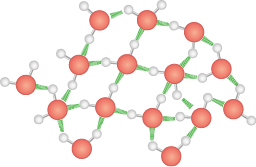
Como essa atração é muito intensa, a energia necessária para rompê-la é alta, logo essas substâncias têm elevadas temperaturas de fusão e de ebulição, exceto o fluoreto de hidrogênio e a amônia, com temperaturas de ebulição iguais a 19 vírgula 5 graus Celsius e menos 33 graus Celsius, respectivamente.
No começo deste capítulo, vimos que alguns insetos conseguem "caminhar" sobre a água. Isso é possível por causa das ligações de hidrogênio entre as moléculas de água, que são fortes o bastante para mantê-las próximas e criar uma forte tensão superficial na água, permitindo que esses insetos se locomovam pela superfície. Se a água fosse agitada ou um composto tensoativo fosse adicionado a ela, essa tensão se romperia.

Dica
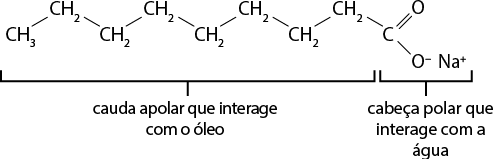
Os tensoativos, presentes no detergente e no sabão, podem alterar as propriedades de superfície das soluções aquosas, pois diminuem as interações entre as moléculas. A estrutura molecular desses compostos contém uma cauda apolar que interage com óleos e gorduras (apolares) e uma cabeça polar que interage com a água.
Página 132
LIGADO NO TEMA
Materiais hidrofóbicos e a segurança no trânsito
Você conhece aplicações da Química em diversas áreas do nosso cotidiano, como é o caso da fabricação de cosméticos e de produtos para tratamento de água e de esgoto. A Química também está presente em situações menos evidentes, como na segurança do trânsito.
Ao atravessar a rua a pé, você já está fazendo parte do trânsito porque exerce o papel de pedestre, e assim tem direitos e obrigações, como atravessar na faixa de pedestres. Os motoristas também têm o seu papel, como respeitar limites de velocidade e não ultrapassar em lugares inapropriados. Tais cuidados devem ser tomados diariamente, especialmente em dias de chuva porque ela pode trazer problemas como a redução da visibilidade de pedestres e de motoristas e a diminuição do atrito entre o veículo e a pista, o que aumenta a distância de frenagem. Por isso, é importante ter atenção extra em dias chuvosos. Veja no cartaz a seguir alguns cuidados destacados aos condutores.

A Química tem ajudado a solucionar algumas questões nesse âmbito. Os airbags, por exemplo, podem amortecer impactos em caso de uma colisão, pois nesses dispositivos ocorre uma reação química que forma um gás, que infla uma espécie de bolsa de ar, evitando ferimentos mais graves.
Em dias de chuva intensa, a visibilidade dos motoristas pode ser afetada pelo acúmulo de água na superfície do para-brisa. Há pesquisas que indicam que 20% dos acidentes de carro no mundo podem estar ligados a condições meteorológicas desfavoráveis.
Atualmente, há produtos no mercado que oferecem uma solução para esse problema: os cristalizadores de vidro. Eles são produtos hidrofóbicos, ou seja, que não apresentam afinidade com as moléculas de água devido à diferença de polaridade entre os compostos presentes no cristalizador e a água. Os tensoativos também são compostos que podem executar esse papel, pois são apolares em sua maioria.
Página 133
Quando a água da chuva entra em contato com o para-brisa externo protegido pelo cristalizador, a aderência dessas moléculas é significativamente diminuída, reduzindo o acúmulo de água sobre a superfície do vidro.
Imagens desta página sem proporção e em cores fantasia.

Confira a seguir como a gota de água no vidro pode atrapalhar a passagem da luz.
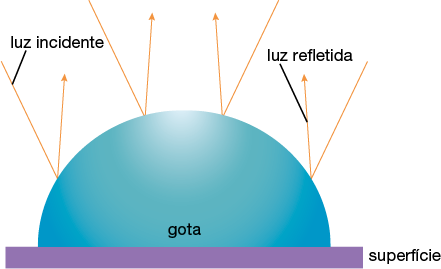
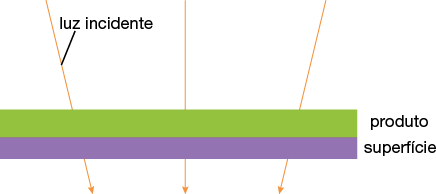
Imagens elaboradas com base em: WAHAB, Izzati Fatiamah et al. Fundamentals of antifogging strategies, coating techniques and properties of inorganic materials; a comprehensive review. Journal of Materials Research and Technology, v. 23, p. 687-714, mar./abr. 2023.
Outro problema que pode acontecer na parte interna é o embaçamento do para-brisa dos carros e da viseira do capacete dos motociclistas. Ele pode ser resolvido com produtos chamados antiembaçantes, ou seja, que evitam o embaçamento do vidro, pois o produto tem compostos apolares em sua composição, e confere uma camada hidrofóbica que impede que o vapor de água se condense no para-brisa interno, o que poderia gerar problemas na visibilidade do motorista.
a ) Qual é a relação entre os cristalizadores e a frase "semelhante dissolve semelhante"?
Resposta: Os cristalizadores têm polaridade diferente da polaridade da molécula da água, o que dificulta sua interação com ela. Isso resulta em menor aderência da água na superfície do vidro.
Página 134
ATIVIDADES
1. Escreva o tipo de interação intermolecular presente em sistemas puros de cada uma das substâncias a seguir: C H subscrito 4 (geometria tetraédrica), S O subscrito 2 (geometria angular), B F subscrito 3 (geometria trigonal plana), H C l (geometria linear) e N H subscrito 3 (geometria piramidal).
Resposta: C H subscrito 4 - dipolo induzido-dipolo induzido; S O subscrito 2 - dipolo permanente-dipolo permanente; B F subscrito 3 - dipolo induzido-dipolo induzido; H C l - dipolo permanente-dipolo permanente; N H subscrito 3 - ligações de hidrogênio.
2. O etanol abre parênteses C H subscrito 3 C H subscrito 2 O H fecha parênteses é um combustível muito utilizado em automóveis. No processo de combustão, ele reage com o gás oxigênio abre parênteses O subscrito 2 fecha parênteses e forma o dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses e a água abre parênteses H subscrito 2 O fecha parênteses.
a ) Analise as afirmações a seguir, sobre as substâncias envolvidas nessa reação química, e identifique as alternativas corretas e incorretas, corrigindo as afirmativas incorretas.
I ) Todas as substâncias são compostas.
II ) As moléculas de O subscrito 2 e C O subscrito 2 apresentam a mesma geometria molecular.
III ) O subscrito 2 e C subscrito 2 H subscrito 6 O são moléculas polares.
IV ) Moléculas de H subscrito 2 O apresentam interações do tipo ligações de hidrogênio.
V ) A temperatura de ebulição do dióxido de carbono é maior do que a da água abre parênteses H subscrito 2 O fecha parênteses por causa da presença de interações do tipo dipolo induzido-dipolo induzido.
Resposta: I) Incorreta. O gás oxigênio é uma substância simples. II) Correta. III) Incorreta. O oxigênio é apolar. IV) Correta. V) Incorreta. A temperatura de ebulição do dióxido de carbono é menor do que a da água.
b ) Considerando que a queima do etanol libera dióxido de carbono para a atmosfera, ainda assim esse combustível é menos prejudicial ao meio ambiente do que a gasolina. Explique por quê.
Resposta: Espera-se que os estudantes comentem que a gasolina é um combustível fóssil, não renovável e não sustentável. Complemente informando que na sua composição pode haver compostos com enxofre, o que resulta na produção de mais substâncias tóxicas e poluentes.
3. Com os conhecimentos científicos referentes à distribuição eletrônica, foi possível fazer previsões sobre a geometria de uma molécula e de sua polaridade. A respeito desse assunto, identifique a alternativa correta.
a ) Uma substância polar é o solvente ideal para compostos apolares.
b ) As moléculas assimétricas tendem a ser apolares.
c ) Moléculas polares tendem a apresentar interações intermoleculares do tipo dipolo induzido-dipolo induzido.
d ) A molécula de gás carbônico apresenta ligações covalentes polares e geometria linear e é uma substância apolar.
e ) A água é uma molécula apolar que apresenta interações intermoleculares do tipo ligações de hidrogênio.
Resposta: Alternativa d.
4. Veja a representação do teste de determinação do etanol na gasolina.
Imagens desta página sem proporção e em cores fantasia.
1.

2.

3.
4.

Explique o funcionamento desse teste, informando que tipos de interações intermoleculares ocorrem.
5. Os compostos polares como o ácido fluorídrico abre parênteses H F fecha parênteses, amônia abre parênteses N H subscrito 3 fecha parênteses e água abre parênteses H subscrito 2 O fecha parênteses apresentam elevadas temperaturas de fusão e de ebulição se forem comparadas com compostos apolares.
a ) Quais tipos de interações intermoleculares estão presentes em sistemas puros de cada um desses compostos polares? Justifique sua resposta.
b ) Sabendo que a eletronegatividade aumenta da esquerda para a direita na tabela periódica e considerando apenas este fator, em qual deles espera-se haver interações intermoleculares mais fortes?
Respostas das questões 4 e 5 nas Orientações para o professor.
Página 135
6. Observe a tabela a seguir.
| Substância | Fórmula química | Fórmula estrutural | Temperatura de ebulição abre parênteses grau Celsius fecha parênteses |
|---|---|---|---|
|
Acetona |
C subscrito 3 H subscrito 6 O |
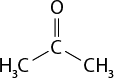
|
56,08 |
|
Água |
H subscrito 2 O |
|
100 |
|
Etanol |
C subscrito 2 H subscrito 6 O |
|
78,24 |
Fonte de pesquisa: HAYNES, William M. (ed.). CRC Handbook of Chemistry and Physics. 97. ed. Oakville: CRC Press LLC, 2017.
a ) Qual é a polaridade de cada substância?
b ) Qual é o tipo de interação intermolecular mais intensa em cada substância?
c ) Por que a molécula de água apresenta a maior temperatura de ebulição?
d ) Quais dessas substâncias poderiam ser dissolvidas em óleo? Justifique sua resposta.
Respostas nas Orientações para o professor.
7. As fórmulas estruturais dos compostos etano, etanol e etilamina estão representadas a seguir.


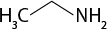
Com base nos conhecimentos adquiridos, verifica-se que, dos três compostos, é possível dissolver em água:
a ) apenas o etano.
b ) apenas o etanol.
c ) o etano e o etanol.
d ) o etanol e a etilamina.
e ) apenas a etilamina.
Resposta: Alternativa d.
8. Note que na fotografia há gotas de água na superfície da folha de uma planta. A folha apresentada é da planta aquática lótus, que tem folhas largas e altamente hidrofóbicas, e serve de inspiração para criação de novos produtos autolimpantes.

a ) Correlacione seus conhecimentos sobre interações intermoleculares com as gotas de água mostradas na fotografia.
Resposta: A formação de gotas é característica de substâncias com alta tensão superficial, decorrente das ligações de hidrogênio.
b ) Como funciona essa capacidade autolimpante do lótus? E como pode ser relacionado com interações intermoleculares? Faça pesquisa em fontes confiáveis para complementar a resposta.
Resposta: A folha é autolimpante porque apresenta compostos apolares em sua superfície.
9. As moléculas podem ser classificadas em apolares ou polares. Essa classificação está relacionada à polaridade das ligações e à geometria da molécula. Estudando as moléculas dos gases nitrogênio abre parênteses N subscrito 2 fecha parênteses, dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses e monóxido de carbono abre parênteses CO fecha parênteses, qual delas pode ser classificada como polar? Justifique sua resposta.
Resposta: Entre as moléculas apresentadas, somente o C O é polar, visto que o vetor resultante do momento de dipolo é diferente de zero.
10. Indique o tipo de geometria referente ao número de pares de elétrons ligantes e pares de elétrons não ligantes no átomo central e considerando que os elétrons ligantes formam apenas ligações simples.
a ) 2 pares de elétrons ligantes e 2 pares de elétrons não ligantes.
Resposta: Geometria angular.
b ) 3 pares de elétrons ligantes e 1 par de elétrons não ligantes.
Resposta: Geometria piramidal.
11. Analise as informações do tetraclorometano abre parênteses C C l subscrito 4 fecha parênteses e metano abre parênteses C H subscrito 4 fecha parênteses na tabela quando estão ao nível do mar e responda às questões.
| Substância | T subscrito e abre parênteses grau Celsius fecha parênteses | M M abre parênteses u fecha parênteses |
|---|---|---|
|
C C l subscrito 4 |
76,7 |
154 |
|
C H subscrito 4 |
menos 161 vírgula 5 |
16 |
Fonte de pesquisa: HAYNES, William. M. (ed.). CRC Handbook of Chemistry and Physics. 97 ed. Oakville: CRC Press LLC, 2017.
a ) Qual é o tipo de interação que essas moléculas fazem?
Resposta: Dipolo induzido-dipolo induzido.
b ) Qual molécula apresenta maior polaridade em suas ligações?
Resposta: Tetraclorometano.
Página 136
12. Leia o trecho de reportagem a seguir.
Entenda para que serve o cleansing oil
[…] É um produto a base de óleo que serve para tirar a maquiagem e outras impurezas da pele. Esse tipo de demaquilante faz há muito tempo parte da rotina de beleza das mulheres asiáticas, principalmente as japonesas e coreanas. O óleo "derrete" tudo o que é à base de óleo e que gruda em nossa pele e é especialmente interessante para tirar maquiagens mais pesadas ou à prova d'água.
[…]
A dermatologista Karla Lessa alerta que é preciso usar com parcimônia. Para evitar a obstrução dos poros e, consequentemente, o surgimento de cravos e espinhas", afirma.
[…]
EIRAS, Natália. Entenda para que serve o cleansing oil. Folha de Londrina, ed. 21.952, ano 71, 19 out. 2020. p. 17.
a ) Explique por que o cleansing oil é eficaz para remover maquiagens mais pesadas ou à prova d'água. Considere que maquiagens são produzidas com ceras (compostos altamente apolares) e pigmentos apolares.
Resposta: Porque sua polaridade é semelhante à dos compostos da maquiagem, que são apolares, gerando melhor solubilização.
b ) Qual é a diferença de características químicas entre um sabonete comum e um cleansing oil?
Resposta: O sabonete é constituído geralmente por surfactante, ou seja, uma molécula com características anfifílicas, que tem uma parte polar e outra apolar; já o óleo de limpeza é completamente apolar.
c ) Explique por que o cleansing oil pode aumentar o surgimento de cravos e espinhas na pele.
Resposta: O cleansing oil pode permanecer na pele e formar uma película oleosa, obstruindo os poros e levando à formação de cravos e espinhas.
13. O consumo adequado de vitaminas faz parte de uma dieta balanceada e saudável. Elas estão presentes em alimentos como frutas, verduras e cereais. As vitaminas podem ser lipossolúveis ou hidrossolúveis, fator que determina sua absorção pelo organismo.
Confira a seguir a estrutura de algumas vitaminas.
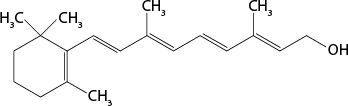
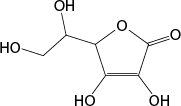
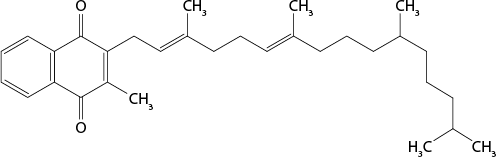
a ) Qual(is) vitamina(s) pode(m) ser classificada(s) como hidrossolúvel(is)? Justifique sua resposta.
Resposta: Vitamina C, pois é uma molécula pequena e contém diversos átomos de oxigênio que podem fazer ligações de hidrogênio com a água.
b ) Qual(is) vitamina(s) pode(m) ser classificada(s) como lipossolúvel(is)? Justifique.
Resposta: Vitaminas A e K1, dado que têm longas cadeias apolares.
c ) Quais estratégias podem ser adotadas na alimentação para promover uma maior absorção da(s) vitamina(s) indicada(s) no item anterior? Se necessário, pesquise em fontes confiáveis para complementar sua resposta.
Resposta: Consumi-las com alguma fonte de gordura boa, para melhor solubilização.
14. A ocorrência de forças de interação é imprescindível para o funcionamento de materiais adesivos. Em sua maioria, os adesivos são compostos de polímeros sintéticos, como o polietileno.
Esse tipo de adesivo adere a superfícies como plásticos e madeira em razão do estabelecimento de interações do tipo:
a ) íon-dipolo.
b ) ligação de hidrogênio.
c ) dipolo induzido-dipolo induzido.
d ) dipolo permanente-dipolo permanente.
Resposta: Alternativa c.
Página 137
CAPÍTULO8
Funções orgânicas I
Introdução à Química Orgânica
1. Alguns seres vivos microscópicos, como fungos e bactérias, desempenham um importante papel nos ecossistemas, conforme apresentado na fotografia. Troque ideias com um colega a respeito dessa importância.
Resposta: Espera-se que os estudantes comentem que as bactérias e os fungos decompositores se alimentam de matéria orgânica proveniente dos seres vivos, como fezes, folhas, frutos que caem das árvores e partes do corpo de cadáveres. A decomposição da matéria orgânica devolve para o ambiente substâncias que as plantas utilizam em seu desenvolvimento.
2. O que você entende por matéria orgânica?
Resposta: O objetivo desta questão é resgatar os conhecimentos prévios dos estudantes sobre matéria orgânica. Verifique se eles comentam que a matéria orgânica é formada por compostos que apresentam átomo de carbono.

Por volta do final do século XVIII, cientistas de diversas áreas, como químicos e biólogos, estavam interessados em isolar e identificar as substâncias presentes em organismos vivos. Essas substâncias continham propriedades muito diferentes das observadas nos minerais. Nesse contexto, no início do século XIX, o químico sueco Jöns Jacob Berzelius (1779-1848) propôs a teoria da força vital, com base na ideia de que os compostos orgânicos só eram oriundos de organismos vivos e não poderiam ser obtidos artificialmente.
No entanto, em 1828, o químico alemão Friedrich Wöhler (1800-1882) realizou em seu laboratório a síntese de um composto orgânico, a ureia abre parênteses C H subscrito 4 N subscrito 2 O fecha parênteses, por meio do aquecimento de um composto inorgânico, o cianato de amônio abre parênteses N H subscrito 4 O C N fecha parênteses, conforme equação química.

As equações químicas são fundamentais para entendermos como as reações acontecem. Elas são a representação, por meio de símbolos, de fenômenos observáveis e farão parte de todo seu estudo de Química, por isso precisamos entender quais são seus componentes.
Os reagentes (R): ficam do lado esquerdo e são as substâncias iniciais. A seta abre parênteses seta para a direita fecha parênteses: indica a ocorrência de uma reação química. Os produtos (P): ficam do lado direito e são as substâncias produzidas.
R mais R seta para a direita P mais P
Algumas reações acontecem em condições específicas, como aquecimento abre parênteses delta fecha parênteses, e isso também pode ser representado com símbolos acima da seta da equação química.
Anteriormente, só era possível obter a ureia por meio da urina, um produto proveniente de seres vivos. Dessa forma, a teoria da força vital foi desacreditada e diversos compostos orgânicos passaram a ser sintetizados e estudados. Nesse cenário surge a Química Orgânica, o campo da Química que estuda compostos formados por átomos de carbono abre parênteses C fecha parênteses, suas propriedades, suas sínteses e aplicações.
A síntese de compostos orgânicos também foi muito importante para que o bioquímico russo Aleksandr Ivanovich Oparin (1894-1980) e o biólogo inglês John Haldane (1892-1964) formulassem a teoria sobre a origem da vida. Eles acreditavam que a atmosfera da Terra primitiva era formada pelos gases metano abre parênteses C H subscrito 4 fecha parênteses, amônia abre parênteses N H subscrito 3 fecha parênteses, hidrogênio abre parênteses H subscrito 2 fecha parênteses e vapor de água abre parênteses H subscrito 2 O fecha parênteses, sem a presença de gás oxigênio abre parênteses O subscrito 2 fecha parênteses.
3. A Ciência é uma construção humana desenvolvida ao longo do tempo com a participação de diversas pessoas. Como você identifica essa informação nos parágrafos anteriores?
Resposta: Espera-se que os estudantes entendam como a descoberta de pequenos fragmentos de informação por diferentes cientistas contribuem para um entendimento unificado de um fenômeno.
Página 138
Em 1952, os químicos estadunidenses Stanley Miller (1930-2007) e Harold Urey (1893-1981) fizeram um experimento envolvendo um dispositivo fechado que continha os gases supostamente existentes na atmosfera primitiva (1), como mostra a imagem do experimento. Durante uma semana, esses gases foram aquecidos, resfriados e submetidos a descargas elétricas (2). Ao final desse período, foi possível observar a formação dos aminoácidos alanina abre parênteses C subscrito 3 H subscrito 7 N O subscrito 2 fecha parênteses e glicina abre parênteses C subscrito 2 H subscrito 5 N O subscrito 2 fecha parênteses (3), compostos orgânicos precursores da vida.
Professor, professora: Comente com os estudantes que na ilustração as setas indicam o fluxo de água no condensador.
Imagem sem proporção e em cores fantasia.
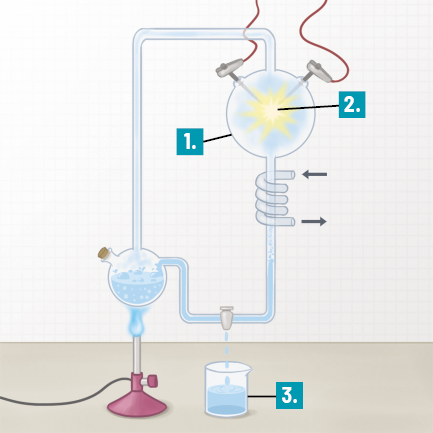
Imagem elaborada com base em: JUNQUEIRA, Luiz C.; CARNEIRO, José. Biologia celular e molecular. 9. ed. Rio de Janeiro: Guanabara Koogan, 2012. p. 11.
Os aminoácidos foram os precursores dos primeiros organismos vivos, mas os seres vivos têm tanto compostos orgânicos quanto inorgânicos.
Dica
Todas as moléculas orgânicas contêm carbono, porém nem todas as moléculas que contêm carbono são orgânicas.
Por definição, os compostos orgânicos têm o átomo de carbono em sua composição. No entanto, há compostos com carbono considerados inorgânicos, como diamante, grafite, monóxido de carbono abre parênteses C O fecha parênteses, carbonatos e bicarbonatos. Geralmente, os compostos orgânicos apresentam o carbono ligado ao hidrogênio abre parênteses H fecha parênteses; os compostos inorgânicos, não – por exemplo, o ácido fórmico abre parênteses C H subscrito 2 O subscrito 2 fecha parênteses, que é o ácido orgânico mais simples, e o ácido carbônico abre parênteses H subscrito 2 C O subscrito 3 fecha parênteses, um composto inorgânico. Confira a seguir.
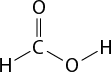
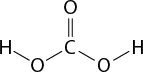
Além de átomos de carbono ligados a átomos de hidrogênio, as moléculas orgânicas costumam ter outros átomos em sua composição, como oxigênio abre parênteses O fecha parênteses, nitrogênio abre parênteses N fecha parênteses, enxofre abre parênteses S fecha parênteses, fósforo abre parênteses P fecha parênteses e halogênios. As ligações entre esses átomos e o carbono são predominantemente covalentes. Quando qualquer um desses átomos estiver inserido na cadeia carbônica, entre dois ou mais átomos de carbono, recebe o nome de heteroátomo.
No século XIX, o químico alemão Friedrich Kekulé (1829-1896) reuniu três postulados para explicar as propriedades do átomo de carbono.
1º postulado: o átomo de carbono é tetravalente.
O carbono é tetravalente, ou seja, realiza quatro ligações covalentes. Confira as estruturas a seguir.
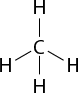
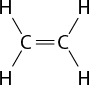
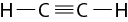
Página 139
2º postulado: as quatro valências do carbono são iguais entre si.
O átomo de carbono tem quatro elétrons de valência e as valências são equivalentes.




3º postulado: os átomos de carbono ligam-se entre si formando cadeias carbônicas.
O carbono tem a propriedade de se ligar a outros átomos de carbono formando cadeias estáveis, chamadas cadeias de carbonos ou cadeias carbônicas, de diversos tamanhos e disposições.
Por outro lado, os compostos inorgânicos costumam conter metais ou hidrogênio combinados a um átomo do grupo dos ametais. Podem ser formados por ligações iônicas, como no caso do cloreto de sódio abre parênteses N a C l fecha parênteses, ou covalentes, como o dióxido de carbono abre parênteses C O subscrito 2 fecha parênteses. Essas características tornam as propriedades físicas e químicas dos compostos orgânicos e inorgânicos bem diferentes.
Propriedades dos compostos orgânicos
As propriedades físicas e as propriedades químicas das moléculas orgânicas são influenciadas por sua composição e variam de acordo com os tipos de átomo ligados aos átomos de carbono, com o tamanho da cadeia carbônica, com os tipos de ligação e com o arranjo espacial das moléculas.
Entre essas propriedades, destacam-se a polaridade molecular, a solubilidade e as interações intermoleculares.
Polaridade molecular
Compostos orgânicos formados apenas por átomos de carbono e de hidrogênio, como o eteno abre parênteses C subscrito 2 H subscrito 4 fecha parênteses, são apolares, ou seja, têm momento dipolar igual a zero. Por outro lado, se houver a presença de um átomo de outro elemento químico fazendo ligação com um átomo de carbono ou hidrogênio, essa molécula geralmente será polar, como o etanol abre parênteses C subscrito 2 H subscrito 6 O fecha parênteses.

Solubilidade em água
Leia o seguinte trecho de reportagem.
Pesquisadora desenvolveu detergente especial para combater poluentes
Produto foi fundamental no combate aos vazamentos de óleo no Nordeste em 2019
PESQUISADORA desenvolveu detergente especial para combater poluentes. Nacional Jovem, 25 jan. 2023. Disponível em: https://s.livro.pro/efruf9. Acesso em: 20 ago. 2024.
O detergente descrito na manchete da reportagem foi desenvolvido por uma equipe de cientistas, em Pernambuco, liderada pela química Leonie Asfora Sarubbo. Esse detergente desempenhou um papel crucial na limpeza de áreas afetadas por derramamento de óleo nas praias do Nordeste em 2019. Ele é formulado com base em extratos vegetais e outros compostos naturais, o que o torna biodegradável e menos agressivo ao meio ambiente em comparação aos convencionais. Portanto, foi usado para limpar a superfície de rochas, corais, animais, vegetação e até mesmo pessoas que tiveram contato com o óleo.
4. O detergente descrito teve um papel essencial na limpeza de superfícies, animais e até de pessoas. Qual é a propriedade das moléculas de detergente que garante a versatilidade de uso?
Resposta: É a polaridade das moléculas do detergente. O óleo e a água são misturas imiscíveis entre si. A molécula de detergente tem uma cadeia carbônica com uma parte polar e outra apolar, assim a parte polar se liga às moléculas da água e a parte apolar se liga às moléculas do óleo, ocorrendo a dissolução do óleo na água.
Página 140
5. Você já lavou uma frigideira ou uma panela engordurada somente com água? Se sim, o que aconteceu?
Resposta pessoal. Espera-se que os estudantes respondam que a água não removeu o óleo da frigideira.
Os compostos apolares são insolúveis em água e solúveis em outros compostos orgânicos. Quando lavamos uma frigideira suja de óleo, por exemplo, não conseguimos remover a gordura apenas com água, porque o óleo de cozinha é apolar. Para limpá-la com eficiência, é necessário adicionar detergente, que em sua composição apresenta uma parte apolar e outra polar, conforme os exemplos.
Notamos também que, quanto mais polar for o composto orgânico, maior será sua tendência de solubilizar-se em água, ou seja, quanto mais átomos diferentes de carbono e hidrogênio a molécula tiver, maior será sua solubilidade, como ocorre no etanol e na acetona, solúveis em água.
Imagens desta página sem proporção e em cores fantasia.
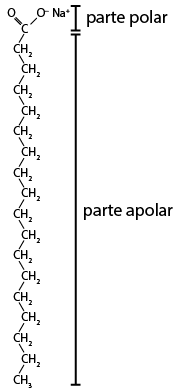
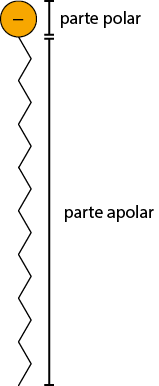
6. Cite outra situação do cotidiano em que é necessário usar um composto apolar ou detergente para dissolver outro composto apolar.
Resposta pessoal. Os estudantes podem citar o uso de detergentes para limpar as mãos sujas de graxa, entre outras situações.
Estados de agregação dos compostos orgânicos
À temperatura ambiente, os compostos orgânicos podem ser encontrados nos estados de agregação (ou fases) sólido, líquido e gasoso. Isso ocorre porque, dependendo de sua composição, diferentes forças intermoleculares agem sobre as moléculas, levando a diferentes temperaturas de fusão e de ebulição. Conforme visto no capítulo anterior, a ligação de hidrogênio é uma interação intermolecular muito intensa, ocorrendo, por exemplo, nos compostos com grupos O traço H, como a sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses, que é sólida à temperatura ambiente.
Em seguida, temos a interação dipolo permanente-dipolo permanente presente, por exemplo, na acetona abre parênteses C subscrito 3 H subscrito 6 O fecha parênteses. A força intermolecular nos compostos orgânicos apolares é do tipo dipolo induzido-dipolo induzido e é a mais fraca. Compostos apolares de cadeias carbônicas curtas, como o butano, são gases à temperatura ambiente, enquanto os de cadeia longa podem ser líquidos ou sólidos.

A.

B.

C.
Página 141
Classificação das cadeias carbônicas
As cadeias carbônicas podem ser classificadas de acordo com diferentes aspectos de sua composição e estrutura. Confira a seguir alguns critérios para a classificação.
1. Fechamento da cadeia: as cadeias carbônicas podem ser abertas, fechadas ou mistas.
Cadeias abertas, acíclicas ou alifáticas: ocorrem quando se têm pelo menos duas extremidades e não há presença de ciclos.

Cadeias fechadas ou cíclicas: ocorrem em moléculas em que todos os átomos de carbono estão unidos, formando ciclos.
Cadeias mistas: apresentam porções tanto de cadeia aberta quanto de cadeia fechada.
2. Disposição dos átomos na cadeia: as cadeias carbônicas podem ser lineares ou ramificadas. Um carbono pode ser considerado primário se estiver ligado a, no máximo, outro átomo de carbono. Se o átomo de carbono estiver ligado a dois outros átomos de carbono, será considerado secundário; se estiver ligado a outros três carbonos, será terciário; e, por fim, o carbono será considerado quaternário se estiver ligado diretamente a quatro carbonos.
- Cadeias normais ou lineares: apresentam somente carbonos primários ou secundários e apenas duas extremidades.
- Cadeias ramificadas: apresentam três ou mais extremidades e carbonos terciários e/ou quaternários.


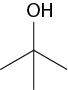

3. Tipo de ligação entre átomos de carbono: as cadeias podem ser saturadas ou insaturadas.
Cadeias saturadas: apresentam apenas ligações simples entre os átomos de carbono.

Cadeias insaturadas: apresentam pelo menos uma ligação dupla ou uma ligação tripla entre dois átomos de carbono.


Página 142


Dica
O eteno ou etileno é responsável pelo amadurecimento de frutos.
4. Natureza dos átomos: as cadeias podem ser homogêneas ou heterogêneas.
- Cadeias homogêneas: não apresentam heteroátomos ao longo da cadeia carbônica. Por exemplo, A e B.
- Cadeias heterogêneas: apresentam pelo menos um heteroátomo entre os carbonos ao longo da cadeia. Os heteroátomos mais comuns são oxigênio, nitrogênio, enxofre e fósforo. Por exemplo, C e D.
A.

B.

C.
D.
5. Presença de anel aromático: as cadeias podem ser aromáticas ou alicíclicas.
- Cadeias aromáticas: ocorrem em compostos que têm pelo menos um anel benzênico (também chamado anel aromático). Por exemplo, as estruturas A e B.
- Cadeias alicíclicas ou não aromáticas: cadeias fechadas que não têm anéis aromáticos. Por exemplo, a estrutura C.
A.
B.
C.
7. O ácido acetilsalicílico é um medicamento muito usado em todo o mundo. No entanto, seu uso excessivo pode causar problemas de saúde, prejudicando principalmente o funcionamento dos rins. Converse com um colega sobre um hábito muito prejudicial à saúde, a automedicação. Pesquisem os principais problemas que essa prática pode causar e como devemos agir quando sentimos mal-estar.
Resposta: O objetivo desta questão é que os estudantes reflitam sobre os malefícios da automedicação. Espera-se que eles respondam que devemos procurar um médico quando sentimos mal-estar, para que seja realizado o diagnóstico correto do problema e o medicamento seguro e eficaz seja receitado.
Além das classificações por cadeias carbônicas há a classificação por funções químicas, variando de acordo com a natureza dos átomos presentes nos compostos orgânicos. O próximo assunto a ser explorado traz uma dessas funções, os hidrocarbonetos.
Página 143
ATIVIDADES
1. O betacaroteno é o pigmento que proporciona cor amarela aos vegetais, como cenoura, batata-doce e pimentão (amarelo e verde). Os animais vertebrados convertem essa substância em vitamina A, que é essencial para a saúde. Confira a seguir a fórmula estrutural do betacaroteno.
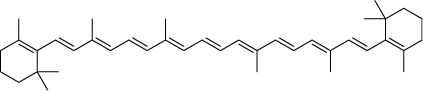
a ) Qual é a classificação da cadeia?
Resposta: Espera-se que os estudantes respondam que o betacaroteno apresenta cadeia mista, não aromática, ramificada, homogênea e insaturada.
b ) Qual é a sua fórmula molecular?
Resposta: C subscrito 40 H subscrito 56
c ) A maioria dos carbonos dessa molécula está ligada a quantos carbonos? Qual é o nome desse tipo de carbono?
Resposta: A maioria está ligada a outros 2 carbonos. São chamados de carbonos secundários.
d ) Há quantas insaturações na estrutura do betacaroteno?
Resposta: 11 insaturações.
2. Em tintas e vernizes, o solvente é o responsável por dissolver ou dispersar os componentes utilizados nas formulações, proporcionando à tinta a consistência e viscosidade adequadas para aplicação uniforme. Dependendo da composição química da tinta, podem ser utilizados como solventes água, tolueno ou xileno. Veja a seguir a estrutura química dos solventes citados.
A.
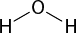
B.
C.
a ) Quais desses solventes são classificados como compostos orgânicos?
b ) Escreva as fórmulas químicas desses compostos.
c ) Qual desses solventes causa menos danos ao ambiente? Para saber mais detalhes, pesquise na internet as fichas técnicas desses materiais, conhecidas como FISPQ (ficha de informação de segurança para produtos químicos).
3. As diferentes composições dos compostos orgânicos acarretam diferentes forças intermoleculares que agem sobre as moléculas, levando a diferentes temperaturas de fusão e ebulição. Analise as estruturas e associe-as com as temperaturas de ebulição abre parênteses T subscrito e fecha parênteses.
A.
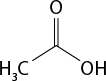
B.
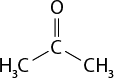
C.
I ) T subscrito e é igual a menos 89 graus Celsius.
II ) T subscrito e é igual a 56 graus Celsius.
III ) T subscrito e é igual a 117 vírgula 9 graus Celsius.
Resposta: A − III; B − II; C − I. Comentários nas Orientações para o professor.
4. O esmalte usado na pintura de unhas é uma mistura homogênea com capacidade plástica, ou seja, promove aderência (fixação) na unha. Para que tenha fácil manuseio, essa mistura é dissolvida em um solvente, que deixa o esmalte com menos viscosidade. Quando ocorre o contato do esmalte com a unha, os solventes evaporam rapidamente, deixando sobre ela apenas os componentes antes dissolvidos.
a ) Por que é importante conservar os esmaltes bem fechados e em lugares frescos?
Resposta: Para que o solvente não evapore e o esmalte não endureça no frasco.
b ) Qual propriedade a molécula que constitui o solvente em esmalte deve ter para que a evaporação ocorra rapidamente?
Resposta: Para que o solvente utilizado evapore rapidamente, suas moléculas devem realizar interações intermoleculares fracas.
5. O experimento de Miller e Urey pretendia explicar como compostos inorgânicos poderiam dar origem a compostos orgânicos por meio de reações químicas.
a ) Diferencie as características de compostos orgânicos e inorgânicos.
b ) Descreva brevemente o experimento realizado por Miller.
c ) Equacione a reação que ocorreu nesse experimento identificando quais são os reagentes, os produtos e quais das moléculas são orgânicas ou inorgânicas.
Professor, professora: Neste item, diga que não é necessário realizar o balanceamento da equação química.
Respostas das questões 2 e 5 nas Orientações para o professor.
6. Analise a estrutura do ácido adípico e responda ao que se pede.
a ) Qual é sua fórmula molecular?
Resposta: C subscrito 6 H subscrito 10 O subscrito 4
b ) A molécula pode ser classificada como apolar ou polar?
Resposta: A presença de átomos de oxigênio na cadeia faz que ela seja polar.
c ) Classifique a cadeia quanto aos seguintes aspectos: aberta ou fechada, homogênea ou heterogênea; e quanto ao tipo de ligação entre os carbonos (saturada ou insaturada).
Resposta: Trata-se de uma cadeia aberta, homogênea, saturada.
Página 144
Hidrocarbonetos
Leia o seguinte trecho de reportagem.
Comunicação
As abelhas se comunicam principalmente por meio de interações químicas, graças à produção de feromônios, substâncias secretadas por diversas glândulas que são percebidas pelos receptores olfativos presentes nas antenas. Os feromônios são o principal meio de estimulação e coordenação de quase todas as atividades das abelhas. O corpo das abelhas também é coberto por esses compostos químicos, chamados de hidrocarbonetos cuticulares, que funcionam como um crachá de identificação. Eles indicam à qual colônia a abelha pertence, o sexo e a casta a qual pertence (qual é a tarefa que realiza na colônia).
[…]
Abelha operária (Apis mellifera): pode atingir aproximadamente 1 vírgula 5 centímetro de comprimento.

COMUNICAÇÃO. Associação Brasileira de Estudos das Abelhas, A.B.E.L.H.A. 29 ago. 2020. Disponível em: https://s.livro.pro/xsxh8f. Acesso em: 20 ago. 2024.
Os compostos mencionados no texto são todos pertencentes à função orgânica hidrocarbonetos, ou seja, compostos formados somente por átomos de carbono e hidrogênio.
Dica
Instale o aplicativo Chemical Nomenclature (Nomenclatura Química) disponível para dispositivos móveis. É um aplicativo de múltipla escolha, com o qual você poderá aprender mais a respeito da nomenclatura dos compostos orgânicos.
Os hidrocarbonetos estão presentes em organismos vivos na forma de esteroides, como o colestano abre parênteses C subscrito 27 H subscrito 48 fecha parênteses, produto da degradação do colesterol abre parênteses C subscrito 27 H subscrito 46 O fecha parênteses. Nem todos os esteroides são hidrocarbonetos, mas todos derivam da mesma estrutura central.

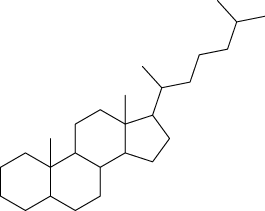
Outra classe de hidrocarbonetos são os terpenos, de fórmula química geral abre parênteses C subscrito 5 H subscrito 8 fecha parênteses subscrito n. Os terpenos são compostos responsáveis por características específicas de muitos vegetais. O limoneno abre parênteses C subscrito 10 H subscrito 16 fecha parênteses, por exemplo, é responsável pelo aroma do limão; já o licopeno abre parênteses C subscrito 40 H subscrito 56 fecha parênteses é responsável pela cor vermelha do tomate. Além disso, os terpenos são precursores de muitos outros compostos, como vitaminas e inseticidas.
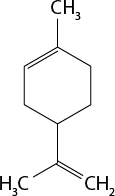

Os hidrocarbonetos são os principais constituintes de combustíveis, como petróleo, gás natural e carvão mineral, além de serem utilizados na produção de diversos materiais, como plásticos e velas.
Por serem compostos apolares, são insolúveis em água. À temperatura ambiente, as cadeias carbônicas de até 4 átomos de carbono são gases. Já as cadeias carbônicas entre 5 e 17 átomos de carbono são líquidos; acima de 17 átomos de carbono, são sólidos.
Página 145
O petróleo sintético é um material que reproduz as propriedades do petróleo extraído da natureza. Enquanto o petróleo convencional é derivado de matéria orgânica fóssil, o sintético é feito com hidrogênio e carbono provenientes de outras fontes.
O hidrogênio utilizado geralmente vem da água, originado de sua decomposição realizada por um processo chamado de eletrólise. Já o carbono necessário para a produção de petróleo sintético pode ser obtido do dióxido de carbono capturado em chaminés industriais por meio de filtros especiais. O uso desse dióxido de carbono contribui para a redução da pegada de carbono, imprescindível para atingir a meta de redução de C O subscrito 2 em 45% até o ano 2030, para que o aquecimento do planeta não supere 1 vírgula 5 graus Celsius sobre as temperaturas da era pré-industrial. Da mesma forma que a queima de combustíveis derivados do petróleo liberam dióxido de carbono para a atmosfera, a queima do petróleo sintético também libera essa substância. Contudo, a captura e utilização do dióxido de carbono da atmosfera para produzir esse combustível neutraliza o valor de emissão. Também é possível utilizar o carbono oriundo do metano liberado, por exemplo, do lixo orgânico e de resíduos agrícolas.
Professor, professora: Comente com os estudantes que o termo pegada de carbono se refere à quantidade de gases do efeito estufa emitida por alguma atividade humana, como um produto, serviço, ou pelas ações diárias de um habitante.
Trabalhadores que lidam com hidrocarbonetos geralmente estão expostos a compostos orgânicos voláteis, os BTEX. Esse acrônimo (abreviação que consiste na letra inicial de cada palavra) refere-se aos seguintes compostos: benzeno abre parênteses C subscrito 6 H subscrito 6 fecha parênteses, tolueno abre parênteses C subscrito 7 H subscrito 8 fecha parênteses, etilbenzeno abre parênteses C subscrito 8 H subscrito 10 fecha parênteses e xileno abre parênteses C subscrito 8 H subscrito 10 fecha parênteses. Essas substâncias químicas estão presentes em alguns tipos de tintas, graxas, combustíveis e removedores de tintas e vernizes.
A exposição aos BTEX está associada a diversos efeitos tóxicos no organismo, como irritação das vias respiratórias, resultando em tosse e falta de ar; comprometimento do sistema nervoso central, provocando sintomas, como dores de cabeça, tontura e confusão mental; prejuízo ao sistema hematopoiético (relacionado à produção de células sanguíneas), causando condições como anemia e leucopenia. Embalagens de produtos e caminhões que contenham BTEX devem ser sinalizadas com símbolos específicos.





Esses compostos entram no corpo principalmente pela respiração, mas também pelo contato com a pele e, em alguns casos, pela ingestão. Dado o risco que representam à saúde, trabalhadores que têm contato com essas substâncias devem, obrigatoriamente, adotar várias precauções para garantir sua saúde e segurança. Um dos cuidados essenciais envolve o uso de equipamento de proteção individual (EPI), como luvas, óculos de proteção, máscaras respiratórias e trajes resistentes a produtos químicos, para prevenir o contato direto com os hidrocarbonetos e a inalação de vapores tóxicos. O armazenamento e a manipulação desses materiais devem ser feitos de modo a evitar derramamentos e vazamentos, além da conservação longe de fontes de ignição.

Além da obrigatoriedade de medidas e equipamentos de segurança, trabalhadores com atividade profissional com exposição permanente a componentes nocivos geralmente têm direito a condições específicas de aposentadoria em razão dos riscos elevados e das adversidades do trabalho, como tintureiros, metalúrgicos, técnicos de enfermagem, entre outros. O tempo de contribuição é reduzido conforme o agente químico ou biológico ao qual o trabalhador foi exposto. A regra para aposentadoria antecipada é concedida também a trabalhadores continuamente expostos a outros agentes prejudicais à saúde, como ruídos, calor excessivo e radiação.
Página 146
Nomenclatura de hidrocarbonetos
A nomenclatura de qualquer composto orgânico pode ser dividida em:
prefixo mais termo central mais sufixo
As regras gerais para nomear um hidrocarboneto envolvem as seguintes características.
1. Prefixo: o número de carbonos da maior cadeia carbônica. Confira no quadro a seguir a lista de prefixos.
| Número de carbonos | Prefixo | Número de carbonos | Prefixo |
|---|---|---|---|
|
1 |
met |
8 |
oct |
|
2 |
et |
9 |
non |
|
3 |
prop |
10 |
dec |
|
4 |
but |
11 |
undec |
|
5 |
pent |
12 |
dodec |
|
6 |
hex |
20 |
eicos |
|
7 |
hept |
100 |
hect |
Dica
Quando a cadeia principal de um hidrocarboneto é fechada, ou seja, um ciclo, devemos inserir a palavra ciclo antes do prefixo. Abordaremos alguns exemplos adiante.
2. Termo do meio: o termo central do nome do hidrocarboneto dependerá dos tipos de ligação que ocorrem na cadeia carbônica.
| Tipo de ligação | Classificação | Termo do meio |
|---|---|---|
|
Apenas ligações simples |
Alcanos |
an |
|
Ligação dupla |
Alcenos |
en |
|
Ligação tripla |
Alcinos |
in |
Dica
Se a cadeia apresentar duas ligações duplas, o termo será dien, se tiver duas triplas, diin, três duplas, trien, e assim por diante.
3. Sufixo: o sufixo dos hidrocarbonetos será sempre a letra o.
Alcanos são os hidrocarbonetos mais simples, pois não têm insaturações na cadeia carbônica. Sua fórmula genérica é C subscrito n H início subscrito, 2 n mais 2, fim subscrito. Utilizando as regras apresentadas anteriormente, podemos nomear alguns alcanos.
Propano (Fórmula molecular: C subscrito 3 H subscrito 8)
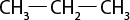

| Prefixo | Intermediário | Sufixo |
|---|---|---|
|
Número de carbonos: 3 |
Ligações: apenas simples |
Função: hidrocarboneto |
|
PROP |
AN |
O |
Hexano (Fórmula molecular: C subscrito 6 H subscrito 14)
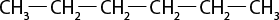

| Prefixo | Intermediário | Sufixo |
|---|---|---|
|
Número de carbonos: 6 |
Ligações: apenas simples |
Função: hidrocarboneto |
|
HEX |
AN |
O |
Página 147
Alcenos ou alquenos são hidrocarbonetos com uma ou mais ligações duplas entre átomos de carbono em sua composição. Nesse caso, precisamos localizar a dupla ligação na cadeia. Para isso, numeramos os carbonos a partir da extremidade mais próxima à insaturação, para que seja o menor número possível. No nome, esse número deverá se situar entre o prefixo e o termo do meio. Sua fórmula geral, quando há apenas uma ligação dupla, é C subscrito n H início subscrito, 2 n, fim subscrito.
Pent-1-eno (Fórmula molecular: C subscrito 5 H subscrito 10)


| Prefixo | Intermediário | Sufixo |
|---|---|---|
|
Número de carbonos: 5 |
Ligações: dupla |
Função: hidrocarboneto |
|
PENT |
EN |
O |
Alcinos ou alquinos, por sua vez, são hidrocarbonetos de cadeia aberta com ligação tripla entre átomos de carbono. As regras para os alcinos são as mesmas descritas para os alcenos. Sua fórmula geral é C subscrito n H início subscrito, 2 n menos 2, fim subscrito.
But-1-ino (Fórmula molecular: C subscrito 4 H subscrito 6)
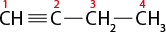

| Prefixo | Intermediário | Sufixo |
|---|---|---|
|
Número de carbonos: 4 |
Ligações: tripla |
Função: hidrocarboneto |
|
BUT |
IN |
O |
Os hidrocarbonetos cíclicos seguem as mesmas regras que os alifáticos, tendo apenas o acréscimo do prefixo ciclo antes do nome, como no exemplo a seguir.
Ciclobuteno (Fórmula molecular: C subscrito 4 H subscrito 6)


| Prefixo | Intermediário | Sufixo |
|---|---|---|
|
Número de carbonos: 4 |
Ligações: dupla |
Função: hidrocarboneto |
|
CICLO + BUT |
EN |
O |
Para os hidrocarbonetos de cadeias ramificadas, deve-se definir a cadeia carbônica principal, a que contém maior número de átomos de carbono e que eventualmente tenha insaturações. Apenas depois disso, deve-se reconhecer as ramificações. A numeração da cadeia deve ser feita de tal maneira que os números das ramificações sejam os menores possíveis. Quando houver mais de uma ramificação do mesmo tipo, os nomes são precedidos de prefixos que indicam suas quantidades: di para dois, tri para três, tetra para quatro etc. Por fim, quando houver dois ou mais substituintes de tipos diferentes deve ser utilizada a ordem alfabética.

Ramificações
no carbono 2: metil
no carbono 3: metil
no carbono 4: propil
no carbono 5: metil
nome: 2,3,5-trimetil-4-propil-heptano

Ramificações
no carbono 2: etil
no carbono 3: metil
nome: 2-etil-3-metilpent-1-eno
Dica
As ramificações são nomeadas como se fossem uma cadeia carbônica normal, mas com o sufixo -il. Por exemplo, uma ramificação menos C H subscrito 3 deriva do metano, C H subscrito 4, então seu nome é metil. Já a ramificação menos C H subscrito 2 C H subscrito 3 é nomeada etil.
8. Comente a importância de haver tantas maneiras de classificar e tantas regras de nomenclatura para os compostos orgânicos.
Resposta: Espera-se que os estudantes considerem a necessidade das diversas classificações e regras, tendo em vista que há muitas possibilidades de compostos orgânicos, sendo necessária uma padronização que torne possível classificar e nomear todas as moléculas.
Página 148
Matriz energética brasileira e consumo de petróleo
Leia o seguinte trecho de reportagem.
Brasil não tem plano claro para transição energética
Prazos para redução do uso de combustíveis fósseis seguem indefinidos
O Brasil não possui planejamento nem metas para abrir mão dos combustíveis fósseis, responsáveis pelo aquecimento global e terceira maior fonte de emissões de gases estufa no país […]
BRASIL não tem plano claro para transição energética. Folha de S.Paulo, São Paulo, 25 fev. 2024. p. 1.
Em 2008, o Brasil assinou o Plano Clima, que deveria nortear ações de combate à crise climática, diminuindo a emissão de gases de efeito estufa com a redução do uso de combustíveis fósseis. Entretanto, em 2024, o ministro de Minas e Energia afirmou que o petróleo ainda será uma fonte energética importante entre 20 e 30 anos, contradizendo os apontamentos da Agenda 2030 para o Desenvolvimento Sustentável.
Matriz energética brasileira (2022)
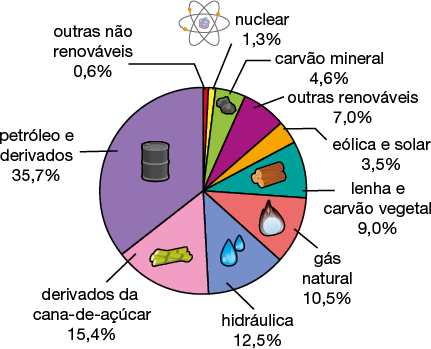
Fonte de pesquisa: BRASIL. Ministério de Minas e Energia. Matriz energética e elétrica. Empresa de Pesquisa Energética. Disponível em: https://s.livro.pro/HuVw2W. Acesso em: 20 ago. 2024.
Carvão, gás natural, petróleo e derivados (entre eles, gasolina e diesel) são os combustíveis fósseis utilizados na matriz energética brasileira.
O petróleo é uma mistura de vários hidrocarbonetos de diferentes tamanhos de cadeias carbônicas. Ao passar por um processo chamado destilação fracionada, o petróleo pode ser separado em diferentes misturas de composição mais homogênea, como o gás liquefeito de petróleo (GLP), formado principalmente por metano, etano e propano; a gasolina, composta de heptano abre parênteses C subscrito 7 H subscrito 16 fecha parênteses, octano abre parênteses C subscrito 8 H subscrito 18 fecha parênteses e nonano abre parênteses C subscrito 9 H subscrito 20 fecha parênteses; e o diesel, formado por moléculas maiores e mais densas.
Já o gás natural é uma mistura de hidrocarbonetos de baixa massa molecular, principalmente metano, etano, propano e butano, e é encontrado em jazidas naturais como resultado da degradação da matéria orgânica ao longo de milhares de anos. Assim, é comumente encontrado junto ao petróleo. O metano é o combustível encontrado no GNV, o gás natural veicular, enquanto o propano e o butano são usados como gás de cozinha.
Os combustíveis fósseis são recursos naturais não renováveis, ou seja, que não podem ser repostos no ambiente em tempo suficiente para manter sua disponibilidade.

a ) Comente a importância da diversificação da matriz energética do país.
Resposta: Espera-se que os estudantes comentem que a diversificação da matriz energética evita problemas provocados pela escassez de recursos, principalmente dos não renováveis, como o petróleo.
b ) Os combustíveis fósseis são responsáveis pela terceira maior fonte de emissão de gases estufa no país. Pesquise quais são as outras fontes de emissão.
Resposta: As outras fontes de efeito estufa são as queimadas e a agropecuária.
Página 149
ATIVIDADES
1. Faça o que se pede nos itens a seguir considerando as fórmulas moleculares C subscrito 2 H subscrito 6, C subscrito 2 H subscrito 4 e C subscrito 2 H subscrito 2.
a ) Represente as fórmulas estruturais.
Atividade(s) adaptada(s) acessível(is)
a ) Descreva as fórmulas estruturais.
Resposta: C subscrito 2 H subscrito 6: dois grupos C H subscrito 3 com os carbonos ligados por uma ligação simples. C subscrito 2 H subscrito 4: dois grupos C H subscrito 2 ligados por uma ligação dupla. C subscrito 2 H subscrito 2: dois grupos C H ligados por uma ligação tripla.
b ) Escreva as nomenclaturas dessas substâncias.
c ) Como essas cadeias carbônicas podem ser classificadas?
2. Confira a estrutura a seguir.
Considere que Y pode ser hidrogênio, bromo ou metil. Ao variarmos Y, o tipo de cadeia carbônica dessa estrutura muda. Associe Y com as cadeias carbônicas descritas a seguir.
a ) Cadeia carbônica homogênea, saturada e sem ramificações.
Resposta: Hidrogênio e bromo.
b ) Cadeia carbônica tipo homogênea, saturada e ramificada.
Resposta: Metil.
3. O gás natural é uma mistura de hidrocarbonetos de baixa massa molecular, principalmente metano, etano, propano e butano. Identifique a alternativa que apresenta a fórmula molecular e a massa molar correta desses hidrocarbonetos.
a ) Metano: C H subscrito 6; 18 gramas vezes mol elevado a menos 1. Etano: C subscrito 2 H subscrito 6; 30 gramas vezes mol elevado a menos 1. Propano: C subscrito 3 H subscrito 8; 44 gramas vezes mol elevado a menos 1. Butano: C subscrito 4 H subscrito 10; 58 gramas vezes mol elevado a menos 1.
b ) Metano: C H subscrito 4; 16 gramas vezes mol elevado a menos 1. Etano: C subscrito 2 H subscrito 6; 30 gramas vezes mol elevado a menos 1. Propano: C subscrito 3 H subscrito 8; 44 gramas vezes mol elevado a menos 1. Butano: C subscrito 4 H subscrito 10; 58 gramas vezes mol elevado a menos 1.
c ) Metano: C H subscrito 4; 16 gramas vezes mol elevado a menos 1. Etano: C subscrito 2 H subscrito 6; 30 gramas vezes mol elevado a menos 1. Propano: C subscrito 3 H subscrito 8; 44 gramas vezes mol elevado a menos 1. Butano: C subscrito 5 H subscrito 10; 70 gramas vezes mol elevado a menos 1.
Resposta: Alternativa b.
4. BTEX faz referência à mistura dos hidrocarbonetos: benzeno abre parênteses C subscrito 6 H subscrito 6 fecha parênteses, tolueno abre parênteses C subscrito 7 H subscrito 8 fecha parênteses, etilbenzeno abre parênteses C subscrito 8 H subscrito 10 fecha parênteses e xileno abre parênteses C subscrito 8 H subscrito 10 fecha parênteses.
I ) Identifique a fórmula estrutural dessas substâncias componentes do BTEX.
Resposta: A – xileno; B – tolueno; C – etilbenzeno; D – benzeno.
II ) Benzeno, tolueno e xileno são os nomes comuns dessas substâncias. Indique a alternativa que apresenta, respectivamente, outras nomenclaturas para identificá-los.
a ) 1,3,5-ciclohexatrieno, ciclohexadieno e metil-ciclopentano.
b ) 1,3,5-ciclohexatrieno, metil-benzeno e 1,2-dimetilbenzeno.
c ) Cicloheptatrieno, propil-benzeno e metil-benzeno.
d ) Metil-ciclobutrieno, ciclohexadieno e 1-metil-2-etil-ciclobutano.
e ) 1,3,5-ciclohexatrieno, etil-ciclohexatrieno e 1-metil-2-etil-ciclobutano.
Resposta: Alternativa b.
5. Os feromônios excretados por insetos, mamíferos e organismos marinhos são capazes de suscitar reações específicas de caráter fisiológico e/ou comportamental em outros membros da mesma espécie que estejam em determinado raio do espaço físico ocupado pelo excretor.
a ) Qual característica estrutural as moléculas de feromônios devem ter para serem secretadas por um indivíduo e atingir outro a certa distância?
b ) O feromônio de trilha das formigas de jardim é o undecano (hidrocarboneto que tem como cadeia principal 11 carbonos). Represente sua fórmula estrutural e relacione a estrutura desse feromônio ao fato de as formigas de jardim andarem em trilhas pela grama em dias de chuva.
Atividade(s) adaptada(s) acessível(is)
b ) O feromônio de trilha das formigas de jardim é o undecano (hidrocarboneto que tem como cadeia principal 11 carbonos). Descreva sua fórmula estrutural e relacione a estrutura desse feromônio ao fato de as formigas de jardim andarem em trilhas pela grama em dias de chuva.
Resposta: Os estudantes devem descrever uma estrutura com um grupo C H subscrito 3 ligado por ligações simples a nove grupos C H subscrito 2 e outro grupo C H subscrito 3.
6. Analise a estrutura a seguir e responda ao que se pede.
a ) Qual é a fórmula molecular da estrutura apresentada?
b ) Ao analisar a estrutura, como sabemos que esse composto pode ter capacidade limpante?
Respostas das questões 1, 5 e 6 nas Orientações para o professor.
Página 150
CAPÍTULO9
Funções orgânicas II
Funções oxigenadas
1. Os cristais mostrados na fotografia são feitos de sacarose abre parênteses C subscrito 12 H subscrito 22 O subscrito 11 fecha parênteses, presente no açúcar. Analisando a fórmula molecular da sacarose, você a classificaria como uma função orgânica oxigenada? Justifique sua resposta.
Resposta: Espera-se que os estudantes respondam que sim e expliquem que a sacarose é formada por átomos de carbono, hidrogênio e oxigênio.
2. Para uma alimentação saudável, como você recomendaria o consumo de açúcar no cotidiano?
Resposta: Espera-se que os estudantes reflitam sobre os malefícios do consumo excessivo de alimentos ricos em açúcar, como a obesidade, os problemas dentários, o diabetes, entre outros, reconhecendo que o consumo desses alimentos deve ser moderado.
Imagem sem proporção.

No capítulo anterior, você estudou os hidrocarbonetos, compostos com apenas átomos de carbono abre parênteses C fecha parênteses e hidrogênio abre parênteses H fecha parênteses Neste capítulo, serão estudadas as funções orgânicas oxigenadas, compostos formados por átomos de carbono, hidrogênio e oxigênio abre parênteses O fecha parênteses
Muitos compostos desse tipo estão presentes em nosso dia a dia. O álcool combustível (etanol, C subscrito 2 H subscrito 5 O H) e sua matéria-prima, o açúcar comum (sacarose) são dois exemplos. Podemos citar também solventes, como o etoxietano abre parênteses C subscrito 4 H subscrito 10 O fecha parênteses e a acetona abre parênteses C subscrito 3 H subscrito 6 O fecha parênteses, o ácido acético abre parênteses C H subscrito 3 C O O H fecha parênteses, presente na composição do vinagre, e todo um grupo de substâncias chamadas flavorizantes, que dão sabor e aroma de frutas para balas e outros doces.
As funções orgânicas oxigenadas são definidas pela forma a qual os átomos de oxigênio estão ligados aos demais átomos de carbono e hidrogênio na molécula.
Um exemplo de composto oxigenado é a glicose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses cuja função é fornecer energia para as células. No processo chamado respiração celular, a glicose reage com o gás oxigênio abre parênteses O subscrito 2 fecha parênteses, liberando energia e produzindo água abre parênteses H subscrito 2 O fecha parênteses e gás carbônico abre parênteses C O subscrito 2 fecha parênteses. É possível notar átomos de oxigênio ligados aos átomos de carbono de duas formas: por meio de ligação simples, formando um grupo hidroxila abre parênteses menos O H fecha parênteses e por meio de ligação dupla, formando um grupo carbonila abre parênteses C é igual a O fecha parênteses. Cada uma dessas formas define uma função orgânica. Neste caso, a hidroxila caracteriza a função álcool e a carbonila ligada a um átomo de hidrogênio caracteriza a função aldeído.
A glicose, portanto, é uma molécula com mais de uma função orgânica. As substâncias orgânicas podem ter estruturas com vários tamanhos e podem conter diversos grupos funcionais.
Página 151
Álcool
Leia o trecho da reportagem a seguir.
Álcool líquido 70% tem venda proibida a partir de 30 de abril
A venda do álcool líquido 70% será proibida em todo o país a partir de 30 de abril. A medida foi tomada pela Agência Nacional de Vigilância Sanitária (Anvisa) e pretende reduzir acidentes registrados com a utilização do produto. Somente a formulação em gel poderá ser comercializada normalmente a partir de maio.
[…]
ÁLCOOL líquido 70% tem venda proibida a partir de 30 de abril. Prefeitura de Porto Alegre, 9 abr. 2024. Disponível em: https://s.livro.pro/0yea4a. Acesso em: 23 ago. 2024.
O álcool 70% se destaca por sua eficácia na eliminação de microrganismos. Porém, em 2002 teve sua venda proibida em razão de acidentes domésticos, sendo substituído pela versão em gel. Contudo, com a pandemia de covid-19, tornou-se uma ferramenta indispensável para conter a disseminação do vírus SARS-CoV-2. A importância da utilização de antissépticos pode ser associada, inclusive, ao Objetivo 3 da Agenda 2030, que visa acabar com as epidemias e outras doenças transmissíveis.
Em abril de 2024, houve uma nova proibição a fim e evitar o risco de acidentes domésticos.
O álcool mais usado no dia a dia é o etanol, ou álcool etílico. É um composto incolor, inflamável e de odor característico. Os álcoois são compostos orgânicos que apresentam um grupo hidroxila abre parênteses menos O H fecha parênteses ligado diretamente a um carbono saturado, e a nomenclatura oficial dos álcoois é dada de forma semelhante à dos hidrocarbonetos, porém com o sufixo -ol.
| Prefixo mais | Parte intermediária mais | Sufixo |
|---|---|---|
|
número de carbonos na cadeia principal |
tipo de ligação entre os carbonos |
-ol |
Professor, professora: Explique aos estudantes que a parte intermediária também pode ser denominada infixo.
É sempre necessário indicar a posição do(s) grupo(s) hidroxila, da(s) insaturação(ões) e/ou da(s) ramificação(ões). A ordem de numeração deve priorizar o grupo funcional, em seguida as insaturações e, por fim, as ramificações. Confira o exemplo a seguir.

Página 152
No Brasil, a principal matéria-prima para a produção do etanol é a cana-de-açúcar, rica em sacarose. Sob a ação do fungo Saccharomyces cerevisiae, ocorre a fermentação alcoólica, produzindo etanol em duas etapas.

Professor, professora: Comente com os estudantes que outras matérias-primas podem ser utilizadas na produção de etanol, como a beterraba, muito utilizada nos Estados Unidos.
Compartilhe ideias
O etanol tem vantagens e desvantagens, desde o cultivo de sua matéria-prima até seu uso como combustível.
a ) Discuta com seus colegas quais seriam essas vantagens e desvantagens e escrevam uma conclusão sobre o uso do etanol como combustível, ressaltando os aspectos ambientais envolvidos.
Resposta pessoal. Os estudantes podem citar vantagens como: uso de combustível renovável; menor emissão de gases poluentes na atmosfera, comparado à gasolina e ao diesel; geração de empregos no plantio e na colheita da cana e na produção do etanol. Como desvantagens, os estudantes podem citar: necessidade de usar grandes áreas para o plantio da cana, que poderiam ser aproveitadas para o cultivo de alimentos; aumento do desmatamento para ampliar a área de plantio de cana; emissão de gases poluentes na atmosfera durante a queima da cana para a colheita; empobrecimento dos solos em razão da monocultura; menor rendimento energético, comparado aos combustíveis fósseis; entre outras.
Na primeira etapa, representada a seguir, a molécula de sacarose reage com a água, em uma reação chamada hidrólise. Os produtos dessa reação são dois outros açúcares, a glicose e a frutose abre parênteses C subscrito 6 H subscrito 12 O subscrito 6 fecha parênteses:
expressão com detalhe abaixo, início da expressão, C subscrito 12 H subscrito 22 O subscrito 11, fim da expressão, início do detalhe abaixo, sacarose, fim do detalhe abaixo mais H subscrito 2 O expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, invertase, fim do detalhe acima expressão com detalhe abaixo, início da expressão, C subscrito 6 H subscrito 12 O subscrito 6, fim da expressão, início do detalhe abaixo, glicose, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, C subscrito 6 H subscrito 12 O subscrito 6, fim da expressão, início do detalhe abaixo, frutose, fim do detalhe abaixo
Dica
A invertase é uma enzima que catalisa a hidrólise da sacarose em frutose e glicose.
Na segunda etapa, glicose e frutose reagem, formando duas moléculas de etanol e duas moléculas de gás carbônico.
expressão com detalhe abaixo, início da expressão, C subscrito 6 H subscrito 12 O subscrito 6, fim da expressão, início do detalhe abaixo, glicose barra frutose, fim do detalhe abaixo mais H subscrito 2 O expressão com detalhe acima, início da expressão, seta para a direita, fim da expressão, início do detalhe acima, zimase, fim do detalhe acima expressão com detalhe abaixo, início da expressão, 2 C subscrito 2 H subscrito 6 O, fim da expressão, início do detalhe abaixo, etanol, fim do detalhe abaixo mais expressão com detalhe abaixo, início da expressão, 2 C O subscrito 2, fim da expressão, início do detalhe abaixo; fim do detalhe abaixo
Dica
A zimase é uma enzima que catalisa a conversão de açúcares em etanol e gás carbônico.
Compartilhe ideias
O consumo de bebidas alcoólicas, além de prejudicar a saúde, causa muitos problemas à sociedade. Um dos produtos da oxidação do etanol no organismo é o acetaldeído, um aldeído que inibe a secreção do hormônio antidiurético ADH, provocando desidratação. Além disso, ocasiona dores de cabeça, náuseas, sudorese, fadiga e sede.
a ) Agora, converse com um colega sobre os problemas decorrentes do consumo de bebidas alcoólicas.
Resposta nas Orientações para o professor.
Outro composto com a função álcool em sua molécula é o colesterol abre parênteses C subscrito 27 H subscrito 46 O fecha parênteses, presente na construção e manutenção das membranas celulares.
3. O que você sabe sobre o colesterol? Pergunte aos seus familiares se eles costumam controlar o nível de colesterol no sangue e qual é a importância desse controle.
Resposta: O objetivo desta questão é incentivar os estudantes a expressar seus conhecimentos prévios acerca do colesterol e refletir sobre os problemas de saúde causados pelo alto índice do colesterol LDL.
Página 153
Aldeídos
Os aldeídos são compostos que têm o grupo carbonila abre parênteses C é igual a O fecha parênteses na extremidade de uma cadeia carbônica. Portanto, o grupo carbonila sempre está ligado também a um átomo de hidrogênio.
A nomenclatura oficial dos aldeídos segue a usada para os hidrocarbonetos, substituindo o sufixo por -al. Confira a seguir alguns exemplos de estruturas e nomenclaturas de aldeídos.

Professor, professora: Ao mencionar o 4-isopropilpent-4-enal, explique aos estudantes que o prefixo iso é utilizado quando a cadeia ramificada está ligada à estrutura principal de forma a apresentar certa simetria.
4. Analise a fotografia. Qual é a substância usada em laboratórios para conservar esses organismos por um longo tempo?

Resposta: Espera-se que os estudantes citem uma substância conhecida comercialmente como formol. Trata-se de uma solução aquosa de aldeído.
Em laboratórios e museus, há animais conservados em misturas líquidas dentro de recipientes. Esse líquido, chamado comercialmente de formol, é uma solução de metanal em água, com aproximadamente 40% em massa do aldeído, com ação desinfetante e conservante. O formol é altamente tóxico se for ingerido, inalado ou entrar em contato com a pele.
A expressão popular "gosto não se discute" reflete a ideia de que as preferências pessoais são subjetivas e variam de pessoa para pessoa. Muitos dos nossos gostos estão relacionados a fatores sociais e culturais, mas alguns gostos têm uma base científica. Um exemplo é o gosto por coentro.
Enquanto para alguns seu aroma e sabor são frescos e vibrantes, para outros o coentro evoca sensações menos agradáveis, pois nasceram com um gene capaz de reconhecer algumas substâncias orgânicas com a função aldeído, que dão seu cheiro característico, sendo associado a aromas desagradáveis, como o de sabão ou de certos insetos. Entre os diferentes aldeídos encontrados no coentro está o dec-2-enal, um aldeído insaturado com uma cadeia de dez carbonos.
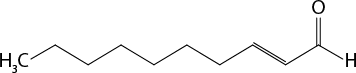
Em muitas culturas, o coentro é um ingrediente essencial e valorizado, utilizado na culinária de geração em geração. Ele foi introduzido no Brasil pelos portugueses, na época da colonização. Além disso, em nossa gastronomia esse tempero está associado à forte influência de diferentes culturas, como a africana, a indígena, a europeia e a árabe. Especialmente na culinária brasileira, ele é associado a pratos tradicionais como a moqueca e o baião de dois. Portanto, para muitas pessoas, o uso desse tempero vai além do sabor, sendo também um elemento importante de expressão cultural.
Página 154
Cetona
Quem costuma esmaltar as unhas com frequência sabe que é necessário remover o esmalte, e que um produto específico é muito utilizado para isso. Trata-se da acetona, ou propanona, que é um exemplo de cetona.
As cetonas apresentam o grupo carbonila em um carbono secundário.
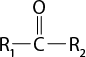
A nomenclatura oficial das cetonas também segue a dos hidrocarbonetos, substituindo o sufixo por -ona. A seguir, alguns exemplos de estruturas e nomenclaturas de cetonas.
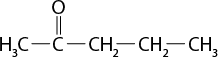
A frutose é um carboidrato encontrado no mel e em vários frutos, vindo daí seu nome. Ela é metabolizada em nosso organismo e se transforma em glicose, fornecendo energia para as células. Em sua estrutura, a frutose tem as funções álcool e cetona.
Professor, professora: Comente que, assim como ocorre com a sacarose, o consumo excessivo de frutose pode aumentar o nível de açúcar no sangue e, com o passar do tempo, provocar a obesidade e o surgimento do diabetes.
Fenol
O estradiol abre parênteses C subscrito 18 H subscrito 24 O subscrito 2 fecha parênteses é um hormônio essencial para o desenvolvimento e a manutenção dos tecidos reprodutores femininos, mas também é importante para muitos outros tecidos, incluindo o ósseo. Nos homens, seus níveis são mais baixos em comparação aos encontrados nas mulheres, mas também apresenta funções importantes no organismo masculino, como a produção de espermatozoides. Confira a seguir a fórmula estrutural do estradiol.
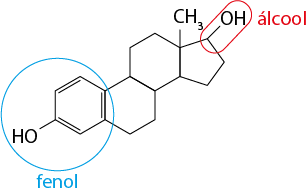
O estradiol tem as funções orgânicas álcool e fenol. Os fenóis são compostos que apresentam o grupo menos O H ligado a um anel benzênico. Na nomenclatura oficial dos fenóis, o grupo menos O H é denominado hidroxi, precedendo o nome do hidrocarboneto que lhe deu origem.
Em geral, em condições ambientais (25 graus Celsius e 1 a t m), os fenóis são sólidos, pouco solúveis em água, de ação corrosiva, são tóxicos e, quando em contato com a pele, penetram rapidamente, causando lesões teciduais severas.
Página 155
Como ocorre com outras funções orgânicas, as posições das ramificações nos fenóis têm prioridade menor do que o grupo funcional.
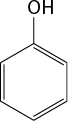
O hidroxibenzeno, ou fenol comum, é utilizado na produção de desinfetantes e medicamentos. O 2,4,6-trinitrofenol ou 2,4,6-trinitro-1-hidroxibenzeno abre parênteses C subscrito 6 H subscrito 3 N subscrito 3 O subscrito 7 fecha parênteses, ou ácido pícrico, representado a seguir, é utilizado na fabricação de pomadas para queimaduras (picrato de butambeno) e na fabricação de detonadores de explosivos.
Éter
Voltando à sacarose, além da função álcool, esse carboidrato apresenta a função orgânica éter.
5. No organismo humano, a sacarose é transformada durante a digestão em glicose e frutose. Para que essas moléculas são utilizadas?
Resposta: Espera-se que os estudantes respondam que essas moléculas são armazenadas e utilizadas pelo organismo para obter energia.
Os éteres são compostos que apresentam oxigênio como heteroátomo (entre dois átomos de carbono). Dessa forma, seu grupo funcional é representado da seguinte forma:
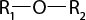
Confira a seguir como é composta a nomenclatura oficial dos éteres e alguns exemplos.
| Exemplo | Prefixo | mais | oxi | mais | Nome do hidrocarboneto |
|---|---|---|---|---|---|
|
etoxietano abre parênteses C subscrito 4 H subscrito 10 O fecha parênteses |
et |
mais |
oxi |
mais |
etano |
|
metoxietano abre parênteses C subscrito 3 H subscrito 8 O fecha parênteses |
met |
mais |
oxi |
mais |
etano |
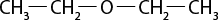
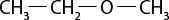
O óxido de etileno (oxirano) é o menor éter cíclico conhecido. Ele pode ser utilizado como esterilizante em ambientes hospitalares, na formulação de fragrâncias, na fabricação de alguns xampus, protetores solares, esmaltes coloridos para unhas, cremes dentais, batons etc.
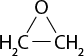
Página 156
Ácido carboxílico
O ômega-3, ou ácido linolênico abre parênteses C subscrito 18 H subscrito 32 O subscrito 2 fecha parênteses, é um composto obtido por meio da alimentação e age na redução das ações inflamatórias e na preservação do sistema imunológico. A seguir, alguns alimentos que contêm ômega-3.
Imagens desta página sem proporção.

6. Alimentos ricos em ômega-3 fazem parte da sua alimentação? Caso não façam, quais deles você poderia inserir?
Resposta pessoal. O objetivo desta questão é levar os estudantes a avaliar sua alimentação e refletir sobre como podem melhorá-la, inserindo alimentos ricos em ômega-3.
O ômega-3 apresenta a função ácido carboxílico, que têm uma carbonila ligada diretamente a uma hidroxila, formando o grupo carboxila. Sua nomenclatura oficial também segue a dos hidrocarbonetos, adicionando a palavra ácido e o sufixo -oico. Confira nos exemplos a seguir.
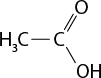
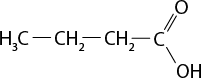
Os ácidos carboxílicos têm inúmeras aplicações, desde tingimento de tecidos e desinfetante até a preparação de perfumes, corantes, acetona e vinagre.
Éster e enol
Confira os alimentos a seguir.

7. Alimentos ricos em vitamina C abre parênteses C subscrito 6 H subscrito 8 O subscrito 6 fecha parênteses, como os apresentados na fotografia, fazem parte da sua alimentação? Caso não façam, quais deles você poderia incluir?
Resposta pessoal. O objetivo desta questão é levar os estudantes a avaliar sua alimentação e refletir sobre como podem melhorá-la, incluindo a ingestão de alimentos ricos em vitamina C.
Página 157
O ácido ascórbico, ou vitamina C, como é mais conhecido, é um composto solúvel em água. Suas funções no organismo consistem em manter o tecido conjuntivo, fortalecer o sistema, facilitar a absorção de ferro abre parênteses F e fecha parênteses, colaborar na síntese de alguns aminoácidos e conferir resistência aos ossos e dentes.
Além da função álcool, que já foi estudada, esse composto apresenta mais duas funções orgânicas: enol e éster.
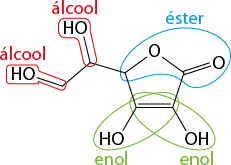
Quando o grupo menos O H está ligado diretamente a um carbono insaturado por dupla-ligação, tem-se a função enol. A nomenclatura dos enóis segue a dos álcoois, alterando apenas o intermediário an para en em razão da ligação dupla. Confira alguns exemplos a seguir.
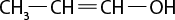
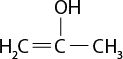
Agora, leia a tirinha a seguir.

BECK, Alexandre. Armandinho zero. Florianópolis: A. C. Beck, 2013. p. 37.
8. Você considera os conselhos da mãe de Armandinho adequados? Por quê?
Resposta: Espera-se que os estudantes reflitam sobre os hábitos alimentares a fim de reconhecerem que a mãe de Armandinho está priorizando uma alimentação saudável ao comentar sobre a necessidade de incluir frutas em detrimento das bolachas recheadas, pois estas são ricas em açúcar e gordura, além de ser alimentos ultraprocessados.
O cheiro e o sabor das bolachas que Armandinho percebe ao comê-las são resultado da presença de ésteres, compostos que conferem aromas e sabores de frutas, bebidas, cosméticos, flores, entre outros.
Derivados de ácidos carboxílicos, os ésteres constituem também óleos e gorduras vegetais e animais, que podem servir para síntese do biodiesel.
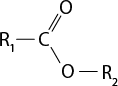
Confira a seguir como é determinada a nomenclatura oficial dos ésteres.
| Exemplo | Hidrocarboneto | mais | ato | mais | de | mais | Nome do substituinte com terminação -ila |
|---|---|---|---|---|---|---|---|
|
metanoato de etila abre parênteses C subscrito 3 H subscrito 6 O subscrito 2 fecha parênteses |
metano |
mais |
ato |
mais |
de |
mais |
etila |
|
butanoato de etila abre parênteses C subscrito 6 H subscrito 12 O subscrito 2 fecha parênteses |
butano |
mais |
ato |
mais |
de |
mais |
etila |

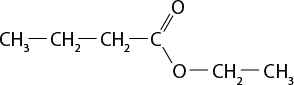
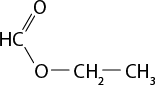
Página 158
CONEXÕES com ... BIOLOGIA
Glicose no sangue
A glicose é obtida por meio da alimentação, sendo utilizada pelas células para produzir as substâncias que armazenam e liberam a energia de que o corpo necessita. Isso ocorre por meio do mecanismo chamado de glicólise, no qual as moléculas de glicose são quebradas pela ação de enzimas reguladas pela insulina, um hormônio produzido pelo pâncreas. Nesse processo, formam-se duas moléculas de adenosina trifosfato (ATP), que armazenam energia, e duas moléculas de piruvato, que são utilizadas em outros processos para gerar mais ATP.
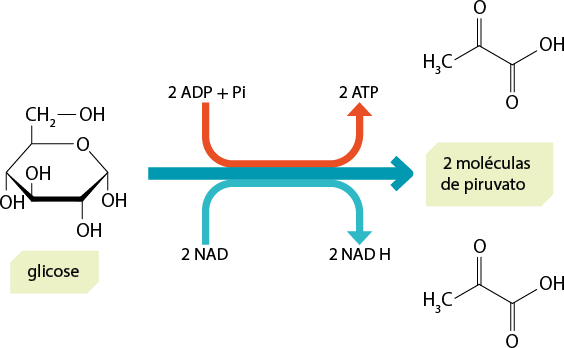
Professor, professora: Comente que a glicose é um dos produtos da quebra da sacarose, o açúcar mais comum presente nos alimentos, formado por uma unidade de glicose e uma unidade de frutose.
Sem a quantidade adequada de insulina, a glicose se acumula no sangue, causando dois tipos de doença.
Diabetes tipo I
- Causa: desconhecida, mas sabe-se que é uma doença crônica e hereditária.
- Manifestação: infância, adolescência ou fase adulta.
- Tratamento: uso contínuo de insulina e/ou outros medicamentos.
- Controle/prevenção: hábitos saudáveis.
Diabetes tipo II
- Causa: sobrepeso, colesterol alto e hipertensão, decorrentes de sedentarismo e hábitos alimentares inadequados.
- Manifestação: majoritariamente em adultos, porém tem-se registrado aumento de casos em crianças e adolescentes.
- Controle/prevenção: hábitos saudáveis e acompanhamento com profissionais.
O acompanhamento do diabetes envolve o monitoramento dos níveis de glicose no sangue. Para a Sociedade Brasileira de Diabetes, a concentração normal desse carboidrato deve estar entre 70 e 100 miligramas barra decilitro de sangue, em jejum. Concentrações inferiores a 70 miligramas barra decilitro caracterizam hipoglicemia. Entre 100 e 125 miligramas barra decilitro, é considerado pré-diabético. Já a hiperglicemia apresenta valores superiores a 126 miligramas barra decilitro.
O diabetes pode afetar significativamente a qualidade de vida das pessoas, gerando problemas cardiovasculares, danos nos nervos e problemas nos rins e olhos, além dos impactos emocionais.
Página 159
[…]
Até o início do século XX, as pessoas com diabetes eram tratadas com uma dieta rigorosa, com um consumo extremamente baixo de calorias, que poderia ser tão fatal quanto a própria doença. "A insulina é marco na história da medicina, porque as pessoas com diabetes tipo 1, cujo organismo não produz esse hormônio, estavam condenadas a morrer em algumas semanas após a doença se manifestar', diz o endocrinologista Domingos Malerbi, presidente da Sociedade Brasileira de Diabetes (SBD) e presidente do Departamento de Diabetes da Sociedade Brasileira de Endocrinologia e Metabologia (SBEM). […]
FIORAVANTI, Carlos. A descoberta da insulina. Pesquisa Fapesp, São Paulo, n. 302, abr. 2022. p. 90-93.
Graças aos avanços científicos, o tratamento do diabetes tem melhorado. Até o final da década de 1980, a insulina era extraída do pâncreas de porcos, depois passou a ser produzida em laboratório com técnicas de engenharia genética, tornando o tratamento mais seguro e acessível. Além disso, medicamentos para controle vêm sendo desenvolvidos, a exemplo da semaglutida.
Esse medicamento é indicado aos indivíduos com diabetes tipo II, que precisam controlar rigorosamente a alimentação. Porém, o paciente ainda deve equilibrar diferentes formulações e doses, acompanhar o nível de glicose e ter a insulina sempre em mãos. Esse medicamento também acarreta efeitos colaterais como náuseas, vômitos e constipação. Por isso, seu uso deve ser acompanhado por um médico.
Outra inovação no controle do diabetes são os dispositivos desenvolvidos para facilitar o acompanhamento da glicemia, como glicosímetros portáteis. Esse tipo de dispositivo traz mais conforto ao indivíduo, pois diminui as consultas em hospital e promove um monitoramento mais rápido da glicemia.
Além disso, tecnologias vêm sendo desenvolvidas nessa área em busca de dispositivos de monitoramento cada vez menos invasivos. Os produtos desenvolvidos até o momento têm limitação tecnológica e falta de precisão, exatidão e confiabilidade. Mas, no geral, as pesquisas buscam criar medidores de glicemia que utilizem amostras de urina, suor e saliva. Esses dispositivos seriam equipados com detectores específicos e poderiam medir a glicemia de forma semelhante aos sistemas de monitoramento de pressão arterial e ritmo cardíaco integrados a smartwatches.

a ) Você conhece alguém que tem diabetes? Quais cuidados essa pessoa precisa ter em seu dia a dia?
Resposta pessoal. Caso conheçam, espera-se que os estudantes respondam que o diabético deve monitorar o nível de glicemia, cuidar de sua alimentação, praticar atividades físicas, realizar acompanhamento médico regularmente etc.
b ) Qual é a importância das tecnologias recentes que ainda estão sendo desenvolvidas para fornecer qualidade de vida às pessoas com diabetes?
Resposta pessoal. Espera-se que os estudantes comentem que as tecnologias podem contribuir desde as medicações até as tecnologias de monitoramento.
c ) Pesquise como a insulina é produzida com as técnicas atuais. Qual é a importância desse avanço científico para os pacientes?
Resposta: Atualmente, a produção de insulina é induzida em bactérias geneticamente modificadas. A produção de insulina transgênica proporcionou um aumento na oferta desse medicamento, além de ter tornado seu uso mais seguro.
d ) Qual é a importância da alimentação e da atividade física para as pessoas com diabetes? E para quem não tem essa doença?
Resposta: A alimentação saudável e a atividade física são essenciais para controlar a glicemia dos diabéticos. Além disso, esses hábitos são importantes para diminuir as chances de desenvolver diabetes tipo II.
Página 160
ATIVIDADES
1. Os antioxidantes são compostos comumente adicionados em alimentos industrializados para aumentar o prazo de validade, pois reduzem a velocidade de algumas reações químicas que alteram as características do produto.
A seguir, estão representadas as estruturas químicas de quatro antioxidantes.
A.
B.
C.
D.
a ) Quais são as funções orgânicas presentes em cada um dos antioxidantes apresentados?
b ) Qual é a função orgânica comum nos quatro compostos?
c ) Pesquise o significado das siglas referentes a cada um desses antioxidantes.
d ) Quais são as nomenclaturas de cada antioxidante de acordo com a União Internacional de Química Pura e Aplicada (IUPAC)?
e ) Em sua casa, procure rótulos de alimentos que contenham antioxidantes e escrevam quais são esses alimentos.
Respostas nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
e ) Com um familiar, procure em sua casa rótulos de alimentos que contenham antioxidantes e anote quais são esses alimentos.
Resposta pessoal. Os estudantes podem citar óleo vegetal, manteiga, ketchup, maionese, entre outros.
2. Para limpar equipamentos eletrônicos, recomenda-se utilizar uma solução de álcool isopropílico. Escolha a alternativa que apresenta a nomenclatura oficial e a fórmula química correspondente a esse composto.
a ) Propan-2-ol e C subscrito 3 H subscrito 8 O.
b ) Propanona e C subscrito 3 H subscrito 8 O.
c ) Propanol e C subscrito 3 H subscrito 6 O.
d ) Propanal e C subscrito 3 H subscrito 6 O.
e ) Propanol e C subscrito 3 H subscrito 10 O.
Resposta: Alternativa a.
3. A erva-dos-gatos, conhecida como catnip, é uma planta do gênero Nepeta L. que afeta o comportamento de felinos, como gatos domésticos, leões, tigres e leopardos. Cerca de dois terços dos gatos domésticos são afetados pelos compostos chamados nepetalactonas, que podem imitar seus feromônios. Há estudos que indicam que eles servem também como repelentes contra insetos.
Erva-do-gato (Nepeta cataria): pode atingir aproximadamente 91 centímetros de altura.
Gato (Felis catus): pode atingir aproximadamente 76 centímetros de comprimento.

A biossíntese da nepetalactona, nessas plantas, ocorre em várias etapas por meio do composto geraniol.
A.
B.
a ) Quais são as funções químicas em cada uma dessas substâncias?
Resposta: No geraniol, há a função orgânica álcool. Na nepetalactona, éter e álcool.
b ) Em termos estruturais, qual é a semelhança entre essas funções?
Resposta: Ambas as estruturas são ramificadas por metilas e apresentam hidroxila do álcool e insaturações.
Página 161
4. A fava de baunilha é obtida da orquídea chamada Vanilla planifolia. Ela e seu extrato são utilizados como flavorizantes em confeitos. O composto responsável por proporcionar o aroma é a vanilina, e sua estrutura química está representada a seguir.
Sobre esse composto, identifique cada informação como verdadeira ou falsa.
I ) Esse composto tem a função orgânica de ácido carboxílico.
Resposta: Falsa. Para ter a função ácido carboxílico, a estrutura precisaria ter uma carboxila (carbono ligado a um oxigênio por dupla-ligação e uma hidroxila por ligação simples).
II ) Esse composto é um tipo de álcool.
Resposta: Falsa. Apesar de ter uma hidroxila, ela está ligada a um anel aromático, o que caracteriza a função fenol.
III ) Esse composto tem as funções orgânicas aldeído e éter.
Resposta: Verdadeiro.
IV ) O nome oficial da vanilina é 4-hidroxi-3-metoxibenzaldeído.
Resposta: Verdadeiro.
V ) Esse composto é aromático e apresenta heteroátomo.
Resposta: Verdadeiro.
5. Em alguns casos, a mesma fórmula química pode corresponder a compostos químicos diferentes.
I ) Para a fórmula química C subscrito 2 H subscrito 6 O, é possível ter as funções:
a ) álcool e ácido carboxílico.
b ) ácido carboxílico e fenol.
c ) éster e enol.
d ) éter e álcool.
Resposta: Alternativa d.
II ) Quais são as nomenclaturas dos possíveis compostos cuja fórmula química é C subscrito 3 H subscrito 6 O subscrito 2?
a ) Metoxietano e ácido propanoico.
b ) Propanol e propanal.
c ) Ácido propanoico e etanoato de metila.
d ) Propanona e metoximetano.
Resposta: Alternativa c.
6. Escreva as estruturas químicas dos seguintes compostos.
a ) Etanol.
b ) Etoxietano.
c ) Metanal.
d ) Propan-2-ol .
e ) Butanona.
f ) Ácido etanoico.
g ) 3-metil-fenol .
h ) Etanoato de butila.
Respostas nas Orientações para o professor.
Atividade(s) adaptada(s) acessível(is)
11. Descreva as estruturas químicas dos seguintes compostos.
a ) Etanol.
Resposta: Ligados por ligação simples, há um grupo C H subscrito 3 ligado a um C H subscrito 2 e um O H.
b ) Etoxietano.
Resposta: Ligado por ligações simples, há dois grupos C H subscrito 3 C H subscrito 2 ligados a um O.
c ) Metanal.
Resposta: Há um carbono ligado a dois hidrogênios por ligações simples e um oxigênio por ligação dupla.
d ) Propan-2-ol.
Resposta: Por ligações simples, há dois grupos C H subscrito 3 ligados a um carbono que está ligado a um grupo O H e um H.
e ) Butanona.
Resposta: Ligado por ligações simples, há uma sequência de quatro carbonos: C H subscrito 3, C, C H subscrito 2 e C H subscrito 3. No segundo carbono, há uma ligação dupla com um O.
f ) Ácido etanoico.
Resposta: Há um grupo C H subscrito 3 ligado por ligação simples a um carbono que faz ligação simples com um O H e ligação dupla com um O.
g ) 3-metil-fenol.
Resposta: Há um ciclo de seis carbonos, com ligações simples e duplas alternadas. O primeiro carbono está ligado a um grupo O H, o terceiro a um grupo C H subscrito 3 e os demais estão ligados cada um a um átomo de hidrogênio.
h ) Etanoato de butila.
Resposta: Há um grupo C H subscrito 3 ligado a um carbono que faz ligação dupla com um O e ligação simples com outro O, o qual está ligado a uma sequência de quatro carbonos ligados por ligações simples: C H subscrito 2, C H subscrito 2, C H subscrito 2 e C H subscrito 3.
7. Analise as estruturas químicas a seguir, correspondentes aos hormônios testosterona e estradiol.
A.
B.
Em relação a essas estruturas, responda às questões a seguir.
a ) Quais são as fórmulas moleculares dos hormônios apresentados?
Resposta: Testosterona: C subscrito 19 H subscrito 28 O subscrito 2; estradiol: C subscrito 18 H subscrito 24 O subscrito 2.
b ) Quais são as funções orgânicas presentes nas moléculas de testosterona e estradiol?
Resposta: Testosterona: cetona e álcool; estradiol: fenol e álcool.
c ) Qual é a importância desses hormônios para o organismo? Se necessário, faça uma pesquisa.
Resposta: A testosterona é o hormônio sexual masculino, responsável pelo desenvolvimento dos genitais e das características masculinas na puberdade, além de aumentar a taxa metabólica e influenciar a libido. Já o estradiol é um hormônio sexual feminino e atua na regulação do ciclo menstrual.
8. Dos compostos representados a seguir, qual pertence somente ao grupo dos álcoois?
A.
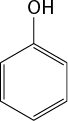
B.
C.
D.
Resposta: Alternativa C.
Página 162
Funções nitrogenadas
A erva-mate é rica em cafeína (teor entre 2% e 5%, maior que o do café cujo teor está entre 1% e 2%) e em teobromina abre parênteses C subscrito 7 H subscrito 8 N subscrito 4 O subscrito 2 fecha parênteses, que também pode ser encontrada no café e no chocolate. Ao ser consumida, tende a aumentar o estado de alerta da pessoa e lhe dá uma sensação de bem-estar, pois é capaz de favorecer a liberação dos hormônios adrenalina abre parênteses C subscrito 9 H subscrito 13 N O subscrito 3 fecha parênteses e dopamina abre parênteses C subscrito 8 H subscrito 11 N O subscrito 2 fecha parênteses no sangue. Em alguns casos, no entanto, pode comprometer o sono e causar dores de cabeça, taquicardia, palpitações, gastrite e alterações de humor.

9. Átomos de quais elementos químicos estão presentes na cafeína?
Resposta: Espera-se que os estudantes citem átomos de carbono, hidrogênio, oxigênio e nitrogênio.
10. Você consome alimentos ricos em cafeína? Quais?
Resposta: Resposta pessoal. O objetivo desta questão é que os estudantes identifiquem alimentos ricos em cafeína que fazem parte de sua alimentação.
11. O que o consumo de cafeína em excesso pode provocar?
Resposta: Os estudantes podem responder que o consumo de cafeína em excesso pode provocar insônia, dor de estômago, tremor, alterações nos batimentos cardíacos, entre outros efeitos.
A erva-mate representa um legado histórico e cultural que conecta os gaúchos aos povos indígenas Guarani, que antigamente habitavam o território que abrange desde a Amazônia até o Rio da Prata. A planta era utilizada por esses povos indígenas em rituais e como fonte de energia. Os guaranis preparavam a infusão da erva-mate em cuias, transmitindo para as próximas gerações seus conhecimentos sobre a planta e seus benefícios.
Atualmente, a erva-mate é um produto de grande consumo e que faz parte da cultura e da economia de Paraguai, Brasil, Uruguai e Argentina. Sua relevância para essas populações se reflete em inúmeras manifestações e tradições culturais, como em músicas, contos populares, mitos e lendas.
Os compostos orgânicos com função nitrogenada são substâncias que contêm átomos de carbono, hidrogênio e nitrogênio abre parênteses N fecha parênteses. A cafeína é um exemplo de função orgânica nitrogenada.
Há diferentes tipos de funções nitrogenadas, e cada uma é definida pela forma como os átomos de nitrogênio estão ligados à molécula. A seguir, serão apresentadas as características de algumas delas.
Amina
A dopamina é um neurotransmissor encontrado nos seres vivos e funciona como mensageiro químico, levando informações de um neurônio para uma célula receptora. Está envolvida em processos como o controle motor, a cognição, o prazer, o humor, algumas funções endócrinas, entre outras ações. Observe a seguir a fórmula estrutural desse composto e note que ele apresenta a função orgânica fenol, com duas hidroxilas ligadas ao anel benzênico, e a função amina, em razão da presença do átomo de nitrogênio.
Professor, professora: Ao abordar o efeito da dopamina no organismo, comente com os estudantes que algumas pessoas desenvolvem compulsão pelo uso de redes sociais porque essas plataformas podem ser projetadas para recompensar os usuários. Durante o uso, as pessoas podem receber incentivos positivos, como curtidas e comentários, e a dopamina é produzida, provocando a sensação de prazer. Esse efeito pode causar vício.
Página 163
A amina é o grupo funcional que apresenta um átomo de nitrogênio ligado a um átomo de carbono por meio de ligações simples. São compostos polares, em que as aminas primárias – ligadas apenas a um carbono – e secundárias – ligadas a dois carbonos – são capazes de realizar ligações de hidrogênio (interações intermoleculares intensas). Dessa forma, apresentam temperaturas de fusão e de ebulição mais elevadas do que os de compostos apolares.
Em geral, a nomenclatura das aminas é dada pela indicação do(s) grupo(s) orgânico(s) ligado(s) ao átomo de nitrogênio acrescida da palavra amina. Confira os exemplos a seguir.
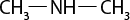
Vários tipos de medicamentos são preparados com aminas, como psicotrópicos✚ e farmacológicos. Algumas aminas são utilizadas como tensoativos e alguns explosivos e corantes orgânicos são produzidos com aminas aromáticas.
A função das aminas faz parte de uma importante classe de biomoléculas, os aminoácidos, que são as unidades básicas das proteínas. Como podemos observar pelo seu nome, os aminoácidos são compostos que apresentam as funções amina e ácido carboxílico. Observe a seguir a fórmula estrutural de dois aminoácidos.


Há centenas de aminoácidos na natureza, mas apenas 20 deles são responsáveis por formar todas as proteínas. Esses aminoácidos são conhecidos como padrões e estão presentes nas moléculas de todas as proteínas. Todos apresentam as funções ácido carboxílico e amina, e diferenciam-se entre si pelo restante da sua cadeia carbônica. A imagem a seguir mostra alguns alimentos ricos em proteínas.
Imagem sem proporção.

12. Você ingere alimentos ricos em proteína? Quais consideraria ingerir?
Resposta pessoal. O objetivo desta questão é levar os estudantes a avaliar sua alimentação e melhorá-la, além de indicarem os alimentos de origem animal (principalmente) e vegetal ricos em proteína.
- Psicotrópicos:
- substâncias que atuam na parte central do sistema nervoso, alterando temporariamente algumas características da pessoa, como percepção, comportamentos e humor. ↰
Página 164
Amida
Ao serem metabolizadas no organismo dos mamíferos, as proteínas são decompostas em outras substâncias, entre elas a ureia abre parênteses C H subscrito 4 N subscrito 2 O fecha parênteses, que é excretada por meio da urina. Altos níveis de ureia na corrente sanguínea indicam possíveis problemas nos rins, pois não estão filtrando o sangue de forma eficaz.
Imagens desta página sem proporção.
13. Converse com os colegas sobre a importância do bom funcionamento dos rins para o nosso organismo.
Resposta: Espera-se que os estudantes comentem que os rins filtram o sangue, retirando do organismo o excesso de água e de outras substâncias que precisam ser eliminadas. Como resultado dessa filtração, é formada a urina.
A ureia também pode ser sintetizada industrialmente por meio do gás carbônico e do gás amônia abre parênteses N H subscrito 3 fecha parênteses. Essa substância é muito utilizada como fertilizante para as plantações. Nesse caso, a ureia pode ser distribuída tanto manualmente como por equipamentos agrícolas específicos, na forma de grânulos ou soluções fertilizantes, por ser solúvel em água. Além disso, a ureia pode compor a alimentação do gado.

A produção de ureia geralmente segue um processo industrial específico que envolve o gás carbônico e o gás amônia. Primeiro, ocorre a decomposição do gás metano abre parênteses CH subscrito 4 fecha parênteses em altas temperaturas, que produz o gás hidrogênio abre parênteses H subscrito 2 fecha parênteses e que é combinado com o nitrogênio abre parênteses N subscrito 2 fecha parênteses, obtendo amônia líquida. Em seguida, a amônia é transformada em carbamato de amônio abre parênteses N H subscrito 2 C O O N H subscrito 4 fecha parênteses com dióxido de carbono e, finalmente, o carbamato de amônio é desidratado, obtendo-se a ureia.
Decomposição do metano: C H subscrito 4 seta para a direita C mais 2 H subscrito 2
Formação da amônia: N subscrito 2 mais 3 H subscrito 2 seta para a direita 2 N H subscrito 3
Formação do carbamato de amônio e ureia: 2 N H subscrito 3 mais C O subscrito 2 seta para a direita N H subscrito 2 C O O N H subscrito 4 seta para a direita N H subscrito 2 C O N H subscrito 2 mais H subscrito 2 O
A ureia apresenta a função orgânica amida. As amidas são compostos orgânicos que têm a carbonila ligada diretamente ao átomo de nitrogênio.
Confira a seguir como é formada a nomenclatura oficial das amidas.
| Exemplo | Prefixo (número de carbonos) mais | Parte intermediária (tipo de ligação química) mais | amida |
|---|---|---|---|
|
Etanamida abre parênteses C subscrito 2 H subscrito 5 N O fecha parênteses |
et |
an |
amida |
|
Propanamida abre parênteses C subscrito 3 H subscrito 7 N O fecha parênteses |
prop |
an |
amida |
As poliamidas são materiais que têm uma ampla utilização na indústria têxtil, na medicina (em procedimentos como pontos cirúrgicos) e na pescaria (como o fio de pesca preso à vara).

Página 165
Isomerias
A fórmula molecular dos compostos etanol e metoximetano é C subscrito 2 H subscrito 6 O. Embora tenham a mesma fórmula molecular, suas fórmulas estruturais são diferentes, conforme mostrado a seguir.
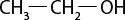
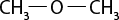
Confira a seguir as propriedades físicas e químicas dessas substâncias, que também se diferem.
| Substância | Temperatura de ebulição abre parênteses grau Celsius fecha parênteses | Densidade abre parênteses grama barra centímetro cúbico fecha parênteses | Reação com o potássio |
|---|---|---|---|
|
Etanol |
78 vírgula 5 |
0 vírgula 79 |
sim |
|
Metoximetano |
menos 24 vírgula 8 |
0 vírgula 67 |
não |
Os compostos químicos que apresentam a mesma fórmula molecular e diferentes fórmulas estruturais são denominados isômeros (traduzido do grego, isos = igual, meros = partes).
Isomeria constitucional
Os isômeros constitucionais podem ter diferenças quanto aos seguintes aspectos:
- tipo de cadeia;
- função orgânica;
- posição de heteroátomos, grupos funcionais, ramificações e insaturações.
O exemplo envolvendo o etanol e o metoximetano é um caso de isomeria envolvendo função, pois os compostos apresentam funções orgânicas diferentes (álcool e éter).
Quando os isômeros apresentam a mesma função orgânica e têm cadeias diferentes (normal/ramificada ou aberta/fechada), trata-se de isomeria envolvendo o tipo de cadeia, como mostrado a seguir.
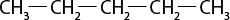
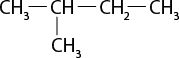
A diferença na posição de um grupo funcional, ramificação ou insaturação constitui uma isomeria envolvendo a posição do aspecto em questão, como ocorre nos exemplos a seguir.
a ) Mudança na posição do grupo funcional.
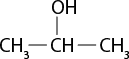
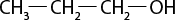
b ) Mudança na posição de uma ramificação.
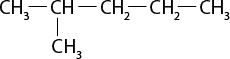
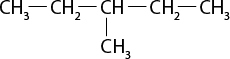
c ) Mudança na posição da instauração.
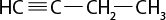

Página 166
d ) Mudança na posição de um heteroátomo.
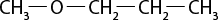
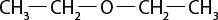
Estereoisomeria
Os estereoisômeros apresentam a mesma fórmula molecular e a mesma fórmula estrutural plana, diferenciando-se por suas fórmulas estruturais espaciais. Portanto, são constituídos pelos mesmos átomos e mesmas ligações químicas, mas em posições espaciais diferentes, o que lhes confere propriedades distintas. Eles podem ser classificados como diastereoisômeros e enantiômeros.
Os diastereoisômeros são compostos isômeros que não são a imagem um do outro em um espelho. Já os enantiômeros são isômeros que são a imagem um do outro em um espelho. Analise a seguir dois exemplos.
Imagens desta página sem proporção e em cores fantasia.
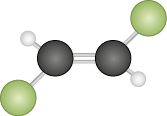
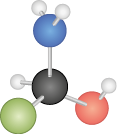
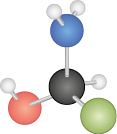
Diastereoisômeros
A diastereoisomeria ocorre quando há uma dupla-ligação entre dois átomos de carbono. A presença da ligação dupla não permite a rotação entre eles, pois ela é rígida. Isso possibilita a formação de duas estruturas diferentes, que são chamados de cis e trans. Observe as imagens a seguir.
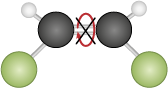
Isso também ocorre em cadeias cíclicas, pois as ligações entre os carbonos também têm impedimento de rotação.
Para que a formação das estruturas cis e trans seja possível, são necessárias algumas condições, como mostra a estrutura a seguir.
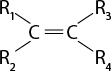
Os ligantes de cada carbono da ligação dupla devem satisfazer à seguinte condição: que R subscrito 1 seja diferente de R subscrito 2, R subscrito 3 seja diferente de R subscrito 4 e que um ligante do lado esquerdo seja igual a um ligante do lado direito.
Página 167
A seguir, alguns exemplos de como podem ser representados os isômeros cis e trans:


Os ácidos graxos insaturados são componentes das gorduras e podem se apresentar na forma cis ou trans.


Compartilhe ideias
A gordura trans é pouco comum na natureza, mas é produzida com gorduras vegetais pela indústria alimentícia. O consumo de gorduras trans tem sido associado a problemas de saúde, logo recomenda-se evitá-la.
a ) Junte-se a um colega e pesquisem os principais problemas de saúde associados ao consumo de alimentos com gorduras trans. Em seguida, confiram se os rótulos dos alimentos industrializados que vocês geralmente consomem indicam a presença de gordura trans ou não.
Resposta: Espera-se que os estudantes percebam que o consumo de gordura trans, principalmente proveniente de alimentos industrializados, aumenta os níveis do colesterol LDL e os riscos de problemas cardiovasculares. Espera-se que verifiquem as informações referentes à gordura trans presentes em diversos alimentos industrializados, principalmente nos que eles geralmente ingerem no cotidiano. Esta atividade leva-os a refletir sobre possíveis mudanças de hábitos a fim de cuidar da própria saúde.
b ) Conversem sobre os malefícios do consumo de gordura trans e elaborem cartazes informativos. Neles, listem os alimentos com gordura trans que vocês mais consomem, sugerindo opções para substituí-los.
Exponham os cartazes na sala de aula.
Resposta pessoal. Esta atividade tem o objetivo de fazer os estudantes compartilharem os resultados obtidos e proporem alternativas para uma alimentação saudável.
Enantiômeros
Os enantiômeros são opticamente ativos, ou seja, desviam o plano da luz polarizada e são formados por estruturas assimétricas. Uma substância com estrutura assimétrica não tem plano de simetria.
Dica
Um raio de luz natural é constituído de ondas eletromagnéticas que oscilam em infinitos planos de vibração e que passam pelo eixo de propagação. Há certos materiais que, ao serem atravessados pela luz natural, deixam passar apenas as vibrações de determinado plano, absorvendo as demais. Nesse caso, tem-se a luz polarizada. A substância que desvia o plano da luz polarizada é uma substância opticamente ativa.
Página 168
O exemplo de molécula orgânica assimétrica apresenta, ao menos, um carbono assimétrico. É considerado carbono assimétrico abre parênteses C asterisco fecha parênteses aquele que contém quatro ligantes distintos entre si, podendo também ser chamado de estereocentro ou centro de quiralidade.
A molécula 2-pentanol é um exemplo de molécula orgânica com um carbono assimétrico, pois o segundo carbono tem quatro ligantes distintos: um grupo metil, um grupo propil, um átomo de hidrogênio e um grupo O H.
Imagem sem proporção e em cores fantasia.

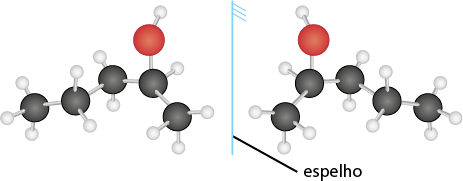
Dica
Na fórmula estrutural, a cunha sólida indica que a ligação está à frente do plano da página, e a cunha tracejada indica que a ligação está atrás do plano da página.
Os exemplos mostrados anteriormente ilustram imagens especulares não sobreponíveis dessas moléculas. Mesmo que viremos a molécula de todas as maneiras possíveis, concluiremos que não é possível sobrepô-la à sua imagem, portanto são enantiômeros. Eles têm as mesmas propriedades físicas, logo apresentam mesmas densidade e fusão e os mesmos pontos de ebulição.
Para identificar se a amostra contém substância quiral e conferir qual é o enantiômero, utiliza-se um equipamento chamado polarímetro. A luz polarizada passa por uma solução contendo um isômero óptico. O plano de polarização da luz é rotacionado para a direita ou para a esquerda, diferenciando o enantiômero.

Há isômeros com fórmulas estruturais bem semelhantes e que são produzidos por meio da mesma reação química. É necessário ficar atento às propriedades desses isômeros, pois a configuração espacial dos enantiômeros faz que eles tenham efeitos diferentes no organismo. Um isômero pode ser totalmente inerte em relação a um receptor do organismo, enquanto o outro pode ter um efeito inesperado.
No início da década de 1960, a Alemanha apresentou diversos casos de crianças que nasciam com malformações. A origem desses problemas estava associada a uma substância ingerida pelas respectivas mulheres grávidas para reduzir os sintomas de enjoo: a talidomida abre parênteses C subscrito 13 H subscrito 10 N subscrito 2 O subscrito 4 fecha parênteses.

A talidomida comercializada era uma mistura de enantiômeros, e um deles causava malformações, o que chamamos de efeito teratogênico. Com esse incidente, a indústria farmacêutica passou a aprimorar a produção de medicamentos seguros cujas moléculas apresentavam esse tipo de isomeria.
14. Converse com um colega sobre a importância de realizar diversos testes envolvendo novos medicamentos, antes de comercializá-los. Anote suas conclusões.
Resposta: Espera-se que os estudantes comentem que a execução de vários testes, sob diferentes condições, é necessária para avaliar a eficácia e a segurança dos medicamentos, identificando as dosagens mais adequadas, contraindicações, efeitos colaterais e possíveis riscos.
15. Pesquise qual é o órgão brasileiro responsável por fiscalizar e regular a comercialização dos medicamentos.
Resposta: Espera-se que os estudantes citem a Agência Nacional de Vigilância Sanitária (Anvisa).
Página 169
ATIVIDADES
1. De acordo com o Instituto Nacional de Câncer (Inca), o tabagismo é considerado uma doença crônica causada pela dependência de nicotina, que está presente em produtos à base de tabaco. Também está associado a muitos tipos de câncer e aumenta o risco de contrair doenças crônicas não transmissíveis. A nicotina é um composto tóxico e viciante. Analise a estrutura desse composto.
a ) Qual é a fórmula molecular da nicotina?
Resposta: C subscrito 10 H subscrito 14 N subscrito 2
b ) A nicotina apresenta em sua estrutura o anel benzênico?
Resposta: Não.
c ) Qual é a principal função orgânica presente na estrutura da nicotina?
Resposta: Amina.
2. Os aminoácidos são os principais constituintes das proteínas. Os aminoácidos sintetizados pelo nosso organismo chamam-se não essenciais e suprem as necessidades celulares. Já os aminoácidos não sintetizados pelo organismo humano precisam compor nossa alimentação e são conhecidos como aminoácidos essenciais.
A valina é um exemplo de aminoácido essencial. Carne, peixe, leite, feijão e castanha são alguns dos principais alimentos que contêm esse aminoácido. Identifique a alternativa que indica apenas as funções orgânicas encontradas na molécula de valina.
a ) Álcool e amida.
b ) Amida e amina.
c ) Cetona e amina.
d ) Éster e éter.
e ) Ácido carboxílico e amina.
Resposta: Alternativa e.
3. A lidocaína é utilizada como anestésico de ação local, podendo também ser usada como tratamento para arritmias e outras doenças cardíacas.
Analisando a fórmula estrutural da lidocaína, identifique as funções orgânicas presentes, considerando também a classificação das aminas em primária, secundária e terciária e, em seguida, identifique a alternativa correta.
a ) Amida e amina terciária.
b ) Apenas grupos amidas.
c ) Cetona e amina.
d ) Apenas grupos aminas.
e ) Amida e amina primária.
Resposta: Alternativa a.
4. Qual das alternativas a seguir apresenta o isômero da substância 5-metil-hexan-3-ona?
a ) 2-metil-hexanoico.
b ) 2,2,3,3-metil-hexanol.
c ) Heptan-3-ona.
d ) Hexan-3-ona.
e ) 4-metil-pentan-2-ona.
Resposta: Alternativa c.
5. Considere os compostos a seguir.
I. hept-1-eno.
II. hexan-3-ol.
III. 2,3-dimetilbutano.
IV. 2,2-dimetilbutano.
V. ciclopentano.
VI. pent-2-ino.
VII. 3-metil-2-pentanona.
Qual desses compostos apresentaria atividade ótica ao ser analisado em polarímetro?
a ) Compostos III e VII.
b ) Compostos II e VII.
c ) Compostos IV, II e V.
d ) Compostos I, III e VI.
e ) Apenas II.
Resposta: Alternativa b.
Página 170
6. Leia o trecho da lenda a seguir e responda ao que se pede.
Professor, professora: Comentários da questão 6 nas Orientações para o professor.
A Lenda da Erva-mate
Lenda do folclore gaúcho
[…] O forasteiro revelou que era um enviado de Tupã, e que este estava preocupado com a sorte daquela pequena família.
– Diga-me, velho senhor, o que gostaria de ter? Como posso lhe ajudar?
– Minha filha não acompanha nosso povo porque quer cuidar de mim. Eu gostaria de ter um amigo que me fizesse companhia, me ajudasse a passar o tempo e me desse mais forças, para que eu pudesse ficar sozinho.
– Pois está feito! Vou lhe trazer exatamente o que precisas!
O homem foi à mata e voltou trazendo um galho da árvore Caá. Era verde e muito perfumado.
– Plante e deixe crescer. Depois, tire outras mudas e vá plantando e replantando esse arbusto, para que se multiplique. Essa erva dá um excelente chá. Vamos, vou lhe ensinar como fazer!
O enviado de Tupã preparou a infusão numa cabaça, colocou um canudo de taquara e ensinou o velho a sorver.
– Está aí o amigo que querias! Suas forças voltarão e você poderá caçar e trabalhar novamente! […]
CAMPOS, Maria Fernanda. A lenda da erva-mate. Instituto Purunã, 3 nov. 2020. Disponível em: https://s.livro.pro/jzp7dr. Acesso em: 23 ago. 2024.
a ) De acordo com a lenda, qual é a função das propriedades da erva-mate?
Resposta: As propriedades da erva-mate, de acordo com a lenda, ajudam a recuperar as forças.
b ) Quais são os principais componentes da erva-mate que a fazem ter o efeito relatado na lenda?
Resposta: Os componentes responsáveis por tais efeitos são a cafeína e a teobromina.
c ) Relacione as estruturas moleculares a seguir com os componentes identificados anteriormente. Qual(is) é (são) a (as) função(ões) orgânica(s) presente(s) nesses compostos?

Resposta: Cafeína. Apresenta função orgânica amida e amina.
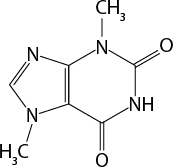
Resposta: Teobromina. Apresenta função orgânica amida e amina.
d ) O penúltimo parágrafo do trecho da lenda explica como se faz o chá. Considerando as estruturas do item anterior, explique por que seu preparo necessita apenas de água.
Resposta: Ao analisar as fórmulas estruturais da cafeína e da teobromina, verifica-se que são moléculas polares. Dessa maneira, basta água quente para extrair essas substâncias da erva-mate.
7. Sabendo que os isômeros são dois ou mais compostos diferentes com a mesma fórmula molecular, o etoxietano é isômero do:
a ) ácido butanoico.
b ) butanal.
c ) butanona.
d ) butanol.
e ) etoxibutano.
Resposta: Alternativa d.
8. Analise a estrutura dos aminoácidos a seguir.
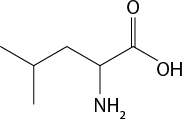
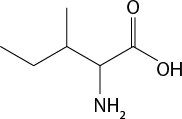
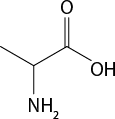
a ) Escreva o número de carbonos assimétricos em cada aminoácido.
Resposta: Leucina: 1. Isoleucina: 2. Alanina: 1.
b ) Quais são as funções orgânicas presentes nos compostos apresentados?
Resposta: Amina e ácido carboxílico.
Página 171
9. Quais compostos a seguir são isômeros de cadeia aberta e não ramificada de fórmula molecular C subscrito 5 H subscrito 10? Justifique sua resposta detalhando o tipo de isomeria.
A.

B.
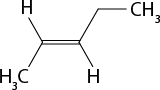
C.
D.
Resposta: Os compostos A e B apresentam a fórmula molecular C subscrito 5 H subscrito 10, e possuem cadeia aberta e não ramificada, portanto, apresentam entre si, isomeria de posição, em relação à insaturação.
10. Quais são as funções orgânicas presentes na molécula de frutose e quantos carbonos assimétricos ela tem?
Resposta: A frutose tem as funções cetona e álcool e apresenta 3 carbonos assimétricos, nos carbonos 3, 4 e 5 da cadeia principal.
11. A substância química adrenalina é um hormônio liberado em maior quantidade pelo organismo em situações de estresse, medo ou raiva, o que eleva temporariamente a frequência cardíaca do indivíduo.
Analise a fórmula estrutural da adrenalina e responda ao que se pede.
a ) Quais são as funções químicas presentes na substância química adrenalina?
Resposta: Fenol, álcool e amina.
b ) Qual é a fórmula molecular da substância citada?
Resposta: C subscrito 9 H subscrito 13 N O subscrito 3
c ) A substância adrenalina apresenta carbono assimétrico em sua estrutura? Caso tenha, em qual(is) carbono(s)?
Resposta: Sim. No carbono ligado à hidroxila, anel aromático e outro carbono ligado ao nitrogênio.
RETOME O QUE ESTUDOU
Imagens desta página sem proporção e em cores fantasia.
Refletindo sobre o que estudou nesta unidade, responda às questões a seguir.
1. Caracterize a ligação metálica e explique por que os metais são bons condutores de eletricidade.
2. Analise as imagens a seguir e classifique as substâncias em polares ou apolares. Explique como podemos classificá-las dessa forma apenas observando a geometria de sua molécula.
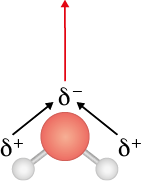
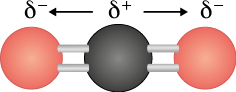
3. Indique, com base na fórmula molecular C subscrito 6 H subscrito 6, a nomenclatura de um hidrocarboneto cíclico e insaturado e a de um hidrocarboneto de cadeia aberta e insaturado.
4. A fórmula química do etanol e do metoximetano é C subscrito 2 H subscrito 6 O. O que diferencia essas substâncias? Como é chamada essa situação?
Respostas nas Orientações para o professor.
Página 172
MAIS QUESTÕES
1. (Enem/MEC) Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5 's' elevado ao quadrado 5 p elevado a 6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demostram que não pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2 's' elevado ao quadrado 2 p elevado a 5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
a ) 6
b ) 8
c ) 10
d ) 12
e ) 14
Resposta: Alternativa c.
2. (Fuvest-SP) Um tema de grande interesse na química é a ativação seletiva de ligações C traço H. Essa ativação permite a substituição de H nessas ligações por outros átomos, como O ou N. A relevância desse tema pode ser verificada em um estudo recentemente publicado no prestigioso periódico Science, que conta com uma egressa da USP dentre seus autores.
A baixa diferença de eletronegatividade entre C e H é um dos motivos que dificulta a ativação da ligação C traço H, pois torna a ligação pouco polar e diminui sua reatividade.
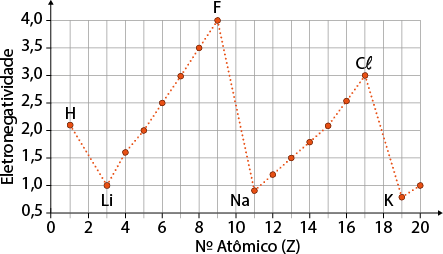
Considerando apenas a eletronegatividade, representada no gráfico, qual das alternativas apresenta uma ligação ainda menos reativa do que a ligação C traço H?
a ) C traço N
b ) C traço F
c ) S traço O
d ) P traço H
e ) P traço C l
Note e adote:
Número atômico abre parênteses Z fecha parênteses dos elementos: H é igual a 1, C é igual a 6, N é igual a 7, O é igual a 8, F é igual a 9, P é igual a 15, S é igual a 16, C l é igual a 17.
Resposta: Alternativa d. Resolução nas Orientações para o professor.
3. (UEPG-PR) A eletronegatividade pode ser definida como a capacidade de um átomo de atrair os elétrons compartilhados em uma ligação química. Na tabela periódica, essa capacidade aumenta ao longo do período, da esquerda para a direita, até a coluna 17 e diminui ao longo do grupo. Baseando-se nessas informações, assinale o que for correto.
01 ) A eletronegatividade é uma propriedade periódica.
02 ) Os halogênios são, comparativamente, os elementos mais eletronegativos da tabela periódica.
04 ) A ligação química entre dois átomos iguais é classificada como ligação apolar.
08 ) As ligações H traço O traço H, na água, são do tipo apolar.
Resposta: Soma: 01 mais 0 2 mais 0 4 é igual a 7.
4. (UFRGS-RS) Considere as afirmações abaixo, a respeito da geometria molecular e da polaridade de moléculas.
I ) A molécula de C H 2 C l subscrito 2 terá momento de dipolo não nulo.
II ) A molécula de B e H subscrito 2 é polar, por causa da diferença de eletronegatividade entre B e e H.
III ) O momento de dipolo do B F subscrito 3 é maior do que o do B C l 3.
Quais estão corretas?
a ) Apenas I.
b ) Apenas II.
c ) Apenas III.
d ) Apenas II e III.
e ) I, II e III.
Resposta: Alternativa a.
Página 173
5. (UAM-SP) A molécula de ureia, O ═ C abre parênteses N H subscrito 2 fecha parênteses subscrito 2, é formada no organismo humano a partir do metabolismo de proteínas. Na molécula de ureia, os arranjos das ligações ao redor do átomo de carbono e do átomo de nitrogênio apresentam, respectivamente, as geometrias
a ) trigonal plana e trigonal piramidal.
b ) trigonal piramidal e tetraédrica.
c ) tetraédrica e trigonal plana.
d ) trigonal plana e angular.
e ) tetraédrica e tetraédrica.
Resposta: Alternativa a.
6. (UERJ) Ao anoitecer, as células da retina envolvidas na percepção da luminosidade disparam sinais que estimulam a glândula pineal a produzir e secretar melatonina, hormônio responsável por preparar o organismo para o repouso. Por ser composta por uma porção hidrofílica e outra hidrofóbica, a melatonina penetra facilmente a membrana plasmática de diferentes tipos de células.
Essa facilidade de penetração da melatonina deve-se à composição da membrana plasmática, que contém moléculas dos seguintes tipos:
a ) polares e apolares
b ) covalentes e iônicas
c ) positivas e negativas
d ) redutoras e oxidantes
Resposta: Alternativa a.
7. (UFRGS-RS) Considere a seguinte escala de energia (em quilojoule mol elevado a menos 1) para as forças inter e intramoleculares mais relevantes que podem ocorrer nas moléculas: covalente, dipolo-dipolo, iônica, dispersão e ligações de hidrogênio.
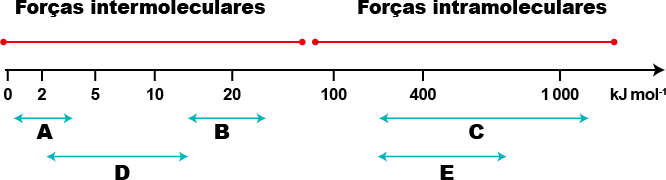
A energia das forças dipolo-dipolo e covalente corresponderia, respectivamente, às regiões assinaladas pelas letras
a ) A e C.
b ) A e E.
c ) B e D.
d ) C e B.
e ) D e E.
Resposta: Alternativa e.
8. (UERJ) Observe a equação química que representa a hidrólise do carbeto de cálcio.
C a C subscrito 2 abre parênteses s fecha parênteses mais 2 H subscrito 2 O abre parênteses l fecha parênteses seta para a direita C a abre parênteses O H fecha parênteses subscrito 2 abre parênteses a q fecha parênteses mais C subscrito 2 H subscrito 2 abre parênteses g fecha parênteses
O nome do composto orgânico obtido nessa reação é:
a ) etino
b ) eteno
c ) etanal
d ) etanol
Resposta: Alternativa a.
9. (UEPG-PR) Em um experimento no laboratório de Química, o professor disponibilizou volumes iguais dos solventes abaixo descritos.
I ) H subscrito 2 O
II ) Clorofórmio, C H C l subscrito 3
III ) Etanol, C subscrito 2 H subscrito 5 O H
Foram realizadas misturas dois a dois entre I e II; entre I e III e entre II e III. Considerando as polaridades dos solventes, as forças intermoleculares existentes e os tipos de misturas obtidas, assinale o que for correto.
01 ) C subscrito 2 H subscrito 5 O H se mistura com H subscrito 2 O em qualquer proporção, formando uma mistura homogênea.
02 ) H subscrito 2 O e C H C l subscrito 3 apresentam polaridades similares.
04 ) A mistura entre II e III é heterogênea, pois o C subscrito 2 H subscrito 5 O H é polar, enquanto o C H C l subscrito 3 é apolar.
08 ) Tanto C subscrito 2 H subscrito 5 O H como H subscrito 2 O apresentam ligações de hidrogênio e, ao se misturarem, também ocorre a formação de ligação de hidrogênio entre eles.
16 ) A mistura entre I e II leva à formação de uma mistura heterogênea, pois a H subscrito 2 O é polar e apresenta ligações de hidrogênio, enquanto o C H C l subscrito 3, por ser apolar, apresenta apenas interações do tipo dipolo induzido-dipolo induzido.
Resposta: Soma: 1 mais 8 é igual a 9.
Página 174
10. (UECE) Presentes em quase todas as formas de vida e sintetizados pelos próprios organismos, os esteroides fazem parte de um grupo complexo de compostos que integram para a manutenção da vida. Fazendo parte de uma classe de lipídios, quando analisados do ponto de vista químico, os esteroides são identificados como compostos lipossolúveis, derivados de triterpenos tetracíclicos.
No corpo humano, destacam-se os esteroides colesterol, testosterona e estradiol. A classe dos esteroides deriva do anel orgânico ciclopentanoperidrofenantreno, cuja estrutura é a seguinte:
Com relação a essa estrutura, é correto afirmar que
a ) existem 24 átomos de hidrogênio ligados a todos os átomos de carbono secundário.
b ) o total de átomos de carbonos primários e terciários é 6.
c ) o anel orgânico ciclopentanoperidrofenantreno é aromático.
d ) como essa estrutura pertence à classe dos lipídios, trata-se de um carboidrato.
Resposta: Alternativa b.
11. (Enem/MEC) De modo geral, a palavra "aromático" invoca associações agradáveis, como cheiro de café fresco ou de um pão doce de canela. Associações similares ocorriam no passado da história da química orgânica, quando os compostos ditos "aromáticos" apresentavam um odor agradável e foram isolados de óleos naturais. À medida que as estruturas desses compostos eram elucidadas, foi se descobrindo que vários deles continham uma unidade estrutural específica. Os compostos aromáticos que continham essa unidade estrutural tornaram-se parte de uma grande família, muito mais com base em suas estruturas eletrônicas do que nos seus cheiros, como as substâncias a seguir, encontradas em óleos vegetais.
SOLOMONS, T. W. G.; FRYHLE, C. B. Química orgânica. Rio de Janeiro: LTC, 2009 (adaptado).
A característica estrutural dessa família de compostos é a presença de
a ) ramificações.
b ) insaturações.
c ) anel benzênico.
d ) átomos de oxigênio.
e ) carbonos assimétricos.
Resposta: Alternativa c.
Página 175
12. (Enem/MEC) Um microempresário do ramo de cosméticos utiliza óleos essenciais e quer produzir um creme com fragrância de rosas. O principal componente do óleo de rosas tem cadeia poli-insaturada e hidroxila em carbono terminal. O catálogo dos óleos essenciais apresenta, para escolha da essência, estas estruturas químicas:
Qual substância o empresário deverá utilizar?
a ) 1
b ) 2
c ) 3
d ) 4
e ) 5
Resposta: Alternativa a.
13. (UFPR) Em química orgânica, é comum os compostos com propriedades físico-químicas, em particular a reatividade, serem classificados em grupos chamados de funções orgânicas. Cada função orgânica apresenta um conjunto de átomos específicos que a define. Considere as seguintes afirmações sobre pares de funções orgânicas.
1. Aminas e amidas são funções orgânicas hidroxiladas.
2. Éteres e ésteres são funções orgânicas nitrogenadas.
3. Fenóis e álcoois são funções orgânicas oxigenadas.
4. Cetonas e aldeídos são funções orgânicas carboniladas.
De acordo com os conhecimentos de química orgânica, a(s) afirmativa(s) que descreve(m) corretamente as características estruturais das funções orgânicas citadas é/são:
a ) 2 apenas.
b ) 1 e 4 apenas.
c ) 3 e 4 apenas.
d ) 1, 2 e 3 apenas.
e ) 1, 2, 3 e 4.
Resposta: Alternativa c.
14. (UFPR) Ao tentar identificar todas as possibilidades de fórmulas estruturais do composto 1,2-diclorociclo-hexano, um estudante propôs as quatro estruturas mostradas na figura abaixo. Entretanto, seu professor apontou que havia um engano, porque apenas três estruturas distintas são possíveis.
O estudante propôs uma estrutura a mais porque considerou em sua resposta que:
a ) 1 e 2 são moléculas diferentes.
b ) 1 e 3 são diasteoisômeros.
c ) 1 e 4 são sobreponíveis.
d ) 2 e 3 são isômeros constitucionais.
e ) 3 e 4 são enantiômeros.
Resposta: Alternativa a.
15. (UERJ) As bases nitrogenadas são componentes fundamentais das moléculas de ácidos nucleicos, encontradas nas células vivas dos órgãos. Observe as fórmulas estruturais de duas dessas bases, a timina e a uracila.
O grupamento que diferencia essas duas bases nitrogenadas é denominado:
a ) metil
b ) propil
c ) carboxila
d ) carbonila
Resposta: Alternativa a.